Method Article
Combinazione dell'ibridazione in situ a fluorescenza multiplex con immunoistochimica fluorescente su sezioni cerebrali di topo fresche, congelate o fisse
In questo articolo
Riepilogo
Questo protocollo descrive un metodo per combinare l'ibridazione in situ a fluorescenza (FISH) e l'immunoistochimica a fluorescenza (IHC) in sezioni cerebrali di topo sia fresche congelate che fisse, con l'obiettivo di ottenere FISH multimarca e segnale IHC di fluorescenza. IHC ha preso di mira le proteine citoplasmatiche e attaccate alla membrana.
Abstract
L'ibridazione fluorescente in situ (FISH) è una tecnica molecolare che identifica la presenza e la distribuzione spaziale di specifici trascritti di RNA all'interno delle cellule. La fenotipizzazione neurochimica di neuroni funzionalmente identificati di solito richiede la marcatura simultanea con più anticorpi (proteina bersaglio) utilizzando l'immunoistochimica (IHC) e l'ottimizzazione dell'ibridazione in situ (RNA mirato), in tandem. Una "firma neurochimica" per caratterizzare particolari neuroni può essere raggiunta, tuttavia i fattori di complicazione includono la necessità di verificare i bersagli FISH e IHC prima di combinare i metodi e il numero limitato di RNA e proteine che possono essere presi di mira simultaneamente all'interno della stessa sezione di tessuto.
Qui descriviamo un protocollo, che utilizza sia preparazioni cerebrali di topo fresche congelate che fisse, che rileva più mRNA e proteine nella stessa sezione cerebrale utilizzando RNAscope FISH seguito da immunocolorazione a fluorescenza, rispettivamente. Utilizziamo il metodo combinato per descrivere il pattern di espressione di mRNA a bassa abbondanza (ad esempio, il recettore 1 della galanina) e mRNA ad alta abbondanza (ad esempio, il trasportatore della glicina 2), nei nuclei del tronco encefalico identificati immunoistochimicamente.
Le considerazioni chiave per l'etichettatura delle proteine a valle del test FISH vanno oltre la preparazione dei tessuti e l'ottimizzazione dell'etichettatura della sonda FISH. Ad esempio, abbiamo scoperto che la specificità del legame e dell'etichettatura degli anticorpi può essere influenzata negativamente dalla fase della proteasi all'interno del test della sonda FISH. Le proteasi catalizzano la scissione idrolitica dei legami peptidici, facilitando l'ingresso della sonda FISH nelle cellule, tuttavia possono anche digerire la proteina bersaglio dal successivo saggio IHC, producendo un legame fuori bersaglio. La posizione subcellulare della proteina bersaglio è un altro fattore che contribuisce al successo dell'IHC dopo il saggio della sonda FISH. Abbiamo osservato che la specificità dell'IHC viene mantenuta quando la proteina bersaglio è legata alla membrana, mentre l'IHC che prende di mira la proteina citoplasmatica ha richiesto un'ampia risoluzione dei problemi. Infine, abbiamo riscontrato che la manipolazione del tessuto congelato fisso montato su vetrino è più impegnativa rispetto al tessuto congelato fresco, tuttavia la qualità dell'IHC è risultata complessivamente migliore con il tessuto congelato fisso, quando combinato con l'RNAscope.
Introduzione
Le proteine e gli mRNA che definiscono neurochimicamente le sottopopolazioni di neuroni sono comunemente identificati rispettivamente con una combinazione di immunoistochimica (IHC) e/o ibridazione in situ (ISH). La combinazione di ISH con tecniche IHC facilita la caratterizzazione di modelli di colocalizzazione unici per i neuroni funzionali (codifica neurochimica) massimizzando la capacità di marcatura multiplex.
I metodi ISH fluorescenti (FISH), incluso l'RNAscope, hanno una maggiore sensibilità e specificità rispetto ai precedenti metodi di rilevamento dell'RNA come l'ISH radioattivo e l'ISH cromogenico non radioattivo. La FISH consente la visualizzazione di singoli trascritti di mRNA come macchie colorate con puntini1. Inoltre, il test RNAscope consente di marcare un numero maggiore di bersagli di RNA alla volta, utilizzando diversi tag fluorofori. Nonostante questi vantaggi, le limitazioni tecniche possono influenzare il numero di fluorofori/cromogeni che possono essere utilizzati in un singolo esperimento. Questi includono la disponibilità di set di filtri per microscopio; tali considerazioni sono aggravate quando l'identificazione neurochimica utilizza la combinazione di FISH e IHC, rispetto all'utilizzo di ciascuna tecnica in modo isolato, poiché i passaggi intrinseci ottimali per un metodo possono essere dannosi per l'altro.
Precedenti applicazioni di FISH in combinazione con IHC hanno dimostrato l'espressione di specifici bersagli cellulari nei linfomi umani a cellule B2, negli embrioni di pulcino3, negli embrioni di zebrafish4, nella retina di topo5 e nelle cellule dell'orecchio interno di topo6. In questi studi, la preparazione del tessuto è stata incorporata in paraffina fissata in formalina (FFPE)2,3,5 o a monte intero fresco 4,6. Altri studi hanno applicato l'RNAscope cromogenico su preparati cerebrali fissi di topo e ratto 7,8,9. In particolare, Baleriola et al.8 hanno descritto due diverse preparazioni tissutali per la combinazione ISH-IHC; corrette le sezioni cerebrali di topo e le sezioni di cervello umano FFPE. In una recente pubblicazione, abbiamo combinato FISH e IHC fluorescente su sezioni fresche congelate, per visualizzare simultaneamente mRNA a bassa abbondanza (recettore 1 della galanina, GalR1), mRNA ad alta abbondanza (trasportatore della glicina 2, GlyT2) e proteina10 del trasportatore vescicolare dell'acetilcolina (vAChT) nella formazione reticolare del tronco encefalico.
Il nucleo del tratto solitario (NTS) è una delle principali regioni del cervello coinvolte nella funzione autonomica. Situata nel rombencefalo, questa popolazione eterogenea di neuroni riceve e integra un vasto numero di segnali autonomi, compresi quelli che regolano la respirazione. L'NTS ospita diverse popolazioni neuronali, che possono essere fenotipicamente caratterizzate dal pattern di espressione di bersagli dell'mRNA, tra cui GalR1 e GlyT2 e marcatori proteici per l'enzima tirosina idrossilasi (TH) e il fattore di trascrizione Paired-like homeobox 2b (Phox2b).
Il titolare dell'RNAscope raccomanda preparazioni di tessuto fresco congelato, ma il tessuto preparato mediante fissazione per perfusione transcardica di animali interi, insieme alla crioprotezione a lungo termine (conservazione a -20 °C) di sezioni fisse di tessuto congelato, è comune in molti laboratori. Pertanto, abbiamo cercato di stabilire protocolli per la FISH in combinazione con l'IHC utilizzando preparati di tessuti freschi congelati e congelati fissi. Qui, forniamo sezioni di cervello fresco congelato e congelato fisso: (1) un protocollo per FISH combinato e IHC fluorescente (2) una descrizione della qualità dell'mRNA e della marcatura delle proteine prodotte, quando si utilizza ogni preparazione (3) una descrizione dell'espressione di GalR1 e GlyT2 nell'NTS.
Il nostro studio ha rivelato che, se combinato con la metodologia RNAscope, il successo dell'IHC variava nelle preparazioni fresche congelate e surgelate fisse e dipendeva dalla localizzazione delle proteine bersaglio all'interno della cellula. Nelle nostre mani, l'etichettatura delle proteine legate alla membrana ha sempre avuto successo. Al contrario, l'IHC per la proteina citoplasmatica richiedeva la risoluzione dei problemi anche nei casi in cui la proteina citoplasmatica era sovraespressa in un animale transgenico (Phox2b-GFP)11. Infine, mentre GalR1 è espresso nei neuroni non catecolaminergici nell'NTS, l'espressione di GlyT2 è assente nell'NTS.
Protocollo
Un riepilogo delle fasi di pre-trattamento dei tessuti è riportato nella Figura 1. Tutte le procedure sono state eseguite in conformità con l'Animal Care and Ethics Committee dell'Università del New South Wales in conformità con le linee guida per l'uso e la cura degli animali a fini scientifici (Australian National Health and Medical Research Council).
1. Preparazione del campione di tessuto cerebrale fresco congelato
- Perfusione transcardica
- Preparare tampone fosfato eparinizzato (2500 U/L) 0,1 M (PB), pH 7,5. Prepara l'impasto di etanolo con ghiaccio secco mescolando ghiaccio secco con etanolo. Questo avrà una temperatura di circa -72 °C e verrà utilizzato per il congelamento immediato del tessuto raccolto.
- Eutanasiare topi adulti C57BL/6 e Phox2b-GFP11 (Mouse Genome Informatics database ID MGI:5776545) anestetizzandoli con pentobarbital di sodio (70 mg/kg, i.p.), utilizzando un calibro dell'ago da 27,5 pollici.
ATTENZIONE: Il pentobarbital è un barbiturico. È acutamente tossico in dosi elevate e può causare la morte per arresto respiratorio. Consultare le linee guida sanitarie locali, legali e di sicurezza dei materiali prima dell'uso. - Esporre il cuore e incannulare il ventricolo sinistro con un ago da disegno (calibro 23 pollici). Eseguire la perfusione transcardica con 0,1 M di PB eparinizzato fino a quando il sangue non si schiarisce (2-3 minuti) a una velocità di flusso di 11-13 mL/min. Determinare la pulizia del sangue monitorando la colorazione del fegato e l'effuso dall'atrio destro12.
- Isolare il cervello dalla cavità cranica, incorporarlo immediatamente in un composto a temperatura di taglio ottimale (OCT) in un criomio o in un foglio di alluminio e posizionarlo sul bagno di etanolo con ghiaccio secco. Conservare il tessuto congelato incorporato in un contenitore ermetico a - 80 °C per un massimo di 3 mesi.
- Sezionamento di tessuto fresco congelato
- Impostare la temperatura del criostato a -20 °C. Lasciare il tessuto incorporato nell'OCT e un mandrino criostato nel criostato per ~30 minuti per consentire l'equilibrio alla nuova temperatura.
NOTA: Tenere il tessuto sempre congelato; trasportare il tessuto dal congelatore a -80 °C al criostato su ghiaccio secco. - Fissare il tessuto al mandrino del criostato pre-raffreddato utilizzando il composto OCT. In questo protocollo, i blocchi di tessuto sono stati montati sul mandrino nel piano coronale.
NOTA: Tagliare l'OCT in eccesso dal tessuto, utilizzando una lama di rasoio, per ridurre al minimo la quantità di OCT tagliata dal criostato e successivamente trasferita sul vetrino. - Tagliare sezioni coronali spesse 14 μm e montarle su vetrini per microscopia caricati.
- Riscaldare le guide a temperatura ambiente prima di montare le sezioni. Una volta che la sezione è stata montata, conservare i vetrini in una scatola di vetrini nel criostato.
- Se è necessario montare più di una sezione su una slitta, riscaldare l'area per la seconda sezione posizionando un dito sul lato opposto della slitta per 5-10 secondi per favorire l'aderenza della sezione alla slitta. Una sezione di tessuto freddo non si attacca a un vetrino freddo. Le sezioni devono aderire alle guide in modo piatto; La piegatura li farà cadere dai vetrini durante le fasi di lavaggio.
- Se si notano crepe nelle sezioni, aumentare la temperatura del criostato di 1-5 °C per evitarlo. È particolarmente importante posizionare sezioni di tessuto molto vicine l'una all'altra sullo stesso vetrino. In questo modo si evita lo spreco di sonde e reagenti FISH durante il saggio.
- Conservare le sezioni di tessuto montate su vetrini in un contenitore ermetico a -80 °C per un massimo di 6 mesi.
NOTA: Mantenere le sezioni sempre congelate ed evitare cicli di gelo e scongelamento, per prevenire la degradazione dell'RNA. Trasportare la scatola dei vetrini dall'interno del criostato al congelatore a -80 °C su ghiaccio secco.
- Impostare la temperatura del criostato a -20 °C. Lasciare il tessuto incorporato nell'OCT e un mandrino criostato nel criostato per ~30 minuti per consentire l'equilibrio alla nuova temperatura.
- Fissazione di tessuto fresco congelato
- Il giorno in cui deve essere eseguito il test della sonda FISH, preparare la paraformaldeide (PFA) al 4% in PB 0,1 M, pH 7,5 (soluzione PFA al 4%). Filtrare facendo passare attraverso la carta da filtro (Grado 1: 11 μm, Tabella dei materiali) in un filtro a imbuto o a crogiolo Buchner.
ATTENZIONE: Il PFA è nocivo e tossico per contatto con la pelle o inalazione. Tutte le procedure con soluzione PFA devono essere eseguite in una cappa aspirante. I rifiuti della soluzione PFA devono essere smaltiti con cura seguendo i protocolli di sicurezza istituzionali. - Raffreddare la soluzione di PFA al 4% a 4 °C. Trasportare il tessuto montato su vetrino dal congelatore a -80 °C nel ghiaccio secco e immergerlo immediatamente nel fissativo pre-raffreddato per 15 minuti.
NOTA: È importante che questa fase di fissazione non superi i 15 minuti, poiché una fissazione eccessiva comporterà un'etichettatura di fondo non specifica.
- Il giorno in cui deve essere eseguito il test della sonda FISH, preparare la paraformaldeide (PFA) al 4% in PB 0,1 M, pH 7,5 (soluzione PFA al 4%). Filtrare facendo passare attraverso la carta da filtro (Grado 1: 11 μm, Tabella dei materiali) in un filtro a imbuto o a crogiolo Buchner.
- Disidratazione di tessuti freschi congelati
- Disidratare le sezioni di tessuto immergendo i vetrini in concentrazioni graduate di etanolo. In un barattolo Coplin, immergere prima il 50%, poi il 70% e infine l'etanolo assoluto, per 5 minuti ciascuno a temperatura ambiente. Ripetere una seconda volta l'incubazione finale assoluta con etanolo.
- Asciugare all'aria i vetrini e, delineare il gruppo di sezioni utilizzando una penna barriera idrofobica, assicurandosi che l'area interna sia ridotta al minimo.
NOTA: Assicurarsi che il vetrino sia completamente asciutto prima di disegnare la barriera idrofobica. La barriera idrofobica deve circondare completamente le sezioni di tessuto senza spazi vuoti e deve essere asciutta prima di un'ulteriore lavorazione.
2. Preparazione del campione di tessuto cerebrale congelato fisso
- Fissazione della perfusione transcardica
- Eutanasiare i topi mediante anestesia con pentobarbital di sodio (70 mg/kg, i.p) seguita da perfusione transcardica, prima con una soluzione di PFA 0,1 M PB e poi al 4%. Fissare con 10 minuti di perfusione a 11-13 mL/min.
- Isolare il cervello dalla cavità cranica dopo la fissazione della perfusione e immergere per una notte in una soluzione di PFA al 4%, a 4 °C.
- Sezionamento tissutale di tessuto fisso
- Sciacquare il cervello in soluzione fisiologica sterile tamponata con fosfato 0,1 M (PBS) prima di rimuovere gli strati meningei, con l'aiuto di un microscopio da dissezione, utilizzando una pinza fine.
- Tagliare il cervello con precisione in blocchi (separare il tronco encefalico dal prosencefalo prima del sezionamento del vibratomo) utilizzando una matrice cerebrale (Tabella dei materiali). In particolare, tagliare il tronco encefalico caudalmente in corrispondenza della decussazione piramidale e sezionare il cervelletto. Allo stesso modo, tagliare immediatamente il proencefalo rostrale al chiasma ottico.
- Fissare il tessuto su un mandrino vibrante per microtomo utilizzando cianoacrilato e incorporare in una soluzione di agar al 2%.
- Tagliare sezioni di tessuto spesse 30 μm utilizzando un microtomo vibrante e conservare le sezioni tagliate in soluzione crioprotettiva (30% saccarosio libero da RNasi, 30% glicole etilenico, 1% polivinilpirrolidone (PVP-40), in PB 0,1 M, pH 7,4). Le sezioni di tessuto possono essere conservate in crioprotettore a -20 °C per un massimo di 6 mesi.
- Preparazione di sezioni fisse prima della FISH
- Il giorno della PESCA, lavare le sezioni galleggianti tre volte, per 10 minuti per lavaggio, per rimuovere la soluzione crioprotettiva. Per il lavaggio, posizionare le sezioni in PBS da 0,1 M in una piastra di coltura cellulare a 12 pozzetti e agitare su un agitatore a piattaforma rotante (90 - 100 giri/min).
- Dopo i lavaggi, utilizzare un pennello per montare le sezioni sui vetrini per microscopia e asciugare all'aria per almeno 2 ore.
NOTA: Le sezioni devono aderire piatte alle diapositive poiché eventuali pieghe pronunciate ne causeranno il distacco durante i lavaggi. - Utilizzando una barriera idrofoba, disegnare una barriera attorno alle sezioni per limitare i reagenti FISH alle sezioni. Ancora una volta, è importante ridurre al minimo l'area interna del contorno disegnato con la penna barriera.
POSSIBILE PUNTO DI ROTTURA: Le sezioni possono essere conservate a temperatura ambiente, durante la notte, per continuare il test il giorno successivo.
3. Saggio FISH
NOTA: Il resto del protocollo si applica sia ai tessuti freschi congelati che a quelli congelati fissi.
- Preparare i reagenti e gli strumenti per le fasi di ibridazione e amplificazione.
- Impostare un'incubatrice da banco e un bagnomaria a 40 °C.
- Preparare una camera umidificata e protetta dalla luce per l'incubazione dei vetrini. L'umidificazione impedisce l'essiccazione dei tessuti: i vetrini sono posizionati in modo sicuro sopra un serbatoio umido. Idealmente, la camera è realizzata in polistirene per impieghi gravosi, è resistente alla luce ed ermetica per mantenere un'atmosfera di vapore acqueo saturo. La chiusura della camera si basa su un attrito minimo per evitare il movimento. Abbiamo usato una scatola di diapositive rivestita con salviette da laboratorio umidificate (Tabella dei materiali) nella parte inferiore. Posizionare la scatola dei vetrini all'interno dell'incubatrice per preriscaldarla a 40 °C.
- Riscaldare il tampone di lavaggio 50x (tabella dei materiali) e le sonde a 40 °C per 10 minuti, utilizzando il bagnomaria, quindi raffreddare a temperatura ambiente.
- Preparare 1 L di 1x Wash Buffer dalla concentrazione di 50x stock.
- Preparare la miscela della sonda (Tabella dei materiali): la sonda C1 è pronta per l'uso alla concentrazione di serie, mentre le sonde C2 e C3 vengono spedite con una concentrazione 50x e richiedono la diluizione con il diluente fornito nel kit.
NOTA: Le miscele di sonde possono essere conservate a 4 °C per un massimo di 6 mesi.
- Trattamento della proteasi
- Incubare le sezioni con Proteasi III (Tabella dei materiali) a temperatura ambiente per 30 minuti.
NOTA: Assicurarsi che la proteasi III e i reagenti di incubazione nei processi a valle (miscela di sonde, soluzioni di amplificazione, tampone bloccante e sieri anticorpali) coprano interamente le sezioni. Il puntale di una pipetta può essere utilizzato per distribuire il reagente sulla sezione in modo da coprire l'intera area all'interno della barriera idrofobica. - Lavare i vetrini due volte con PBS 0,1 M, per 2 minuti ogni volta, in una grande capsula di Petri quadrata di plastica. In questo caso è stata utilizzata una piastra di analisi biologica quadrata di 245 mm x 245 mm (Tabella dei materiali). Tenere da un lato del piatto e inclinare delicatamente 3-5 volte. Dopo i lavaggi, estrarre il PBS in eccesso da 0,1 M dal vetrino e aggiungere immediatamente il reagente successivo. Non lasciare asciugare le sezioni di tessuto.
NOTA: Durante ogni lavaggio, i vetrini vengono immersi in una soluzione a temperatura ambiente. Questo è il flusso di lavoro per tutte le fasi di lavaggio successive. Le sezioni fisse spesse 30 μm si staccano dai vetrini più facilmente delle sezioni spesse 14 μm, sii delicato durante i lavaggi.
- Incubare le sezioni con Proteasi III (Tabella dei materiali) a temperatura ambiente per 30 minuti.
- Ibridazione e amplificazione
- Dopo aver lavato via la soluzione di proteasi, posizionare i vetrini nella camera umidificata e preriscaldata. Incubare le sezioni con miscela di sonde (Tabella dei materiali) per 2 ore a 40 °C all'interno di un incubatore da banco.
NOTA: Assicurarsi che ci siano almeno 2 sezioni riservate alle sonde di controllo positive e negative per valutare la qualità dell'RNA del campione e la permeabilizzazione ottimale. Le sonde di controllo positivo hanno come bersaglio i geni house-keeping; in questo caso, si trattava di un cocktail di RNA che avevano come bersaglio l'ubiquitina C (UBC; ad alta abbondanza), la peptidilpropilisomerasi B (PPIB; a moderata abbondanza) e la RNA polimerasi 2a (POLR2A; a bassa abbondanza). Le sonde di controllo negativo hanno come bersaglio il gene batterico 4-idrossi-tetraidrodipicolinato reduttasi (DapB), che è normalmente assente nei campioni di cervello di topo. Il segnale DapB positivo indica un segnale non specifico e/o una contaminazione batterica del campione. - Dopo l'ibridazione con la miscela di sonde, le fasi di amplificazione del segnale consistono nell'incubazione con Amp 1-FL (30 minuti), poi con Amp 2-FL (15 minuti), seguito da Amp 3-FL (30 minuti) e infine Amp 4-FL (15 minuti) - ciascuno a 40 °C. Utilizzando i flaconi contagocce in dotazione, coprire le sezioni di tessuto con una soluzione di amplificazione. Procedere al test IHC dopo l'ultima fase di amplificazione.
- Risciacquare i vetrini con il tampone di lavaggio due volte per 2 minuti tra l'ibridazione della sonda e ogni fase di amplificazione.
- Dopo aver lavato via la soluzione di proteasi, posizionare i vetrini nella camera umidificata e preriscaldata. Incubare le sezioni con miscela di sonde (Tabella dei materiali) per 2 ore a 40 °C all'interno di un incubatore da banco.
4. Saggio IHC
- Fase di blocco IHC
- Per prevenire il legame aspecifico degli anticorpi, incubare le sezioni per 1 ora a temperatura ambiente con una soluzione bloccante contenente il 10% di siero di cavallo normale, lo 0,3% di Tween20 in 1x TBSm (50 mM Tris-Cl, pH 7,5, 150 mM NaCl, 0,05% mertiolato) dopo il test FISH. Preparare gli anticorpi primari in un tampone di diluizione contenente 1x TBSm, 5% di siero di cavallo normale e 0,1% di Tween20. I fornitori primari di anticorpi sono elencati nella tabella dei materiali.
- Immunoistochimica
- Rimuovere il tampone bloccante in eccesso agitando il vetrino e incubare le sezioni con anticorpi primari per una notte a 4 °C.
- Lavare i vetrini 3 volte (5 minuti ciascuno) con 1x TBSm e incubare con anticorpi secondari in diluente contenente 1x TBSm, 1% di siero di cavallo normale e 0,1% di Tween20 per 2 ore a temperatura ambiente. Gli anticorpi secondari utilizzati in questo protocollo sono elencati nella Tabella dei materiali.
- Lavare i vetrini 3 volte con 1x TBSm (5 minuti ciascuno) prima di coprivetrini con un mezzo di montaggio con o senza DAPI (Table of Materials).
5. Imaging
- Esaminare l'immunocolorazione con un microscopio a epifluorescenza dotato di una telecamera (vedere la tabella dei materiali per i dettagli). Acquisisci immagini rappresentative con un ingrandimento di 20x e salvale come file TIFF.
- Esporta immagini rappresentative in un software di elaborazione delle immagini (Tabella dei materiali) per la regolazione della luminosità/contrasto per aumentare la nitidezza e riflettere il rendering reale.
6. OPZIONALE: Analisi quantitativa dei trascritti target
NOTA: Questo è un articolo sui metodi e non vengono forniti risultati quantitativi. Il metodo di quantificazione qui presentato proviene da Dereli et al.Ore 10.
- Acquisire immagini dalle regioni di interesse come spiegato in 5.1 e applicare le stesse impostazioni del microscopio e della fotocamera (come il tempo di esposizione e l'intensità della luce) a tutte le immagini dello stesso fluoroforo.
- Tracciare i profili neuronali utilizzando un software di analisi delle immagini (Table of Materials).
- Allineare le sezioni con riferimento al livello di Bregma secondo un atlante cerebrale stereotassico13.
- Applica la stessa luminosità e lo stesso contrasto a tutte le immagini dello stesso fluoroforo. Considera solo i neuroni con nuclei colorati con DAPI.
- Contare manualmente il numero di cellule che esprimono mRNA, proteine, mRNA/mRNA, proteine/proteine e mRNA/proteine che coesprimono all'interno della regione di interesse.
- Per ridurre le distorsioni nei risultati sperimentali, chiedi alla persona che quantifica i risultati sperimentali di essere cieca rispetto ai gruppi sperimentali.
- Applicare la correzione di Abercrombie14 al conteggio totale delle cellule utilizzando la seguente equazione di Abercombie:
Conteggio corretto delle cellule = conteggio manuale delle cellule x spessore della sezione / (spessore della sezione + dimensione nucleare)
Ad esempio, per sezioni spesse 14 μm, la larghezza nucleare media è calcolata in 7,7 ± 0,3 μm e lo spessore medio della sezione è di 14 ± 1 μm sulla base di 30 cellule e 10 sezioni rispettivamente in 5 animali10. Secondo l'equazione di Abercrombie, il conteggio corretto delle cellule sarebbe il conteggio manuale delle cellule x 14/(14+7,7).

Figura 1: Flusso di lavoro parallelo delle fasi di pre-trattamento dei tessuti sia per i tessuti freschi congelati che per quelli fissati con paraformaldeide. Le fasi di lavorazione per il tessuto fresco-congelato sono visualizzate nelle caselle con contorno rosso, mentre quelle per il tessuto fissato con paraformaldeide (PFA) sono visualizzate nelle caselle con contorno blu. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Riepilogo della procedura combinata di sonda FISH e immunoistochimica. Dopo la pre-elaborazione del tessuto, il tessuto montato su vetrino viene circondato utilizzando una penna barriera idrofobica, come si vede nel primo fotogramma, e incubato in una soluzione di proteasi a temperatura ambiente. Dopo i lavaggi, il tessuto viene trasferito in un incubatore da banco per l'ibridazione per 2 ore prima delle fasi di amplificazione sequenziale. Il sistema di ibridazione in situ utilizza un design proprietario a "sonda Z", preamplificatori e amplificatori come si vede nei fotogrammi 3-66. Una volta che il tessuto è stato sottoposto alla lavorazione della sonda FISH, viene lavato prima di bloccarsi con il normale siero di cavallo. L'incubazione dell'anticorpo primario viene effettuata durante la notte a 4 °C per massimizzare il legame anticorpo-antigene. L'incubazione secondaria degli anticorpi (2 ore) è stata effettuata a temperatura ambiente. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Qui, delineiamo un metodo per combinare FISH multiplex con IHC fluorescente per localizzare l'espressione di mRNA per GalR1 e GlyT2 utilizzando tessuti congelati freschi e fissati con paraformaldeide rispettivamente nell'NTS di topo. Una pipeline delle procedure di trattamento dei tessuti, FISH e IHC descritte nei metodi è mostrata nella Figura 1 e nella Figura 2. La Tabella 1 fornisce un riepilogo delle combinazioni di sonde e anticorpi FISH utilizzate in ciascuna figura.
Le sonde di controllo vengono regolarmente dosate in concomitanza con la sonda target, per garantire l'integrità del flusso di lavoro e confermare la qualità del campione. L'assenza di etichettatura DapB conferma la qualità e l'integrità del tessuto sano e l'assenza di contaminazione batterica (Figura 3A). La marcatura dell'mRNA delle sonde di controllo positivo che hanno come bersaglio l'ubiquitina C (UBC, alta abbondanza), la peptidilpropil isomerasi B (PPIB, abbondanza moderata) e l'mRNA della RNA polimerasi 2a (POLR2A, bassa abbondanza) conferma l'integrità dell'RNA e il segnale osservato tra i saggi può essere utilizzato per calibrare la variabilità tra i saggi (Figura 3B). Per convalidare l'espressione della sonda FISH, abbiamo utilizzato tessuti di controllo che sono stati precedentemente descritti per esprimere il trascritto dell'mRNA. Ad esempio, è stata confermata la positività dell'espressione dell'mRNA di GalR1 nel talamo come descrittoin precedenza 10,15. La distribuzione dell'mRNA di Phox2b è stata inoltre verificata mediante comarcatura con l'anticorpo Phox2b; abbiamo confermato che la marcatura FISH era presente solo nei neuroni che sono stati colorati positivamente utilizzando l'anticorpo Phox2b (Figura 5).
Per distinguere i neuroni GalR1+ nell'NTS dai nuclei vicini, abbiamo utilizzato ulteriori marcatori neurochimici. L'immunoreattività TH, Phox2b o Phox2b-GFP (Figura 4-6) e Phox2b FISH (Figura 5 e Figura 6) hanno differenziato l'NTS da altri nuclei del tronco encefalico dorsale, poiché i neuroni NTS sono stati precedentemente segnalati per esprimere Phox2b e TH 16,17. Poiché l'NTS è annidato da nuclei colinergici - si trova dorsalmente al nucleo ipoglosso e al nucleo motorio dorsale del vago (DMNX) e ventrale al nucleo vestibolare - abbiamo co-marcato con il marcatore colinergico vAChT18 (Figura 4). Pertanto, l'espressione di GalR1 all'interno dell'NTS è stata valutata in relazione a TH e Phox2b, mentre la marcatura vAChT ha aiutato l'orientamento spaziale rispetto alle coordinate rostrocaudali, dorso-ventrali e mediolaterali. Abbiamo scoperto che tutti i neuroni immunoreattivi TH e l'mRNA positivo per GalR1 nell'NTS erano immunoreattivi per Phox2b-GFP, ma non tutti i neuroni immunoreattivi per Phox2b-GFP nell'NTS erano immunoreattivi per TH o per l'mRNA GalR1 positivi (Figura 4). Inoltre, abbiamo dimostrato che l'mRNA per il recettore a bassa abbondanza GalR1 era assente nei neuroni immunoreattivi TH e vAChT.
Nelle preparazioni fresche surgelate, quando combinate con il saggio della sonda FISH, il successo dell'IHC dipendeva dalla posizione subcellulare della proteina bersaglio. Ad esempio, vAChT (una proteina legata alla membrana delle vescicole sinaptiche) era chiaramente immunomarcata, mentre TH e GFP (proteine citoplasmatiche) erano immunomarcate a tempo indeterminato e osservate solo debolmente (Figura 4). Descriviamo questa etichettatura indefinita come "flocculante" perché le cellule mancavano di un contorno chiaro e si sono rivelate difficili da distinguere dallo sfondo. Sulla stessa sezione di tessuto fresco congelato, la marcatura della sonda GalR1 FISH dell'mRNA citoplasmatico di GalR1 è stata punteggiata e chiaramente osservata (Figura 4).
Inoltre, poiché gli anticorpi TH e vAChT sono cresciuti nello stesso ospite, entrambe le proteine sono state marcate utilizzando lo stesso anticorpo secondario e quindi lo stesso fluoroforo di colore (luce di eccitazione: 594). Sono facilmente distinguibili per due motivi: non co-marcano mai negli stessi neuroni e la localizzazione subcellulare è diversa per queste proteine; vAChT nelle vescicole che mostrano un aspetto puntinato e TH nel citoplasma e nei processi neuronali.
Per supportare la nostra ipotesi che la qualità dell'IHC (nelle preparazioni fresche surgelate) dipenda dalla localizzazione subcellulare delle proteine, abbiamo confrontato la marcatura per l'mRNA di Phox2b (situato nel citoplasma), GFP (sovraespresso nel citoplasma) e la proteina Phox2b (che si trova principalmente nel nucleo) nei neuroni. Come previsto, i nostri risultati mostrano una sovrapposizione dell'mRNA di Phox2b, della GFP e della marcatura degli anticorpi Phox2b nei singoli neuroni dell'NTS (Figura 5). Le cellule con marcatura dell'mRNA citoplasmatico corrispondevano a cellule che presentavano la marcatura nucleare della proteina Phox2b, fornendo la convalida del metodo combinato FISH-IHC. Sebbene la Phox2b-GFP citoplasmatica avesse un aspetto flocculante, il segnale della proteina nucleare Phox2b era chiaro e specifico. In conclusione, se combinate con FISH su preparazioni fresche congelate, le proteine legate alla membrana, tra cui vAChT e Phox2B, presentano un'immunomarcatura di qualità superiore rispetto alle proteine citoplasmatiche.
Al contrario, l'IHC si è dimostrato affidabile indipendentemente dalla localizzazione subcellulare, quando eseguito su sezioni congelate fisse in combinazione con FISH. Il FISH multiplex per l'mRNA GlyT2 e l'mRNA Phox2b ha avuto successo, come mostrato nella Figura 6. I neuroni positivi all'mRNA GlyT2 erano localizzati ventralmente all'NTS e non all'interno dell'NTS. I neuroni GlyT2+ e Phox2b+ non si sono colocalizzati. Una sottopopolazione di neuroni NTS Phox2b+ era TH immunoreattiva e nessuno conteneva mRNA GlyT2. I neuroni immunoreattivi TH sono evidenti sulla stessa sezione di tessuto, mostrando processi soma e neuronali marcati positivamente (Figura 6). Ciò contrasta con l'aspetto "flocculante" dei neuroni immunoreattivi TH nelle sezioni di tessuto fresco congelato. Pertanto, il preparato congelato fisso qui descritto è un metodo alternativo di preparazione dei tessuti che consente un targeting affidabile delle proteine citoplasmatiche immunoistochimicamente, in combinazione con l'RNAscope.

Figura 3: Immagini microscopiche rappresentative di sezioni coronali del prosencefalo di topo a livello del setto laterale (Bregma da 1,1 a -0,1) che mostrano l'etichettatura delle sonde di controllo positive e negative . (A) La mancanza di segnale a seguito di ISH con la 4-idrossi-tetraidrodicolinato reduttasi batterica (DapB) conferma l'assenza di segnali di fondo. (B) La marcatura con sonde di controllo positivo mirate all'ubiquitina C (UBC), alla peptidilpropil isomerasi B (PPIB) e alla RNA polimerasi 2a (POLR2A) illustra il segnale che ci si può aspettare rispettivamente da bersagli ad alta, moderata e bassa abbondanza. Le barre della scala sono di 50 μm. Tutte le immagini sono state acquisite con obiettivo 20x. Fare clic qui per visualizzare una versione più grande di questa figura.
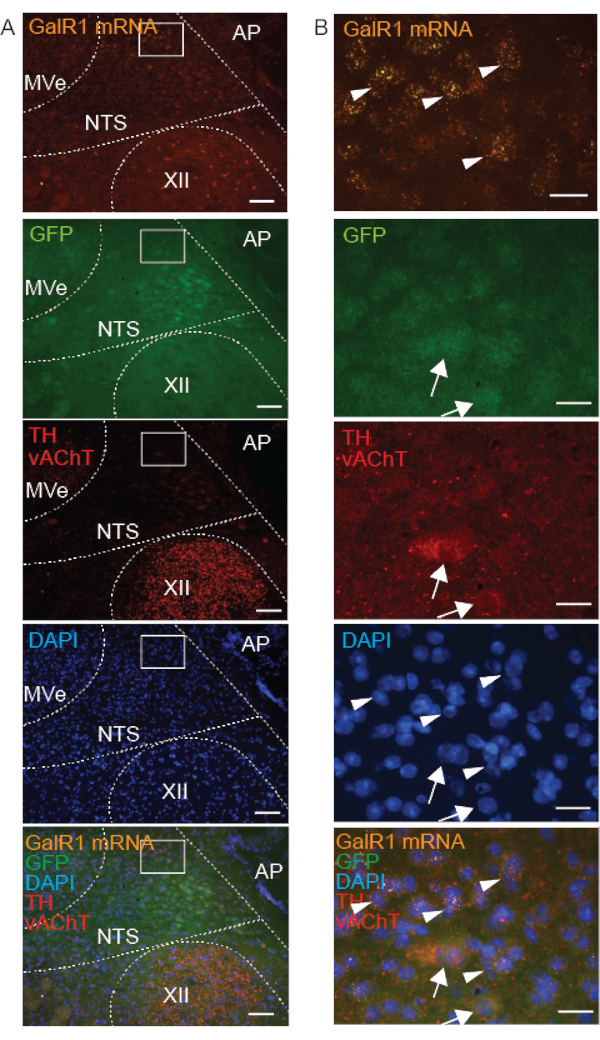
Figura 4: Immagini microscopiche rappresentative di una sezione del tronco encefalico coronale congelata fresca da un topo Phox2b-GFP che mostra la marcatura combinata dell'mRNA GalR1 (FISH) e di 3 proteine (IHC) nel nucleo della regione del tratto solitario (NTS). Gli inserti in A sono ingranditi in B. L'mRNA di GalR1 è indicato dall'etichettatura della sonda FISH puntinata (punte di freccia). Gli anticorpi che hanno come bersaglio le proteine citoplasmatiche GFP e tirosina idrossilasi (TH) hanno mostrato una marcatura "flocculante" (frecce). È stata dimostrata l'immunoreattività del trasportatore vescicolare dell'acetilcolina (vAChT) (marcatura del puntato rosso) nel nucleo ipoglosso (XII). Le barre della scala sono 100 μm in A e 25 μm in B. Tutte le immagini sono state acquisite con obiettivo 20x. Altre abbreviazioni: area postrema (AP), nucleo vestibolare mediale (MVe). Fare clic qui per visualizzare una versione più grande di questa figura.
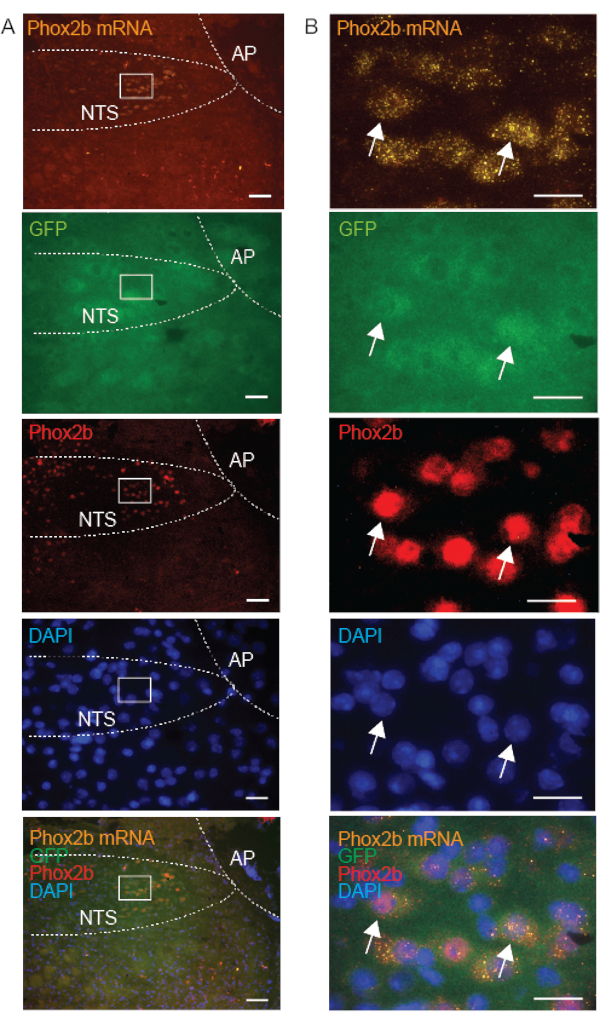
Figura 5: Immagini microscopiche rappresentative di una sezione del tronco encefalico coronale congelata fresca da un topo Phox2b-GFP, che illustrano il targeting di Phox2b nel nucleo del tratto solitario (NTS) con tre diversi approcci: mRNA Phox2b (FISH), GFP (IHC) e proteina Phox2b (IHC). La proteina Phox2b è localizzata nel nucleo. I rientri in A sono ingranditi in B. Le frecce indicano i neuroni che sono tripla marcati con la sonda Phox2b (arancione-550), l'anticorpo GFP (verde-488) e l'anticorpo Phox2b (rosso-647). Le barre della scala sono 100 μm in A e 25 μm in B. Tutte le immagini sono acquisite con un obiettivo 20x. Altre abbreviazioni: area postrema (AP). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Immagini rappresentative di sezioni fisse congelate del tronco encefalico coronale che dimostrano il successo della FISH combinata con un'immunomarcatura affidabile delle proteine citoplasmatiche (tirosina idrossilasi [TH]). Doppio FISH che mostra la marcatura dell'mRNA del trasportatore di glicina 2 (GlyT2-red-647, punte di freccia piene) e Phox2b (giallo-550, frecce) nel nucleo della regione del tratto solitario (NTS). FISH è stato combinato con IHC per la proteina TH (blue-346, punte di freccia vuote). Gli inserti in A sono ingranditi in B. Le barre della scala sono di 25 μm. Tutte le immagini sono state acquisite con un obiettivo 20x. Fare clic qui per visualizzare una versione più grande di questa figura.
| Sonda anticorpale primaria o RNAscope | Anticorpo secondario o Amp 4-FL-Alt Modulo display | Eccitazione (nm) | Preparazione dei tessuti | ||
| Figura 3 | sonda | POLR2A (C1) | Amp 4-FL-Alt B Modulo display | 647 | fresco congelato |
| sonda | PPIB (C2) | Amp 4-FL-Alt B Modulo display | 488 | ||
| sonda | UBC (C3) | Amp 4-FL-Alt B Modulo display | 550 | ||
| sonda | DapB (C1, C2, C3) | Amp 4-FL-Alt B Modulo display | 647, 488, 550 | ||
| DAPI | 346 | ||||
| Figura 4 | anticorpo | coniglio-anti-GFP | asino-anti-coniglio | 488 | fresco congelato |
| anticorpo | pecore-anti-TH | asino-anti-pecora | 647 | ||
| anticorpo | anti-vAChT per capra | asino-anti-capra | 647 | ||
| sonda | GalR1 (C1) | Amp 4-FL-Alt B Modulo display | 550 | ||
| DAPI | 346 | ||||
| Figura 5 | anticorpo | coniglio-anti-GFP | asino-anti-coniglio | 488 | fresco congelato |
| anticorpo | anti-topo Phox2b | asino-anti-topo | 647 | ||
| sonda | Phox2b (C2) | Amp 4-FL-Alt A Modulo display | 550 | ||
| DAPI | 346 | ||||
| Figura 6 | anticorpo | mouse-anti-TH | asino-anti-topo | 346 | fissato |
| sonda | GlyT2 | Amp 4-FL-Alt A Modulo display | 647 | ||
| sonda | Phox2b | Amp 4-FL-Alt A Modulo display | 550 |
Tabella 1: Sonda FISH, anticorpo e corrispondenti combinazioni di flurofori utilizzate nelle Figure 3-6.
Discussione
Nelle neuroscienze, FISH e IHC sono abitualmente utilizzati per studiare l'organizzazione spaziale e il significato funzionale dell'mRNA o delle proteine all'interno delle sottopopolazioni neuronali. Il protocollo descritto in questo studio migliora la capacità di rilevamento simultaneo di mRNA e proteine nelle sezioni cerebrali. Il nostro saggio combinato multiplex FISH-IHC ha permesso l'identificazione fenotipica di sottopopolazioni neuronali distinte nell'NTS sia in preparazioni cerebrali fresche congelate che fisse. Il metodo FISH-IHC nelle preparazioni di tessuti congelati fissi ha prodotto risultati IHC affidabili. Ad esempio, FISH multiplex per mRNA a bassa e alta abbondanza (rispettivamente GalR1 e GlyT2) e IHC (mirato alla tirosina idrossilasi) hanno rivelato che GalR1 e GlyT2 sono espressi nei neuroni NTS non catecolaminergici. L'IHC per TH non ha avuto successo nel tissue fresco congelato, evidenziando la limitata capacità di FISH-IHC nelle preparazioni fresche surgelate.
L'ISH può essere più appropriato dell'IHC in una serie di scenari. In primo luogo, l'IHC potrebbe non funzionare bene quando si rilevano proteine a bassa abbondanza, come i recettori. L'uso di ISH per colpire mRNA di abbondanza relativamente più elevata per queste proteine migliora la rilevabilità1. In secondo luogo, proteine come i neuropeptidi sono spesso trafficate verso i terminali assonali dopo la traduzione nel somacellulare 19. Quando i neuropeptidi sono presi di mira con IHC, i processi assonali e i terminali delle cellule si marcano con l'anticorpo, ma non con il soma, riducendo la capacità di identificare la cellula di origine o di eseguire analisi quantitative del numero di cellule. Tuttavia, poiché gli mRNA che codificano per tutte le proteine si trovano localizzati nel soma, la tecnica ISH è vantaggiosa. Infine, gli anticorpi non sono prontamente disponibili per alcune specie proteiche, oppure gli anticorpi disponibili sono appropriati per altre tecniche proteomiche (ad esempio, western blot) ma non per l'IHC. In queste circostanze, i metodi di marcatura dell'mRNA si rivelano utili. Un avvertimento è che gli mRNA potrebbero non essere sempre tradotti in proteine, e quindi forniscono solo un proxy per l'identificazione delle proteine. Poiché i kit FISH commerciali possono essere costosi e le sonde ISH hanno meno probabilità di essere disponibili in commercio rispetto agli anticorpi, la combinazione di FISH con IHC rappresenta una strategia efficace in termini di costi e tempi per aumentare il numero di bersagli che possono essere marcati contemporaneamente.
La preparazione di tessuti freschi congelati rispetto a quelli fissi è stata un fattore che ha conferito il successo dell'IHC dopo il test della sonda FISH. Abbiamo testato l'IHC utilizzando anticorpi mirati a proteine nucleari, vescicolari e citoplasmatiche e abbiamo trovato una marcatura affidabile delle proteine legate alla membrana (vAChT e Phox2b) su campioni freschi congelati, ma non sulle proteine citoplasmatiche (TH e GFP). La coespressione della proteina Phox2b e dell'mRNA con la marcatura "flocculante" di Phox2b-GFP ha convalidato che i neuroni che esprimono il trascritto esprimono anche la proteina correlata, confermando l'identità neurochimica dei neuroni (Figura 5). Al contrario, le preparazioni di tessuto congelato fisso hanno prodotto una marcatura IHC affidabile indipendentemente dalla localizzazione subcellulare dell'antigene. Studi precedenti hanno dimostrato che il pretrattamento con proteasi (ad es. pronasi 8,20) può avere un effetto dannoso sull'IHC. Il contenuto della soluzione di proteasi utilizzata nel protocollo RNAscope è proprietario e la permeabilizzazione da parte della proteasi è raccomandata per l'accesso della sonda RNAscope nelle cellule. La marcatura delle proteine citoplasmatiche utilizzando gli anticorpi qui descritti è stata precedentemente verificata su sezioni cerebrali di topo congelate fisseda 30 μm flottanti 10,21,22. Abbiamo montato campioni fissi di 30 μm di spessore su vetrino ed eseguito il protocollo FISH-IHC, a differenza delle sezioni fresche congelate di 14 μm di spessore raccomandate dal produttore. In assenza di modifiche del saggio o di alterazione di altre variabili (recupero dell'antigene, maggiore concentrazione di anticorpi, cambiamento della proteasi), è stato ottenuto un IHC affidabile su campioni spessi e fissi con marcatura dimostrata del citoplasma e dei processi assonali insieme alla marcatura della sonda FISH (Figura 6). Mentre approcci simili sono stati impiegati da altri gruppi di ricerca 7,8,9, l'attuale studio ha ottenuto una combinazione ISH-IHC su neuroni e in un set-up fluorescente.
C'erano una serie di passaggi critici nei metodi di cui prendere nota. Per la preparazione fresca congelata, il tempo di fissazione non deve superare i 15 minuti; Tempi di fissazione più lunghi hanno suscitato una maggiore etichettatura di fondo. La fase della proteasi è stata ottimizzata poiché tessuti di diverso spessore e provenienti da vari organi richiedono diversi tipi di proteasi per raggiungere la permeabilizzazione. Le sezioni fisse congelate aderiscono meno ai vetrini e si staccano più facilmente durante le fasi di lavaggio. Pertanto, è necessario prestare particolare attenzione nella manipolazione manuale delle sezioni congelate fisse, per evitare perdite o danni ai tessuti.
Sebbene abbiamo riscontrato che la combinazione di FISH e IHC sia una strategia efficace, gli svantaggi includono il costo e l'analisi tecnicamente impegnativa quando si combinano i due metodi. Una limitazione dello studio è che non è stato eseguito un confronto fianco a fianco dei due protocolli di preparazione dei tessuti. Inoltre, la nostra valutazione dei risultati era limitata dal numero di canali che il microscopio a epifluorescenza poteva ospitare; Il set-up consentiva un massimo di 4 canali alla volta: 346, 488, 550 e 647 nm (luce di eccitazione). Siamo stati in grado di ottenere la marcatura multiplex di 5 bersagli marcando due proteine con diverse localizzazioni subcellulari utilizzando lo stesso fluroforo (Figura 4, Tabella 1). Utilizzando un microscopio confocale, l'eccitazione discreta di molti fluorofori aggiuntivi può essere utilizzata per la marcatura di singole proteine tramite IHC o per l'imaging di molecole fluorescenti espresse da transgeni.
La combinazione di FISH e IHC fluorescente può ridurre l'affidabilità di ciascuna tecnica isolata. In futuro, miriamo a migliorare la marcatura delle proteine citoplasmatiche su tessuto fresco congelato con un trattamento di recupero dell'antigene23. Studi precedenti hanno dimostrato che il recupero dell'antigene indotto dal calore aumenta l'accessibilità dell'epitopo proteico24,25,26. Il trattamento termico scinde i legami incrociati e i gruppi metilolici della proteina e dispiega gli antigeni nei tessuti, esponendo epitopi che altrimenti sarebbero nascosti nella struttura terziaria della proteina in condizioni biologiche. Questa accessibilità può migliorare il successo dell'etichettatura delle proteine26,27. Inoltre, prenderemo di mira diversi epitopi della stessa proteina citoplasmatica per determinare se il successo della marcatura proteina-anticorpo dipende dagli specifici cloni di anticorpi utilizzati.
In conclusione, la combinazione di FISH e IHC è utile per l'identificazione neurochimica di popolazioni eterogenee di cellule nel cervello, come quelle nel NTS. Questo studio presenta due protocolli che analizzano diverse preparazioni di tessuto del tronco encefalico di topo - fresco, congelato o fisso - per la marcatura fluorescente multiplex simultanea di mRNA e proteine in situ. Entrambi i protocolli possono essere ampiamente applicati per rilevare il pattern di espressione di mRNA a bassa abbondanza, come GalR1. Le preparazioni congelate fisse spesse (30 μm) permeabilizzate con proteasi hanno conferito un rilevamento più affidabile delle proteine citoplasmatiche e maggiori difficoltà di manipolazione dei tessuti, rispetto alle preparazioni fresche congelate sottili (14 μm).
Riconoscimenti
Questo lavoro è stato finanziato dall'Australian Research Council Discovery Project grant DP180101890 e dalla Rebecca L Cooper Medical Research Foundation project grant PG2018110
Materiali
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| C57BL/6 mouse | Australian BioResources, Moss Vale | MGI: 2159769 | |
| Phox2b-eGFP mouse | Australian BioResources, Moss Vale | MGI: 5776545 | |
| REAGENTS | |||
| Cyanoacrylate | Loctite | ||
| Ethylene Glycol | Sigma-Aldrich | 324558 | |
| Heparin-Sodium | Clifford Hallam Healthcare | 1070760 | Consult local veterinary supplier or pharmacy. |
| Lethabarb (Sodium Pentabarbitol) Euthanasia Injection | Virbac (Australia) Pty Ltd | N/A | Consult a veterinarian for local pharmaceutical regulations regarding Sodium Pentabarbitol |
| Molecular grade agarose powder | Sigma Aldrich | 5077 | |
| OCT Compound, 118mL | Scigen Ltd | 4586 | |
| Paraformaldehyde, prilled, 95% | Sigma-Aldrich | 441244-1KG | |
| Polyvinylpyrrolidone, average mol wt 40,000 (PVP-40) | Sigma-Aldrich | PVP40 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | With or without DAPI |
| RNAscope Multiplex Fluorescent Reagent Kit (up to 3-plex capability) | Advanced Cell Diagnostics, Inc. (ACD Bio) | ADV320850 | Includes 50x Wash buffer and Protease III |
| RNase Away | Thermo-Fisher Scientific | 7003 | |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | |
| Tween-20, for molecular biology | Sigma-Aldrich | P9416 | |
| EQUIPMENT | |||
| Benchtop incubator | Thermoline scientific micro incubator | Model: TEI-13G | |
| Brain Matrix, Mouse, 30g Adult, Coronal, 1mm | Ted Pella | 15050 | |
| Cryostat | Leica | CM1950 | |
| Drawing-up needle (23 inch gauge) | BD | 0288U07 | |
| Hydrophobic Barrier Pen | Vector labs | H-4000 | |
| Kimtech Science Kimwipes Delicate Task Wipes | Kimberley Clark Professional | 34120 | |
| Olympus BX51 | Olympus | BX-51 | |
| Peristaltic pump | Coleparmer Masterflex | L/S Series | |
| Retiga 2000R Digital Camera | QImaging | RET-2000R-F-CLR | colour camera |
| SuperFrost Plus Glass Slides (White) | Thermo-Fisher Scientific | 4951PLUS4 | |
| Vibrating Microtome (Vibratome) | Leica | VT1200S | |
| Whatman qualitative filter paper, Grade 1, 110 mm diameter | Merck | WHA1001110 | |
| SOFTWARES | |||
| CorelDRAW | Corel Corporation | Version 7 | |
| FIJI (ImageJ Distribution) | Open Source/GNU General Public Licence (GPL) | N/A | ImageJ 2.x: Rueden, C. T.; Schindelin, J. & Hiner, M. C. et al. (2017), "ImageJ2: ImageJ for the next generation of scientific image data", BMC Bioinformatics 18:529, PMID 29187165, doi:10.1186/s12859-017-1934-z and Fiji: Schindelin, J.; Arganda-Carreras, I. & Frise, E. et al. (2012), "Fiji: an open-source platform for biological-image analysis", Nature methods 9(7): 676-682, PMID 22743772, doi:10.1038/nmeth.2019 |
| PRIMARY ANTIBODIES | |||
| Anti-Tyrosine Hydroxylase Antibody | Millipore Sigma | AB1542 | Sheep polyclonal (1:1000 dilution), RRID: AB_90755 |
| Anti-Tyrosine Hydroxylase Antibody, clone LNC1 | Millipore Sigma | MAB318 | Mouse monoclonal (1:1000 dilution), RRID: AB_2201528 |
| Anti-Vesicular Acetylcholine Transporter (VAchT) Antibody | Sigma-Aldrich | ABN100 | Goat polyclonal (1:1000 dilution), RRID: AB_2630394 |
| GFP Antibody | Novus Biologicals | NB600-308 | Rabbit polyclonal (1:1000 dilution), RRID: AB_10003058 |
| Phox2b Antibody (B-11) | Santa Cruz Biotechnology | sc-376997 | Mouse monoclonal (1:1000 dilution), RRID: AB_2813765 |
| SECONDARY ANTIBODIES | |||
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Ms, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 711-545-152 | Donkey anti-Rabbit (1:400 dilution), RRID: AB_2313584 |
| AMCA AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-155-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_AB_2340725 |
| Cy5 AffiniPure Donkey Anti-Goat IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 705-175-147 | Donkey anti-Goat (1:400 dilution), RRID: AB_2340415 |
| Cy5 AffiniPure Donkey Anti-Mouse IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Rb, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 715-175-151 | Donkey anti-Mouse (1:400 dilution), RRID: AB_2619678 |
| Cy5 AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-175-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_2340730 |
| RNASCOPE PROBES | |||
| Galanin Receptor 1 oligonucleotide probe | ACDBio | 448821-C1 | targets bp 482 - 1669 (Genebank ref: NM_008082.2) |
| Glycine transporter 2 oligonucleotide probe | ACDBio | 409741-C3 | targets bp 925 - 2153 (Genebank ref: NM_148931.3) |
| Phox2b oligonucleotide probe | ACDBio | 407861-C2 | targets bp 1617 - 2790 (Genebank ref: NM_008888.3) |
Riferimenti
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Annese, T., et al. RNAscope dual ISH-IHC technology to study angiogenesis in diffuse large B-cell lymphomas. Histochemistry and Cell Biology. 153 (3), 185-192 (2020).
- Morrison, J. A., McKinney, M. C., Kulesa, P. M. Resolving in vivo gene expression during collective cell migration using an integrated RNAscope, immunohistochemistry and tissue clearing method. Mechanisms of Development. 148, 100-106 (2017).
- Gross-Thebing, T., Paksa, A., Raz, E. Simultaneous high-resolution detection of multiple transcripts combined with localization of proteins in whole-mount embryos. BMC Biology. 12, 55(2014).
- Stempel, A. J., Morgans, C. W., Stout, J. T., Appukuttan, B. Simultaneous visualization and cell-specific confirmation of RNA and protein in the mouse retina. Molecular Vision. 20, 1366-1373 (2014).
- Kersigo, J., et al. A RNAscope whole mount approach that can be combined with immunofluorescence to quantify differential distribution of mRNA. Cell and Tissue Research. 374 (2), 251-262 (2018).
- Grabinski, T. M., Kneynsberg, A., Manfredsson, F. P., Kanaan, N. M. A method for combining RNAscope in situ hybridization with immunohistochemistry in thick free-floating brain sections and primary neuronal cultures. PLoS One. 10 (3), 0120120(2015).
- Baleriola, J., Jean, Y., Troy, C., Hengst, U. Detection of axonally localized mRNAs in brain sections using high-resolution in situ hybridization. Journal of Visualized Experiments. (100), e52799(2015).
- Fe Lanfranco, M., Loane, D. J., Mocchetti, I., Burns, M. P., Villapol, S. Combination of fluorescent in situ hybridization (FISH) and immunofluorescence imaging for detection of cytokine expression in microglia/macrophage cells. Bio-Protocol. 7 (22), (2017).
- Dereli, A. S., Yaseen, Z., Carrive, P., Kumar, N. N. Adaptation of respiratory-related brain regions to long-term hypercapnia: focus on neuropeptides in the RTN. Frontiers in Neuroscience. 13, 1343(2019).
- Lazarenko, R. M., et al. Acid sensitivity and ultrastructure of the retrotrapezoid nucleus in Phox2b-EGFP transgenic mice. Journal of Comparative Neurology. 517 (1), 69-86 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Paxinos, G., Franklin, K. B. The mouse brain in stereotaxic coordinates. , Academic Press. (2004).
- Abercrombie, M. Estimation of nuclear population from microtome sections. Anatomical Records. 94, 239-247 (1946).
- Kerr, N., et al. The generation of knock-in mice expressing fluorescently tagged galanin receptors 1 and 2. Molecular and Cellular Neurosciences. 68, 258-271 (2015).
- Kachidian, P., Pickel, V. M. Localization of tyrosine hydroxylase in neuronal targets and efferents of the area postrema in the nucleus tractus solitarii of the rat. Journal of Comparative Neurology. 329 (3), 337-353 (1993).
- Stornetta, R. L., et al. Expression of Phox2b by brainstem neurons involved in chemosensory integration in the adult rat. Journal of Neuroscience. 26 (40), 10305-10314 (2006).
- Gilmor, M. L., et al. Expression of the putative vesicular acetylcholine transporter in rat brain and localization in cholinergic synaptic vesicles. Journal of Neuroscience. 16 (7), 2179-2190 (1996).
- Fisher, J. M., Sossin, W., Newcomb, R., Scheller, R. H. Multiple neuropeptides derived from a common precursor are differentially packaged and transported. Cell. 54 (6), 813-822 (1988).
- Towle, A. C., Lauder, J. M., Joh, T. H. Optimization of tyrosine-hydroxylase immunocytochemistry in paraffin sections using pretreatment with proteolytic-enzymes. Journal of Histochemistry and Cytochemistry. 32 (7), 766-770 (1984).
- Biancardi, V., et al. Mapping of the excitatory, inhibitory, and modulatory afferent projections to the anatomically defined active expiratory oscillator in adult male rats. Journal of Comparative Neurology. 529 (4), 853-884 (2021).
- Matthews, D. W., et al. Feedback in the brainstem: an excitatory disynaptic pathway for control of whisking. Journal of Comparative Neurology. 523 (6), 921-942 (2015).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Shi, S. R., Key, M. E., Kalra, K. L. Antigen retrieval in formalin-fixed, paraffin-embedded tissues: an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections. Journal of Histochemistry and Cytochemistry. 39 (6), 741-748 (1991).
- Yamashita, S., Katsumata, O. Heat-induced antigen retrieval in immunohistochemistry: mechanisms and applications. Methods in Molecular Biology. 1560, 147-161 (2017).
- Yamashita, S., Okada, Y. Mechanisms of heat-induced antigen retrieval: analyses in vitro employing SDS-PAGE and immunohistochemistry. Journal of Histochemistry and Cytochemistry. 53 (1), 13-21 (2005).
- Yamashita, S. Heat-induced antigen retrieval: mechanisms and application to histochemistry. Progress in Histochemistry and Cytochemistry. 41 (3), 141-200 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon