Method Article
리포터 단백질을 발현하는 재조합 로타바이러스를 회수하는 역유전학 방법 간소화
요약
플라스미드 DNA로부터의 재조합 로타바이러스 생성은 로타바이러스 복제 및 병인, 및 로타바이러스 발현 벡터 및 백신의 개발을 위한 필수적인 도구를 제공한다. 본 명세서에서, 우리는 형광 리포터 단백질을 발현하는 균주를 포함하는 재조합 로타바이러스를 생성하기 위한 단순화된 역유전학 접근법을 설명한다.
초록
Rotaviruses는 인간을 포함하여 많은 포유류 및 조류 호스트 종의 젊은에 있는 가혹한 위장염을 일으키는 원인이 되는 분할된 이중 좌초된 RNA 바이러스의 크고 진화하는 인구입니다. 로타바이러스 역유전학 시스템의 최근 출현으로, 로타바이러스 생물학을 탐구하고, 기존 로타바이러스 백신을 수정 및 최적화하고, 로타바이러스 다표적 백신 벡터를 개발하기 위해 지시된 돌연변이 발생을 사용할 수 있게 되었다. 이 보고서에서는 재조합 로타바이러스의 효율적이고 신뢰할 수 있는 복구를 허용하는 단순화된 역유전학 시스템을 설명합니다. 이 시스템은 전신 로타바이러스(+)RNAs를 발현하는 T7 전사 벡터의 공동 형질감염과 BHK 세포에 RNA 캡핑 효소를 코딩하는 CMV 벡터를 구성하여 T7 RNA 폴리머라제(BHK-T7)를 생성한다. 재조합 로타바이러스는 바이러스 성장을 위해 매우 허용되는 원숭이 신장 세포주인 MA104 세포로 형질감염된 BHK-T7 세포를 감독함으로써 증폭된다. 본 보고서에서, 우리는 또한 게놈 세그먼트 7(NSP3)으로 2A 번역 정지 재시작 원소의 도입을 통해 별도의 형광 리포터 단백질을 발현하는 재조합 로타바이러스를 생성하기 위한 접근법을 설명한다. 이 접근법은 바이러스 성 개방 판독 프레임 중 어느 것을 삭제하거나 수정하는 것을 방지하여 형광 단백질을 발현하면서 완전한 기능의 바이러스 성 단백질을 유지하는 재조합 로타바이러스의 생산을 허용합니다.
서문
로타 바이러스는 유아와 어린 아이들에 있는 가혹한 위장염의 중요한 원인, 뿐만 아니라 많은 그밖 포유류 및 조류 종의 젊은1. Reoviridae 가족의 일원으로서, 로타바이러스는 분할된 이중 가닥 RNA (dsRNA) 게놈이 있습니다. 게놈 세그먼트는 단백질2의3개의 동심 층에서 형성된 비 봉투에 싸인 icosahedral virion 안에 포함됩니다. 게놈 세그먼트의 시퀀싱 및 계통유전학 적 분석에 기초하여, 9종의 로타바이러스(A−D, F−J)가3가지로정의되었다. 로타바이러스 종 A를 포함하는 이들 균주는 대부분의 인간 질환에 대한 책임이 있다4. 지난 10 년 에서 시작 된 어린 시절 예방 접종 프로그램에 로타 바이러스 백신의 도입은 로타 바이러스 사망률과 이환율의 상당한 감소와 상관 관계가 있습니다. 가장 주목할 만한, 로타 바이러스 관련 어린 시절 죽음의 수는 2000년에 대략 528,000에서 2016년에 128,500에4,,5로감소했습니다. 로타바이러스 백신은 생후 6개월까지 어린이에게 2~3회 투여되는 살아있는 감쇠 균주에서 제조됩니다. 인간 과 다른 포유류 종에서 순환하는 유전적으로 다양한 로타 바이러스 균주의 많은 수, 돌연변이 발생 및 재분류를 통해 빠르게 진화하는 능력과 결합, 어린이를 감염로 타 바이러스의 유형에 항원 변화를 초래할 수있다6,,7,,8. 이러한 변화는 기존 백신의 효능을 약화시킬 수 있으며, 대체 또는 수정이 필요합니다.
11개의 로타바이러스 게놈 세그먼트 중 어느 한 쪽의 조작을 가능하게 하는 완전 플라스미드 기반 역유전학 시스템의 개발은 최근에9개달성되었다. 이러한 시스템의 가용성으로, 그것은 로타 바이러스 복제 및 병인의 분자 세부 사항을 해명 할 수있게되었다, 안티 로타 바이러스 화합물에 대한 개선 된 높은 처리량 스크리닝 방법을 개발하고, 로타 바이러스 백신의 새로운 잠재적으로 더 효과적인 클래스를 만들 수 있게되었다. 로타바이러스 복제 동안, 바이러스 성 (+)RNAs는 바이러스 성 단백질의 합성을 안내 할뿐만 아니라 자손 dsRNA 게놈 세그먼트10,,11의합성을위한 템플릿역할을합니다. 현재까지 기술된 모든 로타바이러스 역유전학 시스템은 재조합 바이러스9,,12,,13을회수하는데 사용되는 cDNA 유래(+)RNA의 공급원으로서 포유류 세포주내로 T7 전사 벡터의 형질감염에 의존한다. 전사 벡터 내에서, 전신 바이러스 성 cDNA는 상류 T7 프로모터와 다운스트림 간염 델타 바이러스 (HDV) ribozyme 사이에 위치되어 바이러스 (+)RNA가 본격적인 5'및 3'termini를 포함하는 T7 RNA 폴리머라제에 의해 합성됩니다(그림 1A). 1세대 역유전학 시스템에서, 재조합 바이러스는 11T7(pT7) 전사 벡터로 T7 RNA 폴리머라제(BHK-T7)를 발현하는 아기 햄스터 신장 세포를 트랜스펙팅함으로써 만들어졌으며, 시미안 SA11 바이러스 균주의 독특한(+)RNA및 3개의 CMV 프로모터-구동 발현 플라스미드의 각각의 지시 합성, 조류 류바이러스 p10FAST 융합 단백질을 인코딩한 1개 및 백시니아 바이러스 D1R-D12L 캡핑 효소 복합체의 2개의 인코딩서브유닛. 형질감염된 BHK-T7 세포에서 생성된 재조합 SA11 바이러스는 로타바이러스 성장을 허용하는 세포주인 MA104 세포를 감독함으로써 증폭되었다. 1세대 역유전학 시스템의 변형된 버전은 더 이상 지지플라스미드(12)를사용하지 않는다고 기술되었다. 대신, 수정된 시스템은 단순히 BHK-T7 세포를 11개의 SA11 T7 전사 벡터로 트랜스펙팅함으로써 재조합 로타바이러스를 성공적으로 생성하며, 바이러스 성 공장(viroplasm) 빌딩 블록(비구조적 단백질 NSP2 및 NSP5)에 대한 벡터가 다른 벡터14, 15보다,153배 높은 수준으로 추가된다는 경고와 함께. 역유전학 시스템의 변형된 버전은 또한 로타바이러스16,,17의인간 KU 및 Odelia 균주의 회복을 지원하는 개발되었다. 로타바이러스 게놈은 VP418,NSP19,NSP219,NSP320,,21,NSP522,,23에도입된 돌연변이와 함께 현재까지 생성된 재조합 바이러스와 함께 역유전학에 의한 조작이 현저하게 가능하다. 지금까지 생성된 가장 유용한 바이러스 중에는 형광 리포터 단백질(FPs)9,,12,,21,,24,,25를발현하도록 설계된 바이러스가 있다.
이 간행물에서는, 우리는 우리가 SA11 로타바이러스의 재조합 긴장을 생성하기 위하여 우리의 실험실에서 사용하는 역유전학 시스템을 위한 프로토콜을 제공합니다. 당사의 프로토콜의 주요 특징은 11개의 pT7 전사 벡터(pT7/NSP2SA11 및 pT7/NSP5SA1 벡터의 3배 수준을 포함하도록 변형된 변형)와 아프리카 돼지 열바이러스(ASFV) NP868R 캡핑 효소를 코딩하는 CMV 발현 벡터를 가진 BHK-T7 세포의 병용화이다.21 Figure 2 우리의 손에, NP868R 플라스미드의 존재는 형질감염된 BHK-T7 세포에 의한 재조합 바이러스의 더 높은 역가의 생산으로 이어집니다. 본 공보에서는, 우리는 또한 세그먼트 7 단백질 생성물 NSP3뿐만 아니라 별도의 FP를 발현하는 재조합 바이러스가 생성될 수 있도록 pT7/NSP3SA11 플라스미드를 수정하기 위한 프로토콜을 제공한다. 이는 fp ORF(도1B)24,,26에이어 다운스트림 2A 번역 정지-재시작 엘리먼트를 포함하는 pT7/NSP3SA11 플라스미드에서 NSP3 오픈 판독 프레임(ORF)을 재엔지니어링함으로써 달성된다. 이러한 접근법을 통해, 우리는 다양한 FPs를 발현하는 재조합 로타바이러스를 생성하였다: UnaG (녹색), mKate (원빨색), mRuby (빨강), TagBFP (청색), CFP (시안), 및 YFP (노란색)24,,27,,28. 이러한 FP 발현 로타바이러스는 NSP3 ORF를 삭제하지 않고 만들어지므로 기능하는 바이러스 단백질의 완전한 보완을 인코딩할 것으로 예상되는 바이러스를 산출합니다.
프로토콜
1. 배지 준비 및 세포 배양 유지 보수
- T7 RNA 폴리머라제(BHK-T7) 및 아프리카 녹색 원숭이 신장 MA104 세포를 구성하는 아기 햄스터 신장 세포를 구한다.
참고: BHK-T7 (또는 BSR-T7) 세포는 상업적으로 유효하지 않습니다, 그러나 RNA 바이러스 생물학을 공부하기 위하여 역유전학을 사용하여 실험실의 일반적인 세포주입니다. 본 프로토콜에 사용된 BHK-T7 세포주박사는 T7 RNA 폴리머라제29를발현하는 본래 BHK 세포주의 공동 개발사인 우르술라 J. Buchholz 박사(미국 국립보건원, 베데스다, MD, 미국)로부터 수득되었다. MA104 세포는 인증된 세포 배양(ECACC)의 유럽 컬렉션과 미국 유형 배양 컬렉션(ATCC)에서 구할 수 있습니다. - 멸균 환경에서 다음 배양 배지를 제조하는 것은 바람직하게는 Class II 생물학적 안전 캐비닛이다. 사용 직전에 4°C에서 어두운 장소에서 37°C로 따뜻하게 매체를 저장합니다.
참고: 미디어 구성 요소의 소스는 재료 표에제공됩니다.- DMEM 불완전한 배지를 준비하려면, 4.5 g/L 글루코스와 1% 글루타민을 함유한 덜베코의 수정된 이글의 최소 필수 배지(MEM) 500 mL와 100x 펜 스트렙 5 mL을 결합합니다.
- DMEM 완전한 배지를 준비하려면 500 mL의 DMEM 불완전한 배지와 25 mL의 태아 소 혈청(FBS)을 결합합니다.
- GMEM 불완전한 배지를 준비하려면 글래스고 최소 필수 배지 500 mL, 글루타민 100x 5 mL, 트립토스-인산성 육수 50mL(TPB), 100x 비필수 아미노산(NEAA) 5 mL, 100x 펜 스트렙 5 mL을 결합합니다.
- GMEM 완전한 매체를 준비하려면 500 mL의 GMEM 불완전한 배지와 25 mL의 열 불활성화 FBS를 결합하십시오.
- GMEM+G 완전 배지를 준비하려면, GMEM 완전 배지의 500 mL에 50 mg/mL 유전학(G418)의 10 mL를 추가하십시오.
- SMEM 불완전한 매체를 준비하려면 Joklik의 수정된 이글 MEM 500 mL, 글루타민 100x 5mL, TPB 5mL, NEAA 100x NEAA 5mL, 100x 펜 스트렙 5mL를 결합합니다.
- DMEM 완전 배지의 12 또는 25 mL를 포함하는 T75 또는 T175 플라스크에서의 배양 MA104 세포. 100% 수렴에 도달한 MA104 세포를 통과하려면 인산완충식염수(PBS)로 세포 단층 2층을 헹구고 트립신(0.05%)-EDTA(0.1%)로 해리합니다. DMEM 불완전 한 매체의 5 (T75 플라스크) 또는 10 mL (T175 플라스크)에서 다시 일시 중단하십시오.
- 0.5-1.0 mL의 재부유 셀을 신선한 플라스크에 놓고 DMEM 완전 배지를 추가하여 적절한 최종 부피를 가져옵니다. 플라스크를 37°C, 5%CO2 인큐베이터에 놓습니다.
- T75 플라스크에서 BHK-T7 세포를 전파하여, GMEM과 GMEM+G 의 사용이 각 통로마다 번갈아 가며 진행됩니다. 100% 결합에 도달한 BHK-T7 세포를 하위 배양하려면, PBS로 세포 단층 2x를 헹구고, 트립신-EDTA 용액으로 해리하고, 배지의 5 mL에서 재중단한다.
- 신선한 T75 플라스크에 GEM 또는 GMEM+G 완전 배지 15mL를 넣은 후, 다시 매달린 BHK-T7 세포 4방울을 추가합니다. 플라스크를 37°C, 5%CO2 인큐베이터에 놓습니다.
2. 플라스미드 준비
- 애드진으로부터 로타바이러스 SA11 (+)RNA를 발현하는 다음 플라스미드를 구하십시오: pT7/VP1SA11, pT7/VP2SA11, pT7/VP3SA11, pT7/VP4SA11, pT7/VP6SA11, pT7/VP7SA11, pT7/NSP1SA11, pT7/NSP2SA11, pT7/NSP3SA11, pT7/NSP4SA11, pT7/NSP4SA11, 및 p17A. 저자21로부터ASFV 캡핑 효소(pCMV/NP868R)를 발현하는 플라스미드를 얻었다.
참고: 2A 번역 요소(pT7/NSP3-2A-3xFL-FP)의 활성을 통해 FP를 발현하도록 설계된 변형된 pT7/NSP3SA11 플라스미드는 또한 저자24,,26으로부터얻을 수 있다. 다음 의 FP를 표현하는 pT7/NSP3-3A-3xFL-FP 플라스미드를 사용할 수 있습니다: UnaG (녹색), mKate (원빨색), MRuby (빨강), TagBFP (파란색), CFP (시안), 및 YFP (노란색)24. - 플라스미드를 유능한 E로변환합니다. 대장균 DH5α및 적절한 항생제를 함유하는 루리아 국물 한천플레이트에 박테리아를 퍼뜨리게 한다. 개별 식민지에서 수확한 세균 배양을 재배하고 스핀 미니프 정제키트(재료 표)를사용하여 소량의 플라스미드(20 μg)를 제조합니다. 미디와 맥시 정제 키트(재료표)를사용하여 세균 배양물에서 더 많은 양의 플라스미드를 준비합니다.
참고 : 역 유전학 시스템에 사용하기에 적합한 플라스미드는 다른 플라스미드 정제 키트와 함께 제조되었습니다. 내독소가 없는 물질을 생성하도록 특별히 설계된 키트를 사용하여 플라스미드를 준비할 필요는 없습니다. - 뉴클레아제 없는 분자 생물학 등급의 물에서 정제된 플라스미드의 농도를 1 mg/mL로 조정합니다. 분광광도계를 사용하여 ~1.8의 260/280 흡광도 비율을 확인하여 플라스미드 순도를 확인하였다. 또한, 0.8% 아가로즈 젤에 전기 동동을 사용하여 플라스미드가 주로 수퍼코일되어 있는지 확인하십시오.
- Aliquot 정제 플라스미드를 0.5 mL 멸균 미세 원심분리튜브로, 각각 10 μL. -80°C에서 점치 플라스미드를 함유하였다.
3. 재조합 바이러스의 생성
참고: 재조합 로타바이러스 균주의 생성 및 특성화를 포함한 인간 및 동물 로타바이러스 연구는 생물안전성 수준 2(BSL-2) 조건하에서 처리되어야 하며 기관 생물안전위원회(IBC)의 사전 승인을 받아야 합니다. 적절한 BSL-2 실험실 조건은 미국 질병통제예방센터(CDC)30에의해 생산된 미생물 및 생물의학 실험실(BMBL)의 생물안전성에 기재되어 있다.
- 1일차: BHK-T7 세포를 12웰 플레이트에 파종
- PBS를 가진 T75 플라스크 2x에 포함된 BHK-T7 세포의 갓 결합된 단층을 헹구세요. 트립신-EDTA 용액으로 세포 단층을 중단하고 5 mL의 GMEM 완전 배지에서 세포를 다시 중단시킴.
- 배지에서 실행 가능한 BHK-T7 세포의 농도를 결정하기 위해 자동화된 세포 카운터 및 트리판-블루 용액을 사용한다. 종자 세포는 12웰 세포 배양플레이트내로, 각각의 웰을 함유하여 2 x 105 세포를 총 부피의 1 mL의 GMEM(G418-free) 완전 배지. 37°C, 5%CO2 인큐베이터에서 배양한다. 세포는 2 일까지 80-90 % 동률에 도달해야합니다.
- 일 2: 플라스미드 혼합물을 가진 BHK-T7 세포의 형질전환
- 플라스미드 혼합물을 준비하려면, 1 mg/mL로 조정된 플라스미드 스톡을 사용하여 0.5 mL 마이크로원심지 튜브에 다음을 결합한다: 0.8 μL 각 SA11 pT7 플라스미드 VP1, VP2, VP3, VP4, VP6, VP7, NSP1, NSP3 및 NSP4, SA11 pT7 플라스미드 NSP2 및 NSP5 각각 2.4 μL, pCMV/NP868R0.8 μL. 튜브를 눌러 플라스미드를 부드럽게 혼합하고 펄스 원심분리에 의해 내용물 수집합니다. FPs를 발현하는 재조합 바이러스를 준비하려면 pT7/NSP3SA11을 적절한 pT7/NSP3-2A-3XFL-FP 플라스미드로 교체하십시오.
참고: 플라스미드 혼합물은 사용할 때까지 얼음에 보관해야 합니다. 각 형질 감염에 대해 별도의 튜브를 준비해야합니다. - 플라스미드/환혈 시약 혼합물을 준비하려면: 110 μL의 미리 따뜻화된(37°C) 감소된 혈청배지(재료 표)를각 플라스미드 혼합물에 넣고 부드럽게 위아래로 파이펫팅하여 혼합합니다. 그 후, 각 플라스미드/환원 혈청 배지 혼합물에 32 μL의 형질감염 시약(재료표)을첨가한다; 이것은 혼합물에서 플라스미드의 μg 당 2.5 μL의 형질감염 시약의 농도를 산출합니다. 소용돌이 혼합물을 부드럽게 하고 실온에서 20 분 동안 배양하십시오.
- 20분 의 잠복기 동안, BHK-T7 세포를 12웰 플레이트(1일째에 제조)에서 2 mL의 불완전한 매체로 한 번 헹구는다. 그 후, 각 우물에 1 mL의 불완전한 배지를 추가하고 인큐베이터에 플레이트를 반환합니다.
- 20 분 인큐베이션 기간 후, 200 μL 파이펫터를 사용하여 12 웰 플레이트의 각 웰에 플라스미드 / 감소 혈청 배지 / 형질 감염 혼합물을 한 방울씩 추가하십시오. 부드럽게 바위 플레이트를 37°C, 5%CO2 인큐베이터로 되돌려 보냅니다.
- 플라스미드 혼합물을 준비하려면, 1 mg/mL로 조정된 플라스미드 스톡을 사용하여 0.5 mL 마이크로원심지 튜브에 다음을 결합한다: 0.8 μL 각 SA11 pT7 플라스미드 VP1, VP2, VP3, VP4, VP6, VP7, NSP1, NSP3 및 NSP4, SA11 pT7 플라스미드 NSP2 및 NSP5 각각 2.4 μL, pCMV/NP868R0.8 μL. 튜브를 눌러 플라스미드를 부드럽게 혼합하고 펄스 원심분리에 의해 내용물 수집합니다. FPs를 발현하는 재조합 바이러스를 준비하려면 pT7/NSP3SA11을 적절한 pT7/NSP3-2A-3XFL-FP 플라스미드로 교체하십시오.
- 일 4: MA104 세포를 가진 형질 감염된 BHK-T7 세포를 감독
- PBS를 가진 T75 플라스크 2x에 포함된 MA104 세포의 갓 결합된 단층을 헹구세요. 트립신-EDTA 용액을 사용하여 단층을 파괴하고 DMEM 완전 배지의 5 mL에서 세포를 다시 중단하십시오.
- 자동화된 세포 카운터 및 트라이판-블루 용액을 사용하여, 배지에서 가능한 MA104 세포의 농도를 결정한다. DMEM 불완전 배지에서 농도를 8 x 105 MA104 세포/mL로 조정하고 형질감염된 BHK-T7 세포를 함유하는 웰에 0.25 mL의 부유 세포(2 x 105 세포)를 떨어뜨립니다.
- 각 우물에 0.8 μL의 1 mg/mL 트립신 스톡을 추가하여 배지에서 트립신(돼지 췌장 형 IX)의 농도를 ~0.5 μg/mL로 조절한다.
참고 : 트립신 주식은 PBS에서 준비되어야하며, aliquoted, -20 °C에서 보관해야합니다. - 나머지 MA104 세포를 사용하여 재조합 바이러스를 증폭시키기 위해 7일째에 필요한 6웰 플레이트를 준비합니다. 종자 6 웰 플레이트에, DMEM 완전한 배지에서 1.5 x 105 세포 / mL의 농도로 재 일시 중단 된 MA104 세포를 희석하고 각 우물에 2 mL을 배치하십시오. 플레이트를 37°C, 5%CO2 인큐베이터에 놓습니다.
- 일 7: 복구 및 형질 감염 된 세포에서 재조합 바이러스의 증폭
- 대상 BHK-T7/MA104 세포는 12웰 플레이트에서 멸균 조건하에서 동결 해동의 3사이클로, -20°C 냉동고와 실온 표면 사이의 플레이트를 이동한다. 용해액을 1.5 mL 튜브로 옮긴 후, 원심분리튜브를 500 g x g(4°C)에서 10분 동안 펠릿 큰 세포 이물질을 펠릿으로 옮긴다. 상급을 수집하고 4 °C (단기) 또는 -20 °C (장기)에서 저장합니다.
- 6 웰 플레이트 (4 일째에 준비) PBS로 2 x2x에 MA104 단층을 씻으하십시오. 0.5 μg/mL 트립신을 함유한 각 우물에 DMEM 불완전한 배지 2 mL을 놓습니다. BHK-T7/MA104 세포에서 회수된 상층부 300 μL을 우물에 넣고 플레이트를 37°C, 5%CO2 인큐베이터에 넣습니다.
- 7 일 동안 또는 완전한 세포 병증 효과 (CPE)가 관찰 될 때까지 배양 플레이트. Lyse MA104 세포는 동결 해동의 3 사이클에 의해 6 웰 플레이트에서, 다음 1.5 mL 미세 원심 분리튜브에 용해를 전송합니다. 펠렛 큰 세포 파편500 x g (4 °C)에서 10 분 동안 원심 분리에 의해. 정제된 세포용액을 1.5 mL 마이크로원지 튜브로 옮기고 -20°C에서 보관한다.
4. 재조합 바이러스의 플라크 격리
- 100 μL의 정제된 세포 용해물에서 바이러스를 활성화하고 1시간 동안 37°C에서 37°C에서 배양하여 DMEM 불완전 배지에서10-1 ~10-7(각각-7 1 mL)에 이르는 10배 직렬 희석 시리즈를 준비한다.
- 6웰 플레이트에 2x PBS 2mL, DMEM 불완전 한 배지로 한 번 헹구어 보시고 MA104 단층을 헹구어 보냅니다. 400 mL의 용해 성 희석을 접시에 복제하여 추가하십시오. 37°C, 5%CO2 인큐베이터에서 1시간 동안 플레이트를 배양하고, 10-15분마다 흔들어 희석을 단층 전체에 재분배한다.
- 전자레인지를 사용하여 물에 녹고 45°C로 미리 냉각시킨 1.5% 아가로즈와 2x 이글의 최소 필수 배지(EMEM; 37°C로 미리 따뜻해진)의 동일한 부피를 결합하여 아가로즈-MEM 오버레이 솔루션을 준비합니다. 수조를 사용하여 42°C에서 오버레이 용액을 유지하고 세포에 놓기 직전에 0.5 μg/mL 트립신의 최종 농도로 조정합니다.
- 6웰 플레이트에서 용해 희석을 제거한 다음 불완전한 DMEM 2 mL로 세포를 한 번 헹구어 냅니다. 아가로즈-MEM 오버레이 용액의 3 mL를 각 웰에 함유된 세포 단층 위에 부드럽게 오버레이합니다. 아가로즈 오버레이가 실온에서 경화되도록 한 다음 플레이트를 인큐베이터로 되돌려 놓습니다.
- 3일 후, 4.3단계에서와 같이 아가로즈-MEM 오버레이 용액을 준비하고 42°C로 가져온다. 사용 직전에 오버레이 용액을 50 μg/mL 중성 적색(재료표)의최종 농도로 조정합니다.
- 6웰 플레이트에 기존 아가로즈 층 위에 오버레이 용액 2mL를 추가합니다. 새로운 아가로즈 층이 경화하도록 허용한 후, 플레이트를 인큐베이터로 되돌린후. 빛에 노출되지 않도록 중립 적색을 함유한 용액과 플레이트를 보호합니다.
- 다음 6 시간 동안, 라이트 박스의 도움으로 6 웰 플레이트에서 로타 바이러스 플라크를 식별하십시오. 일회용 이송 파이펫을 사용하여 명확하게 정의된 플라크를 선택하고 세포 층으로 완전히 확장되는 아가로즈 플러그를 회수합니다.
- 0.5 mL의 DMEM 불완전한 배지를 함유하고 있는 1.5 mL 튜브로 플러그를 배출하고 30초 동안 샘플을 소용돌이치며, 6웰 플레이트 또는 DMEM 불완전 배지 및 0.5 μg/mL트립을 함유한 T25 플라스크에서 MA104 단층으로 전파하여 배지로 방출된 플라크 분리 바이러스를 증폭시다.
참고 : 플라크 분석에 의한 로타 바이러스의 격리 및 타이터링에 관한 추가 정보는 Arnold et al.31에서확인할 수 있습니다.
5. 바이러스 성 dsRNA의 젤 전기 동동
- 1.5 mL 미세 원심 분리튜브에 1.5 mL 의 미세 원심 분리튜브에 600 μL의 감염된 세포 용해액과 400 μL의 구니디늄 티오시야네이트를 놓고, 30 초 동안 실온에서 배양하고, 클로로폼 200 μL, 30 s의 소용돌이를 추가하고 3 분 동안 배양하십시오. 13,000 x g (4 °C)에서 5 분 동안 원심 분리 한 후 상부 수성 상을 신선한 튜브로 550 μL로 옮긴다.
- 차가운 이소프로필 알코올 2부(~900 μL)를 추가하고 튜브를 4−6x 로 뒤집어 수성 단계에서 바이러스 성 dsRNA를 회수합니다. 실온에서 10분 동안 배양한 후, 원심분리튜브를 13,000 g x g(4°C)에서 10분 동안 배양하였다. 상급물질을 버리고 RNA 펠릿을 유지하십시오.
- 튜브에 75% 에탄올 1mL를 추가하고, 한 번 반전시키고, 7,500 x g(4°C)에서 5분 동안 원심분리하여 펠릿을 세척합니다. g 파이펫터로 에탄올 세척을 조심스럽게 제거한 후, RNA 펠릿을 실험실 벤치에서 5-10분 동안 공기 건조시키십시오.
- 용존 RNA 샘플 10 μL과 6x DNA 로딩 버퍼 2 μL을 결합하고, 프리캐스트 10% 폴리아크릴라미드 미니 겔(또는 핸드 캐스트 등가물)에 로드하고, 일정한 전류(16 mA)에서 2시간 동안 트리스 글리신 실행 버퍼에서 전기 영동에 의한 RNA를 해결합니다. ~ 1 μg / mL 에티듐 브로마이드를 함유 한 물에 5-10 분 동안 젤을 담그고 UV 트랜스 일루미네이터로 로타 바이러스 게놈 세그먼트를 감지하십시오.
6. 바이러스 성 dsRNA의 복구 및 시퀀싱
- 바람직하게는 핵산 가교를 생성하지 않도록, 낮은 강도의 긴 파장 UV 빛을 사용하여 폴리 아크릴 아미드 젤에 바이러스 성 dsRNA 밴드를 찾습니다. 신선한 면도날을 사용하여 dsRNA 밴드를 함유한 젤 조각을 잘라내고 1.5 mL 미세 원심 분리튜브로 옮김을 합니다.
- RNase가 없는 물 10-20 μL을 추가한 후, 1.5mL 마이크로원심분리튜브에 맞도록 설계된 RNase 없는 일회용 펠릿 유봉으로 각 조각을 분쇄하거나 18G 바늘을 통해 위아래로 그립니다. 4°C에서 하룻밤 동안 분쇄된 단편을 배양한다.
- 분쇄된 젤 조각이 들어 있는 튜브에서 3 μL의 액체를 회수합니다. 바이러스 성 dsRNAs의 cdNAs를 생성한 1단계 역전사 폴리머라제 연쇄 반응(RT-PCR)키트(표 재료)및 적절한 올리고뉴클레오티드 프라이머를 사용한다.
참고 : PCR 제품은 PCR 클린 업 키트(재료 표)로젤 정제되고 상용 DNA 서열 서비스에 의해 프라이머와 함께 하룻밤 시퀀싱을 위해 발송됩니다.
7. 바이러스 성 단백질의 면역 블롯 분석
- DMEM 전체 배지의 총 부피에서 웰당 3 x 105 MA104 셀이 있는 시드 6웰 플레이트. 플레이트를 37°C, 5%CO2 인큐베이터에 놓고 세포가 합의에 도달할 때까지 둡니다(3−5일).
참고 : 결합 단층웰 ~ 1.2 x 106 세포를 포함합니다. - 37°C에서 10 μg/mL 트립신으로 배양하여 1시간 동안 1회 동안 배양하여 그 안에 함유된 재조합 로타바이러스 입자를 활성화하여 정제된 과민제를 치료합니다.
- 6웰 플레이트에 2mL의 PBS로 MA104 단층을 헹구어 보냅니다. DMEM 불완전 배지에서 트립신 활성화 로타바이러스세포당 3-5 플라크 형성 유닛(PFU)을 함유하는 접종균의 각각에 200 μL을 첨가하여 세포를 감염시다. 플레이트를 인큐베이터로 되돌아갑니다.
- 매 10 분마다 접시를 제거하고 부드럽게 바위를 흔들어 세포 단층 전체에 접종을 재분배하십시오. 1 시간 후, DMEM 불완전한 매체의 2 mL로 접종을 대체하십시오.
- 8 시간 후 감염에서, PBS로 6 웰 플레이트 2 배에서 세포를 헹구는다. PBS의 750 μL로 세포를 긁어 1.5 mL 미세 원심 분리 튜브로 볼륨을 전송합니다. 다른 750 μL의 PBS로 플레이트를 헹구고 이전에 수집된 750 μL 샘플과 결합합니다.
- 4°C에서 10분 동안 5,000 x g에서 원심분리하여 시료의 펠릿 세포. 상급제 폐기 후, 세포 펠릿을 추가로 처리될 때까지 -80°C에서 저장합니다.
- 300 mM NaCl, 100 mM Tris-HCl, pH 7.4, 2% 트리톤 X-100 및 1x EDTA 프리 완전 프로테아제 억제제가 함유된 세포 용해 완충제준비. 300 μL의 용해 버퍼를 냉동 세포 펠릿에 첨가한 후, 잠시 소용돌이 샘플을 얼음에 10 분 동안 배양하였다.
- 얼음 3x에 소용돌이 및 인큐베이팅 시료의 과정을 반복합니다. 그 후, 4 °C에서 10 분 동안 15,000 x g의 원심 분리기 샘플을 수집 한 다음 -80 °C에서 저장합니다.
- 프리캐스트 선형 8-16% 폴리아크릴아미드 미니 젤에 전기 동공에 의해 상급 시료의 20 μL 볼륨에 포함된 단백질을 해결하고 니트로셀룰로오스 멤브레인으로 옮김을 옮김. PBS-Tween 20 (0.02%)로 인큐베이션하여 멤브레인 을 차단 5 % 무지방 건조 우유를 함유 한 용액.
- 프로브 막은 하나 이상의 1차 항체(예를 들어, 기니피그 항-NSP3 또는 항VP6 항세라, 마우스 단일클론 항-플래그 M2 항체, 또는 토끼 단클론 항-PCNA 항체)로 배양하여. 말 항 마우스 IgG, 항 기니 피그 IgG, 또는 염소 항 토끼 IgG 고추냉이 과옥시다제-접합 이차 항체로 막을 배양하여 1차 항체를 검출하고, 이어서 강화된 화학발광(ECL) 고추냉이 화학발광 기질이 뒤따랐다. 겔 이미징시스템(재료 표)또는 X선 필름을 사용하여 발광 신호를 시각화합니다.
8. FP 발현 바이러스에 감염된 세포의 살아있는 세포 이미징
- DMEM 완전 배지의 총 2 mL에서 웰 당 3 x 105 MA104 셀을 가진 종자 6 웰 플레이트. 플레이트를 37°C, 5%CO2 인큐베이터에 놓고 세포가 합의에 도달할 때까지 둡니다(3−5일).
참고 : 결합 단층웰 ~ 1.2 x 106 세포를 포함합니다. - 로타바이러스 샘플을 1시간 동안 37°C에서 10 μg/mL 트립신으로 배양하여 알려진 적시의 로타바이러스 샘플을 활성화합니다.
- MA104 단층 2x와 PBS 2 mL로 6 웰 플레이트를 헹구어 보냅니다. DMEM 불완전 배지에서 트립신 활성화 로타바이러스의 세포당 3-5 PFU를 함유하는 접종의 각각의 웰 200 μL에 첨가하여 세포를 감염시다. 플레이트를 인큐베이터로 되돌려 10분마다 세포 단층 전체에 접종을 재분배하기 위해 부드럽게 바위 판을 되돌려 보냅니다.
참고: 바이러스가 없는 DMEM 접종에 감염된 모의 웰은 컨트롤로 포함되어야 합니다. - 바이러스 흡착 1시간 후, PBS로 단층 2x를 헹구고 DMEM 불완전 배지당 0.5 mL로 배지를 교체합니다. 7.5 h 포스트 감염에서 배양 배지를 낮은 배경 형광으로 DMEM으로 대체하십시오(재료 표). 8 시간 후 감염에서, 녹색, 적색, 또는 청색 형광 신호에 대한 20 배 배율에서 세포를 검사하기 위해 라이브 세포 이미저를 사용합니다.
결과
이 문서에서 기술된 역유전학 프로토콜은 여러 가지 뚜렷한 단계를 통해 진행됩니다: (1) 로타바이러스 pT7 전사 벡터와 pCMV/NP868R 발현 플라스미드를 가진 BHK-T7 세포의 공동 형질전환, (2) MA104 세포를 이용한 형질감염된 BHK-T7 세포의 감독, (3) MA104 세포를 사용하여 BHK-T7/MA104 세포에 존재하는 재조합 바이러스의 증폭, (4) MA104 세포를 이용한 재조합 바이러스의 플라크분리(그림 2). 우리의 손에, 프로토콜은 효율적입니다, BHK-T7 / MA104 세포에서 재조합 야생형 SA11 바이러스 (rSA11 / wt)의 타이터를 산출 ~ 104 PFU / mL의 및 증폭 MA104 세포 용해 >1 x 107 PFU / mL. FPs를 발현하는 변형된 pT7/NSP3SA11 플라스미드를 사용하여 역유전학에 의해 생성된 SA11 재조합 바이러스(예를 들어, rSA11/NSP3-2A-3xFL-UnaG)는 rSA11/wt보다 ~4배 적은 역가에게 자랍니다.
역유전학 프로토콜에 따라, 우리는 MA104 세포에 대한 플라크 분석으로 쉽게 식별된 재조합 SA11 바이러스를 생성하여 플라크 분리를 허용하였다(도3D). 플라크의 바이러스는 긴 팁 일회용 전사 파이펫으로 포착하고 MA104 세포에서 증폭시켰다. 플라크 정제 된 rSA11 / wt 및 rSA11 / NSP3-2A-3xFL-UnaG 바이러스의 dsRNA 게놈을 구니디늄 티오시아네이트로 추출하고, 10 % 폴리 아크릴라미드 겔에서 전기 영동에 의해 해결되고, 에티듐 브로마이드(그림 3A)로염색하여 검출하였다. 예상대로, rSA11/NSP3-2A-3xFL-UnaG의 세그먼트 7(NSP3) dsRNA는 2A-3xFL-UnaG 서열의 존재로 인해 rSA11/wt(그림3A)보다훨씬 느리게 이동되었다. rSA11/NSP3-2A-3xFL-UnaG의 세그먼트 7(NSP3) dsRNA를 겔 정제하고, RT-PCR에 의해 cDNA 형태로 변환하고, 정확도를 확인하기 위해 시퀀싱하였다.
UnaG 형광 단백질의 발현을 확인하기 위해, 6웰 플레이트의 MA104 세포는 rSA11/wt 및 rSA1/NSP3-2A-3xFL-UnaG의 세포당 3PFU로 감염되었다. 8 시간 후 감염에서, 플레이트내의 배양 배지는 웰당 낮은 배경 형광으로 0.5 mL의 DMEM으로 대체되었고, 플레이트는CO2 인큐베이터에서 37°C에서 30분 동안 추가로 배양하였다. 그 후, 플레이트는 라이브 셀 이미저를 사용하여 UnaG 발현을 검사했습니다. 분석은 rSA11/NSP3-2A-3xFL-UnaG가 재조합 바이러스에서 UnaG 유전자의 기능을 검증하여 녹색 형광을 생성한다는 것을보여주었다(그림 3B). 대조적으로, 녹색 형광은 rSA11/wt에 감염된 세포에서 검출되지 않았다. rSA11/NSP3-2AxFL-UnaG의 변형된 세그먼트 7에서 2A 원소가 두 개의 분리된 단백질(NSP3-2A 및 3xFL-UnaG)의 발현을 촉진했는지 여부를 해결하기 위해 MA104 세포는 rSA1/NSP3-2A-3XFL-UnaG 및 rSA11/wt에 감염되었다. 세포 용해액은 8 시간 후 감염에서 수확 된 세포로부터 제조되었고, 겔 전기 동동에 의해 해결되고, 니트로 셀룰로오스 필터에 블로트화되었다. 블롯은 로타바이러스 VP6 및 NSP3 및 FLAG 태그에 특이적인 항체로 조사되었다. 분석은 NSP3-2A 및 3xFL-UnaG가 rSA1/NSP3-2A-3xFL-UnaG에 감염된 세포에서 별도의 단백질로 발현되었음을 보여주었으며, 이는 2A 원소가 기능적임을나타낸다(도 3C). rSA11/wt에 감염된 세포는 항-FLAG 항체에 의해 인식된 단백질을 발현하지 않았다. rSA11/NSP3-2A-3xFL-UnaG 감염 세포에 존재하는 NSP3 단백질은 NSP3의 C-말단에서 잔재 2A 잔기의 존재로 인해 rSA11/wt 감염 세포에 존재하는 NSP3 항체보다 약간 느리게 이동되었다.

그림 1: 로타바이러스 역유전학 플라스미드. (A)11개의 SA11 로타바이러스 게놈 세그먼트의 전신 cDNA는 pT7 플라스미드 내에 위치하며, HDV 리보자임과 함께 T7 RNA 폴리머라제 및 다운스트림에 대한 프로모터로 상류에 결찰된다. T7 RNA 폴리머라제의 존재에서, 로타바이러스 pT7 플라스미드는 본격적인 5' 및 3' 테르미니를 가진 전신 SA11 (+)RNAs를 생성합니다. (B)pT7/NSP3-2A-3A-3xFL-UnaG 플라스미드에 의해 만들어진 (+)RNA 및 단백질 제품의 회로도. 회로도는 NSP3 cDNA 서열, 및 돼지 테스코바이러스 2A-like(2A) 요소, 3x FLAG(FL) 태그, 및 녹색 형광 단백질 UnaG에 대한 서열을 포함한다. 2A 번역 정지-재시작 사이트의 위치는 빨간색 화살표로 표시됩니다. 2A 원소의 활성으로 인해 RNA의 번역은 두 가지 단백질을 생성합니다. NSP3 부분은 2A 요소의 잔재를 포함하고 UnaG 부분은 3x FLAG 태그에 융합됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 로타바이러스 역유전학 시스템. BHK-T7 단층은 각각 상이한 SA11(+)RNA를 발현하고, 아프리카 돼지 열바이러스(ASFV) NP868R 캡핑 효소(pCMV/NP868R)를 발현하는 pCMV 벡터를 발현하는 11 pT7 플라스미드로 형질감염된다. 3 일 후 감염 (d.p.i.에서, BHK-T7 세포는 MA104 세포로 감독됩니다. 감염 후 7일에서 BHK-T7/MA104 세포 용해물에서 재조합 로타바이러스는 MA104 세포의 통로에 의해 증폭되고 플라크 정제에 의해 분리됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
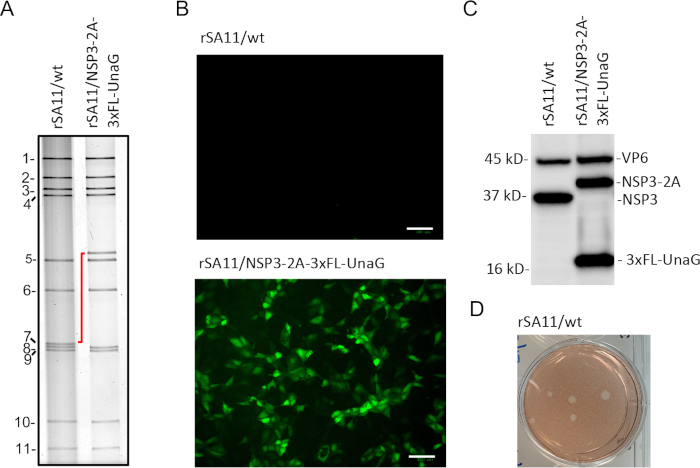
그림 3: 재조합 균주 rSA11/wt 및 rSA11/NSP3-2A-3xFL-UnaG의 특성. (a)플라크-단리 rSA11 균주의 dsRNA 게놈 세그먼트의 전기영동 프로파일. 11개의 게놈 세그먼트는 번호가 매겨지고 세그먼트 7(NSP3)의 위치의 변화는 빨간색 선으로 표시된다. (b)녹색 검출 채널상에 설정된 라이브 셀 이미저(20x 배율)를 이용하여 8시간 후 감염시 rSA11감염MA104 세포에서 형광검출. 스케일 바 = 100 μm.(C)기니피그 항VP6 및 항-NSP3 항-항-플래그 단클론 항체를 사용하여 rSA11 균주에 감염된 MA104 세포에서 8시간 후 감염에 존재하는 단백질의 면역블롯 분석. (D)MA104 세포에 rSA11/wt에 의해 생성된 플라크는 감염 후 3일 후 및 중성 적색 염색에 의해 검출된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
우리의 실험실에서, 우리는 재조합 SA11 로타바이러스를 생성하기 위하여 본원에 기술된 역유전학 프로토콜에 일상적으로 의존한다. 이 접근으로, 분자 생물학 기술에 있는 작은 경험이 있는 개별 또는 rotaviruses로 일하는 것은 그들의 첫번째 시도조차 재조합 바이러스를 복구합니다. 우리는 이 프로토콜에 따라 거의 100개의 재조합 바이러스를 생성했는데, 여기에는 외래 단백질(예를 들어, FPs)을 발현하기 위해 재설계되고 서열 추가, 삭제 및 점 돌연변이를 포함하는 게놈이 있는 바이러스가 있습니다.
이 프로토콜에 주어진 조건 및 배양 시간은 재조합 바이러스의 잘 성장하는 균주의 회복에 적용된다. 유전자 변형으로 인해 제대로 성장할 것으로 예상될 수 있는 SA11 바이러스를 복구하려고 시도하는 경우 조정을 고려해야 합니다. 특히, 형질감염된 BHK-T7/MA014 세포에서 이러한 바이러스의 역가가 낮을 수 있기 때문에, 우리는 전형적으로 후속 증폭 단계에서 접종으로 사용되는 용해물의 양을 두 배로 한다. 더욱이, 증폭 단계에서, 제대로 성장하는 바이러스는 세포 수확을 위한 충분한 CPE의 수준에 도달하기 전에 배양의 더 긴 시간을 요구할 수 있습니다. 실제로, 이러한 바이러스와 함께, 우리는 감염을 10-14 일 동안 진행 하도록 허용할 수 있습니다., 또는 더 이상, 세포를 수확 하기 전에. 마지막으로, 제대로 성장 하는 바이러스는 MA104 세포에 작은, 느린 성장 플 라크를 생성 가능성이. 따라서, 플라크는 이러한 바이러스를 분리하기 위해, 중성 적색으로 세포를 염색하고 플라크를 따기 전에 6-10 일 후 감염까지 플라크가 개발 할 수 있도록 할 필요가있을 수 있습니다.
우리의 경험에서, 재조합 로타 바이러스의 신뢰할 수있는 복구에 하나의 가장 중요한 요소는 건강의 사용이다, 잘 유지 BHK-T7 세포. 우리의 실험실에서, 우리는 정기적으로 10 % FBS뿐만 아니라 NEAA, TPB, 및 포도당 (GMEM 완전한 매체)의 높은 수준으로 보충 매체를 사용하여 동일한 희석에서 일주일에 2 x 를 통과합니다. 추가 보충 도움이 BHK-T7 세포 는 플라스미드 형질 감염 다음 확장 된 생존력을 유지, 제대로 성장 돌연변이 재조합 바이러스를 복구하기위한 가능성이 중요한 요인. 우리는 G418, T7 중합효소 발현 플라스미드의 유지보수를 위해 선택하는 항생제로 다른 모든 통로를 보충합니다. 통로 조건은 BHK-T7 세포가 급격하게 감소된 세포 생존으로 이끌어 내는 과거 confluency, 조건을 증가하는 것을 결코 허용되지 않을 것이라는 점을 그래야 합니다. 우리를 위해, 과성장을 허용된 BHK-T7 세포는 세포가 이후에 적당하게 여러 번 통과되더라도 역유전학 프로토콜에서 제대로 수행하지 못합니다. 자란 BHK-T7 세포를 재활시키는 대신, 우리는 이전에 액체 질소에 저장된 세포로 혈통을 다시 시작합니다.
BHK-T7 및 MA104 세포의 마이코플라즈마 오염은 재조합 바이러스를 생성하는 로타바이러스 역유전학 시스템의 실패의 주요 요인이 될 수 있다. 당사의 실험실에서는 PCR 기반 마이코플라즈마 검출키트(재료 표)를사용하여 세포주의 오염을 검사하고 검출시 BHK-T7 세포와 가장 자주 연관됩니다. 우리는 마이코 플라즈마를 오염시키는 세포주를 치료하는 것을 시도하지 않았고, 대신 액체 질소에 저장된 초기 마이코 플라즈마가없는 통로로 라인을 다시 확립했습니다. 새로운 세포주를 시작하기 전에 이전에 사용한 중간 크기의 보충제를 모두 폐기하고 인큐베이터, 생물학적 안전 캐비닛, 수조, 실험실 벤치 및 파이펫터를 철저히 오염 제거합니다. 또한 마이코플라즈마 검출 키트를 사용하여 재조합 바이러스의 오염 여부를 확인합니다. Vertrel VF32와같은 유기 용매에 의한 변성으로 인해 로타바이러스 입자의 저항성 으로 인해, 마이코플라즈마를 오염시키는 바이러스 스톡을 프리잉할 수 있어 역유전학에 의한 재조합 바이러스를 재생할 필요성이 부정된다. 실험실로 수신된 세포주 및 바이러스 제제는 일상적인 사용 전에 마이코플라즈마 오염을 검사해야 한다는 점을 강조하는 것이 중요합니다.
비록 매일 매일, 우리는 재조합 바이러스를 생성 하기 위해 동일한 프로토콜을 사용 하 여, 우리는 특정 수정 바이러스 복구를 배제 하지 않습니다 만들 수 있습니다 알고. 예를 들어, (i) SA11 pT7 벡터를 가진 pCMV/NSP868R 캡핑-효소 플라스미드의 공동 형질감염은 재조합 바이러스의 회수에 필요하지 않다. 캡핑 플라스미드를 첨가하면 형질감염된 BHK-T7/MA104 세포 에서 더 높은 바이러스 역가를 생성하지만, 우리는 FP를 발현하는 바이러스를 포함하여 수많은 바이러스를 복구할 수 있었습니다. 그러나, 우리는 pCMV/NP868R에 의한 캡핑 효소의 발현이 덜 맞는 바이러스의 회복에 크게 기여할 수 있다는 결론을 내렸다. (ii) 우리는 역유전학 프로토콜에 사용되는 형질전환 시약(표의 물질)의양이 반으로 감소하더라도 재조합 바이러스가 생성될 수 있다는 것을 발견하였을 것이며, 이는 비용을 현저히 감소시킬 수 있는 변형이다. (iii) 유사하게, 우리는 M199 완전한 배지가 DMEM 완전한 배지 대신에 사용될 수 있다고 결정했다. (iv) 마지막으로, SA11 T7 전사 벡터를 제조하는데 사용해야 하는 벡터 백본의 종류에 관한 정해진 요건은 없다. 플라스미드내의 바이러스 성 cDNA가 상류 T7 프로모터 및 다운스트림 HDV 리보자임 및 T7 터미네이터에 둘러싸여 있는 한, 플라스미드는 재조합 바이러스의 회복을 지원할 것으로 예상될 수 있다. 특히, pGEM-, pBluescript 및 pUC 기반 벡터는 역유전학 시스템에서 성공적으로 사용되어 왔다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 NIH 보조금 R03 AI131072 및 R21 AI144881, 인디애나 대학 창업 자금, 로렌스 M. 블랫 인다우먼트에 의해 지원되었다. 우리는 IU 로타후시에 실험실의 구성원, 울리히 Desselberger, 및 귀도 파파 역 유전학 프로토콜을 개발에 그들의 많은 기여와 제안에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Baby Hamster Kidney - T7 RdRP (BHK-T7) Cells | Contact: ubuchholz@niaid.nih.gov | ||
| Bio-Rad 8-16% Tris-Glycine Polyacrylamide Mini-Gel | Bio-Rad | 45608105 | |
| Cellometer AutoT4 viable cell counter | Nexcelom | ||
| ChemiDoc MP Gel Imaging System | Bio-Rad | ||
| Chloroform | MP | 194002 | |
| Clarity Western Enhanced Chemiluminescence (ECL) Substrate | Bio-Rad | 170-5060 | |
| Competent E.coli DH5alpha Bacteria | Lucigen | 60602-2 | |
| Complete Protease Inhibitor | Pierce | A32965 | |
| Disposable Transfer Pipettes, Ultrafine Extended Tips | MTC Bio | P4113-11 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Lonza | 12-604F | |
| Eagle's Minimal Essential Medium, 2x (2xEMEM) | Quality Biological | 115-073-101 | |
| Ethanol, Absolute (200 proof) | Fisher Bioreagents | BP2818-500 | |
| Ethidium Bromide Solution (10 mg/ml) | Invitrogen | 15585-011 | |
| Fetal Bovine Serum (FBS) | Corning | 35-010-CV | |
| Fetal Bovine Serum (FBS), Heat Inactivated | Corning | 35-011-CV | |
| Flag M2 Antibody, Mouse Monoclonal | Sigma-Aldrich | F1804 | |
| GenEluate HP Plasmid Midiprep Kit | Sigma | NA0200-1KT | |
| Geneticin (G-418) | Invitrogen | 10131-027 | |
| Gibco FluroBrite DMEM | ThermoFisher | A1896701 | DMEM with low background fluorescence |
| Glasgow Minimal Essential Medium (GMEM) | Gibco | 11710-035 | |
| Goat Anti-Rabbit IgG, Horseradish Peroxidase (HRP) Conjugated | Cell-Signaling Technology | 7074S | |
| Guinea Pig Anti-NSP3 Antiserum | Patton lab | lot 55068 | |
| Guinea Pig Anti-VP6 Antierum | Patton lab | lot 53963 | |
| Horse Anti-Guinea Pig IgG, Horseradish Peroxidase (HRP) Conjugated | KPL | 5220-0366 | |
| Horse Anti-Mouse IgG, Horseradish eroxidase (HRP) Conjugated | Cell-Signaling Technology | 7076S | |
| iNtRON Biotechnology e-Myco Mycoplasma PCR Detection Kit | JH Science | 25235 | |
| Isopropyl alcohol | Macron | 3032-02 | |
| L-glutamine Solution (100x) | Gibco | 25030-081 | |
| Luria Agar Powder (Miller's LB Agar) | RPI research products | L24020-2000.0 | |
| Medium 199 (M199) Culture Medium | Hyclone | Sh30253.01 | |
| Minimal Essential Medium -Eagle Joklik's Forumation (SMEM) | Lonza | 04-719Q | |
| Monkey Kidney (MA104) Cells | ATCC | ATCC CRL-2378.1 | |
| NanoDrop One Spectrophotometer | ThermoScientific | ||
| Neutral Red Solution (0.33%) | Sigma-Aldrich | N2889-100ml | |
| Non-Essential Amino Acid Solution (100x) | Gibco | 11140-050 | |
| Novex 10% Tris-Glycine Polyacrylamide Mini-Gel | Invitrogen | XP00102BOX | |
| Nuclease-Free Molecular Biology Grade Water | Invitrogen | 10977-015 | |
| NucleoSpin Gel and PCR Clean-Up Kit | Takara | 740609.25 | |
| Opti-MEM Reduced Serum Medium | Gibco | 31985-070 | |
| Pellet pestle (RNase-free, disposable) | Fisher | 12-141-368 | |
| Penicillin-Streptomycin Solution, (100x penn-strep) | Corning | 30-002-Cl | |
| Phosphate Buffered Saline (PBS), 10x | Fisher Bioreagents | BP399-20 | |
| Porcine Trypsin, Type IX-S | Sigma-Aldrich | T0303 | |
| PureYield Plasmid Miniprep System | Promega | A1223 | |
| Qiagen Plasmid Maxi Kit | Qiagen | 12162 | |
| Qiagen Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| SA11 pT7 Transcription Vectors | Addgene | 89162-89172 | |
| SA11 pT7/NSP3 Transcription Vectors Expressing Fluorescent Proteins | Contact: jtpatton@iu.edu | ||
| SeaKem LE Agarose | Lonza | 50000 | For gel electrophoresis |
| SeaPlaque agarose | Lonza | 50100 | For plaque assay |
| Superscript III One-Step RT-PCR kit | Invitrogen | 12574-035 | |
| Trans-Blot Turbo Nitrocellulose Transfer Kit | Bio-Rad | 170-4270 | |
| Trans-Llot Turbo Transfer System | Bio-Rad | ||
| TransIT-LTI Transfection Reagent | Mirus | MIR2306 | |
| Tris-Glycine-SDS Gel Running Buffer (10x) | Bio-Rad | 161-0772 | |
| Triton X 100 | Fisher Bioreagents | BP151-500 | |
| Trizol RNA Extraction Reagent | Ambion | 15596026 | |
| Trypan blue | Corning | 25-900-CI | |
| Trypsin (0.05%)-EDTA (0.1%) Cell Dissociation Solution | Quality Biological | 118-087-721 | |
| Tryptose Phosphate Broth | Gibco | 18050-039 | |
| Tween-20 | VWR | 0777-1L | |
| Vertrel VF solvent | Zoro | G0707178 | |
| Zoe Fluorescent Live Cell Imager | Bio-Rad |
참고문헌
- Crawford, S. E., et al. Rotavirus infection. Nature Reviews Disease Primers. 3 (17083), 1-16 (2017).
- Settembre, E. C., Chen, J. Z., Dormitzer, P. R., Grigorieff, N., Harrison, S. C. Atomic model of an infectious rotavirus particle. The EMBO Journal. 30 (2), 408-416 (2011).
- International Committee on Taxonomy of Viruses. Taxonomic information. Virus taxonomy: 2018b release. , Available from: https://talk.ictvonline.org/taxonomy (2019).
- Tate, J. E., Burton, A. H., Boschi-Pinto, C., Parashar, U. D. World Health Organization-Coordinated Global Rotavirus Surveillance Network. Global, regional, and national estimates of rotavirus mortality in children <5 years of age. Clinical Infectious Diseases. 62, Suppl 2 96-105 (2016).
- Troeger, C., et al. Rotavirus vaccination and the global burden of rotavirus diarrhea among children younger than 5 years. JAMA Pediatrics. 172 (10), 958-965 (2018).
- Matthijnssens, J., Van Ranst, M. Genotype constellation and evolution of group A rotaviruses infecting humans. Current Opinion in Virology. 2 (4), 426-433 (2012).
- McDonald, S. M., Nelson, M. I., Turner, P. E., Patton, J. T. Reassortment in segmented RNA viruses: mechanisms and outcomes. Nature Reviews Microbiology. 14 (7), 448-460 (2016).
- Patton, J. T. Rotavirus diversity and evolution in the post-vaccine world. Discovery Medicine. 13 (68), 85-97 (2012).
- Kanai, Y., et al. Entirely plasmid-based reverse genetics system for rotaviruses. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2349-2354 (2017).
- Trask, S. D., McDonald, S. M., Patton, J. T. Structural insights into the coupling of virion assembly and rotavirus replication. Nature Reviews Microbiology. 10 (3), 165-177 (2012).
- Guglielmi, K. M., McDonald, S. M., Patton, J. T. Mechanism of intraparticle synthesis of the rotavirus double-stranded RNA genome. Journal of Biological Chemistry. 285 (24), 18123-18128 (2010).
- Komoto, S., et al. Generation of recombinant rotaviruses expressing fluorescent proteins by using an optimized reverse genetics system. Journal of Virology. 92 (13), 00588-00618 (2018).
- Trask, S. D., Taraporewala, Z. F., Boehme, K. W., Dermody, T. S., Patton, J. T. Dual selection mechanisms drive efficient single-gene reverse genetics for rotavirus. Proceedings of the National Academy of Sciences of the United States of America. 107, 18652-18657 (2010).
- Fabbretti, E., Afrikanova, I., Vascotto, F., Burrone, O. R. Two non-structural rotavirus proteins, NSP2 and NSP5, form viroplasm-like structures in vivo. Journal of General Virology. 80, 333-339 (1999).
- Eichwald, C., Rodriguez, J. F., Burrone, O. R. Characterization of rotavirus NSP2/NSP5 interactions and the dynamics of viroplasm formation. Journal of General Virology. 85, 625-634 (2004).
- Kawagishi, T., et al. Reverse genetics system for a human group A rotavirus. Journal of Virology. , (2019).
- Komoto, S., et al. Generation of infectious recombinant human rotaviruses from just 11 cloned cDNAs encoding the rotavirus genome. Journal of Virology. 93 (8), 02207-02218 (2019).
- Mohanty, S. K., et al. A point mutation in the rhesus rotavirus VP4 protein generated through a rotavirus reverse genetics system attenuates biliary atresia in the murine model. Journal of Virology. 91 (15), 00510-00517 (2017).
- Navarro, A., Trask, S. D., Patton, J. T. Generation of genetically stable recombinant rotaviruses containing novel genome rearrangements and heterologous sequences by reverse genetics. Journal of Virology. 87, 6211-6220 (2013).
- Duarte, M., et al. Rotavirus infection alters splicing of the stress-related transcription factor XBP1. Journal of Virology. 93 (5), 01739-01818 (2019).
- Philip, A. A., et al. Generation of recombinant rotavirus expressing NSP3-UnaG fusion protein by a simplified reverse genetics system. Journal of Virology. , 1616-1619 (2019).
- Papa, G., et al. Recombinant rotaviruses rescued by reverse genetics reveal the role of NSP5 hyperphosphorylation in the assembly of viral factories. Journal of Virology. , (2019).
- Komoto, S., et al. Reverse genetics system demonstrates that rotavirus nonstructural protein NSP6 is not essential for viral replication in cell culture. Journal of Virology. 91 (21), 00695-00717 (2017).
- Philip, A. A., et al. Collection of recombinant rotaviruses expressing fluorescent reporter proteins. Microbiology Resource Announcements. 8 (27), 00523-00619 (2019).
- Kanai, Y., et al. Development of stable rotavirus reporter expression systems. Journal of Virology. , 01774-01818 (2019).
- Donnelly, M. L., et al. The 'cleavage' activities of foot-and-mouth disease virus 2A site-directed mutants and naturally occurring '2A-like' sequences. Journal of General Virology. 82, 1027-1041 (2001).
- Kumagai, A., et al. A bilirubin-inducible fluorescent protein from eel muscle. Cell. 153, 1602-1611 (2013).
- Rodriguez, E. A., et al. The growing and glowing toolbox of fluorescent and photoactive proteins. Trends in Biochemical Sciences. 42, 111-129 (2017).
- Buchholz, U. J., Finke, S., Conzelmann, K. K. Generation of bovine respiratory syncytial virus (BRSV) from cDNA: BRSV NS2 is not essential for virus replication in tissue culture, and the human RSV leader region acts as a functional BRSV genome promoter. Journal of Virology. 73, 251-259 (1999).
- Centers for Disease Control and Prevention (CDC). Biosafety in microbiological and biomedical laboratories (BMBL), 5th edition. , HHS publication no. CDC 21-1112 (2009).
- Arnold, M., Patton, J. T., McDonald, S. M. Culturing, storage, and quantification of rotaviruses. Current Protocols in Microbiology. 15 (1), (2009).
- Benureau, Y., Huet, J. C., Charpilienne, A., Poncet, D., Cohen, J. Trypsin is associated with the rotavirus capsid and is activated by solubilization of outer capsid proteins. Journal of General Virology. 86 (11), 3143-3151 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유