Method Article
简化反向遗传学方法,恢复重组性轮状病毒表达报告蛋白
摘要
从质粒DNA生成重组性轮状病毒为研究轮状病毒复制和发病机制以及发展轮状病毒表达载体和疫苗提供了重要工具。在这里,我们描述了一种简化的反向遗传学方法来产生重组性轮状病毒,包括表达荧光报告蛋白的菌株。
摘要
轮状病毒是一大批正在进化的分段双链RNA病毒,在许多哺乳动物和鸟类宿主物种(包括人类)幼年时引起严重的肠胃炎。随着轮状病毒反向遗传学系统的出现,利用定向诱变探索轮状病毒生物学,修改和优化现有的轮状病毒疫苗,开发轮状病毒多目标疫苗载体成为可能。在本报告中,我们描述了一个简化的反向遗传学系统,该系统允许有效和可靠地恢复重组性轮状病毒。该系统基于T7转录载体的共同转染,表达全长轮状病毒(+)RNA和CMV载体编码RNA封盖酶到BHK细胞中,产生T7RNA聚合酶(BHK-T7)。重组轮状病毒通过监督带有MA104细胞的转染BHK-T7细胞进行扩增,这是一种对病毒生长高度宽松的猴子肾细胞系。在本报告中,我们还描述了一种生成重组轮状病毒的方法,该方法通过在基因组段 7 (NSP3) 中引入 2A 转化停止重启元件来表达单独的荧光报告蛋白。这种方法避免删除或修改任何病毒开放阅读框架,从而允许产生重组轮状病毒,在表达荧光蛋白的同时保留功能齐全的病毒蛋白。
引言
轮状病毒是婴儿和幼儿以及许多其他哺乳动物和鸟类1幼虫严重肠胃炎的主要原因。作为Reoviridae家族的成员,轮状病毒具有分段的双链RNA(dsRNA)基因组。基因组部分包含在由三个同心蛋白质2层形成的非包络的二体体上。根据基因组片段的测序和植物遗传学分析,确定了9种轮状病毒(A+D、F+J)3个。3那些由轮状病毒A类组成的菌株是造成绝大多数人类疾病的罪魁祸首。从过去十年开始,将轮状病毒疫苗引入儿童免疫计划与轮状病毒死亡率和发病率的显著降低有关。最值得注意的是,与轮状病毒相关的儿童死亡人数从2000年的约528,000人下降到2016年的128,500人,,5。轮状病毒疫苗是从病毒的活衰减菌株中配制的,在6个月大时给儿童施用2至3剂。大量基因多样化的轮状病毒株在人类和其他哺乳动物物种中循环,加上它们通过诱变和重新分类迅速进化的能力,可能导致感染儿童66、7、87,8的轮状病毒类型的抗原变化。这种变化可能损害现有疫苗的功效,需要更换或修改。
完全基于质粒的反向遗传学系统的发展,使操纵11个轮状病毒基因组片段中的任何一个,直到最近才达到9个。随着这些系统的提供,有可能解开轮状病毒复制和发病机制的分子细节,开发改进的抗轮状病毒化合物的高通量筛选方法,并创造新的可能更有效的轮状病毒疫苗类别。在轮状病毒复制期间,封盖病毒(+)RNA不仅指导病毒蛋白的合成,而且还作为后代dsRNA基因组片段10,11,11的合成模板。迄今描述的所有轮状病毒反向遗传学系统都依赖于T7转录载体的转染到哺乳动物细胞系中,作为cDNA衍生(+)RNA的来源,用于恢复重组病毒9,9、12、13。,13在转录载体中,全长病毒cDNA位于上游T7促进剂和下游肝炎三角洲病毒(HDV)核糖核素之间,因此病毒(+)RNA由含有正宗5'和3'termini的T7RNA聚合酶合成(图1A)。在第一代反向遗传学系统中,重组病毒是通过用11 T7(pT7)转录婴儿仓鼠肾细胞,表达T7RNA聚合酶(BHK-T7)的重组病毒, 分别对西米亚SA11病毒株的一种独特的(+)RNA和三个CMV促进驱动表达质粒进行定向合成,一个编码禽流感病毒p10FAST融合蛋白和两个编码子单元的病毒D1R-D12L封盖酶复合物9。在转染的BHK-T7细胞中产生的重组SA11病毒通过用MA104细胞进行监督而放大,MA104细胞是一种细胞系,允许轮状病毒生长。第一代反向遗传学系统的一个修改版本被描述为不再使用支持质粒12。相反,经过修改的系统仅仅通过用11 SA11 T7转录载体转染BHK-T7细胞,就成功地生成重组轮状病毒,并警告病毒工厂(病毒质)构建基块(非结构蛋白NSP2和NSP5)的载体添加水平比其他载体14、15,15高3倍。反向遗传学系统的改性版本也已经开发,以支持恢复人类KU和Odelia的轮状病毒菌株16,17。16,轮状病毒基因组非常适应反向遗传学的操纵,重组病毒生成至今,突变引入VP418、NSP19、NSP219、NSP320、2120,21和NSP522、23。922,2319迄今产生的最有用的病毒包括那些被设计成表达荧光报告蛋白(FPs)的病毒9、12、21、24、25。,12,21,24,25
在本出版物中,我们为在实验室中用于生成SA11轮状病毒重组菌株的反向遗传学系统提供了协议。我们协议的主要特征是与11个pT7转录载体共同转染BHK-T7细胞(修改为包括pT7/NSP2SA11和pT7/NSP5SA11载体的3倍水平)和一个CMV表达载体编码非洲猪瘟病毒(ASFV)NP868R封盖酶21(图2)。在我们手中,NP868R质粒的存在导致通过转染BHK-T7细胞产生更高的重组病毒的结节。在本出版物中,我们还提供了修改 pT7/NSP3SA11 质粒的协议,以便生成重组病毒,不仅表达第 7 段蛋白产品 NSP3,还表示单独的 FP。这是通过重新设计pT7/NSP3SA11质粒中的NSP3开放读取帧(ORF)来包含下游的2A平移停止重启元件,然后是FP ORF(图1B)24,26。24,26通过这种方法,我们产生了反应重组轮状病毒,表达各种FP:UnaG(绿色)、mKate(远红色)、mRuby(红色)、TagBFP(蓝色)、CFP(青色)和YFP(黄色)24、27、28 。24,27,28这些FP表达轮状病毒是在不删除NSP3 ORF的情况下制造的,从而产生病毒,这些病毒有望编码全功能病毒蛋白。
研究方案
1. 介质制备和细胞培养维护
- 获取婴儿仓鼠肾细胞组成表达T7RNA聚合酶(BHK-T7)和非洲绿猴肾MA104细胞。
注:BHK-T7(或BSR-T7)细胞不是商业性的,而是利用反向遗传学研究RNA病毒生物学的实验室的一个常见细胞系。该协议中使用的BHK-T7细胞系来自Ursula J. Buchholz博士(美国马里兰州贝塞斯达国立卫生研究院),他是表达T7RNA聚合酶29的原BHK细胞系的共同开发者。MA104 单元格可从欧洲身份验证细胞培养集合 (ECACC) 和美国类型培养集合 (ATCC) 获得。 - 在无菌环境中制备以下培养介质,最好为 II 类生物安全柜。将介质储存在黑暗中 4 °C,并在使用前立即加热至 37 °C。
注:介质组件的来源在材料表中提供。- 要制备 DMEM 不完全介质,请将 500 mL 的 Dulbecco 改性鹰的最小必需介质 (MEM) 含有 4.5 g/L 葡萄糖和 1% 谷氨酰胺,以及 5 mL 的 100x 笔链。
- 为制备DMEM完整介质,将500 mL的DMEM不完全介质与25mL的胎儿牛血清(FBS)结合。
- 要制备 GMEM 不完全介质,请结合 500 mL 的格拉斯哥最小必需介质、5 mL 的 100x 谷氨酰胺、50 mL 的试乳磷汤 (TPB)、5 mL 的 100x 非必需氨基酸 (NEAA) 和 5 mL 的 100x 笔链。
- 为制备GMEM完整介质,将500 mL的GMEM不完全介质与25 mL的热灭性FBS相结合。
- 要制备 GMEM_G 完整介质,将 10 mL 的 50 mg/mL 基因素 (G418) 添加到 500 mL 的 GMEM 完整介质中。
- 要制备 SMEM 不完全介质,将 Joklik 改进的鹰 MEM 的 500 mL、5 mL 的 100x 谷氨酰胺、50 mL 的 TPB、5 mL 的 100x NEAA 和 5 mL 的 100x 笔链夹结合。
- 培养T75或T175烧瓶中的MA104细胞,分别含有12或25 mL的DMEM完整介质。要通过已经达到100%汇合的MA104细胞,用磷酸缓冲盐水(PBS)冲洗细胞单层2倍,用胰蛋白酶分离(0.05%)-EDTA(0.1%)溶液,重新悬浮在5 (T75 烧瓶)或 10 mL (T175 烧瓶) 的 DMEM 不完全介质.
- 将 0.5±1.0 mL 的重新悬浮细胞放入新鲜烧瓶中,通过添加 DMEM 完整介质将重新悬浮的电池带入适当的最终体积。将烧瓶放入 37 °C,5% CO2培养箱中。
- 在T75烧瓶中传播BHK-T7细胞,在使用GMEM和GMEM+G完整介质之间交替使用,每轮通过。要亚种BHK-T7细胞达到100%汇合,用PBS冲洗细胞单层2x,用胰蛋白酶-EDTA溶液分离,并在5 mL介质中重新悬浮。
- 将15 mL的创业板或GMEM+G完整介质放入新鲜的T75烧瓶中后,加入四滴重新悬浮的BHK-T7细胞。将烧瓶放入 37 °C,5% CO2培养箱中。
2. 质粒制备
- 从添加基因获取以下表示轮状病毒 SA11 (+) RNA 的质粒:pT7/VP1SA11,pT7/VP2SA11, pT7/VP3SA11、pT7/VP4SA11、pT7/VP6SA11、pT7/VP7SA11、pT7/NSP1SA11、pT7/NSP5SA11、pT7/NSP4SA11 和pT7/NSP5SA11。从作者21中获取表达ASFV封盖酶(pCMV/NP868R)的质粒。
注:经过修改的pT7/NSP3SA11质粒,通过2A转化元件(pT7/NSP3-2A-3xFL-FP)的活动来表达FP,也可以从作者24,26,26获得。pT7/NSP3-2A-3xFL-FP质粒表示以下FP可用:UnaG(绿色)、mKate(远红色)、mRuby(红色)、TagBFP(蓝色)、CFP(青色)和YFP(黄色)24。 - 将质粒转换为称职的E。大肠杆菌DH5+并将细菌传播到含有适当抗生素的Luria肉汤加盘上。根据制造商的说明,使用旋转迷你制备纯化试剂盒(材料表)培育从单个菌落中采摘的细菌培养物,并准备少量质粒(20μg)。使用中和maxi纯化试剂盒(材料表)从细菌培养物制备大量质粒。
注:适合在反向遗传学系统中使用的质粒也与其他质粒净化试剂盒一起制备。无需使用专门设计用于生成无内毒素材料的试剂盒制备质粒。 - 在无核酸分子生物学等级水中,将纯化质粒的浓度调整到1毫克/mL。使用分光光度计确认 260/280 吸收比为 ±1.8,从而检查质粒纯度。此外,在0.8%的琼脂凝胶上使用电泳,以验证质粒是否主要是超冲。
- 阿利quot纯化质粒成0.5 mL无菌微离心管,每个管含有10μL。 储存质粒在-80°C。
3. 重组病毒的生成
注:人类和动物轮状病毒研究,包括重组轮状病毒菌株的生成和表征,必须在生物安全等级 2 (BSL-2) 条件下处理,并且需要机构生物安全委员会 (IBC) 事先批准。适当的BSL-2实验室条件在由疾病控制和预防中心(CDC)30生产的微生物和生物医学实验室(BMBL)的生物安全中描述。
- 第1天:将BHK-T7细胞播种到12孔板中
- 用PBS冲洗T75烧瓶2x中所含的BHK-T7细胞中新结合的单层。使用胰蛋白酶-EDTA溶液破坏细胞单层,并在GMEM完整介质的5 mL中重新悬浮细胞。
- 使用自动细胞计数器和锥蓝色溶液来确定介质中可行的 BHK-T7 细胞的浓度。种子细胞进入12孔细胞培养板,每个孔包含2 x 105个细胞,总体积为1 mL的GMEM(G418无)完整介质。孵育在37°C,5%CO2培养箱。第 2 天,细胞应达到 80-90% 的汇合度。
- 第2天:用质粒混合物转染BHK-T7细胞
- 要制备质粒混合物,请使用调整为 1 mg/mL 的质粒库存将以下情况组合在 0.5 mL 微离心管中:SA11 pT7 质粒 VP1 各 0.8 μL, VP2、VP3、VP4、VP6、VP7、NSP1、NSP3 和 NSP4,SA11 pT7 质粒 NSP2 和 NSP5 各 2.4 μL,pCMV/NP868R 的 0.8 μL。通过敲击管,通过脉冲离心来收集内容物,轻轻混合质粒。要制备表示 FP 的重组病毒,请将 pT7/NSP3SA11 替换为适当的 pT7/NSP3-2A-3xFL-FP 质粒。
注:质粒混合物应储存在冰上,直到使用。应为每个转染准备单独的管。 - 准备质粒/减少血清介质/转染试剂混合物:将110μL的预热血清介质(37°C)减少的血清介质(材料表)添加到每个质粒混合物中,然后轻轻上下移液混合。之后,在每个质粒/减少血清介质混合物中加入32μL的转染试剂(材料表);这会产生混合物中质粒每微克转染试剂的浓度2.5μL。涡旋混合物轻轻孵育,在室温下孵育20分钟。
- 在20分钟的孵育期,用2 mL的GMEM不完全介质冲洗12孔板中的BHK-T7细胞(第1天制备)。之后,在每个井中加入1 mL的SMEM不完全介质,并将板返回培养箱。
- 在20分钟的孵育期后,使用200μL移液器将质粒/减少的血清介质/转染混合物逐滴添加到12孔板的每个孔中。轻轻摇动板,并返回到 37 °C,5% CO2培养箱。
- 要制备质粒混合物,请使用调整为 1 mg/mL 的质粒库存将以下情况组合在 0.5 mL 微离心管中:SA11 pT7 质粒 VP1 各 0.8 μL, VP2、VP3、VP4、VP6、VP7、NSP1、NSP3 和 NSP4,SA11 pT7 质粒 NSP2 和 NSP5 各 2.4 μL,pCMV/NP868R 的 0.8 μL。通过敲击管,通过脉冲离心来收集内容物,轻轻混合质粒。要制备表示 FP 的重组病毒,请将 pT7/NSP3SA11 替换为适当的 pT7/NSP3-2A-3xFL-FP 质粒。
- 第4天:用MA104细胞监督转染的BHK-T7细胞
- 用 PBS 冲洗 T75 烧瓶 2x 中所含的 MA104 细胞新结合的单层。使用胰蛋白酶-EDTA溶液破坏单层,并在5 mL的DMEM完整介质中重新悬浮细胞。
- 使用自动细胞计数器和锥蓝色溶液,确定介质中可行的MA104细胞的浓度。在DMEM不完全介质中,将浓度调整到8 x 105 MA104细胞/mL,并将悬浮细胞(2 x 105细胞)滴至含有转染BHK-T7细胞的井中加入0.25 mL。
- 通过将0.8 μL的1mg/mL胰蛋白素储存到每口井中,将介质中的胰蛋白酶(猪胰腺9型)的浓度调整到±0.5微克/米。
注:胰蛋白酶库存应准备在PBS中,以报价,并储存在-20°C。 - 使用剩余的MA104细胞制备第7天所需的6孔板来放大重组病毒。要播种6孔板,稀释重新悬浮的MA104细胞,在DMEM完整介质中浓度为1.5 x105细胞/mL,并在每口孔中放置2 mL。将板放入 37 °C,5% CO2培养箱中。
- 第7天:从转染细胞中恢复和扩增重组病毒
- 将12孔板中的BHK-T7/MA104细胞置于无菌条件下三个冷冻解冻周期,在-20°C冰柜和室温表面之间移动板。将水电解质转移到 1.5 mL 管后,在 500 x g (4 °C) 下将离心管 10 分钟,以颗粒大型细胞碎屑。收集超清液,储存在4°C(短期)或-20°C(长期)。
- 用 PBS 在 6 孔板中清洗 MA104 单层(第 4 天准备) 2 倍。将 2 mL 的 DMEM 不完全介质放置在每个含有 0.5 μg/mL 胰蛋白酶的井中。将从BHK-T7/MA104细胞液化液中回收的300μL超清液加入井中,并将板放入37°C,5%CO2培养箱中。
- 孵化板7天或直到观察到完整的细胞病效应(CPE)。在6孔板中,通过三个循环的冷冻解冻,将水肿转移到1.5mL微离心管中的酶MA104细胞。在 500 x g (4 °C) 下,通过离心 10 分钟,将大型细胞碎屑进行颗粒化。将澄清的细胞液化液转移到1.5mL微离心管中,储存在-20°C。
4. 重组病毒的斑块隔离
- 通过将胰蛋白酶加入到最终浓度为10μg/mL并在37°C孵育1小时,在100μL澄清细胞精化剂中激活病毒。-1 -7
- 用 2 mL PBS 冲洗 MA104 单层,在 6 孔板中 2 倍,使用 DMEM 不完全介质冲洗一次。在板材中加入400 mL的稀释液。在 37 °C、5% CO2培养箱中孵育板 1 小时,每 10-15 分钟摇动一次,以在单层上重新分配稀释液。
- 通过将2x Eagle最小基本介质(EMEM;预热至37°C)的同等体积与1.5%的琼脂糖(使用微波炉在水中熔化并预冷却至45°C)相结合,制备琼脂-MEM覆盖溶液。使用水浴将叠加溶液保持在 42°C,并在放置细胞之前立即调整至 0.5 μg/mL 胰蛋白酶的最终浓度。
- 从6孔板中抽取乳液稀释液,然后用2 mL的不完全DMEM冲洗细胞一次。将 3 mL 的琼脂-MEM 叠加溶液轻轻叠加到每个孔中包含的细胞单层上。让琼脂覆盖在室温下变硬,然后将板返回到培养箱。
- 三天后,准备一个琼脂-MEM覆盖溶液,如步骤4.3,并带来42°C。在使用前,立即将叠加溶液调整到最终浓度为 50 μg/mL 中性红色(材料表)。
- 在 6 孔板的现有琼脂层顶部添加 2 mL 的叠加溶液。允许新的琼脂层变硬后,将板返回到培养箱。保护含有中性红色的解决方案和板免受光线照射。
- 在接下来的6小时中,借助灯箱识别6孔板中的轮状病毒斑块。使用一次性转移移液器挑选明确定义的斑块,回收完全延伸到细胞层的琼脂塞。
- 将插头排出1.5 mL管中,含有0.5mL的DMEM不完全介质,并将样品旋涡30s。 将斑块分离的病毒通过在6孔板或含有DMEM不完全介质的T25瓶筒上传播,将斑块分离的病毒放大到介质中。
注:有关通过斑块检测分离和定位化轮状病毒的其他信息,请访问Arnold等人31。
5. 病毒dsRNA的凝胶电泳
- 将600μL的澄清性受感染细胞液酸盐和400μL的二氧化铝放在1.5mL微离心管中,旋涡30秒,在室温下孵育5分钟。加入200μL的氯仿,旋涡30s,孵育3分钟。在 13,000 x g (4 °C) 下离心 5 分钟后,将上水相的 ±550 μL 转移到新鲜管中。
- 通过添加2卷(+900 μL)的冷异丙醇和倒置管4×,从水相中恢复病毒dsRNA。在室温下孵育10分钟后,在13,000 x g (4 °C)下,离心管10分钟。丢弃超钠,并保留RNA颗粒。
- 通过在管子中加入 1 mL 的 75% 乙醇来清洗颗粒,反转一次,在 7,500 x g (4 °C) 下离心 5 分钟。用移液器小心去除乙醇清洗后,让RNA颗粒在实验室工作台上风干5~10分钟。 将RNA颗粒溶解在15μL的无核酸分子生物学等级水中,储存在-20°C。
- 将10 μL溶解RNA样品与2μL的6xDNA加载缓冲液相结合,加载到预铸的10%聚丙烯酰胺迷你凝胶(或手铸等价物),并通过电泳在三糖氨酸运行缓冲液中电泳在恒定电流(16 mA)下2小时解析RNA。将凝胶浸泡5~10分钟,水中含有±1 μg/mL溴化铀,用紫外线透射器检测轮状病毒基因组片段。
6. 病毒dsRNA的恢复和测序
- 最好使用低强度长波长紫外光在聚丙烯酰胺凝胶上定位病毒dsRNA波段,以避免产生核酸交界。使用新鲜的剃须刀刀片,切出含有dsRNA带的凝胶片段,并转移到1.5mL微离心管中。
- 加入 10±20 μL 的无 RNase 水后,用无 RNase 一次性颗粒害虫粉碎每个片段,该颗粒用于安装 1.5 mL 微离心管,或通过 18 G 针向上和向下绘制。在4°C下孵育碎碎碎片过夜。
- 从含有碎凝胶片段的管中回收3 μL液体。使用一步反向转录聚合酶链反应(RT-PCR)试剂盒(材料表)和适当的寡核苷酸底漆生成病毒dsRNA的cDNA。
注:PCR 产品通过 PCR 清洁试剂盒(材料表)进行凝胶纯化,并通过商业 DNA 序列服务发送用于隔夜测序以及底漆。
7. 病毒蛋白的免疫布洛分析
- 种子6孔板与3 x 105 MA104 细胞每孔在总体积2 mL的DMEM完整介质。将板放入 37 °C、5% CO2培养箱中,直到细胞达到汇合(3~5 天)。
注:具有汇合单层的孔将包含 ±1.2 x 106个单元格。 - 通过在37°C下孵育10微克/mL胰蛋白酶1小时,以激活其中所含的重组轮状病毒颗粒,治疗澄清的超子体。
- 用 2 mL PBS 在 6 孔板中冲洗 MA104 单体 2 倍。通过在DMEM不完全介质中每细胞添加含有3~5斑块成形单元(PFU)的200μL的鼻孔,感染细胞。将盘子返回培养箱。
- 每隔 10 分钟,取出板并轻轻摇动,在细胞单层上重新分布。1 小时后,用 2 mL 的 DMEM 不完全介质替换接种。
- 感染后8小时,用PBS冲洗6孔板中的细胞2倍。将细胞刮入 750 μL 的 PBS,并将体积转移到 1.5 mL 微离心管中。用另外 750 μL 的 PBS 冲洗板,并与之前收集的 750 μL 样品结合使用。
- 样品中的颗粒细胞,在5,000 x g的离心下,在4°C下10分钟。丢弃上清液后,将细胞颗粒储存在-80°C,直到进一步加工。
- 制备含有300 mM NaCl、100 mM Tris-HCl、pH 7.4、2% Triton X-100和1x EDTA全蛋白酶抑制剂的细胞集解液缓冲液。在冷冻细胞颗粒中加入300μL的滑丝缓冲液后,短暂涡旋样品,并在冰上孵育10分钟。
- 重复在冰上3倍涡旋和孵化样品的过程。之后,在4°C下以15,000 x g的离心机样品10分钟,然后收集超钠剂,储存在-80°C。
- 通过在预制线性 8-16% 聚丙烯酰胺迷你凝胶上电泳解决 20 μL 超成清样品量中所含的蛋白质,并转移到硝基纤维素膜。与 PBS-Tween 20 孵育来阻块膜 20 (0.02%)溶液含有5%无脂干牛奶。
- 通过孵化一种或多种原抗体(例如,豚鼠抗NSP3或抗VP6抗血清、小鼠单克隆抗Flag M2抗体或兔子单克隆抗PCNA抗体)来探测膜。通过用马抗鼠IgG、抗豚鼠IgG或山羊抗兔IgG马萝卜过氧化物酶结合的二次抗体孵育膜检测原抗体,然后通过增强的化学发光(ECL)马萝卜化学发光基质检测。使用凝胶成像系统(材料表)或X射线膜可视化发光信号。
8. 感染FP表达病毒的细胞的活细胞成像
- 种子6孔板与3 x 105 MA104 细胞每孔在共2 mL DMEM完整介质。将板放入 37 °C、5% CO2培养箱中,直到细胞达到汇合(3~5 天)。
注:具有汇合单层的孔将包含 ±1.2 x 106个单元格。 - 激活已知风化的轮状病毒样本,在37°C下孵育10微克/mL胰蛋白酶1小时。
- 用 MA104 单体 2x 用 2 mL PBS 冲洗 6 孔板。通过在DMEM不完全介质中每细胞加入含有3~5 PFU的鼻孔,感染细胞。将板返回到培养箱,轻轻摇动板,每 10 分钟在细胞单层上重新分配一次。
注:模拟感染无病毒 DMEM 的井应作为对照。 - 1h病毒吸附后,用PBS冲洗单层2倍,用DMEM不完全介质每口0.5mL更换介质。感染后7.5小时,用低背景荧光代替培养基(材料表)。感染后8小时,使用活细胞成像仪以20倍放大倍率检查细胞,以获得绿色、红色或蓝色荧光信号。
结果
本文中描述的反向遗传学协议通过多个不同的步骤进行:(1) BHK-T7细胞与轮状病毒pT7转录载体和pCMV/NP868R表达质粒,共转导, (2) 监督具有MA104细胞的转染BHK-T7细胞;(3)使用MA104细胞对BHK-T7/MA104细胞中的重组病毒进行扩增;(4)使用MA104细胞分离重组病毒(图2)。在我们手中,该协议是有效的,在BHK-T7/MA104细胞赖酸(104 PFU/mL)和放大MA104细胞赖酸(1 0 x 107 PFU/mL)中产生重组野生型SA11病毒(rSA11/wt)的结位剂。使用改性pT7/NSP3SA11表示FPs的质粒(例如,rSA11/NSP3-2A-3xFL-UnaG)的反向遗传学产生的SA11重组病毒长成比rSA11/wt少4倍的0分体。
按照反向遗传学协议,我们生成了重组SA11病毒,这些病毒在MA104细胞上很容易被斑块测定识别,从而允许斑块分离(图3D)。斑块中的病毒是用长尖一次性转移移液器挑选的,并在MA104细胞上放大。斑块纯化rSA11/wt和rSA11/NSP3-2A-3xFL-UnaG病毒的dsRNA基因组用二聚氰酸酯提取,在10%聚丙烯酰胺凝胶上通过电泳解决,并通过用溴化二苯染色检测(图3A)。正如预期的那样,由于存在2A-3xFL-UnaG序列,rSA11/NSP3-2A-3xFL-UnaG的段7(NSP3)dsRNA迁移速度比rSA11/wt(图3A)慢得多。rSA11/NSP3-2A-3xFL-UnaG 的段 7 (NSP3) dsRNA 经过凝胶纯化,通过 RT-PCR 转换为 cDNA 形式,并排序以确认准确性。
为了检查UnaG荧光蛋白的表达,6孔板中的MA104细胞每细胞感染了3个PFU,每细胞为rSA11/wt和rSA11/NSP3-2A-3xFL-UnaG。在感染后8小时,板中的培养介质被0.5mL的DMEM所取代,每口井的背景荧光较低,在CO2培养箱37°C下,板在37°C下孵育了30分钟。之后,使用活细胞成像器检查板的 UnaG 表达。分析表明,rSA11/NSP3-2A-3xFL-UnaG产生绿色荧光,验证了重组病毒中UnaG基因的功能(图3B)。相反,在感染rSA11/wt的细胞中未检测到绿色荧光。为了解决rSA11/NSP3-2AxFL-UnaG修正后的第7段中的2A元素是否促进两种独立蛋白质(NSP3-2A和3xFL-UnaG)的表达,MA104细胞感染了rSA11/NSP3-2A-3xFL-UnaG和rSA11/wt。 细胞赖解物是从感染后8小时收获的细胞制备的,通过凝胶电泳解决,并被斑点到硝基纤维素过滤器上。印迹被探测与抗体特定的轮状病毒VP6和NSP3,和FLAG标签。分析表明,NSP3-2A和3xFL-UnaG在感染rSA11/NSP3-2A-3AFL-UnaG的细胞中作为单独的蛋白质表示,表明2A元素是功能性的(图3C)。感染rSA11/wt的细胞没有表达抗FLAG抗体识别的蛋白质。由于NSP3的C型细胞存在残留2A残留物,抗NSP3抗体存在于rSA11/NSP3-2A-3xFL-UnaG感染细胞中的NSP3蛋白迁移速度略低于nSP3。

图1:轮状病毒逆转遗传学质粒。(A) 11 SA11轮状病毒基因组片段的全长cDNA位于pT7质粒内,与T7RNA聚合酶的启动子连接上游,下游与HDV核糖核糖体连接。在T7RNA聚合酶的存在下,轮状病毒pT7质粒产生全长SA11(+)RNA与正宗5'和3'终点。(B) pT7/NSP3-2A-3xFL-UnaG 质粒制成的 (+) RNA 和蛋白质产品的原理图。原理图包括NSP3 cDNA序列,以及猪底病毒2A型(2A)元素、3倍FLAG(FL)标签和绿色荧光蛋白UnaG的序列。2A 平移停止重启站点的位置用红色箭头表示。由于2A元素的活性,RNA的转换产生两种蛋白质。NSP3 部分包含 2A 元素的残余,UnaG 部分熔融到 3x FLAG 标记。请点击此处查看此图形的较大版本。

图2:轮状病毒反向遗传学系统。BHK-T7单层用11个pT7质粒进行转染,每个质粒均表示不同的SA11(+)RNA,以及一个pCMV载体,用于表达非洲猪瘟病毒(ASFV)NP868R封盖酶(pCMV/NP868R)。在感染后3天(d.p.i.),BHK-T7细胞被MA104细胞超籽。在感染后7天,BHK-T7/MA104细胞赖化剂中的重组轮状病毒通过MA104细胞的通道被扩增,然后通过斑块纯化进行分离。请点击此处查看此图形的较大版本。
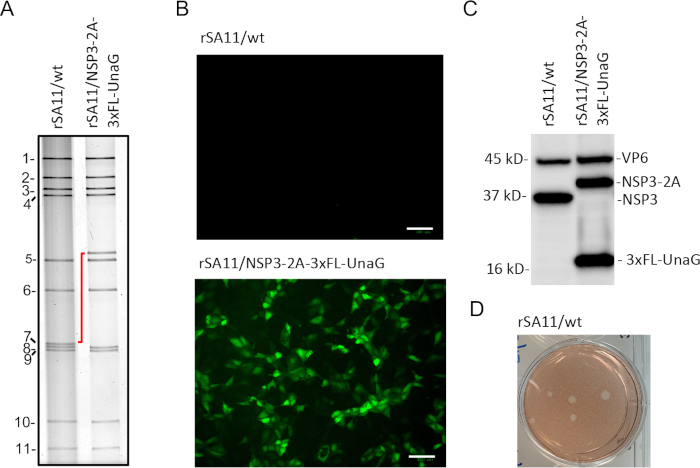
图3:重组菌株 rSA11/wt 和 rSA1/NSP3-2A-3xFL-UnaG 的特性。(A) 斑块分离的rSA11菌株的dsRNA基因组片段的电泳图谱。11个基因组段被编号,第7段(NSP3)位置的变化用红线表示。(B) 使用绿色检测通道上设置的活细胞成像仪 (20 倍放大倍率) 在感染后 8 小时在 rSA11 感染的 MA104 细胞中检测到荧光。比例杆 = 100 μm. (C) 免疫布洛分析在8h感染后在MA104细胞感染rSA11菌株使用豚鼠抗VP6和抗NSP3抗丁核和小鼠抗FLAG单克隆抗体。(D) rSA11/wt 在感染后 3 天内在 MA104 细胞上产生的斑块,并通过中性红色染色检测。请点击此处查看此图形的较大版本。
讨论
在我们的实验室中,我们通常依靠本文描述的反向遗传学协议来产生重组SA11轮状病毒。使用这种方法,在分子生物学技术或使用轮状病毒方面经验不足的个人,即使在第一次尝试时,也能恢复重组病毒。我们按照此协议生成了近 100 种重组病毒,包括那些经过重新设计以表达外来蛋白质(例如 FPs)且包含序列添加、删除和点突变的基因组病毒。
该协议给出的条件和潜伏时间适用于重组病毒菌株的恢复。如果试图恢复SA11病毒,由于基因改造,可能生长不良,应考虑调整。特别是,由于转染BHK-T7/MA014细胞液化液中的此类病毒的定位可能很低,因此,在后续扩增步骤中,我们通常将用作水肿的落液量增加一倍。此外,在扩增步骤中,生长不良的病毒可能需要更长的孵育时间,才能达到足以用于细胞采集的CPE水平。事实上,对于这种病毒,我们可能允许感染在收获细胞之前持续10~14天,甚至更长时间。最后,生长不良的病毒可能在MA104细胞上产生小而缓慢生长的斑块。因此,要斑块分离这些病毒,可能有必要允许斑块在感染后6-10天之前发育,然后用中性红色染色细胞并采摘斑块。
根据我们的经验,重组轮状病毒可靠恢复的最重要因素是使用健康、维护良好的BHK-T7细胞。在我们的实验室中,我们每周2次使用中度补充的BHK-T7细胞,不仅补充10%的FBS,而且还与NEAA、TPB和高血糖(GMEM全中)一样稀释。额外的补充剂帮助BHK-T7细胞在质粒转染后保持扩展的生存能力,这可能是恢复生长不良的突变重组病毒的关键。我们补充其他通道的介质与G418,一种抗生素,选择维持T7聚合酶表达质粒。通过条件应该如此,BHK-T7细胞永远不会被允许生长通过汇合,条件迅速导致细胞生存能力下降。对我们来说,BHK-T7细胞已经被允许过度生长在反向遗传协议中表现不佳,即使细胞随后适当地多次通过。我们不是试图恢复过度生长的BHK-T7细胞,而是用以前储存在液氮中的细胞来重启系系。
BHK-T7和MA104细胞的支原体污染可能是轮状病毒反向遗传学系统未能产生重组病毒的主要因素。在我们的实验室中,我们使用基于PCR的支原体检测试剂盒(材料表)来检查细胞系是否受到污染,当检测到细胞系时,它通常与我们的BHK-T7细胞有关。我们没有试图治愈污染支原体的细胞系,而是用储存在液氮的早期无支原体的通道来重建这些行。在开始新的细胞系之前,我们丢弃了所有以前使用过的中度补充剂和彻底除污培养箱、生物安全柜、水浴、实验室工作台和移液器。我们还使用支原体检测试剂盒来检查重组病毒的库存有无污染。由于轮状病毒颗粒对有机溶剂(如Vertrel VF32)变性的抗药性,因此有可能使病毒储存免受支原体的污染,从而无需通过反向遗传学再生重组病毒。必须强调,在常规使用之前,应检查进入实验室的细胞系和病毒制剂是否受到支原体污染。
虽然日复一日,我们使用相同的协议来生成重组病毒,我们知道可以进行某些修改,这不排除病毒恢复。例如,(i) 与 SA11 pT7 载体共同转染 pCMV/NSP868R 封盖酶质粒是恢复重组病毒所必需的。虽然添加封盖质粒在转染的BHK-T7/MA104细胞裂变剂中产生更高的病毒定分剂,但我们已经能够恢复许多病毒,包括那些表达FPs的病毒,没有它。然而,我们得出的结论是,通过pCMV/NP868R表达封盖酶可能大大有助于恢复不太合适的病毒。(ii) 我们发现,即使反向遗传学协议中使用的转染试剂(材料表)数量减少了一半,也可以产生重组病毒,这种改变可以大大减少开支。(三) 同样,我们确定M199全介质可用于DMEM完整介质。(四) 最后,对于生产SA11 T7转录向量必须使用的矢量骨干网类型,没有设定要求。只要质粒中的病毒cDNA被上游T7启动子和下游HDV核糖体和T7终结器包围,质粒就可以支持重组病毒的恢复。值得注意的是,pGEM、pBluescript和基于pUC的载体已经成功地应用于反向遗传学系统。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了NIH赠款R03 AI131072和R21 AI144881、印第安纳大学启动基金和劳伦斯·布拉特捐赠基金的支持。我们感谢IU罗塔霍西尔实验室、乌尔里希·德塞尔贝格尔和吉多·帕帕的成员在制定反向遗传学方案方面所作的许多贡献和建议。
材料
| Name | Company | Catalog Number | Comments |
| Baby Hamster Kidney - T7 RdRP (BHK-T7) Cells | Contact: ubuchholz@niaid.nih.gov | ||
| Bio-Rad 8-16% Tris-Glycine Polyacrylamide Mini-Gel | Bio-Rad | 45608105 | |
| Cellometer AutoT4 viable cell counter | Nexcelom | ||
| ChemiDoc MP Gel Imaging System | Bio-Rad | ||
| Chloroform | MP | 194002 | |
| Clarity Western Enhanced Chemiluminescence (ECL) Substrate | Bio-Rad | 170-5060 | |
| Competent E.coli DH5alpha Bacteria | Lucigen | 60602-2 | |
| Complete Protease Inhibitor | Pierce | A32965 | |
| Disposable Transfer Pipettes, Ultrafine Extended Tips | MTC Bio | P4113-11 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Lonza | 12-604F | |
| Eagle's Minimal Essential Medium, 2x (2xEMEM) | Quality Biological | 115-073-101 | |
| Ethanol, Absolute (200 proof) | Fisher Bioreagents | BP2818-500 | |
| Ethidium Bromide Solution (10 mg/ml) | Invitrogen | 15585-011 | |
| Fetal Bovine Serum (FBS) | Corning | 35-010-CV | |
| Fetal Bovine Serum (FBS), Heat Inactivated | Corning | 35-011-CV | |
| Flag M2 Antibody, Mouse Monoclonal | Sigma-Aldrich | F1804 | |
| GenEluate HP Plasmid Midiprep Kit | Sigma | NA0200-1KT | |
| Geneticin (G-418) | Invitrogen | 10131-027 | |
| Gibco FluroBrite DMEM | ThermoFisher | A1896701 | DMEM with low background fluorescence |
| Glasgow Minimal Essential Medium (GMEM) | Gibco | 11710-035 | |
| Goat Anti-Rabbit IgG, Horseradish Peroxidase (HRP) Conjugated | Cell-Signaling Technology | 7074S | |
| Guinea Pig Anti-NSP3 Antiserum | Patton lab | lot 55068 | |
| Guinea Pig Anti-VP6 Antierum | Patton lab | lot 53963 | |
| Horse Anti-Guinea Pig IgG, Horseradish Peroxidase (HRP) Conjugated | KPL | 5220-0366 | |
| Horse Anti-Mouse IgG, Horseradish eroxidase (HRP) Conjugated | Cell-Signaling Technology | 7076S | |
| iNtRON Biotechnology e-Myco Mycoplasma PCR Detection Kit | JH Science | 25235 | |
| Isopropyl alcohol | Macron | 3032-02 | |
| L-glutamine Solution (100x) | Gibco | 25030-081 | |
| Luria Agar Powder (Miller's LB Agar) | RPI research products | L24020-2000.0 | |
| Medium 199 (M199) Culture Medium | Hyclone | Sh30253.01 | |
| Minimal Essential Medium -Eagle Joklik's Forumation (SMEM) | Lonza | 04-719Q | |
| Monkey Kidney (MA104) Cells | ATCC | ATCC CRL-2378.1 | |
| NanoDrop One Spectrophotometer | ThermoScientific | ||
| Neutral Red Solution (0.33%) | Sigma-Aldrich | N2889-100ml | |
| Non-Essential Amino Acid Solution (100x) | Gibco | 11140-050 | |
| Novex 10% Tris-Glycine Polyacrylamide Mini-Gel | Invitrogen | XP00102BOX | |
| Nuclease-Free Molecular Biology Grade Water | Invitrogen | 10977-015 | |
| NucleoSpin Gel and PCR Clean-Up Kit | Takara | 740609.25 | |
| Opti-MEM Reduced Serum Medium | Gibco | 31985-070 | |
| Pellet pestle (RNase-free, disposable) | Fisher | 12-141-368 | |
| Penicillin-Streptomycin Solution, (100x penn-strep) | Corning | 30-002-Cl | |
| Phosphate Buffered Saline (PBS), 10x | Fisher Bioreagents | BP399-20 | |
| Porcine Trypsin, Type IX-S | Sigma-Aldrich | T0303 | |
| PureYield Plasmid Miniprep System | Promega | A1223 | |
| Qiagen Plasmid Maxi Kit | Qiagen | 12162 | |
| Qiagen Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| SA11 pT7 Transcription Vectors | Addgene | 89162-89172 | |
| SA11 pT7/NSP3 Transcription Vectors Expressing Fluorescent Proteins | Contact: jtpatton@iu.edu | ||
| SeaKem LE Agarose | Lonza | 50000 | For gel electrophoresis |
| SeaPlaque agarose | Lonza | 50100 | For plaque assay |
| Superscript III One-Step RT-PCR kit | Invitrogen | 12574-035 | |
| Trans-Blot Turbo Nitrocellulose Transfer Kit | Bio-Rad | 170-4270 | |
| Trans-Llot Turbo Transfer System | Bio-Rad | ||
| TransIT-LTI Transfection Reagent | Mirus | MIR2306 | |
| Tris-Glycine-SDS Gel Running Buffer (10x) | Bio-Rad | 161-0772 | |
| Triton X 100 | Fisher Bioreagents | BP151-500 | |
| Trizol RNA Extraction Reagent | Ambion | 15596026 | |
| Trypan blue | Corning | 25-900-CI | |
| Trypsin (0.05%)-EDTA (0.1%) Cell Dissociation Solution | Quality Biological | 118-087-721 | |
| Tryptose Phosphate Broth | Gibco | 18050-039 | |
| Tween-20 | VWR | 0777-1L | |
| Vertrel VF solvent | Zoro | G0707178 | |
| Zoe Fluorescent Live Cell Imager | Bio-Rad |
参考文献
- Crawford, S. E., et al. Rotavirus infection. Nature Reviews Disease Primers. 3 (17083), 1-16 (2017).
- Settembre, E. C., Chen, J. Z., Dormitzer, P. R., Grigorieff, N., Harrison, S. C. Atomic model of an infectious rotavirus particle. The EMBO Journal. 30 (2), 408-416 (2011).
- International Committee on Taxonomy of Viruses. Taxonomic information. Virus taxonomy: 2018b release. , Available from: https://talk.ictvonline.org/taxonomy (2019).
- Tate, J. E., Burton, A. H., Boschi-Pinto, C., Parashar, U. D. World Health Organization-Coordinated Global Rotavirus Surveillance Network. Global, regional, and national estimates of rotavirus mortality in children <5 years of age. Clinical Infectious Diseases. 62, Suppl 2 96-105 (2016).
- Troeger, C., et al. Rotavirus vaccination and the global burden of rotavirus diarrhea among children younger than 5 years. JAMA Pediatrics. 172 (10), 958-965 (2018).
- Matthijnssens, J., Van Ranst, M. Genotype constellation and evolution of group A rotaviruses infecting humans. Current Opinion in Virology. 2 (4), 426-433 (2012).
- McDonald, S. M., Nelson, M. I., Turner, P. E., Patton, J. T. Reassortment in segmented RNA viruses: mechanisms and outcomes. Nature Reviews Microbiology. 14 (7), 448-460 (2016).
- Patton, J. T. Rotavirus diversity and evolution in the post-vaccine world. Discovery Medicine. 13 (68), 85-97 (2012).
- Kanai, Y., et al. Entirely plasmid-based reverse genetics system for rotaviruses. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2349-2354 (2017).
- Trask, S. D., McDonald, S. M., Patton, J. T. Structural insights into the coupling of virion assembly and rotavirus replication. Nature Reviews Microbiology. 10 (3), 165-177 (2012).
- Guglielmi, K. M., McDonald, S. M., Patton, J. T. Mechanism of intraparticle synthesis of the rotavirus double-stranded RNA genome. Journal of Biological Chemistry. 285 (24), 18123-18128 (2010).
- Komoto, S., et al. Generation of recombinant rotaviruses expressing fluorescent proteins by using an optimized reverse genetics system. Journal of Virology. 92 (13), 00588-00618 (2018).
- Trask, S. D., Taraporewala, Z. F., Boehme, K. W., Dermody, T. S., Patton, J. T. Dual selection mechanisms drive efficient single-gene reverse genetics for rotavirus. Proceedings of the National Academy of Sciences of the United States of America. 107, 18652-18657 (2010).
- Fabbretti, E., Afrikanova, I., Vascotto, F., Burrone, O. R. Two non-structural rotavirus proteins, NSP2 and NSP5, form viroplasm-like structures in vivo. Journal of General Virology. 80, 333-339 (1999).
- Eichwald, C., Rodriguez, J. F., Burrone, O. R. Characterization of rotavirus NSP2/NSP5 interactions and the dynamics of viroplasm formation. Journal of General Virology. 85, 625-634 (2004).
- Kawagishi, T., et al. Reverse genetics system for a human group A rotavirus. Journal of Virology. , (2019).
- Komoto, S., et al. Generation of infectious recombinant human rotaviruses from just 11 cloned cDNAs encoding the rotavirus genome. Journal of Virology. 93 (8), 02207-02218 (2019).
- Mohanty, S. K., et al. A point mutation in the rhesus rotavirus VP4 protein generated through a rotavirus reverse genetics system attenuates biliary atresia in the murine model. Journal of Virology. 91 (15), 00510-00517 (2017).
- Navarro, A., Trask, S. D., Patton, J. T. Generation of genetically stable recombinant rotaviruses containing novel genome rearrangements and heterologous sequences by reverse genetics. Journal of Virology. 87, 6211-6220 (2013).
- Duarte, M., et al. Rotavirus infection alters splicing of the stress-related transcription factor XBP1. Journal of Virology. 93 (5), 01739-01818 (2019).
- Philip, A. A., et al. Generation of recombinant rotavirus expressing NSP3-UnaG fusion protein by a simplified reverse genetics system. Journal of Virology. , 1616-1619 (2019).
- Papa, G., et al. Recombinant rotaviruses rescued by reverse genetics reveal the role of NSP5 hyperphosphorylation in the assembly of viral factories. Journal of Virology. , (2019).
- Komoto, S., et al. Reverse genetics system demonstrates that rotavirus nonstructural protein NSP6 is not essential for viral replication in cell culture. Journal of Virology. 91 (21), 00695-00717 (2017).
- Philip, A. A., et al. Collection of recombinant rotaviruses expressing fluorescent reporter proteins. Microbiology Resource Announcements. 8 (27), 00523-00619 (2019).
- Kanai, Y., et al. Development of stable rotavirus reporter expression systems. Journal of Virology. , 01774-01818 (2019).
- Donnelly, M. L., et al. The 'cleavage' activities of foot-and-mouth disease virus 2A site-directed mutants and naturally occurring '2A-like' sequences. Journal of General Virology. 82, 1027-1041 (2001).
- Kumagai, A., et al. A bilirubin-inducible fluorescent protein from eel muscle. Cell. 153, 1602-1611 (2013).
- Rodriguez, E. A., et al. The growing and glowing toolbox of fluorescent and photoactive proteins. Trends in Biochemical Sciences. 42, 111-129 (2017).
- Buchholz, U. J., Finke, S., Conzelmann, K. K. Generation of bovine respiratory syncytial virus (BRSV) from cDNA: BRSV NS2 is not essential for virus replication in tissue culture, and the human RSV leader region acts as a functional BRSV genome promoter. Journal of Virology. 73, 251-259 (1999).
- Centers for Disease Control and Prevention (CDC). Biosafety in microbiological and biomedical laboratories (BMBL), 5th edition. , HHS publication no. CDC 21-1112 (2009).
- Arnold, M., Patton, J. T., McDonald, S. M. Culturing, storage, and quantification of rotaviruses. Current Protocols in Microbiology. 15 (1), (2009).
- Benureau, Y., Huet, J. C., Charpilienne, A., Poncet, D., Cohen, J. Trypsin is associated with the rotavirus capsid and is activated by solubilization of outer capsid proteins. Journal of General Virology. 86 (11), 3143-3151 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。