Method Article
طريقة مبسطة علم الوراثة العكسي لاسترداد الفيروسات الروتا المؤتلفة التعبير عن البروتينات مراسل
In This Article
Summary
يوفر توليد فيروسات الروتا المؤتلفة من الحمض النووي البلازمي أداة أساسية لدراسة تكرار فيروس الروتا ومسببات الأمراض ، وتطوير ناقلات التعبير عن فيروس الروتا واللقاحات. هنا، نحن نصف نهج علم الوراثة العكسي المبسط لتوليد فيروسات الروتا المؤتلفة، بما في ذلك سلالات تعبر عن بروتينات مراسل الفلورسنت.
Abstract
فيروسات الروتا هي مجموعة كبيرة ومتطورة من فيروسات الحمض النووي الريبي المجزأة المزدوجة التي تسبب التهاب المعدة والأمعاء الحاد في صغار العديد من الأنواع المضيفة للثدييات والطيور، بما في ذلك البشر. ومع ظهور أنظمة الوراثة العكسية لفيروس الروتا مؤخراً، أصبح من الممكن استخدام الطفرات الموجهة لاستكشاف بيولوجيا فيروس الروتا، وتعديل لقاحات فيروس الروتا الموجودة وتحسينها، وتطوير ناقلات اللقاحات متعددة الأهداف لفيروس الروتا. في هذا التقرير، نحن نصف نظام علم الوراثة العكسي المبسط الذي يسمح بالتعافي الفعال والموثوق به من فيروسات الروتا المؤتلفة. ويستند النظام على التطفل المشترك من ناقلات النسخ T7 التعبير عن كامل طول rotavirus (+) RNAs وناقل CMV ترميز إنزيم غطاء الحمض النووي الريبي في خلايا BHK إنتاج اسيشن ايمرياز T7 الحمض النووي الريبي (BHK-T7). يتم تضخيم فيروسات الروتا المؤتلفة من خلال الإشراف على خلايا BHK-T7 المصابة عبرها مع خلايا MA104 ، وهو خط خلية الكلى القرد الذي هو متساهل للغاية لنمو الفيروس. في هذا التقرير، نحن أيضا ً نصف نهج لتوليد فيروسات الروتا المؤتلفة التي تعبر عن بروتين مراسل فلوري منفصل من خلال إدخال عنصر إيقاف إعادة التشغيل الترجمي 2A في الجزء 7 من الجينوم (NSP3). هذا النهج يتجنب حذف أو تعديل أي من إطارات القراءة المفتوحة الفيروسية، مما يسمح لإنتاج فيروسات الروتا المؤتلفة التي تحتفظ بالبروتينات الفيروسية تعمل بكامل طاقتها مع التعبير عن بروتين الفلورسنت.
Introduction
فيروسات الروتا هي الأسباب الرئيسية لالتهاب المعدة والأمعاء الحاد في الرضع والأطفال الصغار ، وكذلك الشباب من العديد من الثدييات الأخرى والطيورالأنواع 1. كأعضاء في عائلة Reoviridae، الفيروسات الدوارة لديها تجزئة الحمض النووي الريبي المزدوج تقطعت بهم السبل (dsRNA) الجينوم. وترد شرائح الجينوم داخل فيرجيون icosahedral غير مغلفة تشكلت من ثلاث طبقات متحدة المركز من البروتين2. واستناداً إلى التسلسل والتحليل الجيني لأجزاء الجينوم، تم تحديد تسعة أنواع من فيروس الروتا (A-D, F−J)3. تلك السلالات التي تتألف من أنواع فيروس الروتا A هي المسؤولة عن الغالبية العظمى من الأمراض البشرية4. ويرتبط إدخال لقاحات فيروس الروتا في برامج تحصين الأطفال ابتداء من العقد الماضي بتخفيضات كبيرة في وفيات واعتلال فيروس الروتا. وعلى وجه الخصوص، انخفض عدد وفيات الأطفال المرتبطة بفيروس الروتا من حوالي 528,000 في عام 2000 إلى 128,500 في عام 20164,5. يتم صياغة لقاحات فيروس الروتا من سلالات حية مخففة من الفيروس، مع إعطاء 2 إلى 3 جرعات للأطفال بحلول 6 أشهر من العمر. قد يؤدي العدد الكبير من سلالات فيروس الروتا المتنوعة وراثيًا المتداولة في البشر وأنواع الثدييات الأخرى ، إلى جانب قدرتها على التطور السريع من خلال الطفرات وإعادة الفرز ، إلى تغييرات مضادة للجينات في أنواع فيروسات الروتا التي تصيب الأطفال6و7و8. وقد تقوض هذه التغييرات فعالية اللقاحات الموجودة، مما يتطلب استبدالها أو تعديلها.
ولم يتحقق سوى مؤخرا ً 9 تطوير نظم علم الوراثة العكسية القائمة على البلازميد9بالكامل التي تمكن من التلاعب بأي من شرائح جينوم فيروس الروتا 11. ومع توافر هذه النظم، أصبح من الممكن كشف التفاصيل الجزيئية لتكرار فيروس الروتا ومسبباته، وتطوير أساليب فحص عالية الإنتاجية محسنة لمركبات مكافحة فيروس الروتا، وإنشاء فئات جديدة يمكن أن تكون أكثر فعالية من لقاحات فيروس الروتا. أثناء تكرار فيروس الروتا، توج الفيروسية (+) RNAs ليس فقط دليل توليف البروتينات الفيروسية، ولكن أيضا بمثابة قوالب لتركيب شرائح الجينوم dsRNA ذرية10،11. تعتمد جميع أنظمة الوراثة العكسية للفيروس الروتا الموصوفة حتى الآن على نقل ناقلات النسخ T7 إلى خطوط خلايا الثدييات كمصدر لـ cDNA المشتقة (+) RNAs المستخدمة في استعادة الفيروسات المؤتلفة9،12،13. داخل ناقلات النسخ ، يتم وضع الأقراص الفيروسية الكاملة الطول بين مروج T7 المنبع وفيروس دلتا التهاب الكبد المصب (HDV) ribozyme بحيث يتم تصنيعها من قبل البوليميراز T7 RNA التي تحتوي على أصلية 5 ' و 3'-termini(الشكل 1A). في الجيل الأول من نظام علم الوراثة العكسي ، تم إجراء الفيروسات المؤتلفة عن طريق نقل خلايا الكلى الطفل الهامستر التعبير عن T7 RNA polymerase (BHK-T7) مع 11 T7 (pT7) ناقلات النسخ ، كل توليف توجيه فريدة من نوعها (+) الجيش الملكي النيبالي من سلالة الفيروس SA11 simian، وثلاثة CMV المروج محرك التعبير plasmids، واحد ترميز بروتين انصهار reovirus الطيور p10FAST ووحدتين فرعيتين ترميز من فيروس vaccinia D1R-D12L توج إنزيم معقدة9. تم تضخيم الفيروسات SA11 المؤتلفة المتولدة في خلايا BHK-T7 المصابة المنقولة من خلال الإشراف على خلايا MA104 ، وهو خط خلية متساهل لنمو فيروس الروتا. وقد وصفت نسخة معدلة من الجيل الأول من نظام علم الوراثة العكسية التي لم تعد تستخدم دعم plasmids12. بدلا من ذلك، يولد النظام المعدل بنجاح فيروسات روتا المؤتلفة ببساطة عن طريق نقل خلايا BHK-T7 مع ناقلات النسخ SA11 T7 11، مع التحذير من أن ناقلات للمصنع الفيروسي (viroplasm) كتل البناء (البروتينات غير الهيكلية NSP2 و NSP5) تضاف عند مستويات 3 أضعاف أعلى من ناقلات أخرى14،15. كما تم تطوير نسخ معدلة من نظام علم الوراثة العكسي التي تدعم الانتعاش من سلالات KU وOdelia البشرية من فيروس الروتا16,17. الجينوم الفيروس الروتا قابلة بشكل ملحوظ للتلاعب عن طريق علم الوراثة العكسي، مع الفيروسات المؤتلفة ولدت حتى الآن مع الطفرات التي أدخلت في VP418،NSP19،NSP219،NSP320،,21،وNSP522،,23. من بين الفيروسات الأكثر فائدة التي تم إنشاؤها حتى الآن هي تلك التي تم هندستها للتعبير عن البروتينات مراسل الفلورسنت (FPs)9،12،21،24،25.
في هذا المنشور، ونحن نقدم بروتوكول لنظام علم الوراثة العكسي التي نستخدمها في مختبرنا لتوليد سلالات المؤتلفة من فيروس الروتا SA11. السمة الرئيسية لبروتوكولنا هي التطفل المشترك لخلايا BHK-T7 مع ناقلات النسخ pT7 11 (المعدلة لتشمل مستويات 3x من pT7/NSP2SA11 و pT7/NSP5SA11 vectors) وناقل تعبير CMV ترميز فيروس حمى الخنازير الأفريقية (ASFV) NP868R توج الإنزيم21 (الشكل 2). في أيدينا، وجود البلازميد NP868R يؤدي إلى إنتاج أعلى titers من الفيروسات المؤتلفة من قبل خلايا BHK-T7 المصابة. في هذا المنشور، ونحن نقدم أيضا بروتوكول لتعديل pT7/NSP3SA11 plasmid بحيث يمكن إنشاء الفيروسات المؤتلفة التي تعبر ليس فقط عن الجزء 7 البروتين المنتج NSP3 ولكن أيضا FP منفصلة. ويتم تحقيق ذلك عن طريق إعادة هندسة إطار القراءة المفتوحة NSP3 (ORF) في pT7/NSP3SA11 plasmid لاحتواء عنصر إيقاف إعادة التشغيل التحويلي 2A المصب متبوعاً بـ FP ORF(الشكل 1B)24،26. من خلال هذا النهج، قمنا بتوليد فيروسات روتا المؤتلفة التي تعبر عن مختلف FPs: UnaG (الأخضر)، mKate (أحمر بعيد)، mRuby (الأحمر)، TagBFP (الأزرق)، CFP (سماوي)، وYFP (أصفر)24،27،28. يتم إجراء هذه الفيروسات الروتا التعبير ية FP دون حذف ORF NSP3 ، وبالتالي تسفر عن الفيروسات التي من المتوقع أن ترميز مجموعة كاملة من البروتينات الفيروسية العاملة.
Protocol
1. إعداد وسائل الإعلام وصيانة ثقافة الخلايا
- الحصول على خلايا الكلى الهامستر الطفل التي تعبر بشكل تأسيسي T7 الحمض النووي الريبي بوليميراز (BHK-T7) والأفريقية الخضراء القرد الكلى MA104 الخلايا.
ملاحظة: خلايا BHK-T7 (أو BSR-T7) ليست متوفرة تجاريًا، ولكنها خط خلية مشترك للمختبرات باستخدام علم الوراثة العكسي لدراسة بيولوجيا فيروس RNA. تم الحصول على خط الخلية BHK-T7 المستخدمة في هذا البروتوكول من الدكتور ة أورسولا ج. بوشهولز (المعاهد الوطنية للصحة، Bethesda، MD، الولايات المتحدة الأمريكية)، وهو مطور مشارك لخط الخلية BHK الأصلي الذي يعبر عن T7 RNA polymerase29. تتوفر خلايا MA104 من المجموعة الأوروبية لثقافات الخلايا الموثقة (ECACC) ومن مجموعة ثقافة النوع الأمريكي (ATCC). - إعداد وسائل الإعلام الثقافية التالية في بيئة معقمة، ويفضل أن يكون مجلس الوزراء السلامة البيولوجية من الفئة الثانية. تخزين وسائل الإعلام في الظلام في 4 درجة مئوية ودافئة إلى 37 درجة مئوية مباشرة قبل الاستخدام.
ملاحظة: يتم توفير مصادر مكونات الوسائط في جدول المواد.- لإعداد متوسط DMEM غير مكتمل، اجمع بين 500 مل من الحد الأدنى المتوسط الأساسي لـ Dulbecco في جلّر أساسي (MEM) الذي يحتوي على 4.5 جرام/لتر من الجلوكوز و1% غلوتامين مع 5 مل من 100 x القلم العقدية.
- لإعداد متوسط كامل DMEM، اجمع بين 500 مل من متوسط DMEM غير مكتمل مع 25 مل من مصل الأبقار الجنيني (FBS).
- لإعداد GMEM المتوسطة غير مكتملة، والجمع بين 500 مل من غلاسكو الحد الأدنى المتوسطة الأساسية، 5 مل من الجلوتامين 100x، 50 مل من مرق التربتوز الفوسفات (TPB)، 5 مل من الأحماض الأمينية غير الضرورية 100x (NEAA)، و 5 مل من 100x القلم العقدية.
- لإعداد GMEM المتوسطة كاملة، والجمع بين 500 مل من GMEM المتوسط غير مكتملة مع 25 مل من FBS تنشيط الحرارة.
- لإعداد GMEM + G المتوسطة كاملة، إضافة 10 مل من 50 ملغ/ مل جينجين (G418) إلى 500 مل من GMEM المتوسط الكامل.
- لإعداد المتوسطة غير مكتملة SMEM، والجمع بين 500 مل من MEM النسر Joklik المعدلة، 5 مل من الجلوتامين 100x، 50 مل من TPB، 5 مل من 100x NEAA، و 5 مل من 100x القلم العقدية.
- الخلايا MA104 الثقافة في T75 أو T175 القوارير التي تحتوي على 12 أو 25 مل من DMEM المتوسط الكامل، على التوالي. لمرور خلايا MA104 التي وصلت إلى التقاء 100٪، شطف الخلية أحادية الطبقة 2x مع المالحة المخزنة مؤقتا الفوسفات (PBS)، والانفصال مع التربسين (0.05٪- EDTA (0.1٪) الحل، وإعادة تعليق في 5 (T75 قارورة) أو 10 مل من (T175 قارورة) من المتوسط غير مكتملة DMEM.
- ضع 0.5−1.0 مل من الخلايا التي أعيد تعليقها في قوارير طازجة وأحضر إلى الحجم النهائي المناسب عن طريق إضافة متوسط كامل DMEM. ضع القوارير في حاضنة 37 درجة مئوية و5% CO2.
- نشر خلايا BHK-T7 في قوارير T75، بالتناوب بين استخدام GMEM وGMEM + G متوسطة كاملة مع كل جولة من المرور. للاستزراع الفرعي BHK-T7 الخلايا التي وصلت إلى التقاء 100٪، شطف الخلية أحادية الطبقة 2x مع PBS، والانفصال مع حل التربسين-EDTA، وإعادة تعليق في 5 مل من المتوسط.
- بعد وضع 15 مل من GEM أو GMEM + G متوسطة كاملة في قارورة T75 جديدة، أضف أربع قطرات من خلايا BHK-T7 المعمرة. ضع قارورة في حاضنة 37 درجة مئوية و5% CO2.
2- إعداد بلازميد
- الحصول على البلازميدات التالية التي تعبر عن فيروس الروتا SA11 (+) RNAs من Addgene: pT7/VP1SA11, pT7/VP2SA11, pT7/VP3SA11, pT7/VP4SA11, pT7/VP6SA11, pT7/NSP1SA1, pT7/NSP2SA11, pT7/NSP3SA11, pT7/NSP4SA11, و pT7/NSP5SA11. الحصول على plasmid التعبير عن إنزيم توج ASFV (pCMV/NP868R) من المؤلفين21.
ملاحظة: يمكن أيضا الحصول على pT7/NSP3SA11plasmids المعدلة للتعبير عن FP من خلال نشاط عنصر 2A الترجمة (pT7/NSP3-2A-3xFL-FP) من المؤلفين24,26. pT7/NSP3-2A-3xFL-FP plasmids التعبير عن FPs التالية متوفرة: UnaG (الأخضر)، mKate (الأحمر البعيد)، mRuby (الأحمر)، TagBFP (الأزرق)، CFP (سماوي)، وYFP (أصفر)24. - تحويل البلازميدات إلى Eالمختصة . القولونية DH5α وانتشار البكتيريا على لوحات لوريا مرق أغار التي تحتوي على المضادات الحيوية المناسبة. زراعة الثقافات البكتيرية التي تم انتقاؤها من المستعمرات الفردية وإعداد كميات أصغر من البلازميد (20 ميكروغرام) باستخدام مجموعة تنقية الميني prep تدور(جدول المواد)،وفقا لتعليمات الشركة المصنعة. إعداد كميات أكبر من البلازميد من الثقافات البكتيرية باستخدام مجموعات تنقية ميدي وماكسي(جدول المواد).
ملاحظة: تم أيضا إعداد البلازميدات مناسبة للاستخدام في نظام علم الوراثة العكسي مع غيرها من مجموعات تنقية البلازميد. ليس من الضروري إعداد البلازميدات باستخدام مجموعات مصممة خصيصًا لتوليد مواد خالية من السموم الإندوتوكسين. - ضبط تركيزات البلازميدات النقية إلى 1 ملغ / مل في المياه البيولوجيا الجزيئية خالية من nuclease الصف. تحقق من نقاء البلازميد عن طريق تأكيد نسبة امتصاص 260/280 ~ 1.8 باستخدام مطياف. أيضا، استخدم electrophoresis على 0.8٪ المواد الهلامية agarose للتحقق من أن البلازميدات هي في الغالب supercoiled.
- Aliquoted البلازميدات في 0.5 مل أنابيب الطرد المركزي المجهري المعقم، كل منها يحتوي على 10 ميكرولتر. تخزين البلازميدات في -80 درجة مئوية.
3- توليد فيروس مؤتلف
ملاحظة: يجب التعامل مع أبحاث فيروس الروتا البشري والحيواني، بما في ذلك توليد وتوصيف سلالات فيروس الروتا المؤتلف، في ظل ظروف المستوى 2 للسلامة البيولوجية (BSL-2) وستتطلب موافقة مسبقة من اللجنة المؤسسية للسلامة البيولوجية (IBC). يتم وصف الظروف المختبرية المناسبة BSL-2 في السلامة البيولوجية في المختبرات الميكروبيولوجية والطبية الحيوية (BMBL) التي تنتجها مراكز مكافحة الأمراض والوقاية منها (CDC)30.
- اليوم الأول: بذر خلايا BHK-T7 إلى لوحات 12 بئر
- شطف طبقة أحادية ملتوية حديثا من خلايا BHK-T7 الواردة في قارورة T75 2x مع برنامج تلفزيوني. تعطيل أحادي الخلية مع حل التربسين-EDTA وإعادة تعليق الخلايا في 5 مل من GMEM المتوسط الكامل.
- استخدام عداد الخلية الآلي وحل trypan-blue لتحديد تركيز خلايا BHK-T7 قابلة للحياة في الوسط. خلايا البذور في 12 بئر لوحات الخلايا الثقافة، مع كل بئر تحتوي على 2 × 105 خلايا في حجم إجمالي من 1 مل من GMEM (G418 خالية) المتوسطة كاملة. احتضان في حاضنة 37 درجة مئوية، 5٪ CO2. يجب أن تصل الخلايا إلى التقاء 80-90٪ بحلول اليوم الثاني.
- اليوم الثاني: التَجُرمن من الخلايا BHK-T7 مع الخلائط البلازميدة
- لإعداد خليط البلازميد، اجمع ما يلي في أنبوب الطرد المركزي الدقيق 0.5 مل باستخدام مخزونات البلازميد المعدلة إلى 1 ملغم/مل: 0.8 ميكرولتر لكل من SA11 pT7 plasmids VP1، VP2، VP3، VP4، VP6، VP7، NSP1، NSP3 و NSP4، 2.4 ميكرولتر لكل من SA11 pT7 plasmids NSP2 و NSP5، و 0.8 ميكرولتر من pCMV/NP868R. مزيج بلطف البلازميدات عن طريق النقر على أنبوب وجمع المحتويات عن طريق مركز ة النبض. لإعداد الفيروسات المؤتلفة التي تعبر عن FPs، استبدل pT7/NSP3SA11 بـ pT7/NSP3-2A-3xFL-FP plasmid.
ملاحظة: يجب تخزين مخاليط البلازميد على الثلج حتى استخدامها. يجب إعداد أنبوب منفصل لكل الحلويات. - لإعداد خليط الكاشف المتوسط/المختزل في المصل: أضف 110 ميكرولتر من المخوار (37 درجة مئوية) انخفاض متوسط المصل(جدول المواد)إلى كل خليط بلازميد وخلطه عن طريق الأنابيب بلطف لأعلى ولأسفل. بعد ذلك ، أضف 32 ميكرولتر من كاشف الحلويات(جدول المواد)إلى كل خليط متوسط من المصل البلازميد / مخفض ؛ وهذا ينتج تركيز 2.5 ميكرولتر من كاشف التطفل لكل ميكروغرام من البلازميد في الخلائط. خليط الدوامة بلطف واحتضان في درجة حرارة الغرفة لمدة 20 دقيقة.
- خلال فترة الحضانة 20 دقيقة، شطف BHK-T7 الخلايا في لوحات 12 بئر (أعدت في اليوم 1) مرة واحدة مع 2 مل من وسائل الإعلام GMEM غير مكتملة. بعد ذلك، إضافة 1 مل من المتوسطة غير مكتملة SMEM إلى كل بئر والعودة لوحات إلى الحاضنة.
- بعد فترة الحضانة 20 دقيقة، إضافة البلازميد / انخفاض المصل المتوسطة / خليط الترانزستور قطرة قطرة إلى كل بئر من لوحات 12 بئر باستخدام البيبتور 200 ميكرولتر. لوحات الصخور بلطف والعودة إلى حاضنة 37 درجة مئوية، 5٪ CO2.
- لإعداد خليط البلازميد، اجمع ما يلي في أنبوب الطرد المركزي الدقيق 0.5 مل باستخدام مخزونات البلازميد المعدلة إلى 1 ملغم/مل: 0.8 ميكرولتر لكل من SA11 pT7 plasmids VP1، VP2، VP3، VP4، VP6، VP7، NSP1، NSP3 و NSP4، 2.4 ميكرولتر لكل من SA11 pT7 plasmids NSP2 و NSP5، و 0.8 ميكرولتر من pCMV/NP868R. مزيج بلطف البلازميدات عن طريق النقر على أنبوب وجمع المحتويات عن طريق مركز ة النبض. لإعداد الفيروسات المؤتلفة التي تعبر عن FPs، استبدل pT7/NSP3SA11 بـ pT7/NSP3-2A-3xFL-FP plasmid.
- اليوم الرابع: الإشراف على الخلايا BHK-T7 المصابة المنقولة بخلايا MA104
- شطف طبقة أحادية ملتوية حديثا من خلايا MA104 الواردة في قارورة T75 2x مع برنامج تلفزيوني. تعطيل أحادية باستخدام حل التربسين-EDTA وإعادة تعليق الخلايا في 5 مل من المتوسط الكامل DMEM.
- باستخدام عداد الخلية الآلي والحل trypan-blue، حدد تركيز خلايا MA104 القابلة للحياة في الوسط. ضبط التركيز إلى 8 × 105 MA104 خلايا / مل في DMEM غير مكتملة المتوسطة وإضافة 0.25 مل من الخلايا المعلقة (2 × 105 خلايا) dropwise إلى الآبار التي تحتوي على خلايا BHK-T7 المصابة المنقولة.
- ضبط تركيز التربسين (بورسين البنكرياس النوع التاسع) في المتوسط إلى ~ 0.5 ميكروغرام / مل عن طريق إضافة 0.8 ميكرولتر من 1 ملغ / مل التربسين المخزون إلى كل بئر.
ملاحظة: يجب إعداد مخزون التربسين في PBS، وألييقتبس، وتخزينها في -20 درجة مئوية. - استخدام خلايا MA104 المتبقية لإعداد لوحات 6 بئر التي ستكون هناك حاجة في اليوم 7 لتضخيم الفيروسات المؤتلفة. لالبذور 6-جيدا لوحات, تمييع خلايا MA104 إعادة تعليق إلى تركيز 1.5 × 105 خلايا / مل في DMEM المتوسطة كاملة ووضع 2 مل في كل بئر. ضع لوحات في حاضنة 37 درجة مئوية، 5٪ CO2.
- اليوم السابع: استعادة وتضخيم الفيروس المؤتلف من الخلايا المتحولة
- الموضوع BHK-T7/MA104 الخلايا في لوحات 12 بئر إلى ثلاث دورات من تجميد ذوبان في ظل ظروف معقمة، لوحات تتحرك بين -20 درجة مئوية الفريزر وسطح درجة حرارة الغرفة. بعد نقل الليسات إلى أنابيب 1.5 مل، أنابيب الطرد المركزي لمدة 10 دقيقة في 500 × ز (4 درجات مئوية) لبيليه الحطام الخلوي الكبير. جمع supernatant وتخزينها في 4 درجة مئوية (على المدى القصير) أو -20 درجة مئوية (على المدى الطويل).
- غسل الطبقات أحادية MA104 في لوحات 6 بئر (أعدت في اليوم 4) 2x مع برنامج تلفزيوني. ضع 2 مل من DMEM متوسطة غير مكتملة لكل بئر يحتوي على 0.5 ميكروغرام /مل التربسين. أضف 300 ميكرولتر من الفوقناتانتمتما من BHK-T7/MA104 خلية الليسات في الآبار ولوحات مكان في حاضنة 37 درجة مئوية، 5٪ CO2.
- ويلاحظ لوحات الحضن لمدة 7 أيام أو حتى الآثار الخلايا كاملة (CPE). خلايا ليس MA104 في لوحات 6 آبار من قبل ثلاث دورات من تجميد ذوبان، ثم نقل الخلايا إلى 1.5 مل أنابيب الطرد المركزي الدقيقة. بيليه الحطام الخلوي الكبير عن طريق الطرد المركزي لمدة 10 دقيقة في 500 × ز (4 درجات مئوية). نقل الخلايا الموضحة إلى 1.5 مل أنابيب الطرد المركزي الدقيقة وتخزينها في -20 درجة مئوية.
4. عزل البلاك من الفيروسات المؤتلفة
- تنشيط الفيروسات في 100 ميكرولتر من حلرات الخلايا توضيح بإضافة التربسين إلى تركيز نهائي من 10 ميكروغرام / مل واحتضان في 37 درجة مئوية لمدة 1 ساعة. إعداد سلسلة تخفيف المسلسل 10 أضعاف تتراوح بين10-1 إلى10-7 (1 مل لكل منهما) في المتوسط غير مكتملة DMEM.
- شطف MA104 monolayers في لوحات 6 بئر 2x مع 2 مل من برنامج تلفزيوني ومرة واحدة مع متوسط DMEM غير مكتملة. إضافة 400 مل من التخفيفات في مكررة إلى لوحات. احضن اللوحات لمدة ساعة واحدة في حاضنة 37 درجة مئوية، و5% من ثاني أكسيد الكربون2، وتهتز كل 10-15 دقيقة لإعادة توزيع التخفيفات عبر الطبقة الأحادية.
- قم بإعداد محلول تراكب agarose-MEM من خلال الجمع بين وحدات تخزين متساوية لمتوسط الحد الأدنى الأساسي من 2x Eagle (EMEM؛ الدافئ مسبقًا إلى 37 درجة مئوية) مع 1.5٪ agarose التي تم إذابتها في الماء باستخدام فرن الميكروويف وتبريدها مسبقًا إلى 45 درجة مئوية. الحفاظ على محلول تراكب في 42 درجة مئوية باستخدام حمام مائي وضبط لتركيز النهائي من 0.5 ميكروغرام / مل التربسين مباشرة قبل وضع على الخلايا.
- اسحب تخفيفات المحلول من 6 أطباق جيدة ، ثم شطف الخلايا مرة واحدة بـ 2 مل من DMEM غير مكتملة. تراكب بلطف 3 مل من حل تراكب agarose-MEM على أحادية الخلية الواردة في كل بئر. السماح لتراكب agarose لتصلب في درجة حرارة الغرفة، ثم العودة لوحات إلى الحاضنة.
- بعد ثلاثة أيام، قم بإعداد حل تراكب agarose-MEM كما هو الحال في الخطوة 4.3 وأحضر إلى 42 درجة مئوية. مباشرة قبل الاستخدام، وضبط محلول تراكب إلى تركيز نهائي من 50 ميكروغرام / مل أحمر محايد(جدول المواد).
- أضف 2 مل من محلول التراكب أعلى طبقة agarose الموجودة في لوحات 6-well. بعد السماح لطبقة agarose الجديدة بالتصلب ، تعود اللوحات إلى الحاضنة. حماية المحاليل والصحون التي تحتوي على أحمر محايد من التعرض للضوء.
- على مدى 6 ساعة القادمة، وتحديد لويحات فيروس الروتا في لوحات 6 بئر مع المعونة من مربع ضوء. اختيار لوحات محددة بوضوح باستخدام الأنابيب نقل المتاح، واستعادة المقابس agarose التي تمتد تماما إلى طبقة الخلية.
- طرد المكونات في أنبوب 1.5 مل يحتوي على 0.5 مل من DMEM غير مكتملة المتوسطة والدوامة العينة لمدة 30 ق. تضخيم الفيروس المعزولة البلاك eluted في المتوسط عن طريق الانتشار على monolayers MA104 في لوحات 6 بئر أو T25 القوارير التي تحتوي على DMEM المتوسط غير مكتملة و0.5 ميكروغرام / مل التربسين.
ملاحظة: تتوفر معلومات إضافية بشأن عزل وtitering فيروس الروتا عن طريق الكياسة في أرنولد وآخرون31.
5. جل electrophoresis من dsRNA الفيروسية
- ضع 600 ميكرولتر من الخلايا المصابة الموضحة و400 ميكرولتر من الثيوسيات guanidinium في أنابيب الطرد المركزي الدقيقة 1.5 مل، والدوامة لمدة 30 ق، واحتضان في درجة حرارة الغرفة لمدة 5 دقائق. إضافة 200 ميكرولتر من الكلوروفورم، دوامة لمدة 30 سنة، واحتضان لمدة 3 دقائق. بعد الطرد المركزي لمدة 5 دقيقة عند 13000 × ز (4 درجات مئوية) ، نقل ~ 550 ميكرولتر من المرحلة المائية العليا إلى أنابيب جديدة.
- استرداد dsRNA الفيروسية من المرحلة المائية بإضافة 2 مجلدات (~ 900 ميكرولتر) من الكحول ايزوبروبيل الباردة والأنابيب المقلوبة 4-6x. بعد احتضان هاوية الغرفة لمدة 10 دقيقة، أنابيب الطرد المركزي لمدة 10 دقيقة عند 13000 × غرام (4 درجات مئوية). تجاهل supernatants والاحتفاظ الكريات الجيش الملكي النيبالي.
- اغسل الكريات بإضافة 1 مل من الإيثانول بنسبة 75٪ إلى الأنبوب ، وعكس مرة واحدة ، والطرد المركزي لمدة 5 دقيقة عند 7500 × ز (4 درجة مئوية). بعد إزالة بعناية غسل الإيثانول مع البيكتور، والسماح الكريات الحمض النووي الريبي لتجف الهواء على مقاعد البدلاء مختبر لمدة 5-10 دقيقة. حل الكريات الحمض النووي الريبي في 15 ميكرولتر من المياه البيولوجيا الجزيئية خالية من nuclease وتخزين في -20 درجة مئوية.
- الجمع بين 10 μL من عينات الحمض النووي الريبي الذائبة مع 2 μL من 6x الحمض النووي تحميل المخزن المؤقت، وتحميل على المواد الهلامية المصغرة precast 10٪ البولياكريلاميد (أو ما يعادلها باليد)، وحل الحمض النووي الريبي عن طريق electrophoresis في تريس الجليسين تشغيل المخزن المؤقت لمدة 2 ساعة تحت تيار ثابت (16 مللي أ). نقع المواد الهلامية لمدة 5-10 دقيقة في المياه التي تحتوي على ~ 1 ميكروغرام / مل بروميد الإيتيهيديوم واكتشاف شرائح جينوم فيروس الروتا مع مغير للأشعة فوق البنفسجية.
6. استعادة وتسلسل dsRNA الفيروسية
- حدد نطاقات dsRNA الفيروسية على المواد الهلامية polyacrylamide يفضل استخدام ضوء الأشعة فوق البنفسجية الطول الموجي الطويل منخفض الكثافة ، لتجنب توليد الروابط المتقاطعة الحمض النووي. باستخدام شفرة حلاقة طازجة، اقطع شظايا الجل التي تحتوي على نطاقات dsRNA ونقلها إلى أنابيب الطرد المركزي الدقيقة 1.5 مل.
- بعد إضافة 10-20 ميكرولتر من المياه الخالية من RNase، قم بسحق كل جزء بآفة بيليه قابلة للتصرف خالية من RNase مصممة لتناسب أنبوب الطرد المركزي الدقيق 1.5 مل أو عن طريق الرسم صعودا وهبوطا من خلال إبرة 18 G. الاحتضان سحق شظايا بين عشية وضحاها في 4 درجة مئوية.
- استرداد 3 ميكرولتر من السائل من أنابيب تحتوي على شظايا هلام سحقت. توليد cDNAs من dsRNAs الفيروسية باستخدام خطوة واحدة عكس النسخ البوليميراز سلسلة التفاعل (RT-PCR) عدة(جدول المواد)والتمهيديات oligonucleotide المناسبة.
ملاحظة: يتم تنقية منتجات PCR مع مجموعة تنظيف PCR(جدول المواد)وإرسالها للتسلسل بين عشية وضحاها، جنبا إلى جنب مع التمهيديات، من خلال خدمات تسلسل الحمض النووي التجارية.
7. تحليل البلوت المناعي للبروتينات الفيروسية
- البذور 6-جيدا لوحات مع 3 × 105 خلايا MA104 لكل بئر في حجم إجمالي 2 مل من DMEM المتوسطة كاملة. ضع اللوحات في حاضنة 37 درجة مئوية و5% CO2 واترك حتى تصل الخلايا إلى التقاء (3-5 أيام).
ملاحظة: سوف تحتوي الآبار ذات الطبقات الأحادية المتجانسة الملتوية على ~ 1.2 × 106 خلايا. - علاج المواد الخارقة الموضحة عن طريق احتضان هاوية مع 10 ميكروغرام / مل التربسين في 37 درجة مئوية لمدة 1 ساعة لتنشيط جزيئات فيروس الروتا المؤتلف ة الواردة داخلها.
- شطف MA104 monolayers في لوحات 6 بئر 2x مع 2 مل من برنامج تلفزيوني. تصيب الخلايا بإضافة 200 ميكرولتر من اللاوكولوم إلى كل بئر تحتوي على وحدات تشكيل البلاك 3−5 لكل خلية من فيروس الروتا المنشط من التربسين في وسط DMEM غير مكتمل. لوحات العودة إلى الحاضنة.
- كل 10 دقيقة، وإزالة لوحات والصخور بلطف لإعادة توزيع التلقيح عبر أحادية الخلية. بعد 1 ساعة، استبدال اللاوكولوم مع 2 مل من المتوسط غير مكتملة DMEM.
- في 8 ح بعد العدوى، شطف الخلايا في لوحات 6 بئر 2x مع برنامج تلفزيوني. كشط الخلايا إلى 750 ميكرولتر من PBS ونقل حجم إلى أنبوب الطرد المركزي الدقيق 1.5 مل. شطف لوحة مع آخر 750 ميكرولتر من برنامج تلفزيوني والجمع مع السابق جمع عينة 750 μL.
- خلايا بيليه في عينة عن طريق الطرد المركزي في 5000 × ز لمدة 10 دقيقة في 4 درجات مئوية. بعد التخلص من supernatant ، قم بتخزين كريات الخلايا عند -80 درجة مئوية حتى تتم معالجتها بشكل أكبر.
- إعداد خلية زنس العازلة التي تحتوي على 300 mM NaCl، 100 mM تريس-HCl، درجة الحموضة 7.4، 2٪ تريتون X-100، و 1x EDTA خالية من مثبطات البروتياز الكامل. بعد إضافة 300 ميكرولتر من الليليس العازلة إلى كريات الخلايا المجمدة، عينات دوامة لفترة وجيزة واحتضان على الجليد لمدة 10 دقيقة.
- كرر عملية الدوامة واحتضان العينات على الجليد 3x. بعد ذلك، عينات أجهزة الطرد المركزي في 15،000 × ز لمدة 10 دقائق في 4 درجة مئوية، ثم جمع المواد الخارقة وتخزينها في -80 درجة مئوية.
- حل البروتينات الواردة في 20 ميكرولتر أحجام من عينات فائقة عن طريق الكهرباء على المواد الهلامية المصغرة قبل البث الخطي 8-16٪ وتنتقل إلى أغشية النيتروسيلولوسي. كتلة الأغشية عن طريق الحضانة مع PBS-Tween 20 (0.02٪ من المائة) حل يحتوي على 5٪ الحليب الجاف غير الدهنية.
- الأغشية التحقيق عن طريق احتضان مع واحد أو أكثر من الأجسام المضادة الأولية (على سبيل المثال، غينيا خنزير المضادة NSP3 أو المضادة لVP6 antisera، الماوس أحادي النسيلة المضادة العلم M2 الأجسام المضادة، أو أرنب أحادي النسيلة المضادة PCNA). الكشف عن الأجسام المضادة الأولية عن طريق احتضان الأغشية مع الحصان المضادة للفأر IgG، المضادة للغينيا خنزير IgG، أو الماعز المضادة للأرنب IgG الفجل peroxidase-اقتران الأجسام المضادة الثانوية، تليها تعزيز الركيزة chemiluminescence (ECL) الفجل chemiluminescence. تصور إشارات التألوئ باستخدام نظام التصوير هلام(جدول المواد)أو فيلم الأشعة السينية.
8. تصوير الخلايا الحية للخلايا المصابة بالفيروسات المعبرة عن FP
- البذور 6-جيدا لوحات مع 3 × 105 خلايا MA104 لكل بئر في ما مجموعه 2 مل من المتوسط الكامل DMEM. ضع اللوحات في حاضنة 37 درجة مئوية و5% CO2 واترك حتى تصل الخلايا إلى التقاء (3-5 أيام).
ملاحظة: سوف تحتوي الآبار ذات الطبقات الأحادية المتجانسة الملتوية على ~ 1.2 × 106 خلايا. - تنشيط عينات فيروس الروتا، من titer المعروفة، عن طريق الحضانة مع 10 ميكروغرام / مل التربسين في 37 درجة مئوية لمدة 1 ساعة.
- شطف لوحات 6 بئر مع MA104 monolayers 2x مع 2 مل من برنامج تلفزيوني. تصيب الخلايا بإضافة 200 ميكرولتر من اللاوكوليوم إلى كل بئر تحتوي على 3-5 PFU لكل خلية من فيروس الروتا المنشط من التربسين في وسط DMEM غير مكتمل. إعادة لوحات إلى الحاضنة ولوحات الصخور بلطف لإعادة توزيع التلقيح عبر أحادية الخلية كل 10 دقيقة.
ملاحظة: يجب تضمين الآبار التي هي وهمية مصابة بفيروس DMEM inoculum خالية من الفيروسات كعناصر تحكم. - بعد 1 ح من امتصاص الفيروس، شطف أحادية الطبقات 2x مع برنامج تلفزيوني واستبدال المتوسطة مع 0.5 مل لكل بئر من المتوسط غير مكتملة DMEM. في 7.5 ساعة بعد الإصابة، واستبدال المتوسطة الثقافة مع DMEM مع الفلورات الخلفية المنخفضة(جدول المواد). في 8 ح بعد العدوى، استخدم صور الخلايا الحية لفحص الخلايا في التكبير 20x للإشارة الفلورية الخضراء أو الحمراء أو الزرقاء.
النتائج
بروتوكول علم الوراثة العكسي الموصوف في هذه المقالة ينتقل من خلال خطوات متميزة متعددة: (1) التطفل المشترك لخلايا BHK-T7 مع ناقلات النسخ pT7 فيروس روتا وpCMV/NP868R التعبير plasmid، (2) الإشراف على الخلايا BHK-T7 المصابة بخلايا MA104 ، (3) تضخيم الفيروسات المؤتلفة الموجودة في خلايا BHK-T7/MA104 التي تسيل باستخدام خلايا MA104 ، و (4) عزل البلاك للفيروس المؤتلف باستخدام خلايا MA104(الشكل 2). في أيدينا، البروتوكول هو كفاءة، مما أسفر عن titers من الفيروس SA11 المؤتلف ة البرية (rSA11/wt) في BHK-T7/MA104 خلية lysates من ~ 104 PFU/mL وفي تضخيم MA104 خلية lysates من > 1 × 107 PFU/ مل. SA11 الفيروسات المؤتلفة التي تولدها الوراثة العكسية باستخدام pT7/NSP3SA11plasmids المعدلة التي تعبر عن FPs (على سبيل المثال، rSA11/NSP3-2A-3xFL-UnaG) تنمو إلى titers التي هي ~ 4 أضعاف أقل من rSA11/wt.
بعد بروتوكول علم الوراثة العكسي ، قمنا بإنشاء فيروسات SA11 المؤتلفة التي تم التعرف عليها بسهولة من خلال مسح البلاك على خلايا MA104 ، مما يسمح بعزل البلاك(الشكل 3D). تم اختيار الفيروسات في اللويحات مع أنبوب نقل قابل للتصرف طويل المدى وتضخيمه على خلايا MA104. تم استخراج جينوم dsRNA من rSA11/wt وrSA11/NSP3-2A-3xFL-UnaG فيروسات مع guanidinium thiocyanate ، وحلها عن طريق electrophoresis على هلام البولي اكريلاميد 10 ٪ ، والكشف عنها عن طريق تلطيخ مع بروميد الإيثهيديوم(الشكل 3A). كما هو متوقع ، الجزء 7 (NSP3) dsRNA من rSA11/NSP3-2A-3xFL-UnaG هاجر أبطأ بكثير من rSA11/wt(الشكل 3A)بسبب وجود تسلسلات 2A-3xFL-UnaG. الجزء 7 (NSP3) dsRNA من rSA11/NSP3-2A-3xFL-UnaG كان هلام تنقية، وتحويلها إلى شكل cDNA بواسطة RT-PCR، وتسلسل لتأكيد الدقة.
للتحقق من التعبير عن بروتين الفلورسنت UnaG، أصيبت خلايا MA104 في لوحات 6-well مع 3 PFU لكل خلية من rSA11/wt و rSA11/NSP3-2A-3xFL-UnaG. في 8 ساعة بعد الإصابة، تم استبدال الثقافة المتوسطة في لوحات مع 0.5 مل من DMEM مع الفلور اتّصل الخلفية منخفضة لكل بئر وألواح احتضنت لمدة 30 دقيقة إضافية في 37 درجة مئوية في حاضنة CO2. بعد ذلك، تم فحص اللوحات للتعبير عن UnaG باستخدام صور الخلايا الحية. وأظهر التحليل أن rSA11/NSP3-2A-3xFL-UnaG أنتجت الفلورسال الأخضر، والتحقق من وظائف الجين UnaG في الفيروس المؤتلف(الشكل 3B). وعلى النقيض من ذلك، لم يتم الكشف عن الفلورسينس الأخضر في الخلايا المصابة بـ rSA11/wt. لمعالجة ما إذا كان عنصر 2A في الجزء المعدل 7 من rSA11/NSP3-2AxFL-UnaG يعزز التعبير عن بروتينين منفصلين (NSP3-2A و 3xFL-UnaG)، أصيبت خلايا MA104 بـ rSA11/NSP3-2A-3xFL-UnaG وrSA11/wt. تم إعداد الخلايا من الخلايا التي تم حصادها في 8 h بعدان آخر، وحلها عن طريق الكهربية هلام، ولطخت على مرشحات النيتروسيلولوز. تم بحث البوات مع الأجسام المضادة محددة لVP6 روتا فيروس وNSP3، وعلامة FLAG. وأظهر التحليل أن NSP3-2A و 3xFL-UnaG تم التعبير عنها كبروتينات منفصلة في الخلايا المصابة بـ rSA11/NSP3-2A-3xFL-UnaG ، مما يشير إلى أن عنصر 2A كان وظيفيًا(الشكل 3C). الخلايا المصابة rSA11/wt لم تعبر عن البروتين المعترف بها من قبل الأجسام المضادة للراية. البروتين NSP3 موجودة في rSA11/NSP3-2A-3xFL-UnaG الخلايا المصابة بالأجسام المضادة المضادة NSP3 هاجر أبطأ قليلاً من NSP3 الموجودة في الخلايا المصابة rSA11/wt بسبب وجود بقايا بقايا 2A في C-terminus من NSP3.

الشكل 1: فيروس روتا عكسي علم الوراثة البلازميدات. (أ)يتم وضع cDNAs كامل الطول من 11 SA11 شرائح الجينوم الفيروس الروتافي داخل pT7 plasmids، وليغا المنبع مع المروج لبولميراز T7 RNA والمصب مع ريبوزييم HDV. في وجود T7 RNA polymerase, وrotavirus pT7 plasmids إنتاج كامل طول SA11 (+) RNAs مع أصيلة 5 ' و 3' termini. (ب)التخطيطات من (+) الحمض النووي الريبي ومنتجات البروتين التي أدلى بها pT7/NSP3-2A-3xFL-UnaG plasmid. التخطيطي يتضمن تسلسل CDNA NSP3، وتسلسل لschovirus porcine 2A مثل (2A) عنصر، 3x العلم (فلوريدا) العلامة، والبروتين الفلورسنت الأخضر UnaG. تتم الإشارة إلى موضع موقع إيقاف إعادة التشغيل المترجم 2A بسهم أحمر. بسبب نشاط عنصر 2A ، تنتج ترجمة الحمض النووي الريبي بروتينين. يحتوي الجزء NSP3 على بقايا عنصر 2A ويتم دمج جزء UnaG إلى علامة 3x FLAG. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: نظام الوراثة العكسي لفيروس الروتا. يتم نقل أجهزة أحادية BHK-T7 بـ 11 pT7 plasmids ، يعبر كل منها عن SA11 (+) RNA ، ومتجه pCMV يعبر عن فيروس حمى الخنازير الأفريقي (ASFV) NP868R وتوج إنزيم (pCMV/NP868R). في 3 أيام بعد العدوى (d.p.i.) ، يتم الإشراف على خلايا BHK-T7 مع خلايا MA104. في 7 أيام بعد العدوى، يتم تضخيم فيروسات الروتا المؤتلفة في الخلايا BHK-T7/MA104 عن طريق المرور على خلايا MA104، ثم معزولة عن طريق تنقية البلاك. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
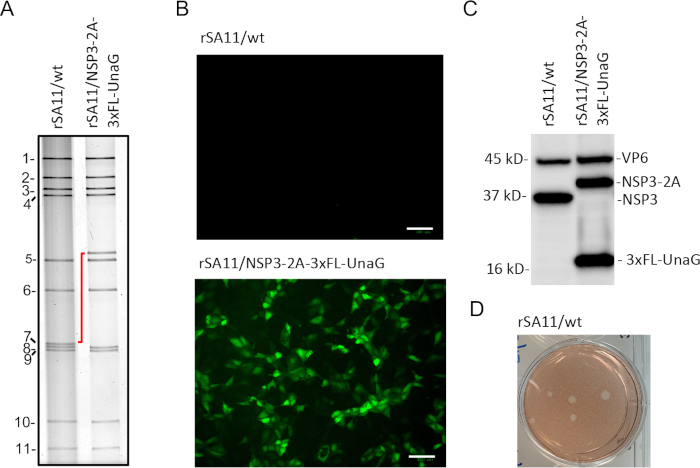
الشكل 3: خصائص السلالات المؤتلفة rSA11/wt وrSA11/NSP3-2A-3xFL-UnaG. (أ)لمحات Electrophoretic من شرائح الجينوم dsRNA من البلاك معزولة سلالات rSA11. يتم ترقيم شرائح الجينوم الإحدى عشرة ويشار إلى التحول في موضع الجزء 7 (NSP3) بخط أحمر. (ب)الفلورسينس المكتشفة في خلايا MA104 المصابة rSA11 في 8 ساعة بعد الإصابة باستخدام صور حية للخلايا (التكبير 20x) المنصوص عليها على قناة الكشف الخضراء. مقياس شريط = 100 ميكرون.(C)تحليل Immunoblot من البروتينات الموجودة في 8 ساعة بعد العدوى في خلايا MA104 المصابة سلالات rSA11 باستخدام غينيا خنزير المضادة VP6 والمضادة NSP3 antisera والفأر المضادة أحادية النسيلة. (D)اللويحات التي تنتجها rSA11/wt على خلايا MA104 في 3 أيام بعد العدوى والكشف عنها من قبل تلطيخ أحمر محايد. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في مختبرنا، ونحن نعتمد بشكل روتيني على بروتوكول علم الوراثة العكسي الموصوف هنا لإنتاج فيروسات روتا SA11 المؤتلفة. مع هذا النهج ، والأفراد مع خبرة ضئيلة في تقنيات البيولوجيا الجزيئية أو العمل مع الفيروسات الروتا استرداد الفيروسات المؤتلفة حتى في محاولتهم الأولى. لقد قمنا بتوليد ما يقرب من 100 فيروس مؤتلف بعد هذا البروتوكول، بما في ذلك الفيروسات ذات الجينوم التي تمت إعادة هندستها للتعبير عن البروتينات الأجنبية (على سبيل المثال، FPs) التي تحتوي على إضافات التسلسل، والحذف، والطفرات النقطية.
تنطبق الشروط وأوقات الحضانة الواردة في هذا البروتوكول على تعافي سلالات متزايدة من الفيروسات المؤتلفة. وينبغي النظر في التعديلات إذا كانت محاولة استرداد فيروسات SA11 التي، بسبب التعديل الوراثي، قد يتوقع أن تنمو بشكل سيئ. على وجه الخصوص، لأن titer من هذه الفيروسات في الخلايا BHK-T7/MA014 قد تكون منخفضة، ونحن عادة ضعف كمية lysate المستخدمة كتلقيح في خطوات التضخيم اللاحقة. وعلاوة على ذلك، في خطوة التضخيم، قد تتطلب الفيروسات الضعيفة النمو أوقات حضانة أطول قبل الوصول إلى مستويات CPE كافية لحصاد الخلايا. في الواقع، مع مثل هذه الفيروسات، قد نسمح للعدوى بالمضي قدماً لمدة 10-14 يوماً، أو حتى لفترة أطول، قبل حصاد الخلايا. وأخيراً، من المرجح أن تولد الفيروسات الضعيفة النمو لويحات صغيرة بطيئة النمو على خلايا MA104. وبالتالي، لعزل البلاك هذه الفيروسات، قد يكون من الضروري السماح لللويحات بالتطور حتى 6-10 أيام بعد العدوى قبل تلطيخ الخلايا باللون الأحمر المحايد والتقاط اللويحات.
في تجربتنا، العامل الوحيد الأكثر أهمية في الانتعاش الموثوق به من فيروس الروتا المؤتلف هو استخدام الخلايا BHK-T7 صحية ومصانة بشكل جيد. في مختبرنا، نقوم بمرور خلايا BHK-T7 بشكل روتيني 2x في الأسبوع بنفس التخفيف باستخدام متوسط مكمل ليس فقط مع 10٪ FBS، ولكن أيضًا مع NEAA و TPB ومستويات عالية من الجلوكوز (GMEM المتوسط الكامل). المكملات الإضافية مساعدة BHK-T7 الخلايا الاحتفاظ قابلة للحياة الموسعة بعد التطفل البلازميد, عامل من المرجح أن تكون حاسمة لاسترداد الفيروسات المؤتلفة متحولة النمو سيئة النمو. نحن تكملة المتوسطة كل ممر آخر مع G418, مضاد حيوي الذي يختار لصيانة التعبير T7 البوليمرplasmid. وينبغي أن تكون ظروف المرور بحيث لا يسمح أبدا خلايا BHK-T7 لتنمو الماضي التقاء, الظروف التي تؤدي بسرعة إلى انخفاض قدرة الخلية على البقاء. بالنسبة لنا، فإن خلايا BHK-T7 التي تم السماح لها بالإفراط في النمو تؤدي أداءً ضعيفًا في بروتوكول علم الوراثة العكسي، حتى لو تم تمرير الخلايا لاحقًا بشكل مناسب عدة مرات. بدلاً من محاولة إعادة تأهيل خلايا BHK-T7 المتضخمة ، نقوم بإعادة تشغيل النسب بخلايا مخزنة سابقًا في النيتروجين السائل.
يمكن أن يكون تلوث الميكوبلازما لخلايا BHK-T7 و MA104 عاملاً رئيسياً في فشل نظام علم الوراثة العكسي لفيروس الروتا لتوليد فيروس مؤتلف. في مختبرنا، نستخدم مجموعة الكشف عن الميكوبلازما المستندة إلى PCR(جدول المواد)للتحقق من تلوث خطوط الخلايا، وعند اكتشافها، غالبًا ما يرتبط ذلك بخلايا BHK-T7. لم نحاول علاج خطوط الخلايا من تلويث الميكوبلازما ، بدلا من ذلك إعادة إنشاء الخطوط مع الممرات الخالية من الميكوبلازما في وقت سابق المخزنة في النيتروجين السائل. قبل البدء في خطوط الخلايا الجديدة، ونحن تجاهل جميع المكملات الغذائية المتوسطة والمتوسطة المستخدمة سابقا وإزالة التلوث تماما حاضنات، خزانات السلامة البيولوجية، وحمامات المياه، ومقاعد المختبر، والأنابيب. كما نستخدم مجموعات الكشف عن الميكوبلازما للتحقق من مخزون الفيروسات المؤتلفة للتلوث. بسبب مقاومة جزيئات فيروس الروتا لتسخ بواسطة المذيبات العضوية، مثل Vertrel VF32،فمن الممكن لتحرير مخزونات الفيروسات من تلويث الميكوبلازما، مما ينفي الحاجة إلى تجديد الفيروسات المؤتلفة عن طريق علم الوراثة العكسي. من المهم التأكيد على أنه يجب فحص خطوط الخلايا وتحضيرات الفيروسات التي يتم تلقيها إلى المختبر بحثًا عن تلوث الميكوبلازما قبل الاستخدام الروتيني.
على الرغم من أن اليوم في وبعد يوم، ونحن نستخدم نفس البروتوكول لتوليد الفيروسات المؤتلفة، ونحن نعلم أنه يمكن إجراء بعض التعديلات التي لن تحول دون استعادة الفيروس. على سبيل المثال، '1' لا يلزم التطفل المشترك لـ pCMV/NSP868R توج-إنزيم البلازميد مع ناقلات SA11 pT7 لاسترداد الفيروسات المؤتلفة. في حين أن إضافة البلازميد الغطاء ينتج أعلى titers الفيروس في الخلايا BHK-T7/MA104 الخلايا المنقولة، تمكنا من استعادة العديد من الفيروسات، بما في ذلك تلك التي تعبر عن FPs، دون ذلك. ومع ذلك، فقد خلصنا إلى أن التعبير عن إنزيم التوج بواسطة pCMV/NP868R قد يساهم بشكل كبير في استعادة الفيروسات الأقل ملاءمة. '2' لقد وجدنا أنه يمكن توليد فيروسات مؤتلفة حتى لو تم تخفيض كمية كاشف التطفل(جدول المواد)المستخدم في بروتوكول علم الوراثة العكسي بمقدار النصف، وهو تعديل يمكن أن يقلل بشكل كبير من النفقات. '3' وبالمثل، قررنا أنه يمكن استخدام الوسائط الكاملة M199 بدلا من المتوسط الكامل DMEM. '4' وأخيراً، لا يوجد شرط محدد فيما يتعلق بنوع العمود الفقري للمتجه الذي يجب استخدامه في إنتاج ناقلات النسخ SA11 T7. طالما أن cDNA الفيروسية في plasmid محاطة بمروج T7 المنبع وribozyme HDV المصب وT7 المنهي ، يمكن توقع البلازميد لدعم استعادة الفيروس المؤتلف. وتجدر الإشارة إلى أن ناقلات pGEM-و pBluescript وpUC المستندة إلى pUC قد استخدمت بنجاح في نظام علم الوراثة العكسي.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد تم دعم هذا العمل من قبل المعاهد القومية للصحة المنح R03 AI131072 وR21 AI144881، جامعة انديانا تمويل بدء التشغيل، ولورانس M. بلات الوقف. نشكر أعضاء مختبر روتاهوسير، أولريش ديسيلبرغر، وغيدو بابا على مساهماتهم واقتراحاتهم العديدة في تطوير بروتوكول علم الوراثة العكسي.
Materials
| Name | Company | Catalog Number | Comments |
| Baby Hamster Kidney - T7 RdRP (BHK-T7) Cells | Contact: ubuchholz@niaid.nih.gov | ||
| Bio-Rad 8-16% Tris-Glycine Polyacrylamide Mini-Gel | Bio-Rad | 45608105 | |
| Cellometer AutoT4 viable cell counter | Nexcelom | ||
| ChemiDoc MP Gel Imaging System | Bio-Rad | ||
| Chloroform | MP | 194002 | |
| Clarity Western Enhanced Chemiluminescence (ECL) Substrate | Bio-Rad | 170-5060 | |
| Competent E.coli DH5alpha Bacteria | Lucigen | 60602-2 | |
| Complete Protease Inhibitor | Pierce | A32965 | |
| Disposable Transfer Pipettes, Ultrafine Extended Tips | MTC Bio | P4113-11 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Lonza | 12-604F | |
| Eagle's Minimal Essential Medium, 2x (2xEMEM) | Quality Biological | 115-073-101 | |
| Ethanol, Absolute (200 proof) | Fisher Bioreagents | BP2818-500 | |
| Ethidium Bromide Solution (10 mg/ml) | Invitrogen | 15585-011 | |
| Fetal Bovine Serum (FBS) | Corning | 35-010-CV | |
| Fetal Bovine Serum (FBS), Heat Inactivated | Corning | 35-011-CV | |
| Flag M2 Antibody, Mouse Monoclonal | Sigma-Aldrich | F1804 | |
| GenEluate HP Plasmid Midiprep Kit | Sigma | NA0200-1KT | |
| Geneticin (G-418) | Invitrogen | 10131-027 | |
| Gibco FluroBrite DMEM | ThermoFisher | A1896701 | DMEM with low background fluorescence |
| Glasgow Minimal Essential Medium (GMEM) | Gibco | 11710-035 | |
| Goat Anti-Rabbit IgG, Horseradish Peroxidase (HRP) Conjugated | Cell-Signaling Technology | 7074S | |
| Guinea Pig Anti-NSP3 Antiserum | Patton lab | lot 55068 | |
| Guinea Pig Anti-VP6 Antierum | Patton lab | lot 53963 | |
| Horse Anti-Guinea Pig IgG, Horseradish Peroxidase (HRP) Conjugated | KPL | 5220-0366 | |
| Horse Anti-Mouse IgG, Horseradish eroxidase (HRP) Conjugated | Cell-Signaling Technology | 7076S | |
| iNtRON Biotechnology e-Myco Mycoplasma PCR Detection Kit | JH Science | 25235 | |
| Isopropyl alcohol | Macron | 3032-02 | |
| L-glutamine Solution (100x) | Gibco | 25030-081 | |
| Luria Agar Powder (Miller's LB Agar) | RPI research products | L24020-2000.0 | |
| Medium 199 (M199) Culture Medium | Hyclone | Sh30253.01 | |
| Minimal Essential Medium -Eagle Joklik's Forumation (SMEM) | Lonza | 04-719Q | |
| Monkey Kidney (MA104) Cells | ATCC | ATCC CRL-2378.1 | |
| NanoDrop One Spectrophotometer | ThermoScientific | ||
| Neutral Red Solution (0.33%) | Sigma-Aldrich | N2889-100ml | |
| Non-Essential Amino Acid Solution (100x) | Gibco | 11140-050 | |
| Novex 10% Tris-Glycine Polyacrylamide Mini-Gel | Invitrogen | XP00102BOX | |
| Nuclease-Free Molecular Biology Grade Water | Invitrogen | 10977-015 | |
| NucleoSpin Gel and PCR Clean-Up Kit | Takara | 740609.25 | |
| Opti-MEM Reduced Serum Medium | Gibco | 31985-070 | |
| Pellet pestle (RNase-free, disposable) | Fisher | 12-141-368 | |
| Penicillin-Streptomycin Solution, (100x penn-strep) | Corning | 30-002-Cl | |
| Phosphate Buffered Saline (PBS), 10x | Fisher Bioreagents | BP399-20 | |
| Porcine Trypsin, Type IX-S | Sigma-Aldrich | T0303 | |
| PureYield Plasmid Miniprep System | Promega | A1223 | |
| Qiagen Plasmid Maxi Kit | Qiagen | 12162 | |
| Qiagen Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| SA11 pT7 Transcription Vectors | Addgene | 89162-89172 | |
| SA11 pT7/NSP3 Transcription Vectors Expressing Fluorescent Proteins | Contact: jtpatton@iu.edu | ||
| SeaKem LE Agarose | Lonza | 50000 | For gel electrophoresis |
| SeaPlaque agarose | Lonza | 50100 | For plaque assay |
| Superscript III One-Step RT-PCR kit | Invitrogen | 12574-035 | |
| Trans-Blot Turbo Nitrocellulose Transfer Kit | Bio-Rad | 170-4270 | |
| Trans-Llot Turbo Transfer System | Bio-Rad | ||
| TransIT-LTI Transfection Reagent | Mirus | MIR2306 | |
| Tris-Glycine-SDS Gel Running Buffer (10x) | Bio-Rad | 161-0772 | |
| Triton X 100 | Fisher Bioreagents | BP151-500 | |
| Trizol RNA Extraction Reagent | Ambion | 15596026 | |
| Trypan blue | Corning | 25-900-CI | |
| Trypsin (0.05%)-EDTA (0.1%) Cell Dissociation Solution | Quality Biological | 118-087-721 | |
| Tryptose Phosphate Broth | Gibco | 18050-039 | |
| Tween-20 | VWR | 0777-1L | |
| Vertrel VF solvent | Zoro | G0707178 | |
| Zoe Fluorescent Live Cell Imager | Bio-Rad |
References
- Crawford, S. E., et al. Rotavirus infection. Nature Reviews Disease Primers. 3 (17083), 1-16 (2017).
- Settembre, E. C., Chen, J. Z., Dormitzer, P. R., Grigorieff, N., Harrison, S. C. Atomic model of an infectious rotavirus particle. The EMBO Journal. 30 (2), 408-416 (2011).
- International Committee on Taxonomy of Viruses. Taxonomic information. Virus taxonomy: 2018b release. , Available from: https://talk.ictvonline.org/taxonomy (2019).
- Tate, J. E., Burton, A. H., Boschi-Pinto, C., Parashar, U. D. World Health Organization-Coordinated Global Rotavirus Surveillance Network. Global, regional, and national estimates of rotavirus mortality in children <5 years of age. Clinical Infectious Diseases. 62, Suppl 2 96-105 (2016).
- Troeger, C., et al. Rotavirus vaccination and the global burden of rotavirus diarrhea among children younger than 5 years. JAMA Pediatrics. 172 (10), 958-965 (2018).
- Matthijnssens, J., Van Ranst, M. Genotype constellation and evolution of group A rotaviruses infecting humans. Current Opinion in Virology. 2 (4), 426-433 (2012).
- McDonald, S. M., Nelson, M. I., Turner, P. E., Patton, J. T. Reassortment in segmented RNA viruses: mechanisms and outcomes. Nature Reviews Microbiology. 14 (7), 448-460 (2016).
- Patton, J. T. Rotavirus diversity and evolution in the post-vaccine world. Discovery Medicine. 13 (68), 85-97 (2012).
- Kanai, Y., et al. Entirely plasmid-based reverse genetics system for rotaviruses. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2349-2354 (2017).
- Trask, S. D., McDonald, S. M., Patton, J. T. Structural insights into the coupling of virion assembly and rotavirus replication. Nature Reviews Microbiology. 10 (3), 165-177 (2012).
- Guglielmi, K. M., McDonald, S. M., Patton, J. T. Mechanism of intraparticle synthesis of the rotavirus double-stranded RNA genome. Journal of Biological Chemistry. 285 (24), 18123-18128 (2010).
- Komoto, S., et al. Generation of recombinant rotaviruses expressing fluorescent proteins by using an optimized reverse genetics system. Journal of Virology. 92 (13), 00588-00618 (2018).
- Trask, S. D., Taraporewala, Z. F., Boehme, K. W., Dermody, T. S., Patton, J. T. Dual selection mechanisms drive efficient single-gene reverse genetics for rotavirus. Proceedings of the National Academy of Sciences of the United States of America. 107, 18652-18657 (2010).
- Fabbretti, E., Afrikanova, I., Vascotto, F., Burrone, O. R. Two non-structural rotavirus proteins, NSP2 and NSP5, form viroplasm-like structures in vivo. Journal of General Virology. 80, 333-339 (1999).
- Eichwald, C., Rodriguez, J. F., Burrone, O. R. Characterization of rotavirus NSP2/NSP5 interactions and the dynamics of viroplasm formation. Journal of General Virology. 85, 625-634 (2004).
- Kawagishi, T., et al. Reverse genetics system for a human group A rotavirus. Journal of Virology. , (2019).
- Komoto, S., et al. Generation of infectious recombinant human rotaviruses from just 11 cloned cDNAs encoding the rotavirus genome. Journal of Virology. 93 (8), 02207-02218 (2019).
- Mohanty, S. K., et al. A point mutation in the rhesus rotavirus VP4 protein generated through a rotavirus reverse genetics system attenuates biliary atresia in the murine model. Journal of Virology. 91 (15), 00510-00517 (2017).
- Navarro, A., Trask, S. D., Patton, J. T. Generation of genetically stable recombinant rotaviruses containing novel genome rearrangements and heterologous sequences by reverse genetics. Journal of Virology. 87, 6211-6220 (2013).
- Duarte, M., et al. Rotavirus infection alters splicing of the stress-related transcription factor XBP1. Journal of Virology. 93 (5), 01739-01818 (2019).
- Philip, A. A., et al. Generation of recombinant rotavirus expressing NSP3-UnaG fusion protein by a simplified reverse genetics system. Journal of Virology. , 1616-1619 (2019).
- Papa, G., et al. Recombinant rotaviruses rescued by reverse genetics reveal the role of NSP5 hyperphosphorylation in the assembly of viral factories. Journal of Virology. , (2019).
- Komoto, S., et al. Reverse genetics system demonstrates that rotavirus nonstructural protein NSP6 is not essential for viral replication in cell culture. Journal of Virology. 91 (21), 00695-00717 (2017).
- Philip, A. A., et al. Collection of recombinant rotaviruses expressing fluorescent reporter proteins. Microbiology Resource Announcements. 8 (27), 00523-00619 (2019).
- Kanai, Y., et al. Development of stable rotavirus reporter expression systems. Journal of Virology. , 01774-01818 (2019).
- Donnelly, M. L., et al. The 'cleavage' activities of foot-and-mouth disease virus 2A site-directed mutants and naturally occurring '2A-like' sequences. Journal of General Virology. 82, 1027-1041 (2001).
- Kumagai, A., et al. A bilirubin-inducible fluorescent protein from eel muscle. Cell. 153, 1602-1611 (2013).
- Rodriguez, E. A., et al. The growing and glowing toolbox of fluorescent and photoactive proteins. Trends in Biochemical Sciences. 42, 111-129 (2017).
- Buchholz, U. J., Finke, S., Conzelmann, K. K. Generation of bovine respiratory syncytial virus (BRSV) from cDNA: BRSV NS2 is not essential for virus replication in tissue culture, and the human RSV leader region acts as a functional BRSV genome promoter. Journal of Virology. 73, 251-259 (1999).
- Centers for Disease Control and Prevention (CDC). Biosafety in microbiological and biomedical laboratories (BMBL), 5th edition. , HHS publication no. CDC 21-1112 (2009).
- Arnold, M., Patton, J. T., McDonald, S. M. Culturing, storage, and quantification of rotaviruses. Current Protocols in Microbiology. 15 (1), (2009).
- Benureau, Y., Huet, J. C., Charpilienne, A., Poncet, D., Cohen, J. Trypsin is associated with the rotavirus capsid and is activated by solubilization of outer capsid proteins. Journal of General Virology. 86 (11), 3143-3151 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved