Method Article
마우스 골격 근 이식에서 기본 근구의 격리 및 분화
요약
근세포는 다핵근화 된 myotubes를 형성하고 결국 골격 근섬유를 형성하기 위해 분화 전구세포를 증식시. 여기에서, 우리는 젊은 성인 마우스 골격 근육에서 1 차적인 근분의 능률적인 격리 그리고 문화를 위한 프로토콜을 제시합니다. 이 방법은 배양에서 근육 세포의 분자, 유전 및 대사 연구를 가능하게합니다.
초록
1 차 근세포는 골격 근의 미분화 증식 선구자입니다. 그들은 배양 하 고 근육 선구자로 공부 하거나 근육 개발의 나중 단계로 분화 유도 수 있습니다. 여기에 제공된 프로토콜은 젊은 성인 마우스 골격 근 이식으로부터 의 골수 세포집단의 고도로 증식성 집단의 격리 및 배양에 대한 강력한 방법을 설명한다. 이들 세포는 다른 마우스 모델의 골격 근의 대사 특성의 연구뿐만 아니라 바이러스 발현 벡터를 가진 외인성 DNA 또는 형질전환과 같은 다른 다운스트림 응용 분야에서 유용하다. 이들 세포의 분화 및 대사 프로필의 수준은 근구 분화를 유도하는 데 사용되는 매체의 노출 길이 및 조성에 따라 달라집니다. 이들 방법은 마우스 근육 세포 대사 엑생체의 연구를 위한 견고한 시스템을 제공한다. 중요한 것은, 생체 내 모델과는 달리, 여기에 기술된 방법은 높은 수준의 재현성으로 확장되고 연구될 수 있는 세포 집단을 제공한다.
서문
종종 전반적인 신진 대사 건강의 표시로 인용 하는 동안, 여러 연구 는 체 질량 지 수 (BMI) 노인에서 일관 되 게 사망의 높은 위험과 관련 되지 않습니다. 현재까지, 이 인구에 있는 감소된 사망률과 일치하는 것으로 나타난 유일한 요인은 증가된 근육 질량1. 근육 조직은 신체에서 인슐린에 민감한 세포의 가장 큰 공급원 중 하나를 나타내며, 따라서 전반적인 대사 항상성의 유지에 중요합니다2. 운동을 통한 골격근 조직의 활성화는 국소 인슐린 감수성 및 전반적인 대사 건강 의 증가와 관련이있다 3. 생체 내 모델은 근육 생리학과 통합 신진 대사에 대한 근육 기능의 영향을 연구하는 데 필수적이지만, myotube의 기본 문화는 동물 연구의 복잡성을 줄이는 견인 시스템을 제공합니다.
산후 근육에서 파생된 근세포는 매우 재현가능한 방식으로 수많은 치료 및 성장 조건의 영향을 연구하는 데 사용할 수 있습니다. 이는 오랫동안 인식되어 왔으며 근강초 격리 및 문화에 대한 여러 가지 방법이4,5,6,7,8,9로설명되어 왔다. 이러한 방법 중 일부는 신생아 근육을 사용하고 더 큰 규모의 연구를 위해 여러 동물을 필요로하는 근체5,8의상대적으로 낮은 숫자를 산출합니다. 또한, 근세포를 배양하기 위한 가장 널리 사용되는 방법은 다른 세포 유형보다 덜 부착된 근세포를 풍부하게 하기 위해 "사전 도금"을 사용합니다. 우리는 고도로 증식하는 근강군을 풍부하게 하기 위한 훨씬 더 효율적이고 재현성이 있는 것으로 여기에서 기술된 대체 농축 방법을 발견했습니다. 요약하면,이 프로토콜은 젊은 성인 근육 이식에서 고도로 증식성 근종의 격리를 가능하게, 문화 매체로 의자 성장을 통해. 근체는 며칠에 걸쳐 반복적으로 수확되고, 급속히 확장되고, myotube로 분화하도록 유도될 수 있습니다. 이 프로토콜은 자발적으로 경련하는 myotubes로 강력하게 분화하는 많은 수의 건강한 근세포 세포를 재현가능하게 생성합니다. 그것은 우리가 다양한 유전자형의 마우스의 기본 myotube에서 신진 대사와 circadian 리듬을 연구할 수 있게 했습니다. 마지막으로, 우리는 96 웰 플레이트에서 산소 소비율의 측정을 사용하여 산화 물질 대사의 연구를 위한 myotubes를 준비하는 방법을 포함합니다.
프로토콜
이 프로토콜은 스크립스 연구의 동물 관리 지침을 따릅니다.
1. 근육 조직 이식의 수집 및 처리
- 해부 전날, 모든 해부 장비(집게, 면도날 및 가위)를 소독하고 필요한 모든 매체를 준비합니다: 인산염 완충식염수(PBS), MB 도금 매체(DMEM 12.5 mL, HAMS F12 12mL, 열-불활성화 태아 소 20mL) 혈청 (FBS), 양수 배지 보충의 5 mL), 및 코팅 용액 (DMEM의 24 mL, HAMS F12의 24 mL, 콜라겐 1.7 mL, 마트리겔 1 mL).
- 해부 당일, 각 근육에 대한 코팅 용액으로 6cm 접시 하나를 코팅하십시오. 각 플레이트의 표면에 2 mL의 코팅 용액을 추가하고 부드럽게 흔들어 표면에 균일 한 코팅을 만들고 4 °C에서 용액으로 플레이트를 1 시간 동안 배양하십시오.
- 플레이트에서 코팅 용액을 제거하고 재고 용액으로 돌아갑니다.
참고: 코팅 용액은 최대 6개월 동안 재사용할 수 있으며 4°C에서 보관해야 합니다. - 2 mL의 PBS로 접시를 두 번 헹구어 언바운드 콜라겐과 마트리겔을 제거합니다.
- 플레이트를 해부 동안 37°C 조직 배양 인큐베이터에 놓습니다.
- 두꺼운 흡수제 용지 2-3장을 비닐 봉지 또는 멸균 15cm 접시에 넣고 피펫을 사용하여 종이 표면을 멸균수로 적시면 습한 챔버를 준비합니다.
- 챔버를 자외선 아래에 5분 동안 두어 살균합니다.
- 4~8주 된 마우스에서 원하는 근육을 해부하십시오. 근육 조직을 살균하려면 40 μg/mL 겐타미신이 함유된 PBS에서 부드럽게 헹구십시오.
참고: 사두근과 위내혈증 근육의 경우 플레이트 당 하나의 근육을 플레이트하십시오. 발바닥, 발바닥 및 EDL의 경우, 한 접시에 두 다리의 근육을 결합합니다. - 멸균 포셉을 사용하여 근육을 멸균 된 10cm 코팅되지 않은 페트리 접시로 옮김하십시오. 0.5-1.0 mL의 도금 매체를 근육에 첨가하여 조직이 촉촉하지만 부동되지 않도록합니다(도 1A).
- 멸균 메스 나 면도날을 사용하여 근육을 작은 조각 (약 1-3mm3)으로부드럽게 슬라이스하십시오.
참고: 최상의 결과 대 한 근육 조직 처리를 최소화 하는 것이 중요 하다. - 집게 또는 파이펫을 사용하여 미리 코팅된 6cm 플레이트의 표면에 근육 조각을 전달합니다. 매우 부드럽게 조직에 도금 매체의 추가 0.8 mL을 오버레이. 조직 조각을 수화하지만 부동하지 않도록 하기에 충분한 매체가 있어야합니다(그림 1B).
- 습한 챔버 내부에 근육 단편을 포함하는 6 cm 접시를 놓고 48 시간 동안 인큐베이터 (37 °C, 5 %CO2)로돌아갑니다(도 1C).
참고: 근육 파편이 판의 표면에 부착되어 근로 세포 자생을 허용하는 것이 중요합니다. 플레이트/챔버를 48시간 이상 움직이지 마십시오. - 48 시간 후, 조심스럽게 근육 조각이 부착되어 있는지 확인하기 위해 판을 확인하십시오. 도금 매체의 2 mL오버레이, 조각을 빼내지 않도록주의.
참고: 접시에 눈에 띄는 오염이나 파편이 있는 경우 근육 조각을 조심스럽게 씻으십시오. 플레이트 의 끝에 PBS / gentamicin 용액의 플레이트 2 mL과 부드럽게 근육 조직을 씻어 팁. PBS를 제거하고 세척 단계를 반복합니다. 두 번째 세척 후, 도금 매체의 2 mL를 오버레이. - 포근세포체를 수확하기 전에 플레이트를 37°C 인큐베이터에 최대 3일(원래 해부로부터 5일)까지 보관하십시오. 매일 근조의 생후를 확인하십시오.
참고: 근육 이식에서 나오는 세포의 모양은 가변적이고 이질적 일 것입니다. 기본 근세포는 작고 둥글며 밝은 세포로 나타납니다. 그러나 이 단계에서 의외로 식별할 필요도 신뢰할 수 있는 것도아닙니다(그림 2).
2. 자라나는 근세포 수확
- 준비하고 미리 온난 근강 변종 미디어 (DMEM의 17.5 mL, HAMS F12의 17.5 mL, FBS의 10 mL, 양수 액상 중간 보충의 5 mL), 트립신, 및 PBS / gentamicin. 코팅 용액으로 수확되는 근육 군당 하나의 T25 플라스크를 코팅하고 1.2단계에 기재된 대로(표 1참조).
- 도금 매체를 제거하고 2 mL의 PBS/gentamicin으로 근육 이식을 부드럽게 헹구십시오. 신속하게 PBS를 제거 (한 번에 하나의 접시를 헹구고이 단계에서 접시가 PBS에 앉지 않도록하십시오).
- 1 mL의 PBS/gentamicin을 부드럽게 넣고 플레이트를 37°C 인큐베이터에 1분간 넣습니다.
- P1000 파이펫을 사용하여 15mL 원심분리기 튜브에서 PBS/셀을 수집합니다.
- 접시에 트립신 1 mL을 넣고 37 °C 인큐베이터로 3분간 되돌아갑니다. 트립신/셀을 수집하고 PBS 컬렉션과 결합합니다. 원심분리기 튜브에 8 mL의 Myoblast Media를 넣고 부드럽게 섞어 주세요.
- 근육 플레이트에 2 mL의 도금 용액을 부드럽게 오버레이하고 37°C 인큐베이터로 되돌아갑니다.
- 200 x g에서3 분 동안 원심 분리기에 세포가 들어있는 원심 분리튜브를 돌십시오.
- 상급자를 ~ 1 mL로 흡인하고 세포 펠릿을 피하기 위해 주의하십시오. Myoblast Media를 부드럽게 첨가하고(표 1참조) 세포를 미리 코팅된 플라스크로 옮기고 37°C 인큐베이터에 놓습니다. 이것은 P0 수확입니다. 현미경으로 관찰하는 경우, 극소수의 세포가 있을 수있다(그림 3).
- 격일로 세 번까지 위에서 설명한 수확을 반복합니다. 세 번째 수확 후, 이식을 버린다.
3. 증식하는 근구의 확장 및 농축
참고: P0 수확은 이질적 일 것입니다 (~ 60 % 근강세포). 다음 2 구절은 PBS를 사용하여 선택적으로 근구를 수확합니다. 더 부착 세포의 대부분은 뒤에 남아있을 것입니다 빠르게 증식 myoblasts는 2 대항 내에서 ≥95 % 순수 할 것이다. 근강근이 확립되면 자발적인 분화를 피하기 위해 저밀도로 유지되어야 합니다.
- 섹션 2에서 ~ 40-50 % 동시 세포의 각 T25 플라스크에 대해, 코팅 용액 5 mL로 T75 플라스크 1 개를 코팅하고 1-4 시간 동안 4 °C에 놓습니다.
- 플라스크에서 코팅 용액을 제거하고 재고 용액으로 돌아갑니다. PBS/gentamicin 2 mL로 플라스크를 두 번 헹구고 37°C 인큐베이터에 놓습니다.
- P0 근강 T25 플라스크에서 미디어를 흡인합니다. 따뜻한 PBS/젠타미신 2 mL로 세포를 간략하게 헹굽니다. 플라스크에서 PBS를 흡인합니다.
참고: 이 단계(3.3)의 목적은 세균 오염의 가능성을 감소시키는 것이다. 신속하고 부드럽게 수행하면 근세포가 손실되지 않아야합니다. 원하는 경우 근강종 보존을 최대화하기 위해 생략할 수 있습니다. - 피펫 2 mL의 따뜻한 PBS (트립신 아님)를 근세포체를 함유하는 각 플라스크에 넣습니다. PBS가 있는 플라스크를 37°C 인큐베이터에 넣고 3분 동안 넣습니다.
참고: 근세포는 PBS로 플라스크에서 쉽게 분리해야 합니다. 이 단계에서 트립신보다는 PBS를 사용하는 것은 다른 세포 유형으로 근강구 인구의 오염을 줄이는 데 중요합니다. - 37°C 인큐베이터에서 세포를 제거하고 플라스크의 측면을 단단히 탭하여 세포를 빼내도록 합니다. 가벼운 현미경으로 자유롭게 떠있는 근구 체를 확인하십시오.
- 플라스크를 조직 배양 후드에 똑바로 놓고 플라스크 바닥을 10 mL의 Myoblast Media로 2-3 회 헹구어 모든 세포가 빠지도록합니다.
- 15 mL 원심 분리기 튜브에서 세포 / 미디어 혼합물을 수집합니다. 원심분리기 200 x g에서3 분.
- 약 1 mL에 매체를 흡인, 세포 펠릿을 피하기 위해 주의. 원심분리튜브에 Myoblast Media의 적절한 부피를 부드럽게 넣고 부드럽게 섞습니다.
- 새로운 T75 플라스크에 셀 혼합물을 분배합니다. 각 새로운 T75 플라스크에 Myoblast 미디어의 10 mL를 추가합니다. 플라스크를 수평으로 부드럽게 흔들어 세포를 분배하고 밤새 37°C 인큐베이터에 놓는다.
- 이틀 후, PBS로 다시 한 번 통과하여 각 T75 플라스크를 3개의 T75 플라스크로 분할합니다.
참고: 근구가 50%-60% 이상 부유해지는 것을 허용하지 마십시오. - 추가 구절의 경우 트립신을 사용하십시오. PBS 수익률 >95% 근강세포로 두 번 통과; 순도를 더욱 향상시키려는 시도는 더 나쁜 분화를 초래하는 경향이 있다.
4. 1차 근세포와 묘튜브의 분화
- 코팅 플레이트에 Myoblast 미디어에서 플레이트 P2 (또는 이후 통로) 근강세포 (권장 코팅 및 도금 볼륨 및 셀 번호에 대한 표 1 참조). 2~3일 후, 세포가 70-80% 동률일 때, 매체를 분화 매체로 변경한다(DMEM 24 mL, HAMS F12의 24 mL, 열 불활성화 말 혈청 1.5 mL, 인슐린-셀레늄-트랜스포메이션린0.5 mL).
- 분화 매체를 매일 분화하여 1차 근구를 근구로 분화시 뮤오튜브로 변경한다. 분화는 전형적으로 4-5일에 의해 완료되고 자발적으로 경련하는 길쭉한, 융합한 세포에 의해 표시됩니다. 6일 이내에 차별화된 myotube에서 실험을 수행합니다. 전형적으로 세포는 분화를 개시한 후 5~6일 후에 분석된다.
5. 96 웰 플레이트에서 근종 또는 Myotubes에서 산소 소비 속도 측정
- 잘 당 코팅 용액의 25 μL와 96 웰 플레이트를 코팅. 플레이트를 58 x g에서 1분 동안 원심분리하여 거품을 제거합니다.
- 4 °C에서 1-4 시간 동안 코팅 용액에 플레이트를 배양하십시오. 다중 채널 파이펫을 사용하여 코팅 용액을 제거하고 차가운 PBS/gentamicin 25 μL에서 세 번 세척하십시오. 이러한 중 하나 이상의 원심분리기는 거품이 갇히지 않도록 합니다.
- 각 웰에 40 μL의 분화 미디어를 추가합니다. 58 x g에서 1 분 동안 세포가없는 코팅 된 플레이트상의 매체를 원심 분리하여 기포를 피하고 표면 장력을 제거하여 균일 한 매체 층을 얻습니다.
- 각 웰에 40 μL의 추가로 부유 된 세포를 추가합니다. 58 x g에서다시 스핀 .
참고: 도금의 일관성은 최상의 결과를 위해 중요하며, 웰당 도금된 셀의 수는 각 실험 설정에 최적화되어야 하며, 96웰 플레이트의 웰당 분화 매체로 도금된 ~10,000-25,000 개의 근강세포 범위에 있을 가능성이 높습니다. - 차별화 하는 동안 매일 미디어를 부드럽게 변경 합니다. 미디어를 흡인하지 말고 피펫으로 제거하여 세포를 떨어지거나 공기에 노출시키지 않도록 작은 볼륨을 남겨 둡자하십시오. 예를 들어, 한 번에 80 μL이 아닌 3회 반복에 대해 한 번에 50 μL을 교체하십시오.
- 조건당 8-15개의 웰을 사용하십시오. 세포가 myotubes의 균일 한 층을 형성하지 않는 경우 일부 우물을 생략 할 필요가있을 수 있습니다.
참고: 증발에 매우 취약하기 때문에 플레이트 가장자리에 우물을 생략하십시오. 체계적인 오류를 방지하기 위해 실험 복제에 대한 플레이트 설정을 변경합니다. - 전체 분화의 1-2 일 이내에 차별화 된 myotube에서 원하는 분석 (분화 시작부터 4-6 일)에서 원하는 분석술을 수행하십시오. 산소 소비율 측정을 위한 권장 기기 및 시약은 재료 표에나와 있습니다.
결과
제공된 프로토콜의 섹션 1에 따라 표준 광 현미경 하에서 볼 수 있는 이식으로부터 나오는 1차 세포를 산출해야한다(도 2). 이기종 세포 인구에서 성장 하 고 각 근육 조직 이식 주위 볼 것 이다. 근체는 작고 둥글고 밝은 구체로 나타납니다. 프로토콜의 섹션 2에 따라 조직 이식에서 조세포의 조기 수확을 얻을 것이다, 이는 몇 가지 세포를 포함하고 이기종 될 것입니다(그림 3). 프로토콜의 섹션 3 PBS와 초기 수확을 통과 설명 (보다는 트립신), 추가 배양에 대 한 myoblasts의 상대적으로 순수한 인구를 제공 합니다. 프로토콜의 섹션 4에 따라 추가 실험 조작을 위해 완전히 차별화 된 myotubes를 얻을 것이다. 근체 세포의 분화는 전형적으로 4-6 일이 걸리며, 그 동안 세포의 형태는 단일 원형 구체에서 길쭉한, 융합된 긴 다중 핵 섬유로 바뀝니다(그림 4). 프로토콜의 섹션 5에 따라 산소 소비 및 세포외 산성화율10의 변화에 기초하여 다양한 대사 특성화를 가능하게 하기 위해 96웰 플레이트에서 분화된 myotube를 생성할것이다(도 5).
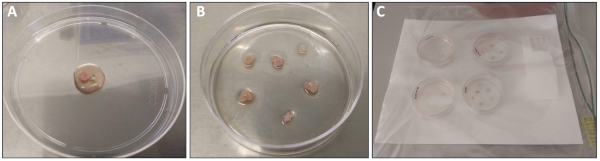
그림 1: 사두근의 해부 및 처리. (A)10cm 접시로 옮기기 전에 PBS로 갓 해부하고 헹구어 온 근육을 사두근. 도금 매체의 1 mL가 처리를 위해 오버레이되었습니다. (B)미리 코팅된 6cm 플레이트로 옮김을 옮김을 옮김으로 옮김을 옮김을 옮김으로 한다. (C)37°C 인큐베이터에 배치하기 전에 습한 챔버 내부에 6 cm 플레이트를 배치하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 근강근의 생후 사두근 근육 이식에서 근구의 자생의 자생. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 초기 통로 근강체. T25 플라스크에 이송 및 부착 후 P0 근강세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 1차 myotube의 도금 및 분화. (A)분화 매체에 노출을 개시한 후 하루 만에 근강유골이 됩니다. (B, C) 차별화된 뮤오튜브5개(B)또는 6일(C) 분화를 개시한 후 일. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
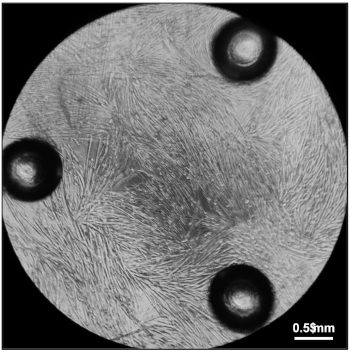
그림 5: 산소 소비율을 측정할 준비가 된 Myotube. 완전히 분화된 묘튜브는 96웰 세포 배양 마이크로플레이트의 각 웰에서 분화 배지에서 20,000개의 조세포체를 도금한 후 5일 후에 완전히 분화되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
골격 근은 대사 항상성의 설립 및 유지보수에 필수적입니다11. 근육 생리학의 연구는 개별적인 가변성에 의해 복잡합니다, 뿐만 아니라 견본을 얻기에 있는 어려움, 특히 인간 적인 연구 결과의 경우에. 배양된 1차 묘튜브는 칼슘 항상성12,손상된 근육 조직 재생5,운동에 대한 반응으로 대사 변경13,및 근육 생리학의 많은 특징을 되풀이하는 것으로 나타났다. 당뇨병과 같은 질병으로 인한 신진 대사에 대한 변경14. 마우스에서 근세포체와 myotubes의 1 차적인 배양은 잘 정의된 유전 조작을 품고 있는 근육 세포의 조사를 가능하게 하고, 인간 근육 생검12,15에서 파생된 myotubes의 연구 결과에 보완을 제공합니다 ,16. 따라서, 마우스 1차 근세포 및 myotubes의 분리 및 배양을 위한 방법은 생체내 근육 세포 기능의 재현성, 높은 처리량 조사를 가능하게 하는 데 필수적이다. 여기에 설명된 프로토콜은 다양한 실험 조작하에서 원발성 마우스 근세포 및 myotubes의 확립 및 연구를 가능하게 한다.
이전 프로토콜은 이식 배양으로부터 근육 줄기 세포의 분리를 설명했지만,이 프로토콜은 여러 가지 유형의 근육 조직에서 근세포를 성공적으로 분리하는 방법을 제공합니다. 또한,이 방법은 추가 실험 조작을위한 줄기 세포의 상당히 큰 인구를 산출한다. 또한, 이 방법은 성숙한 근육세포(17)의마커를 발현하는 분화 된 myotube를 산출하고, 일주기 리듬17 및 미토겐 활성 단백질 키나아제 (MAPK) 신호와 같은 정상적인 생리학을 나타낸다는 것을 입증하였다. 변환18.
프로토콜의 중요한 단계는 근육 조직 이식의 해부 및 처리뿐만 아니라 수확 사이의 오염을 피하는 것입니다. 조직의 과잉 처리를 피하기 위해주의를 기울여야합니다. 근육의 작은 조각 은 근구의 큰 숫자를 산출하는 동안, 근육의 과도한 절단은 줄기 세포 의 성장을 방지 할 수 있습니다. 일단 도금되면 이식을 빼내지 않는 것이 중요하지만, PBS/gentamicin으로 플레이트를 조심스럽게 세척하는 것은 오염을 줄이는 데 매우 중요합니다. 수확된 근세포는 10% DMSO/90% 근강근체 혼합체를 사용하여 저온에서 P2 세포로서 동결될 수 있다. 근강세포는 성장을 촉진하기 위해 고밀도로 유지 될 필요가 없지만 세포가 40-50 % 합류로 동결되는 것이 좋습니다. 전형적으로, 1개의 T75 플라스크는 세포의 4 개의 cryovials를 산출합니다.
공개
없음.
감사의 말
저자는 멜버른 대학의 매튜 와트 박사와 존스 홉킨스 대학의 아나스타샤 크랄리 박사에게 목벨 등의 작업을 기반으로이 프로토콜을 채택하는 데 도움을 주셔서 감사합니다6. 우리는 또한 우리의 실험실에서이 프로토콜을 개발하고 채택하는 데 도움을 준 Sabine Jordan 박사에게 감사드립니다. 이 작품은 K.A.L에 건강 R01s DK097164 및 DK112927의 국립 연구소에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| Coating Solution: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| Collagen | Life Technologies | A1064401 | 1.7 mL |
| Matrigel | Fisher | CB40234A | 1 mL |
| Plating Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 12.5 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 12.5 mL |
| Heat Inactivated FBS | Life Technologies | 16000044 | 20 mL; can be purchased as regular FBS and heat-inactivated by placing in a 40 °C water bath for 20 minutes |
| Amniomax | Life Technologies | 12556023 | 5 mL |
| Myoblast Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 17.5 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 17.5 mL |
| Heat Inactivated FBS | Life Technologies | 16000044 | 10 mL; can be purchased as regular FBS and heat-inactivated by placing in a 40 °C water bath for 20 minutes |
| Amniomax | Life Technologies | 12556023 | 5 mL |
| Differentiation Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| Heat Inactivated Horse Serum | Sigma | H1138 | 1.5 mL |
| Insulin-Selenium-Transferrin | Life Technologies | 41400045 | 0.5 mL |
| Other Materials: | |||
| PBS | Gibco | 14040133 | |
| Gentamicin | Sigma | G1397 | |
| TrypLE | Gibco | 12604013 | |
| DMSO | Sigma | 472301 | Prepare as 10% DMSO in Myoblast Media for freezing cells |
| Forceps | Any | ||
| Razor Blades | Any | ||
| Scissors | Any | ||
| Whatman paper | VWR | 21427-648 | |
| 60 mm plate | VWR | 734-2318 | |
| 10 cm plate | VWR | 25382-428 (CS) | |
| T25 Flasks | ThermoFisher | 156367 | |
| T75 Flasks | ThermoFisher | 156499 | |
| Centrifuge Tubes (15mL) | BioPioneer | CNT-15 | |
| Oxygen Consumption Rates: | |||
| Seahorse XFe96 Analyzer | Agilent | Seahorse XFe96 Analyzer | Instrument used to measure oxygen consumption rates read out by acidification of the extracellular media |
| Seahorse XFe96 FluxPak | Agilent | 102416-100 | 96-well plates for use in XFe96 Analyzer |
| Seahorse XF Cell Mito Stress Test Kit | Agilent | 103015-100 | components may be purchased from other suppliers once assay is established; some recommendations are listed below |
| Seahorse XF Palmitate-BSA FAO substrate | Agilent | 102720-100 | components may be purchased from other suppliers once assay is established; some recommendations are listed below |
| Palmitic acid | Sigma | P5585-10G | for measurement of fatty acid oxidation |
| carnitine | Sigma | C0283-5G | for measurement of fatty acid oxidation |
| Etomoxir | Sigma | E1905 | for measurement of fatty acid oxidation |
| BSA | Sigma | A7030 | used as control or in conjugation with palmitic acid for use in measurement of fatty acid oxidation |
참고문헌
- Srikanthan, P., Karlamangla, A. S. Muscle mass index as a predictor of longevity in older adults. American Journal of Medicine. 127 (6), 547-553 (2014).
- Lee-Young, R. S., Kang, L., Ayala, J. E., Wasserman, D. H., Fueger, P. T. The physiological regulation of glucose flux into muscle in vivo. Journal of Experimental Biology. 214 (2), 254-262 (2010).
- Sjøberg, K. A., et al. Exercise increases human skeletal muscle insulin sensitivity via coordinated increases in microvascular perfusion and molecular signaling. Diabetes. 66 (6), 1501-1510 (2017).
- Girgis, C. M., Clifton-Bligh, R. J., Mokbel, N., Cheng, K., Gunton, J. E. Vitamin D signaling regulates proliferation, differentiation, and myotube size in C2C12 skeletal muscle cells. Endocrinology. 155 (2), 347-357 (2014).
- Smith, J., Merrick, D. Embryonic skeletal muscle microexplant culture and isolation of skeletal muscle stem cells. Methods in Molecular Biology. 633, 29-56 (2010).
- Mokbel, N., et al. K7del is a common TPM2 gene mutation associated with nemaline myopathy and raised myofibre calcium sensitivity. Brain. 136 (2), 494-507 (2013).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1977).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. Journal of Cell Biology. 125 (6), 1275-1287 (1994).
- Musarò, A., Carosio, S. Isolation and Culture of Satellite Cells from Mouse Skeletal Muscle. Methods in Molecular Biology. 1553, 155-167 (2017).
- Smolina, N., Bruton, J., Kostareva, A., Sejersen, T. Assaying mitochondrial respiration as an indicator of cellular metabolism and fitness. Methods in Molecular Biology. 1601, 79-87 (2017).
- Elliott, B., Renshaw, D., Getting, S., Mackenzie, R. The central role of myostatin in skeletal muscle and whole body homeostasis. Acta Physiologica. 205 (3), 324-340 (2012).
- Smolina, N., Kostareva, A., Bruton, J., Karpushev, A., Sjoberg, G., Sejersen, T. Primary murine myotubes as a model for investigating muscular dystrophy. BioMed Research International. , (2015).
- Nedachi, T., Fujita, H., Kanzaki, M. Contractile C 2 C 12 myotube model for studying exercise-inducible responses in skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 295 (5), E1191-E1204 (2008).
- Chen, M. B., et al. Impaired activation of AMP-kinase and fatty acid oxidation by globular adiponectin in cultured human skeletal muscle of obese type 2 diabetics. Journal of Clinical Endocrinology and Metabolism. 90 (6), 3665-3672 (2005).
- Douillard-Guilloux, G., Mouly, V., Caillaud, C., Richard, E. Immortalization of murine muscle cells from lysosomal α-glucosidase deficient mice: A new tool to study pathophysiology and assess therapeutic strategies for Pompe disease. Biochemical and Biophysical Research Communications. 388 (2), 333-338 (2009).
- Varga, B., et al. Myotube elasticity of an amyotrophic lateral sclerosis mouse model. Scientific Reports. 8 (1), 5917 (2018).
- Kriebs, A., et al. Circadian repressors CRY1 and CRY2 broadly interact with nuclear receptors and modulate transcriptional activity. Proceedings of the National Academy of Sciences. 114 (33), 8776-8781 (2017).
- Cho, Y., et al. Perm1 enhances mitochondrial biogenesis, oxidative capacity, and fatigue resistance in adult skeletal muscle. FASEB Journal. 30 (2), 674-687 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유