Method Article
Isolement et différenciation des myoblastes primaires des explantations de muscle squelettique de souris
Dans cet article
Résumé
Les myoblastes sont des cellules précurseurs proliférantes qui se différencient pour former des myotubes polynucléés et éventuellement des myofibres musculaires squelettiques. Ici, nous présentons un protocole pour l'isolement efficace et la culture des myoblastes primaires des muscles squelettiques de souris jeunes adultes. La méthode permet des études moléculaires, génétiques et métaboliques des cellules musculaires en culture.
Résumé
Les myoblastes primaires sont des précurseurs proliférants indifférenciés du muscle squelettique. Ils peuvent être cultivés et étudiés comme précurseurs musculaires ou induits à se différencier en stades ultérieurs du développement musculaire. Le protocole fourni ici décrit une méthode robuste pour l'isolement et la culture d'une population fortement proliférante des cellules de myoblast des explants de muscle squelettique de souris de jeune adulte. Ces cellules sont utiles pour l'étude des propriétés métaboliques du muscle squelettique de différents modèles de souris, ainsi que dans d'autres applications en aval telles que la transfection avec l'ADN exogène ou la transduction avec des vecteurs d'expression virale. Le niveau de différenciation et le profil métabolique de ces cellules dépend de la durée d'exposition, et la composition des médias utilisés pour induire la différenciation du myoblaste. Ces méthodes fournissent un système robuste pour l'étude du métabolisme des cellules musculaires de la souris ex vivo. Fait important, contrairement aux modèles in vivo, les méthodes décrites ici fournissent une population cellulaire qui peut être élargie et étudiée avec des niveaux élevés de reproductibilité.
Introduction
Bien que souvent cité comme une indication de la santé métabolique globale, de multiples études ont montré que l'indice de masse corporelle (IMC) chez les personnes âgées n'est pas systématiquement associée à un risque plus élevé de mortalité. À ce jour, le seul facteur démontré compatible avec la réduction de la mortalité dans cette population est l'augmentation de la masse musculaire1. Le tissu musculaire représente l'une des plus grandes sources de cellules sensibles à l'insuline dans le corps, et est donc critique dans le maintien de l'homéostasie métabolique globale2. L'activation du tissu musculaire squelettique par l'exercice est associée à des augmentations de la sensibilité locale à l'insuline et de la santé métabolique globale3. Alors que les modèles in vivo sont essentiels pour étudier la physiologie musculaire et l'impact de la fonction musculaire sur le métabolisme intégré, les cultures primaires des myotubes fournissent un système tractable qui réduit la complexité des études animales.
Les myoblastes dérivés des muscles postnatals peuvent être utilisés pour étudier l'impact de nombreux traitements et conditions de croissance d'une manière hautement reproductible. Cela a longtemps été reconnu et plusieurs méthodes pour l'isolement et la culture du myoblaste ont été décrits4,5,6,7,8,9. Certaines de ces méthodes utilisent des muscles néonatals et produisent un nombre relativement faible de myoblastes5,8, nécessitant plusieurs animaux pour des études à plus grande échelle. En outre, les méthodes les plus largement utilisées pour cultiver les myoblastes utilisent le « pré-plaquage » pour enrichir les myoblastes, qui sont moins adhérents que les autres types de cellules. Nous avons trouvé la méthode alternative d'enrichissement décrite ici comme étant beaucoup plus efficace et reproductible pour enrichir une population de myoblastes hautement proliférante. En résumé, ce protocole permet l'isolement des myoblastes hautement proliférants des explants musculaires de jeunes adultes, par l'intermédiaire de la croissance dans les médias culturels. Les myoblastes peuvent être récoltés à plusieurs reprises, sur plusieurs jours, rapidement élargis, et induits à se différencier en myotubes. Ce protocole génère reproductiblement un grand nombre de cellules de myoblaste saines qui se différencient solidement en myotubes secousses spontanément. Il nous a permis d'étudier le métabolisme et les rythmes circadiens dans les myotubes primaires des souris d'une variété de génotypes. Enfin, nous incluons des méthodes pour préparer les myotubes pour l'étude du métabolisme oxydatif, en utilisant des mesures des taux de consommation d'oxygène dans les plaques de 96 puits.
Protocole
Ce protocole suit les directives de soins aux animaux de Scripps Research.
1. Collecte et traitement des explants de tissu musculaire
- La veille de la dissection, stériliser tous les équipements de dissection (forceps, lames de rasoir et ciseaux) et préparer tous les supports requis : saline tamponnée en phosphate (PBS), mb Placage (12,5 mL de DMEM, 12,5 mL de HAMS F12, 20 mL de bovins fœtaux inactivés par la chaleur sérum (FBS), 5 mL de supplément moyen de liquide amniotique), et solution de revêtement (24 ml de DMEM, 24 ml de HAMS F12, 1,7 ml de collagène, 1 ml de matrigel).
- Le jour de la dissection, enrober un plat de 6 cm avec la solution de revêtement pour chaque muscle à disséquer. Ajouter 2 ml de solution de revêtement à la surface de chaque plaque, secouer doucement pour créer une couche uniforme sur la surface, et couver les plaques avec une solution à 4 oC pendant 1 h.
- Retirez la solution de revêtement des plaques et retournez à la solution de stock.
REMARQUE: La solution de revêtement peut être réutilisée jusqu'à six mois et doit être stockée à 4 oC. - Rincer les plaques deux fois avec 2 ml de PBS pour enlever le collagène et le matrigel non liés.
- Placer les plaques dans un incubateur de culture tissulaire de 37 oC pendant les dissections.
- Préparer une chambre humide en plaçant 2-3 feuilles de papier absorbant épais dans un sac en plastique ou un plat stérile de 15 cm et utiliser une pipette pour mouiller la surface du papier avec de l'eau stérile.
- Placer la chambre sous la lumière UV pendant 5 min pour stériliser.
- Disséquer les muscles désirés d'une souris de 4 à 8 semaines. Pour stériliser les tissus musculaires, rincer délicatement dans le PBS contenant 40 g/mL de gentamicine.
REMARQUE: Pour les quadriceps et les muscles gastrocnemius, plaquer un muscle par plaque. Pour le soleus, les plantaris et l'EDL, combinez les muscles des deux jambes dans une seule assiette. - Utilisez des forceps stériles pour transférer le muscle dans un plat stérile de 10 cm de Petri non enrobé. Ajouter 0,5-1,0 ml de support de placage sur le muscle de telle sorte que le tissu est humide mais pas flottant (Figure 1A).
- Utilisez un scalpel stérile ou une lame de rasoir pour trancher délicatement le muscle en petits fragments (environ 1-3 mm3).
REMARQUE: Il est important de minimiser la manipulation du tissu musculaire pour de meilleurs résultats. - Utilisez des forceps ou une pipette pour transférer les fragments musculaires sur la surface d'une plaque pré-enduite de 6 cm. Très doucement recenser un 0,8 ml supplémentaire de Placage De médias sur le tissu. Il devrait y avoir suffisamment de médias pour garder les morceaux de tissu hydratés mais pas flottants (Figure 1B).
- Placer les plats de 6 cm contenant les fragments musculaires à l'intérieur de la chambre humide et retourner dans un incubateur (37 oC, 5 % DE CO2) pendant 48 h(figure 1C).
REMARQUE: Il est essentiel que des fragments de muscle adhèrent à la surface de la plaque pour permettre la prolifération des myoblastes. Ne déplacez pas les plaques/chambre pendant au moins 48 h. - Après 48 h, vérifiez soigneusement les plaques pour s'assurer que les fragments de muscle ont adhéré. Recenser avec 2 ml de Placage Media, en prenant soin de ne pas déloger les fragments.
REMARQUE: S'il y a contamination visible ou débris sur les plaques, lavez soigneusement les morceaux de muscle. Plaque 2 mL de pbS/gentamicin solution au bord de la plaque et pointe doucement pour laver le tissu musculaire. Retirez le PBS et répétez l'étape de lavage. Après le deuxième lavage, rectier 2 ml de Placage Media. - Conservez les plaques dans l'incubateur de 37 oC jusqu'à 3 jours supplémentaires (5 jours à partir de la dissection originale) avant de récolter les myoblastes. Vérifiez tous les deux jours pour la croissance des myoblastes.
REMARQUE: L'apparition de cellules émergeant d'explants musculaires sera variable et hétérogène. Les myoblastes primaires apparaissent sous forme de petites cellules rondes et brillantes. Cependant, il n'est ni nécessaire ni fiable de les identifier par leur comparution à ce stade (figure 2).
2. Récolte des myoblastes de croissance
- Préparer et préréchauffer Myoblast Media (17,5 mL de DMEM, 17,5 mL de HAMS F12, 10 mL de FBS, 5 mL de supplément moyen de liquide amniotique), trypsine, et PBS/gentamicin. Enrober un flacon T25 par groupe musculaire récolté avec la solution de revêtement et tel que décrit à l'étape 1.2 (voir tableau 1).
- Enlever les supports de placage et rincer délicatement les épandages musculaires avec 2 ml de PBS/gentamicin. Retirez rapidement PBS (rincer une plaque à la fois et ne laissez pas la plaque s'asseoir dans PBS à cette étape).
- Ajouter délicatement 1 ml de PBS/gentamicin et placer la plaque dans l'incubateur de 37 oC pendant 1 min.
- Utilisez une pipette P1000 pour recueillir des CELLULES PBS/cellules dans un tube de centrifugeuse de 15 ml.
- Ajouter 1 ml de trypsine dans l'assiette et retourner à l'incubateur de 37 oC pendant 3 min. Appuyez doucement sur les plaques pour déloger les myoblastes. Recueillir la trypsine / cellules et combiner avec la collection PBS. Ajouter 8 mL de Myoblast Media au tube de centrifugeuse et inverser délicatement pour mélanger.
- Repondrez délicatement 2 ml de solution de placage sur les plaques musculaires et retournez à l'incubateur de 37 oC.
- Faire tourner les tubes de centrifugeuse contenant des cellules dans une centrifugeuse pendant 3 min à 200 x g.
- Aspirez le supernatant à 1 ml, en prenant soin d'éviter les granulés cellulaires. Ajouter délicatement Myoblast Media (voir tableau 1) et transférer les cellules dans le flacon pré-enduit et placer dans l'incubateur de 37 oC. C'est la récolte P0. S'ils sont observés au microscope, il peut y avoir très peu de cellules (figure 3).
- Répétez la récolte décrite ci-dessus tous les deux jours jusqu'à trois fois. Après la troisième récolte, jeter les explants.
3. Expansion et enrichissement des myoblastes proliférants
REMARQUE: La récolte de P0 sera hétérogène (60% de myoblastes). Les 2 passages suivants utilisent PBS pour récolter sélectivement les myoblastes. Beaucoup des cellules les plus adhérentes seront laissées pour compte et les myoblastes qui prolifèrent rapidement seront purs à 95 % dans les 2 passages. Une fois que les myoblastes sont établis, ils doivent être maintenus à une faible densité pour éviter la différenciation spontanée.
- Pour chaque flacon T25 de 40 à 50 % de cellules confluentes de la section 2, enrober un flacon T75 de 5 ml de solution de revêtement et placer à 4 oC pendant 1 à 4 h.
- Retirez la solution de revêtement des flacons et retournez à la solution de stock. Rincer les flacons deux fois avec 2 ml de PBS/gentamicin et les placer dans l'incubateur de 37 oC.
- Aspirez les médias des flacons de myoblaste T25 de P0. Rincer brièvement les cellules avec 2 ml de PBS/gentamicin chaud. Aspirez PBS à partir du flacon.
REMARQUE: Le but de cette étape (3.3) est de réduire la possibilité de contamination bactérienne. S'il est exécuté rapidement et doucement, il ne devrait pas entraîner la perte de myoblastes. Il peut être omis pour maximiser la préservation du myoblaste si désiré. - Pipette 2 mL de PBS chaud (pas trypsine) dans chaque flacon contenant des myoblastes. Placer les flacons avec du PBS dans l'incubateur de 37 oC pendant 3 min.
REMARQUE: Les myoblastes doivent facilement se détacher des flacons avec PBS. L'utilisation de PBS plutôt que la trypsine à cette étape est essentielle pour réduire la contamination de la population de myoblastes avec d'autres types de cellules. - Retirez les cellules de l'incubateur de 37 oC et appuyez fermement sur le côté des flacons pour déloger les cellules. Vérifiez sous un microscope léger pour les myoblastes flottants librement.
- Placez les flacons debout dans une hotte de culture tissulaire et rincez le fond des flacons avec 10 ml de Myoblast Media 2-3 fois pour s'assurer que toutes les cellules sont délogées.
- Recueillir le mélange cellulaire/média dans un tube centrifugeur de 15 ml. Centrifugeuse de 3 min à 200 x g.
- Aspirer le support à environ 1 ml, en prenant soin d'éviter la pastille cellulaire. Ajouter délicatement un volume approprié de Myoblast Media au tube de centrifugeuse et mélanger délicatement.
- Distribuer le mélange cellulaire dans de nouveaux flacons T75. Ajouter 10 ml de Myoblast Media à chaque nouveau flacon T75. Secouez doucement les flacons horizontalement pour répartir les cellules et placez-les dans l'incubateur de 37 oC pendant la nuit.
- Deux jours plus tard, passage une fois de plus avec PBS, le fractionnement de chaque flacon T75 en trois flacons T75.
REMARQUE: Ne laissez pas les myoblastes devenir plus de 50%-60% confluents, car cela les amènerait à commencer à se différencier et à perdre la capacité prolifaterive. - Pour d'autres passages, utilisez la trypsine. Passaging deux fois avec des rendements PBS '95% myoblastes; les tentatives d'améliorer encore la pureté ont tendance à se traduire par une plus faible différenciation.
4. Différenciation des myoblastes primaires aux myotubes
- Plaque P2 (ou passage ultérieur) myoblastes dans Myoblast Media sur plaques enduites (voir le tableau 1 pour les volumes de revêtement et de placage suggérés et les numéros de cellules). Deux ou trois jours plus tard, lorsque les cellules sont à 70-80% de confluence, changer le média à Differentiation Media (24 mL de DMEM, 24 mL de HAMS F12, 1,5 mL de sérum de cheval inactivé par la chaleur, 0,5 ml d'insuline-sélénium-transferrin).
- Changer les médias de différenciation tous les deux jours lors de la différenciation des myoblastes primaires en myotubes. La différenciation est généralement complète par jour 4-5 et sera marquée par allongée, cellules fusionnées qui se contractent spontanément. Effectuez des expériences sur des myotubes différenciés dans les 6 jours. Typiquement, les cellules sont astoyées cinq ou six jours après avoir initié la différenciation.
5. Mesurer le taux de consommation d'oxygène dans les myoblastes ou les myotubes dans 96 puits Plates
- Enrober les plaques de 96 puits d'une solution de revêtement de 25 l par puits. Centrifuger les plaques à 58 x g pendant 1 min pour enlever les bulles.
- Incuber les plaques dans une solution de revêtement de 1 à 4 h à 4 oC. Utilisez une pipette multicanal pour enlever la solution de revêtement et lavez-les trois fois dans 25 L de PBS/gentamicin froid. Centrifugeau au moins un de ces lavages pour s'assurer qu'aucune bulle n'est emprisonnée.
- Ajouter 40 lde de médias de différenciation à chaque puits. Centrifuger le support sur la plaque enduite sans cellules pendant 1 min à 58 x g pour éviter les bulles et enlever la tension de surface pour obtenir une couche uniforme de médias.
- Ajouter les cellules suspendues dans 40 l de supports supplémentaires à chaque puits. Tourner à nouveau à 58 x g.
REMARQUE: La cohérence dans le placage est importante pour de meilleurs résultats et le nombre de cellules plaquées par puits devrait être optimisé pour chaque configuration expérimentale, et sera probablement dans la gamme de 10.000-25.000 myoblastes plaqués dans le support de différenciation par puits d'une plaque de 96 puits. - Changer doucement les médias tous les jours lors de la différenciation. Ne pas aspirer le support, mais plutôt l'enlever avec une pipette, en laissant un petit volume derrière pour éviter de déloger les cellules ou de les exposer à l'air. Par exemple, remplacez 50 L à la fois pendant trois répétitions plutôt que les 80 l à la fois.
- Utilisez 8-15 puits par condition. Il peut être nécessaire d'omettre certains puits si les cellules ne forment pas une couche uniforme de myotubes.
REMARQUE: Omettre les puits sur les bords de la plaque parce qu'ils sont très sensibles à l'évaporation. Variez la configuration de la plaque pour les répliques expérimentales afin d'éviter les erreurs systématiques. - Effectuer l'analyse désirée sur les myotubes différenciés dans les 1-2 jours de la différenciation complète (Jour 4-6 du début de la différenciation). Les instruments et réactifs recommandés pour la mesure des taux de consommation d'oxygène sont énumérés dans le Tableau des matériaux.
Résultats
La section 1 du protocole fourni devrait produire des cellules primaires issues des explants qui seront visibles sous un microscope léger standard (figure 2). Une population hétérogène de cellules sera vue se développant hors et entourant chaque explante de tissu de muscle. Les myoblastes apparaîtront comme de petites sphères rondes et lumineuses. La section 2 du protocole produira des récoltes précoces de myoblastes à partir d'explants de tissus, qui contiendront peu de cellules et seront hétérogènes (figure 3). La section 3 du protocole décrit le passage des récoltes précoces avec pbS (plutôt que la trypsine), qui fournira une population relativement pure de myoblastes pour la culture ultérieure. La section 4 du protocole produira des myotubes entièrement différenciés pour d'autres manipulations expérimentales. La différenciation des myoblastes prend généralement de 4 à 6 jours, au cours desquels la morphologie des cellules passera de sphères uniques et rondes à des fibres allongées, fusionnées et longues multinucléées (figure 4). La section 5 du protocole produira des myotubes différenciés dans des plaques de 96 puits afin de permettre une variété de caractérisations métaboliques basées sur les changements dans la consommation d'oxygène et les taux d'acidification extracellulaire10 (figure 5).
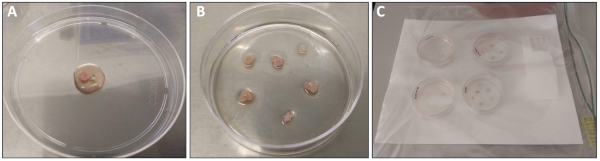
Figure 1 : Dissection et traitement du muscle quadriceps. (A) Quadriceps muscle qui a été fraîchement disséqué et rincé avec PBS avant le transfert à un plat de 10 cm. 1 ml de support de placage a été superposé pour le traitement. (B) Quadriceps morceaux de tissu musculaire après le transfert à la plaque pré-enduite de 6 cm. (C) plaques de 6 cm à l'intérieur de la chambre humide avant le placement dans l'incubateur de 37 oC. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Excroissance des myoblastes. Excroissance des myoblastes des explants musculaires du quadriceps. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Myoblastes de passage précoce. Myoblastes de P0 après transfert et attachement au flacon T25. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Le placage et la différenciation des myotubes primaires. (A) Myoblastes un jour après avoir initié l'exposition aux médias de différenciation. (B,C) Myotubes différenciés cinq (B) ou six (C) jours après l'initiation de la différenciation. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
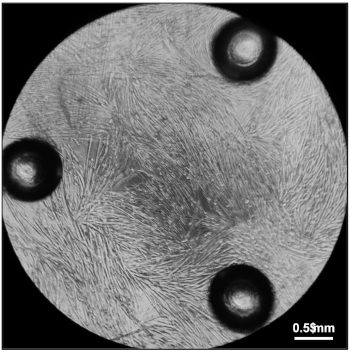
Figure 5 : Myotubes prêts à mesurer les taux de consommation d'oxygène. Myotubes entièrement différenciés cinq jours après placage 20.000 myoblastes dans les médias de différenciation dans chaque puits d'une microplaque de culture cellulaire de 96 puits. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Le muscle squelettique est essentiel pour l'établissement et le maintien de l'homéostasie métabolique11. L'étude de la physiologie musculaire est compliquée par la variabilité interindividuelle, ainsi que par la difficulté d'obtenir des échantillons, en particulier dans le cas des études humaines. Les myotubes primaires cultivés ont été montrés pour récapituler beaucoup de dispositifs de la physiologie de muscle, y compris l'homéostasie de calcium12,régénération du tissu musculaire endommagé5,altérations métaboliques en réponse à l'exercice13,et altérations du métabolisme résultant de maladies telles que le diabète14. La culture primaire des myoblastes et des myotubes de souris permet d'étudier les cellules musculaires hébergeant des manipulations génétiques bien définies, et fournit un complément aux études des myotubes dérivés des biopsies musculaires humaines12,15 ,16. Par conséquent, les méthodes d'isolement et de culture des myoblastes et des myotubes primaires de souris sont essentielles pour permettre l'investigation reproductible et à haut débit de la fonction de cellules musculaires ex vivo. Le protocole décrit ici permet l'établissement et l'étude des myoblastes et des myotubes de souris primaires sous une variété de manipulations expérimentales.
Alors que les protocoles précédents ont décrit l'isolement des cellules souches musculaires des cultures d'explantation, ce protocole fournit une méthode pour l'isolement réussi des myoblastes de plusieurs différents types de tissu musculaire. En outre, cette méthode donne une population significativement plus grande de cellules souches pour une manipulation expérimentale plus poussée. En outre, cette méthode a été validée en tant que myotubes différenciés qui expriment des marqueurs des cellules musculaires matures17, et montrent la physiologie normale, telle que les rythmes circadiens17 et le signal de kinase activé de protéine de mitogène (MAPK) transduction18.
Les étapes critiques du protocole sont la dissection et le traitement des explants des tissus musculaires, ainsi que l'évitement de la contamination entre les récoltes. Il faut prendre soin d'éviter le surtraitement des tissus. Tandis que de plus petits morceaux de muscle produisent un plus grand nombre de myoblastes, la coupe excessive du muscle pourrait empêcher l'excroissance de cellules souches. Bien qu'il soit important de ne pas déloger les explants une fois qu'ils sont plaqués, un lavage soigneux des plaques avec PBS/gentamicin est essentiel pour réduire la contamination. Les myoblastes récoltés peuvent être congelés sous forme de cellules P2 dans des cryovials à l'aide d'un mélange de 10 % de DMSO/90 % Myoblast Media. Bien que les myoblastes n'aient pas besoin d'être maintenus à haute densité pour faciliter la croissance, il est conseillé que les cellules soient congelées à la confluence de 40-50%. Typiquement, un flacon T75 donne 4 cryovials de cellules.
Déclarations de divulgation
aucun.
Remerciements
Les auteurs sont reconnaissants au Dr Matthew Watt de l'Université de Melbourne et au Dr Anastasia Kralli de l'Université Johns Hopkins pour leur aide à adopter ce protocole basé sur les travaux de Mokbel et al.,6. Nous remercions également la Dre Sabine Jordan pour son aide à l'élaboration et à l'adoption de ce protocole dans notre laboratoire. Ces travaux ont été financés par les National Institutes of Health R01s DK097164 et DK112927 à K.A.L.
matériels
| Name | Company | Catalog Number | Comments |
| Coating Solution: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| Collagen | Life Technologies | A1064401 | 1.7 mL |
| Matrigel | Fisher | CB40234A | 1 mL |
| Plating Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 12.5 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 12.5 mL |
| Heat Inactivated FBS | Life Technologies | 16000044 | 20 mL; can be purchased as regular FBS and heat-inactivated by placing in a 40 °C water bath for 20 minutes |
| Amniomax | Life Technologies | 12556023 | 5 mL |
| Myoblast Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 17.5 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 17.5 mL |
| Heat Inactivated FBS | Life Technologies | 16000044 | 10 mL; can be purchased as regular FBS and heat-inactivated by placing in a 40 °C water bath for 20 minutes |
| Amniomax | Life Technologies | 12556023 | 5 mL |
| Differentiation Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| Heat Inactivated Horse Serum | Sigma | H1138 | 1.5 mL |
| Insulin-Selenium-Transferrin | Life Technologies | 41400045 | 0.5 mL |
| Other Materials: | |||
| PBS | Gibco | 14040133 | |
| Gentamicin | Sigma | G1397 | |
| TrypLE | Gibco | 12604013 | |
| DMSO | Sigma | 472301 | Prepare as 10% DMSO in Myoblast Media for freezing cells |
| Forceps | Any | ||
| Razor Blades | Any | ||
| Scissors | Any | ||
| Whatman paper | VWR | 21427-648 | |
| 60 mm plate | VWR | 734-2318 | |
| 10 cm plate | VWR | 25382-428 (CS) | |
| T25 Flasks | ThermoFisher | 156367 | |
| T75 Flasks | ThermoFisher | 156499 | |
| Centrifuge Tubes (15mL) | BioPioneer | CNT-15 | |
| Oxygen Consumption Rates: | |||
| Seahorse XFe96 Analyzer | Agilent | Seahorse XFe96 Analyzer | Instrument used to measure oxygen consumption rates read out by acidification of the extracellular media |
| Seahorse XFe96 FluxPak | Agilent | 102416-100 | 96-well plates for use in XFe96 Analyzer |
| Seahorse XF Cell Mito Stress Test Kit | Agilent | 103015-100 | components may be purchased from other suppliers once assay is established; some recommendations are listed below |
| Seahorse XF Palmitate-BSA FAO substrate | Agilent | 102720-100 | components may be purchased from other suppliers once assay is established; some recommendations are listed below |
| Palmitic acid | Sigma | P5585-10G | for measurement of fatty acid oxidation |
| carnitine | Sigma | C0283-5G | for measurement of fatty acid oxidation |
| Etomoxir | Sigma | E1905 | for measurement of fatty acid oxidation |
| BSA | Sigma | A7030 | used as control or in conjugation with palmitic acid for use in measurement of fatty acid oxidation |
Références
- Srikanthan, P., Karlamangla, A. S. Muscle mass index as a predictor of longevity in older adults. American Journal of Medicine. 127 (6), 547-553 (2014).
- Lee-Young, R. S., Kang, L., Ayala, J. E., Wasserman, D. H., Fueger, P. T. The physiological regulation of glucose flux into muscle in vivo. Journal of Experimental Biology. 214 (2), 254-262 (2010).
- Sjøberg, K. A., et al. Exercise increases human skeletal muscle insulin sensitivity via coordinated increases in microvascular perfusion and molecular signaling. Diabetes. 66 (6), 1501-1510 (2017).
- Girgis, C. M., Clifton-Bligh, R. J., Mokbel, N., Cheng, K., Gunton, J. E. Vitamin D signaling regulates proliferation, differentiation, and myotube size in C2C12 skeletal muscle cells. Endocrinology. 155 (2), 347-357 (2014).
- Smith, J., Merrick, D. Embryonic skeletal muscle microexplant culture and isolation of skeletal muscle stem cells. Methods in Molecular Biology. 633, 29-56 (2010).
- Mokbel, N., et al. K7del is a common TPM2 gene mutation associated with nemaline myopathy and raised myofibre calcium sensitivity. Brain. 136 (2), 494-507 (2013).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1977).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. Journal of Cell Biology. 125 (6), 1275-1287 (1994).
- Musarò, A., Carosio, S. Isolation and Culture of Satellite Cells from Mouse Skeletal Muscle. Methods in Molecular Biology. 1553, 155-167 (2017).
- Smolina, N., Bruton, J., Kostareva, A., Sejersen, T. Assaying mitochondrial respiration as an indicator of cellular metabolism and fitness. Methods in Molecular Biology. 1601, 79-87 (2017).
- Elliott, B., Renshaw, D., Getting, S., Mackenzie, R. The central role of myostatin in skeletal muscle and whole body homeostasis. Acta Physiologica. 205 (3), 324-340 (2012).
- Smolina, N., Kostareva, A., Bruton, J., Karpushev, A., Sjoberg, G., Sejersen, T. Primary murine myotubes as a model for investigating muscular dystrophy. BioMed Research International. , (2015).
- Nedachi, T., Fujita, H., Kanzaki, M. Contractile C 2 C 12 myotube model for studying exercise-inducible responses in skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 295 (5), E1191-E1204 (2008).
- Chen, M. B., et al. Impaired activation of AMP-kinase and fatty acid oxidation by globular adiponectin in cultured human skeletal muscle of obese type 2 diabetics. Journal of Clinical Endocrinology and Metabolism. 90 (6), 3665-3672 (2005).
- Douillard-Guilloux, G., Mouly, V., Caillaud, C., Richard, E. Immortalization of murine muscle cells from lysosomal α-glucosidase deficient mice: A new tool to study pathophysiology and assess therapeutic strategies for Pompe disease. Biochemical and Biophysical Research Communications. 388 (2), 333-338 (2009).
- Varga, B., et al. Myotube elasticity of an amyotrophic lateral sclerosis mouse model. Scientific Reports. 8 (1), 5917 (2018).
- Kriebs, A., et al. Circadian repressors CRY1 and CRY2 broadly interact with nuclear receptors and modulate transcriptional activity. Proceedings of the National Academy of Sciences. 114 (33), 8776-8781 (2017).
- Cho, Y., et al. Perm1 enhances mitochondrial biogenesis, oxidative capacity, and fatigue resistance in adult skeletal muscle. FASEB Journal. 30 (2), 674-687 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon