Method Article
العزلة والتمايز من المقاطع الاساسيه من الماوس الهيكل العظمي العضلات الشرح
In This Article
Summary
وتنتشر الخلايا السلائف التي تفرق لتشكيل myotubes بولينوتيد وألياف عضلية في نهاية المطاف الهيكل العظمي العضلات. هنا ، نقدم بروتوكولا للعزل الفعال وثقافة العضلات الاوليه من عضلات الماوس الكبار الشباب الهيكل العظمي. وتتيح هذه الطريقة الدراسات الجزيئية والجينية والايضيه لخلايا العضلات في الثقافة.
Abstract
العضلات الاوليه هي السلائف التكاثر غير متمايزة للعضلات الهيكل العظمي. ويمكن زراعتها ودراستها كسلائف العضلات أو المستحثة للتمييز في مراحل لاحقه من تطور العضلات. البروتوكول المقدم هنا يصف طريقه قويه للعزل والثقافة من السكان التكاثري للغاية من خلايا ميوبلاست من الشباب الكبار الفار العضلات الهيكل العظمي الشرح. هذه الخلايا هي مفيده لدراسة الخصائص الايضيه للعضلات الهيكل العظمي من نماذج الماوس المختلفة ، وكذلك في التطبيقات المصب الأخرى مثل التحول مع الحمض النووي الخارجية أو محول مع ناقلات التعبير الفيروسي. مستوي التمايز والتمثيل الأيضي لهذه الخلايا يعتمد علي طول التعرض ، وتكوين وسائل الاعلام المستخدمة للحث علي التمايز ميوبلاست. توفر هذه الطرق نظام قوي لدراسة الخلية العضلية الماوس التمثيل الغذائي السابق الجسم الحيوي. الأهم من ذلك ، علي عكس النماذج المجرية ، توفر الطرق الموصوفة هنا عدد الخلايا التي يمكن توسيعها ودراستها مع مستويات عاليه من الاستنساخ.
Introduction
في حين غالبا ما يستشهد كمؤشر علي الصحة الايضيه الشاملة, وقد أظهرت دراسات متعددة ان مؤشر كتله الجسم (BMI) في كبار السن لا يرتبط باستمرار مع ارتفاع خطر الوفاات. حتى الآن ، والعامل الوحيد الذي يظهر ان تكون متسقة مع انخفاض معدل الوفاات في هذه الفئة السكانية زيادة كتله العضلات1. الانسجه العضلية تمثل واحده من أكبر مصادر الخلايا الحساسة للانسولين في الجسم ، التالي حاسمه في الحفاظ علي التوازن الأيضي العام2. ويرتبط تفعيل انسجه العضلات الهيكل العظمي عن طريق ممارسه الزيادات في كل من حساسية الانسولين المحلية والصحة الايضيه العامة3. بينما في النماذج المجرية ضرورية لدراسة فسيولوجيا العضلات وتاثير وظيفة العضلات علي الأيض المتكاملة, الثقافات الاوليه من myotubes توفير نظام عريكة التي تقلل من تعقيد الدراسات الحيوانية.
يمكن استخدام العضلات المستمدة من عضلات ما بعد الولادة لدراسة تاثير العديد من ظروف العلاج والنمو بطريقه قابله للتكرار بشكل كبير. وقد تم الاعتراف بهذا منذ فتره طويلة وتم وصف عده طرق للعزل والثقافة ميوبلاست4,5,6,7,8,9. بعض هذه الطرق استخدام عضلات حديثي الولادة وتسفر عن اعداد منخفضه نسبيا من المقاطعات5,8, تتطلب العديد من الماشية للدراسات علي نطاق أوسع. أيضا ، تستخدم الطرق الأكثر استخداما لزراعه المقاطع العضلية "ما قبل الطلاء" لإثراء المقاطع العضلية ، التي هي اقل تمسكا من أنواع الخلايا الأخرى. وقد وجدنا ان طريقه الإثراء البديلة الموصوفة هنا لتكون أكثر كفاءه واستنساخا لإثراء السكان الميبلاست التكاثريين. وباختصار ، فان هذا البروتوكول يمكن عزل المقاطع العضلية التكاثرية العالية من الشباب البالغين من العضلات المفسرة ، عبر النمو في وسائل الاعلام الثقافية. يمكن حصاد المقاطع العضلية بشكل متكرر ، علي مدي عده أيام ، وتوسيعها بسرعة ، والتي تحفز علي التفريق في myotubes. هذا البروتوكول التكرار يولد عددا كبيرا من خلايا ميوبلاست صحية التي تفرق بقوة في الوخز التلقائي myotubes. وقد مكنتنا من دراسة الأيض وإيقاعات الايقاعيه في myotubes الابتدائية من الفئران من مجموعه متنوعة من الأنماط الجينية. وأخيرا ، ونحن تشمل أساليب لاعداد myotubes لدراسة الأيض التاكسدي ، وذلك باستخدام قياسات معدلات استهلاك الأوكسجين في لوحات 96-بئر.
Protocol
يتبع هذا البروتوكول إرشادات الرعاية الحيوانية لأبحاث سكريبس.
1. جمع ومعالجه الانسجه العضلية الشرح
- في اليوم السابق لتشريح ، تعقيم جميع معدات تشريح (ملقط ، شفرات الحلاقة ، ومقص) واعداد جميع وسائل الاعلام المطلوبة: الفوسفات مخزنه المالحة (تلفزيوني) ، ميغابايت تصفيح وسائل الاعلام (12.5 مل من DMEM ، 12.5 mL من همس F12 ، 20 مل من البقري الجنين الحرارة المعطلة مصل ([دم]), 5 [مل] من [امنيوسلس] سائل ملحق متوسطه), ويكسو حل (24 [مل] من [دميم], 24 [مل] من [همس] F12, 1.7 مل من كولاجين, 1 [مل] من [متريجل]).
- يوم تشريح ، معطف واحد 6-سم طبق مع طلاء الحل لكل العضلات ليتم تشريحها. أضافه 2 مل من الحل طلاء علي سطح كل لوحه ، يهز بلطف لإنشاء معطف حتى علي السطح ، واحتضان لوحات مع الحل في 4 درجه مئوية ل 1 ح.
- أزاله طلاء الحل من لوحات والعودة إلى حل الأسهم.
ملاحظه: طلاء الحل يمكن أعاده استخدامها لمده تصل إلى سته أشهر ، وينبغي ان تخزن في 4 درجه مئوية. - شطف لوحات مرتين مع 2 مل من تلفزيوني لأزاله الكولاجين غير منضم والأمومي.
- وضع لوحات في الحاضنة 37 درجه مئوية الانسجه ثقافة اثناء التفكيك.
- اعداد غرفه رطبه عن طريق وضع 2-3 ورقه من الورق السميك ماصه في كيس من البلاستيك أو طبق معقم 15 سم واستخدام ماصه لترطيب سطح الورقة مع الماء المعقم.
- وضع الغرفة تحت ضوء الاشعه فوق البنفسجية لمده 5 دقائق لتعقيم.
- تشريح العضلات المطلوبة من الماوس 4 إلى 8 أسابيع القديمة. لتعقيم الانسجه العضلية ، شطف برفق في التلفزيونية التي تحتوي علي 40 ميكروغرام/مل جنتاميسين.
ملاحظه: للعضلات الرباعية وعضلات المعدة ، لوحه واحده العضلات لكل لوحه. لل soleus ، بلاريس و EDL ، الجمع بين العضلات من كلا الساقين في لوحه واحده. - استخدم ملقطا معقما لنقل العضلات إلى طبق بيتري غير مغطي بالمعقم بطول 10 سم. أضافه 0.5-1.0 مل من وسائل الاعلام تصفيح علي العضلات بحيث الانسجه رطبه ولكن ليس العائمة (الشكل 1A).
- استخدم مشرط معقم أو شفره حلاقه لتقطيع العضلة برفق إلى أجزاء صغيره (حوالي 1-3 مم3).
ملاحظه: من المهم التقليل من التعامل مع الانسجه العضلية للحصول علي أفضل النتائج. - استخدام ملقط أو ماصه لنقل شظايا العضلات علي سطح لوحه 6 سم المغلفة مسبقا. تراكب بلطف جدا اضافيه 0.8 mL من وسائل الاعلام تصفيح علي الانسجه. يجب ان يكون هناك ما يكفي من وسائل الاعلام للحفاظ علي قطع الانسجه رطبه ولكن ليس العائمة (الشكل 1ب).
- وضع الاطباق 6 سم التي تحتوي علي شظايا العضلات داخل غرفه رطبه والعودة إلى حاضنه (37 درجه مئوية ، 5 ٪ CO2) ل 48 h (الشكل 1ج).
ملاحظه: فمن المهم ان أجزاء العضلات الانضمام إلى سطح لوحه للسماح لنمو ميوبلاست. لا تتحرك لوحات/غرفه لمده لا تقل عن 48 h. - بعد 48 h ، تحقق بعناية لوحات للتاكد من ان شظايا العضلات قد انضمت. تراكب مع 2 مل من وسائل الاعلام تصفيح ، مع الحرص علي عدم أزاحه شظايا.
ملاحظه: إذا كان هناك تلوث مرئية أو الحطام علي لوحات ، وغسل بعناية قطع العضلات. لوحه 2 مل من الحل التلفزيوني/جنتاميسين علي حافه لوحه وغيض بلطف لغسل أكثر من الانسجه العضلية. أزاله التلفزيونية وكرر خطوه الغسيل. بعد غسل الثانية ، تراكب 2 مل من وسائل الاعلام تصفيح. - الحفاظ علي لوحات في الحاضنة 37 درجه مئوية لمده تصل إلى 3 أيام اضافيه (5 أيام من تشريح الأصلي) قبل حصاد الأقاليم العضلية. تحقق من كل يوم للحصول علي النمو من الأقاليم العضلية.
ملاحظه: سيكون ظهور الخلايا الناشئة من الشرح العضلات متغير وغير متجانسة. تظهر المقاطع الاساسيه كخلايا صغيره مستديرة وساطعه. غير انه ليس من الضروري ولا من الموثوق به تحديدها بظهورها في هذه المرحلة (الشكل 2).
2. حصاد المحاصيل الأكثر نموا
- اعداد وقبل الحارة Myoblast وسائل الاعلام (17.5 mL من DMEM ، 17.5 مل من لحم الخنزير F12 ، 10 مل من السائل ، 5 مل من الملحق المتوسطة السوائل السلوى) ، التريبسين ، والتلفزيونية/جنتاميسين. معطف واحد T25 قارورة لكل مجموعه العضلات يجري حصادها مع طلاء الحل وكما هو موضح في الخطوة 1.2 (انظر الجدول 1).
- أزاله وسائل الاعلام الطلاء وشطف بلطف الشرح العضلات مع 2 مل من تلفزيوني/جنتاميسين. بسرعة أزاله تلفزيوني (شطف لوحه واحده في كل مره ولا تدع لوحه الجلوس في الاذاعه التلفزيونية في هذه الخطوة).
- أضافه برفق 1 مل من تلفزيوني/جنتاميسين ووضع لوحه في 37 درجه مئوية حاضنه لمده 1 دقيقه.
- استخدام ماصه P1000 لجمع تلفزيوني/الخلايا في أنبوب الطرد المركزي 15 مل.
- أضافه 1 مل من التريبسين إلى لوحه والعودة إلى الحاضنة 37 درجه مئوية لمده 3 دقائق. انقر برفق علي اللوحات لأزاحه المقاطع العضلية. جمع التريبسين/الخلايا والجمع بين مع مجموعه التلفزيونية الخاصة. أضافه 8 مل من وسائل الاعلام Myoblast إلى أنبوب الطرد المركزي وعكس بلطف لخلط.
- تراكب بلطف 2 مل من الحل تصفيح علي لوحات العضلات والعودة إلى حاضنه 37 درجه مئوية.
- تدور أنابيب الطرد المركزي التي تحتوي علي خلايا في جهاز الطرد المركزي لمده 3 دقائق في 200 x g.
- يستنشق ماده طافي إلى ~ 1 مل ، وتوخي الحذر لتجنب بيليه الخلية. برفق أضافه Myoblast وسائل الاعلام (انظر الجدول 1) ونقل الخلايا إلى قارورة قبل المغلفة ومكان في الحاضنة 37 درجه مئوية. هذا حصاد P0 إذا لوحظ تحت المجهر ، قد يكون هناك عدد قليل جدا من الخلايا (الشكل 3).
- كرر الحصاد الموصوف أعلاه كل يوم حتى ثلاث مرات. بعد الحصاد الثالث ، وتجاهل الشرح.
3-توسيع وإثراء الأقاليم المنتشرة
ملاحظه: سيكون الحصاد P0 غير متجانسة (~ 60 ٪ myoblasts). التالي 2 الممرات استخدام تلفزيوني لحصاد انتقائي الأقاليم. سيتم ترك العديد من الخلايا أكثر تمسكا وراء وسوف تكون المقاطع السريعة التكاثر ≥ 95 ٪ نقيه داخل 2 الممرات. وبمجرد إنشاء الأقاليم ، ينبغي الحفاظ عليها بكثافة منخفضه لتجنب التفريق العفوي.
- لكل قارورة T25 من ~ 40-50 ٪ متموج الخلايا من القسم 2 ، معطف واحد T75 قارورة مع 5 مل من محلول الطلاء ومكان في 4 درجه مئوية ل 1-4 h.
- أزاله طلاء الحل من قوارير والعودة إلى حل الأوراق المالية. شطف قوارير مرتين مع 2 مل من تلفزيوني/جنتاميسين ومكان في الحاضنة 37 درجه مئوية.
- يستنشق وسائل الاعلام من P0 ميوبلاست T25 قوارير. شطف الخلايا لفتره وجيزة مع 2 مل من تلفزيونيه الدافئة/جنتاميسين. الشفط التلفزيوني من القارورة.
ملاحظه: الغرض من هذه الخطوة (3.3) هو الحد من امكانيه التلوث البكتيري. إذا أجريت بسرعة وبلطف ، فانه لا ينبغي ان يؤدي إلى فقدان الأقاليم. ويمكن حذفه لتعظيم المحافظة ميوبلاست إذا رغبت في ذلك. - ماصه 2 مل من تلفزيونيه الدافئة (وليس التريبسين) في كل قارورة تحتوي علي الأقاليم. وضع قوارير مع تلفزيوني في حاضنه 37 درجه مئوية لمده 3 دقائق.
ملاحظه: يجب ان تنفصل المقاطع العضلية بسهوله عن القوارير مع الاذاعه التلفزيونية. استخدام تلفزيوني بدلا من التريبسين في هذه الخطوة أمر بالغ الاهميه للحد من تلوث السكان ميوبلاست مع أنواع الخلايا الأخرى. - أزاله الخلايا من الحاضنة 37 درجه مئوية وبحزم الصنبور الجانب من قوارير لأزاحه الخلايا. تحقق تحت المجهر الضوئي للأقاليم العائمة بحريه.
- وضع قوارير تستقيم في غطاء النسيج الثقافي وشطف الجزء السفلي من قوارير مع 10 مل من Myoblast وسائل الاعلام 2-3 مرات لضمان يتم فك جميع الخلايا.
- جمع الخلية/مزيج الوسائط في أنبوب الطرد المركزي 15 مل. الطرد المركزي لمده 3 دقائق في 200 x g.
- يستنشق وسائل الاعلام إلى حوالي 1 مل ، وتوخي الحذر لتجنب بيليه الخلية. برفق أضافه حجم مناسب من Myoblast وسائل الاعلام إلى أنبوب الطرد المركزي ومزيج بلطف.
- توزيع خليط الخلية إلى قوارير T75 الجديدة. أضافه 10 مل من وسائل الاعلام Myoblast لكل قارورة T75 جديده. يهز برفق قوارير أفقيا لتوزيع الخلايا ومكان في الحاضنة 37 درجه مئوية بين عشيه وضحيها.
- بعد يومين ، والمرور مره أخرى مع تلفزيوني ، وتقسيم كل قارورة T75 إلى ثلاثه قوارير T75.
ملاحظه: لا تسمح الأقاليم لتصبح أكثر من 50 ٪-60 ٪ متموج ، لان هذا من شانه ان يسبب لهم لبدء التفريق وفقدان القدرة البروليفاتيريفيه. - لمقاطع اضافيه ، استخدم التريبسين. المرور مرتين مع عوائد تلفزيونيه > 95% المقاطع العضلية; محاولات لزيادة تحسين النقاء يميل إلى ان يؤدي إلى التمايز الأكثر فقرا.
4-التفريق بين الأقاليم الاساسيه والmyotubes
- اللوحة P2 (أو المرور لاحقا) المقاطع العضلية في Myoblasts Media علي لوحات مغلفه (انظر الجدول 1 للحصول علي الطلاء المقترح واحجام الطلاء وأرقام الخلايا). يومين أو ثلاثه أيام في وقت لاحق ، عندما تكون الخلايا في 70-80 ٪ كونفلوينسي ، تغيير وسائل الاعلام إلى وسائل الاعلام التمايز (24 مل من DMEM ، 24 مل من لحم الخنزير F12 ، 1.5 مل من الحرارة المصل الحصان المنشط ، 0.5 مل من الانسولين-السيلينيوم-ترانسفيرين).
- تغيير وسائل الاعلام التمايز كل يوم خلال التفريق بين الأقاليم الاساسيه في myotubes. وعاده ما تكتمل التمايز بحلول يوم 4-5 سيتم وضع علامة عليها من قبل الخلايا ممدود ، تنصهر التي نشل تلقائيا. اجراء تجارب علي myotubes المتمايزة في غضون 6 أيام. وعاده ما يتم التخفيف من الخلايا بعد خمسه أو سته أيام من بدء التمايز.
5. قياس معدل استهلاك الأكسجين في المقاطع أو Myotubes في لوحات 96-بئر
- معطف 96 لوحات جيدا مع 25 μL من محلول الطلاء لكل بئر. الطرد المركزي لوحات في 58 x g لمده 1 دقيقه لأزاله اي فقاعات.
- احتضان لوحات في محلول الطلاء ل 1-4 h في 4 ° c. استخدم الماصة متعددة القناات لأزاله محلول الطلاء واغسل ثلاث مرات في 25 μL من الباردة التلفزيونية/جنتاميسين. أجهزه الطرد المركزي علي الأقل واحده من هذه يغسل لضمان عدم وجود فقاعات المحاصرين.
- أضافه 40 μL من وسائل الاعلام التمايز لكل بئر. الطرد المركزي وسائل الاعلام علي لوحه المغلفة مع عدم وجود خلايا لمده 1 دقيقه في 58 x g لتجنب فقاعات وأزاله التوتر السطحي للحصول علي طبقه موحده من وسائل الاعلام.
- أضافه الخلايا المعلقة في اضافيه 40 μL من وسائل الاعلام لكل بئر. تدور مره أخرى في 58 x g.
ملاحظه: الاتساق في الطلاء مهم للحصول علي أفضل النتائج وعدد الخلايا المطلية لكل بئر يجب ان يكون الأمثل لكل الاعداد التجريبية ، سيكون من المرجح ان يكون في نطاق ~ 10000-25000 myoblasts مطلي في وسائل الاعلام التمايز في بئر من لوحه 96-حسنا. - تغيير الوسائط برفق يوميا اثناء التفريق. لا يستنشق وسائل الاعلام ولكن بدلا ازالته مع ماصه ، وترك حجم صغير وراء لتجنب المسكن الخلايا أو تعريضهم للهواء. علي سبيل المثال ، استبدال 50 μL في وقت لتكرار ثلاثه بدلا من كافة 80 μL في ان واحد.
- استخدام 8-15 الآبار لكل حاله. قد يكون من الضروري حذف بعض الآبار إذا كانت الخلايا لا تشكل طبقه موحده من myotubes.
ملاحظه: حذف الآبار علي حواف لوحه لأنها عرضه للغاية لتبخر. تغيير اعداد لوحه لنسخ متماثلة التجريبية لتجنب الأخطاء المنهجية. - أداء الفحص المطلوب علي myotubes المتمايزة في غضون أيام 1-2 من التمايز الكامل (يوم 4-6 من بداية التمايز). وترد الصكوك الموصي بها والكواشف لقياس معدلات استهلاك الأوكسجين في جدول المواد.
النتائج
وبعد القسم 1 من البروتوكول المقدم ينبغي ان تسفر عن الخلايا الاوليه الناشئة من الشرح التي ستكون مرئية تحت مجهر ضوء قياسي (الشكل 2). وسوف ينظر إلى الخلايا غير المتجانسة السكان المتزايد من والمحيطة كل الانسجه العضلية الشرح. ستظهر المقاطعات كمجالات صغيره مستديرة ومشرقه. سينتج عن المادة 2 من البروتوكول الحصاد المبكر للأقاليم من الانسجه المفسرة ، التي ستحتوي علي عدد قليل من الخلايا ستكون غير متجانسة (الشكل 3). ويصف القسم 3 من البروتوكول الحصاد المبكر للتقادم مع النظام التلفزيوني (بدلا من التريبسين) ، الذي سيوفر عددا صافيا نسبيا من السكان من الأقاليم لمزيد من الاستزراع. بعد القسم 4 من البروتوكول سوف تسفر عن myotubes متمايزة تماما لمزيد من التلاعب التجريبية. التمايز من المناطق العضلية عاده ما يستغرق 4-6 أيام ، وخلالها المورفولوجية من الخلايا سوف تتغير من المجالات واحده ، مستديرة إلى ممدود ، تنصهر ، ألياف نوى طويلة (الشكل 4). بعد القسم 5 من البروتوكول سوف تنتج myotubes المتمايزة في لوحات 96 البئر لتمكين مجموعه متنوعة من التوصيفات الايضيه استنادا إلى التغيرات في استهلاك الأكسجين ومعدلات تحمض خارج الخلية10 (الشكل 5).
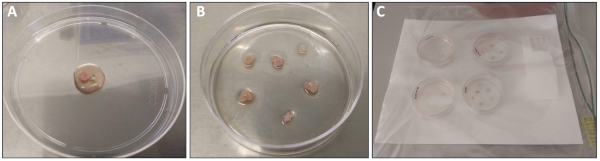
الشكل 1: تشريح ومعالجه العضلات رباعيه الرؤوس. (ا) عضله رباعيه الرؤوس التي تم تشريحها حديثا وشطفها بالخدمات التلفزيونية قبل نقلها إلى صحن بطول 10 سم. وقد تم تراكب 1 مل من وسائل الاعلام الطلاء للمعالجة. (B) قطع الانسجه العضلية رباعيه الرؤوس بعد نقلها إلى لوحه 6 سم المغلفة مسبقا. (C) لوحات 6 سم داخل غرفه رطبه قبل وضعها في 37 درجه مئوية حاضنه. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 2: النمو في الأقاليم العضلية. النمو العضلي من العضلات الرباعية. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 3: الممرات المبكرة للمرور. P0 المقاطع العضلية بعد النقل والتعلق بقارورة T25. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 4: الطلاء والتمايز من myotubes الابتدائية. (ا) الأقاليم بعد يوم واحد من بدء التعرض لوسائط التمايز. (ب ، ج) [ميوتوبس] يميز خمسه ([ب]) أو سته ([ج]) أيام بعد يبدا تمييز. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
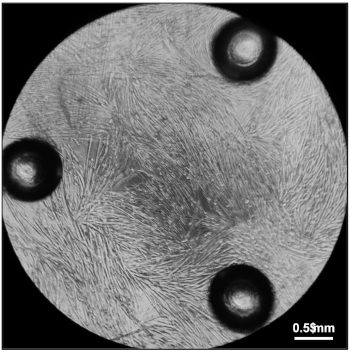
الشكل 5: Myotubes جاهزه لقياس معدلات استهلاك الأكسجين. تماما يميز [ميوتوبس] خمسه أيام بعد طليه 20,000 [ميووستس] في تمييز أوساط في كل بئر من [96-ول] خليه ثقافة [ميكروبلايت]. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
الهيكل العظمي العضلات أمر حيوي لإنشاء وصيانة التوازن الأيضي11. وتعقد دراسة فسيولوجيا العضلات من خلال التباين بين الافراد, فضلا عن صعوبة في الحصول علي عينات, لا سيما في حاله الدراسات البشرية. وقد تبين myotubes الابتدائية مثقف لتلخيص العديد من الميزات من فسيولوجيا العضلات, بما في ذلك التوازن الكالسيوم12, تجديد الانسجه العضلية التالفة5, التعديلات الايضيه استجابه لممارسه13, التعديلات علي الأيض الناجمة عن امراض مثل مرض السكري14. الثقافة الاساسيه للخلايا و myotubes من الفئران تمكن التحقيق في خلايا العضلات إيواء التلاعب الوراثية المحددة جيدا ، ويوفر تكمله للدراسات myotubes المستمدة من الخزعات العضلات البشرية12،15 ،16. ولذلك ، فان أساليب العزلة والثقافة من الماوس الاساسيه myotubes والفئران هي ضرورية لتمكين استنساخه ، والتحقيق عاليه الانتاجيه من العضلات وظيفة الخلية السابقة الجسم الحيوي. البروتوكول الموصوف هنا يسمح لإنشاء ودراسة الفئران الرئيسية والماوس myotubes تحت مجموعه متنوعة من التلاعب التجريبية.
في حين وصفت البروتوكولات السابقة العزلة من الخلايا الجذعية العضلات من الثقافات المفسرة, هذا البروتوكول يوفر طريقه لعزل ناجحه من الأقاليم من أنواع مختلفه متعددة من الانسجه العضلية. الاضافه إلى ذلك ، فان هذا الأسلوب ينتج عددا أكبر بكثير من الخلايا الجذعية لمزيد من التلاعب التجريبي. وعلاوة علي ذلك ، تم التحقق من صحة هذه الطريقة كما الغلة myotubes المتمايزة التي تعبر عن علامات خلايا العضلات الناضجة17، وتظهر فسيولوجيا الطبيعية ، مثل إيقاعات الايقاعيه17 و mitogen تنشيط البروتين كيناز (mapk) اشاره المحول18.
الخطوات الحاسمة في البروتوكول هي تشريح ومعالجه الانسجه العضلات الشرح ، فضلا عن تجنب التلوث بين المحاصيل. وينبغي توخي الحذر لتجنب الإفراط في معالجه الانسجه. في حين ان الأجزاء الأصغر من العضلات تسفر عن اعداد أكبر من المقاطع العضلية ، فان القطع المفرط للعضلات يمكن ان يمنع نمو الخلايا الجذعية. في حين انه من المهم عدم أزاحه الشرح بمجرد ان يتم مطلي ، وغسل دقيق للوحات مع تلفزيوني/جنتاميسين أمر بالغ الاهميه للحد من التلوث. قد يتم تجميد الكريات المقطوعة كخلايا P2 في تخزن باستخدام خليط ميديا مياوبلاست بنسبه 10 ٪/90 ٪. وفي حين لا تحتاج المحافظات إلى الحفاظ علي كثافة عاليه لتسهيل النمو ، فانه ينصح بتجميد الخلايا عند التقاء 40-50%. عاده ، واحده T75 قارورة غله 4 تخزن من الخلايا.
Disclosures
اي.
Acknowledgements
ويعرب صاحبا البلاغ عن امتنانهما للدكتور ماثيو وات في جامعه ملبورن والدكتورة اناستاسيا كرالي في جامعه جونز هوبكنز للمساعدة في اعتماد هذا البروتوكول استنادا إلى عمل موبيل وآخرون6. كما نشكر الدكتورة سابين جوردان علي مساعدتها في تطوير واعتماد هذا البروتوكول في مختبرنا. تم تمويل هذا العمل من قبل المعاهد الوطنية للصحة R01s DK097164 و DK112927 إلى K.A.L.
Materials
| Name | Company | Catalog Number | Comments |
| Coating Solution: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| Collagen | Life Technologies | A1064401 | 1.7 mL |
| Matrigel | Fisher | CB40234A | 1 mL |
| Plating Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 12.5 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 12.5 mL |
| Heat Inactivated FBS | Life Technologies | 16000044 | 20 mL; can be purchased as regular FBS and heat-inactivated by placing in a 40 °C water bath for 20 minutes |
| Amniomax | Life Technologies | 12556023 | 5 mL |
| Myoblast Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 17.5 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 17.5 mL |
| Heat Inactivated FBS | Life Technologies | 16000044 | 10 mL; can be purchased as regular FBS and heat-inactivated by placing in a 40 °C water bath for 20 minutes |
| Amniomax | Life Technologies | 12556023 | 5 mL |
| Differentiation Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| Heat Inactivated Horse Serum | Sigma | H1138 | 1.5 mL |
| Insulin-Selenium-Transferrin | Life Technologies | 41400045 | 0.5 mL |
| Other Materials: | |||
| PBS | Gibco | 14040133 | |
| Gentamicin | Sigma | G1397 | |
| TrypLE | Gibco | 12604013 | |
| DMSO | Sigma | 472301 | Prepare as 10% DMSO in Myoblast Media for freezing cells |
| Forceps | Any | ||
| Razor Blades | Any | ||
| Scissors | Any | ||
| Whatman paper | VWR | 21427-648 | |
| 60 mm plate | VWR | 734-2318 | |
| 10 cm plate | VWR | 25382-428 (CS) | |
| T25 Flasks | ThermoFisher | 156367 | |
| T75 Flasks | ThermoFisher | 156499 | |
| Centrifuge Tubes (15mL) | BioPioneer | CNT-15 | |
| Oxygen Consumption Rates: | |||
| Seahorse XFe96 Analyzer | Agilent | Seahorse XFe96 Analyzer | Instrument used to measure oxygen consumption rates read out by acidification of the extracellular media |
| Seahorse XFe96 FluxPak | Agilent | 102416-100 | 96-well plates for use in XFe96 Analyzer |
| Seahorse XF Cell Mito Stress Test Kit | Agilent | 103015-100 | components may be purchased from other suppliers once assay is established; some recommendations are listed below |
| Seahorse XF Palmitate-BSA FAO substrate | Agilent | 102720-100 | components may be purchased from other suppliers once assay is established; some recommendations are listed below |
| Palmitic acid | Sigma | P5585-10G | for measurement of fatty acid oxidation |
| carnitine | Sigma | C0283-5G | for measurement of fatty acid oxidation |
| Etomoxir | Sigma | E1905 | for measurement of fatty acid oxidation |
| BSA | Sigma | A7030 | used as control or in conjugation with palmitic acid for use in measurement of fatty acid oxidation |
References
- Srikanthan, P., Karlamangla, A. S. Muscle mass index as a predictor of longevity in older adults. American Journal of Medicine. 127 (6), 547-553 (2014).
- Lee-Young, R. S., Kang, L., Ayala, J. E., Wasserman, D. H., Fueger, P. T. The physiological regulation of glucose flux into muscle in vivo. Journal of Experimental Biology. 214 (2), 254-262 (2010).
- Sjøberg, K. A., et al. Exercise increases human skeletal muscle insulin sensitivity via coordinated increases in microvascular perfusion and molecular signaling. Diabetes. 66 (6), 1501-1510 (2017).
- Girgis, C. M., Clifton-Bligh, R. J., Mokbel, N., Cheng, K., Gunton, J. E. Vitamin D signaling regulates proliferation, differentiation, and myotube size in C2C12 skeletal muscle cells. Endocrinology. 155 (2), 347-357 (2014).
- Smith, J., Merrick, D. Embryonic skeletal muscle microexplant culture and isolation of skeletal muscle stem cells. Methods in Molecular Biology. 633, 29-56 (2010).
- Mokbel, N., et al. K7del is a common TPM2 gene mutation associated with nemaline myopathy and raised myofibre calcium sensitivity. Brain. 136 (2), 494-507 (2013).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1977).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. Journal of Cell Biology. 125 (6), 1275-1287 (1994).
- Musarò, A., Carosio, S. Isolation and Culture of Satellite Cells from Mouse Skeletal Muscle. Methods in Molecular Biology. 1553, 155-167 (2017).
- Smolina, N., Bruton, J., Kostareva, A., Sejersen, T. Assaying mitochondrial respiration as an indicator of cellular metabolism and fitness. Methods in Molecular Biology. 1601, 79-87 (2017).
- Elliott, B., Renshaw, D., Getting, S., Mackenzie, R. The central role of myostatin in skeletal muscle and whole body homeostasis. Acta Physiologica. 205 (3), 324-340 (2012).
- Smolina, N., Kostareva, A., Bruton, J., Karpushev, A., Sjoberg, G., Sejersen, T. Primary murine myotubes as a model for investigating muscular dystrophy. BioMed Research International. , (2015).
- Nedachi, T., Fujita, H., Kanzaki, M. Contractile C 2 C 12 myotube model for studying exercise-inducible responses in skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 295 (5), E1191-E1204 (2008).
- Chen, M. B., et al. Impaired activation of AMP-kinase and fatty acid oxidation by globular adiponectin in cultured human skeletal muscle of obese type 2 diabetics. Journal of Clinical Endocrinology and Metabolism. 90 (6), 3665-3672 (2005).
- Douillard-Guilloux, G., Mouly, V., Caillaud, C., Richard, E. Immortalization of murine muscle cells from lysosomal α-glucosidase deficient mice: A new tool to study pathophysiology and assess therapeutic strategies for Pompe disease. Biochemical and Biophysical Research Communications. 388 (2), 333-338 (2009).
- Varga, B., et al. Myotube elasticity of an amyotrophic lateral sclerosis mouse model. Scientific Reports. 8 (1), 5917 (2018).
- Kriebs, A., et al. Circadian repressors CRY1 and CRY2 broadly interact with nuclear receptors and modulate transcriptional activity. Proceedings of the National Academy of Sciences. 114 (33), 8776-8781 (2017).
- Cho, Y., et al. Perm1 enhances mitochondrial biogenesis, oxidative capacity, and fatigue resistance in adult skeletal muscle. FASEB Journal. 30 (2), 674-687 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved