Method Article
マウス骨格筋移植からの原発性筋芽生の単離と分化
要約
ミオブラストは、多核化ミオチューブと最終的に骨格筋筋筋筋繊維を形成するために分化する前駆細胞を増殖させる。ここでは、若年成人マウス骨格筋からの原発筋芽生の効率的な単離および培養のためのプロトコルを提示する。この方法は、培養中の筋肉細胞の分子的、遺伝的、代謝的研究を可能にする。
要約
原発性筋芽生児は、骨格筋の未分化増殖前駆体である。彼らは培養し、筋肉の前駆体として研究したり、筋肉の発達の後の段階に区別するように誘導することができます.ここで提供されるプロトコルは、若い成人マウス骨格筋移植から筋芽細胞の高増殖集団の単離および培養のための堅牢な方法を説明する。これらの細胞は、異なるマウスモデルの骨格筋の代謝特性の研究、ならびに外因性DNAによるトランスフェクションやウイルス発現ベクターによるトランスダクションなどの他の下流アプリケーションの研究に有用である。これらの細胞の分化および代謝プロファイルのレベルは、暴露の長さ、および筋芽細胞分化を誘導するために使用される培養物の組成に依存する。これらの方法は、マウス筋細胞代謝ex vivoの研究のための堅牢なシステムを提供する。重要なのは、生体内モデルとは異なり、ここで説明する方法は、高いレベルの再現性で拡張および研究できる細胞集団を提供する。
概要
多くの場合、全体的な代謝健康の指標として引用されているが、複数の研究は、高齢者のボディマス指数(BMI)が一貫して死亡率の高いリスクと関連付けられていないことを示しています。現在までに、この集団における死亡率の低下と一致することが示された唯一の因子は、筋肉量1の増加である。筋肉組織は、体内のインスリン感受性細胞の最大の供給源の1つを表し、したがって、全体的な代謝恒常性2の維持に重要である。運動による骨格筋組織の活性化は、局所インスリン感受性と全体的な代謝健康3の両方の増加に関連している。生体内モデルでは、筋肉の生理学と統合された代謝に対する筋肉機能の影響を研究するために不可欠であるが、ミオチューブの一次培養は、動物研究の複雑さを軽減する扱いやすいシステムを提供する。
出生後の筋肉に由来する筋芽生性は、非常に再現性の高い方法で多数の治療と成長条件の影響を研究するために使用することができます。これは長い間認識されており、筋芽生性分離および培養のためのいくつかの方法が説明されています4,5,6,7, 8,9.これらの方法のいくつかは、新生児の筋肉を使用し、ミオブラスト5、8の比較的低い数を生み出し、より大規模な研究のためにいくつかの動物を必要とします。また、筋芽細胞を培養するための最も広く使用されている方法は、他の細胞型よりも付着性が低い筋芽細胞を濃縮するために「プレメッキ」を使用します。我々は、ここで説明する代替濃縮方法は、非常に増殖性の高い筋芽生性集団を濃縮するためにはるかに効率的で再現性があることを見出した。要約すると、このプロトコルは、培養培地への成長を介して、若い成人筋移植から非常に増殖性の筋芽生性の単離を可能にする。ミオブラストは、数日間にわたって繰り返し収穫することができ、急速に拡大し、ミオチューブに分化するように誘導される。このプロトコルは、自発的にけいれんミオチューブに強く分化する多数の健康な筋芽細胞を再現的に生成します。様々なマウスの一次筋管における代謝と概日リズムを研究することが可能になりました。最後に、96ウェルプレートの酸素消費率の測定値を用いて、酸化代謝の研究のために筋管を調製する方法を取り入れています。
プロトコル
このプロトコルは、スクリプス研究の動物ケアガイドラインに従っています。
1. 筋肉組織移植の収集と処理
- 解剖の前日、すべての解剖装置(鉗子、かみそり刃、はさみ)を殺菌し、必要なすべての媒体を準備する:リン酸緩衝生理食べ物(PBS)、MBめっき媒体(DMEMの12.5 mL、HAMS F12の12.5 mL、熱不活性化された胎児の20 mL)血清(FBS)、羊水培地サプリメント5mL、およびコーティング溶液(DMEMの24mL、HAMS F12の24mL、コラーゲン1.7mL、マトリゲル1mL)。
- 解剖の日は、解剖する各筋肉のためのコーティング溶液で1 6cmの皿を塗ります。各プレートの表面に2mLのコーティング溶液を加え、表面に均一なコートを作成するために穏やかに振り、1時間4°Cでプレートをインキュベートします。
- プレートからコーティング溶液を取り出し、ストック溶液に戻します。
注:コーティング溶液は、最大6ヶ月間再利用することができ、4 °Cで保存する必要があります。 - 2 mLのPBSでプレートを2回すすいで、バインドされていないコラーゲンとマトリゲルを除去します。
- 解剖の間に37°C組織培養インキュベーターにプレートを置きます。
- ビニール袋または滅菌15センチの皿に厚い吸収性紙の2-3枚を置くことによって湿った部屋を準備し、滅菌水で紙の表面を濡らすためにピペットを使用します。
- 紫外線の下にチャンバーを5分間置き、殺菌します。
- 4~8週齢のマウスから希望の筋肉を解剖する。筋肉組織を殺菌するには、40 μg/mLゲンタマイシンを含むPBSで穏やかにすすいでください。
注:四頭筋と胃腸筋の場合は、プレートごとに1つの筋肉をプレートします。ソレウス、足底、EDLの場合は、両足の筋肉を1枚のプレートに組み合わせます。 - 無菌鉗子を使用して、無菌10cm非コーティングペトリ皿に筋肉を移します。組織が湿っているが浮かびないように、筋肉の上にめっき媒体の0.5-1.0 mLを加えます(図1A)。
- 無菌のメスまたはカミソリの刃を使用して、筋肉を小さな断片(約1〜3 mm3)にそっとスライスします。
注:最良の結果を出すために筋肉組織の取り扱いを最小限に抑えることが重要です。 - 鉗子またはピペットを使用して、筋肉の断片をあらかじめコーティングされた6cmプレートの表面に移します。非常に穏やかにティッシュの上にめっき媒体の付加的な0.8 mLをオーバーレイする。組織片を水和させ、浮遊させないようにするのに十分なメディアが必要です(図1B)。
- 湿った部屋の中に筋肉の断片を含む6cmの皿を置き、48 h(図1C)のインキュベーター(37°C、5%CO2)に戻ります。
注:筋の断片がプレートの表面に付着し、筋芽生攣の成長を可能にすることが重要です。少なくとも48時間はプレート/チャンバを動かさないようにしてください。 - 48時間後、プレートを注意深くチェックして、筋肉の断片が付着していることを確認します。2 mLのめっきメディアでオーバーレイし、断片を取り除かないように注意してください。
注:プレートに目に見える汚染や破片がある場合は、筋肉片を注意深く洗ってください。プレートの端にPBS/ゲンタマイシン溶液のプレート2 mLと筋肉組織上を洗浄するために穏やかに先端。PBSを取り外し、洗浄工程を繰り返します。2回目の洗浄に続いて、めっき媒体の2mLをオーバーレイする。 - 37°Cのインキュベーターでプレートを37°Cのインキュベーターに入れて、筋芽筋芽を収穫する前に、さらに3日間(元の解剖から5日間)保ちます。筋芽生の成長を1日おきにチェックしてください。
注:筋肉の移植から出てくる細胞の出現は可変的で不均一である。原発性筋芽細胞は、小さく、丸く、明るい細胞として現れる。しかし、この段階で見た目で識別する必要も信頼できるものでもない(図2)。
2. 成長する筋芽生の収穫
- ミオブラスト培地(DMEMの17.5mL、HAMS F12の17.5mL、FBSの10mL、羊水培地サプリメントの5mL)、トリプシン、およびPBS/ゲンタマイシンを準備し、事前に温めた。コーティング溶液で収穫される筋肉群ごとに1つのT25フラスコをコーティングし、ステップ1.2で説明するように(表1を参照)。
- めっきメディアを取り外し、PBS/ゲンタマイシンの2mLで筋肉の移植を穏やかにすすいでください。PBSを素早く取り除きます(一度に1枚ずつすすいで、このステップでプレートをPBSに座らせないようにしてください)。
- PBS/ゲンタマイシンを1mL加え、37°Cインキュベーターに1分間入れます。
- P1000ピペットを使用して、15 mL遠心管でPBS/セルを収集します。
- プレートに1mLのトリプシンを加え、37°Cのインキュベーターに3分間戻します。トリプシン/セルを収集し、PBS コレクションと組み合わせます。遠心管に8mLのミオブラストメディアを追加し、穏やかに反転して混ぜます。
- 筋肉板上のめっき液の2 mLを穏やかにオーバーレイし、37°Cインキュベーターに戻ります。
- 遠心分離機に細胞を含む遠心管を200 x gで3分間回転させます。
- 上清を~1mLに吸引し、細胞ペレットを避けるように注意する。筋芽細胞培地を穏やかに加え(表1参照)、37°Cインキュベーターに予めコーティングされたフラスコに細胞を移し、37°Cのインキュベーターに置きます。これがP0の収穫です。顕微鏡で観察すると、細胞が非常に少ない場合があります(図3)。
- 上記の収穫を1日おきに3回まで繰り返します。3回目の収穫の後、移植所を廃棄します。
3. 増殖筋芽の拡大と濃縮
注:P0の収穫は不均一(約60%筋芽生)である。次の2つの通路は、選択的に筋芽生を収穫するためにPBSを使用しています。より多くの付着細胞の多くが取り残され、急速に増殖する筋芽細胞は2つの通路内で≥95%純粋になります。筋芽生が確立されると、自発的な分化を避けるために低密度で維持する必要があります。
- セクション2から〜40〜50%のコンフルエントセルの各T25フラスコについて、コーティング溶液の5 mLで1つのT75フラスコをコーティングし、1〜4時間4°Cに置きます。
- フラスコからコーティング溶液を取り出し、ストック溶液に戻します。フラスコを2mLのPBS/ゲンタマイシンで2回すすぎ、37°Cインキュベーターに入します。
- P0筋芽生T25フラスコからメディアを吸引する。2 mLの温かいPBS/ゲンタマイシンで細胞を簡単にすすいでください。フラスコから PBS を吸引します。
注:このステップ(3.3)の目的は、細菌汚染の可能性を減らすことである。迅速かつ穏やかに行う場合は、筋芽生の損失をもたらさないはずです。必要に応じて、筋芽生性保存を最大化するために省略することができます。 - ミオブラストを含む各フラスコに温かいPBS(トリプシンではない)のピペット2mL。フラスコをPBSで37°Cインキュベーターに3分間入します。
注:筋芽生は、PBSでフラスコから簡単に取り外す必要があります。このステップでトリプシンではなくPBSを使用することは、他の細胞型との筋芽細胞集団の汚染を減らすために重要です。 - 37°Cインキュベーターから細胞を取り出し、フラスコの側面をしっかりとタップして細胞を取り除きます。光顕微鏡の下で自由に浮遊する筋芽生物を確認してください。
- フラスコを組織培養フードに直立させ、10mLのMyoblast Mediaでフラスコの底部を2~3回すすいで、すべての細胞が脱落していることを確認します。
- 15 mL遠心管でセル/メディア混合物を収集します。200 x gで3分間遠心分離機。
- 培剤を約1mLに吸引し、細胞ペレットを避けるように注意する。遠心管に適量ミオブラストメディアをゆっくりと加え、優しく混ぜます。
- セル混合物を新しいT75フラスコに分配します。新しいT75フラスコに10mLのミオブラストメディアを追加します。フラスコを水平にゆっくりと振り、細胞を分散させ、一晩37°Cインキュベーターに入れます。
- 2日後、PBSでもう一度通路を通過し、各T75フラスコを3つのT75フラスコに分割する。
注:これは、彼らが分化を開始し、前駆能力を失うことになるので、筋芽生攣が50%-60%以上のコンフルエントになることを許可しないでください。 - その他の通路については、トリプシンを使用してください。PBSで2回通過する >95% 筋芽球;純度をさらに向上させようとする試みは、分化が悪くなる傾向がある。
4. ミオチューブに対する原発筋芽の分化
- コーティングされたプレート上のMyoblast MediaにおけるプレートP2(またはそれ以降の通路)筋芽細胞(推奨されるコーティングおよびめっき量および細胞数については表1参照)。2、3日後、細胞が70〜80%の合流性にある場合、メディアを分化媒体に変更する(DMEMの24 mL、HAMS F12の24 mL、1.5mLの熱不活性化馬血清、0.5 mLのインスリン-セレン-トランスフェリン)。
- 主筋芽生をミオチューブに分化する際に、1日おきに分化メディアを変更する。分化は通常、4日目から5日目までに完了し、自発的にけいれんを起こした細長い融合細胞によってマークされます。6日以内に分化した筋管の実験を行う。典型的には、細胞は、分化を開始した後5〜6日後にアッセイされる。
5. 96ウェルプレートにおける筋芽生体またはミオチューブにおける酸素消費量の測定
- ウェルあたり25 μLのコーティング溶液で96ウェルプレートをコーティングします。58 x gでプレートを1分間遠心分離し、気泡を除去します。
- 4°Cで1-4時間のコーティング溶液でプレートをインキュベートします。マルチチャンネルピペットを使用してコーティング溶液を除去し、25 μLの冷たいPBS/ゲンタマイシンで3回洗浄します。気泡が閉じ込められていないことを確認するために、これらの洗い出しの少なくとも1つを遠心分離します。
- 各ウェルに40μLの分化媒体を追加します。58 x gで1分間セルなしで被覆板上のメディアを遠心分離し、気泡を避け、表面張力を除去して、メディアの均一な層を得ます。
- 各ウェルに40μLの培体を追加して懸濁したセルを追加します。58 x gで再びスピンします。
注:めっきの一貫性は最良の結果を生み出す上で重要であり、ウェル当たりの細胞数は実験セットアップごとに最適化されるべきであり、96ウェルプレートの分化媒体でめっきされた約10,000~25,000筋芽細胞の範囲である可能性が高い。 - 差別化中に毎日メディアをゆっくりと変更します。メディアを吸引するのではなく、ピペットで取り除き、細胞を取り外したり、空気にさらすことを避けるために、小さなボリュームを残します。たとえば、一度にすべての 80 μL ではなく、3 回の繰り返しに対して一度に 50 μL を交換します。
- 条件ごとに8-15ウェルを使用してください。細胞が筋管の均一な層を形成しない場合は、いくつかのウェルを省略する必要があるかもしれません。
注:蒸発の影響を受けやすいため、プレートの端にある井戸を省略します。体系的なエラーを避けるために、実験反復用のプレート設定を変更します。 - 完全な分化の1-2日以内に分化されたミオチューブに対して所望のアッセイを行う(分化開始から4-6日目)。酸素消費率の測定のための推奨される器械および試薬は材料の表にリストされている。
結果
提供されたプロトコルのセクション1に従って、標準的な光顕微鏡の下で見える移植所から出てくる一次細胞を得るべきである(図2)。異種細胞集団は、各筋肉組織の切除から成長し、周囲に見られる。筋芽生は、小さく、丸く、明るい球として表示されます。プロトコルのセクション2に続いて、組織の移植から筋芽細胞の早期収穫が得られ、これは少数の細胞を含み、不均一になる(図3)。プロトコルのセクション3は、(トリプシンではなく)PBSで早期収穫を通過することを説明し、これはさらに培養するための筋芽生の比較的純粋な集団を提供する。プロトコルのセクション4に従って、さらなる実験操作のために完全に分化されたミオチューブが得られます。筋芽細胞の分化は通常4〜6日かかり、その間に細胞の形態は単一の円形球から細長い、融合された、長い多核繊維に変化する(図4)。プロトコルのセクション5に続いて、酸素消費量および細胞外酸性化率10の変化に基づいて様々な代謝特性を可能にするために、96ウェルプレートで分化されたミオチューブを生成する(図5)。
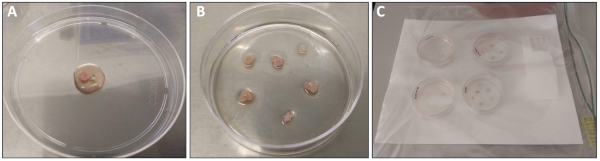
図1:四頭筋の解剖と処理(A)10cm皿に移す前にPBSで切除し、すすいだ四頭筋。1mLのめっき媒体は処理のために重ね合わされた。(B)前塗り6cmプレートに転移した後の四頭筋組織片。(C)37°Cインキュベーターに配置する前に湿った室内に6cmのプレート。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:筋芽生の伸び四頭筋筋からの筋芽生の成長.この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:早期通過筋芽生箇所。P0筋芽生は、T25フラスコへの転送および取り付け後に生えます。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図4:一次筋管のめっきと分化。(A)分化媒体への暴露を開始した翌日に、Myoblasts.(B,C)分化ミオチューブ5(B)または6(C)分化開始後の日数。この図のより大きなバージョンを表示するには、ここをクリックしてください。
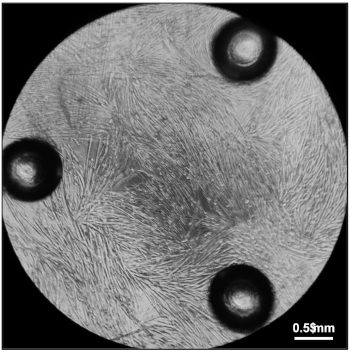
図5:酸素消費率を測定する準備ができているミオチューブ。96ウェル細胞培養マイクロプレートの各ウェルで分化媒体で20,000個の筋芽細胞をめっきした5日後に完全に分化したミオチューブ。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
骨格筋は、代謝恒常性11の確立と維持のために不可欠である。筋肉生理学の研究は、特に人間の研究の場合には、個々の変動、ならびにサンプルを得ることの困難によって複雑である。培養された原発性筋管は、カルシウム恒常性12、損傷した筋肉組織5の再生、運動13に応答する代謝変化を含む筋肉生理学の多くの特徴を要約することが示されている。糖尿病などの疾患に起因する代謝の変化14.マウスからの筋芽細胞および筋管の一次培養は、よく定義された遺伝子操作を有する筋肉細胞の研究を可能にし、ヒトの筋肉生検に由来する筋管の研究を補完する12,15 、16.したがって、マウス原発性筋芽細胞および筋管の単離および培養のための方法は、筋肉細胞機能ex vivoの再現性、高スループットの調査を可能にするために不可欠である。ここで説明するプロトコルは、様々な実験操作の下で一次マウス筋芽および筋管の確立および研究を可能にする。
以前のプロトコルは、植物培養からの筋肉幹細胞の単離を記述しているが、このプロトコルは、複数の異なるタイプの筋肉組織からの筋芽細胞の正常な単離のための方法を提供する。さらに、この方法は、さらなる実験操作のための幹細胞の有意に大きな集団をもたらす。また、この方法は、成熟した筋肉細胞17のマーカーを発現する分化ミオチューブを得ることを検証し、概日リズム17やミトゲン活性化タンパク質キナーゼ(MAPK)シグナルなどの正常な生理学を示す。トランスダクション18.
プロトコルの重要なステップは、筋肉組織の移植の解剖および処理、ならびに収穫間の汚染の回避である。組織の過剰処理を避けるために注意する必要があります。.筋肉の小さな部分は、筋芽細胞のより大きな数を生成しながら, 筋肉の過度の切断は、幹細胞の成長を防ぐことができます。.メッキを施した後は除臼しないことが重要ですが、PBS/ゲンタマイシンでプレートを注意深く洗うことは、汚染を減らすために重要です。収穫された筋芽細胞は、10%DMSO/90%筋芽細胞培養物混合物を用いて凍結し、凍結してもよい。筋芽細胞は成長を促進するために高密度で維持する必要はないが、細胞は40〜50%の合流で凍結されることをお勧めします。典型的には、1つのT75フラスコは、細胞の4凍結を得る。
開示事項
なし。
謝辞
著者らは、メルボルン大学のマシュー・ワット博士とジョンズ・ホプキンス大学のアナスタシア・クラリ博士に感謝し、Mokbelらの研究に基づいてこのプロトコルを採用する支援を行っています6.また、サビーヌ・ヨルダン博士が当研究室でこのプロトコルを開発し、採用する支援をしてくれたことに感謝します。この研究は、国立衛生研究所R01s DK097164とK.A.L.へのDK112927によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Coating Solution: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| Collagen | Life Technologies | A1064401 | 1.7 mL |
| Matrigel | Fisher | CB40234A | 1 mL |
| Plating Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 12.5 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 12.5 mL |
| Heat Inactivated FBS | Life Technologies | 16000044 | 20 mL; can be purchased as regular FBS and heat-inactivated by placing in a 40 °C water bath for 20 minutes |
| Amniomax | Life Technologies | 12556023 | 5 mL |
| Myoblast Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 17.5 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 17.5 mL |
| Heat Inactivated FBS | Life Technologies | 16000044 | 10 mL; can be purchased as regular FBS and heat-inactivated by placing in a 40 °C water bath for 20 minutes |
| Amniomax | Life Technologies | 12556023 | 5 mL |
| Differentiation Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| Heat Inactivated Horse Serum | Sigma | H1138 | 1.5 mL |
| Insulin-Selenium-Transferrin | Life Technologies | 41400045 | 0.5 mL |
| Other Materials: | |||
| PBS | Gibco | 14040133 | |
| Gentamicin | Sigma | G1397 | |
| TrypLE | Gibco | 12604013 | |
| DMSO | Sigma | 472301 | Prepare as 10% DMSO in Myoblast Media for freezing cells |
| Forceps | Any | ||
| Razor Blades | Any | ||
| Scissors | Any | ||
| Whatman paper | VWR | 21427-648 | |
| 60 mm plate | VWR | 734-2318 | |
| 10 cm plate | VWR | 25382-428 (CS) | |
| T25 Flasks | ThermoFisher | 156367 | |
| T75 Flasks | ThermoFisher | 156499 | |
| Centrifuge Tubes (15mL) | BioPioneer | CNT-15 | |
| Oxygen Consumption Rates: | |||
| Seahorse XFe96 Analyzer | Agilent | Seahorse XFe96 Analyzer | Instrument used to measure oxygen consumption rates read out by acidification of the extracellular media |
| Seahorse XFe96 FluxPak | Agilent | 102416-100 | 96-well plates for use in XFe96 Analyzer |
| Seahorse XF Cell Mito Stress Test Kit | Agilent | 103015-100 | components may be purchased from other suppliers once assay is established; some recommendations are listed below |
| Seahorse XF Palmitate-BSA FAO substrate | Agilent | 102720-100 | components may be purchased from other suppliers once assay is established; some recommendations are listed below |
| Palmitic acid | Sigma | P5585-10G | for measurement of fatty acid oxidation |
| carnitine | Sigma | C0283-5G | for measurement of fatty acid oxidation |
| Etomoxir | Sigma | E1905 | for measurement of fatty acid oxidation |
| BSA | Sigma | A7030 | used as control or in conjugation with palmitic acid for use in measurement of fatty acid oxidation |
参考文献
- Srikanthan, P., Karlamangla, A. S. Muscle mass index as a predictor of longevity in older adults. American Journal of Medicine. 127 (6), 547-553 (2014).
- Lee-Young, R. S., Kang, L., Ayala, J. E., Wasserman, D. H., Fueger, P. T. The physiological regulation of glucose flux into muscle in vivo. Journal of Experimental Biology. 214 (2), 254-262 (2010).
- Sjøberg, K. A., et al. Exercise increases human skeletal muscle insulin sensitivity via coordinated increases in microvascular perfusion and molecular signaling. Diabetes. 66 (6), 1501-1510 (2017).
- Girgis, C. M., Clifton-Bligh, R. J., Mokbel, N., Cheng, K., Gunton, J. E. Vitamin D signaling regulates proliferation, differentiation, and myotube size in C2C12 skeletal muscle cells. Endocrinology. 155 (2), 347-357 (2014).
- Smith, J., Merrick, D. Embryonic skeletal muscle microexplant culture and isolation of skeletal muscle stem cells. Methods in Molecular Biology. 633, 29-56 (2010).
- Mokbel, N., et al. K7del is a common TPM2 gene mutation associated with nemaline myopathy and raised myofibre calcium sensitivity. Brain. 136 (2), 494-507 (2013).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1977).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. Journal of Cell Biology. 125 (6), 1275-1287 (1994).
- Musarò, A., Carosio, S. Isolation and Culture of Satellite Cells from Mouse Skeletal Muscle. Methods in Molecular Biology. 1553, 155-167 (2017).
- Smolina, N., Bruton, J., Kostareva, A., Sejersen, T. Assaying mitochondrial respiration as an indicator of cellular metabolism and fitness. Methods in Molecular Biology. 1601, 79-87 (2017).
- Elliott, B., Renshaw, D., Getting, S., Mackenzie, R. The central role of myostatin in skeletal muscle and whole body homeostasis. Acta Physiologica. 205 (3), 324-340 (2012).
- Smolina, N., Kostareva, A., Bruton, J., Karpushev, A., Sjoberg, G., Sejersen, T. Primary murine myotubes as a model for investigating muscular dystrophy. BioMed Research International. , (2015).
- Nedachi, T., Fujita, H., Kanzaki, M. Contractile C 2 C 12 myotube model for studying exercise-inducible responses in skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 295 (5), E1191-E1204 (2008).
- Chen, M. B., et al. Impaired activation of AMP-kinase and fatty acid oxidation by globular adiponectin in cultured human skeletal muscle of obese type 2 diabetics. Journal of Clinical Endocrinology and Metabolism. 90 (6), 3665-3672 (2005).
- Douillard-Guilloux, G., Mouly, V., Caillaud, C., Richard, E. Immortalization of murine muscle cells from lysosomal α-glucosidase deficient mice: A new tool to study pathophysiology and assess therapeutic strategies for Pompe disease. Biochemical and Biophysical Research Communications. 388 (2), 333-338 (2009).
- Varga, B., et al. Myotube elasticity of an amyotrophic lateral sclerosis mouse model. Scientific Reports. 8 (1), 5917 (2018).
- Kriebs, A., et al. Circadian repressors CRY1 and CRY2 broadly interact with nuclear receptors and modulate transcriptional activity. Proceedings of the National Academy of Sciences. 114 (33), 8776-8781 (2017).
- Cho, Y., et al. Perm1 enhances mitochondrial biogenesis, oxidative capacity, and fatigue resistance in adult skeletal muscle. FASEB Journal. 30 (2), 674-687 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved