Method Article
בידוד והבידול של מכשולים ראשוניים מתוך שריר השלד של העכבר Explants
In This Article
Summary
מיאוברוב הם מתרבים תאים מקודכי להבדיל לטופס מיונוקלאוטים מיופולימרים ובסופו של דבר שריר השלד סיבים. כאן, אנו מציגים פרוטוקול עבור בידוד יעיל והתרבות של myoblasts חזיקה הראשוני של השרירים העכבר המבוגר הצעיר. השיטה מאפשרת מחקרים מולקולריים, גנטיים ומטבוליים של תאי שריר בתרבות.
Abstract
Myoblasts נמשך ראשוני הם מובחן מתרבים מקדם של שריר השלד. הם יכולים להיות מתורבתים ולמדו כלפי מקדם שרירים או המושרה להבדיל בשלבים מאוחרים יותר של פיתוח שרירים. הפרוטוקול המסופק כאן מתאר שיטה איתנה עבור הבידוד והתרבות של אוכלוסיה מתרבים מאוד של תאים myoblast חוז מפני השלד הצעיר למבוגרים שרירים בשרירים. תאים אלה שימושיים למחקר של מאפייני חילוף החומרים של שריר השלד של דגמי עכבר שונים, כמו גם ביישומים אחרים במורד הזרם כגון העברה עם DNA אקסוגני או התמרה עם וקטורים ביטוי ויראלי. רמת הבידול ופרופיל חילוף החומרים של תאים אלה תלויה באורך החשיפה, והרכב של המדיה המשמש כדי לגרום בידול myאובאלי. שיטות אלה לספק מערכת חזקה לחקר של תא שרירי העכבר מטבוליזם לשעבר vivo. חשוב לציין, בניגוד לדגמים vivo, השיטות המתוארות כאן מספקות אוכלוסיית תאים שניתן להרחיב וללמוד ברמות גבוהות של האפשרות הניתנת למחקר.
Introduction
בעוד מצוטט לעתים קרובות כאינדיקציה לבריאות מטבולית כוללת, מחקרים מרובים הראו כי מדד מסת הגוף (BMI) אצל מבוגרים לא קשורה בעקביות עם סיכון גבוה יותר של תמותה. עד כה, הגורם היחיד המוצג להיות עקבי עם תמותה מופחתת באוכלוסייה זו הוא מוגבר מסת השריר1. רקמת השריר מייצגת את אחד המקורות הגדולים ביותר של תאים רגישים לאינסולין בגוף, ולכן הוא קריטי בתחזוקת הומאוסטזיס הכולל מטבולית2. הפעלה של רקמת שריר השלד באמצעות פעילות גופנית קשורה מגדילה הן רגישות מקומית אינסולין הכולל בריאות מטבולית3. בעוד במודלים vivo חיוניים לחקר הפיזיולוגיה שרירים ההשפעה של תפקוד שרירים על חילוף החומרים משולב, התרבויות הראשיות של מיוכי מספקים מערכת צייתן המפחית את המורכבות של מחקרים בעלי חיים.
מוביאוטיבי נגזר השרירים שלאחר לידה ניתן להשתמש כדי ללמוד את ההשפעה של הטיפול בתנאים רבים והצמיחה באופן מאוד מיוניתן. זה כבר מזמן הוכרה ומספר שיטות לבידוד myoblast חוז ותרבות תוארו4,5,6,7,8,9. חלק מהשיטות הללו משתמשות בשרירי הילדים ומפיקות מספר נמוך יחסית של myoblasts חזיק5,8, המחייב כמה בעלי חיים למחקרים בקנה מידה גדול יותר. כמו כן, השיטות הנפוצות ביותר לשימוש בשיטת "ציפוי מקדים" להעשרת עבור myoblasts אשר הם פחות חסיד מאשר סוגי תאים אחרים. מצאנו את שיטת ההעשרה החלופית המתוארת כאן כדי להיות הרבה יותר יעילה ומיושבה להעשרת אוכלוסיית מחוז מאוד מתרבים. לסיכום, פרוטוקול זה מאפשר את הבידוד של myoblasts צמיחה מאוד מתרבים מפני השרירים הצעירים explants בוגרים, באמצעות צמיחה לתוך מדיה התרבות. ניתן לקצור את המכשולים שוב ושוב, במשך מספר ימים, להרחיב במהירות, והמושרה כדי להבדיל לתוך שפופרות. פרוטוקול זה מייצר מספר רב של תאי מחוז מיאובלי בריאים אשר מבדילים באופן ספונטני מיופופרות. הוא איפשר לנו ללמוד חילוף החומרים ומקצבים מעגליות ב מיוכי הראשי של עכברים של מגוון של גנוסוגים. לבסוף, אנו כוללים שיטות להכנת מיוצינורות לחקר מטבוליזם חמצוני, באמצעות מדידות של שיעורי צריכת החמצן ב 96-לוחיות.
Protocol
פרוטוקול זה עוקב אחר ההנחיות לטיפול בבעלי חיים של סקריפס מחקר.
1. איסוף ועיבוד של הרחבות רקמת שריר
- ביום שלפני הניתוח, לחטא את כל הציוד לחיתוך (מלקחיים, סכיני גילוח, ומספריים) ולהכין את כל המדיה הנדרשת: פוספט באגירה מלוחים (PBS), מדיה ציפוי MB (12.5 mL של DMEM זיכרון, 12.5 mL של בשר החזיר F12, 20 מ ל של בחום מופעל העוברי שור סרום (FBS), 5 מ ל של תוספת בינונית של נוזל השפיר), ואת פתרון ציפוי (24 מ ל של DMEM, 24 מ ל של החזיר F12, 1.7 מ ל של קולגן, 1 מ ל של מטריצות).
- היום של הניתוח, מעיל אחד 6-ס מ צלחת עם ציפוי פתרון לכל שריר להיות גזור. הוסף 2 מ ל של פתרון ציפוי על פני השטח של כל צלחת, לנענע בעדינות כדי ליצור מעיל אפילו על פני השטח, ו מודקת את הצלחות עם פתרון ב 4 ° c עבור 1 h.
- הסר פתרון ציפוי מהלוחות וחזור לפתרון המניה.
הערה: ניתן לעשות שימוש חוזר בפתרון הציפוי לשישה חודשים ויש לאחסנם ב-4 ° c. - לשטוף את הצלחות פעמיים עם 2 מ ל של PBS להסיר קולגן לא מאוגד מטריצות.
- מניחים את הצלחות בחממה של 37 מעלות צלזיוס במהלך הניתוח.
- הכינו תא לח על-ידי הצבת 2-3 גיליונות של נייר סופג סמיך לשקית ניילון או מנה סטרילית בגודל 15 ס מ והשתמשו בפיפטה כדי להרטיב את המשטח של הנייר במים סטריליים.
- מניחים את התא תחת אור UV עבור 5 דקות לחטא.
- לנתח את השרירים הרצויים מעכבר בן 4 עד 8 שבועות. כדי לעקר את רקמת השריר, לשטוף בעדינות ב-PBS המכיל 40 μg/mL gentamicin.
הערה: . שריר אחד לכל צלחת עבור הסוליה, plantaris ו אדי, לשלב שרירים משתי הרגליים בצלחת אחת. - השתמש מלקחיים סטרילי להעביר את השריר לצלחת פטרי מצופה 10 ס"מ ללא ציפוי. הוסף 0.5-1.0 mL של ציפוי מדיה על השריר כך הרקמה היא לחה אך לא צף (איור 1A).
- השתמש בסכין גילוח סטרילי או תער כדי לחתוך בעדינות את השריר לרסיסים קטנים (כ 1-3 מ"מ3).
הערה: חשוב למזער את הטיפול ברקמת השריר לקבלת התוצאות הטובות ביותר. - השתמש מלקחיים או פיפטה כדי להעביר את שברי שריר על פני השטח של צלחת מצופה מראש 6 ס מ. בעדינות רבה יותר 0.8 מ ל של ציפוי מדיה על הרקמה. צריך להיות מספיק מדיה כדי לשמור את חתיכות הרקמה רטוב אבל לא צף (איור 1B).
- מניחים את 6 ס מ מנות המכילות את שברי שריר בתוך החדר הלח ולחזור לאינקובטור (37 ° c, 5% CO2) עבור 48 h (איור 1ג).
הערה: זה חיוני כי שברי שריר לדבוק פני השטח של הצלחת כדי לאפשר את מחוז myoblast. אין להזיז את לוחות/חדר לפחות 48 h. - לאחר 48 h, בדוק בקפידה את לוחיות הרישוי כדי לוודא שרסיסי השריר הדבקו. שכבת עם 2 מ ל של ציפוי מדיה, מטפל לא להוציא את השברים.
הערה: אם יש זיהום או פסולת גלויים על הלוחות, לשטוף בזהירות את חתיכות השריר. צלחת 2 מ ל של הפתרון PBS/gentamicin בקצה הצלחת וטיפ בעדינות לשטוף את רקמת השריר. הוצא את ה-PBS וחזור על שלב השטיפה. לאחר השטיפה השנייה, שכבת-על 2 מ ל של ציפוי מדיה. - שמרו את הצלחות בחממה 37 ° c למשך 3 ימים נוספים (5 ימים מניתוח מקורי) לפני איסוף myoblasts. תבדקו בכל יום אחר. לצמיחה של מכשולים
הערה: המראה של תאים המתעוררים השרירים שרירים יהיה משתנה הטרוגנית. מקוצר ראשי מופיע כתאים קטנים, עגולים ובהירים. עם זאת, אין צורך ולא אמין לזהות אותם לפי הופעתם בשלב זה (איור 2).
2. קציר הולך וגובר
- להכין ולחמם טרום מדיה Myoblast (17.5 mL של DMEM 17.5 mL של בשר חזיר F12, 10 מ ל של FBS, 5 מ ל של נוזל השפיר תוסף בינוני), טריפסין, ו PBS/. מעיל אחד T25 בקבוקון לקבוצה שריר להיות שנקטפו עם פתרון ציפוי וכמתואר בשלב 1.2 (ראה טבלה 1).
- הסר מדיה ציפוי ולשטוף בעדינות את explants שרירים עם 2 מ ל של PBS/. הסר במהירות את ה-PBS (לשטוף צלחת אחת בכל פעם ואל תיתן את הצלחת לשבת PBS בשלב זה).
- מוסיפים בעדינות 1 מ ל של PBS/gentamicin ומניחים את הצלחת בחממה 37 ° c עבור 1 דקות.
- השתמש בפיפטה P1000 כדי לאסוף תאים PBS בשפופרת צנטריפוגה של 15 מ ל.
- הוסיפו 1 מ ג של טריפסין לצלחת וחזרו לאינקובטור 37 ° c במשך 3 דקות. הקש בעדינות על לוחיות הרישוי. לאסוף את טריפסין/תאים ולשלב עם אוסף PBS. הוסיפו 8 מ ל של המדיה של מיאובאל בשפופרת הצנטריפוגה והיפוך עדין לערבוב.
- כיסוי בעדינות 2 מ ל של פתרונות ציפוי על לוחיות השריר ולחזור לחממה 37 ° c.
- ספין צינורות צנטריפוגה המכיל תאים בצנטריפוגה עבור 3 דקות ב 200 x g.
- להיות זהיר כדי להימנע. מגלולה סלולרית הוסיפו בעדינות את Myoblast מדיה (ראו לוח 1) והעבירו את התאים לבקבוקון המצופה מראש ומניחים בחממה 37 ° c. . זה הקציר P0 אם נצפתה תחת מיקרוסקופ, ייתכנו מעט מאוד תאים (איור 3).
- חזור על הקציר המתואר מעל כל יום אחר עד שלוש פעמים. לאחר הקציר השלישי, למחוק את האקסוצמחים.
3. התרחבות והעשרה של מפיצים מתרבים
הערה: הקציר P0 יהיה הטרוגנית (~ 60% myoblasts חזיק). שני המעברים הבאים משתמשים ב-PBS כדי לקצור את היבול הסלקטיבי. רבים של תאים מחסיד יותר יישאר מאחור את myoblasts מתרבים במהירות יהיה ≥ 95% טהור בתוך 2 מעברים. לאחר הקמת מכשולים, הם צריכים להישמר בצפיפות נמוכה כדי למנוע בידול ספונטנית.
- עבור כל T25 בקבוקון של ~ 40-50% בתאים confluent מסעיף 2, מעיל אחד T75 בקבוקון עם 5 מ ל של פתרון ציפוי ומקום ב 4 ° c עבור 1-4 h.
- הסר פתרון ציפוי מתוך מבחנות ולחזור לפתרון המניה. לשטוף את מבחנות פעמיים עם 2 מ ל של PBS/gentamicin ומקום בחממה 37 ° c.
- מP0 את התקשורת. מצלוחיות T25 מאובאלי לשטוף את התאים בקצרה עם 2 מ"ל של PBS חם/gentamicin. . הייתי מבין את הPBS מהבקבוקון
הערה: מטרת שלב זה (3.3) היא להפחית את האפשרות של זיהום חיידקי. אם מבוצע במהירות ובעדינות, זה לא צריך לגרום לאובדן של myoblasts. ניתן להשמיט אותו כדי למקסם את שימור מחוז myoblast אם תרצה. - פיפטה 2 מ ל של PBS חם (לא טריפסין) לתוך כל בקבוקון המכיל myoblasts. מניחים את מבחנות עם PBS לתוך החממה 37 ° c עבור 3 דקות.
הערה: מיאובלי צריך להתנתק בקלות מצלוחיות עם PBS. השימוש ב-PBS במקום בטריפסין בשלב זה הוא קריטי להפחתת הזיהום של אוכלוסיית myoblast חוז עם סוגי תאים אחרים. - הסר את התאים מהאינקובטור 37 ° c ומצד הברז החזק של מבחנות כדי להוציא את התאים. בדוק תחת מיקרוסקופ קל עבור מכשולים צף בחופשיות.
- מניחים את מבחנות זקוף במכסה התרבות רקמה ולשטוף את החלק התחתון של מבחנות עם 10 מ ל של Myאובלסט מדיה 2-3 פעמים כדי להבטיח את כל התאים הם במקומם.
- לאסוף את תערובת התא/מדיה בשפופרת צנטריפוגה 15 מ ל. צנטריפוגה עבור 3 דקות ב 200 x g.
- . להיזהר למנוע את הגלולה הסלולרית הוסף בעדינות כמות מתאימה של מדיית Myoblast לצינורית צנטריפוגה וערבבו בעדינות.
- הפץ את תערובת התא לצלוחיות T75 חדשות. הוסף 10 מ ל של Myoblast מדיה לכל חדש T75 בקבוקון. לנער בעדינות את מבחנות אופקית כדי לפזר את התאים ומניחים בחממה 37 ° c בלילה.
- יומיים לאחר מכן, מעבר פעם נוספת עם PBS, פיצול כל T75 בקבוקון לתוך שלושה T75 צלוחיות.
הערה: אל תאפשר myoblasts להיות יותר מ 50%-60% confluent, כמו זה יגרום להם להתחיל להבדיל ולאבד קיבולת prolifaterive. - למעברים נוספים, השתמשו בטריפסין. הפסנת פעמיים עם התשואות של PBS > 95% מקוצר; ניסיונות לשפר עוד יותר את הטוהר נוטה לגרום בידול עניים.
4. הבדלה של מיאובלי ראשוני ליופופרות
- לוחית P2 (או מעבר מאוחר יותר) myoblasts חזיק במדיה של מיאובלסט על צלחות מצופות (ראה שולחן 1 לציפוי מוצעים וכלי ציפוי ומספרי תאים). שניים או שלושה ימים לאחר מכן, כאשר התאים הם ב 70-80% שליטה, לשנות את המדיה לבידול מדיה (24 מ ל של DMEM, 24 מ ל של חזיר F12, 1.5 מ ל של סרום מופעל בחום, 0.5 מ ל של אינסולין-סלניום-העברה).
- שינוי בידול מדיה בכל יום אחר במהלך הבידול של מכשולים ראשוניים לתוך מיוכי. בידול הוא בדרך כלל להשלים לפי יום 4-5 ויסומן על ידי תאים מאורכים, התמזגו באופן ספונטני עווית. בצע ניסויים על מיולים מובחנות תוך 6 ימים. בדרך כלל תאים הם חמישה או שישה ימים לאחר התחלת בידול.
5. מדידת שיעור צריכת החמצן במינורות או ביויומטרים ב 96-צלחות ועוד
- מעיל 96-ובכן צלחות עם 25 μL של פתרון ציפוי לכל טוב. צנטריפוגה את לוחיות ב 58 x g עבור 1 דקות כדי להסיר בועות כלשהן.
- מודאת לוחיות הרישוי בפתרון ציפוי עבור 1-4 h ב -4 ° c. השתמש בצינורות מרובי ערוצים כדי להסיר את הפתרון ציפוי ולשטוף שלוש פעמים ב 25 μL של הקרה PBS/gentamicin. צנטריפוגה לפחות אחד מאותם שוטף כדי להבטיח כי בועות לא לכודים.
- הוסף 40 μL של בידול מדיה לכל באר. צנטריפוגה את התקשורת על צלחת מצופה ללא תאים עבור 1 דקות ב 58 x g כדי למנוע בועות ולהסיר את המתח פני השטח כדי לקבל שכבה אחידה של מדיה.
- הוסף תאים שהושעו ב-40 μL נוסף של מדיה לכל באר. ספין שוב ב 58 x g.
הערה: העקביות בציפוי חשוב עבור התוצאות הטובות ביותר ואת מספר התאים מצופה לכל טוב צריך להיות ממוטב עבור כל התקנה ניסיונית, וסביר להניח בטווח של ~ 10000-25000 myoblasts מצופה מדיה בידול לכל טוב של צלחת 96-באר. - שנה בעדינות את המדיה היומית במהלך בידול. אין להוריד את המדיה אלא להסיר אותו בעזרת פיפטה, להשאיר את הנפח הקטן מאחור כדי להימנע מפירוק התאים או לחשוף אותם לאוויר. לדוגמה, החלף 50 μL בכל פעם עבור שלוש חזרות ולא את כל 80 μL בו.
- השתמש 8-15 בארות לכל תנאי. ייתכן שיהיה צורך להשמיט כמה בארות אם התאים אינם יוצרים שכבה אחידה של מיומים.
הערה: השמט בארות על קצות הצלחת כי הם רגישים מאוד התאיידות. לשנות את כיוונון הצלחת לשכפל ניסיוני כדי למנוע שגיאות שיטתיות. - לבצע את הצורך הרצוי על מיולים הבדיל בתוך 1-2 ימים של בידול מלא (יום 4-6 מתחילת בידול). מכשירים מומלצים וריאגנטים למדידת שיעורי צריכת החמצן מפורטים בטבלת החומרים.
תוצאות
לאחר סעיף 1 של הפרוטוקול המסופק יש להניב תאים ראשוניים המתעוררים מתוך explants שיהיו גלויים תחת מיקרוסקופ אור רגיל (איור 2). אוכלוסיית תאים הטרוגנית יראו גדלה ומקיפה כל רקמת שריר לחקור. מיאובלי יופיע כספירות קטנות, עגולות ובהירות. לאחר סעיף 2 של הפרוטוקול תניב יבול מוקדם של myoblasts מתוך הרחבות רקמות, אשר יכיל תאים מעטים יהיה הטרוגנית (איור 3). סעיף 3 של הפרוטוקול מתאר מעבר יבול מוקדם עם ה-PBS (ולא טריפסין), אשר יספק אוכלוסייה טהורה יחסית של myoblasts נמשך עבור הליך נוסף. לאחר סעיף 4 של הפרוטוקול תניב מיולים מלאים לטיפול ניסיוני נוסף. הבידול של myoblasts חזיקה בדרך כלל לוקח 4-6 ימים, שבמהלכו המבנה של התאים ישתנה מתוך יחיד, עגול הספירות עד מוארך, התמזגו, סיבים הארוך המאוחד (איור 4). לאחר סעיף 5 של הפרוטוקול יפיק מיולים מובחנים ב 96-היטב צלחות כדי לאפשר מגוון של תווים מטבוליים בהתבסס על השינויים צריכת החמצן ושיעורי חמצה מסחטות10 (איור 5).
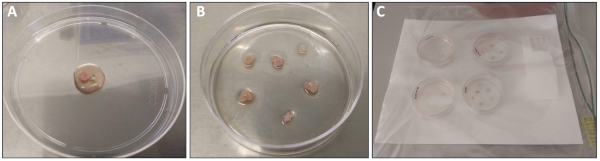
איור 1: חיתוך ועיבוד של שריר הארבע ראשי. (A) השריר הארבע ראשי כי היה טרי גזור ושטפה עם PBS לפני העברת 10 ס מ צלחת. 1 מ ל של מדיית ציפוי מצופה לעיבוד. (ב) הארבע שרירי רקמת השריר הראשי לאחר העברת מצופה מראש 6 ס מ לוחית. (ג) 6 לוחות ס מ בתוך התא הלח לפני מיקום בחממה 37 ° c. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הצמיחה של מכשולים. הצמיחה של myoblasts מתוך השרירים הארבע הראשי השריר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: המעבר המוקדם מחזיק מוקדם. P0 myoblasts חזיק לאחר העברת והחזקה T25 בקבוקון. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: הציפוי והבידול של מיופופרות ראשיות. (א) מילוכייום אחד לאחר התחלת החשיפה לבידול מדיה. (ב, ג) מובחנות חמש (ב) או שישה (ג) ימים לאחר התחלת בידול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
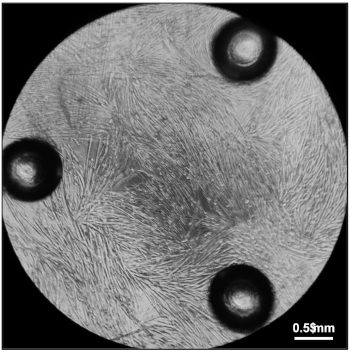
איור 5: מיונורות מוכנות למדידה של תעריפי צריכת החמצן. לגמרי הבדיל מיופופרות חמישה ימים לאחר ציפוי 20,000 myoblasts בבידול מדיה בכל באר של מיקרופלייט 96-היטב התרבות התא. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
שריר השלד חיוני להקמת ותחזוקה של הומאוסטזיס מטבולית11. המחקר של הפיזיולוגיה שרירים הוא מסובך על ידי השונות הבינאישית, כמו גם קושי להשיג דגימות, במיוחד במקרה של מחקרים אנושיים. מיולים הראשי מתורבת הוכחו לכידה של תכונות רבות של פיזיולוגיה שרירים, כולל סידן הומאוסטזיס12, התחדשות של רקמת שריר פגום5, שינויים מטבוליים בתגובה לתרגיל13, ו שינויים בחילוף החומרים כתוצאה ממחלות כגון סוכרת14. התרבות הראשית של myoblasts ומיוצינורות מעכברים מאפשר חקירה של תאי שריר מעניק היטב מניפולציות גנטיות מוגדרות, ומספק משלים למחקרים של מיוצינורות נגזר ביופסיה של האדם12,15 ,בן 16 לכן, שיטות בידוד ותרבות של העכבר הראשי myoblasts ומיוטוטים חיוניים כדי לאפשר להתרבות, התפוקה הגבוהה החקירה של תפקוד תא שריר לשעבר vivo. הפרוטוקול המתואר כאן מאפשר הקמת ולימוד של העכבר הראשי myoblasts חזיק ומיותצינורות תחת מגוון רחב של מניפולציות ניסיוני.
בעוד הפרוטוקולים הקודמים תיארו את הבידוד של תאי גזע שריר מתרבויות ההסבר, פרוטוקול זה מספק שיטה לבידוד מוצלח של myoblasts מסוגים שונים של רקמת שריר. בנוסף, שיטה זו מניבה אוכלוסיה גדולה באופן משמעותי של תאי גזע לטיפול ניסיוני נוסף. יתר על כך, שיטה זו אומתה כמו מניב מובחנים מניבים כי לבטא סמנים של תאי שריר בוגרת17, והתצוגה פיזיולוגיה נורמלית, כגון מקצבים אחראי17 ו מיעוגן הופעל חלבון קינאז (mapk) אות התמרה חושית18.
השלבים הקריטיים בפרוטוקול הם הניתוח והעיבוד של הרחבות רקמת השריר, כמו גם הימנעות זיהום בין היבול. הטיפול צריך להילקח כדי למנוע עיבוד מעל הרקמות. בעוד חתיכות קטנות יותר של תשואה שרירים מספרים גדולים יותר של myoblasts חיתוך מוגזם של השריר יכול למנוע את הצמיחה של תא גזע. אמנם חשוב לא להוציא את explants ברגע שהם מצופים, שטיפת זהיר של צלחות עם PBS/gentamicin הוא קריטי להפחתת זיהום. משלי שנקטפו עשוי להיות קפוא כמו תאים P2 בהקפאה באמצעות 10% DMSO/90% מחוז מדיה תערובת. בעוד myoblasts לא צריך להישמר בצפיפות גבוהה כדי להקל על הצמיחה, מומלץ כי התאים קפואים ב 40-50% המפגש. בדרך כלל, אחד T75 בקבוקון מניב 4 קריוצלוחיות של תאים.
Disclosures
לא.
Acknowledgements
המחברים אסירי תודה ד ר מתיו וואט באוניברסיטת מלבורן וד ר אנסטסיה קראלי באוניברסיטת ג'ונס הופקינס לסיוע אימוץ פרוטוקול זה מבוסס על העבודה של מומבל ואח '6. אנו גם מודים לד ר סבין ג'ורדן על סיוע בפיתוח ואימוץ הפרוטוקול הזה במעבדה שלנו. עבודה זו ממומנת על ידי המכון הלאומי לבריאות R01s DK097164 ו DK112927 כדי K.A.L.
Materials
| Name | Company | Catalog Number | Comments |
| Coating Solution: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| Collagen | Life Technologies | A1064401 | 1.7 mL |
| Matrigel | Fisher | CB40234A | 1 mL |
| Plating Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 12.5 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 12.5 mL |
| Heat Inactivated FBS | Life Technologies | 16000044 | 20 mL; can be purchased as regular FBS and heat-inactivated by placing in a 40 °C water bath for 20 minutes |
| Amniomax | Life Technologies | 12556023 | 5 mL |
| Myoblast Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 17.5 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 17.5 mL |
| Heat Inactivated FBS | Life Technologies | 16000044 | 10 mL; can be purchased as regular FBS and heat-inactivated by placing in a 40 °C water bath for 20 minutes |
| Amniomax | Life Technologies | 12556023 | 5 mL |
| Differentiation Media: | |||
| DMEM | Gibco | 10569010 | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| HAMS F12 | Lonza | 12-615F | Always add gentamicin (1:1000 by volume) prior to use; 24 mL |
| Heat Inactivated Horse Serum | Sigma | H1138 | 1.5 mL |
| Insulin-Selenium-Transferrin | Life Technologies | 41400045 | 0.5 mL |
| Other Materials: | |||
| PBS | Gibco | 14040133 | |
| Gentamicin | Sigma | G1397 | |
| TrypLE | Gibco | 12604013 | |
| DMSO | Sigma | 472301 | Prepare as 10% DMSO in Myoblast Media for freezing cells |
| Forceps | Any | ||
| Razor Blades | Any | ||
| Scissors | Any | ||
| Whatman paper | VWR | 21427-648 | |
| 60 mm plate | VWR | 734-2318 | |
| 10 cm plate | VWR | 25382-428 (CS) | |
| T25 Flasks | ThermoFisher | 156367 | |
| T75 Flasks | ThermoFisher | 156499 | |
| Centrifuge Tubes (15mL) | BioPioneer | CNT-15 | |
| Oxygen Consumption Rates: | |||
| Seahorse XFe96 Analyzer | Agilent | Seahorse XFe96 Analyzer | Instrument used to measure oxygen consumption rates read out by acidification of the extracellular media |
| Seahorse XFe96 FluxPak | Agilent | 102416-100 | 96-well plates for use in XFe96 Analyzer |
| Seahorse XF Cell Mito Stress Test Kit | Agilent | 103015-100 | components may be purchased from other suppliers once assay is established; some recommendations are listed below |
| Seahorse XF Palmitate-BSA FAO substrate | Agilent | 102720-100 | components may be purchased from other suppliers once assay is established; some recommendations are listed below |
| Palmitic acid | Sigma | P5585-10G | for measurement of fatty acid oxidation |
| carnitine | Sigma | C0283-5G | for measurement of fatty acid oxidation |
| Etomoxir | Sigma | E1905 | for measurement of fatty acid oxidation |
| BSA | Sigma | A7030 | used as control or in conjugation with palmitic acid for use in measurement of fatty acid oxidation |
References
- Srikanthan, P., Karlamangla, A. S. Muscle mass index as a predictor of longevity in older adults. American Journal of Medicine. 127 (6), 547-553 (2014).
- Lee-Young, R. S., Kang, L., Ayala, J. E., Wasserman, D. H., Fueger, P. T. The physiological regulation of glucose flux into muscle in vivo. Journal of Experimental Biology. 214 (2), 254-262 (2010).
- Sjøberg, K. A., et al. Exercise increases human skeletal muscle insulin sensitivity via coordinated increases in microvascular perfusion and molecular signaling. Diabetes. 66 (6), 1501-1510 (2017).
- Girgis, C. M., Clifton-Bligh, R. J., Mokbel, N., Cheng, K., Gunton, J. E. Vitamin D signaling regulates proliferation, differentiation, and myotube size in C2C12 skeletal muscle cells. Endocrinology. 155 (2), 347-357 (2014).
- Smith, J., Merrick, D. Embryonic skeletal muscle microexplant culture and isolation of skeletal muscle stem cells. Methods in Molecular Biology. 633, 29-56 (2010).
- Mokbel, N., et al. K7del is a common TPM2 gene mutation associated with nemaline myopathy and raised myofibre calcium sensitivity. Brain. 136 (2), 494-507 (2013).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1977).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. Journal of Cell Biology. 125 (6), 1275-1287 (1994).
- Musarò, A., Carosio, S. Isolation and Culture of Satellite Cells from Mouse Skeletal Muscle. Methods in Molecular Biology. 1553, 155-167 (2017).
- Smolina, N., Bruton, J., Kostareva, A., Sejersen, T. Assaying mitochondrial respiration as an indicator of cellular metabolism and fitness. Methods in Molecular Biology. 1601, 79-87 (2017).
- Elliott, B., Renshaw, D., Getting, S., Mackenzie, R. The central role of myostatin in skeletal muscle and whole body homeostasis. Acta Physiologica. 205 (3), 324-340 (2012).
- Smolina, N., Kostareva, A., Bruton, J., Karpushev, A., Sjoberg, G., Sejersen, T. Primary murine myotubes as a model for investigating muscular dystrophy. BioMed Research International. , (2015).
- Nedachi, T., Fujita, H., Kanzaki, M. Contractile C 2 C 12 myotube model for studying exercise-inducible responses in skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 295 (5), E1191-E1204 (2008).
- Chen, M. B., et al. Impaired activation of AMP-kinase and fatty acid oxidation by globular adiponectin in cultured human skeletal muscle of obese type 2 diabetics. Journal of Clinical Endocrinology and Metabolism. 90 (6), 3665-3672 (2005).
- Douillard-Guilloux, G., Mouly, V., Caillaud, C., Richard, E. Immortalization of murine muscle cells from lysosomal α-glucosidase deficient mice: A new tool to study pathophysiology and assess therapeutic strategies for Pompe disease. Biochemical and Biophysical Research Communications. 388 (2), 333-338 (2009).
- Varga, B., et al. Myotube elasticity of an amyotrophic lateral sclerosis mouse model. Scientific Reports. 8 (1), 5917 (2018).
- Kriebs, A., et al. Circadian repressors CRY1 and CRY2 broadly interact with nuclear receptors and modulate transcriptional activity. Proceedings of the National Academy of Sciences. 114 (33), 8776-8781 (2017).
- Cho, Y., et al. Perm1 enhances mitochondrial biogenesis, oxidative capacity, and fatigue resistance in adult skeletal muscle. FASEB Journal. 30 (2), 674-687 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved