Method Article
뇌의 세포 외 공간의 부피비와 비틀림을 정량화하기위한 테트라 메틸 암모늄을 이용한 실시간 이온 도입
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 살아있는 두뇌의 세포 외 공간 (ECS)의 물리적 매개 변수를 측정하는 방법 인 실시간 이온 삼투압을 설명합니다. ECS로 방출 된 불활성 분자의 확산은 ECS 부피 분율 및 비틀림을 계산하는 데 사용됩니다. 그것은 뇌의 ECS에 대한 급격한 가역적 인 변화를 연구하는데 이상적입니다.
초록
이 리뷰에서는 살아있는 두뇌의 세포 외 공간 (ECS)을 탐구하고 정량화하기위한 금 이온 표준 인 실시간 이온 삼투압 (RTI) 방법을 수행하기위한 기본 개념과 프로토콜에 대해 설명합니다. ECS는 모든 뇌 세포를 둘러싸고 있으며 간질 액과 세포 외 기질 모두를 포함합니다. 신경 전달 물질, 호르몬 및 영양소를 포함한 뇌 활동에 필요한 많은 물질의 운반은 ECS를 통한 확산에 의해 발생합니다. 이 공간의 부피와 기하 구조의 변화는 수면과 허혈과 같은 병리학 적 상태와 같은 정상적인 뇌 과정에서 발생합니다. 그러나, 특히 병이있는 상태에서 뇌 ECS의 구조와 조절은 아직 미개척이다. RTI 방법은 살아있는 두뇌의 두 가지 물리적 매개 변수, 즉 체적 분율과 비틀림을 측정합니다. 부피 분율은 ECS가 차지하는 조직 부피의 비율입니다. 구불 구불 한 (tortuosity)은 뇌를 통해 확산 될 때 물질이 마주 치는 상대적인 방해의 척도이다장애물이없는 매체에 비해 RTI에서 불활성 분자는 근원 미세 전극에서 뇌 ECS로 펄싱된다. 분자가이 소스에서 멀리 확산함에 따라 이온의 변화하는 농도는 약 100 μm 떨어진 이온 선택 미세 전극을 사용하여 시간에 따라 측정됩니다. 결과적인 확산 곡선으로부터 부피 분율 및 비틀림을 계산할 수 있습니다. 이 기술은 여러 종 (인간 포함)의 뇌 조각과 생체 내 에서 ECS의 급성 및 만성 변화를 연구하는 데 사용되었습니다. 다른 방법과 달리 RTI는 실시간으로 두뇌 ECS의 가역적 및 비가 역적 변화를 검사하는 데 사용할 수 있습니다.
서문
세포 외 공간 (ECS)은 모든 뇌 세포 외부의 상호 연결된 채널의 네트워크이며 간질 액과 세포 외 기질 모두를 포함합니다 ( 그림 1a 및 그림 1b ). 영양소, 호르몬 및 신경 전달 물질을 포함한 뇌 세포 기능에 필요한 많은 물질의 분포는 ECS를 통한 확산에 의해 발생합니다. 체적, 기하학 및 세포 외 기질을 포함한이 공간의 물리적 매개 변수의 변화는 뇌 세포 기능에 중대한 영향을 미치는 뇌 세포를 목욕시키는 ECS 및 국소 이온 농도를 통한 확산에 크게 영향을 미칠 수 있습니다 1 , 2 .
실시간 이온 삼투압 (RTI)은 뇌 영역의 두 가지 구조적 특성을 결정하는 데 사용됩니다 : 체적 분율과 비틀림 3 , 4 ,"xref"> 5. 부피 분율 ( α )은 대표적인 기본 부피의 총 조직 부피 ( V 조직 )에 대한 ECS ( V ECS )가 차지하는 조직 부피의 비율입니다.

구불러움 (tortuosity, λ )은 방해물이없는 매체에 비해 뇌 영역을 통해 확산 될 때 물질이 마주 친 상대적인 장애입니다.
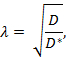
D의 * (cm 2 초 -1) 뇌 및 D의 물질의 유효 확산 계수이고 (cm 2 초 -1) 아가로 오스 겔을 희석 같은 자유 매질 물질의 자유 확산 계수이다.
오늘날 R에서 가장 일반적으로 사용되는 프로브 물질TI 법은 작은 양이온의 테트라 메틸 암모늄 (TMA)이다. TMA는 74g / mol의 분자량을 가지며 용액에서 완전히 해리되고 하나의 양전하를 띤다. 이 이온을 이용한 RTI 연구는 α  0.2 및 λ
0.2 및 λ  1.6 1 , 2 . 이것은 ECS 작은 불활성 분자의 확산 장애물 3 중간 ECS보다 대략 2.5 배 더 느리게 발생하는 뇌 전체 부피의 약 20 % 인 것을 의미한다. 그러나 α 와 λ는 모두 뇌의 나이, 지역, 상태 및 병리학 적 조건에 따라 다양합니다 1 . 이러한 매개 변수의 변경은 뇌 발달, 노화, 수면, 간질 및 기타 여러 근본적인 과정과 뇌의 질병과 관련되어 있습니다 1, 6 . 다른 기술은 α 와 λ를 측정하지만, RTI는 실시간으로 살아있는 조직의 국부적 인 영역에서 양자를 측정 할 수 있습니다. 이러한 이유로 RTI는 급성 및 가역적 인 챌린지 기간 동안 α 와 λ의 변화를 조사하는 데 필수적인 도구가되었습니다.
1.6 1 , 2 . 이것은 ECS 작은 불활성 분자의 확산 장애물 3 중간 ECS보다 대략 2.5 배 더 느리게 발생하는 뇌 전체 부피의 약 20 % 인 것을 의미한다. 그러나 α 와 λ는 모두 뇌의 나이, 지역, 상태 및 병리학 적 조건에 따라 다양합니다 1 . 이러한 매개 변수의 변경은 뇌 발달, 노화, 수면, 간질 및 기타 여러 근본적인 과정과 뇌의 질병과 관련되어 있습니다 1, 6 . 다른 기술은 α 와 λ를 측정하지만, RTI는 실시간으로 살아있는 조직의 국부적 인 영역에서 양자를 측정 할 수 있습니다. 이러한 이유로 RTI는 급성 및 가역적 인 챌린지 기간 동안 α 와 λ의 변화를 조사하는 데 필수적인 도구가되었습니다.
RTI지지 이론은 원래 니콜슨 필립스에 의해 확인하고,이 기법은 시간 4,7 이후 광범위하게 사용되어왔다. RTI를 사용하는 실험은 희석 된 아가로 오스 겔로 이온 삼투압에 의해 근원 미세 전극으로부터의 TMA 펄스의 방출로 시작된다. 일단 방출되면, 이온은 잠재적으로 무한 수의 무작위 경로 ( 그림 1d )에서 선택하여 점원으로부터 자유롭게 확산됩니다. 이온의 변화하는 농도는 대략적으로 위치 된 이온 선택적 미세 전극 (ISM)을 사용하여 시간에 걸쳐 측정된다100 μm의 거리 ( 그림 1c ). TMA 농도의 변화를 그래프로 표시하고 이온 삼투압 미세 전극 (프로토콜에서 논의 된 매개 변수)의 D 와 운송 번호를 모두 계산할 수있는 곡선에 맞 춥니 다. 이 값을 사용하여 D * 를 구하고 α 와 λ를 모두 계산하기 위해 뇌의 관심 영역에서 절차를 반복합니다. 이온 삼투압 미세 전극의 제어, 데이터 수집, TMA 농도 곡선의 그래프 및 피팅 및 실험 매개 변수의 계산은 일반적으로이 목적을 위해 특별히 설계된 Wanda 및 Walter 프로그램에 의해 수행됩니다 (소프트웨어 및 설명서는 저자의 요청에 따라 자유롭게 이용 가능).
이 리뷰의 의정서 섹션은 설치류 뇌 조각을 RTI로 설계하고 수행하는 데 필요한 기본 절차를 설명합니다. 이 기술은 또한 비로드 (non-rod)생체의 뇌 제제 1, 4, 6, 8, 9, 인간의 뇌 조각을 포함하고있는 ENT 모델. 대표 결과 섹션에서는 데이터 해석의 뉘앙스를 강조하기 위해 이상 및 비 이상적인 결과를 제공합니다. 마지막으로, 토론 섹션에서는 문제 해결 기법, RTI의 한계, ECS를 연구하는 데 사용 된 대체 기술 및 RTI의 향후 적용에 대해 간략하게 설명합니다.
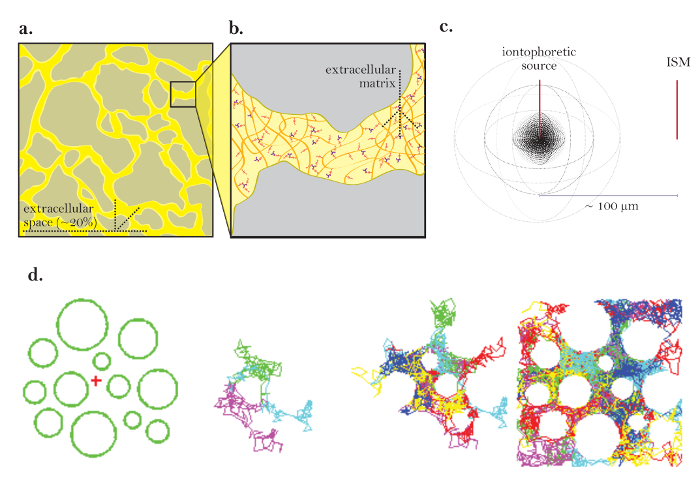
그림 1 : ECS를 통한 확산의 다이어그램. ( a ) ECS 다이어그램 : 일반적인 뇌 영역에서 ECS의 크기와 위치를 보여줍니다. 노란색은 회색 뇌 세포 과정 사이의 ECS를 표시합니다. ECS의 부피는 전체 조직 부피의 약 20 %입니다 ( 즉, 부피비 = 0).2). ( b ) ECS의 확대 된 다이어그램 : 뇌 세포 기하학 (회색)과 세포 외 기질 (다색성 글리코 사 미노 글리 칸과 프로테오글리칸의 그물망으로 그려져 있음)을 포함하여 왜곡에 기여하는 물리적 매개 변수를 강조합니다. ( c ) 점 소스로부터의 확산의 3D 다이어그램 : 이온 주입 소스에서 ISM으로의 불활성 분자의 순 움직임을 보여줍니다. 확산 장벽과 세포 흡수를 제외하면, 분자는 모든 방향으로 바깥쪽으로 확산되어 구형의 집중 전면을 생성합니다. ISM은 이온 삼투압 소스로부터 방출 된 불활성 분자의 국소 농도를 정량화합니다. ( d ) 뇌의 ECS에서 확산의 컴퓨터 시뮬레이션 : [먼 왼쪽] 몬테카를로 시뮬레이션을위한 설정; 녹색 구체는 뇌 세포 과정을 나타내고 적십자는 점 근원을 나타냅니다. 이 설정은 그림 1a 에 표시된 뇌 조직을 모델링합니다. [중간 이미지] 3 및6 분자는 2 차원으로 나타낸 뇌의 세포 외 공간을 통해 확산 될 때 무작위 운동을 수행합니다. 점원에서 방출 된 많은 분자가 무작위로 걷습니다. 그림 1c 에서 묘사 된 것처럼 점원으로부터 모든 분자의 순수 이동은 바깥 쪽입니다. 누적 된 무작위 걷기는 세포 사이의 공간을 개괄합니다 ( 예 : ECS, 자세한 설명은 참고 자료 5 참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
조직 샘플을 얻는 데 사용 된 모든 동물 절차는 SUNY Downstate Medical Center의 동물 윤리위원회의 승인을 받았습니다.
1. 솔루션 및 장비 준비
- ISM의 기준 배럴에 150mM NaCl 백필 용액을 준비하십시오. 0.22 μm 필터 (박테리아 또는 입자를 제거하기 위해)에 부착 된 10 mL 주사기에 보관하십시오.
- microelectrodes에 대한 150 MM TMA 염화물 (TMA - 클럭) backfill 솔루션을 준비합니다. 0.22 μm 필터에 부착 된 10 mL 주사기에 보관하십시오. 정확한 농도를 보장하기 위해 5M 제조업체 용액에서 TMA-Cl 용액 (이 프로토콜에서)을 준비하십시오.
- 적어도 2 시간 동안 표백제 (차아 염소산 나트륨)에 전선을 잠기 게하여 미세 전극 제조용으로 적어도 4 개의은 전선을 염화시킨다. 과량의 표백제를 에탄올로 제거하고 전선을 건조시킵니다.
- 비커에서 150 MM NaCl 및 0.5 MM TMA-Cl 중 0.3 % 아가 로즈 50 ML을 준비그것을 덮어 라. 좋은 확산 측정을 보장하기 위해 가루와 합리적으로 신선한 아가로 오스를 사용하십시오.
- 가열하고 아가로 오스 용액을 교반 막대와 혼합하여 용해시킵니다. 용액을 실온으로 식힌다. 이것을 1 ° C까지 4 ° C에 보관하십시오.
- 1 M KCl에서 4 % 아가로 오스로 만들어진 무관계 (접지) 전극 준비 (부록 A의 지침)
- 실험실에 들어갈 수 있고 내용물과 외부 환경 사이의 전기적 연속성을 허용하는 작고 다공성 인 컵을 제작하십시오 ( 그림 2a ). 부분적으로 물에 잠겼을 때 부풀지 않도록이 컵의 바닥에 금속 링을 놓습니다.
- ISM 교정을 위해 5M TMA-Cl 스톡을 연속 희석하여 100mL TMA-CL 용액 5 개를 만드십시오. 용액은 TMA-Cl 0.5 mM, 1 mM, 2 mM, 4 mM 및 8 mM의 최종 농도를 가져야한다. 증발을 방지하기 위해 밀봉 용액에 교정 용액을 보관하십시오.
2. 전자 설정
- 그림 2b 의 블록 다이어그램에 따라 실험 설정의 RTI 구성 요소를 연결합니다. 2 개의 입력 채널 (ISM의 이온 선택 배럴에 대해 매우 높은 임피던스 여야 함), 10Hz에서 설정된 로우 패스 필터, 차트 레코더, A / D + D / A 변환기, 이온 삼투압 장치 (또는 정전류 펄스를 공급할 수있는 증폭기) 및 Wanda 및 Walter 프로그램을 실행하는 컴퓨터 (PC)가 포함됩니다. 전자 설정을 검사하여 모든 연결이 제 위치에 있는지 확인하십시오.
- 필요한 경우 ISM이 높은 저항을 가지며 주변 움직임에 의해 생성되는 인공물에 민감하므로 접지 된 인클로저 (예 : 패러데이 케이지)에서 실험 설정을 보호하십시오.
- 이중 입력 증폭기, 차트 레코더, 적절한 ISM 홀더 및 무관 한 접지 전극으로 구성된 전용 ISM 교정 스테이션을 만듭니다. 가능하다면,인클로저를 보호하십시오. 실험 설정에서 ISM을 보정하는 경우이 단계를 건너 뜁니다 (3.29 단계)
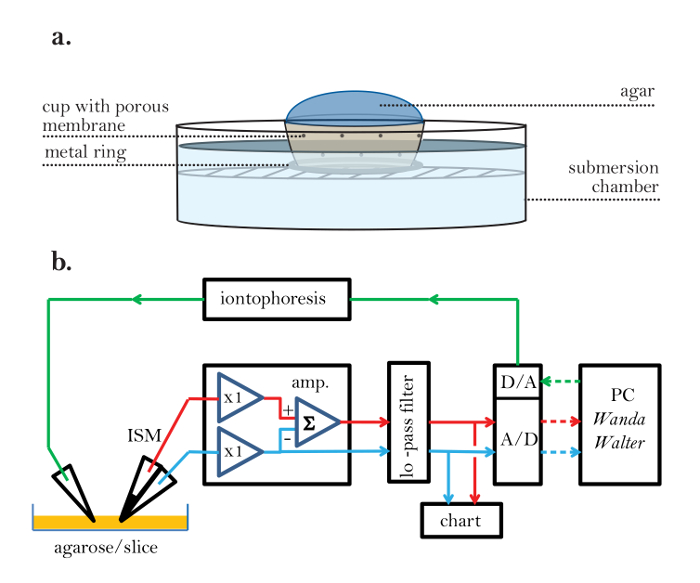
그림 2 : 다공성 실험 컵 및 전자 설정. ( a ) 다공성 실험 컵 : 아가로 오스 (내부)와 실험용 입욕액 (외부) 사이의 전기적 연속성을 허용하는 실험 컵을 만들기 위해 다공성 메쉬가 사용됩니다. 컵이 욕조에 떠 다니는 것을 방지하기 위해 컵의 바닥에 금속 링이 부착되어 있습니다. ( b ) RTI 설정의 블록 다이어그램 (2.1 및 2.2 단계) : ISM이 증폭기 (앰프)에 연결되어 있습니다. ISM에는 두 개의 배럴이 있습니다. 하나는 팁에 액체 이온 교환기 (LIX)를 포함하고 국소 주변 전압과 함께 팁에서 TMA 농도의 대수에 비례하는 전압을 생성합니다. 일e 신호 경로는 빨간색 선으로 표시됩니다. ISM의 다른 배럴은 기준 배럴로 알려져 있으며 ISM의 팁에서 주변 전압을 측정합니다. 그것은 청색 신호 경로로 연결됩니다. 증폭기에는 ISM에 연결되는 두 개의 소위 헤드 스테이지가 있습니다. 이들 유닛은 1 (x1)의 이득을 가지며 마이크로 전극의 하이 임피던스를 나머지 증폭기 회로의 로우 임피던스와 정합시킨다. 이온 선택 배럴에 연결된 헤드 스테이지는 약 1,000MΩ의 유입 저항과 일치 할 수 있어야하며 기준 배럴의 저항은 일반적으로 약 10MΩ입니다. 헤드 스테이지를 떠난 후 기준 배럴의 전압을 반전시키고 합산 증폭기 (Σ)를 사용하여 이온 선택 배럴의 전압에서 빼내 순수한 이온 신호 전압을 얻습니다. 증폭기의 출력은 추가 증폭 및 다중 폴 (multipole) 저역 통과 필터 (≤ 10 Hz, 일반적으로 Bessel fi필터는 노이즈를 제거하고 아날로그 - 디지털 변환기 (A / D)에서 신호 앨리어싱을 방지합니다. 필터의 출력은 스트립 차트 레코더에도 표시됩니다. A / D 컨버터는 신호를 디지털화하여 PC (personal computer)로 보냅니다. 또한 PC는 디지털 신호를 생성하여 D / A 변환기를 통해 이온 토 포레 시스 장치에 공급되는 아날로그 전압 펄스로 변환합니다.이 펄스는 전압을 일정한 진폭의 전류 펄스로 변환하여 전송합니다 이온 삼투압 미세 전극에 전달한다. 이온 삼투압 신호 경로는 녹색 선으로 표시됩니다. 데이터 수집 및 이온 삼투압 신호는 Wanda 프로그램의 통제하에 있으며, Wanda 프로그램은 실험을 정의하는 모든 매개 변수와 함께 전압 대 시간 기록의 형태로 각 확산 기록에 대한 출력 파일을 생성합니다. 두 번째 프로그램 인 Walter는 출력 파일을 읽고 ISM 교정 데이터를 사용하여 디지털화 된 전압을 농도로 변환합니다. 집중력rsus 시간 곡선은 Walter에서 확산 방정식에 대한 적절한 해답에 맞추어진다. D 와 n t 는 매체가 아가로 오스라면 추출되고 λ와 α 는 매체가 뇌인 경우 추출됩니다. 아날로그 신호는 실선입니다. 디지털 신호는 점선입니다. 또한 슬라이스를 함유 한 배쓰에 무관심한 접지 전극 (도시하지 않음)이있다. 빨간색 선 = 이온 신호, 파란색 선 = 기준 신호, 녹색 선 = 이온 삼투압 명령, 실선 = 아날로그, 점선 = 디지털. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 이온 선택적 미세 전극의 준비와 교정
- 실험 하루 전에 아래의 프로토콜을 사용하여 ISM을 제작하십시오. ISM을 일괄 처리하여 실험 당일에 적어도 두 가지가 작동하도록합니다.
참고 : 대부분의 ISM은 하루 동안 안정적입니다.두. ISM 제작은 습도 및 대기 조건에 민감합니다. 모든 미세 전극이 성공적으로 교정되지는 않습니다. - 오래된 포셉 한 쌍을 사용하는 이중 배럴 붕 규산염 유리 모세관의 배럴 중 하나 끝에 약 0.5cm 떨어진 유리 칩을칩니다.
- 모세관의 반대쪽 끝에 단일 배럴을칩니다 ( 그림 3a ). 격막이 손상되지 않았는지 확인하십시오 (위험). 주의 : 발사 유리로 인한 부상을 방지하기 위해 고글을 착용하십시오.
- 모세관을 적어도 1 시간 동안 아세톤 병에 넣고 오염 물질을 제거합니다.
- 아세톤에서 모세관을 제거하고 과량의 아세톤을 제거하기 위해 세척, 건조, 압축 질소 가스 또는 공기를 펄스하십시오. 남아있는 아세톤이 실란 화를 방해 할 수 있으므로 모세관의 모든 아세톤을 제거하십시오 (중요).
- 세로 또는 가로 풀러에 micropipette의 끝을 조작하십시오. 긴 테이퍼로 피펫을 당길 수있는 매개 변수를 조정하고날카로운 팁, 약 1 μm 이하의 직경. 이 단계가 끝나면 하나의 모세관이 두 개의 피펫으로 만들어집니다 ( 그림 3a ).
- 복합 10X 대물 렌즈가있는 직립 현미경으로 단일 마이크로 피펫을 시각화합니다. 팁의 최종 직경 ( 즉, 두 배럴)이 2 ~ 5 μm ( 그림 3b )가되도록 유리 현미경 슬라이드를 사용하여 팁을 잘라냅니다. 이 피펫은 이제부터는 ISM이라고합니다.
- 0.22 μm의 필터와 28 G, 97mm 바늘 ( 그림 3B )에 부착 된 10 ML 주사기를 사용하여 부서진 측면에있는 구멍을 통해 150 MM NaCl 참조 솔루션 ISM의 부서진 배럴을 채 웁니다. 배럴 높이의 4 분의 3을 지나서 배럴을 채우지 마십시오.
- 150 mM TMA-Cl 백필 용액으로 ISM의 조각이 채워지지 않은 배럴을 채 웁니다. ISM을 가볍게 두 드리면 용액에서 공기 방울이 빠져 나옵니다. 마이크 아래에 거품이 있는지 확인하십시오.팁을 치핑하는 데 사용되는로 스코프.
- Bunsen 버너를 사용하여 ISM의 뒷면을 화염시켜 ISM 뒤쪽의 격벽을 가로 질러 백필 용액이 흐르지 않도록하십시오. 화염 후 ISM의 상단 1/4이 건조한 지 확인하십시오.
- 염화은 와이어를 ISM의 기준 용액에 넣고 모세관에서 튀어 나온 와이어를 구부려 기준 배럴 ( 그림 3c )으로 표시합니다. 와이어가 백필 용액에 잠기고 실험 기간 동안 용액에 남아 있는지 확인하십시오.
- 25G 주사기 바늘 끝에 짧은 길이의 폴리 테트라 플루오르 에틸렌 튜빙 (약 20cm 길이)을 밀어 넣습니다. 이온 선택 배럴의 뒷면에 튜브의 다른 끝을 놓습니다. 튜빙이 배럴에 있지만 백필 용액보다 위에 있는지 확인하십시오 ( 그림 3c ).
- 분젠 버너로 치과 용 왁스 막대를 가열하고 튜빙과 실을 밀봉하십시오( 그림 3c ). 이온 선택 배럴의 플라스틱 튜빙 주위에 완전한 에어 실이 생성되었는지 확인하십시오 (중요).
- 크실렌 중 4 % 클로로 트리메틸 실란의 작고 투명한 유리 용기 (5 mL 이하)를 준비하십시오. 주의 : 크 실렌과 실란은 건강에 매우 위험합니다. 두 화학 물질을 흄 후드 내부에서 처리하고 적절히 폐기하십시오.
- 뚜껑 후드에 수평으로 장착 된 스테레오 해부 현미경의 앞에 용기를 놓습니다. micromanipulator를 사용하여 컨테이너 위에 수직으로 ISM을 고정시킵니다 ( 그림 3d ).
- chlorotrimethylsilane 솔루션 microelectrode의 팁을 딥.
- ISM으로 이어지는 25 게이지 바늘에 빈 10 mL 주사기를 부착하십시오. TMA-Cl 용액의 거품이 형성 될 때까지 주사기에서 양의 공기 압력을가하십시오. 이 단계는 현미경을 통해 직접 시각화하에 수행되어야합니다.
- 팁에서 거품을 두드리기 위해 ISM 홀더를 부드럽게 두 드리십시오.
- 10 ML 주사기에 부정적인 압력을 사용하여 ISM의 끝 부분에 대략 1,500 μm의 높이 chlorotrimethylsilane 솔루션을 그립니다.
- 팁에서 TMA-Cl 용액의 거품이 생성 될 때까지 ISM의 팁에서 chlorotrimethylsilane 용액을 완전히 배출하십시오 ( 그림 3d ).
- 단계 3.19 및 3.20을 다섯 번 반복하십시오. 매번 액체가 연속적으로 쏟아져 나오는지 확인하십시오. 팁을 잡아 당길 수없는 경우 호스가 막혔는지, 에어 씰이 불완전한 지 또는 ISM의 팁이 막혔는지 확인하십시오.
- TMA-Cl 용액의 버블이 생성 될 때까지 팁 밖으로 모든 클로로 트리메틸 실란 용액을 세척하십시오.
- 주사기에 긍정적 인 압력을 유지하면서 크실렌 용액에서 ISM을 제거합니다. 초과 된 크실렌이 exc를 파괴하므로 모든 크실렌 용액이 ISM 팁에서 배출되도록하십시오.행거 열은 후속 단계에서 생성됩니다.
- TMA 용 액체 이온 교환기 (LIX)가있는 작고 투명한 용기 (교환기가 들어있는 소형 용기 또는 소형 큐벳)에 ISM의 끝 부분을 놓습니다. 수평 현미경 설정을 사용하여 직접 시각화에서이 단계를 수행하십시오.
- 소량의 부압을 가해 최소량의 LIX를 팁에 넣습니다 ( 예 : LIX가 팁에 들어가면 부압을 가하지 않음).
- 튜빙에서 10mL 주사기를 분리하고 ISM이 5 분 동안 앉도록하십시오. 그 시간 동안, LIX는 평형 상태에 도달 할 때까지 silanized 팁에 들어갑니다.
- LIX에서 ISM을 제거하십시오. 가능한 한 작은 왁스를 제거하면서 교환기 배럴에서 튜빙을 당겨냅니다. 염화은 전선을 ISM의 뒤쪽에있는 작은 구멍에 넣습니다. 용융 된 왁스로 교환기 통의 백필에 와이어를 밀봉하십시오.
- ISM 허용적어도 30 분 동안. 유연한 임시 접착제를 사용하여 완료된 ISM을 비커의 안쪽 가장자리에 부착하십시오.
- 1.8 단계에서 만든 각 보정 용액에 ISM으로 측정 한 전압을 기록하여 ISM을 보정하십시오.
참고 : 교정은 교정 스테이션 (2.3 단계 참조) 또는 실험 설치에서 수행 할 수 있습니다. 이 절차는 부록 B와 Haack 외 10 에 요약되어있다. - 여러 ISM에 대해 ISM 보정이 성공적으로 수행 된 경우 의도 한 사용 일까지 여기에서 중지하십시오. 그렇지 않은 경우 ISM을 추가로 가공하십시오.
- 실험 당일, 미세 전극을 다시 보정하십시오 (3.29 단계 참조).

그림 3 : 이온 선택 식 미세 전극의 준비. ( a ) 모세관의 끝을 치핑하고 잡아 당긴 후 ISM (3.2-3.6 단계) : 양쪽 끝의 단일 배럴 ofa 유리 모세관이 부서진다. ISM은 이중 팁 식 유리 모세관 하나를 당겨 정밀한 팁이있는 두 개의 마이크로 피펫을 생성하여 생성됩니다. ( b ) 두 배럴을 채우고 나서 ISM (3.7-3.9 단계) : 단일 ISM의 팁을 직경 2 ~ 5 μm로 칩핑합니다. 이온 선택 배럴에는 TMA-Cl이 채워지고 기준 배럴에는 NaCl이 채워집니다. ( c ) 클로로 트리메틸 실란으로 코팅하기 전의 ISM (단계 3.11-3.13) : 염화은 전선을 기준 배럴에 삽입한다. Polytetrafluoroethylene (PTFE) 튜빙은 25G 바늘에 연결되어 이온 선택 배럴에 삽입됩니다. 치아 왁스를 사용하여 두 배럴 상단에 기밀 봉인이 만들어집니다. ( d ) 클로로 트리메틸 실란으로 마이크로 피펫 코팅 (단계 3.15-3.26) : [저배율] 수평 적으로 장착 된 실체 현미경과 일치하여 클로로 트리메틸 실란에 현탁 된 ISM. [고배율 (high magnification)] 수평으로 장착 된 stereomicroscchlorotrimethylsilane 용액에 ISM 팁의 ope. 현미경을 통해 팁을 시각화 한 후, 소량의 TMA-Cl 용액을 이온 선택 배럴 (TMA-Cl 용액의 작은 거품을 생성하기에 충분)에서 제거합니다. ISM 홀더를 두드려 TMA-Cl 용액 거품을 방출 한 다음 클로로 트리메틸 실란을 팁으로 끌어 올립니다. 이주기는 여러 번 반복됩니다. 모든 클로로 트리메틸 실란이 ISM에서 분출 된 후 ISM을 TMA 용 액체 이온 교환기 (LIX)에 넣고 LIX를 이온 선택 배럴의 팁으로 가져온다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. Iontophoresis Microelectrodes의 준비
참고 : Iontophoresis microelectrode는 실험 당일 날조해야합니다.
- 수직 또는 호에 이중 괄호 붕규산 유리 모세관을 당깁니다.rizontal 끌어 당기는 사람. 단계 3.6 ( 그림 4a )에서 뽑아 micropipettes와 유사한 피펫을 당겨 매개 변수를 조정합니다.
- 3.7 단계에서 사용되는 복합 현미경 아래에 micropipette을 놓고 결과 직경이 2 ~ 5 μm ( 그림 4a )가되도록 유리 현미경 슬라이드를 사용하여 팁을 잘라냅니다.
- 0.22 μm 필터와 28 G, 97 mm 바늘 ( 그림 4a )에 부착 된 10 ML 주사기를 사용하여 150 MM TMA - C 백필 용액으로 두 배럴을 채 웁니다.
- 미세 통을 가볍게 두드려 두 배럴의 용액에 기포가 남지 않도록하십시오.
- micropipette의 두 배럴에 chloridized 실버 전선을 놓으십시오. 와이어가 백필 솔루션에서 충분히 깊어서 실험 기간 동안 솔루션과 계속 접촉 할 수 있도록하십시오.
- 뜨거운 치과 용 왁스를 사용하여 전선을 배럴에 밀봉하십시오. 부드럽게 연동 ( 그림 4b에 표시된 완성 된 미세 전극).

그림 4 : Iontophoresis Microelectrode의 준비. ( a ) 두 배럴을 채우고 난 후의 이온 도입법 미세 전극 (단계 4.1-4.3) : 모세관으로부터 이온 삼투압 미세 전극을 잡아 당긴다. 미세 전극의 팁은 2-5 μm의 직경으로 칩핑됩니다. 이온 삼투압 미세 전극의 두 배럴은 TMA-Cl 용액으로 채워진다. ( b ) 완료 iontophoresis microelectrode (4.5-4.6 단계) : 두 개의 염화은 전선이 배럴에 삽입 된 이온 삼투압 미세 전극. 미세 전극의 배럴은 왁스로 밀봉되고,은 전선은 미세 전극의 뒤쪽에서 함께 비틀어진다./files/ftp_upload/55755/55755fig4large.jpg "target ="_ blank ">이 그림의 확대 버전을 보려면 여기를 클릭하십시오.
5. 인공 뇌척수액 및 설치류 뇌 조직 절편의 준비
- 실험에 적합한 조성을 가진 인공 뇌척수액 (ACSF) 1 L을 준비하고 0.5 mM TMA-Cl을 넣는다.
참고 : TMA-Cl은 실험 중에 TMA의 백그라운드 농도를 설정하는 데 필요합니다. - 표준 프로토콜 11 , 12 에 따라 400 μm의 두께와 설치류 두뇌 조각을 준비합니다. 뇌 조각의 해부 및 유지 관리를 위해 5.1 단계에서 준비한 ACSF를 사용하십시오.
6. 아가로 오스의 실시간 이온 도입법
- Walter 및 Wanda 프로그램을 실행하는 컴퓨터를 켜십시오.
참고 :이 프로그램은 요청에 따라 무료로 사용할 수 있습니다. 이 소프트웨어가 필수적인 것은 아니지만 유사한 프로그래밍소프트웨어 또는 손으로 분석을 수행하는 것이 필요합니다. - 적절한 속도 ( 예 : 2 mL / min)로 침수 챔버를 통해 ACSF를 실행하십시오. 온도 컨트롤러를 원하는 온도로 설정하고 실험 기간 동안 95 % O 2 / 5 % CO 2 (또는 다른 적절한 가스 혼합물)로 버블 ACSF를 버블 링하십시오.
- 적절한 홀더에 무관계 (접지) 전극을 장착하고 침지 챔버를 통과하는 ACSF에 팁을 잠급니다. 와이어를 녹음 설정의 접지에 연결하십시오.
- 이전에 준비한 0.3 % 아가로 오스로 다공성 컵 (단계 1.7에서 만든)을 채우고 침수 챔버에 넣으십시오. 용액이 컵 상단을지나 가지 않도록하십시오.
- 하나의 micromanipulator의 피펫 홀더와 두 번째 iontophoresis microelectrode에 보정 ISM을 확보. 홀더를 설치에 적합한 각도로 설정하십시오 ( 그림 5a ).
- 잇다ISM 및 이온 삼투압 미세 전극 와이어는 기록 증폭기의 각각의 헤드 스테이지에 연결된다. 또는 앰프에 직접 연결하십시오 (설정에 따라 다름).
- 위치 선정의 작은 변동이 결과에 영향을 줄 수 있으므로 연결 와이어 또는 클립의 무게 / 위치가 미세 전극을 움직이지 않도록하십시오.
- 전자 설정을 켜십시오 (2 단계에서). Walter와 Wanda를 별도의 인스턴스로 시작하십시오.
- Wanda GUI에서 "Calibrate"를 클릭하십시오 ( 그림 6a ). 보정 상자 ( 그림 6b )에서 ISM 교정 중에 측정 된 전압을 채우고 (3.29 단계) "Fit Data"를 클릭하십시오.
참고 : 이는 Nicolsky 방정식의 다음 표현에 적합하게합니다 (또는 방정식을 M 과 K 를 얻기위한 다른 방법으로 맞 춥니 다).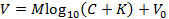
그녀V 는 측정 된 전압 (mV), M 은 니콜 스키 기울기 (mV), C 는 이온 농도 (mM), K 는 간섭 (mM), V 0 는 오프셋 전압 (mV) 3 이다. - Calibrate 상자에서 "Accept"를 클릭하여 단계 6.9에서 생성 된 경사 ( M )와 간섭 ( K )을 기본 GUI로 자동 전송하십시오.
참고 : 여기에서 K 는 일반적으로 무시할 수있는 Na 간섭을 나타냅니다. - GUI의 왼쪽에서 모든 실험 매개 변수가 해당 항목에 설정되어 있는지 확인하십시오 ( 그림 6a ).
- 소스 방법 상자에서 이온 주입 소스 (기본값), "기록 지속 시간"을 "200 초"(기본값), "펄스 시작"을 "10 초"(기본값), "펄스 종료" "60s"(기본값), "바이어스 전류"를 "20nA"(기본값),"Main Current"를 "100 nA"(기본값)로 설정하고 "Conversion Factor"를 적절한 값으로 설정하십시오.
- Measuring Electrode (측정 전극) 상자에서 "Bath C"를 욕조 용액에 포함 된 TMA의 농도 (mM로 표시)로 설정합니다. 사용중인 데이터 수집 시스템에 적절한 값으로 "총 이득", "출력 채널", "ISM 채널"및 "참조 채널"을 설정하십시오.
참고 : "Conversion Factor"는 적절한 값 (사용중인 이온 삼투압 유니트에만 해당)으로 설정해야합니다. 이 값은 D / A 변환기에서 주어진인가 전압 (nA / mV)에 대해 통과하는 전류의 양을 지정합니다.
- 온도 프로브를 한천 컵에 넣으십시오. 측정 된 온도를 GUI의 "Measuring Electrode"상자에있는 "Temperature"항목에 기록하십시오 ( 그림 6a ).
- 보조 무대 조명기를 켭니다. 필요한 경우 마이크에 연결된 카메라를 켭니다.roscope 및 카메라 모니터입니다.
- 아가로 오스에 적어도 1,000 μm의 깊은 microelectrodes을 낮추고 컵 ( 그림 5b )에 그들을 중심으로. 현미경으로 10X 대물 렌즈 (긴 작동 거리의 수침 객관식)를 사용하여 시각화하십시오.
- 아가로 오스에 기록 된 전압을 기준 전압으로 설정하기 위해 기준 전압과 ISM 채널 모두에 대해 앰프의 전압을 0 mV로 오프셋합니다.
- 2 채널 증폭기에서 수동으로 ISM 채널 커넥터를 전압 빼기 출력으로 이동하여 기준 채널과 ISM 채널 사이의 뺄셈을 설정하십시오.
참고 : 뺄셈은 ISM 채널의 전압 변화가 TMA 농도의 변화 만 반영 함을 보장합니다. - 이온 삼투압 미세 전극의 끝 부분에 닿도록 ISM을 움직입니다. 세 방향 축 모두에서 팁을 가운데에 맞 춥니 다.
- 두 미세 전극의 상대 위치를 제로micromanipulator 컨트롤 박스. 미세 전극이 정확하고 정확하게 (중요하게) 중앙에 위치하는지 확인하십시오.
- 한 축 (왼쪽 - 오른쪽 축, 그림 5b )에서 이온 삼투압 미세 전극에서 ISM을 120 μm 멀리 이동시킵니다. 이 거리를 GUI의 "Measuring Electrode"박스에 입력하십시오 ( 그림 6a ).
- GUI에서 "Acquire"를 클릭하여 녹음을 시작하십시오 ( 그림 6a ). 프로그램이 전체 녹음을 녹음 할 수있게하십시오.
참고 : iontophoresis microelectrode는 일정한 바이어스 전류를 수신합니다. "Acquire (획득)"를 클릭 한 후 주 전류가 제한된 기간 동안 적용되기 전에 약간의 지연이 있습니다. - 6.20 단계를 2 ~ 3 회 더 반복합니다. 새로운 기록을 얻기 전에 TMA 신호가 기준선으로 되돌아 갈 때까지 기다리십시오. 프로그램은 나중에 분석 할 수 있도록 각 레코드를 저장합니다.
- ISM을 뒤로 움직여 두 개의 미세 전극의 간격을 확인하십시오.o 컨트롤 박스에 의해 지정된 제로 위치. 미세 전극이 더 이상 가운데에 있지 않으면 6.17 단계와 동일한 전략을 사용하여 미세 전극을 다시 중심에 놓습니다. 전극 위치의 변화를 기록하십시오.
참고 : 간격이 약 2 % 이상 변경되면 6.19 단계에서 수집 한 레코드를 정확하다고 생각할 수 없으며 새로운 레코드를 가져와야합니다.
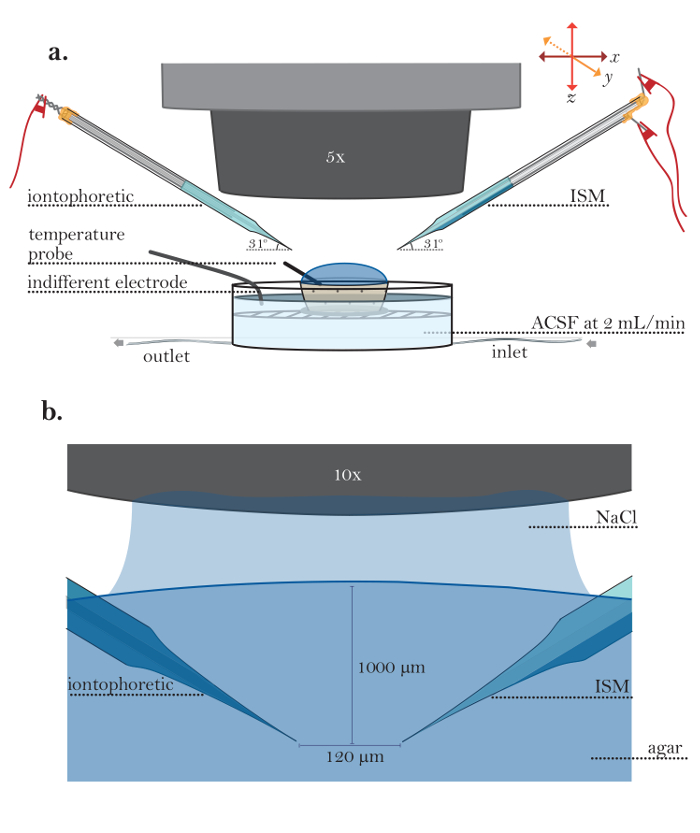
그림 5 : Agar에서의 실험 설정. ( a ) 희석 한천 (단계 6.1-6.5)에서 실험을위한 설치 : 실행중인 관류 챔버에 배치 희석 한천으로 가득한 작은 다공성 용기. 이온 삼투압 미세 전극 (왼쪽)과 ISM (오른쪽)은 미세 전극 홀더에 의해 유지됩니다. 미세 전극 홀더는 로봇 마이크로 매니퓰레이터의 팔에 끼워져있다. 온도 프로브를 한천 겔에 넣고 무관심한 접지 전극을 pl침수 챔버 내에 있어야한다. ( b ) 한천에 microelectrodes의 확대보기 : iontophoresis microelectrode (왼쪽)와 ISM (오른쪽) 10X 물이 침지 목표 (150mM NaCl에 여기 잠긴 목적)를 사용하여 한천에서 시각화됩니다. Microelectrodes는 micromanipulators를 사용하여 1,000 μm의 깊이에 위치합니다. 미세 전극 사이의 간격은 120μm이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6 : Wanda 컴퓨터 소프트웨어 인터페이스. ( a ) Wanda 탐색 GUI (그래픽 사용자 인터페이스) : Wanda 소프트웨어를 연 후에 나타나는 화면입니다. 박스 (1)에서, 적절한 매질, 이온 삼투 요법 분자 및 기술이 선택된다. (2) "보정"을 클릭하면완다 보정 상자. ISM ( 그림 6b 및 부록 B 참조)을 보정 한 후 ISM은 프로토콜의 6 단계 및 8 단계에서 설명한대로 한천 또는 두뇌에 위치합니다. 박스 (6)에서, 수행되는 실험에 대한 모든 적절한 값이 입력된다. (7) "Acquire"를 클릭하면 녹음이 시작됩니다. Wanda GUI의 오른쪽 위 부분에 전압 대 시간의 그래프가 나타납니다. ( b ) Wanda에서 ISM 보정 : Wanda GUI에서 (2) "Calibrate"를 클릭하면 열리는 창이 열립니다. 3.29 단계의 값이 상자 (3)에 입력되고 (4) "데이터 맞춤"이 선택됩니다. 검량선은 선형으로 확인됩니다. (5) Wanda GUI로 돌아가려면 "수락"을 클릭하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
아가로 오스 데이터 분석
- 그컴퓨터 (PC)의 월터 프로그램. "0. Records From :"메뉴에서 Wanda ( 그림 7a )에 의해 생성 된 레코드를 읽으려면 "Wanda / VOLTORO"버튼을 클릭하십시오. 스프레드 시트에 대한 출력이 필요하다고 생각되면 해당 소프트웨어를여십시오. "1. Excel 작성?"에서 "시트 1,3"을 클릭하십시오. 메뉴 ( 그림 7b ).
- 다음 팝업 창에서 읽을 레코드를 선택하고 "열기"를 클릭하십시오 ( 그림 7b ). 레코드가 자동으로 그래프로 표시됩니다. 피팅 절차를 시작하려면 다음 단계를 수행하십시오.
- "2. 옵션"메뉴에서 "선택 녹음"버튼을 클릭하십시오. " 그림 2 "팝업 창에서 마우스를 사용하여 처리 할 첫 번째 레코드 위로 십자선을 이동하십시오 ( 그림 7c ). 마우스 버튼을 눌러 레코드를 선택하십시오.
- o를 클릭하십시오.n "fit curve"를 선택하십시오. 피팅의 반복 횟수를 선택하십시오. 데이터의 정확한 적합성을 얻기 위해 적어도 20 번의 피팅 반복을 사용하십시오.
- 메뉴에서 "모든 데이터"를 선택하고 "계속"을 선택하십시오. 프로그램이 표시된 곡선에 맞을 것입니다. 피팅 절차를 관찰하고 얻은 최적의 맞춤 곡선과 실험 기록을 비교하십시오.
- "7. 결과"메뉴 ( 그림 7d )에서 "Excel"을 클릭하여 결과를 적절한 스프레드 시트 프로그램에 쓰는 옵션을 선택하십시오. ' D (E5) ', ' Reference D (E5) ', ' r_app ', 운송 번호 ' n t ', ' Apparent '와 같은 이온 삼투압 미세 전극의 기능을 결정하는 데 사용될 중요한 데이터를 기록하십시오. n t '.
참고 : " D (E5) ": 측정 된 자유 확산 계수TX (10) 5 (2 cm / s); " 기준 D (E5) ": 이론적 자유 확산 계수 x 10 5 (cm 2 / s). 이 값은 이온, 매체 및 온도 입력을 기반으로 Walter 내의 데이터베이스에서 추출됩니다. " r_app ": 측정 된 기준 D (E5)를 기준으로 계산 된 겉보기 미세 전극 간격 (cm ) . " n t ": 운송 번호 (무차 원). 이 숫자는 TMA 4 를 방출하는데 사용되는 이온 삼투압 전류의 분율을 결정합니다. " 명백한 n t ": 명백한 운송 번호 (무 차원). r_app 에서 계산 된 전송 번호입니다. 이 값은 측정 된 n 개의 t에 가까워 야한다. - 선택한 한 쌍의 미세 전극에 대한 각 레코드에 대해 7.1-7.3 단계를 반복하십시오.
- 이온 삼투압 미세 전극의 사용 여부는 다음과 같이 결정합니다.
- " r_app" 를 실제 r ( 즉, 120 μm)과 비교하십시오. 모든 임상 시험의 평균값이 서로 4 % 이내이면이 기준이 충족됩니다.
- " D (E5)" 와 Reference D (E5)를 비교하십시오. 모든 임상 시험의 평균값이 서로 8 % 이내이면이 기준이 충족됩니다.
- 동일 microelectrode로 시행 간의 " n t "을 비교하십시오. 모든 임상 시험의 평균값이 서로 10 % 이내이면이 기준이 충족됩니다.
- 7.5 단계의 기준 중 하나가 충족되지 않으면 이온 삼투압 미세 전극 문제를 해결하거나 다른 것을 시험하기 시작합니다.
- 이온 삼투압 미세 전극이 실험에 적합하다고 판단되면 Wanda GUI의 "Transport Num N"필드 ( 그림 6a )에서 모든 시도의 평균 운송 횟수를 기록하십시오.
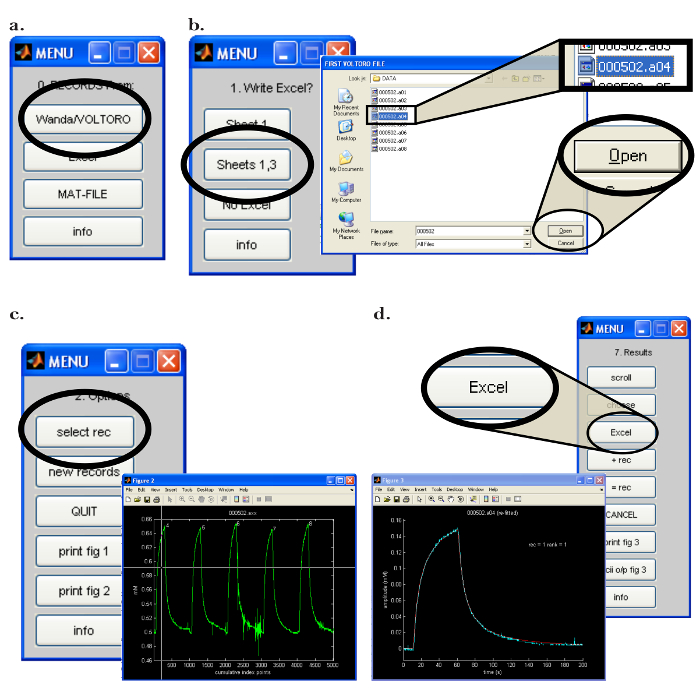
그림 7 : Walter 컴퓨터 소프트웨어 인터페이스. ( a ) Walter에서 데이터 수집 프로그램 선택 : Walter 소프트웨어를 시작한 후 "0. Records From :"메뉴가 열립니다. Wanda가 저장 한 레코드를로드하는 옵션은 "Wanda / Voltoro"버튼을 클릭하여 선택합니다. ( b ) Walter에서 데이터 및 데이터 분석 출력 위치 선택 : [왼쪽] 적절한 스프레드 시트 프로그램이 열리면 이전에 열린 스프레드 시트 프로그램에 모든 Walter 데이터 분석을 출력하도록 "Sheets 1,3"이 선택됩니다. [오른쪽] 데이터 분석 출력 위치를 선택한 후 사용자가 Walter에서 읽은 첫 번째 및 마지막 녹음을 선택할 수있는 팝업 창이 열립니다. ( c ) Walter에서 분석 할 녹음 선택하기 : [Right] 읽으려는 파일을 선택한 후, 선택한 모든 레코드가 표시된 팝업 창이 열립니다그래프로 재생됩니다 ( " 그림 2 "). [왼쪽] "2.Options"메뉴에서 "rec 선택"을 클릭하고 마우스를 사용하여 십자 기호를 이동하여 분석을위한 첫 번째 녹음을 식별합니다. 마우스 버튼을 눌러 녹음을 선택하십시오. ( d ) Walter에서 스프레드 시트로 데이터 분석 내보내기 : 데이터를 맞추면 팝업 창이 나타나고 "7. 결과"메뉴가 나타납니다. [Left] 월터 (적색)에 의해 생성 된 적합한 확산 곡선과 함께 선택된 레코딩의 그래프 (파란색). [오른쪽] "7. 결과"메뉴를 사용하면 분석에서 "Excel"버튼을 클릭하여 스프레드 시트 프로그램에 데이터를 쓸 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 뇌 절편에서 실시간 Iontophoresis
- 400 μm 두께의 뇌를 넣으십시오.lice는 기록 실에서 완전히 흐르는 ACSF에 잠기도록 보장합니다. 수채화 물감 붓을 사용하여 슬라이스를 배치하고 그리드로 부드럽게 고정합니다.
- 이온 삼투압 미세 전극과 ISM을 두뇌 슬라이스의 관심 분야 위에 이동하십시오. 흐르는 ACSF에서 둘 다 잠기십시오 그러나 조각의 위.
- 기준 및 이온 감지 채널의 전압을 "0"mV로 오프셋합니다. 두 채널의 전압이 안정 될 때까지 기다리십시오. 차트 레코더에서 ISM의 이온 감지 채널에서 측정 된 전압을 표시하십시오. Wanda의 기본 V 매개 변수를 계산할 때 사용합니다.
- ISM과 이온 삼투 microelectrode 200 μm의 깊이 슬라이스와 서로 120 μm의 멀리 놓으십시오. 미세 전극을 뇌 절편으로 이동시킨 후 신호가 안정화 될 때까지 기다리십시오.
참고 : 이온 삼투압 미세 전극에 적용된 바이어스 전류는 TMA의 작은 누적을 유발합니다. ar을 먹는 것은 흔한 실수입니다.너무 빨리 발음하고 신호 축적을 과소 평가했다. - 차트 레코더에서 ISM의 이온 감지 채널에서 뇌 조각으로 측정 된 안정화 된 전압을 표시합니다. 8.3 단계와 8.4 단계에서 측정 된 TMA 신호의 전압 차를 계산하고 Wanda GUI의 Measuring Electrode 상자 ( 그림 6a )의 "Baseline V (mV)"필드에이 값을 입력하십시오.
- GUI의 왼쪽에서 모든 실험 매개 변수가 올바르게 기록 / 입력되었는지 확인하십시오. 단계 7.4에서 이온 삼투압 미세 전극에 대해 계산 된 평균값으로 "중간"을 "뇌"로 설정하고, "온도"를 슬라이스가 들어있는 욕조의 온도로 설정합니다.
참고 : V 는 각 측정 세트에 대해 기록되어야합니다. 기준선 V 는 Wanda에 의해 기준 C (mM) 매개 변수 ( 즉, 뇌 조직의 TMA 농도)로 변환됩니다. - "Acquire"를 클릭하여 녹음을 시작한 후 녹음을 시작합니다. 새로운 녹음을 얻기 전에 TMA 신호가 기준선으로 되돌아 갈 때까지 기다리십시오.
- 선택한 뇌의 위치에서 미세 전극을 제거하기 전에 2 ~ 3 회의 연속 녹음을하십시오. Wanda 소프트웨어에 측정 된 온도를 각 기록 직전에 입력하십시오.
- 두 미세 전극을 대각선으로 슬라이스 표면으로 다시 이동합니다. 양쪽을 슬라이스 위로 50 μm 이상 올리십시오. 차트 레코더를 사용하여 지금 측정 된 V와 8.3 단계의 측정 값 사이의 변경 사항을 결정합니다.
- ISM의 팁과 이온 삼투압 미세 전극을 x 축, y 축, z 축 중심에 놓습니다. micromanipulator 컨트롤 박스의 디스플레이에서 간격 변경을 얻으십시오 (있는 경우).
9. 두뇌 데이터 분석
- 분석 결과를위한 새로운 스프레드 시트를 엽니 다.
- Walter에서 7.1-7.4 단계를 반복하여 분석합니다.e 두뇌에서 찍은 녹음.
- Walter 메뉴에서 "Excel"을 클릭하여 스프레드 시트 프로그램에 데이터를 씁니다. , α, 뇌 ECS의 부피비를 기록; λ , 두뇌의 tortuosity ECS; 및 k (s -1 ), 비 특정 클리어런스.
10. 전송 번호 및 ISM 교정 점검
- 아래의 프로토콜을 사용하여 실험의 끝에서 ISM 전송 횟수 (n 개 t)를 측정한다. 또는 치명적인 시도가 있거나 측정 결과가 비정상적으로 표시되면 n t를 확인하십시오. 그러나 확인 n 개의 t 너무 많이는 뇌 조각에 외상이 발생할 수 있습니다.
- 아가로 오스로 새로운 녹음을하십시오. 6.4, 6.11, 6.12, 6.14, 6.15 및 6.17-6.22 단계를 참조하십시오.
- 반복 새로운 아가로 오스 녹음에서 n 개의 t을 얻기 위해 월터에서 7.1-7.4 단계를 반복합니다. 스프레드 시트를 검사 : n 개의 t이 이상 변경된 경우뇌 측정 이전에 얻어진 상기 N t에서 10 % 이상이 미세 이온 삼투압으로 얻어진 데이터는 신뢰할 수 없다.
- 모든 뇌 데이터가 수집 된 후 ISM에 대한 새로운 교정을 수행하십시오 (3.29 참조). 새롭게 얻은 ISM 교정 데이터를 Wanda Calibrate 상자의 입력으로 사용하고 (6.9 및 6.10 단계 참조) 기울기 값이 이전 교정에서 10 % 미만 차이가 나는지 확인하십시오.
참고 : 기울기 값이 이전 보정 값과 10 % 이상 차이가 나는 경우이 ISM으로 얻은 데이터는 신뢰할 수 없습니다.
결과
RTI 기법의 유용성은 α 와 hypoosmolar challenge 동안 변화를 측정하기 위해 고안된 실험에서 입증된다 ( 그림 8 과 그림 9 ). hypotonic ACSF를 세척하여 ECS의 삼투압을 줄이면 α 가 감소하고 λ 13이 증가한다는 것이 이전에 밝혀졌습니다.
이 실험에서, RTI는 저온 ACSF의 세척 조건 동안 및 제어 조건 모두 하에서 래트 뇌 절편에서 수행되었다. ISM을 제작하고, 교정 파라미터를 Wanda에 입력하여 Nicolsky 방정식에 맞추어서 58.21mV의 기울기 ( M )를 계산했습니다. ISM과 iontophoresis microelectrodes를 한천에 넣고 120 μm 간격을두고 위치시켰다.mber. 3 회의 기록을 수행하고, 곡선을 프로토콜의 단계 6의 절차에 따라 맞추고 분석 하였다 ( 도 8a ). 각 시험의 적합 곡선은 미가공 곡선과 중첩됩니다 ( 그림 8a ). 측정 된 확산 계수 ( D × 1E5 ), 수송 수 ( n t ) 및 미세 전극의 겉보기 간격 ( r_app )과 실제 간격 ( r ) 간의 차이는 세 번의 기록 사이에서 유의미한 차이가 없었다 ( 그림 8b , 녹음 a1-3). 이러한 기준에 기초하여,이 이온 삼투압 미세 전극은 실험을 계속하기에 합당한 것으로 간주되었다.
일단 안정한 이온 삼투압 미세 전극이 선택되면, 이들 매개 변수에 대한 기준선을 확립하기 위해 래트 뇌 절편에서 α 및 λ 에 대한 대조 값을 취했다. 사전vious 연구 = 래트 신피질에 대한 제어 값을 α로하고 0.18-0.22 1.54-1.65 λ = 1을 발견했다. 이 실험에서이 값을 재현하기 위해 ISM과 이온 삼투압 미세 전극을 쥐의 신피질에서 200μm, 서로 120μm의 간격을두고 배치했다. 그림 8b 의 데이터로부터 계산 된 평균 n t 는 Wanda 프로그램에 입력되어 α 와 λ 의 계산에 사용되었습니다. 뇌에서 약 200μm 깊이의 두 미세 전극의 위치에서 기준선 V 의 이동이 기록되었고, 전압 점프가 완다에 입력되어 기준선 TMA ( 즉, 기준 C 파라미터) 농도를 보정했다. 3 회의 녹음을 수행하고 곡선을 맞추었다 ( 그림 9a , 그림 9d 및 그림 9f ). 맞는 결과는 평균α = 0.192 및 λ = 1.69 ( 도 9e ). 기록을 찍은 후 기준선 V의 간격과 이동을 확인한 다음 수정 된 값을 Wanda에 입력하여 데이터 재검색을 수행했습니다 (프로토콜 8 단계에서 자세히 설명). 재 계산 된 값은 크게 다르지 않고 그림 9d 에보고 된 값이 수용되었습니다.
ACSF의 일반적인 삼투압은 300mOsm이다. 랫드 체성 감각 신피질에서 α 및 λ 에 대한 저 자극 ACSF의 효과를 시험하기 위해, 150mOsm의 삼투압을 갖는 ACSF는 NaCl 농도를 감소시킴으로써 제조되었다. 그것은이 저장성 ACSF 낮은 α 및 잠재적으로 높은 13 λ 일으키는 뇌 세포의 팽창을 야기한다고 가정 하였다. 뇌 절편을 약 30 분 동안 저 자극 ACSF로 수퍼 퓨징하여뇌와 평형을 이룬다. 이 시간 동안 microelectrodes는 이전의 제어 조건을 측정하는 동안 신피질의 동일한 위치에 남아있었습니다. 5 회의 기록은 저 강온 상태에서 수행되었다 ( 그림 9b 및 f ). 이것은 평균 α = 0.13 및 λ = 1.84를 생성합니다 ( 그림 9e ). 이 값들은 hypoosmolarity가 α를 감소시키고 λ를 증가 시킨다는 가설과 일치한다. 베이스 라인 V의 간격과 변화를 측정하고 분석 및 피팅 절차 중에 고려했습니다.
회복 매개 변수는 또한 일반 ACSF (300mOsm)로 세척하고 신피질의 동일한 장소에서 새로운 기록을 촬영하여 측정되었습니다. 팽창 효과는 가역적이어야하기 때문에 α 와 λ 가 통제 수준으로 회복 될 것으로 예상됩니다. 값 avACSF wash-on 30 분이 경과 한 후 취해진 네 가지 기록에 대해 조사한 결과 α = 0.37 및 λ = 1.61이었다 ( 그림 9c , 그림 9e 및 그림 9f ). 이것은 이러한 조건 하에서 α를 회복하는 동안 예기치 않은 오버 슈트가 있음을 보여 주었다 ( 그림 9e 및 그림 9f ). 그 후 미세 전극을 한천으로 되돌려 이온 삼투압 미세 전극의 이동 번호가 변하지 않았 음을 확인했다 ( 그림 8c ). ISM을 재조정하고 Nicolsky 방정식을 새로 적용하여 기울기가 58.21 mV임을 나타 냈습니다.
이 실험은 이상적인 조건에서 RTI가 어떻게 생겼는지에 대한 명확한 예입니다. 실험의 다음 요소가 성공의 열쇠였습니다. 첫째, 실험 데이터는아가로 오스와 뇌는 완다 (Wanda)에 의해 생성 된 이론적 인 곡선과 적절한 중첩을 나타냈다 ( 그림 8a 및 그림 9a 및 그림 9c ). 유사한 기준선에 대한 기울기, 최고점 및 복귀의 유사성은 모두 경기의 강도를 결정하는 데 중요합니다. 곡선의 이러한 부분은 아가로 오스에서 녹음 할 때 종종 문제가되며 잘 매칭 된 곡선을 생성하는 조건 ( 즉, 양호한 미세 전극)을 찾기 전에 여러 녹음을 수행해야하는 것이 일반적입니다. 둘째, 실험 전후의 평균 운송 횟수는 서로 10 % 이내였다 ( 그림 8b 및 그림 8c ). 이것이 발생하지 않았다면 뇌에 기록 된 값을 신뢰할 수 없었습니다. 이것은 RTI 실험에서 가장 많이 발생하는 문제입니다. 셋째, 표준화 된 TMA 솔루션의 ISM 캘리브레이션실험 결과가 일치했습니다 (데이터는 표시되지 않음). 일반적으로 작동중인 ISM의 교정은 10 % 이내이므로 실험 실패의 흔한 원인이됩니다.

그림 8 : 뇌에서 실험 전후의 한천에서 이상적인 곡선 피팅 데이터. ( a ) 한천 시험에서 얻은 대표 자료 : [왼쪽 먼] TMA의 농도 곡선을 보여주는 한천에서 얻은 단일 시험의 대표 데이터. 확산 측정에 앞서, + 20nA의 일정한 바이어스 전류가 이온 삼투압 미세 전극을 통해인가되었다. 시간 = 10 초에서 + 60nA의 주 전류를 50 초 동안인가하여 이온 삼투압 미세 전극으로부터 한천 속으로 TMA를 펄스했다. 소스로부터 120μm에 위치 된 ISM을 사용하여 [TMA]를 시간에 따라 측정함으로써 확산 곡선을 생성 하였다. [중간] 데이터 p에서 얻은 피팅 된 곡선월터에서 rocessing. [Right] 데이터와 피팅 된 커브의 겹침은 월터가 수행 한 커브 피팅이이 시험에서 확산을 정확하게 모델링 함을 보여줍니다. ( b ) 뇌에서 실험하기 전의 한천 측정 표 : 저 삼투압 스트레스 실험 ( 그림 9 ) 이전에 세 번의 실험 (위 그림에서 a1)으로 얻은 데이터. 모든 시도는 저 삼투압 스트레스 실험에 사용 된 이온 삼투압 미세 전극 및 ISM으로 수행되었습니다. 데이터는 뇌 조각에서 실험을 진행하는 데 필요한 기준을 충족 시켰습니다. 이러한 기준에는 데이터와 맞는 곡선 (위와 같음)과 운송 번호의 10 % 미만의 적절한 겹침이 포함됩니다. 추가 기준은 단계 7.6에 요약되어 있습니다. ( c ) 뇌에서 실험 후 한천 측정 표 : 저 삼투압 스트레스 실험 후 한천에서 수행 된 세 번의 실험에서 얻은 데이터 ( 그림 9 ). 구성 시련 a1-3과 a4-6 사이에서 시연 된 ency는 ISM과 이온 삼투압 미세 전극이 두뇌 실험에서 안정적 이었음을 강력히 시사한다. 기록 = 기록 또는 재판; r = ISM과 이온 삼투압 미세 전극 사이의 거리; Cb =베이스 라인 농도; ref D x1E5 = 미리 계산 된 표준에 근거한 이론적 자유 확산 계수 x 10 5 (cm 2 s -1 ); n t = 운송 번호 (무차 원); D (E5) = 덴파 확산 계수 × 105 (cm 2 개 S-1); r_app = 측정 및 기준 D (E5)에 근거한 겉보기 미세 전극 간격 (cm); n t 명백 = r_app에 기반한 명백한 전송 번호. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도표 9 : Hypoosmotic 긴장은 알파를 감소시키고 람다를 증가시킵니다
ac. ( a ) 컨트롤, ( b ) hypoosmotic 및 ( c ) 복구 조건에서 뇌에서 시행 한 대표 데이터 : 실선은 데이터를 나타내고 파선은 검정 곡선을 나타냅니다. 세 가지 조건은 서로 다른 기울기, 진폭 및 폭을 포함하여 현저하게 다른 확산 곡선을 나타냅니다. ( d ) 대조군 실험 데이터 표 : 세 가지 대조군 데이터 표 (b1, 위 그래프); α 와 λ 는 모든 실험에서 유사하며 쥐 대뇌 피질에 대한 발표 된 데이터와 일치한다. 뇌, 사전 및 사후 실험 한천 측정 (그림 8b와도 8c) 뇌 n 개의 t에 사용 된의 평균 n 개의 t의 모든 시험의 경우 . 뇌 D ref 는 T = 34.5 [℃] 일 때 래트 뇌에서 얻은 확산 계수 데이터베이스를 기반으로 1.25 x 10-5 cm 2 s -1 로 설정되었습니다. 파라미터 k ' [s -1 ]는 확산 측정 동안 ECS로부터 손실 된 소량의 TMA를 설명한다. k ' 는 일반적으로 매우 작지만 커브 피팅의 매개 변수를 포함하면 RTI 방법의 정확도가 향상됩니다. 손실 파라미터 k '는 아마도 세포 흡수 또는 ACSF에 대한 TMA의 손실을 나타낸다. ( e ) 통제, hypoosmotic 및 회복 조건의 비교 : 제어, hypoosmotic 및 복구 조건에서 뇌의 모든 재판에서 평균. 데이터는 hypoosmotic stress가 α를 감소시키고 λ를 증가 시킨다는 것을 보여줍니다. hypoosmotic 조건 후 복구 기간 동안, α는 기준선을 초과합니다 (대조군), λ기준선으로 돌아갑니다. 결과는 hypoosmotic challenge 동안 ECS의 변화는 부분적으로 가역적임을 시사한다. RTI 방법은 이러한 유형의 급성 가역적 인 효과를 연구하는 데 이상적입니다. ( f ) 데이터 클러스터링을 나타내는 그래프 : 각 시험에서 체적 분율 (x 축) 및 tortuosity (y 축)가 단일 점으로 표시됩니다. 이 그래프는 각 그룹 내의 데이터 클러스터링 ( 즉, 대조, 저 반성 및 회복)을 보여 주며, 이는 RTI가 뇌 자극 ECS에서 저 삼투압 챌린지의 재현 가능한 효과를 감지 할 수 있음을 시사합니다. 기록 = 기록 또는 재판; r = ISM과 이온 삼투압 미세 전극 사이의 거리; Cb =베이스 라인 농도; 알파 = 체적 분율; 람다 = tortuosity; k ' = 프로브의 비 특이적인 클리어런스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 : 여기를 클릭하여 파일을 다운로드하십시오.
토론

도표 10 : 일반적인 기술적 인 문제점을 설명하는 비 이상적인 자료. ( a ) iontophoresis microelectrodes와 함께 일반적인 기술적 인 문제의 다이어그램 : 기능적인 iontophoresis microelectrode에서 TMA의 정상적인 릴리스와 기술적 인 문제를 보여주는 세 가지 소스의 비교. [고배율, a1] 이상적인 이온 삼투압 소스의 전류는 TMA 방출과 염화물 흡수에 의해 동등하게 전달됩니다. N 개의 로우 t 릴리스 이하 TMA와 [고배율, (A2)]은 이온 삼투압 미세 전극은 정상보다 클로라이드를 차지한다. [고배율, a3] 전기 침투를 나타내는 이온 삼투압 미세 전극은 TMA, 염화물 및 용매를 방출합니다. [High magnification, a4] 시간이 지남에 따라 방출이 증가하는 이온 삼투압 미세 전극 ( 예 : "예열"). ( b ) 비정상적인 데이터의 그래프 o한천에서 얻은 것 : 데이터는 월터 (Walter)의 곡선에 의해 적절히 모델링되지 않았기 때문에 정확하게 해석 될 수 없다. 불일치의 정확한 원인은 분명하지 않다. ( c ) 한천에서 얻은 비정상적인 데이터의 테이블 : 한천의 정상 또는 예상 결과는 두 번째 행의 비 이상적인 데이터와 비교하기 위해 상단 행 ( 그림 8a 에서 그래프로 표시)에 표시됩니다 ( 그림 10b 에서 그래프로 표시). 그림 10b 의 데이터와 피팅 된 곡선 사이의 빈약 한 중첩은 피팅 된 곡선이 확산 데이터를 정확하게 모델링하지 않는다는 것을 의미합니다. 따라서 계산 된 값 (* 표시)은 해석 할 수 없습니다. 이것은 이온 삼투압 미세 전극 ( 예 : 워밍업) 또는 ISM ( 예 : 느린 반응) 문제로 인해 발생할 수 있습니다. 문제 해결 : 이온 삼투압 미세 전극으로 시작하여 한번에 하나씩 미세 전극을 교환하십시오. 기록 = 기록 또는 재판; 아르 자형ISM과 이온 삼투압 미세 전극 사이의 거리; Cb =베이스 라인 농도; ref D x1E5 = 미리 계산 된 표준에 근거한 이론적 자유 확산 계수 x 10 5 (cm 2 s -1 ); n t = 운송 번호 (무차 원); D (E5) = 덴파 확산 계수 × 105 (cm 2 개 S-1); r_app = 측정 및 기준 D (E5)에 근거한 겉보기 미세 전극 간격 (cm); n t 명백 = r_app에 기반한 명백한 전송 번호. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 8 과 그림 9 의 실험은 안정적이고 작동하는 이온 삼투압 미세 전극과 ISM을 가졌지 만,microelectrodes는 손상되어 이상적인 결과를 나타내지 않습니다. "정상적인"TMA의 이온 삼투압 미세 N 개의 t의 값을 갖는다  0.3. 그림 10a 는 RTI 실험 중에 발생할 수있는 이온 삼투압 미세 전극의 세 가지 일반적인 문제를 보여줍니다.
0.3. 그림 10a 는 RTI 실험 중에 발생할 수있는 이온 삼투압 미세 전극의 세 가지 일반적인 문제를 보여줍니다.
낮은 방출. 이온 삼투압 미세 릴리스 바이어스 전류 또는 주 전류는 N 개의 t <0.1의 결과인가 거의 TMA. 전류는 여전히 팁을 통과하고 있지만, 대부분은 팁에 들어가는 Cl 음이온에 의해 운반되며, 팁을 벗어나는 TMA 양이온에 의해 거의 전달되지 않습니다. n t 가 여러 번의 연속 시험에서 안정적이면 이러한 이온 삼투 전극을 사용할 수 있습니다. 그러나 최적의 기능을 수행하지 못하기 때문에 권장하지 않습니다. 즉, 추가 문제가 발생할 수 있습니다. 더 큰 극단이온 삼투압 미세 전극의 끝이 막히고 이온이 빠져 나가거나 팁에 들어 가지 않을 때 발생합니다. 이 경우 커브가 생성되지 않습니다. 그러한 경우 모든 전기 연결이 적절하고 안전한지 확인한 후 이온 삼투압 미세 전극을 폐기해야합니다.
높은 방출 (전기 침투). TMA 이외에, 이온 삼투압 미세 전극은 N 개의 t> 0.5의 결과, 물을 발표한다. n 개의 t 여러 실험을 통해 안정적인 경우 더 문제가 개발 될 수 있으므로, 이러한 이온 토 포레 시스 마이크로 전극을 사용할 수 있지만,이 방법은 추천하지 않습니다. 취할 수있는 유일한 문제 해결 단계는 주 전류를 줄이는 것입니다. 이것은 때때로 물 방출을 제거하고 0.5 이하로 감소하는 n 개의 t됩니다.
성장 출시 ( "워밍업"). 이 경우 TMA 릴리스는 시간이 지남에 따라 증가합니다. "워밍업"이 빠르면,확산 곡선은 도 10b에 도시 된 것과 유사한 형상을 가지며, 신뢰성있게 장착 될 수 없다. 이 경우, 확산 곡선은 주 전류의 초기 단계에서 TMA 농도의 느린 상승을 나타내며, TMA 농도는 고원하지 않습니다. 신뢰할 수없는 적합은 측정 된 전송 번호와 r_app 값의 일관성에 영향을 미치는 부정확 한 측정 D를 만듭니다. (가) "워밍업하는 것은"더 점진적으로 할 때, 각각의 확산 곡선의 모양에 큰 영향을 미치지 않지만, 연속적인 실험을 통해 증가시키는 n 개의 t에 나타난다. "웜업 (warming up)"상태는 때로는 이온 삼투압 미세 전극을 "펄싱 (pulsing)"하여 일정 시간 (약 30 분) 치료할 수 있습니다. 이는 한 번에 몇 초 동안 바이어스 전류와 높은 주전원 (+ 200nA)을 번갈아 사용하여 수행됩니다. 이온 삼투압 미세 전극이 여전히 안정을주지 않으면전자 전송 번호를 얻으려면 새 것을 간단히 테스트하는 것이 가장 좋습니다.
α에 대한 정확한 값을 보장하기 위해서는 전체 실험 동안 수송 수와 안정성의 정확한 측정이 필수적입니다. 미세 전극 사이의 간격을 유지하는 것은 α 와 λ 모두를 결정하는 데 중요합니다. 아가로 오스 또는 뇌에서 측정 후 간격이 변경되면 미세 전극의 끝 사이의 직선 거리를 출력 스프레드 시트에 입력하고 Walter가 재분석 할 수 있습니다. 값이 너무 다르면 측정을 폐기해야합니다. 온도 변동은 부정확성의 원인이 될 수 있으므로 정확한 온도 프로브와 안정적인 챔버 가열 요소를 사용하는 것이 중요합니다.
iontophoresis microelectrode는 RTI 기법에서 가장 빈번한 문제의 근원이다. 안정적인 ISM을 만들고 사용하는 것은 좋은 데이터를 얻는 데 중요합니다. 영형ISM의 가능한 문제는 느린 반응 일 수 있습니다. 이는 팁의 매우 높은 임피던스로 인해 발생할 수 있습니다. 반응이 느린 ISM으로 모든 이온 삼투압 미세 전극은 "웜업"효과를 나타낼 수 있지만 ( 그림 10b ), ISM이 변화하는 TMA 농도를 충분히 빨리 감지하지 못하기 때문에 곡선이 단순히 생깁니다. 미세 전극 (최대 150 μm) 사이의 거리를 늘리면 ISM이 반응하는 데 더 많은 시간을 허용하고 곡선 적합성을 향상시킬 수 있습니다. 부진한 반응은 이온 교환기가 팁 내부로 후퇴했다는 것을 나타낼 수 있습니다. 이것은 복합 현미경으로 볼 수 있으며, 존재한다면 silanization이 좋지 않고 ISM을 폐기해야 함을 의미합니다. 또한 ISM 신호가 드리프트하면 데이터가 부정확하게 적용될 수 있습니다. 드리프트가 허용 오차를 초과하는 데이터에 영향을 미치는지 확인하는 것은 실험자의 몫입니다.
RTI의 한계
티여기에는 데이터 분석의 기초가되는 가정 때문에 RTI 방법에 대한 몇 가지 제한 사항이 있습니다. 이러한 가정에는 관심있는 뇌 영역과이 영역을 둘러싸는 구형 체적 모두에서 조직 균질성 및 조직 등방성에 대한 요구 사항이 포함됩니다. RTI의 맥락에서, 조직 균질성은 확산 매개 변수가 관심 영역 내에서 일정해야한다. 조직 등방성은 D * 의 단일 값이 3 개의 공간 축 모두에 적용됨을 의미합니다. 소스 미세 전극으로부터 방출 된 각 분자는 기록 ISM의 위치에 도달하기 전에 무작위 경로를 취한다. 단일 시간에 기록 된 분자 수 ( 즉, 농도)를 나타내는 ISM의 전압에는 ISM을 초과하여 이동하여 측정으로 돌아온 일부 분자뿐만 아니라 3 개의 공간 축 모두에서 이동 한 분자가 포함됩니다 포인트 ( 그림 1c ). RTI 데이터 분석 동안 Walter 프로그램 생성는 점원에서 ISM으로 모든 축을 이동하는 모든 분자의 확산을 포함하는 평균 α 와 λ 를 나타냅니다. 3 개의 공간 축 (이방성) 중 어느 하나에서 확산 속도가 크게 다르거 나 조직이 균질하지 않은 경우 α 및 λ 8 , 14 를 계산하려면 추가 데이터 수집 및 데이터 분석이 필요합니다.
위의 조직 선행 조건에 추가하여 RTI 방법은 점원과 ISM 사이의 간격 ( r )을 대략 80-130 μm가되도록 요구합니다. r 이 50 μm 이하로 감소하면 ISM 반응은 프로브 분자 농도의 확산 의존성 변화를 기록하기에 충분히 빠르지 않을 수 있습니다. 이는보다 빠른 응답 시간 10 , 15의 동심 ISM을 사용하여 향후 해결 될 수 있습니다. 큰 r거리는 또한 ISM 배치 중 ECS 환경, ISM 팁 크기 및 뇌 조직 손상의 뇌 지역 독립적 인 차이를 최소화합니다. R은 150㎛의 이상으로 증가 할 때, 반대로 이온 삼투압 점 광원으로부터 분자의 확산 비 등방성 의한 영향에 더 민감하고, 관심있는 뇌 영역 또는 조직 관류 경계 (14)를 둘러싸는 불균일 소자.
ECS 탐구를위한 RTI 및 대체 기술 통합
RTI 방법은 ECS를 연구하기 위해 분자 탐침을 이용하는보다 큰 기술 그룹에 속한다. 각 방법에는 그것의 자신의 이점 및 결손이있다. RTI는 실시간으로 α 와 λ 를 정확하게 계산할 수 있지만이 방법은 이온 교환기로 검출 할 수있는 하전 된 분자 프로브가 필요합니다. 이온 삼투압 법이 적합하지 않은 실험, 예를 들어 전하가없는 프로브에 대한 연구에서접종은 압력 방출로 대체 될 수 있습니다. 릴리스 부피 주입 매체 (16)의 성질에 의존하기 때문에 불행하게도, 현재의 기술은 압력과 토출 α의 산출을 허용하지 않는다. 교환기가 존재하지 않는 탐침을 사용하기 위해, 탐침은 형광 표식이 될 수 있고 표식 부착 현미경 검사법으로 측정 된 ECS를 통해 확산 될 수 있습니다. 통합 광학 이미징 (IOI)으로 알려진이 기술은 형광으로 표지 된 분자의 크기와 가용성 및 세포 흡수에 대한 잠재력으로 인해 제한적입니다 17 , 18 . IOI 기법은 거대 분자가 프로브로 사용될 수 있다는 이점이 있으며, 이로 인해 분자 크기에 따라 λ가 증가한다는 것이 밝혀졌습니다. 마지막으로, 확산 방법의 중요한 부류는 방사성 추적자를 사용했지만 더 이상 공통적으로 사용되지는 않는다 2 .
RTI의 미래 응용
1 , 4 , 6 의 잠재력을 확장하여 생체 내 에서이 기술을 안정적으로 구현하는 것도 가능합니다. 그것은 또한 화학 환경, 약리학, 외상, 또는 유전자 녹아웃 1 로 변경에 의해 유도 된 것과 같은 뇌 생리학의 변화의 다양한 효과를 테스트하는 데 사용할 수 있습니다. ECS에서 유도 된 변화가 약 2 분 이상 지속되는 한, RTI는 ECS 체적 분율 및 비틀림의 정확한 정량화를 제공 할 수있다.
지난 50 년간 뇌 ECS의 구조와 기능에 대한 중요한 통찰력이 창출되었지만많은 대답하지 않은 질문이 남아있다. 예를 들어, 항상성 메커니즘이 α를 조절하는지, 어떻게 α의 변화가 뇌 기능에 영향을주는지는 아직 명확하지 않다. 컴퓨터 모델은 세포 기하학 및 λ 에 영향을 미치는 다른 요인들의 상대적 기여도를 평가하는 데 도움이되었지만 더 많은 연구가 필요합니다 1 . 마지막으로, 신경 질환의 병인에있어서 ECS의 역할 (및 그 반대)은 대체로 미개척이다. 가까운 장래에 RTI 측정은 특정 뇌 영역에 대한 약물 전달을 향상시킬 수 있습니다 19 .
공개
저자는 경쟁적인 금전적 이해 관계가 없다고 선언합니다.
감사의 말
이 작업은 NIH NINDS grant R01 NS047557에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate - do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5mm x 16mm) |
| objective 5x dry | Olympus | MPlan N | |
| objective 10x water immersion | Olympus | UMPlan FL N | 10x objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
참고문헌
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C., Michael, A. C., Borland, L. M. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. , 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes, ., Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유