Method Article
脳の細胞外空間の体積分率とねじれを定量するためのテトラメチルアンモニウムによるリアルタイムイオントフォレシス
* これらの著者は同等に貢献しました
要約
このプロトコールは、生体内の脳の細胞外空間(ECS)の物理的パラメータを測定する方法であるリアルタイムイオントフォレシスを説明しています。 ECSに放出された不活性分子の拡散を用いて、ECSの体積分率および蛇行度を計算する。これは、脳のECSへの急性の可逆変化を研究するのに理想的です。
要約
このレビューでは、生きた脳の細胞外空間(ECS)を探索および定量するための金標準である、リアルタイムイオントフォレーゼ(RTI)法を実行するための基本概念およびプロトコルについて説明しています。 ECSはすべての脳細胞を囲み、間質液と細胞外マトリックスの両方を含む。神経伝達物質、ホルモンおよび栄養素を含む脳活動に必要な多くの物質の輸送は、ECSを通る拡散によって起こる。この空間の容積および形状の変化は、睡眠のような正常な脳プロセスおよび虚血のような病理学的状態の間に生じる。しかしながら、特に罹患した状態での脳ECSの構造および調節は、未だに未解明のままである。 RTI法は、生きた脳の2つの物理的パラメーター、すなわち体積分率および蛇行を測定する。体積分率は、ECSが占める組織体積の割合である。屈曲は、脳に拡散して物質が遭遇する相対的障害の尺度である妨害のない媒体と比較して、 RTIでは、不活性分子が供給源の微小電極から脳ECSにパルスされる。分子がこの供給源から拡散するにつれて、イオンの変化する濃度は、約100μm離れて配置されたイオン選択性微小電極を用いて経時的に測定される。得られた拡散曲線から、体積分率と曲がり率の両方を計算することができる。この技術は、複数の種(ヒトを含む)およびインビボの脳切片において、ECSに対する急性および慢性の変化を研究するために使用されている。 RTIは、他の方法とは異なり、リアルタイムで脳ECSの可逆的および不可逆的変化の両方を調べるために使用することができる。
概要
細胞外空間(ECS)は、すべての脳細胞の外部にある相互接続されたチャネルのネットワークであり、間質液および細胞外マトリックスの両方を含む( 図1aおよび図1b )。栄養素、ホルモン、神経伝達物質を含む脳細胞機能に必要な多くの物質の分布は、ECSを通じた拡散によって起こります。体積、形状、および細胞外マトリックスを含む、この空間の物理的パラメータの変化は、急激ECSおよび脳細胞機能1、2に重大な影響を与える脳細胞を浸す局所イオン濃度、を通して拡散に影響を与えることができます。
、体積分率及びねじれ3、4:リアルタイムイオントフォレーシス(RTI)は、脳の領域の2つの構造的特徴を決定するために使用されます"xref"> 5。体積分率( α )は、代表的な基本体積における全組織体積( V 組織 )に対するECS( V ECS )が占める組織体積の割合である。

屈曲( λ )は、物質が障害のない媒体と比較して脳領域を通って拡散するときに遭遇する相対的障害である。
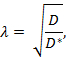
ここで、 D * (cm 2 s -1 )は脳内の物質の有効拡散係数であり、 D (cm 2 s -1 )は希薄アガロースゲルなどの遊離媒質中の物質の自由拡散係数である。
現在、Rに最も一般的に使用されるプローブ物質TI法は、小さなカチオンのテトラメチルアンモニウム(TMA)である。 TMAは74g / molの分子量を有し、溶液中で完全に解離し、1つの正電荷を有する。このイオンによるRTIの研究は、 α  0.2とλ
0.2とλ  1.6 1、2。これは、ECSが総脳容積のおよそ20%であり、小さな不活性分子の拡散が、障害物のない媒体と比較してECSにおいて約2.5倍遅くなることを意味する3 。しかし、 αとλの両方は、脳の年齢、地域、状態、および病的状態によって変化する1 。これらのパラメータの変更は、脳の発達、老化、睡眠、てんかん、および脳の多くの他の基本的なプロセスおよび疾患に関連している1、 6 。他の技術はαおよびλを測定するが、RTIはリアルタイムで生体組織の局所化された領域で両方を測定することができる。このため、RTIは、急性および可逆性挑戦中のαおよびλの変化を調査するために不可欠なツールとなっている。
1.6 1、2。これは、ECSが総脳容積のおよそ20%であり、小さな不活性分子の拡散が、障害物のない媒体と比較してECSにおいて約2.5倍遅くなることを意味する3 。しかし、 αとλの両方は、脳の年齢、地域、状態、および病的状態によって変化する1 。これらのパラメータの変更は、脳の発達、老化、睡眠、てんかん、および脳の多くの他の基本的なプロセスおよび疾患に関連している1、 6 。他の技術はαおよびλを測定するが、RTIはリアルタイムで生体組織の局所化された領域で両方を測定することができる。このため、RTIは、急性および可逆性挑戦中のαおよびλの変化を調査するために不可欠なツールとなっている。
RTIを支持する理論は、もともとニコルソンとフィリップスによって検証し、及び技術は、その時4,7ため広く使用されてきました。 RTIを用いた実験は、希薄アガロースゲル中へのイオン導入法によって、源微小電極からTMAのパルスを放出することから始まる。いったん放出されると、イオンは、潜在的に無数のランダムな経路から選択して、点源から自由に拡散する( 図1d )。イオンの変化する濃度は、大まかに位置付けられたイオン選択性微小電極(ISM)を用いて経時的に測定される100μm離れている( 図1c )。 TMA濃度の変化をグラフ化し、イオントフォレーシス微小電極(プロトコルで議論されたパラメータ)のDおよび輸送数の両方の計算を可能にする曲線に適合させる。これらの値を用いて、脳の関心領域で手順を繰り返してD *を求め、 αとλの両方を計算する。イオントフォレーシス微小電極の制御、データ収集、TMA濃度曲線のグラフ化およびフィッティング、および実験パラメータの計算はすべて、典型的にはこの目的のために特別に設計されたプログラムWandaおよびWalterによって行われる(ソフトウェアおよびそのマニュアルは要求に応じて著者から自由に入手可能)。
このレビューの議定書のセクションでは、げっ歯類の脳スライスをRTIで設計および実施するために必要な基本的な手順について説明しています。この技術はまた、非ロッドヒト脳切片を含むとインビボ脳調製物1、4、6、8、9 で ENTモデル、。代表結果セクションでは、データ解釈のニュアンスを強調する理想的な結果と理想的でない結果の両方を提供します。最後に、ディスカッション・セクションでは、トラブルシューティング手法、RTIの制限事項、ECSの研究に使用される代替技術、およびRTIの今後のアプリケーションについて簡単に説明します。
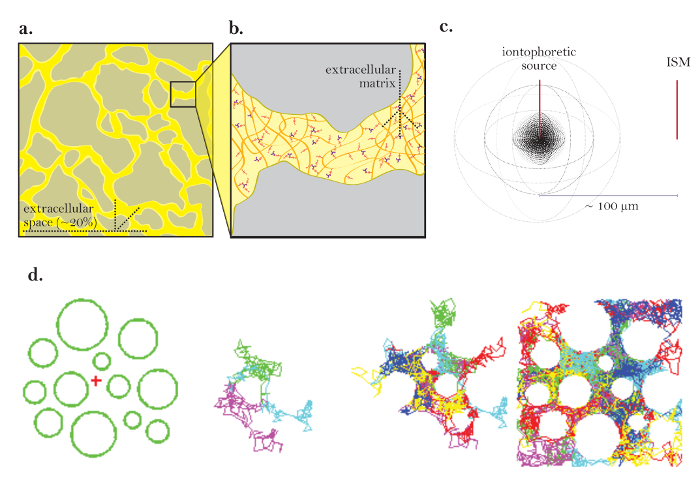
図1:ECSによる拡散の図。 ( a )ECSの図:典型的な脳切片におけるECSの大きさと位置を示す。黄色は、灰色の脳細胞プロセス間のECSをマークする。 ECSの体積は、全組織体積の約20%である( すなわち、体積率= 0)。2)。 ( b )ECSの拡大図:脳細胞の形状(灰色)および細胞外マトリックス(多糖グリコサミノグリカンおよびプロテオグリカンのメッシュとして図示)を含む、蛇行に寄与する物理的パラメータを強調する。 ( c )点源からの拡散の3D図:イオントフォレシス源からISMへの不活性分子の正味の移動を示す。拡散障壁および細胞摂取を除いて、分子はあらゆる方向に外側に拡散し、球状の濃度の前面を生成する。 ISMは、イオントフォレシス源から放出された不活性分子の局所濃度を定量化する。 ( d )脳のECSにおける拡散のコンピュータシミュレーション:[Far left]モンテカルロシミュレーションのセットアップ;緑色の球体は脳細胞プロセスを表し、赤色の十字形は点源を表す。このセットアップは、 図1aに示す脳組織をモデリングします 。 [中間画像] 3と6分子は、2次元で示される脳の細胞外空間を通って拡散する際にランダムな動きをする。 [原爆]点源から放出された多くの分子のランダムな散歩。 図1cに示すように、点源からのすべての分子の正味の移動は外向きである。累積ランダムウォークは、細胞間の空間を概説する( すなわち、 ECS;さらなる説明については、参考文献5を参照)。 この図の拡大版を見るには、ここをクリックしてください。
プロトコル
組織サンプルを得るために使用されたすべての動物手順は、SUNY Downstate Medical Centerの動物倫理委員会の承認を受けていました。
1.溶液および装置の準備
- ISMの基準バレル用の150mM NaClバックフィル溶液を調製する。 0.22μmフィルター(細菌または粒子を除去するため)に取り付けられた10mLシリンジに保管してください。
- マイクロ電極用の150mM TMAクロライド(TMA-Cl)バックフィル溶液を調製する。 0.22μmフィルターに添付された10 mLシリンジに保存してください。正確な濃度を確保するために、5Mメーカーのストック溶液からTMA-Cl溶液(このプロトコールで)を調製します。
- ワイヤを漂白剤(次亜塩素酸ナトリウム)に少なくとも2時間浸漬することによって、微小電極の製造のために少なくとも4本の銀線を塩化する。過剰の漂白剤をエタノールで除去し、ワイヤーを乾燥させる。
- ビーカー中の150mM NaClおよび0.5mM TMA-Cl中の0.3%アガロースの50mLを調製するカバーしてください。良好な拡散測定を確実にするために粉末状で合理的に新鮮なアガロースを使用する。
- アガロース溶液を加熱し、撹拌棒で混合して溶解させる。溶液を室温に冷却する。これを4℃で最大1週間保管してください。
- 1M KCl中の4%アガロースで作られた無関心(グラウンド)電極を調製する(補遺Aの指示)
- 実験室に収めることができ、内容物と外部環境との間の電気的連続性を可能にする小さな多孔性のカップを製作する( 図2a )。このカップの底に金属リングを置き、水に部分的に沈むときに浮かないようにします。
- ISMの較正のために5M TMA-Clストックの連続希釈を使用して5つの100mL TMA-Cl溶液を作成する。溶液は、すべて150mM NaCl中に0.5,1,2,4および8mM TMA-Clの最終濃度を有するべきである。蒸発を防ぐために、キャリブレーション溶液をシール可能なカップに保管してください。/ li>
2.電子セットアップ
- 図2bのブロック図に従ってRTI実験装置の構成要素を接続する。 2つの入力チャンネル(ISMのイオン選択バレルには非常に高いインピーダンスが必要)、10 Hzで設定されたローパスフィルター、チャートレコーダー、A / D + D / Aコンバータ、イオントフォレーシスユニット(または定電流パルスを供給することができる増幅器)、およびWandaおよびWalterプログラムを実行するコンピュータ(PC)を含む。電子設定を調べて、すべての接続が正しいことを確認します。
- 必要に応じて、ISMは高抵抗であり、近くの動きによって生じるアーチファクトに敏感であるため、接地されたエンクロージャ(ファラデーケージなど)で実験セットアップをシールドします。
- デュアルインプットアンプ、チャートレコーダー、適切なISMホルダー、および無関係のグランド電極で構成された専用のISMキャリブレーションステーションを作成します。可能なら、エンクロージャをシールドしてください。 ISMが実験セットアップで較正されている場合は、この手順をスキップします(ステップ3.29)
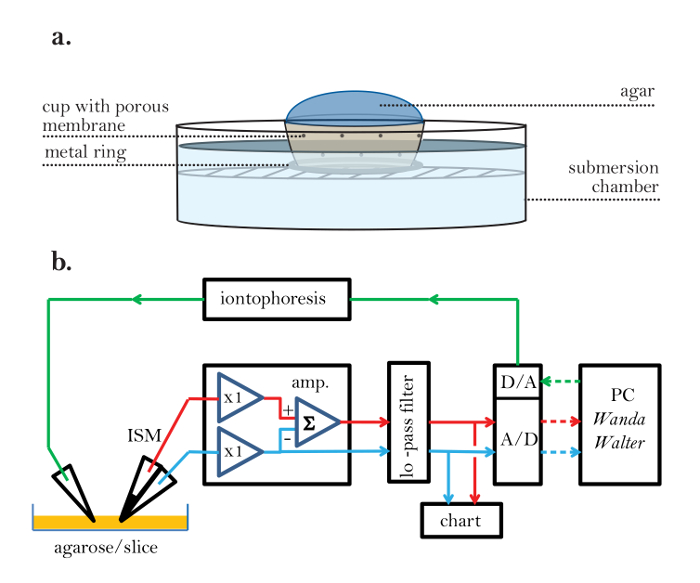
図2:多孔質の実験用カップおよび電子装置のセットアップ。 ( a )多孔性の実験用カップ:多孔質メッシュを用いて、アガロース(内側)と実験用の入浴用流体(外側)との電気的連続性を可能にする実験用カップを作製する。金属リングがカップの底部に取り付けられて、カップが浴槽内に浮遊することを防止する。 ( b )RTIセットアップのブロック図(ステップ2.1および2.2):ISMはアンプ(アンプ)に接続されています。 ISMには2つのバレルがあります。 1つは、先端に液体イオン交換体(LIX)を含み、先端のTMA濃度の対数に比例した電圧を局部的な周囲電圧とともに生成する。 the信号経路は赤線で表されます。 ISMのもう一方のバレルは基準バレルと呼ばれ、ISMの先端の周囲電圧を測定します。それは青信号経路によって接続される。アンプには、ISMに接続する2つのいわゆるヘッドステージがあります。これらのユニットは1(x1)のゲインを持ち、マイクロ電極の高インピーダンスと残りのアンプ回路の低インピーダンスを一致させます。イオン選択性バレルに接続されたヘッドステージは、約1,000MΩの入力抵抗に一致しなければならないが、基準バレルの抵抗は、典型的には約10MΩである。ヘッドステージを離れると、基準バレルからの電圧が反転され、加算増幅器(Σ)を用いてイオン選択バレルの電圧から減算され、純粋なイオン信号電圧が得られる。増幅器の出力は、追加の増幅と多極低域通過フィルタ(≦10Hz、典型的にはベッセル・フィーチャノイズを除去し、アナログ - デジタルコンバータ(A / D)で信号エイリアシングを防止します。フィルターの出力はストリップチャートレコーダーにも表示されます。 A / Dコンバータは、信号をデジタル化してパーソナルコンピュータ(PC)に送信します。 PCはまた、デジタル - アナログ変換器(D / A)によってアナログ電圧パルスに変換されたデジタル信号を生成し、このアナログ電圧パルスは、イオントフォレシスユニットに供給され、電圧を一定振幅の電流パルスに変換し、イオントフォレーシス微小電極に送達する。イオントフォレシス信号経路は、緑色の線で表される。データ取得およびイオントフォレーシス信号は、Wandaプログラムの制御下にあり、Wandaプログラムは、実験を定義するすべてのパラメータとともに、電圧対時間記録の形で各拡散記録の出力ファイルを生成する。第2のプログラムWalterは、出力ファイルを読み取り、ISM較正データを使用してデジタル化された電圧を濃度に変換する。濃度veその後、rsusの時間曲線はWalterに拡散方程式の適切な解に当てはめられます。媒質がアガロースであればDとn tが抽出され、媒質が脳であればλとαが抽出される。アナログ信号は実線です。デジタル信号は点線である。また、スライスを含む浴中に無関心の接地電極(図示せず)がある。赤線=イオン信号、青線=基準信号、緑線=イオントフォレーシスコマンド、実線=アナログ、点線=デジタル。 この図の拡大版を見るには、ここをクリックしてください。
3.イオン選択性マイクロ電極の作製と較正
- 実験の1日前にプロトコルを使用してISMを作成します。 ISMをバッチで作成して、実験の日に少なくとも2つの作業が確実に行われるようにします。
注:ほとんどのISMは1日または二。 ISM製造は、湿度および大気条件に敏感である。すべてのマイクロ電極が較正に成功するわけではありません。 - 鉗子の古いペアを使用して二重括弧つきホウケイ酸ガラス毛細管のバレルの一つの端に約0.5cmのガラスを捨てる。
- キャピラリーの反対側の端に1本のバレルをチップします ( 図3a )。セプタムが損傷していないことを確認します(クリティカル)。注意:発射ガラスによるけがを防ぐため、ゴーグルを着用してください。
- キャピラリーをアセトンのボトルに少なくとも1時間入れて混入物を除去する。
- キャピラリーをアセトンから取り出し、清潔で乾燥した圧縮窒素ガスまたは空気を通して余分なアセトンを除去する。残留アセトンがシラン化を妨げる可能性があるため(重要)、キャピラリー内のアセトンをすべて除去してください。
- マイクロピペットの先端を垂直または水平のプラーで製作する。長いテーパでピペットを引っ張るためのパラメーターを調整し、直径約1μm以下の尖った先端。このステップの最後に、1本のキャピラリーを2本のピペットにします( 図3a )。
- 単一のマイクロピペットを、10倍の対物レンズを備えたコンパクトな直立顕微鏡下で視覚化する。チップの最終直径( すなわち、両方のバレル)が2〜5μm( 図3b )になるように、ガラス顕微鏡スライドを使用して先端を切断します。このピペットは今からISMと呼ばれます。
- 0.22μmのフィルターと28 G、97 mmの針( 図3b )に取り付けられた10 mLシリンジを使用して、チップ側の開口部を介してISMの欠損バレルに150 mM NaCl参照溶液を充填する。バレルの高さの3/4を超えてバレルを満たさないでください。
- 150mM TMA-Clバックフィル溶液で、ISMの非切削バレルを充填する。 ISMを静かにタップして、溶液から気泡をノックアウトします。マイクの下に泡がないかチェックするチップをチッピングするために使用されるロスコープ。
- ブンゼンバーナーを使用してISMの背面を火炎処理して、ISMの背面の中隔にわたってバックフィルソリューションの通信が行われないようにします。炎の後、ISMの上部1/4が乾燥していることを確認します。
- 塩素化された銀線をISMの参照溶液に挿入し、キャピラリから突出したワイヤを曲げてこれを基準バレルとしてマークします( 図3c )。ワイヤーがバックフィル溶液に浸されていることを確認し、実験の間は溶液中に留まります。
- 短い長さのポリテトラフルオロエチレンチューブ(長さ約20cm)を25G注射針の先端にスライドさせます。イオン選択性バレルの背面にチューブのもう一方の端を置きます。チューブがバレル内にあり、バックフィル溶液より上にあることを確認します( 図3c )。
- ブンゼンバーナーで歯科用ワックスの棒を加熱し、チューブとシルバーの両方をシールする( 図3c )。イオン選択バレル内のプラスチックチューブの周りに完全なエアーシールが生成されていることを確認します(クリティカル)。
- キシレン中の4%クロロトリメチルシランの小さい透明なガラス容器(5 mL以下)を準備する。注意:キシレン類とシラン類は健康に非常に危険です。両方の化学物質をヒュームフード内で取り扱い、適切に廃棄してください。
- ヒュームフード内に水平に取り付けられたステレオ解剖顕微鏡の前に容器を置く。マイクロマニピュレーターを使用して、容器の上にISMを垂直に固定します ( 図3d )。
- クロロトリメチルシラン溶液中の微小電極の先端を浸す。
- ISMにつながる25ゲージの針に空の10 mLシリンジを取り付けます。 TMA-Cl溶液の泡が形成されるまでシリンジから正の空気圧を加えます。このステップは、顕微鏡を通した直接視覚化下で実施されるべきである。
- チップの泡をノックオフするには、ISMホルダーを静かにタップします。
- 10 mLシリンジの負圧を使用して、ISMの先端に約1,500μmの高さまでクロロトリメチルシラン溶液を吸引する。
- TMA-Cl溶液の泡が先端に形成されるまで、ISMの先端からクロロトリメチルシラン溶液を完全に排出する( 図3d )。
- 手順3.19と3.20を5回繰り返します。毎回、途切れることなく連続した液体のコラムが先端に引き込まれていることを確認してください。先端に溶液を引き込むことができない場合は、チューブが詰まっているか、エアーシールが不完全であるか、またはISMの先端が詰まっていないかを確認してください。
- TMA-Cl溶液の泡が生じるまで、チップから全てのクロロトリメチルシラン溶液をフラッシュする。
- シリンジに正圧を維持しながら、ISMをキシレン溶液から取り出します。余分なキシレンがexcを台無しにするので、すべてのキシレン溶液がISM先端から追い出されるようにしてください次のステップで作成されたハンガーカラム。
- TMA用の液体イオン交換体(LIX)を保持している小型で透明な容器(交換器の入ったものか小さなキュベットのいずれか)にISMの先端を置きます。水平顕微鏡セットアップを使用して直接視覚化してこの手順を実行します。
- 先端( すなわち、できるだけ早くLIXは、先端に入っ見られるように、負圧の適用を停止)にLIXの最小限の量を描画するための負圧を少量を適用します。
- チューブから10 mLシリンジを取り外し、ISMを5分間放置します。その間、LIXは平衡状態に達するまでシラン化されたチップに入る。
- LIXからISMを削除します。可能な限りワックスを除去しながら、交換器バレルからチューブを引き出します。塩素化された銀線を、ISMの後端に作成された小さな開口部に置きます。溶融ワックスで交換器バレルのバックフィル内のワイヤをシールします。
- ISMを座らせる少なくとも30分間。柔軟な仮接着剤を使用して、完成したISMをビーカーの内側リムに取り付けます。
- 手順1.8で作成した各較正溶液にISMで測定した電圧を記録して、ISMを較正します。
注記:キャリブレーションはキャリブレーションステーション(ステップ2.3を参照)または実験セットアップで実行できます。この手順は補遺BおよびHaack ら 10に概説されている 。 - ISMの較正が複数のISMで成功した場合は、意図した使用日までここで休止してください。そうでない場合は、ISMをさらに製作します。
- 実験の日に、再び微小電極を較正する(ステップ3.29参照)。

図3:イオン選択性微小電極の調製。 ( a )毛細管の端部をチッピングして引っ張った後のISM(ステップ3.2~3.6):両端の単一バレルファーガラスキャピラリーが欠けている。 ISMは、細いチップを有する2つのマイクロピペットを生成するために、1つの二重バレルガラスキャピラリーを引っ張ることによって生成される。 ( b )両方のバレルをバックフィルした後のISM(ステップ3.7~3.9):単一のISMの先端を2~5μmの直径に切り刻む。イオン選択性バレルにはTMA-Clが充填され、基準バレルにはNaClが充填されています。 ( c )クロロトリメチルシランで被覆する前のISM(ステップ3.11-3.13):塩化バナジウム銀線を基準バレルに挿入する。ポリテトラフルオロエチレン(PTFE)配管を25G針に接続し、イオン選択性バレルに挿入する。歯科用ワックスを使用して、両方のバレルの上に気密シールを作成します。 ( d )クロロトリメチルシランでマイクロピペットをコーティングする(ステップ3.15-3.26):[低倍率]水平に取り付けられた実体顕微鏡に沿ってクロロトリメチルシラン中に懸濁したISM。 [高倍率]水平に取り付けられたステレオクロロトリメチルシラン溶液中のISMチップの溶液。顕微鏡でチップを可視化した後、少量のTMA-Cl溶液をイオン選択バレルから追い出す(TMA-Cl溶液の小さなバブルを生成するのに十分)。 ISMホルダーをタップしてTMA-Cl溶液のバブルを放出させ、次いでクロロトリメチルシランを先端に引き上げる。このサイクルは数回繰り返される。すべてのクロロトリメチルシランがISMから排出された後、ISMをTMA用の液体イオン交換体(LIX)に入れ、LIXをイオン選択性バレルの先端に引き込む。 この図の拡大版を見るには、ここをクリックしてください。
イオントフォレーシス微小電極の作製
注:イオン導入術の微小電極は、実験の当日に製作する必要があります。
- 縦または横に二重に括ったホウケイ酸ガラスキャピラリを引っ張りますリゾンタルプラー。ステップ3.6( 図4a )で引っ張ったマイクロピペットに類似したピペットを引き出すパラメータを調整します。
- マイクロピペットをステップ3.7で使用した複合顕微鏡の下に置き、得られた直径が2〜5μmになるようにガラス顕微鏡スライドを使用して先端を切断する( 図4a )。
- 0.22μmのフィルターと28 G、97 mmの針( 図4a )に取り付けられた10 mLシリンジを使用して、両方のバレルを150 mM TMA-Clバックフィル溶液で満たします。
- 両方のバレルの溶液に気泡が残っていないことを確認するために、マイクロピペットを静かにタップします。
- マイクロピペットの両方のバレルに塩素化銀線を入れる。ワイヤは、バックフィル溶液の深さが十分に深く、実験期間中溶液と接触したままになるようにしてください。
- 熱い歯科用ワックスを使用してワイヤーをバレルに密封する。静かにインターロック ( 図4bに示されているように完成した微小電極)相互にねじることによってワイヤーを結ぶ。

図4:イオントフォレーシス微小電極の調製。 ( a )両方のバレルをバックフィルした後のイオントフォレーシス微小電極(ステップ4.1-4.3):毛細血管からイオントフォレーゼ微小電極を引っ張る。微小電極の先端は、2〜5μmの直径に削られている。イオントフォレーシス微小電極の両方のバレルにTMA-Cl溶液を充填する。 ( b )完了したイオン導入微小電極(段階4.5~4.6):2つの塩素化された銀線がバレルに挿入されたイオントフォレシス微小電極。微小電極のバレルはワックスで封止され、銀ワイヤは微小電極の後部で一緒にねじられる。/files/ftp_upload/55755/55755fig4large.jpg "target =" _ blank ">この図の拡大版を見るには、ここをクリックしてください。
人工髄液および齧歯動物の脳組織切片の調製
- 実験に適した組成の人工脳脊髄液(ACSF)1Lを調製し、0.5mM TMA-Clを加える。
注:TMA-Clは実験中にバックグラウンド濃度のTMAを確立するために必要です。 - 標準的なプロトコル11、12によれば400ミクロンの厚さの齧歯類脳切片を調製。脳スライスの解剖および維持のために、ステップ5.1で調製したACSFを使用する。
6.アガロース中でのリアルタイムイオントフォレシス
- WalterとWandaプログラムを実行しているコンピュータの電源を入れます。
注:これらのプログラムは、リクエストに応じて無料で利用できます。このソフトウェアは必須ではありませんが、同様のプログラミングソフトウェアを使用するか、手動で分析を実行する必要があります。 - 適切な速度( 例えば、 2mL /分)で浸漬チャンバを通してACSFを流す。温度コントローラーを所望の温度に設定し、95%O 2 /5%CO 2 (または別の適切なガス混合物)で実験期間中ACSFをバブリングする。
- 適切なホルダーに無関心(接地)電極を取り付け、浸水チャンバーを通って走っているACSFに先端を沈めます。電線を録音設定の地面に接続します。
- 前に調製した0.3%アガロースで多孔性カップ(ステップ1.7で作製)を満たし、浸漬チャンバーに入れる。解決策がカップの上部で動かないようにしてください。
- 1つのマイクロマニピュレーターのピペットホルダーにキャリブレーションされたISMを固定し、2番目のマイクロマニピュレーターのイオントフォレーシスマイクロ電極を固定します。ホルダーをセットアップに適した角度に設定します( 図5a )。
- 接続するISMおよびイオントフォレーシス微小電極ワイヤは、記録増幅器のそれぞれのヘッドステージに接続される。または、アンプに直接接続します(設定に応じて)。
- 接続ワイヤまたはクリップの重量/位置が微小電極の動きを引き起こさないようにしてください。位置のわずかな変動が結果に影響する可能性があります。
- 電子設定をオンにします(ステップ2から)。 WalterとWandaを別々のインスタンスで起動します。
- WandaのGUIで、「Calibrate」をクリックします( 図6a )。較正ボックス( 図6b )で、ISM較正中に測定された電圧を入力し(ステップ3.29)、「Fit Data」をクリックします。
注:これにより、Nicolsky方程式の次の表現にフィッティングすることができます(あるいは、別の方法で式をMとKにします )。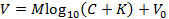
彼女Vは測定電圧(mV)、 Mはニコルスキースロープ(mV)、 Cはイオン濃度(mM)、 Kは干渉(mM)、 V 0はオフセット電圧(mV) 3である 。 - 手順6.9で生成したスロープ( M )と干渉( K )をメインGUIに自動的に転送するには、[較正]ボックスの[承認]をクリックします。
注記:ここで、 KはNa干渉を表し、通常無視します。 - GUIの左側で、すべての実験パラメータが対応するエントリに設定されていることを確認します( 図6a )。
- Source Methodボックスで、イオントフォレーシスソース(デフォルト)、 "Record Duration"を "200 s"(デフォルト)、 "Pulse Begin"を "10 s"(デフォルト)、 "Pulse End" "60s"(デフォルト)、 "Bias Current"を "20nA"(デフォルト)、"Main Current"を "100 nA"(デフォルト)に設定し、 "Conversion Factor"を適切な値に設定します。
- Measuring Electrodeボックスで、浴溶液中に含まれるTMAの濃度(mMで表示)に「Bath C」を設定します。 「トータルゲイン」、「出力チャンネル」、「ISMチャンネル」、および「リファレンスチャンネル」を、使用中のデータ集録システムの適切な値に設定します。
注意:「変換係数」は、適切な値(使用中のイオントフォレーシス装置に固有の値)に設定する必要があります。この値は、D / A変換器から与えられた印加電圧に対して(nA / mV)通過する電流量を指定します。
- 温度プローブを寒天カップに入れる。測定された温度をGUIの "Measuring Electrode"ボックスの "Temperature"エントリーに記録します( 図6a )。
- サブステージイルミネータをオンにします。必要に応じて、マイクに接続されたカメラの電源を入れますロスコープとカメラモニター。
- アガロースに少なくとも1,000μmの深さの微小電極を下ろし、カップの中にそれらを中心に置く( 図5b )。 10倍の対物レンズ(長い作動距離の水浸対物レンズ)を使用して顕微鏡下で視覚化する。
- ベースライン電圧としてアガロースに記録された電圧を確立するために、リファレンスおよびISMチャンネルの両方について、アンプの電圧を0 mVにオフセットします。
- 2チャネルアンプでは、手動でISMチャネルコネクタを電圧減算出力に移動して、リファレンスチャネルとISMチャネルの間の減算を「オン」に設定します。
注:減算は、ISMチャンネルの電圧変化がTMA濃度の変化のみを反映することを保証します。 - ISMをイオントフォレーシス微小電極の先端に触れるように動かします。チップを3つの方向軸のすべての中心に合わせます。
- 両方の微小電極の相対位置をゼロにする。マイクロマニピュレーターコントロールボックス。微小電極が正確に(正確に)センタリングされていることを確認します。
- ISMをイオントフォレーシス微小電極から1軸(左軸、 図5b )に120μm移動させます。この距離をGUIの「Measuring Electrode」ボックスに入力します( 図6a )。
- GUIで「Acquire」をクリックして録音を開始します ( 図6a )。プログラムが完全な録音を録音できるようにします。
注:イオントフォレーシスマイクロ電極は一定のバイアス電流を受けます。 「Acquire」をクリックすると、主電流が制限された期間だけ適用されるまでにわずかの遅延があります。 - ステップ6.20を2〜3回以上繰り返します。新しいレコードを取得する前に、TMA信号がベースラインに戻るまで待ちます。プログラムは後で分析するために各レコードを保存します。
- ISMを戻して2つの微小電極の間隔を確認するoコントロールボックスで指定されたゼロ位置。微小電極がもはやセンタリングされていない場合は、ステップ6.17と同じ方法を使用して再度センタリングします。電極の位置の変化を記録する。
注:スペースが約2%以上変化した場合、ステップ6.19で取得したレコードは正確ではなく、新しいものを取らなければなりません。
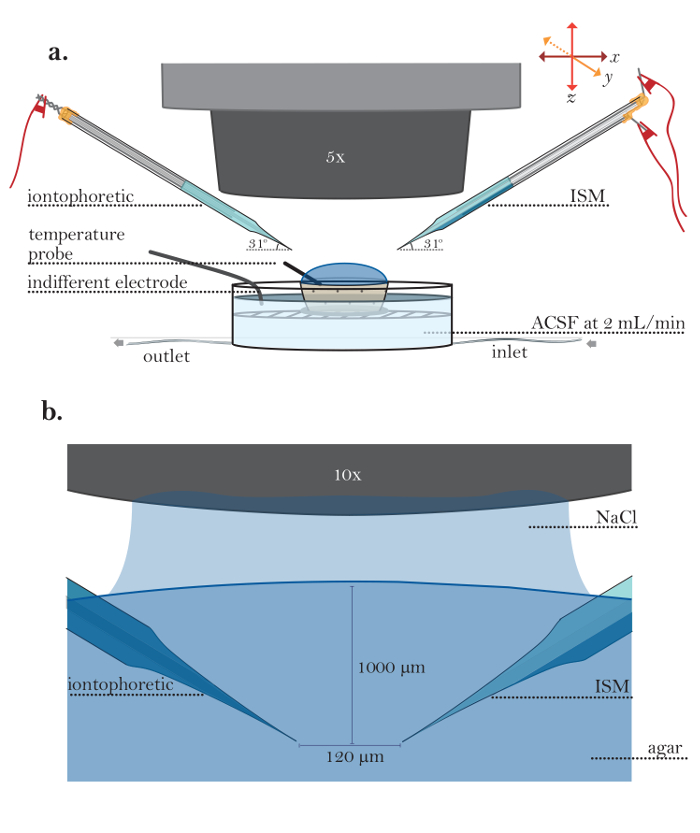
図5:寒天培地における実験のセットアップ。 ( a )希釈寒天中の実験のためのセットアップ(ステップ6.1-6.5):希釈寒天を充填した小さな多孔質容器を、実行中の灌流チャンバーに配置する。イオントフォレーシス微小電極(左側)とISM(右側)を微小電極ホルダーで保持し、微小電極ホルダーは、ロボットマイクロマニピュレーターのアームにはめ込まれる。温度プローブを寒天ゲルに入れ、無関係の接地電極をpl浸漬チャンバ内に設置される。 ( b )寒天中の微小電極の拡大図:イオントフォレシス微小電極(左側)およびISM(右側)を10倍水浸対物レンズ(ここでは150mM NaClに浸したもの)を用いて寒天中で視覚化する。微小電極は、マイクロマニピュレーターを用いて1000μmの深さに配置される。微小電極間の間隔は120μmである。 この図の拡大版を見るには、ここをクリックしてください。

図6:Wandaコンピュータのソフトウェアインターフェイス ( a )WandaナビゲーションGUI(Graphical User Interface):Wandaソフトウェアを開いた後に表示される画面。ボックス(1)では、適切な培地、イオントフォレシス分子および技法が選択される。 (2)「キャリブレート」をクリックして開くワンダ較正ボックス。 ISM( 図6bおよび補遺B参照)を較正した後、プロトコルのステップ6および8に記載されているように、ISMを寒天または脳内に配置する。ボックス(6)には、実行されている実験のためのすべての適切な値が入力される。 (7) "Acquire"をクリックして録音します。 Wanda GUIの右上部分に電圧対時間のグラフが表示されます。 ( b ) ワンダのISMのキャリブレーション :ワンダGUIの(2)「キャリブレーション」をクリックすると開くウィンドウ。ステップ3.29からの値がボックス(3)に入力され、(4)「フィットデータ」が選択される。検量線は線形であることが確認されます。 (5)Wanda GUIに戻るには、 "Accept"をクリックします。 この図の拡大版を見るには、ここをクリックしてください。
アガロースのデータ解析
- オープンコンピュータ上のウォルタープログラム(PC)。 "0. Records From:"メニューで、Wanda( 図7a )によって生成されたレコードを読むために "Wanda / VOLTORO"ボタンをクリックします。その出力がスプレッドシートに必要な場合は、適切なソフトウェアを開きます。 「1. Excelを書きますか?」の「シート1,3」をクリックします。メニュー( 図7b )。
- 次のポップアップウィンドウで、読み込むレコードを選択し、[開く]をクリックします( 図7b )。レコードが自動的にグラフ化されることに注意してください。フィッティング手順を開始するには、次の手順を実行します。
- 「2.オプション」メニューで、「選択する」ボタンをクリックします。 [ 図2 ]ポップアップウィンドウで、マウスを使用して、処理する最初のレコードに十字線を移動します( 図7c )。マウスボタンを押してレコードを選択します。
- oをクリックn「フィットカーブ」を選択します。フィッティングの反復回数を選択します。データの正確な適合を得るために少なくとも20回のフィッテイング反復を使用してください。
- メニューで、すべてのデータポイントに合わせて「すべて」を選択し、「続行」を選択します。プログラムは表示された曲線に適合します。フィッティング手順を観察し、得られた最良のフィット曲線と実験記録を比較する。
- 「7.結果」メニュー( 図7d )の「Excel」をクリックして、結果を適切な表計算プログラムに書き込むオプションを選択します。 「 D(E5) 」、「 基準D(E5) 」、「 r_app 」、トランスポート番号「 n t 」、「 見掛け上の位置 」のイオントフォレーシス微小電極の機能を決定するために使用される次の重要なデータをメモn t 'である。
注: " D(E5) ":測定された自由拡散係数tx10 5 (cm 2 / s)。 「 基準D(E5) 」:理論上の自由拡散係数x 10 5 (cm 2 / s)。この値は、イオン、媒体、および温度入力に基づいてWalter内のデータベースから抽出されます。 " r_app ":測定された基準D(E5)に基づいて計算された見かけ上の微小電極間隔(cm ) 。 " n t ":トランスポート番号(無次元)。この数はTMA 4を解放するために使用されているイオン導入電流の割合を決定します。 " 見かけ上のn t ":明らかなトランスポート番号(無次元)。これは、 r_appから計算されたトランスポート番号です 。この数値は、測定されたn tに近い値でなければなりません。 - 選択した一対の微小電極のレコードごとにステップ7.1-7.3を繰り返します。
- イオントフォレーシス微小電極が使用可能かどうかは、以下のようにして決定します。
- 実際のR( すなわち、120ミクロン)で「r_app」を比較します。この基準は、すべての試験からの平均値がお互いに4%以内である場合に満たされる。
- 「 D(E5)」を基準D(E5)と比較する。この基準は、すべての試験からの平均値がお互いの8%以内であれば満たされる。
- 同じ微小電極を用いて試験間の「 n t 」を比較する。この基準は、すべての試行の平均値がお互いの10%以内であれば満たされます。
- ステップ7.5の基準の1つが満たされなかった場合は、イオントフォレーシス微小電極のトラブルシューティングを行ったり、別の試験を開始したりします。
- イオントフォレーゼ微小電極が実験に適していると思われる場合は、Wanda GUI( 図6a )の「輸送数N」フィールドにすべての試験からの平均輸送数を記録する。
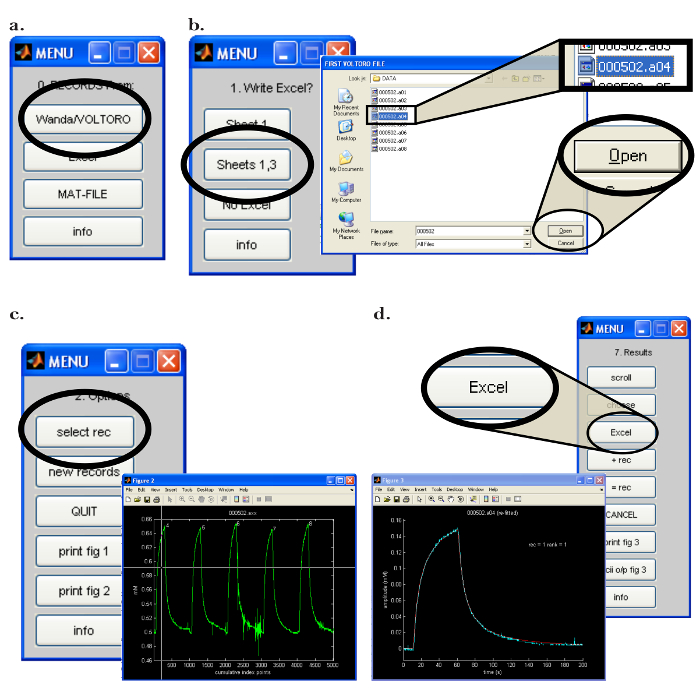
図7:Walterコンピュータのソフトウェアインターフェイス ( a )Walterでのデータ収集プログラムの選択:Walterソフトウェアの起動後に「0. Records From:」メニューが開きます。 Wanda / Voltoroボタンをクリックすると、Wandaによって保存されたレコードを読み込むオプションが選択されます。 ( b )Walterでのデータとデータ分析の出力場所の選択:[Left]適切なスプレッドシートプログラムを開いた後、以前に開いたスプレッドシートプログラムにすべてのWalterデータ分析を出力するために "Sheets 1,3"が選択されます。 [右]データ解析の出力場所を選択すると、ポップアップウィンドウが開き、ユーザーはWalterが最初に読み込んだ録音を選択できるようになります。 ( c )Walterで分析する録音を選択する:[右]読み込むファイルを選択すると、選択したすべてのレコードが表示されたポップアップウィンドウが開きますグラフとして再生されます(「 図2 」)。 [Left]「2.Options」メニューでは、「select rec」をクリックし、マウスを使用して十字線を移動して分析用の最初の記録を特定します。いずれかのマウスボタンを押して録音を選択します。 ( d ) ウォルターからスプレッドシートへのデータ分析のエクスポート:データをフィッティングした後、ポップアップウィンドウと「7.結果」メニューが表示されます。 [Left]選択したレコーディングのグラフ(青色)。ウォルター(赤色)によって生成された拡散曲線が表示されます。 [右]「7.結果」メニューでは、「Excel」ボタンをクリックすることで、分析からスプレッドシートプログラムにデータを書き込むことができます。 この図の拡大版を見るには、ここをクリックしてください。
8.脳スライスにおけるリアルタイムイオントフォレシス
- 400μm厚の脳を置きます。記録チャンバー内のシラミは、流れているACSFに完全に沈められていることを保証する。水彩画ブラシを使用してスライスを配置し、格子で静かに固定します。
- イオントフォレーシス微小電極とISMの両方を脳スライス上の関心領域の上に移動します。流れているACSFではなく、スライスの上に沈んでください。
- リファレンスチャネルとイオン検出チャネルの両方の電圧を「0」mVにオフセットします。両方のチャンネルの電圧が安定するのを待ちます。チャートレコーダーで、ISMのイオン検出チャンネルで測定された電圧をマークします。これを使用して、WandaのベースラインVパラメータを計算します。
- ISMとイオントフォレーシス微小電極をスライスに200μmの深さに、120μm離れて配置します。微小電極を脳スライスに移動させた後、信号の安定を待つ。
注:イオントフォレシス微小電極に印加されるバイアス電流は、TMAの小さな蓄積を引き起こす。 arを取るのはよくある間違いですあまりにも早すぎると信号の蓄積を過小評価する。 - カルテレコーダーで、ISMのイオン検出チャンネル上の脳スライスで測定された安定した電圧をマークします。ステップ8.3とステップ8.4で測定したTMA信号の電圧差を計算し、Wanda GUI( 図6a )のMeasuring Electrodeボックスの "Baseline V(mV)"フィールドにこの値を入力します。
- GUIの左側で、すべての実験パラメータが正しく記録/入力されていることを確認します。ステップ7.4でイオントフォレーシス微小電極について計算された平均値に「中」を「脳」に、「輸送数」を、そしてスライスを含む浴の温度に「温度」を設定する。
注記:測定値ごとにVを記録する必要があります。ベースラインVは、WandaによってベースラインC (mM)パラメータ( すなわち、脳組織中のTMAの濃度)に変換される。 - "Acquire"をクリックしてレコーディングを開始し、フルレコーディングを可能にします。 TMA信号がベースラインに戻るまで待ってから、新しい録音を取得してください。
- 選択した脳の場所から微小電極を取り除く前に、2〜3回の連続した記録を行います。各記録の直前にWandaソフトウェアに測定した温度を入力します。
- 両方の微小電極を斜めにスライスの表面に戻してください。両方をスライスの上50μm以上に上げます。チャートレコーダを使用して、今測定されたVとステップ8.3の測定値との間の変化を決定する。
- ISMの先端とイオントフォレーシス微小電極をx軸、y軸、z軸の中心に合わせます。マイクロマニピュレーターコントロールボックスのディスプレイからスペーシング変化があれば、それを得る。
9.脳データ解析
- 解析出力用に新しいスプレッドシートを開きます。
- ウォルターの分析で7.1-7.4の手順を繰り返します。脳から採取された記録。
- ウォルターメニューの「Excel」をクリックして、スプレッドシートプログラムにデータを書き込みます。脳ECSのα 、体積分率を記録する; λ 、脳ECSの屈曲; k (s -1 )、非特異的クリアランス。
10.トランスポート番号とISMキャリブレーションの確認
- 以下のプロトコルを使用して、実験の最後にISM輸送番号( n t )を測定する。あるいは、致命的な試行のあと、または測定結果に異常がある場合は、 n tをチェックします。しかしながら、 n tを何度もチェックすることは、脳スライスに外傷をもたらす可能性がある。
- アガロースで新しい記録を取る。手順6.4,6.11,6.12,6.14,6.15、および6.17-6.22を参照してください。
- 繰り返しますが、新たなアガロース録音からn個のトンを得るために、ウォルターに7.1から7.4を繰り返します。スプレッドシートを検査する: n tがさらに変化した場合脳測定前に得られたn tから10%よりも大きい場合、このイオン導入微小電極で得られたデータは信頼できない。
- すべての脳データが収集された後、ISMの新しい較正(ステップ3.29参照)を実行します。新たに得られたISM校正データをWanda校正ボックス(6.9および6.10項を参照)の入力として使用し、勾配値が以前の校正から10%未満異なることを確認します。
注記:このISMで得られたデータは、傾きの値が前回の較正と10%以上異なる場合は信頼できません。
結果
RTI技術の有用性は、 αの変化および低浸透圧チャレンジ中の変化を測定するために設計された実験で実証されている( 図8および図9 )。以前に低張ACSFで洗浄することにより、ECSの浸透圧を低下させることはαの減少及びλ13の増加を生じさせることが示されています。
この実験において、RTIは、制御条件下および低張性ACSFのウォッシュ・オンの両方の条件下で、ラットの脳スライスで実施した。 ISMを製作し、その較正パラメータを、58.21mVの勾配( M )を計算したNicolsky方程式に適合させるためにWandaに入力した。 ISMおよびイオントフォレシス微小電極を寒天中に置き、輸送ニューロンを測定するために互いに120μm離して配置したmber。 3回の記録を行い、プロトコルのステップ6( 図8a )の手順に従って曲線を適合させ、分析した。各試行のフィッティングされた曲線は生の曲線と重なった( 図8a )。測定された拡散係数( D×1E5 )、輸送数( n t )、および微小電極の見かけの間隔( r_app )とそれらの実際の間隔( r )との間の差は、3回の記録間で有意に異ならなかった( 図8b 、レコーディングa1-3)。これらの基準に基づいて、このイオントフォレシス微小電極は、実験を続けるために許容可能であると考えられた。
一旦、安定なイオントフォレーシス微小電極が選択されると、これらのパラメータのベースラインを確立するために、ラット脳スライスにおけるαおよびλの対照値をとった。プレvious研究は、0.18から0.22 =ラット新皮質のための制御値がαであることが判明し、λ= 1.54から1.65 1。この実験においてこれらの値を再現するために、ISMおよびイオントフォレシス微小電極を、ラット新皮質中に200μmの深さに配置し、互いに120μm離して配置した。 図8bのデータから計算された平均n tは 、 αおよびλの計算に使用するWandaプログラムに入力された。脳の深さ約200μmの2つの微小電極の配置からのベースラインVのシフトを記録し、電圧ジャンプをWandaに入力して、ベースラインTMA( すなわち、ベースラインCパラメータ)濃度を補正した。 3回の記録を行い、それらの曲線を適合させた( 図9a 、 図9dおよび図9f )。適合は平均を示したα = 0.192およびλ = 1.69( 図9e )。記録をとった後、ベースラインVの間隔およびシフトをチェックし、補正された値をWandaに入力してデータを再解析した(プロトコルのステップ8で詳述)。再計算された値は有意に異ならず、 図9dに報告された値が受け入れられた。
ACSFの通常のモル浸透圧濃度は300mOsmである。ラットの体性感覚新皮質におけるαおよびλに対する低張ACSFの効果を試験するために、150mOsmの浸透圧を有するACSFを、NaCl濃度を低下させることによって作製した。それは、この低張ACSFが低くαおよび潜在的により高いλ13を引き起こし、脳細胞の腫れにつながるという仮説を立てました。脳スライスを低張性ACSFで約30分間灌流し、脳と平衡させる。この間、微小電極は、対照状態の以前の測定の間と同じように新皮質の同じ場所にとどまった。 5回の記録を低緊張条件下で行った( 図9bおよびf )。これにより、平均α = 0.13およびλ = 1.84が生成された( 図9e )。これらの値は、低浸透圧がαを減少させ、 λを増加させるという仮説と一致していた。ベースラインVの間隔および変化を測定し、分析および適合手順中に考慮した。
回復パラメータも、通常のACSF(300mOsm)で洗浄し、新皮質の同じ場所に新しい記録を取ることによって測定した。膨潤効果は可逆的でなければならないので、 αおよびλは対照レベルに回復すると予想された。値av通常のACSFウォッシュ・オンの30分後に採取された4つの記録について、 α = 0.37およびλ = 1.61であった( 図9c 、 図9eおよび図9f )。これは、これらの条件下でαの回復中に予期しないオーバーシュートがあることを示した( 図9eおよび図9f )。その後、微小電極を寒天に戻して、イオントフォレーシス微小電極の輸送数が変化していないことを確認した( 図8c )。その後、ISMを再較正し、ニコールスキーの式に新たに当てはめた結果、勾配は58.21mVであることが判明した。
この実験は、RTIが理想的な条件下でどのように見えるかの明確な例です。実験の次の要素が成功の鍵でした。まず、アガロースおよび脳は、Wanda( 図8aおよび図9aおよび図9c )によって生成された理論曲線との適切なオーバーラップを示した。同様のベースラインに対する勾配、ピーク、およびリターンの類似性は、マッチの強さを決定する上ですべて重要です。アガロースで記録する場合、曲線のこれらの部分はしばしば問題となり、よく適合した曲線( すなわち、良好な微小電極)を生成する条件を見出す前に、複数の記録を行わなければならないことが一般的である。第2に、実験前後の平均輸送数はお互いに10%以内であった( 図8bおよび図8c )。これが起こらなければ、脳に記録された値は信頼できませんでした。これは、RTI実験で最も一般的な問題である。第3に、標準化されたTMAソリューションのISM較正実験は一致した(データは示さず)。通常、動作中のISMのキャリブレーションは10%以内であり、これは実験の失敗の稀な原因となります。

図8:脳の実験の前後における寒天の理想曲線適合データ。 ( a )寒天培地における代表的なデータ:[左図] TMAの濃度曲線を示す寒天培地で得られた単一の試験の代表的なデータ。拡散測定の前に、+ 20nAの一定のバイアス電流をイオントフォレーシス微小電極を通して印加した。時間= 10秒で、+ 60nAの主電流を50秒間印加することにより、TMAをイオントフォレシス微小電極から寒天中にパルスした。源から120μmの位置にあるISMを用いて[TMA]を経時的に測定することによって拡散曲線を生成した。 [ミドル]データpから得られたフィット曲線ウォルターでのロセス[右]データとフィッティングされたカーブの重なりは、Walterが行ったカーブフィッティングがこの試行で拡散を正確にモデル化することを示しています。 ( b )脳における実験前の寒天測定の表:低張ストレス実験( 図9 )の前に3回の試験(a1、グラフ上)から得られたデータ。すべての試行は、低浸透圧ストレス試験に使用されるイオントフォレシス微小電極およびISMを用いて行った。データは、脳スライスで実験を進めるために必要な基準を満たしていた。これらの基準には、データとフィッティングされた曲線(上記のような)との間の適切な重なり、および輸送数の10%未満の変動が含まれる。追加の基準は、ステップ7.6に概説されている。 ( c )脳における実験後の寒天測定の表:低浸透圧ストレス実験後の寒天で行った3回の試験から得られたデータ( 図9 )。構成試験a1-3とa4-6との間で実証されたencyは、ISMおよびイオントフォレーシス微小電極が脳試験を通じて安定であることを強く示唆している。 Rec =録音または試聴。 r = ISMとイオントフォレーシス微小電極との間の距離; Cb =ベースライン濃度; ref D x1E5 =予め計算された標準に基づく理論上の自由拡散係数x 10 5 (cm 2 s -1 )。 n t =輸送番号(無次元)。 D (E5)=測定された自由拡散係数×10 5 (cm 2 s -1 )。 r_app =測定および基準D (E5)に基づく見かけの微小電極間隔(cm)。 n t明らか = r_appに基づく見かけ上のトランスポート番号。 この図の拡大版を見るには、ここをクリックしてください。

図9:低浸透圧ストレスはアルファを減少させ、ラムダを増加させる
ac。 ( a )対照、( b )低浸透圧、および( c )回復条件下での脳における試験からの代表的なデータ:実線はデータを表し、黒色の破線は適合曲線である。 3つの条件は、異なる傾き、振幅、幅を含む著しく異なる拡散曲線を示す。 ( d )対照試験からのデータ表:3つの対照試験のデータ表(b1、上のグラフ); αおよびλはすべての試験において類似しており、ラット新皮質についての公表されたデータと一致する。脳内のすべての試験のために、測定値( 図8Bおよび8C)寒天前後の実験からの平均値N tは 、脳の N Tのために使用しました。脳D refは、T = 34.5 [℃]でラットの脳で得られた拡散係数(Walter)のデータベースに基づいて、1.25×10 -5 cm 2 s -1に設定した。パラメータk ' [s -1 ]は、拡散測定中にECSから失われた少量のTMAを説明する。 k 'は典型的には非常に小さいが、曲線フィッティングのパラメータを含めてRTI法の精度を向上させる。損失パラメータk 'はおそらく、細胞取り込みまたはACSFへのTMAの損失を表す。 ( e )対照、低浸透圧および回復条件の比較:コントロール、低浸透圧および回復条件下での脳内のすべての試験の平均。データは、低浸透圧ストレスがαを減少させ、 λを増加させることを示している。低浸透圧状態に続く回復期間中に、 αはベースライン(対照)でオーバーシュートし、 λベースラインに戻ります。この結果は、低浸透圧刺激の際のECSの変化が部分的に可逆的であることを示唆している。 RTI法は、このタイプの急性可逆的効果を研究するのに理想的である。 ( f )データクラスタリングを示すグラフ:各試験からの体積分率(x軸)および曲がり率(y軸)を単一点としてプロットする。このグラフは、各群( すなわち、対照、低浸透圧および回復)におけるデータのクラスタリングを示し、RTIが脳刺激ECSにおける低浸透圧チャレンジの再現性のある影響を検出する感度を有することを示唆している。 Rec =録音または試聴。 r = ISMとイオントフォレーシス微小電極との間の距離; Cb =ベースライン濃度; α =体積分率; ラムダ =蛇行。 k ' =プローブの非特異的クリアランス。 この図の拡大版を見るには、ここをクリックしてください。
補足ファイル: ここをクリックしてファイルをダウンロードしてください。
ディスカッション

図10:一般的な技術的問題を示す理想的でないデータ ( a )イオントフォレーシス微小電極による一般的な技術的問題の図:機能的イオントフォレーシス微小電極からのTMAの正常放出と、技術的問題を示す3つの供給源との比較。 [高倍率、a1]理想的なイオン導入源の電流は、TMA放出および塩化物の取り込みによって等しく運ばれる。 [高倍率、a2]低いn tを有するイオントフォレシス微小電極は、TMAが少なく放出し、通常より多くの塩化物を取り込む。 [高倍率、a3]電気浸透を示すイオントフォレシス微小電極は、TMA、塩化物および溶媒を放出する。 [高倍率、a4]経時的な放出増大( すなわち、 「ウォーミングアップ」)を示すイオントフォレシス微小電極。 ( b )非理想データのグラフo寒天で得られる:データはウォルターによってフィットされた曲線によって適切にモデル化されていないため、正確に解釈することはできない。不一致の正確な原因は不明である。 ( c )寒天で得られた理想的でないデータの表:第2行の非理想的なデータとの比較のために、寒天中の正常または期待結果を上段に表示する( 図8aにグラフで示す )( 図10bにグラフで示す )。 図10bのデータとフィッティングされた曲線との間の重複が少ないことは、フィッティングされた曲線が拡散データを正確にモデル化しないことを意味する。したがって、計算値(*印)は解釈できません。これは、イオントフォレーシス微小電極( 例えば、ウォームアップ)またはISM( 例えば、遅い応答)の問題によって引き起こされた可能性がある。トラブルシューティング:イオントフォレーシス微小電極から始めて、一度に1つずつ微小電極を交換する。 Rec =録音または試聴。 rISMとイオントフォレーシス微小電極との間の距離; Cb =ベースライン濃度; ref D x1E5 =予め計算された標準に基づく理論上の自由拡散係数x 10 5 (cm 2 s -1 )。 n t =輸送番号(無次元)。 D (E5)=測定された自由拡散係数×10 5 (cm 2 s -1 )。 r_app =測定および基準D (E5)に基づく見かけの微小電極間隔(cm)。 n t明らか= r_appに基づく見かけ上のトランスポート番号。 この図の拡大版を見るには、ここをクリックしてください。
図8および図9に示された実験は、安定して動作するイオントフォレーシス微小電極およびISMを有していたが、理想的な結果をもたらさない。 「正常」TMAイオン泳動微小電極は、 n t  0.3である。 図10aは、RTI実験中に遭遇する可能性のあるイオントフォレーシス微小電極の3つの共通の問題を示す。
0.3である。 図10aは、RTI実験中に遭遇する可能性のあるイオントフォレーシス微小電極の3つの共通の問題を示す。
低リリース。イオントフォレーシス微小電極は、バイアス電流または主電流が印加されたとき、非常に小さなTMAを放出し、 n t <0.1となる。電流は依然として先端を通過しているが、その大部分は先端に入っているClアニオンによって運ばれ、先端を離れるTMA陽イオンによってほとんど保持されない。 n tがいくつかの連続した試験において安定である場合、これらのイオントフォレシス微小電極を使用することができる。ただし、最適に機能していないため、これは推奨されません。これは、さらなる問題が発生する可能性があることを意味します。さらに大きな極端なイオントフォレーシス微小電極の先端が塞がれ、イオンが先端から出たり入ったりしないときに生じる。この場合、曲線は生成されません。そのような場合、すべての電気的接続が適切かつ確実であることを確認した後、イオントフォレーシス微小電極を廃棄しなければならない。
高放出(電気浸透)。 TMAに加えて、イオントフォレーシス微小電極も水を放出し、 n t > 0.5となる。 n tがいくつかの試行にわたって安定している場合、これらのイオントフォレーシス微小電極を使用することができるが、さらなる問題が発生する可能性があるので、これは推奨されない。取るべきトラブルシューティングの唯一のステップは、主電流を減らすことです。これにより、水の放出がなくなり、 n tが0.5未満に減少することがあります。
成長の勃発(「ウォームアップ」)。この場合、TMAのリリースは時間とともに増加します。 「ウォームアップ」が急速であるとき、拡散曲線は図10bに示すものと同様の形状を有し、確実にはめ込むことができない。この場合、拡散曲線は、主電流の初期段階におけるTMA濃度のゆっくりした上昇を示し、TMA濃度はプラトーではない。信頼性の低い適合は、測定された輸送数とr_app値の一貫性に影響する不正確な測定Dを作成します。 「ウォームアップ」がより緩やかになると、個々の拡散曲線の形状に大きな影響はありませんが、それは連続した試験で増加するn tに現れます。 「ウォーミングアップ」状態は、ある時間(約30分)イオントフォレーシス微小電極を「脈動させる」ことによって時々是正することができる。これは、バイアス電流と高い主電流(+ 200nA)とを数秒間交互に行うことによって行われる。イオントフォレーシス微小電極が依然としてスタブを与えない場合eトランスポート番号を使用する場合は、単に新しいものをテストするのが最善です。
αの正確な値を保証するには、実験全体の輸送数と安定性の正確な測定が不可欠です。微小電極間の間隔を維持することは、 αとλの両方を決定するために重要である。アガロース中または脳内で測定後に間隔が変化した場合、マイクロ電極の先端間の直線距離を出力スプレッドシートに入力し、Walterによって再分析することができる。値の差が大きすぎる場合は、測定値を破棄する必要があります。温度変動は、不正確さの原因となる可能性もあります。したがって、正確な温度プローブと信頼性の高いチャンバー発熱体を使用することが重要です。
イオントフォレーシス微小電極は、RTI技術における問題の最も頻繁な原因である。優れたデータを得るためには、安定したISMの作成と使用が不可欠です。 OISMの可能性のある問題は、チップの非常に高いインピーダンスによって引き起こされることがある緩やかな応答になります。応答が遅いISMでは、すべてのイオントフォレーシス微小電極は「ウォーミングアップ」効果を示すように見えますが( 図10b )、ISMが変化するTMA濃度を十分に速く検出できないことが原因です。微小電極間の距離を増やすと(150μmまで)、ISMが応答する時間が長くなり、曲線のフィッティングが改善されます。遅い応答は、イオン交換体が先端内部に後退したことを示している可能性がある。これは複合顕微鏡の下で見ることができ、存在する場合、シラン化が不良であり、ISMを廃棄しなければならないことを意味する。さらに、ISM信号がドリフトすると、データが不正確になる可能性があります。ドリフトが許容範囲を超えるデータに影響を与えるかどうかは、実験者の判断で決まります。
RTIの制限
Tここでは、データ分析の根底にある仮定のためRTI法に対するいくつかの制限がある。これらの仮定には、関心のある脳領域およびこの領域を取り囲む球形容積の両方における組織均質性および組織等方性の要件が含まれる。 RTIの文脈では、組織の均一性は、拡散パラメータが関心領域内で一定であることを必要とする。組織等方性は、 D *の単一の値が3つの空間軸すべてに適用されることを意味します。ソース微小電極から放出された各分子は、記録ISMの位置に到達する前にランダムな経路をとる。一度に記録される分子( すなわち濃度)の数を表すISMの電圧は、3つの空間軸のすべてを移動した分子、およびISMを超えて移動して測定に戻った分子を含む( 図1c )。 RTIデータ解析中、Walterプログラムの生成平均αとλは、点源からISMまでのすべての軸を移動するすべての分子の拡散を含む。拡散速度は、3つの空間軸(異方性)または組織が不均質である場合、追加のデータ収集およびデータ分析のいずれかにおいて有意に異なる場合、α及びλ8、14を計算するために必要とされます。
上記の組織前提条件に加えて、RTI法は、点源とISMとの間の間隔(これは、 rと呼ばれる)がおよそ80〜130μmであることを必要とする。 rが50μm未満に減少すると、ISM応答は、プローブ分子の濃度の拡散依存的な変化を記録するのに十分速くない可能性がある。これは、より速い応答時間10、15と同心ISMSを使用して、将来的に改善される可能性があります。より大きいrISM配置中のECS環境、ISM先端サイズ、および脳組織損傷の脳領域非依存性の差異も最小にする。逆に、 rが150μmを超えて増加すると、イオン泳動点源からの分子の拡散は、脳の関心領域または組織 - 灌流境界14を取り囲む非等方性、不均一な要素の影響を受けやすくなる。
ECSを探索するためのRTIと代替技術の組み込み
RTI法は、分子プローブを利用してECSを研究するより大きなグループの技術に属する。それぞれの方法には独自の利点と欠点があります。 RTIはリアルタイムでαとλの両方の正確な計算を可能にするが、この方法はイオン交換体によって検出できる荷電分子プローブを必要とする。荷電していないプローブの研究など、イオン導入法が適切でない実験では、i咽頭滲出液を圧力放出に置き換えることができる。残念ながら、現在の技術では、放出される体積は、注入された媒体16の特性に依存するため、圧力放出を伴うαの計算は考慮されていない。交換体が存在しないプローブを使用するために、プローブは蛍光標識され、エピ蛍光顕微鏡によって測定されるECSを通したその拡散が標識されてもよい。統合光学イメージング(IOI)として知られるこの技術は、サイズおよび蛍光標識分子の利用可能性および細胞取り込み17,18のための潜在的により制限されます。 IOI技術は、巨大分子がプローブとして使用できるという利点を有し、これは分子サイズとともにλが増加することを明らかにしている。最後に、重要な種類の拡散方法が放射性トレーサーを使用していますが、もはや一般的な使用ではありません2 。
RTIの将来のアプリケーション
1、4、6を拡大し 、in vivoでこの技術を実現することも可能です。それはまた、化学環境、薬理学、外傷、または遺伝子ノックアウト1への変更によって誘発されるものなど、脳生理学における広範な変化の影響を試験するためにも使用することができる。 ECSで誘導された変化が約2分以上持続する限り、RTIはECSの体積分率および蛇行の正確な定量を提供することができる。
過去50年間に脳のECSの構造と機能に関する重要な洞察が得られていますが、多くの未解決の疑問が残ります。例えば、恒常性機構がαを調節するかどうか、 αの変化が脳機能にどのように影響するかは依然として不明である。コンピュータモデルは、細胞の形状やλに影響する他の要因の相対的な寄与を推定するのに役立ちましたが、より多くの作業が必要となります1 。最後に、神経疾患の病因におけるECSの役割(およびその逆)は、ほとんど未解明です。近い将来、RTI測定は特定の脳領域への標的薬物送達を改善する可能性がある19 。
開示事項
著者らは、競合する金銭的利益がないと宣言している。
謝辞
この研究は、NIH NINDS助成金R01 NS047557によって支持された。
資料
| Name | Company | Catalog Number | Comments |
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate - do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5mm x 16mm) |
| objective 5x dry | Olympus | MPlan N | |
| objective 10x water immersion | Olympus | UMPlan FL N | 10x objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
参考文献
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C., Michael, A. C., Borland, L. M. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. , 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes, ., Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved