Method Article
Iontoforesi in tempo reale con tetrametilammonio per quantificare la frazione del volume e la tortuosità dello spazio extracellulare del cervello
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive la iontoforesi in tempo reale, un metodo che misura i parametri fisici dello spazio extracellulare (ECS) dei cervelli viventi. La diffusione di una molecola inerte rilasciata nell'ECS viene usata per calcolare la frazione del volume ECS e la tortuosità. È ideale per studiare cambiamenti reversibili acuti al cervello ECS.
Abstract
Questa revisione descrive i concetti base e il protocollo per eseguire il metodo in tempo reale di iontoforesi (RTI), lo standard oro per esplorare e quantificare lo spazio extracellulare (ECS) del cervello vivente. L'ECS circonda tutte le cellule del cervello e contiene sia il liquido interstiziale che la matrice extracellulare. Il trasporto di molte sostanze necessarie per l'attività cerebrale, compresi i neurotrasmettitori, gli ormoni e le sostanze nutritive, avviene per diffusione attraverso la ECS. Le variazioni del volume e della geometria di questo spazio si verificano durante i processi normali del cervello, come il sonno e le condizioni patologiche, come l'ischemia. Tuttavia, la struttura e la regolazione della ECS cerebrale, in particolare negli stati malati, rimangono in gran parte inesplorati. Il metodo RTI misura due parametri fisici del cervello vivente: frazione di volume e tortuosità. La frazione di volume è la proporzione del volume di tessuto occupata da ECS. Tortuosità è una misura della relativa impedenza che una sostanza incontra quando si diffonde attraverso un cervelloGion rispetto ad un mezzo senza ostruzioni. In RTI, una molecola inerte viene pulsata da un microelettrodo di origine nel cervello ECS. Mentre le molecole si diffondono da questa sorgente, la variabile concentrazione dello ione viene misurata nel tempo utilizzando un microelettrodo ionico selettivo posizionato a circa 100 μm di distanza. Dalla curva di diffusione risultante, è possibile calcolare sia la frazione di volume sia la tortuosità. Questa tecnica è stata utilizzata in fette cerebrali di molteplici specie (compresi gli esseri umani) e in vivo per studiare cambiamenti acuti e cronici a ECS. A differenza di altri metodi, RTI può essere utilizzato per esaminare sia cambiamenti reversibili che irreversibili nel cervello ECS in tempo reale.
Introduzione
Lo spazio extracellulare (ECS) è la rete di canali interconnessi esterni a tutte le cellule del cervello e contiene sia il liquido interstiziale che la matrice extracellulare ( Figura 1a e Figura 1b ). La distribuzione di molte sostanze necessarie per la funzionalità delle cellule cerebrali, comprese le sostanze nutritive, gli ormoni e i neurotrasmettitori, avviene per diffusione attraverso la ECS. I cambiamenti nei parametri fisici di questo spazio, compresi il volume, la geometria e la matrice extracellulare, possono influenzare drasticamente la diffusione attraverso la ECS e le cellule cerebrali di concentrazione delle ioni locali che hanno un impatto profondo sulla funzione delle cellule cerebrali 1 , 2 .
La iontoforesi in tempo reale (RTI) è utilizzata per determinare due caratteristiche strutturali di una regione del cervello: frazione di volume e tortuosità 3 , 4 ,"Xref"> 5. La frazione di volume ( α ) è la proporzione del volume tissutale occupato dall'ECS ( V ECS ) rispetto al volume totale del tessuto ( tessuto V ) in un volume elementare rappresentativo;

La tortuosità ( λ ) è l'impedenza relativa che una sostanza incontra quando diffonde attraverso una regione del cervello rispetto ad un mezzo senza ostruzioni;
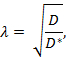
Dove D * (cm 2 s -1 ) è il efficace coefficiente di diffusione della sostanza nel cervello e D (cm 2 s -1 ) è il coefficiente di diffusione libera della sostanza in un mezzo libero, come il gel agarosio diluito.
Oggi, la sostanza sonda più comunemente utilizzata per la RIl metodo TI è il piccolo cation tetrametilammonio (TMA). TMA ha un peso molecolare di 74 g / mol, si dissociizza completamente in soluzione e ha una carica positiva. Gli studi di RTI con questo ione hanno dimostrato che α  0,2 e λ
0,2 e λ  1,6 1 , 2 . Ciò significa che l'ECS è circa il 20% del volume totale del cervello e che la diffusione di una piccola molecola inerte si verifica circa 2,5 volte più lentamente nella ECS che in un mezzo senza ostruzioni 3 . Tuttavia, entrambi α e λ variano con l'età del cervello, la regione e lo stato e nelle condizioni patologiche 1 . Le alterazioni di questi parametri sono state legate allo sviluppo del cervello, all'invecchiamento, al sonno, all'epilessia e ad altri processi fondamentali e alle malattie del cervello 1, 6 . Mentre altre tecniche misurano α e λ , RTI può misurare sia in regioni localizzate del tessuto vivente in tempo reale. Per questa ragione, RTI è diventato uno strumento indispensabile per indagare i cambiamenti in α e λ durante le sfide acute e reversibili.
1,6 1 , 2 . Ciò significa che l'ECS è circa il 20% del volume totale del cervello e che la diffusione di una piccola molecola inerte si verifica circa 2,5 volte più lentamente nella ECS che in un mezzo senza ostruzioni 3 . Tuttavia, entrambi α e λ variano con l'età del cervello, la regione e lo stato e nelle condizioni patologiche 1 . Le alterazioni di questi parametri sono state legate allo sviluppo del cervello, all'invecchiamento, al sonno, all'epilessia e ad altri processi fondamentali e alle malattie del cervello 1, 6 . Mentre altre tecniche misurano α e λ , RTI può misurare sia in regioni localizzate del tessuto vivente in tempo reale. Per questa ragione, RTI è diventato uno strumento indispensabile per indagare i cambiamenti in α e λ durante le sfide acute e reversibili.
La teoria che supporta RTI è stata originariamente convalidata da Nicholson e Phillips, e la tecnica è stata ampiamente usata da quel tempo 4 , 7 . Gli esperimenti che impiegano RTI iniziano con il rilascio di un impulso di TMA da un microelettrodo di origine mediante iontoforesi in un gel agaroso diluito. Una volta espulsi, gli ioni si diffondono liberamente dalla sorgente di punti, scegliendo da un numero potenzialmente infinito di percorsi casuali ( Figura 1d ). La variabile concentrazione dello ione viene misurata nel tempo utilizzando un microelettrodo ionico-selettivo (ISM) posizionato approssimativamente100 μm di distanza ( figura 1c ). Le variazioni della concentrazione TMA sono grafiche e montate su una curva che permette di calcolare sia il D che il numero di trasporto del microelettrodo ionoforesi (parametri discussi nel Protocollo). Con questi valori, la procedura viene ripetuta in una regione cerebrale di interesse per ottenere D * e per calcolare sia α che λ . Il controllo del microelettrodo ionoforesi, la raccolta dei dati, la grafica e l'adattamento della curva di concentrazione TMA e il calcolo dei parametri sperimentali sono tutti tipicamente eseguiti dai programmi Wanda e Walter, che sono stati appositamente progettati per questo scopo (il software ei relativi manuali sono Liberamente disponibile dagli autori su richiesta).
La sezione del protocollo di questa rassegna descrive le procedure di base necessarie per progettare e eseguire RTI nelle fette del cervello di roditore. La tecnica è stata usata anche in non-astaTra cui le fette del cervello umano e le preparazioni cerebrali in vivo 1 , 4 , 6 , 8 , 9 . La sezione Risultati rappresentativi fornisce sia risultati ideali che non ideali per evidenziare le sfumature nell'interpretazione dei dati. Infine, la sezione Discussione riguarda brevemente tecniche di risoluzione dei problemi, limitazioni di RTI, tecniche alternative utilizzate per studiare l'ECS e future applicazioni di RTI.
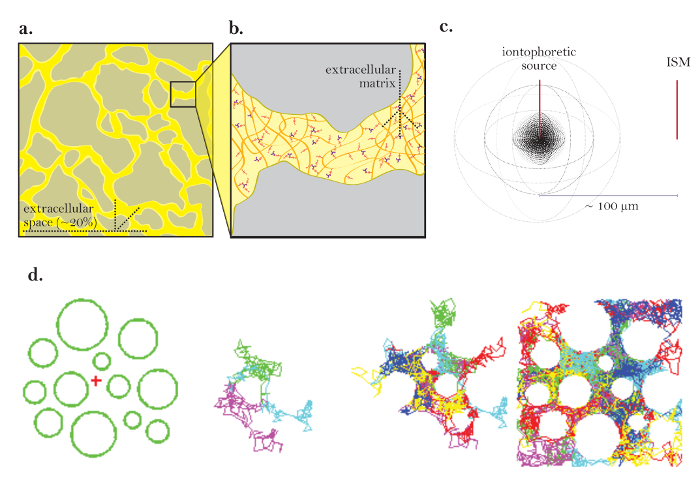
Figura 1: Diagrammi di diffusione tramite ECS. (A) Schema di ECS: dimostra la dimensione e la posizione della ECS in una sezione tipica del cervello. Il colore giallo contrassegna l'ECS tra i processi grigi della cervello. Il volume della ECS è circa il 20% del volume totale del tessuto ( cioè, frazione volume = 0.2) in condizioni fisiologiche. ( B ) Schema ingrandito della ECS: evidenzia i parametri fisici che contribuiscono alla tortuosità, compresa la geometria delle cellule cerebrali (grigio) e la matrice extracellulare (schematizzata come una mesh di glicosaminoglicani multicolori e proteoglicani). ( C ) Diagramma 3D della diffusione da una sorgente di punti: dimostra il movimento netto delle molecole inerte da una sorgente ionoforoica ad un ISM. Escludendo le barriere di diffusione e l'assorbimento cellulare le molecole si diffondono verso l'esterno in tutte le direzioni, producendo una parte frontale di concentrazione sferica. L'ISM quantifica la concentrazione locale delle molecole inerte rilasciate dalla fonte iontoforica. ( D ) Simulazione computerizzata della diffusione in ECS del cervello: [Fine a sinistra] Impostazione per la simulazione di Monte Carlo; Le sfere verdi rappresentano i processi delle cellule cerebrali e la croce rossa rappresenta una fonte di punti. Questa impostazione modella il tessuto cerebrale disegnato in Figura 1a . [Immagini medie] 3 e6 molecole che eseguono movimenti casuali in quanto diffondono attraverso lo spazio extracellulare del cervello, mostrato in 2 dimensioni. [Estrema destra] Camminate casuali di molte molecole rilasciate dalla sorgente di punti. Il movimento netto di tutte le molecole dalla sorgente di punti è verso l'esterno come mostrato nella Figura 1c . Le passeggiate casuali cumulative delineano gli spazi tra le celle ( cioè l'ECS; vedere il riferimento 5 per ulteriori spiegazioni). Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
Tutte le procedure animali, utilizzate per ottenere campioni di tessuto, sono stati approvati dal comitato di etica animale presso il SUNY Downstate Medical Center.
1. Preparazione di soluzioni e attrezzature
- Preparare una soluzione di riempimento di 150 mM NaCl per il barile di riferimento dell'ISM. Conservarlo in una siringa da 10 ml attaccata ad un filtro da 0,22 μm (per rimuovere batteri o particelle).
- Preparare una soluzione di riempimento di 150 mM TMA cloruro (TMA-Cl) per i microelettrodi. Conservarlo in una siringa da 10 ml attaccata ad un filtro da 0,22 μm. Preparare le soluzioni TMA-Cl (in questo protocollo) da una soluzione di magazzino da 5 M per garantire la corretta concentrazione.
- Cloridizzare almeno quattro fili d'argento per la fabbricazione di microelettrodi sottometrando i fili in candeggina (ipoclorito di sodio) per almeno 2 ore. Rimuovere l'eccesso di candeggina con etanolo e lasciare asciugare i fili.
- Preparare 50 ml di agarosio 0,3% in 150 mM NaCl e 0,5 mM TMA-Cl in un bicchiereE coprirlo. Utilizzare agarosio in polvere e ragionevolmente fresco per garantire buone misure di diffusione.
- Scaldare e mescolare la soluzione agarosa con una barra di stirata per sciogliere. Lasciare raffreddare la soluzione a temperatura ambiente. Conservare a 4 ° C per una settimana.
- Preparare un elettrodo indifferente (macinato) composto da 4% di agarosio in 1 M KCl (indicazioni nel Supplemento A)
- Fabbricare una piccola tazza porosa che può essere inserita nella camera sperimentale e che consente la continuità elettrica tra il suo contenuto e l'ambiente esterno ( Figura 2a ). Posizionare un anello metallico sul fondo di questa coppa per impedirlo di galleggiare quando parzialmente sommerso in acqua.
- Utilizzare la diluizione seriale di un magazzino da 5 M di TMA-Cl per fare cinque soluzioni TMA-Cl da 100 mL per la calibrazione delle ISM. Le soluzioni devono avere concentrazioni finali di 0,5, 1, 2, 4 e 8 mM TMA-Cl, tutte in 150 mM NaCl. Conservare le soluzioni di calibrazione in una tazza sigillabile per evitare l'evaporazione.
2. Impostazione elettronica
- Collegare i componenti della configurazione sperimentale RTI secondo lo schema a blocchi della Figura 2b ; Includere un amplificatore con due canali di ingresso (uno dei quali dovrebbe avere un'elevata impedenza per la barra ionica selettiva dell'ISM), un filtro passa-basso impostato a 10 Hz, un registratore di schede, un A / D + D / A Un convertitore, un'unità ionoforica (o un amplificatore in grado di fornire impulsi di corrente costante) e un computer (PC) che esegue i programmi Wanda e Walter. Ispezionare l'impostazione elettronica per verificare che tutti i collegamenti siano in posizione.
- Se necessario, schermare la configurazione sperimentale in un recinto a terra (come ad esempio una gabbia di Faraday), poiché gli ISM hanno un'elevata resistenza e sono sensibili agli artefatti creati dal movimento circostante.
- Creare una stazione di calibrazione ISM dedicata costituita da un doppio amplificatore di ingresso, un registratore di schede, un appropriato supporto ISM e un elettrodo di terra indifferente. Se possibile,Schermare l'involucro. Salta questa fase se gli ISM sono calibrati nell'installazione sperimentale (passo 3.29)
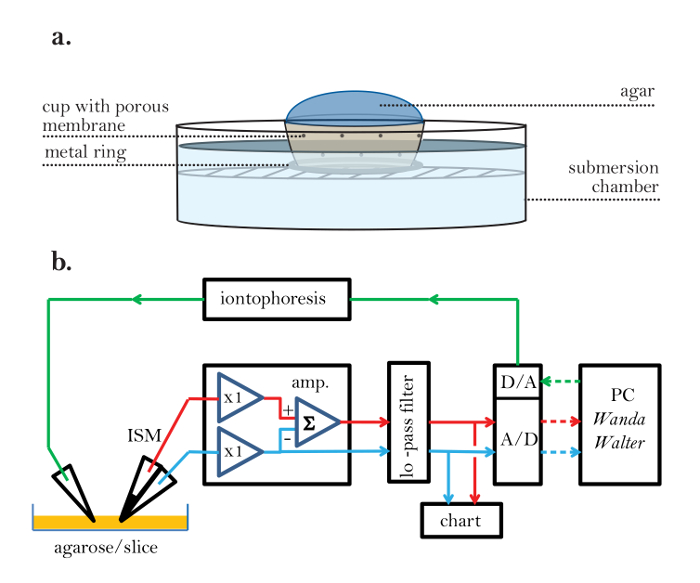
Figura 2: Coppa sperimentale porosa e configurazione elettronica. (A) tazza sperimentale poroso: Una maglia porosa viene usato per creare una coppa sperimentale che consente la continuità elettrica tra l'agarosio (interno) e il fluido balneazione sperimentale (esterno). Un anello di metallo è attaccato al fondo della coppa per impedire la tazza di galleggiare nella soluzione di bagnatura. ( B ) Schema a blocchi della configurazione RTI (passaggi 2.1 e 2.2): Un ISM è collegato ad un amplificatore (amp.). L'ISM ha due barili. Uno contiene lo scambiatore di ioni liquido (LIX) nella punta e genera una tensione proporzionale al logaritmo della concentrazione TMA alla punta insieme alla tensione ambientale locale; esimoIl percorso del segnale è rappresentato da una linea rossa. L'altro barile dell'ISM è conosciuto come barile di riferimento e misura la tensione ambientale alla punta dell'ISM; È collegato da un percorso segnale blu. L'amplificatore ha due cosiddetti stadi di testa collegati all'ISM; Queste unità hanno un guadagno di 1 (x1) e corrispondono l'alta impedenza del microelettrodo alla bassa impedenza del resto della circuiteria dell'amplificatore. La fase di testa collegata alla barriera ionica deve essere in grado di abbinare una resistenza in ingresso di circa 1000 MΩ, mentre la resistenza del cannotto di riferimento è tipicamente di circa 10 MΩ. Dopo aver lasciato la fase di testa, la tensione dal cannotto di riferimento viene invertita e sottratta dalla tensione sul cannotto ioni-selettivo utilizzando un amplificatore di somma (Σ) per ottenere la tensione di segnale ioni puro. Le uscite dell'amplificatore passano ad una unità di condizionamento del segnale che fornisce un'amplificazione aggiuntiva e un filtro a passa-basso multipolare (≤ 10 Hz, tipicamente Bessel fiLter), che rimuove il rumore e impedisce l'aliasing dei segnali al convertitore analogico-digitale (A / D). Le uscite del filtro vengono visualizzate anche su un registratore a nastro. Il convertitore A / D digitalizza i segnali e li invia a un personal computer (PC). Il PC genera inoltre un segnale digitale convertito da un convertitore digitale-analogico (D / A) ad un impulso di tensione analogico alimentato all'unità iontoforesi che converte la tensione ad un impulso di corrente di ampiezza costante e lo invia Al microelettrodo ionoforesi. Il percorso del segnale iontoforesi è rappresentato da una linea verde. L'acquisizione di dati e il segnale di ionoforesi sono sotto il controllo del programma Wanda, che genera un file di output per ogni record di diffusione sotto forma di registrazione tensione e tempo, insieme a tutti i parametri che definiscono l'esperimento. Un secondo programma, Walter, legge il file di output e utilizza i dati di calibrazione ISM per convertire le tensioni digitalizzate in concentrazioni. La concentrazione veLe curve del tempo di rsus vengono poi montate in Walter per la soluzione appropriata all'equazione di diffusione. D e n t vengono estratti se il mezzo è agarosio e λ e α estratto se il mezzo è cervello. I segnali analogici sono linee solide; I segnali digitali sono linee tratteggiate. C'è anche un elettrodo di terra indifferente (non mostrato) nel bagno che contiene la fetta. Linee rosse = segnale di ioni, linee blu = segnale di riferimento, linee verdi = comando iontoforesi, linee solidali = analogiche, linee tratteggiate = digitale. Clicca qui per visualizzare una versione più grande di questa figura.
3. Preparazione e calibrazione di microelettrodi ionici
- Fabbrichi ISM utilizzando il protocollo sottostante un giorno prima dell'esperimento. Fai ISM in batch per assicurare almeno due lavori al giorno dell'esperimento.
NOTA: la maggior parte delle ISM sono stabili per un giorno oDue. La fabbricazione ISM è sensibile all'umidità e alle condizioni atmosferiche. Non tutte le microelettrodi verranno calibrate con successo. - Tagliare circa 0,5 cm di vetro alla fine di uno dei barilotti di un capillare di vetro borosilicato a doppio barre utilizzando un vecchio paio di pinze.
- Chip un singolo barile sull'estremità opposta del capillare ( Figura 3a ). Assicurarsi che il setto non sia danneggiato (critico). Attenzione: indossare occhiali per evitare lesioni a causa del vetro proiettile.
- Mettere il capillare in una bottiglia di acetone per almeno 1 h per rimuovere contaminanti.
- Rimuovere il capillare dall'acetone e pulire pulito, asciutto, compresso l'azoto di gas o aria attraverso di esso per rimuovere qualsiasi eccesso di acetone. Rimuovere tutto l'acetone nel capillare, in quanto l'acetone residuo può interferire con la silanizzazione (cruciale).
- Fabbricare la punta della micropipetta su un tirante verticale o orizzontale. Adattare i parametri per tirare una pipetta con un cono lungo ePunta tagliente, diametro di circa 1 μm o inferiore. Alla fine di questa fase, un capillare sarà fatto in due pipette ( Figura 3a ).
- Visualizzare una singola micropipetta sotto un composto, microscopio verticale con un obiettivo 10x. Tagliare la punta usando uno scivolo a microscopio di vetro in modo che il diametro finale della punta ( ossia entrambi i barili) sia compreso tra 2 e 5 μm ( figura 3b ). Questa pipetta verrà ora chiamata ISM.
- Riempire il barattolo di ISM con la soluzione di riferimento di 150 mM di NaCl attraverso l'apertura sul lato tagliato usando una siringa da 10 ml attaccata ad un filtro da 0,22 μm e un ago da 28 g, 97 mm ( figura 3b ). Non riempire il barile oltre tre quarti l'altezza del barile.
- Riempire il barattolo non tagliato dell'ISM con una soluzione di riempimento di 150 mM TMA-Cl. Toccare l'ISM con delicatezza per bussare tutte le bolle d'aria fuori dalla soluzione. Controllare che le bolle siano sotto il microfonoRoscope utilizzato per la tranciatura della punta.
- Lanciare la parte posteriore dell'ISM usando un bruciatore Bunsen per assicurare che nessuna comunicazione della soluzione di riempimento si verifichi in tutto il setto sul retro dell'ISM. Assicurarsi che il primo quarto dell'ISM sia asciutto dopo la fiamma.
- Inserire un filo argentato clorurato nella soluzione di riferimento dell'ISM e piegare il filo sporgente dal capillare per contrassegnarlo come barilotto di riferimento ( Figura 3c ). Assicurarsi che il filo sia sommerso nella soluzione di riempimento e rimanga in soluzione per tutta la durata dell'esperimento.
- Far scorrere una breve lunghezza di tubo di politetrafluoroetilene (circa 20 cm di lunghezza) sopra la punta di un ago da 25 g di siringa. Posizionare l'altra estremità del tubo nella parte posteriore del barile ione-selettivo. Assicurarsi che il tubo sia nella canna, ma al di sopra della soluzione di riempimento ( figura 3c ).
- Scaldare un bastone di cera dentale con un bruciatore Bunsen e sigillare sia il tubo che il silvFili nelle loro rispettive botti ( Figura 3c ). Assicurarsi che una guarnizione completa dell'aria venga prodotta attorno al tubo di plastica nella barriera ionica (critica).
- Preparare un contenitore di vetro piccolo e trasparente (5 mL o meno) del 4% di clorotrimetilsilano in xilene. Attenzione: Xileni e silani sono molto pericolosi per la salute; Maneggiare entrambe le sostanze chimiche all'interno di un cappuccio e scartare in modo appropriato.
- Posizionare il contenitore davanti a un microscopio di dissezione stereo montato orizzontalmente in una cappa di fumo. Fissare l'ISM verticalmente sopra il contenitore usando un micromanipolatore ( Figura 3d ).
- Immergere la punta del microelettrodo nella soluzione di clorotrimetilsilano.
- Collegare una siringa vuota da 10 ml all'ago da 25 gauge che conduce all'ISM. Applicare pressione d'aria positiva dalla siringa fino a formare una bolla di soluzione TMA-Cl; Questo passaggio dovrebbe essere eseguito sotto visualizzazione diretta attraverso il microscopio.
- Toccare il contenitore ISM delicatamente per togliere la bolla dalla punta.
- Disegnare la soluzione di clorotrimetilsilano ad un'altezza di circa 1.500 μm nella punta dell'ISM utilizzando pressione negativa sulla siringa da 10 ml.
- Espellere completamente la soluzione di clorotrimetilsilano dalla punta dell'ISM finché non si crea una bolla di soluzione TMA-Cl alla punta ( Figura 3d ).
- Ripetere i passaggi 3.19 e 3.20 cinque volte. Assicurarsi che una colonna di fluido uniforme e ininterrotta sia attirata ogni volta nella punta. Se non viene prelevata alcuna soluzione nella punta, controllare se il tubo è bloccato, la tenuta dell'aria è incompleta o la punta dell'ISM è bloccata.
- Sciacquare tutta la soluzione di clorotrimetilsilano dalla punta fino a creare una bolla di soluzione TMA-Cl.
- Pur mantenendo una pressione positiva sulla siringa, rimuovere l'ISM dalla soluzione di xilene. Assicurarsi che tutta la soluzione di xilene sia espulsa dalla punta ISM, poiché l'eccesso di xilene rovina l'escColonna appendiabiti creata nei passaggi successivi.
- Posizionare la punta dell'ISM in un piccolo contenitore trasparente (quello in cui è entrato lo scambiatore o una piccola cuvetta) che tiene lo scambiatore di liquidi (LIX) per TMA. Eseguire questo passaggio in visualizzazione diretta utilizzando l'impostazione del microscopio orizzontale.
- Applicare una piccola quantità di pressione negativa per disegnare una minima quantità di LIX nella punta ( cioè, non appena viene visto LIX entrando nella punta, interrompere l'applicazione della pressione negativa).
- Scollegare la siringa da 10 ml dal tubo e lasciare che l'ISM rimanga per 5 minuti. Durante questo periodo, il LIX entrerà nella punta silanizzata fino a raggiungere uno stato di equilibrio.
- Rimuovere l'ISM dal LIX. Estrarre il tubo dalla canna dello scambiatore (rimuovendo la cera minima possibile). Mettere un filo argentato cloridrato nella piccola apertura creata all'estremità posteriore dell'ISM. Sigillare il filo nella riempimento dello scambiatore con cera fuso.
- Consenti l'ISM di sedersiPer almeno 30 min. Collegare ISM completati al bordo interno di un bicchiere utilizzando un adesivo flessibile e temporaneo.
- Calibrare l'ISM registrando la tensione misurata dall'ISM in ogni soluzione di calibrazione fatta nel punto 1.8.
NOTA: la calibrazione può essere eseguita in una stazione di calibrazione (vedere la fase 2.3) o nella configurazione sperimentale. Questa procedura è descritta nel Supplemento B e in Haack et al 10 . - Se la calibrazione ISM ha avuto successo per più ISM, interrompere qui fino al giorno dell'uso previsto. Altrimenti, costruite più ISM.
- Nel giorno dell'esperimento, calibrare nuovamente la microelettrode (vedere la fase 3.29).

Figura 3: Preparazione di un microelettrodo ionico-selettivo. (A) ISM dopo scheggiatura indietro le estremità di un capillare e tirando (punti 3.2-3.6): Un singolo cilindro ad entrambe le estremità oFa capillare di vetro è tagliato. Un ISM viene generato tirando un capillare di vetro a doppio barile per generare due micropipette con punte fini. ( B ) ISM dopo il riempimento di entrambi i barili (punti 3.7-3.9): La punta di un singolo ISM viene tagliata a un diametro di 2-5 μm. Il barile ione-selettivo viene riempito con TMA-Cl e il barile di riferimento viene riempito con NaCl. C ) ISM prima del rivestimento con clorotrimetilsilano (passaggi 3.11-3.13): un filo d'argento cloridrato viene inserito nel barile di riferimento. Il tubo di politetrafluoroetilene (PTFE) è collegato ad un ago da 25 G e inserito nella canna ionica selettiva. Una guarnizione a tenuta d'aria sulla parte superiore di entrambi i barili viene creata usando la cera dentale. ( D ) Rivestimento di una micropipetta con clorotrimetilsilano (passi 3.15-3.26): [Bassa ingrandimento] Un ISM sospeso in clorotrimetilsilano in linea con uno stereomicroscopio montato orizzontalmente. [Ingrandimento elevato] La vista attraverso un stereomicrosc montato orizzontalmenteO di una punta ISM in soluzione di clorotrimetilsilano. Dopo la visualizzazione della punta attraverso un microscopio, una piccola quantità di soluzione TMA-Cl viene espulsa dalla barile ion-selettiva (sufficiente per generare una piccola bolla di soluzione TMA-Cl). Il supporto ISM viene sfruttato per rilasciare una bolla di soluzione TMA-Cl e poi il clorotrimetilsilano viene disegnato nella punta. Questo ciclo viene ripetuto più volte. Dopo che tutto il clorotrimetilsilano viene espulso dall'ISM, l'ISM viene inserito nello scambiatore di liquidi (LIX) per TMA e LIX viene prelevato nella punta del cilindro ione-selettivo. Clicca qui per visualizzare una versione più grande di questa figura.
4. Preparazione dei microelettrodi di ionoforesi
NOTA: I microelettrodi di ionoforesi devono essere fabbricati il giorno dell'esperimento.
- Tirare un capillare di vetro borosilicato a doppio canale su una verticale oa un cerchioEstrattore orizzontale. Adattare i parametri per tirare una pipetta simile alle micropipette tirate nel passaggio 3.6 ( Figura 4a ).
- Posizionare la micropipetta sotto il microscopio composto impiegato nel punto 3.7 e tagliare la punta usando uno scivolo a microscopio di vetro in modo che il diametro risultante sia compreso tra 2 e 5 μm ( Figura 4a ).
- Riempite entrambi i barili con la soluzione di riempimento TMA-Cl da 150 mM utilizzando una siringa da 10 ml attaccata ad un filtro da 0,22 μm e un ago da 28 g, 97 mm ( figura 4a ).
- Toccare con delicatezza la micropipetta per assicurare che non siano presenti bolle d'aria nella soluzione di entrambi i barili.
- Inserire i fili d'argento clorurati in entrambi i barili della micropipetta. Assicurarsi che i cavi siano abbastanza profondi nelle soluzioni di riempimento in modo che restino in contatto con le soluzioni per la durata dell'esperimento.
- Sigillare i cavi nei barili utilizzando cera dentale calda. Bloccare delicatamente il t Fili, tirandoli intorno all'altro (microelettrodo completato mostrato in Figura 4b ).

Figura 4: Preparazione di un microelettrodo di ionoforesi. (A) microelettrodo iontoforesi dopo il riempimento, entrambe le canne (passi 4.1-4.3): Un microelettrodo ionoforesi è tirato da un tubo capillare. La punta del microelettrodo viene tagliata ad un diametro di 2-5 μm. Entrambi i barili del microelectrode iontoforesi sono riempiti con soluzione TMA-Cl. ( B ) Microelettrodi iontoforesi completato (punti 4.5-4.6): Un microelettrodo ionoforesi con due cavi argentati in cloruro inseriti nei barili. I barili del microelettrodo sono sigillati con cera ei fili d'argento sono intrecciati alla parte posteriore del microelettrodo./files/ftp_upload/55755/55755fig4large.jpg "target =" _ blank "> Fare clic qui per visualizzare una versione più grande di questa figura.
5. Preparazione del liquido cerebrospinale artificiale e delle fette del tessuto del cervello del roditore
- Preparare 1 L di liquido cerebrospinale artificiale (ACSF) con una composizione appropriata per l'esperimento e aggiungere ad esso 0,5 mM TMA-Cl.
NOTA: Il TMA-Cl è necessario per stabilire una concentrazione di sfondo di TMA durante l'esperimento. - Preparare le fette del cervello di roditore con uno spessore di 400 μm secondo i protocolli standard 11 , 12 . Utilizzare l'ACSF preparato nel punto 5.1 per la dissezione e la manutenzione delle fette del cervello.
6. Iontoforesi in tempo reale in Agarose
- Accendere il computer che esegue i programmi Walter e Wanda.
NOTA: Questi programmi sono liberamente disponibili su richiesta. Mentre questo software non è essenziale, la programmazione è simileSoftware o eseguire l'analisi a mano sarebbe altrimenti necessario. - Eseguire ACSF attraverso la camera di immersione ad una velocità adeguata ( es. 2 mL / min). Impostare il regolatore di temperatura a una temperatura desiderata e una bolla ACSF con 95% O 2 /5% CO 2 (o un'altra miscela di gas appropriata) per tutta la durata dell'esperimento.
- Montare un elettrodo indifferente (terra) in un apposito supporto e immergere la punta nell'ACSF che attraversa la camera di immersione. Collegare il filo al suolo dell'impostazione di registrazione.
- Riempire la tazza porosa (fatta nel punto 1.7) con l'agarosio del 0,3% preparato in precedenza e collocarlo nella camera di immersione. Assicurarsi che la soluzione non esegua sulla parte superiore della coppa.
- Fissare un ISM calibrato sul supporto pipetta di un micromanipolatore e una microelettrodi ionoforesi al secondo. Impostare i supporti in un angolo appropriato per l'impostazione ( Figura 5a ).
- CollegareI fili di microelettrodi ISM e ionoforesi alle loro rispettive stadio di testa dell'amplificatore di registrazione. In alternativa, collegare direttamente all'amplificatore (a seconda dell'impostazione).
- Assicurarsi che il peso / posizionamento dei fili di collegamento o delle clip non provoca alcun movimento dei microelettrodi, in quanto piccole fluttuazioni di posizionamento possono influenzare i risultati.
- Accendere l'impostazione elettronica (dal punto 2). Avviate Walter e Wanda in casi separati.
- Nella GUI Wanda, fare clic su "Calibrate" ( Figura 6a ). Nella casella Calibration ( Figura 6b ), riempire le tensioni misurate durante la calibrazione ISM (passo 3.29) e fare clic su "Fit Data".
NOTA: Ciò consente di adattarsi alla seguente rappresentazione dell'equazione Nicolsky (alternare in alternativa l'equazione con altri mezzi per ottenere M e K ):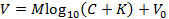
SuaE, V è la tensione misurata (mV), M è la pendenza Nicolsky (mV), C è la concentrazione di ioni (mM), K è l'interferenza (mM) e V 0 è la tensione offset (mV) 3 . - Fare clic su "Accetta" nella casella Calibrate per trasferire automaticamente la pendenza ( M ) e l'interferenza ( K ) generata nel passaggio 6.9 nella GUI principale.
NOTA: qui, K rappresenta l'interferenza di Na, di solito trascurabile. - Sul lato sinistro della GUI, assicurarsi che tutti i parametri sperimentali siano impostati in corrispondenti voci ( Figura 6a ).
- Nella casella Metodo di origine, impostare la sorgente sulla sorgente ionoforica (impostazione predefinita), "Durata registrazione" a "200 s" (impostazione predefinita), "Pulse Begin" a "10 s" (impostazione predefinita) A "60 s" (impostazione predefinita), la "Bias Current" a "20 nA" (impostazione predefinita), il"Corrente principale" a "100 nA" (impostazione predefinita) e "Fattore di conversione" a un valore appropriato.
- Nella casella Elettrodo di misura, impostare "Bath C" alla concentrazione di TMA contenuta nella soluzione bagno (espresso in mM). Impostare i valori "Gain Total", "Channel Output", "Channel ISM" e "Channel Ref." Per i valori appropriati per il sistema di acquisizione dati in uso.
NOTA: Il "fattore di conversione" deve essere impostato su un valore appropriato (specifico per l'unità ionoforica in uso). Questo valore specifica la quantità di corrente passata per una determinata tensione applicata dal convertitore D / A (nA / mV).
- Mettere una sonda di temperatura nella tazza agar. Registrare la temperatura misurata nella voce "Temperatura" nella casella "Elettrodo di misura" della GUI ( Figura 6a ).
- Accendere l'illuminatore del sottofase. Se necessario, accendere la fotocamera collegata al microfonoRoscope e monitor della fotocamera.
- Abbassare i microelettrodi di almeno 1.000 μm nell'agarosio e centrarli nella tazza ( figura 5b ). Esaminarli sotto il microscopio utilizzando un obiettivo 10X (obiettivo di immersione in acqua con una lunga distanza di lavoro).
- Offset la tensione sull'amplificatore a 0 mV per entrambi i canali di riferimento e ISM per stabilire la tensione registrata nell'agarosio come tensione di base.
- Nell'amplificatore a due canali, spostare manualmente il connettore del canale ISM all'uscita di sottrazione di tensione per impostare la sottrazione "on" tra i canali di riferimento e ISM.
NOTA: La sottrazione assicura che le variazioni di tensione nel canale ISM riflettano solo le modifiche della concentrazione TMA. - Spostare l'ISM in modo che tocchi la punta del microelettrodo iontoforesi. Centrare le punte l'una sull'altra in tutti e tre gli assi direzionali.
- Zero le posizioni relative di entrambi i microelettrodi sullaScatole di controllo micromanipulator. Accertarsi che i microelettrodi siano centrati accuratamente e con precisione (critica).
- Spostare l'ISM a 120 μm lontano dal microelettrodo iontoforesi in un asse (l'asse sinistro destro, figura 5b ). Inserisci questa distanza nella casella "Elettrodo di misura" della GUI ( Figura 6a ).
- Avviare una registrazione facendo clic su "Acquisisci" nella GUI ( Figura 6a ); Consentire al programma di registrare una registrazione completa.
NOTA: Il microelettrodo della iontoforesi riceve una corrente costante di bias. Dopo aver fatto clic su "Acquisisci", c'è un breve ritardo prima che la corrente principale venga applicata per una durata limitata. - Ripetere il passaggio 6.20 due o tre volte più volte. Attendere che il segnale TMA torni alla linea di base prima di acquisire nuovi record; Il programma salverà ogni record per l'analisi successiva.
- Controllare la spaziatura dei due microelettrodi spostando l'ISM indietroO la posizione zero specificata dalla casella di controllo. Se i microelettrodi non sono più centrati, centrarli nuovamente utilizzando la stessa strategia di cui al punto 6.17. Registrare eventuali cambiamenti nella posizione degli elettrodi.
NOTA: Se la spaziatura cambia di oltre il 2%, i record acquisiti nel passaggio 6.19 non possono essere considerati precisi e devono essere prese nuove.
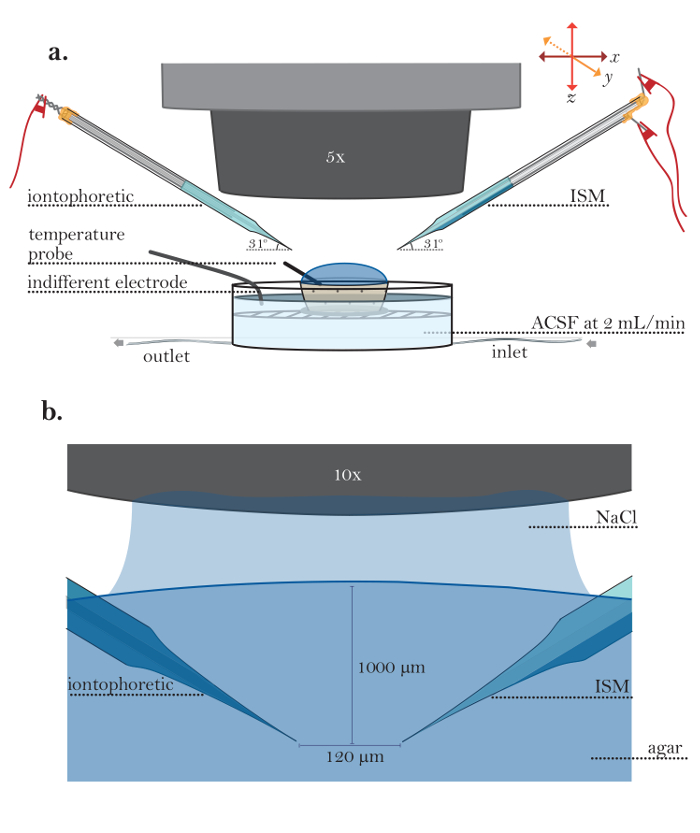
Figura 5: Impostazione per esperimenti in agar. (A) installazione di esperimento in agar diluito (passi 6,1-6,5): Un piccolo contenitore poroso riempito con agar diluito posto in una camera di perfusione esecuzione. Un microelettrodo ionoforesi (lato sinistro) e un ISM (lato destro) sono detenuti da supporti microelettrodi; I supporti microelettrodi sono inseriti nelle braccia dei micromanipulatori robotici. Una sonda di temperatura viene posizionata in gel agar, e un elettrodo di terra indifferente è plNella camera di immersione. ( B ) Visione ingrandita di microelettrodi in agar: Un microelettrodo di ionoforesi (lato sinistro) e un ISM (lato destro) vengono visualizzati in agar utilizzando un obiettivo 10X di immersione in acqua (obiettivo immerso qui in 150 mM NaCl). I microelettrodi sono posizionati utilizzando micromanipulatori ad una profondità di 1000 μm; La distanza tra i microelettrodi è di 120 μm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Wanda Computer Software Interface. (A) Navigazione Wanda interfaccia utente grafica (GUI): La schermata che appare dopo aver aperto il software Wanda. Nella casella (1) vengono selezionati i mezzi appropriati, la molecola iontoforesi e la tecnica. (2) "Calibra" viene cliccato per aprireLa casella di calibrazione Wanda. Dopo la calibrazione dell'ISM (vedi Figura 6b e Supplemento B), l'ISM è posizionato in agar o nel cervello, come descritto nei passaggi 6 e 8 del protocollo. Nella casella (6) vengono immessi tutti i valori appropriati per l'esperimento eseguito. (7) Fare clic su "acquisire" per eseguire una registrazione; Un grafico di tensione rispetto al tempo appare nella parte superiore destra del Wanda GUI. ( B ) Calibrazione di ISM in Wanda : La finestra che si apre dopo aver cliccato su (2) "Calibrare" nella GUI di Wanda. I valori dal punto 3.29 vengono inseriti nella casella (3) e (4) viene selezionato "Fit Data". La curva di calibrazione è confermata come lineare. (5) Si accede a "Accetta" per tornare alla GUI di Wanda. Clicca qui per visualizzare una versione più grande di questa figura.
7. Analisi dei dati Agarose
- Apri ilProgramma Walter sul computer (PC). Nel menu "0. Records From:", fare clic sul pulsante "Wanda / VOLTORO" per leggere i record generati da Wanda ( Figura 7a ). Assumendo che l'output in un foglio di calcolo è necessario, aprire il software appropriato. Fai clic su "Foglio 1,3" nella casella "1. Scrivi Excel?" ( Figura 7b ).
- Nella finestra popup successiva, selezionare i record da leggere e fare clic su "Apri" ( Figura 7b ); Notare che i record saranno automaticamente grafici. Per iniziare la procedura di montaggio, eseguire le seguenti operazioni.
- Nel menu "2. Opzioni", fare clic sul pulsante "select rec". Nella finestra a comparsa " Figura 2 ", utilizzare il mouse per spostare le crosshairs sopra il primo record da elaborare ( Figura 7c ); Premere il pulsante del mouse per scegliere il record.
- Fare clic su oN "curva di misura" nel menu. Selezionare il numero desiderato di iterazioni di montaggio; Utilizzare almeno 20 iterazioni di raccordo per ottenere una corretta adattamento dei dati.
- Nel menu, selezionare "tutto" per adattarsi a tutti i punti dati e selezionare "continua"; Il programma si inserisce nella curva visualizzata. Osservare la procedura di montaggio e confrontare il record sperimentale con la migliore curva montata ottenuta.
- Selezionare l'opzione per scrivere il risultato nel programma di foglio di calcolo appropriato facendo clic su "Excel" nel menu "7. Risultati" ( Figura 7d ). Nota (e registrare) i seguenti dati critici che verranno utilizzati per determinare la funzionalità del microelettrodo ionoforesi: ' D (E5) ', ' Reference D (E5) ', ' r_app ', numero di trasporto ' n t ', ' Apparente N t '.
NOTA: " D (E5) ": misurato il coefficiente di diffusione liberaTx 10 5 (cm 2 / s); " Riferimento D (E5) ": coefficiente di diffusione libera teorica x 10 5 (cm 2 / s). Questo valore viene estratto da un database all'interno di Walter in base allo ione, al mezzo e all'ingresso della temperatura. " R_app ": spaziatura apparente microelettrodi (cm), calcolata in base alla misura e riferimento D (E5) . " N t ": Numero di trasporto (senza dimensione). Questo numero determina la frazione della corrente di ionoforesi utilizzata per rilasciare TMA 4 . " Apparente n t ": numero di trasporto apparente (senza dimensione). Questo è un numero di trasporto calcolato da r_app . Questo numero dovrebbe essere vicino alla misura n t . - Ripetere i passaggi 7.1-7.3 per ciascuno dei record per una coppia scelta di microelettrodi.
- Determinare se il microelettrodo iontophoresis è usabile facendo quanto segue.
- Confronta " r_app" con il reale r ( cioè 120 μm); Questo criterio è soddisfatto se i valori medi di tutte le prove sono entro il 4% dell'altro.
- Confronta " D (E5)" con il riferimento D (E5) ; Questo criterio è soddisfatto se i valori medi di tutte le prove sono entro l'8% dell'altro.
- Confronta la " n t " tra le prove con lo stesso microelettrodo; Questo criterio è soddisfatto se i valori medi di tutte le prove sono entro il 10% dell'altro.
- Se uno dei criteri di cui al punto 7.5 non è stato soddisfatto, risolvere il problema del microelectrode iontoforesi o avviare un altro test.
- Se il microelettrodo iontoforesi è considerato idoneo per l'esperimento, registrare il numero di trasporto medio da tutti i test nel campo "Trasporto Num. N" nella GUI di Wanda ( Figura 6a ).
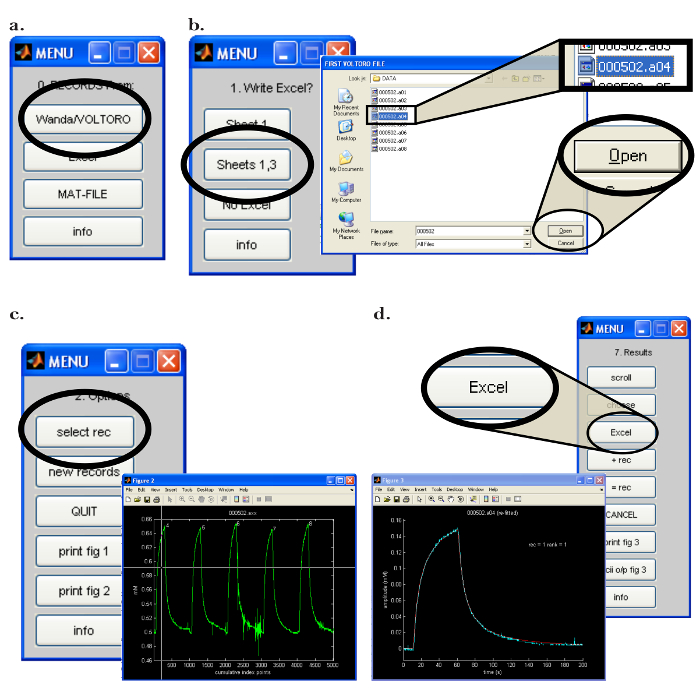
Figura 7: Walter Computer Software Interface. (A) La scelta del programma di raccolta dei dati in Walter: Il "0. Records a partire da:" menu apre dopo l'avvio del software di Walter. L'opzione per caricare i record salvati da Wanda è selezionata facendo clic sul pulsante "Wanda / Voltoro". ( B ) Scelta della posizione di output dell'analisi dei dati e dei dati in Walter: [Sinistra] Dopo aver aperto il programma di foglio di calcolo appropriato, viene scelto "Fogli 1,3" per emettere l'analisi dei dati Walter nel programma di foglio di calcolo precedentemente aperto. [Destra] Dopo aver scelto la posizione di output dell'analisi dei dati, viene aperta una finestra popup che consente all'utente di scegliere le prime e ultime registrazioni da leggere da Walter. ( C ) Scelta della registrazione da analizzare in Walter: [Destra] Dopo aver scelto i file da leggere, viene aperta una finestra popup con tutti i record sceltiGiocato come un grafico (" Figura 2 "). [Sinistra] Nel menù "2.Options" si fa clic su "select rec" e il mouse viene utilizzato per spostare le crosshairs per identificare la prima registrazione per l'analisi; Premere il pulsante del mouse per scegliere la registrazione. ( D ) Esportare l'analisi dei dati da Walter a un foglio di calcolo: Dopo aver montato i dati, viene visualizzata una finestra pop-up e il menu "7. Risultati". [Sinistra] Grafico della registrazione selezionata (blu) con la curva di diffusione montata generata da Walter (rosso). [Destra] Il menu "7. Risultati" consente all'utente di scrivere i dati dall'analisi in un programma di fogli di calcolo facendo clic sul pulsante "Excel". Clicca qui per visualizzare una versione più grande di questa figura.
8. Iontoforesi in tempo reale in fette del cervello
- Mettere un cervello di 400 μmI pidocchi nella camera di registrazione, assicurandosi che sia completamente immersa nell'acqua corrente ACSF. Posizionare la fetta utilizzando un pennello acquerello e fissarlo delicatamente con una griglia.
- Spostare sia il microelettrodo iontoforesi che l'ISM sopra il campo di interesse sulla fetta del cervello. Immergere entrambi nell'alimentazione ACSF, ma sopra la fetta.
- Offset la tensione sia per i canali di riferimento che per i sensori ioni a "0" mV. Attendere che la tensione sia stabilizzata in entrambi i canali. Sul registratore del grafico, contrassegnare la tensione misurata sul canale di rilevazione di ioni dell'ISM. Utilizzare questo per calcolare il parametro V di base in Wanda.
- Posizionare l'ISM e la microtelefono iontoforesi 200 μm in profondità nella fetta e 120 μm lontano l'uno dall'altro. Attendere la stabilizzazione del segnale dopo aver spostato il microelettrodo nella fetta del cervello.
NOTA: La corrente di polarizzazione applicata al microelectrode iontoforesi causa un piccolo accumulo di TMA. È un errore comune prendere arTrascurando troppo presto e sottovalutare l'accumulo del segnale. - Sul registratore del grafico, contrassegnare la tensione stabilizzata misurata nella fetta del cervello sul canale di rilevazione ionica dell'ISM. Calcolare la differenza di tensione tra il segnale TMA misurato nel passaggio 8.3 e il punto 8.4 e immettere questo valore nel campo "Baseline V (mV)" nella casella Elettrodo di misura della GUI Wanda ( Figura 6a ).
- Sul lato sinistro della GUI, accertarsi che tutti i parametri sperimentali siano correttamente registrati / inseriti. Impostare "Medio" a "Cervello", "Numero di trasporto" al valore medio calcolato per la microelettrodi ionoforesi nel punto 7.4 e "Temperatura" alla temperatura del bagno che contiene la fetta.
NOTA: V deve essere registrato per ogni serie di misurazioni. La linea di base V sarà convertita da Wanda nel parametro di base C (mM) ( cioè la concentrazione di TMA nel tessuto cerebrale). - Avviare la registrazione facendo clic su "Acquisisci" e lasciatela prendere una registrazione completa. Attendere che il segnale TMA torni alla linea di base prima di acquisire una nuova registrazione.
- Prendete due o tre registrazioni successive prima di rimuovere i microelettrodi dalla posizione del cervello scelto. Immettere la temperatura misurata nel software Wanda immediatamente prima di ogni registrazione.
- Spostare entrambi i microelettrodi diagonalmente alla superficie della fetta. Sollevare entrambi a almeno 50 μm sopra la fetta. Utilizzando il registratore del grafico, determinare qualsiasi modifica tra il valore V misurato e la sua misurazione dal punto 8.3.
- Centrare le punte dell'ISM e dei microelettrodi ionoforici relativi all'altro negli assi x, y e z. Ottieni eventuali variazioni di spaziatura dalla visualizzazione della scatola di controllo del micromanipulatore.
9. Analisi dei dati del cervello
- Apri un nuovo foglio di calcolo per l'output di analisi.
- Ripetere i passaggi 7.1-7.4 in Walter per analizzareLe registrazioni prese dal cervello.
- Scrivere i dati sul programma di fogli elettronici facendo clic su "Excel" nel menu Walter. Registrare la frazione α , volume del cervello ECS; Λ , tortuosità del cervello ECS; E k (s -1 ), spazio non specifico.
10. Controllo del numero di trasporto e della taratura ISM
- Misurare il numero di trasporto ISM (n t) alla fine dell'esperimento utilizzando il protocollo di seguito. In alternativa, controllare n t dopo prove critiche o quando le misurazioni appaiono anomale. Tuttavia, controllando n t troppe volte possono provocare traumi al fetta cervello.
- Prendi nuove registrazioni in agarosio. Vedere i passaggi 6.4, 6.11, 6.12, 6.14, 6.15 e 6.17-6.22.
- Ripetere i passaggi 7.1-7.4 in Walter per ottenere il n t dalle nuove registrazioni di agarosio. Ispezionare il foglio di calcolo: se il n t è cambiato di piùal 10% dalla t n ottenuto prima delle misurazioni del cervello, i dati ottenuti con questa microelettrodo Iontoforetico non sono affidabili.
- Eseguire una nuova calibrazione (vedere la fase 3.29) per l'ISM dopo che tutti i dati del cervello sono stati raccolti. Utilizzare i dati di calibrazione ISM appena acquisiti come input nella casella Wanda Calibrate (vedere passaggi 6.9 e 6.10) e verificare che il valore di pendenza differisca di meno del 10% rispetto alla calibrazione precedente.
NOTA: I dati ottenuti con questo ISM non sono affidabili se il valore della pendenza differisce di oltre il 10% dalla calibrazione precedente.
Risultati
L'utilità della tecnica RTI è dimostrata in un esperimento progettato per misurare i cambiamenti in α e durante una sfida ipoosmolare ( Figura 8 e Figura 9 ). È stato precedentemente dimostrato che ridurre l'osmolarità del ECS mediante lavaggio su ACSF ipotonico produrrà una diminuzione di α e un aumento di λ 13 .
In questo esperimento, RTI è stato eseguito su fette del cervello ratto in entrambe le condizioni di controllo e durante il lavaggio dell'ACSF ipotonica. Un ISM è stato fabbricato ed i suoi parametri di calibrazione sono stati inseriti in Wanda per l'adattamento all'equazione Nicolsky, che ha calcolato un pendio ( M ) di 58,21 mV. I microelettrodi ISM e ionoforesi sono stati posizionati in agar e posizionati 120 μm l'uno dall'altro per misurare il trasporto number. Sono state prese tre registrazioni e le curve sono state montate e analizzate secondo la procedura del punto 6 del protocollo ( figura 8a ). La curva montata di ogni prova si sovrappone alla curva grezzo ( Figura 8a ). Il coefficiente di diffusione misurata (D x 1E5), il numero di trasporto (n t), e la differenza tra la distanza apparente dei microelettrodi (r_app) e la loro distanza effettiva (r) non differiva significativamente tra i tre registrazioni (figura 8b, Registrazioni a1-3). Sulla base di questi criteri, questo microelettrodo iontoforesi è stato ritenuto accettabile per continuare con l'esperimento.
Una volta scelto il microelettrodo stabile ionoforesi, sono stati presi in considerazione i valori di controllo per α e λ nella fetta del cervello del ratto per stabilire una linea di base per questi parametri. PreGli studi hanno individuato che i valori di controllo per la neocortex del ratto sono α = 0,18-0,22 e λ = 1,54-1,65 1 . Per replicare questi valori in questo esperimento, l'ISM e la microtrode di ionoforesi sono stati collocati 200 μm di profondità nel neocortex del ratto e 120 μm l'uno dall'altro. T media n, calcolato dai dati in figura 8b, è stato inserito nel programma Wanda per l'utilizzo nei calcoli di α e λ. È stato registrato uno spostamento nella linea di base V dal posizionamento dei due microelettrodi di circa 200 μm nel cervello e il salto di tensione è stato inserito in Wanda per correggere la concentrazione di base del TMA ( cioè la linea di base C ). Sono state prese tre registrazioni e le loro curve sono state montate ( Figura 9a , Figura 9d e Figura 9f ). I vestiti hanno rivelato una mediaΑ = 0,192 e λ = 1,69 ( figura 9e ). La distanza e gli spostamenti nella linea di base V sono stati verificati dopo le registrazioni e i valori corretti sono stati inseriti in Wanda per riesaminare i dati (come descritto nel passaggio 8 del protocollo). I valori ricostruiti non differivano in modo significativo ei valori riportati nella Figura 9d sono stati accettati.
L'osmolarità normale di ACSF è di 300 mOsm. Per testare l'effetto dell'ACSF ipotonico su α e λ nel neocortex somatosensoriale del ratto, ACSF con osmolarità di 150 mOsm è stato fatto riducendo la concentrazione di NaCl. È stato ipotizzato che questo ACSF ipotonico porterebbe a gonfiore delle cellule cerebrali, causando un α inferiore e un potenzialmente superiore λ 13 . La fetta del cervello è stata superfusa con ACSF ipnotico per circa 30 minuti, permettendoloPer equilibrare con il cervello. Durante questo periodo, i microelettrodi rimasero nello stesso posto nel neocortex come erano durante le misurazioni precedenti delle condizioni di controllo. Cinque registrazioni sono state prese in condizioni ipotoniche ( Figura 9b e f ). Questo ha generato una media α = 0,13 e λ = 1,84 ( figura 9e ). Questi valori erano coerenti con l'ipotesi che l'ipoosmolarità diminuisce α e aumenta λ . La spaziatura e le variazioni della linea di base V sono state misurate e tenute in considerazione durante la procedura di analisi e di montaggio.
I parametri di recupero sono stati anche misurati lavando su ACSF regolare (300 mOsm) e prendendo nuove registrazioni nello stesso posto nel neocortex. Poiché gli effetti gonfiori dovrebbero essere reversibili, si prevede che α e λ si riprenderanno ai livelli di controllo. I valori avCancellato su quattro record dopo 30 minuti di lavaggio ACSF regolare sono stati α = 0,37 e λ = 1,61 ( Figura 9c , Figura 9e e Figura 9f ). Ciò ha dimostrato che vi è stato un superamento inaspettato durante il recupero di α in queste condizioni ( Figura 9e e Figura 9f ). Successivamente, i microelettrodi sono stati restituiti all'agar per confermare che il numero di trasporto del microelettrodo iontoforesi è rimasto invariato ( Figura 8c ). L'ISM è stato quindi ricalibrato, e la nuova misura all'equazione Nicolsky ha rivelato la pendenza di essere 58,21 mV.
Questo esperimento è un chiaro esempio di ciò che sembra RTI in condizioni ideali. I seguenti elementi dell'esperimento sono stati la chiave del suo successo. In primo luogo, i dati sperimentali raccolti inL'agarosio e il cervello hanno dimostrato un'adeguata sovrapposizione con le curve teoriche generate da Wanda ( Figura 8a e Figura 9a e Figura 9c ). La somiglianza in pendenza, picco e ritorno a una linea di base simile sono tutti importanti per determinare la forza della partita. Queste porzioni della curva sono frequentemente problematiche quando si registrano in agarosio ed è comune che siano effettuate più registrazioni prima di trovare le condizioni che producono curve ben corrispondenti ( cioè, buone microelettrodi). In secondo luogo, i numeri di trasporto medi prima e dopo l'esperimento erano entro il 10% dell'altro ( Figura 8b e Figura 8c ). Se ciò non fosse avvenuto, i valori registrati nel cervello non potevano essere attendibili. Questo è di gran lunga il problema più comune che si verifica negli esperimenti di RTI. In terzo luogo, le calibrazioni ISM in soluzioni TMA standardizzate prima e dopoL'esperimento abbinato (dati non mostrati). In genere, le calibrazioni di un ISM funzionante sono all'interno del 10%, rendendo questa una fonte non comune di errore di esperimento.

Figura 8: Curva Ideale Adattamento dei dati in Agar prima e dopo la sperimentazione nel cervello. (A) i dati rappresentativi di uno studio in agar: [all'estrema sinistra] Dati rappresentativi di un singolo trial ottenuto in agar dimostrare la curva di concentrazione di TMA. Prima di misurare la diffusione, una corrente di bias costante di +20 nA è stata applicata attraverso il microelectrode di ionoforesi. Al tempo = 10 s, TMA è stato pulsato dal microelectrode di ionoforesi nell'agar applicando una corrente di corrente +60 nA per 50 s. Una curva di diffusione è stata generata misurando [TMA] nel tempo utilizzando un ISM posizionato 120 μm dalla sorgente. [Medio] Una curva montata ottenuta da dati pRocessing a Walter. [Destra] La sovrapposizione dei dati e la curva montata dimostra che il raccordo a curva fatto da Walter accuratamente modella la diffusione in questo processo. ( B ) Tabella delle misure di agar prima della sperimentazione nel cervello: i dati ottenuti da tre prove (a1, graffiti sopra) prima degli esperimenti di stress ipotonico ( Figura 9 ). Tutte le prove sono state condotte con il microelectrode iontoforesi e ISM utilizzati per le prove di stress ipoosmotico. I dati soddisfarono i criteri necessari per procedere all'esperimento nelle fette del cervello. Questi criteri includono un'adeguata sovrapposizione tra i dati e la curva montata (come sopra) e meno del 10% di variazione nel numero di trasporto. Ulteriori criteri sono descritti nel punto 7.6. ( C ) Tabella delle misure dell'agar dopo la sperimentazione nel cervello: dati ottenuti da tre prove effettuate in agar dopo gli esperimenti di stress ipossosmico ( Figura 9 ). Il composto L'ency dimostrato tra le prove a1-3 e a4-6 suggerisce fortemente che i microelettrodi ISM e ionoforesi erano stabili durante le prove cerebrali. Rec = registrazione o prova; R = distanza tra ISM e microelectrode iontoforesi; Cb = concentrazione di base; Ref D x1E5 = coefficiente di diffusione libera teorica x 10 5 (cm 2 s -1 ) basato su uno standard pre-calcolato; N t = numero di trasporto (senza dimensione); D (E5) = coefficiente di diffusione libera misurata x 10 5 (cm 2 s -1 ); R_app = distanza di microelettrodi apparente (cm) in base alla misura e riferimento D (E5); N t apparent = numero di trasporto apparente basato su r_app . Clicca qui per visualizzare una versione più grande di questa figura.

Figura 9: Lo stress ipossosmico diminuisce l'alfa e aumenta l'Lambda
AC. Dati rappresentativi di sperimentazioni nel cervello sotto il controllo ( a ), ( b ) ipoosmotiche e ( c ) condizioni di recupero: linee continue rappresentano dati e curve di montaggio delle linee nere tratteggiate. Le tre condizioni dimostrano diverse curve di diffusione, comprese diverse pendenze, ampiezze e larghezze. D ) tabella dei dati provenienti da controlli: tabella dati di tre prove di controllo (b1, grafico sopra); Α e λ sono simili in tutte le prove e coerenti con i dati pubblicati per il neocortex del ratto. Per tutte le sperimentazioni nel cervello, la media n t delle misure di agar pre- e post-esperimento ( Figura 8b e 8c ) è stata utilizzata per il cervello n t . Il cervello D ref è stato impostato su 1,25 × 10 -5 cm 2 s -1 , basato su un database di coefficienti di diffusione (in Walter) ottenuti nel cervello del topo quando T = 34,5 ° C. Il parametro k ' [s -1 ] rappresenta la piccola quantità di TMA persa dall'ECS durante le misurazioni di diffusione. Anche se k ' è tipicamente molto piccolo, incluso il parametro in curva, migliora l'accuratezza del metodo RTI. Il parametro di perdita k ' rappresenta probabilmente l'assorbimento cellulare o la perdita di TMA all'ACSF. ( E ) Confronto tra i controlli, ipoosmosi e le condizioni di recupero: Medie di tutti i processi nel cervello sotto controllo, ipoosmosi e condizioni di recupero. I dati dimostrano che lo stress ipossosmico diminuisce α e aumenta λ . Durante un periodo di recupero a seguito di condizioni ipoosmotiche, α supera la linea di base (controllo), mentre λTorna alla linea di base. I risultati suggeriscono che i cambiamenti nella ECS durante le sfide ipossosmici sono parzialmente reversibili. Il metodo RTI è l'ideale per studiare questo tipo di effetto acuta reversibile. ( F ) Grafico che dimostra il raggruppamento dei dati: La frazione di volume (asse x) e la tortuosità (asse y) di ciascun processo sono tracciati come singolo punto. Il grafico illustra il raggruppamento dei dati all'interno di ciascun gruppo ( cioè, controllo, ipoosmolo e recupero), suggerendo che RTI ha la sensibilità di rilevare gli effetti riproducibili di una sfida ipossoscopica nel cervello ECS. Rec = registrazione o prova; R = distanza tra ISM e microelectrode iontoforesi; Cb = concentrazione di base; Alfa = frazione di volume; Lambda = tortuosità; K ' = clearance di sonda non specifico. Clicca qui per visualizzare una versione più grande di questa figura.
File aggiuntivi: Fare clic qui per scaricare i file.
Discussione

Figura 10: Dati non ideali che dimostrano problemi tecnici comuni. (A) Schemi di problemi tecnici comuni con microelettrodi ionoforesi: Confronto tra il normale rilascio di TMA da un microelettrodo funzionamento ionoforesi con tre fonti che dimostrano problemi tecnici. [Elevata ingrandimento, a1] La corrente in una sorgente ionoforica ideale viene trasportata ugualmente da rilascio di TMA e assorbimento di cloruro. [Alto ingrandimento, a2] Un microelettrodo iontoforesi con basso n t rilascia meno TMA e occupa più cloruro del normale. [Elevata ingrandimento, a3] Un microelettrodo di ionoforesi che mostra l'elettroosmosi rilascia TMA, cloruro e solvente. [Ingrandimento elevato, a4] Un microelettrodo di ionoforesi che mostra il rilascio crescente nel tempo (ad esempio, "riscaldamento"). ( B ) Grafico di dati non ideali oBatch in agar: i dati non sono adeguatamente modellati dalla curva montata da Walter e pertanto non possono essere interpretati con precisione; La causa esatta della discrepanza non è chiara. ( C ) Tabella dei dati non ideali ottenuti in agar: i risultati normali o attesi in agar vengono visualizzati nella riga superiore (grafico in figura 8a ) per il confronto con i dati non ideali nella seconda riga (grafico della figura 10b ). La scarsa sovrapposizione tra i dati e la curva montata in Figura 10b significa che la curva montata non modella in modo preciso i dati di diffusione; Quindi, i valori calcolati (contrassegnati con *) non possono essere interpretati. Ciò potrebbe essere stato causato da problemi con il microelettrodo iontoforesi ( ad es. Riscaldamento) o l'ISM ( ad esempio, risposta lenta). Risoluzione dei problemi: scambiare i microelettrodi uno alla volta, partendo dal microelectrode iontoforesi. Rec = registrazione o prova; r= Distanza tra ISM e microelectrode iontoforesi; Cb = concentrazione di base; Ref D x1E5 = coefficiente di diffusione libera teorica x 10 5 (cm 2 s -1 ) basato su uno standard pre-calcolato; N t = numero di trasporto (senza dimensione); D (E5) = coefficiente di diffusione libera misurata x 10 5 (cm 2 s -1 ); R_app = distanza di microelettrodi apparente (cm) in base alla misura e riferimento D (E5); N t apparent = numero di trasporto apparente basato su r_app . Clicca qui per visualizzare una versione più grande di questa figura.
Mentre l'esperimento mostrato in Figura 8 e Figura 9 ha avuto un microelettrodo e ISM stabile e funzionante iontophoresis, ci sono molti esperimenti in cui uno o dueI microelettrodi sono compromessi e non producono risultati ideali. Un "normale" microtrode di ionoforesi TMA ha un valore di n t  0.3. La Figura 10a mostra tre problemi comuni con il microelettrodo ionoforesi che può essere incontrato durante gli esperimenti di RTI.
0.3. La Figura 10a mostra tre problemi comuni con il microelettrodo ionoforesi che può essere incontrato durante gli esperimenti di RTI.
Basso rilascio. Il microelettrodo ionoforesi rilascia pochissimo TMA quando si applica la corrente di corrente o corrente principale, con conseguente n t <0,1. La corrente è ancora passando attraverso la punta, ma la maggior parte è portata dall'anione Cl entrando nella punta e molto poco dal cation TMA lasciando la punta. Se n t è stabile in diverse prove consecutive, questi microelettrodi iontophoresis possono essere utilizzati. Tuttavia, questo non è raccomandato, in quanto non funzionano in modo ottimale, il che significa che potrebbero svilupparsi ulteriori problemi. Ancora più estremaSi verifica quando la punta del microtrodo iontoforetico è bloccata e nessun ione lascia o entra nella punta. In questo caso non verrà prodotta alcuna curva. In tali casi, dopo aver verificato che tutte le connessioni elettriche siano corrette e sicure, il microelettrodo iontophoresis dovrebbe essere scartato.
Alta liberazione (elettrososmosizzazione). Oltre alla TMA, la microtrode di ionoforesi rilascia anche acqua, con conseguente n t > 0,5. Se il n t è stabile su più prove, questi microelettrodi iontophoresis possono essere usati, ma questo non è raccomandato, in quanto ulteriori problemi possono svilupparsi. L'unica soluzione di risoluzione dei problemi da prendere è ridurre la corrente principale. Ciò a volte elimina il rilascio dell'acqua e provoca la diminuzione di n t inferiore a 0,5.
Maggiore rilascio ("riscaldamento"). In questo caso, il rilascio di TMA aumenta nel tempo. Quando il "riscaldamento" è rapido,La curva di diffusione ha una forma simile a quella mostrata nella figura 10b e non può essere montata in modo affidabile. In questo caso la curva di diffusione dimostra un lento aumento della concentrazione TMA durante la fase iniziale della corrente principale e la concentrazione TMA non è plagio. Una condizione inaffidabile crea un D misurato inesatto, che influenza la coerenza del numero di trasporto misurato e dei valori di r_app . Quando il "riscaldamento" è più graduale, non ha un impatto significativo sulla forma delle singole curve di diffusione, ma si manifesta in un n t che aumenta su prove successive. Una condizione di "riscaldamento" può talvolta essere rimossa mediante "pulsare" la microtelefono iontophoresis per un periodo di tempo (circa 30 minuti). Ciò avviene alternando tra una corrente di polarizzazione e un'alta corrente di corrente (+ 200 nA) per alcuni secondi alla volta. Se un microelettrodo di ionoforesi ancora non dà un stablE il numero di trasporto, è meglio semplicemente provare una nuova.
La misurazione precisa del numero di trasporto e della stabilità durante l'intero esperimento sono essenziali per garantire un valore accurato per α . Il mantenimento della distanza tra i microelettrodi è fondamentale per la determinazione di α e λ . Se la spaziatura cambia dopo una misurazione, sia in agarosio che nel cervello, la distanza lineare tra le punte dei microelettrodi può essere inserita nel foglio di calcolo di uscita e reanalizzata da Walter. Se i valori si differenziano troppo, la misura deve essere scartata. La fluttuazione della temperatura può anche essere un fattore che contribuisce all'inadeguatezza, quindi è importante utilizzare una sonda di temperatura accurata e un elemento riscaldante affidabile.
Il microelettrodo ionoforesi è la fonte più frequente di problemi nella tecnica RTI; Fare e utilizzare un ISM stabile è fondamentale per ottenere buoni dati. OIl possibile problema con l'ISM può essere una risposta lenta, che può essere causata da un'elevata impedenza nella punta. Con un ISM a risposta lenta, tutti i microelettrodi di ionoforesi sembrano avere un effetto "di riscaldamento" ( Figura 10b ), ma la curva è semplicemente causata dall'incapacità dell'ISM di rilevare rapidamente le concentrazioni TMA mutevoli. Aumentare la distanza tra i microelettrodi (fino a 150 μm) può consentire più tempo per rispondere all'ISM e migliorare il montaggio della curva. Una risposta lenta può indicare che lo scambiatore di ioni si è ritirato all'interno della punta. Questo può essere visto sotto un microscopio composto e, se presente, significa che la silanizzazione è scarsa e che l'ISM deve essere scartato. Inoltre, le deviazioni nel segnale ISM possono causare inesatta configurazione dei dati. Spetta allo sperimentatore determinare se la deriva influenza i dati oltre la tolleranza.
Limitazioni di RTI
TQui ci sono diverse limitazioni al metodo RTI a causa delle ipotesi sottostanti all'analisi dei dati. Queste ipotesi includono un requisito per l'omogeneità dei tessuti e l'isotropia tissutale sia nella regione cerebrale di interesse che in un volume sferico che circonda questa regione. Nel contesto di RTI, l'omogeneità dei tessuti richiede che i parametri di diffusione siano costanti all'interno della regione di interesse. L'isotropia tissutale significa che un singolo valore di D * si applica a tutti e tre gli assi spaziali. Ogni molecola rilasciata da un microelectrode di origine prende un percorso casuale prima di arrivare alla posizione dell'ISM di registrazione. La tensione sull'ISM, che rappresenta il numero di molecole ( cioè, concentrazione) registrata in una sola volta, comprende molecole che hanno viaggiato in tutti e tre gli assi spaziali, così come alcune molecole che hanno viaggiato oltre l'ISM e sono tornati alla misurazione Punto ( figura 1c ). Durante l'analisi dei dati RTI, il programma Walter generaMedia α e λ , che includono la diffusione di tutte le molecole che viaggiano in tutti gli assi da una sorgente di punti all'ISM. Se il tasso di diffusione è significativamente diverso in uno dei tre assi spaziali (anisotropia) o se il tessuto non è omogeneo, è necessario un ulteriore raccolta di dati e un'analisi dei dati per calcolare α e λ 8 , 14 .
Oltre ai requisiti di tessuto precedenti, il metodo RTI richiede che la distanza tra una sorgente di punti e ISM, di cui si fa riferimento r , sia di circa 80 - 130 μm. Quando r è diminuito inferiore a 50 μm, la risposta ISM potrebbe non essere abbastanza veloce per registrare variazioni dipendenti dalla diffusione nella concentrazione della molecola della sonda. Questo potrebbe essere rimediato in futuro utilizzando ISM concentriche con tempi di risposta più rapidi 10 , 15 . Più grande rLe distanze minimizzano anche le differenze indipendenti dalla regione del cervello nell'ambiente ECS, dimensione della punta ISM e danni ai tessuti cerebrali durante il collocamento ISM. Al contrario, quando r è aumentato oltre i 150 μm, la diffusione di molecole dalla fonte di punto iontoforetica è più suscettibile di influenzare da elementi non isotropici e inhomogeni che circondano la regione del cervello di interesse o il limite del tessuto-perfusione 14 .
Incorporare RTI e tecniche alternative per esplorare ECS
Il metodo RTI appartiene a un più ampio gruppo di tecniche che utilizzano una sonda molecolare per studiare l'ECS; Ogni metodo ha i propri vantaggi e le sue carenze. Mentre RTI consente un calcolo accurato di α e λ in tempo reale, il metodo richiede una sonda molecolare carica che può essere rilevata da uno scambiatore di ioni. Negli esperimenti in cui l'iontoforesi non è adatta, come lo studio di una sonda non carica,L'ontoforesi può essere sostituito da espulsione di pressione. Purtroppo, le tecniche attuali non consentono il calcolo di α con l'espulsione di pressione, perché il volume rilasciato dipende dalle proprietà del mezzo iniettato 16 . Per utilizzare una sonda per cui non esiste uno scambiatore, la sonda può essere marcata in fluorescenza e la sua diffusione tramite ECS misurata mediante microscopia epifluorescente. Questa tecnica, nota come imaging ottico integrativo (IOI), è limitata dalla dimensione e dalla disponibilità di molecole fluorescenti e dal potenziale di assorbimento cellulare 17 , 18 . La tecnica IOI ha il vantaggio che le macromolecole possono essere usate come sonde, e questo ha rivelato che aumenta λ con dimensione molecolare. Infine, una classe importante dei metodi di diffusione ha impiegato radiotracci, ma non sono più in uso comune 2 .
Future Applicazioni di RTI
Il metodo RTI può essere difficile da implementare e richiede persistenza, ma è un potente strumento per quantificare le modifiche che si verificano nei parametri che descrivono il cervello ECS. Questo protocollo descrive il metodo RTI applicato alle fette, ma è anche possibile implementare in modo affidabile questa tecnica in vivo , ampliando il suo potenziale 1 , 4 , 6 . Può anche essere usato per testare gli effetti di una grande varietà di cambiamenti nella fisiologia del cervello, come quelli indotti da alterazioni all'ambiente chimico, alla farmacologia, al trauma o al knockout genetico 1 . Fintanto che il cambiamento indotto nell'ECS dura per un periodo di circa 2 min o più, RTI può fornire una quantificazione precisa della frazione di volume ECS e della tortuosità.
Mentre negli ultimi cinquant'anni sono stati generati significativi approfondimenti sulla struttura e sulla funzione del ECS cerebraleRimangono molte domande senza risposta. Ad esempio, non è ancora chiaro se e come i meccanismi omeostatici regolino α e come i cambiamenti in α influenzino la funzione del cervello. I modelli di computer hanno contribuito a stimare i relativi contributi della geometria delle cellule e di altri fattori che influenzano λ , ma è necessario un maggiore lavoro 1 . Infine, il ruolo della ECS nella patogenesi della malattia neurologica (e viceversa) è in gran parte inesplorato. Nel prossimo futuro, le misure di RAG potrebbero migliorare la distribuzione mirata di farmaci a regioni cerebrali specifiche 19 .
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Il lavoro è stato sostenuto da NIH NINDS concedere R01 NS047557.
Materiali
| Name | Company | Catalog Number | Comments |
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate - do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5mm x 16mm) |
| objective 5x dry | Olympus | MPlan N | |
| objective 10x water immersion | Olympus | UMPlan FL N | 10x objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
Riferimenti
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C., Michael, A. C., Borland, L. M. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. , 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes, ., Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon