Method Article
בזמן אמת Iontophoresis עם Tetramethylammonium כדי לכמת את נפח השבר ואת הצרות של המוח תאיים שטח
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר בזמן אמת iontophoresis, שיטה המודדת פרמטרים פיזיים של המרחב החוץ תאי (ECS) של המוח. דיפוזיה של מולקולה אינרטי משוחרר לתוך ECS משמש לחישוב השבירה נפח ECS ו צרות. זה אידיאלי עבור חקר שינויים הפיך אקוטי למוח ECS.
Abstract
סקירה זו מתארת את המושגים הבסיסיים ואת הפרוטוקול כדי לבצע בזמן אמת את יונתופורסיס (RTI) שיטה, תקן הזהב לחקור לכמת את החלל החיצוני (ECS) של המוח חי. ה- ECS מקיף את כל תאי המוח ומכיל גם נוזל אינטרסטיציאלי וגם מטריקס תאיים. הובלה של חומרים רבים הדרושים לפעילות המוח, כולל נוירוטרנסמיטורים, הורמונים, וחומרים מזינים, מתרחשת על ידי דיפוזיה באמצעות ECS. שינויים בנפח ובגיאומטריה של חלל זה מתרחשים במהלך תהליכי מוח נורמליים, כמו שינה ומצבים פתולוגיים, כמו איסכמיה. עם זאת, המבנה והרגולציה של ECS במוח, בייחוד במדינות חולות, עדיין לא נחקרו. שיטת ה- RTI מודדת שני פרמטרים פיזיים של המוח החיה: שברי נפח וצפי. נפח חלק הוא היחס של נפח רקמות שנכבשו על ידי ECS. הצב הוא מדד של הפרעה יחסית חומר נתקל בעת התפוצצות דרך המוח מוחGion לעומת בינוני ללא חסימות. ב RTI, מולקולה אינרטי הוא פעמו מן microelectrode מקור לתוך ECS המוח. כמו מולקולות מפוזרים מן המקור הזה, הריכוז המשתנה של יון נמדדת לאורך זמן באמצעות microelectrode סלקטיבי יון מיקומו בערך 100 מיקרומטר משם. מן עקומת דיפוזיה וכתוצאה מכך, הן נפח השבירה ואת הצרות ניתן לחשב. טכניקה זו כבר בשימוש פרוסות המוח ממספר מינים (כולל בני אדם) ו in vivo ללמוד שינויים חריפים כרוניים ECS. שלא כמו שיטות אחרות, RTI ניתן להשתמש כדי לבחון הן הפיך שינויים בלתי הפיך על ECS המוח בזמן אמת.
Introduction
החלל תאיים (ECS) היא רשת של ערוצי מחוברים החיצוני לכל תאי המוח ומכיל הן נוזל interstitial ו מטריקס תאיים ( איור 1 א ואיור 1b ). התפלגות של חומרים רבים הנדרשים לתפקוד תאי המוח, כולל חומרים מזינים, הורמונים, נוירוטרנסמיטורים, מתרחשת על ידי דיפוזיה באמצעות ECS. שינויים בפרמטרים הפיזיים של החלל הזה, כולל נפח, גיאומטריה, מטריקס תאיים, יכול להשפיע באופן דרסטי על דיפוזיה באמצעות ECS ו ריכוזי יונים מקומיים רחצה תאי המוח, אשר יש השפעה עמוקה על תפקוד המוח במוח 1 , 2 .
בזמן אמת iontophoresis (RTI) משמש כדי לקבוע שני מאפיינים מבניים של אזור המוח: נפח נפח ו צרות 3 , 4 ,"Xref"> 5. נפח חלק ( α ) הוא היחס של נפח רקמות שנכבשו על ידי ECS ( V ECS ) ביחס נפח הרקמה הכולל ( רקמת V ) בנפח יסוד מייצג;

Tortuosity ( λ ) היא הפרעה היחסית שחומר נתקל כאשר מתפשט דרך אזור במוח לעומת בינוני ללא חסימות;
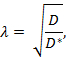
שם * D (ס"מ 2 s -1) הוא מקדם הדיפוזיה יעילה של חומר במוח ו- D (ס"מ 2 s -1) הוא מקדם הדיפוזיה חופשי של חומר במדיום חופשי, כגון לדלל agarose ג'ל.
כיום, חומר בדיקה הנפוץ ביותר עבור Rשיטת TI היא tetramethylammonium קטיון קטן (TMA). TMA יש משקל מולקולרי של 74 גרם / מול, לחלוטין disociates בפתרון, ויש לו חיוב אחד חיובי. מחקרים RTI עם יון זה הוכיחו כי α  0.2 ו λ
0.2 ו λ  1.6 1 , 2 . משמעות הדבר היא כי ECS הוא בערך 20% מכלל נפח המוח, וכי דיפוזיה של מולקולה קטנה אינרטית מתרחשת בערך פי 2.5 לאט יותר ב- ECS מאשר במדיום ללא חסימות 3 . עם זאת, הן α ו λ להשתנות עם גיל המוח, האזור, המדינה ובתנאים פתולוגיים 1 . שינויים של הפרמטרים הללו נקשרו להתפתחות המוח, הזדקנות, שינה, אפילפסיה, ותהליכים בסיסיים רבים אחרים ומחלות של המוח 1, 6 . בעוד טכניקות אחרות למדוד α ו λ , RTI יכול למדוד הן באזורים מקומיים של רקמה חיה בזמן אמת. מסיבה זו, RTI הפך לכלי הכרחי לבדיקת שינויים ב- α ו- λ במהלך אתגרים חריפים ובלתי הפיכים.
1.6 1 , 2 . משמעות הדבר היא כי ECS הוא בערך 20% מכלל נפח המוח, וכי דיפוזיה של מולקולה קטנה אינרטית מתרחשת בערך פי 2.5 לאט יותר ב- ECS מאשר במדיום ללא חסימות 3 . עם זאת, הן α ו λ להשתנות עם גיל המוח, האזור, המדינה ובתנאים פתולוגיים 1 . שינויים של הפרמטרים הללו נקשרו להתפתחות המוח, הזדקנות, שינה, אפילפסיה, ותהליכים בסיסיים רבים אחרים ומחלות של המוח 1, 6 . בעוד טכניקות אחרות למדוד α ו λ , RTI יכול למדוד הן באזורים מקומיים של רקמה חיה בזמן אמת. מסיבה זו, RTI הפך לכלי הכרחי לבדיקת שינויים ב- α ו- λ במהלך אתגרים חריפים ובלתי הפיכים.
התיאוריה תומכת RTI אושרה במקור על ידי ניקולסון ו פיליפס, ואת הטכניקה שימשה בהרחבה מאז אותו 4 , 7 . ניסויים המעסיקים RTI להתחיל עם שחרורו של הדופק של TMA מן microelectrode מקור על ידי יונתורזה לתוך ג'ל agarose לדלל. לאחר נפלט, היונים בחופשיות להתפזר מן המקור נקודה, בחירה מתוך מספר אינסופי של נתיבים אקראיים ( איור 1 ד ). הריכוז המשתנה של יון נמדדת לאורך זמן באמצעות microelectrode יון סלקטיבית (ISM) מיקומו בגסות100 מיקרומטר משם ( איור 1 ג ). השינויים בריכוז TMA הם graphed ו מצויד עקומה המאפשר חישוב של D והן את מספר התחבורה של microelectrode יון (פרמטרים הנדונים בפרוטוקול). עם ערכים אלה, הנוהל חוזר על עצמו באזור במוח של עניין כדי לקבל D * ולחשב הן α ו λ . שליטה של microelectrode יון, איסוף נתונים, גרפים והתאמה של עקומת ריכוז TMA, וחישוב הפרמטרים הניסוייים נעשים בדרך כלל על ידי תוכניות וונדה וולטר, אשר תוכננו במיוחד למטרה זו (התוכנה המדריכים שלהם הם זמין באופן חופשי על ידי המחברים על פי בקשה).
סעיף הפרוטוקול של סקירה זו מתאר את ההליכים הבסיסיים הדרושים לתכנון וביצוע RTI בפרוסות מוח מכרסמים. הטכניקה יש גם נעשה שימוש ב-מוט לאמודלים אף אוזן גרון, כולל פרוסות מוח אנושיות ועל הכנות מוח vivo 1, 4, 6, 8, 9. החלק נציג תוצאות מספק הן אידיאליים ולא אידיאלי תוצאות להדגיש ניואנסים בפרשנות נתונים. לבסוף, סעיף הדיון מכסה בקצרה טכניקות לפתרון בעיות, מגבלות RTI, טכניקות חלופיות המשמשות ללימוד ECS, ויישומים עתידיים של RTI.
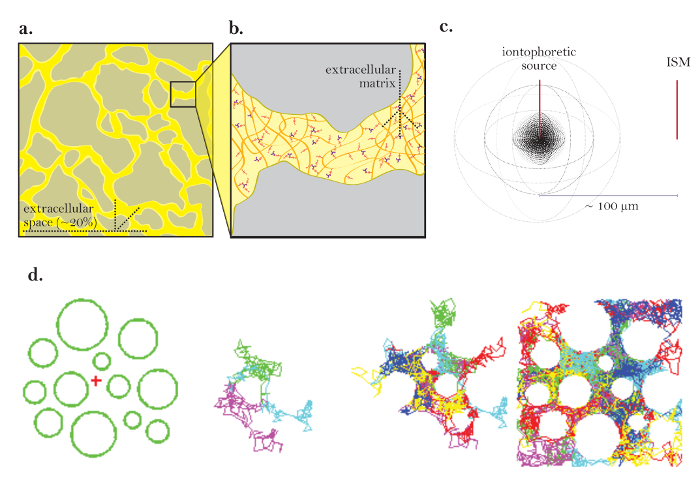
איור 1: דיאגרמות של דיפוזיה באמצעות ECS. ( א ) תרשים של ECS: מדגים את הגודל והמיקום של ECS בחלק מוחי טיפוסי. צהוב מסמן את ECS בין תהליכי תא המוח האפור. נפח ECS הוא בערך 20% מכלל נפח הרקמה ( כלומר, נפח השבר = 0.2) בתנאים פיזיולוגיים. ( ב ) תרשים מוגדל של ECS: מדגיש פרמטרים פיזיים התורמים טרטו, כולל גיאומטריה התא במוח (אפור) ו מטריקס תאיים (תרשים כמו רשת של glycosaminoglycans רבגוניים ו proteoglycans). ( ג ) תרשים 3D של דיפוזיה ממקור נקודה: מדגים את התנועה נטו של מולקולות אינרטי ממקור iontophoretic ל- ISM. לא כולל מחסומי דיפוזיה ספיגת הסלולר, מולקולות מפוזרות החוצה לכל הכיוונים, לייצר חזית ריכוז כדורית. ה- ISM מכמת את הריכוז המקומי של המולקולות האינרטיות המשתחררות מהמקור האונטופורטי. ( ד ) הדמיית מחשב של דיפוזיה ב ECS של המוח: [רחוק משמאל] ההתקנה עבור סימולציה מונטה קרלו; כדורים ירוקים מייצגים תהליכים בתאי המוח והצלב האדום מייצג מקור נקודה. הגדרה זו מודלים של רקמות המוח תרשים diagrammed באיור 1a . תמונה 36 מולקולות ביצוע תנועות אקראיות כפי שהם מפוזרים דרך החלל החוץ תאי של המוח, שמוצג 2 ממדים. [ימין קיצוני] מסלולים אקראיים של מולקולות רבות שוחררו ממקור הנקודה. התנועה נטו של כל המולקולות ממקור הנקודה היא כלפי חוץ כפי שמתואר באיור 1 ג . המסלולים האקראיים המצטברים מתארים את החללים שבין התאים ( כלומר, ECS, ראו התייחסות 5 להסבר נוסף). אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Protocol
כל ההליכים בבעלי חיים, המשמשים כדי לקבל דגימות רקמות, אושרו על ידי ועדת האתיקה של בעלי חיים במרכז הרפואי סוני דאונסטאט.
1. הכנת פתרונות וציוד
- הכן פתרון מילוי 150 מ"ל NaCl עבור חבית ייחוס של ISM. אחסן אותו מזרק 10 מ"ל מחובר מסנן 0.22 מיקרומטר (כדי להסיר חיידקים או חלקיקים).
- הכן 150 מ"מ TMA כלורי (TMA-Cl) מילוי פתרון עבור microelectrodes. אחסן אותו מזרק 10 מ"ל מחובר מסנן 0.22 מיקרומטר. הכן את פתרונות ה- TMA-Cl (בפרוטוקול זה) מתוך פתרון 5 מ 'מלאי המניות כדי להבטיח את הריכוז הנכון.
- Chloridize לפחות ארבעה חוטי כסף עבור ייצור של microelectrodes על ידי השקעת חוטים אקונומיקה (hypochlorite נתרן) לפחות 2 שעות. הסר עודף אקונומיקה עם אתנול ולאפשר החוטים להתייבש.
- הכן 50 מ"ל של agarose 0.3% ב 150 מ"מ NaCl ו 0.5 מ"מ TMA-CL בכוסואת לכסות אותו. השתמש agarose כי הוא אבקה טרי למדי כדי להבטיח מדידות דיפוזיה טובה.
- מחממים ומערבבים את הפתרון agarose עם סערה לערבב לפזר אותו. אפשר פתרון להתקרר לטמפרטורת החדר. חנות זו ב 4 מעלות צלזיוס למשך עד 1 שבוע.
- הכן אלקטרודה (קרקע) אדיש עשוי 4% agarose ב M 1 KCl (כיוונים מוסף A)
- לפברק כוס קטנה, נקבובי שיכול להתאים חדר ניסיוני וזה מאפשר המשכיות חשמל בין התוכן שלה ואת הסביבה החיצונית ( איור 2 א ). מניחים טבעת מתכת על החלק התחתון של כוס זו כדי למנוע ממנה לצוף כאשר שקוע חלקית במים.
- השתמש דילול סדרתי של 5 M M-TMA-CL לעשות חמש 100 מ"ל TMA-CL פתרונות לכיול של ה- ISMs. פתרונות צריך ריכוז סופי של 0.5, 1, 2, 4, ו 8 מ"מ TMA-CL, כל 150 מ"מ NaCl. אחסנו את פתרונות הכיול בכוס איטום כדי למנוע אידוי/ Li>
2. הגדרה אלקטרונית
- חבר את הרכיבים של ההתקנה הניסויית RTI על פי דיאגרמת בלוק בתרשים 2b ; כולל מגבר עם שני ערוצי קלט (אחד מהם צריך להיות עכבה גבוהה מאוד עבור חבית סלקטיבית יון של ISM), מסנן נמוך לעבור מוגדר 10 הרץ, רשם תרשימים, A / D + D / A ממיר, יחידה יונית (או מגבר המסוגל לספק פולסים קבועים-שוטפים), ומחשב (PC) המפעיל את תוכניות Wanda ו- Walter. בדוק את ההגדרה האלקטרונית כדי לוודא שכל החיבורים נמצאים במקומם.
- להגן על ההתקנה ניסיוני במארז מוארק (כגון כלוב פאראדיי), אם יש צורך, כמו ISMs יש התנגדות גבוהה רגישים חפצים שנוצרו על ידי התנועה הסמוכה.
- צור תחנת כיול ייעודית של ISM המורכבת ממגבר קלט כפול, רשם תרשימים, בעל ISM מתאים ואלקטרודה קרקעית אדישה. אם אפשר,להגן על המתחם. דלג על שלב זה אם ה- ISMs מכוילים בהגדרת הניסוי (שלב 3.29)
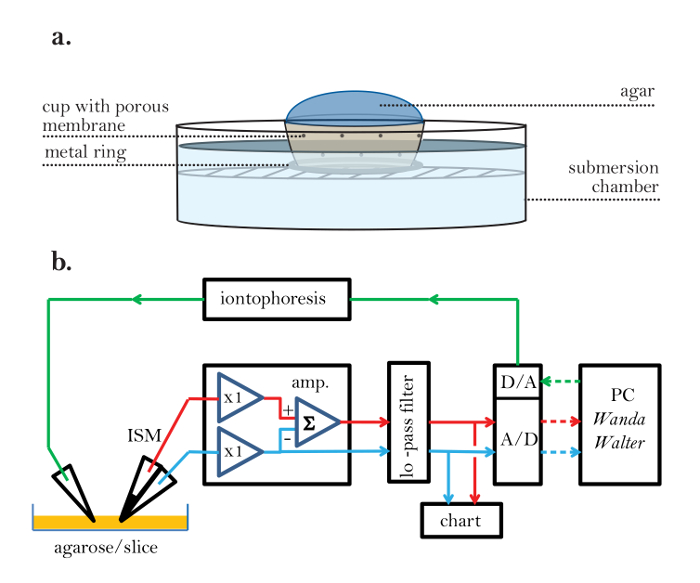
איור 2: נקבובי ניסוי גביע ההתקנה האלקטרונית. ( א ) כוס ניסוי נקבובית: רשת נקבובית משמש ליצירת כוס ניסיוני המאפשר המשכיות חשמל בין agarose (בפנים) לבין נוזל רחצה ניסיוני (בחוץ). טבעת מתכת מחוברת לתחתית הכוס כדי למנוע מהספל לצוף בפתרון הרחצה. ( ב ) דיאגרמת בלוק של הגדרת RTI (צעדים 2.1 ו -2.2): ISM מחובר למגבר (amp). ISM יש שתי חביות. אחד מכיל מחליף יון נוזלי (LIX) בקצה ומייצר מתח ביחס לוגריתם של ריכוז ה- TMA בקצה יחד עם מתח הסביבה המקומי; הנתיב האות e מיוצג על ידי קו אדום. הקנה השני של ה- ISM ידוע כחבית הייחוס ומודד את המתח הסביבתי בקצה ה- ISM; הוא מחובר באמצעות נתיב אות כחול. למגבר יש שני שלבי ראש שנקשרו ל- ISM; יחידות אלה יש רווח של 1 (x1) ו להתאים את עכבה גבוהה של microelectrode כדי עכבה נמוכה של שאר המעגל מגבר. בשלב הראש מחובר לחבית סלקטיבית יון חייב להיות מסוגל להתאים התנגדות נכנסות של כ 1000 MΩ, ואילו ההתנגדות של החבית התייחסות הוא בדרך כלל על 10 MΩ. לאחר שעזב את הבמה הראשית, המתח של חבית ההתייחסות מופנה ומוריד מהמתח על חבית הסלקציה היונית באמצעות מגבר סיכום (Σ) כדי להשיג את מתח האות היון הטהור. התפוקות של המגבר עוברות ליחידת מיזוג אותות המספקת הגברה נוספת ומסנן בעל תעלה נמוכה (multipole low pass pass) (10 Hz; בדרך כלל Bessel FiLter), אשר מסיר רעש ומונע aliasing האות בממיר אנלוגי לדיגיטלי (A / D). יציאות של המסנן מוצגים גם על רשם תרשים רשם. ממיר A / D digitizes את האותות ושולח אותם למחשב אישי (PC). המחשב גם מייצר אות דיגיטלי המומר על ידי ממיר דיגיטלי ל - אנלוגי (D / A) לדופק מתח אנלוגי המוזן ליחידת iontophoresis, הממירה את המתח לדופק הנוכחי של משרעת קבועה ושולחת אותו כדי microelectrode iontophoresis. נתיב האות iontophoresis מיוצג על ידי קו ירוק. רכישת הנתונים ואת האות iontophoresis נמצאים תחת שליטה של תוכנית ונדה, אשר מייצר קובץ פלט עבור כל רשומה דיפוזיה בצורה של מתח לעומת הזמן הקלטה, יחד עם כל הפרמטרים המגדירים את הניסוי. תוכנית שנייה, וולטר, קוראת את קובץ הפלט ומשתמשת בנתוני כיול ISM כדי להמיר את המתח הדיגיטלי לריכוזים. הריכוזעקומות הזמן rsus מותקנים מכן וולטר לפתרון המתאים למשוואת דיפוזיה. D ו- n t מופקים אם המדיום הוא agarose, ו λ ו α חילוץ אם המדיום הוא המוח. אותות אנלוגיים הם קווים מוצקים; אותות דיגיטליים הם קווים מנוקדים. יש גם אלקטרודה הקרקע אדיש (לא מוצג) באמבטיה המכילה את הפרוסה. קווים אדומים = אות יון, קווים כחולים = אות הפניה, קווים ירוקים = פקודת iontophoresis, קווים מוצקים = אנלוגיים, קווים מנוקדים = דיגיטלי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
3. הכנה וכיול של microelectrodes יון סלקטיבית
- צור את רכיבי ה- ISM באמצעות הפרוטוקול שמתחת ליום אחד לפני הניסוי. הפוך את שירותי ה- ISM לקבוצות כדי להבטיח שלפחות שתי עבודות ביום הניסוי.
הערה: רוב רכיבי ה- ISM יציבים למשך יום אושתיים. ייצור ISM רגיש ללחות ותנאים אטמוספריים. לא כל microelectrode יהיה לכייל בהצלחה. - צ 'יפ במרחק של בערך 0.5 ס"מ של זכוכית בסוף אחד חביות של זכוכית כפולה borosilicate זכוכית נימי באמצעות זוג הישן של מלקחיים.
- שבב חבית אחת על הקצה הנגדי של נימי ( איור 3 א ). ודא מחצה לא פגום (קריטי). זהירות: ללבוש משקפי מגן כדי למנוע פגיעה עקב זכוכית קליע.
- מניחים את נימי בבקבוק אצטון במשך לפחות 1 שעות כדי להסיר מזהמים.
- הסר את נימי מן אצטון דופק נקי, יבש, גז חנקן דחוס או אוויר דרכו להסיר כל אצטון עודף. הסר את כל אצטון נימי, כמו אצטון שיורית יכול להפריע silanization (חיוני).
- לפברק את קצה micropipette על או משיכה אנכית או אופקי. להתאים את הפרמטרים למשוך פיפטה עם taper ארוךקצה חד, על 1 מיקרומטר או פחות בקוטר. בסוף שלב זה, אחד נימי ייעשה שתי טפטפות ( איור 3 א ).
- דמיינו micropipette אחת תחת מיקרוסקופ, מתחם זקוף עם מטרה 10X. חותכים את קצה באמצעות שקופית מיקרוסקופ זכוכית כך הקוטר הסופי של קצה ( כלומר, שתי חביות) הוא בין 2 ו 5 מיקרומטר ( איור 3 ב ). פיפטה זה ייקרא ISM מעתה ואילך.
- ממלאים את החבית סדוקה של ISM עם פתרון 150 מ"מ NaCl התייחסות דרך הפתח בצד סדוק באמצעות מזרק 10 מ"ל המצורפת מסנן 0.22 מיקרומטר ו 28 G, 97 מחט מ"מ ( איור 3 ב ). אל תמלא את הקנה מעבר לשלושה רבעים גובה החבית.
- מלאו את החבית הלא סדוקה של ISM עם 150 מ"מ TMA-Cl מילוי חוזר. הקש ISM בעדינות לדפוק כל בועות אוויר מתוך הפתרון. בדוק את הבועות מתחת למיקרופוןרוסקופ המשמש לסחוט את קצה.
- להבה האחורי של ISM באמצעות מבער Bunsen כדי להבטיח כי אין תקשורת של פתרון מילוי מתרחשת לאורך מחצה בחלק האחורי של ISM. ודא כי הרבע העליון של ISM יבש לאחר הלהבה.
- הכנס חוט כסף chloridized לתוך הפתרון התייחסות של ISM ו לכופף את חוט בולט מן נימי כדי לסמן את זה כמו חבית התייחסות ( איור 3 ג ). ודא שהחוט שקוע בתמיסה למילוי חוזר ונשאר בתמיסה למשך הניסוי.
- השקופית אורך קצר של צינורות polytetrafluoroethylene (כ 20 ס"מ) מעל קצה של מחט מזרק 25 G. מניחים את הקצה השני של צינורות בחלק האחורי של החבית סלקציה יון. ודא כי הצינור הוא בחבית אבל מעל הפתרון מילוי ( איור 3 ג ).
- מחממים מקל שעווה דנטלית עם מבער בונזן וחותמים הן את צינורות ואת silvחוטי er לתוך החביות בהתאמה ( איור 3 ג ). ודא כי חותם אוויר שלם מיוצר סביב צינורות פלסטיק בחבית יון סלקטיבי (קריטי).
- הכן קטן, שקוף מיכל זכוכית (5 מ"ל או פחות) של 4% chlorotrimethylsilane ב xylene. זהירות: Xylenes ו silanes הם מסוכנים מאוד לבריאות; לטפל בשני כימיקלים בתוך מכסה המנוע קטר להשליך כראוי.
- מקם את המכולה מול מיקרוסקופ דיסקציה סטריאו רכוב אופקית במנדף קטר. Secure את ה- ISM אנכית מעל המיכל באמצעות micromanipulator ( איור 3D ).
- טובלים את קצה microelectrode בפתרון chlorotrimethylsilane.
- צרף מזרק 10 מ"ל ריק למחט 25 מד שהוביל ISM. החל לחץ אוויר חיובי מן המזרק עד בועה של פתרון TMA-Cl נוצר; שלב זה צריך להתבצע תחת להדמיה ישירה באמצעות מיקרוסקופ.
- הקש על בעל ISM בעדינות כדי לדפוק את הבועה של קצה.
- צייר את הפתרון chlorotrimethylsilane לגובה של כ 1500 מיקרומטר לתוך קצה ISM באמצעות לחץ שלילי על מזרק 10 מ"ל.
- לגמרי לגרש את הפתרון chlorotrimethylsilane מקצה ISM עד בועה של פתרון TMA-Cl נוצר בקצה ( איור 3 ).
- חזור על שלבים 3.19 ו 3.20 חמש פעמים. ודא כי גם, טור ללא הפרעה של נוזל נמשך לתוך קצה בכל פעם. אם לא ניתן להסיק פתרון לתוך קצה, לבדוק אם צינורות חסום, חותמת האוויר אינו שלם, או קצה ISM נחסם.
- שטוף את כל הפתרון chlorotrimethylsilane מתוך קצה עד בועה של פתרון TMA-Cl נוצר.
- תוך שמירה על לחץ חיובי על המזרק, להסיר את ISM מן הפתרון קסילן. ודא כי כל פתרון קסילן הוא גורש מן קצה ISM, כמו קסילן עודף יהרוס את ה- excעמודת קול שנוצרה בשלבים הבאים.
- מניחים את קצה ISM במיכל קטן שקוף (או אחד מחליף נכנס או קוביט קטן) מחזיק את מחליף יון נוזלי (LIX) עבור TMA. בצע שלב זה תחת להדמיה ישירה באמצעות ההתקנה מיקרוסקופ אופקית.
- החלת כמות קטנה של לחץ שלילי כדי לצייר כמות מינימלית של LIX לתוך קצה ( כלומר, ברגע LIX נראה הזנת קצה, להפסיק הפעלת לחץ שלילי).
- לנתק את מזרק 10 מ"ל מן צינורות ולאפשר ISM לשבת 5 דקות. במהלך הזמן הזה, LIX ייכנס קצה silanized עד שהוא מגיע למצב של שיווי משקל.
- הסר את ה- ISM מן LIX. משוך את צינורות מתוך חבית מחליף (תוך הסרת שעווה קטנה ככל האפשר). מניחים חוט כסף כלוריד לתוך פתח קטן נוצר בקצה האחורי של ISM. לאטום את החוט במילוי של חבית מחליף עם שעווה נמסה.
- אפשר ל- ISM לשבתלפחות 30 דקות. צרף ISMs הושלמה לשפת הפנימי של כוס באמצעות כל דבק גמיש, זמני.
- כייל את ה- ISM על ידי הקלטת המתח שנמדד על ידי ה- ISM בכל פתרון כיול שבוצע בשלב 1.8.
הערה: כיול יכול להתבצע בתחנת כיול (ראה שלב 2.3) או בהתקנה הניסויית. הליך זה מתואר ב מוסף B ב Haack et al 10 . - אם כיול ה- ISM היה מוצלח עבור מספר רכיבי ISM, השהה כאן עד ליום השימוש המיועד. אם לא, לפברק יותר ISMs.
- ביום הניסוי, שוב לכייל את microelectrode (ראה שלב 3.29).

איור 3: הכנה של microelectrode יון סלקטיבית. ( א ) ISM לאחר סתתים בחזרה את הקצוות של נימי ומושך (צעדים 3.2-3.6): חבית אחת בשני הקצוות oFa זכוכית נימי הוא סדוק. ISM מופק על ידי משיכת אחד זכוכית כפולה barillled נימי לייצר שני micropipettes עם טיפים בסדר. ( ב ) ISM לאחר מילוי שני חביות (שלבים 3.7-3.9): קצה ISM אחד הוא סדוק בקוטר של 2-5 מיקרומטר. חבית סלקטיבית יון הוא מילוי חוזר עם TMA-CL, ואת הקנה התייחסות הוא מילא מחדש עם NaCl. ( ג ) ISM לפני ציפוי עם chlorotrimethylsilane (שלבים 3.11-3.13): חוט כסף chloridized מוכנס לתוך החבית התייחסות. Polytetrafluoroethylene (PTFE) צינורות מחובר מחט 25 G מוכנס לתוך חבית סלקטיבית יון. אטם חזק האוויר על גבי שני החביות נוצר באמצעות שעווה שיניים. ( ד ) ציפוי micropipette עם chlorotrimethylsilane (שלבים 3.15-3.26): [הגדלה נמוכה] ISM מושעה chlorotrimethylsilane בקנה אחד עם stereomicroscope רכוב אופקית. [הגדלה גבוהה] הנוף דרך stereomicrosc רכוב אופקיתOpe של קצה ISM ב chlorotrimethylsilane פתרון. לאחר הדמיה של קצה דרך מיקרוסקופ, כמות קטנה של פתרון TMA-Cl הוא גורש מן החבית סלקציה יון (מספיק כדי ליצור בועה קטנה של פתרון TMA-Cl). בעל ISM הוא טפח לשחרר בועת פתרון TMA-Cl ולאחר מכן chlorotrimethylsilane נמשך לתוך קצה. מחזור זה חוזר על עצמו מספר פעמים. לאחר כל chlorotrimethylsilane הוא נפלט מן ISM, ה- ISM ממוקם לתוך מחליף יון נוזלי (LIX) עבור TMA ו LIX נמשך לתוך קצה החבית סלקטיבית יון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
4. הכנת מיקרואלקטרודות Iontophoresis
הערה: microtlectrodes Iontophoresis צריך להיות מפוברק ביום הניסוי.
- משוך זכוכית כפולה borosilicate זכוכית נימי על אנכי או הוריזונלית. להתאים את הפרמטרים למשוך פיפטה דומה micropipettes משך בשלב 3.6 ( איור 4 א ).
- מניחים את micropipette תחת מיקרוסקופ המתחם בשימוש בשלב 3.7 וחותכים את קצה באמצעות שקופית מיקרוסקופ זכוכית כך בקוטר המתקבל הוא בין 2 ו 5 מיקרומטר ( איור 4 א ).
- מלאו את שתי חביות עם 150 מ"מ TMA-Cl מילוי פתרון באמצעות מזרק 10 מ"ל מחובר מסנן 0.22 מיקרומטר ו 28 G, 97 מחט מ"מ ( איור 4 א ).
- הקש על micropipette בעדינות על מנת להבטיח כי לא בועות אוויר נותרים הפתרון של שתי החביות.
- המקום חוטי כסף כלורידי לתוך שתי החביות של micropipette. ודא כי החוטים עמוקים מספיק פתרונות מילוי, כך שהם יישארו בקשר עם הפתרונות למשך הניסוי.
- חותם את החוטים לתוך הקנים באמצעות שעווה דנטלית חם. בעדינות interlock t הוא חוטים על ידי סיבוב אותם סביב אחד (microelectrode הושלמה שמוצג באיור 4b ).

איור 4: הכנת Microelectrode Iontophoresis. ( א ) microtlectrode Iontophoresis לאחר מילוי שני חביות (שלבים 4.1-4.3): microelectrode יון הוא משך מן צינור נימי. קצה microelectrode הוא סדוק בקוטר של 2-5 מיקרומטר. שתי החביות של microelectrode iontophoresis מלאים פתרון TMA-Cl. ( ב ) השלמה יון microoplectrode (צעדים 4.5-4.6): microelectrode iontophoresis עם שני חוטי כסף כלוריד מוכנס לתוך החביות. החביות של microelectrode סגורים עם שעווה, ואת חוטי כסף מעוותים בחלק האחורי של microelectrode./ אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו. "Target =" _ blank "
5. הכנה של נוזל המוח השדרה מלאכותית ו מכרסמים המוח פרוסות רקמות
- הכן 1 ליטר של נוזל מוחי מלאכותי (ACSF) עם הרכב המתאים לניסוי ולהוסיף 0.5 מ"מ TMA-CL אליו.
הערה: TMA-CL יש צורך להקים ריכוז רקע של TMA במהלך הניסוי. - הכן פרוסות מוח מכרסמים עם עובי של 400 מיקרומטר על פי פרוטוקולים סטנדרטיים 11 , 12 . השתמש ACSF מוכן בשלב 5.1 עבור לנתיחה ותחזוקה של פרוסות המוח.
6. בזמן אמת Iontophoresis ב Agarose
- הפעל את המחשב שמפעיל את התוכניות Walter ו- Wanda.
הערה: תוכניות אלה זמינות באופן חופשי על פי דרישה. בעוד תוכנה זו אינה חיונית, תכנות דומהתוכנה או ביצוע הניתוח על ידי יד אחרת היה נדרש. - הפעל ACSF דרך תא הטבילה בקצב מתאים ( למשל, 2 מ"ל / דקה). הגדרת בקר הטמפרטורה לטמפרטורה הרצויה בועה ACSF עם 95% O 2 /5% CO 2 (או תערובת גז מתאימה אחרת) למשך הניסוי.
- הרכבה של אלקטרודה אדישה (קרקעית) בתוך בעל מתאים לצלול את קצה לתוך ACSF פועל דרך החדר שקוע. חבר את החוט לקרקע של הגדרת ההקלטה.
- ממלאים את כוס נקבובי (עשה בשלב 1.7) עם agarose 0.3% מוכן בעבר ומניחים אותו בחדר התה. ודא כי הפתרון אינו פועל מעל החלק העליון של הכוס.
- מאובטח ISM מכויל לבעלים פיפטה של micromanipulator אחד ו microelectrode iontophoresis השני. הגדר את המחזיקים לזווית המתאימה להתקנה ( איור 5 א ).
- לְחַבֵּרISM ו iontophoresis חוטים microelectrode לשלבים הראשיים שלהם של מגבר הקלטה. לחלופין, התחבר ישירות למגבר (בהתאם להגדרות).
- ודא כי משקל / מיקום של החוטים המחברים או קליפים לא גורם כל תנועה של microelectrodes, כמו תנודות קטנות המיקום יכול להשפיע על התוצאות.
- הפעל את ההגדרה האלקטרונית (משלב 2). הפעל את וולטר וונדה במקרים נפרדים.
- ב GUI וונדה, לחץ על "כיול" ( איור 6 א ). בתיבה כיול ( איור 6 ב ), למלא את המתחים שנמדדו במהלך כיול ISM (שלב 3.29) ולחץ על "Fit Data".
הערה: זה מאפשר להתאים את הייצוג הבא של משוואת Nicolsky (לחלופין להתאים את המשוואה באמצעים אחרים כדי להשיג M ו- K ):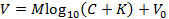
שֶׁלָהדואר, V הוא המתח הנמדד (mV), M הוא שיפוע Nicolsky (mV), C הוא הריכוז של יון (מ"מ), K הוא ההפרעה (מ"מ), ו- V 0 הוא מתח ההיסט (mV) 3. - לחץ על "קבל" בתיבה כיול כדי להעביר באופן אוטומטי את המדרון ( M ) וההפרעה ( K ) שנוצר בשלב 6.9 ל- GUI הראשי.
הערה: כאן, K מייצג את הפרעה Na, שהוא בדרך כלל זניח. - בצד שמאל של ממשק המשתמש, ודא שכל הפרמטרים הניסוייים נקבעים בערכים המתאימים ( איור 6 א ).
- בתיבה Source Source (הגדרת מקור), הגדר את המקור למקור iontophoretic (ברירת המחדל), את "משך ההקלטה" ל - "200 s" (ברירת המחדל), את "הדופק בגין" ל - "10 s" (ברירת המחדל,) "Pulse End" כדי "60" (ברירת המחדל), "זרם קדום" ל "20 nA" (ברירת מחדל),"Main Current" ל "100 nA" (ברירת מחדל) ו "- גורם ההמרה" לערך מתאים.
- בתיבה אלקטרודה מדידה, להגדיר "אמבט C" לריכוז של TMA הכלול בתוך הפתרון אמבטיה (לידי ביטוי mM). הגדר את "רווח כולל", "ערוץ פלט", "ערוץ ISM" ו "ערוץ Ref" כדי להתאים ערכים עבור מערכת רכישת נתונים בשימוש.
הערה: יש להגדיר את "גורם ההמרה" לערך מתאים (ספציפי ליחידה היונית-טורית בשימוש). ערך זה מציין את כמות הזרם המועבר עבור מתח מתח נתון מממיר D / A (nA / mV).
- מניחים טמפרטורה בדיקה בכוס אגר. הקלט את הטמפרטורה נמדדת ערך "טמפרטורה" בתיבת "מדידה אלקטרודה" של GUI ( איור 6 א ).
- הפעל את תאורת שלב המשנה. אם נדרש, הפעל את המצלמה המצורפת למיקרופוןRoscope ואת המצלמה לפקח.
- להנמיך את microelectrodes לפחות 1000 מיקרומטר עמוק לתוך agarose ומרכז אותם בכוס ( איור 5 ב ). דמיינו אותם תחת מיקרוסקופ באמצעות מטרה 10X (מים טבילה המטרה עם מרחק עבודה ארוך).
- לקזז את המתח על המגבר ל 0 mV הן עבור ערוצי הפניה והן עבור ערוצי ISM על מנת לקבוע את המתח שנרשם ב - agarose כמתח הבסיסי.
- על המגבר בעל שני הערוצים, העבר ידנית את מחבר ערוץ ה - ISM אל יציאת החיסור של המתח כדי להגדיר את החיסור 'on' בין ערוצי ההפניה וערוצי ISM.
הערה: חיסור מבטיח ששינויי המתח בערוץ ISM משקפים את השינויים בריכוז TMA בלבד. - להזיז את ה- ISM כך שהוא נוגע בקצה microelectrode יון. מרכז את העצות אחד על השני בכל שלושת צירים כיווני.
- אפס את עמדות היחסיים של שניהם microelectrodes עלתיבות בקרה micromanipulator. ודא כי microelectrodes מרוכזים במדויק ומדויק (קריטי).
- להזיז את ISM 120 מיקרומטר הרחק microelectrode iontophoresis בציר אחד (ציר שמאל, איור 5b ). קלט את המרחק הזה לתוך "מדידה אלקטרודה" תיבת GUI ( איור 6 א ).
- התחל הקלטה על ידי לחיצה על "רכש" ב GUI ( איור 6 א ); לאפשר לתוכנית להקליט הקלטה מלאה.
הערה: microelectrode iontophoresis מקבל זרם הטיה קבוע. לאחר לחיצה על "רכש", יש עיכוב קצר לפני הנוכחי הראשי מוחל למשך מוגבל. - חזור על שלב 6.20 פעמיים עד שלוש פעמים נוספות. המתן עד שיחזור אות ה- TMA לקו הבסיס לפני רכישת רשומות חדשות; התוכנית תחסוך כל שיא לניתוח מאוחר יותר.
- בדוק את המרווח של שני microelectrodes ידי העברת ISM בחזרה tO מיקום אפס שצוין על ידי תיבת הבקרה. אם microelectrodes אינם ממוקדים עוד, מרכז אותם שוב באמצעות אותה אסטרטגיה כמו בשלב 6.17. הקלט כל שינוי במיקום האלקטרודות.
הערה: אם המרווח משתנה ביותר מ -2%, הרי הרשומות שנרכשו בשלב 6.19 לא יכולות להיחשב מדויקות וחדשות.
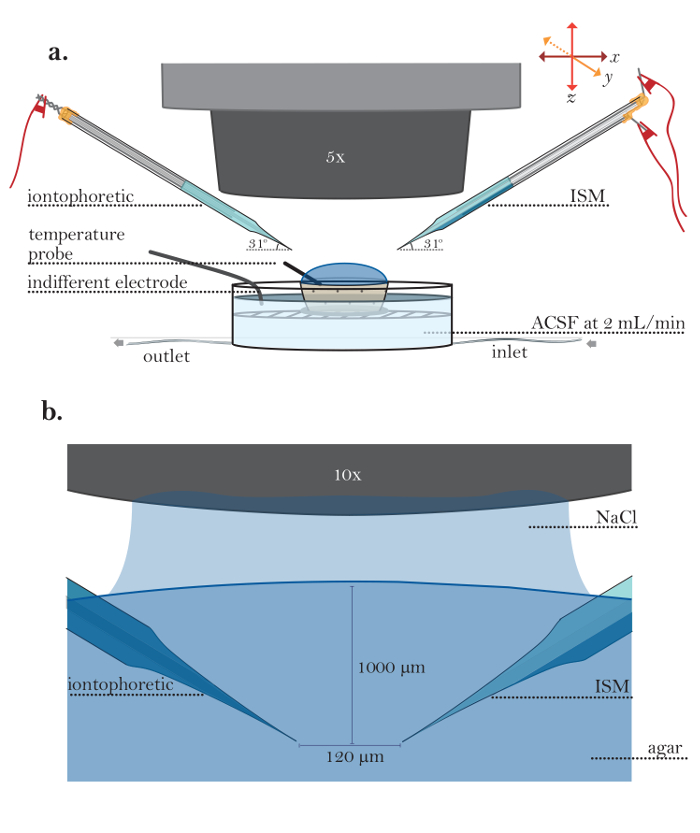
איור 5: הגדרה לניסויים באגר. ( א ) ההתקנה לניסוי אגר לדלל (מדרגות 6.1-6.5): מיכל נקבובי קטן מלא אגר לדלל להציב תא זלוף ריצה. מיקרואלקטרודה iontophoresis (בצד שמאל) ו ISM (בצד ימין) מוחזקים על ידי מחזיקי microelectrode; מחזיקי microelectrode מצוידים בזרועות של micromanipulators רובוטית. בדיקה טמפרטורה ממוקמת ג'ל אגר, ואת האלקטרודה הקרקע אדיש הוא plAced בתוך החדר subersion. ( ב ) תצוגה מוגדל של microelectrodes ב אגר: microelectrode iontophoresis (בצד שמאל) ו ISM (בצד ימין) הם דמיינו אגר באמצעות מטרה 10X מים טבילה (אובייקטיבי שקוע כאן 150 מ"מ NaCl). Microelectrodes ממוקמים באמצעות micromanipulators לעומק של 1000 מיקרומטר; המרווח בין microelectrodes הוא 120 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 6: וונדה תוכנת מחשב ממשק. ( א ) ניווט ממשק המשתמש הגרפי של Wanda (GUI): המסך שמופיע לאחר פתיחת תוכנת Wanda. בתיבה (1), נבחרים מולקולה בינונית, יונתופורזה וטכניקה. ) 2 (לחץ על "כיול"תיבת כיול וונדה. לאחר כיול ה- ISM (ראה איור 6b ותוספת B), ה- ISM ממוקם באגר או במוח, כמתואר בשלבים 6 ו -8 של הפרוטוקול. בתיבה (6), מוזנים כל הערכים המתאימים לניסוי המבוצע. (7) "רכש" הוא לחץ כדי לקחת הקלטה; גרף של מתח לעומת הזמן מופיע בחלק הימני העליון של Wanda GUI. ( ב ) כיול ISM ב Wanda : החלון שנפתח לאחר לחיצה על (2) "כייל" ב GUI וונדה. הערכים משלב 3.29 נכנסו לתיבה (3), ו (4) "Fit Data" נבחרה. עקומת כיול הוא אישר להיות ליניארי. (5) "קבל" הוא לחץ כדי לחזור GUI וונדה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
7. Agarose ניתוח נתונים
- פתח את התוכנית Walter במחשב (PC). ב "0. רשומות מתוך:" בתפריט, לחץ על "Wanda / VOLTORO" כפתור לקרוא את הרשומות שנוצרו על ידי Wanda ( איור 7 א ). בהנחה כי פלט לגיליון אלקטרוני נדרש, לפתוח את התוכנה המתאימה. לחץ על "גיליון 1,3" ב "1. כתוב Excel?" ( איור 7 ב ).
- בחלון מוקפץ הבא, בחר את הרשומות (ים) כדי לקרוא ולחץ על "פתח" ( איור 7 ב ); שים לב כי הרשומות יהיו באופן אוטומטי graphed. כדי להתחיל בהליך הולם, בצע את השלבים הבאים.
- בתפריט "2. אפשרויות", לחץ על כפתור "בחר rec". ב " איור 2 " חלון מוקפץ, להשתמש בעכבר כדי להזיז את הכוונת מעל הרשומה הראשונה להיות מעובד ( איור 7 ג ); לחץ על לחצן העכבר כדי לבחור את הרשומה.
- לחץ על oN "עקומה בכושר" בתפריט. בחר את המספר הרצוי של איטרציות של התאמה; להשתמש לפחות 20 איטרציות של התאמה כדי להשיג התאמה מדויקת של הנתונים.
- בתפריט, בחר "הכל" כדי להתאים את כל נקודות הנתונים ובחר "המשך" התוכנית תתאים את העקומה המוצגת. לבחון את ההליך מתאים ולהשוות את הרשומה הניסוי עם עקומת מצויד הטוב ביותר שהושג.
- בחר את האפשרות לכתוב את התוצאה לתוכנית גיליון אלקטרוני המתאים על ידי לחיצה על "Excel" בתפריט "7. תוצאות" ( איור 7 ד ). הערה (ולהקליט) את הנתונים הקריטיים הבאים שישמשו כדי לקבוע את הפונקציונליות של microelectrode יון: ' D (E5) ', ' הפניה D (E5) ', ' r_app ', מספר התחבורה ' n t ', ' נראה N t '.
הערה: " D (E5) ": מדידת דיפוזיה חופשיתTx 10 5 (ס"מ 2 / s); " הפניה D (E5) ": מקדם דיפוזיה חופשי חינם x 10 5 (ס"מ 2 / s). ערך זה מופק מתוך מסד נתונים בתוך Walter מבוסס על יון, המדיום, ואת קלט הטמפרטורה. " R_app ": ריווח microelectrode לכאורה (ס"מ), מחושב על בסיס D ו נמדד D (E5) . " N t ": מספר התחבורה (ללא מידות). מספר זה קובע את חלקו של זרם יונתופורסיס המשמש לשחרור TMA 4 . " נראה n t ": לכאורה מספר התחבורה (חסר ממדים). זהו מספר התחבורה מחושב מ r_app . מספר זה צריך להיות קרוב t n נמדד. - חזור על שלבים 7.1-7.3 עבור כל הרשומות עבור זוג נבחר של microelectrodes.
- לקבוע אם microelectrode יון הוא שמיש על ידי ביצוע הפעולות הבאות.
- השווה " r_app" עם r בפועל ( כלומר, 120 מיקרומטר); קריטריון זה מתקיים אם הערכים הממוצעים מכל הניסויים הם בתוך 4% אחד מהשני.
- השווה " D (E5)" עם הפניה D (E5) ; קריטריון זה מתממש אם הערכים הממוצעים מכל הניסויים נמצאים בתוך 8% זה מזה.
- השווה את "n t" בין ניסויים עם אותו microelectrode; קריטריון זה מתקיים אם הערכים הממוצעים מכל הניסויים נמצאים בתוך 10% זה מזה.
- אם אחד הקריטריונים משלב 7.5 לא התקיים, לפתור את microelectrode יון או להתחיל לבדוק עוד אחד.
- אם microelectrode iontophoresis ייחשב מתאים לניסוי, להקליט את מספר התחבורה הממוצע מכל הניסויים בשדה "Num N התחבורה" ב GUI וונדה ( איור 6 א ).
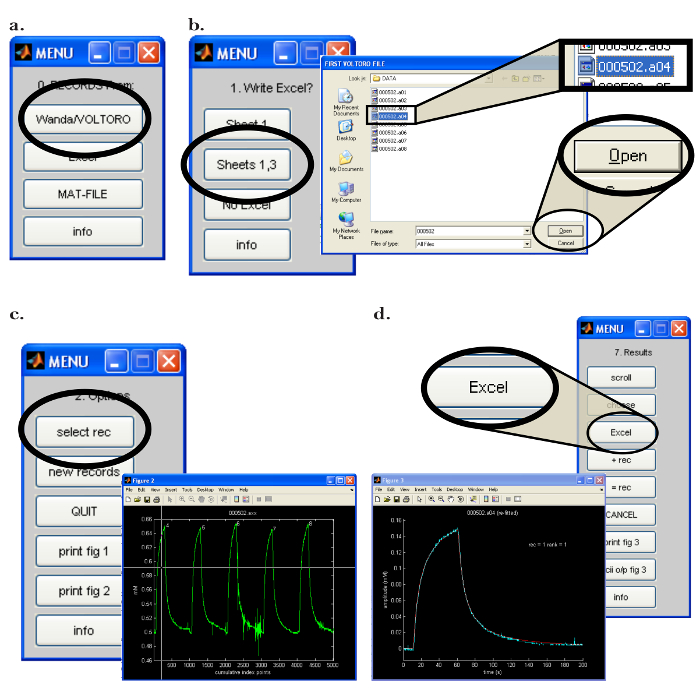
איור 7: תוכנת מחשב של וולטר. ( א ) בחירת תוכנית איסוף הנתונים בוולטר: התפריט "0. רשומות מ:" נפתח לאחר הפעלת תוכנת Walter. האפשרות לטעון את הרשומות שנשמרו על ידי Wanda נבחרה על ידי לחיצה על כפתור "Wanda / Voltoro". ( ב ) בחירת הנתונים ואת הנתונים ניתוח מיקום פלט ב Walter: [שמאל] לאחר התוכנית המתאימה גיליון אלקטרוני נפתח, "Sheets 1,3" נבחר פלט כל ניתוח נתונים Walter לתוכנית גיליון שנפתח בעבר. [Right] לאחר בחירת נתוני הפלט מיקום, נפתח חלון קופץ, המאפשר למשתמש לבחור את הקלטות הראשון והאחרון כדי לקרוא על ידי וולטר. ( ג ) בחירת הקלטה כדי לנתח ב Walter: [מימין] לאחר הקבצים לקריאה נבחרים, חלון קופץ ייפתח עם כל הרשומות שנבחרו disשיחק כגרף (" איור 2 "). [שמאל] בתפריט "2.Options", "בחר rec" הוא לחץ, ואת העכבר משמש להזיז את הכוונת כדי לזהות את ההקלטה הראשונה לניתוח; לחץ על לחצן העכבר כדי לבחור את ההקלטה. ( ד ) ייצוא ניתוח הנתונים מ Walter לגיליון אלקטרוני: לאחר התאמת הנתונים, חלון מוקפץ ותפריט "תוצאות 7." יופיעו. [שמאל] גרף של ההקלטה שנבחרה (כחול) עם עקומת דיפוזיה מצויד שנוצר על ידי וולטר (אדום). [Right] "7. תוצאות" התפריט מאפשר למשתמש לכתוב את הנתונים מניתוח לתוכנית גיליון אלקטרוני על ידי לחיצה על כפתור "Excel". אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
8. בזמן אמת Iontophoresis ב פרוסות המוח
- מניחים 400 מיקרומטר עבה של המוחכינים בתא ההקלטה, להבטיח כי הוא שקוע במלואו ACSF זורם. מקמו את הפרוסה באמצעות מכחול בצבעי מים ואבטחו בעדינות ברשת.
- להעביר הן microelectrode iontophoresis ו- ISM מעל תחום עניין על פרוסת המוח. לצלול הן ACSF זורם אבל מעל הפרוסה.
- לקזז את המתח הן עבור הפניה ערוצי יון חישה "0" mV. המתן עד שהמתח בשני הערוצים יתייצב. על רשם תרשימים, סמן את המתח נמדד על ערוץ יון חישה של ISM. השתמש בו כדי לחשב את הפרמטר V הבסיס בונדה.
- מניחים את ISM ו iontophoresis microelectrode 200 מיקרומטר עמוק הפרוסה 120 מיקרומטר הרחק אחד מהשני. המתן ייצוב של האות לאחר העברת microelectrode לתוך פרוסת המוח.
הערה: הטיה הנוכחית מוחל על microelectrode יון גורם הצטברות קטנה של TMA. זוהי טעות נפוצה לקחת arבהקדם האפשרי ו להמעיט את הצטברות האות. - על רשם תרשימים, סמן את המתח התייצב נמדד פרוסת המוח על ערוץ יון חישה של ISM. חישוב הפרש המתח בין אות TMA הנמדד בשלב 8.3 ובצעד 8.4 ו קלט ערך זה לתוך השדה "Baseline V (mV)" בתיבה מדידה אלקטרודה של GUI וונדה ( איור 6 א ).
- בצד שמאל של הממשק הגרפי, ודא שכל הפרמטרים הניסיוניים נרשמים / הוזנו כראוי. הגדר "בינוני" ל "המוח", "מספר התחבורה" לערך הממוצע מחושב עבור microelectrode יון בשלב 7.4, ו "טמפרטורה" לטמפרטורה של האמבטיה המכיל את הפרוסה.
הערה: יש להקליט V עבור כל קבוצת מדידות. קו הבסיס V יומר על ידי ונדה לתוך הפרמטר C (mM) הבסיסי ( כלומר, ריכוז TMA ברקמת המוח). - התחל את ההקלטה על ידי לחיצה על "רכש" ולאפשר לו לקחת הקלטה מלאה. המתן עד שיחזור אות ה- TMA לקו הבסיס לפני רכישת הקלטה חדשה.
- קח שניים עד שלושה הקלטות רצופות לפני הסרת microelectrodes ממיקום המוח הנבחר. קלט את הטמפרטורה נמדדת לתוך התוכנה וונדה מיד לפני כל הקלטה.
- העבר הן microelectrodes באלכסון בחזרה אל פני השטח של הפרוסה. להעלות את שניהם לפחות 50 מיקרומטר מעל הפרוסה. באמצעות רשם התרשימים, יש לקבוע כל שינוי בין ה- V שנמדד כעת לבין המדידה שלו משלב 8.3.
- מרכז את הקצות של ה- ISM ואת microelectrodes iontophoretic יחסית זה לזה ב x, y, ו- z- צירים. השג שינויים בריווח, אם בכלל, מהצג של תיבת הבקרה micromanipulator.
9. ניתוח נתונים המוח
- פתח גיליון אלקטרוני חדש עבור פלט הניתוח.
- חזור על שלבים 7.1-7.4 בוולטר כדי לנתחההקלטות שנלקחו מהמוח.
- כתוב את הנתונים על התוכנית גיליון אלקטרוני על ידי לחיצה על "Excel" בתפריט Walter. שיא את α , נפח חלק של ECS המוח; Λ , צרות של ECS המוח; ו - k (s -1 ), ללא אישור ספציפי.
10. בדיקת מספר התחבורה וכיול ה- ISM
- מדוד את מספר התחבורה של ISM ( n t ) בסוף הניסוי באמצעות הפרוטוקול שלהלן. לחלופין, לבדוק n t לאחר ניסויים קריטיים או כאשר מדידות מופיעות חריגות. עם זאת, לא n בדיקה מדי פעמים רבות יכולות לגרום טראומת פרוסת המוח.
- קח הקלטות חדשות agarose. ראה צעדים 6.4, 6.11, 6.12, 6.14, 6.15 ו- 6.17-6.22.
- חזור על שלבי 7.1-7.4 ב וולטר להשיג את t n מהקלטות agarose החדשות. בדוק את הגיליון האלקטרוני: אם n t השתנה על ידי יותרמ -10% מן n t השיג לפני המדידות המוח, הנתונים המתקבלים עם microelectrode iontophoretic אלה אינם אמינים.
- בצע כיול חדש (ראה צעד 3.29) עבור ISM לאחר כל נתוני המוח נאסף. השתמש בנתוני כיול ISM שהתקבלו זה עתה כקלט בקופסת Wanda Calibrate (ראה את השלבים 6.9 ו -6.10) ובדוק אם ערך השיפוע משתנה פחות מ -10% מהכיול הקודם.
הערה: הנתונים המתקבלים עם ISM זה אינם אמינים אם ערך המדרון משתנה ביותר מ - 10% מהכיול הקודם.
תוצאות
השירות של הטכניקה RTI הוא הוכיח בניסוי שנועד למדוד את השינויים α ובמהלך האתגר hypoosmolar ( איור 8 ו איור 9 ). הוכח בעבר כי הפחתת osmolarity של ECS על ידי שטיפה על ACSF hypotonic תייצר ירידה α עלייה λ 13 .
בניסוי זה, RTI בוצע על פרוסות המוח חולדה תחת שני תנאי שליטה במהלך לשטוף על של ACSF hypotonic. ISM היה מפוברק, הפרמטרים כיול שלו היו קלט לתוך ונדה עבור מתאים למשוואת Nicolsky, אשר מחושב מדרון ( M ) של 58.21 mV. ISM ו microtlectrodes iontophoresis הונחו אגר ו מיקומו 120 מיקרומטר בנפרד אחד מהשני כדי למדוד את התחבורה nuMber. שלוש הקלטות נלקחו, ואת הקימורים היו מצויד ונותחו על פי הנוהל בשלב 6 של הפרוטוקול ( איור 8 א ). עקומת מצויד של כל משפט חופפים עם עקומת גלם ( איור 8 א ). מקדם הדיפוזיה הנמדד ( D x 1E5 ), מספר התחבורה ( n t ) וההבדל בין המרווח לכאורה של המיקרואלקטרודות ( r_app ) לבין המרווח בפועל שלהם ( r ) לא היה שונה משמעותית בין שלוש ההקלטות ( איור 8 ב , הקלטות a1-3). בהתבסס על קריטריונים אלה, זה microtlectrode iontophoresis היה מקובל להמשיך עם הניסוי.
לאחר שנבחרה microelectrode יון iontophoresis, ערכי שליטה עבור α ו λ בפרוסת המוח חולדה נלקחו על מנת להקים בסיס עבור פרמטרים אלה. מִרֹאשׁמחקרים vious מצאו ערכי שליטה עבור neocortex חולדה להיות α = 0.18-0.22 ו λ = 1.54-1.65 1 . כדי לשכפל ערכים אלה בניסוי זה, ISM ו iontophoresis microelectrode הוצבו 200 מיקרומטר עמוק neocortex חולדה ו 120 מיקרומטר בנפרד אחד מהשני. הממוצע n לא , מחושב מן הנתונים באיור 8b , נכנס לתוכנית ונדה לשימוש בחישובים של α ו λ . משמרת V הבסיס מן המיקום של שתי microelectrodes על 200 מיקרומטר עמוק במוח נרשמה, ואת קפיצת המתח נכנס לתוך ונדה לתקן את הבסיס TMA ( כלומר, את הבסיס C פרמטר) ריכוז. שלוש הקלטות נלקחו, ואת הקימורים שלהם היו מצוידים ( איור 9 א , איור 9 ד , ו איור 9f ). ההתאמות גילו ממוצעΑ = 0.192 λ = 1.69 ( איור 9e ). ריווח ותנודות V בסיס נבדקו לאחר ההקלטות נלקחו, ועל הערכים המתוקנים נקשרו וונדה לנתח מחדש את הנתונים (כמפורט צעד 8 לפרוטוקול). הערכים שחושב מחדש לא היו שונים באופן משמעותי, והערכים שדווחו בתרשים 9 ד התקבלו.
Osmolarity נורמלי של ACSF הוא 300 mOsm. כדי לבדוק את ההשפעה של ACSF hypotonic על α ו λ ב neocortex סומטוסנסורי חולדה, ACSF עם osmolarity של 150 mOsm נעשתה על ידי הפחתת ריכוז NaCl. זה היה שיערו כי ACSF היפוטוני זה יוביל נפיחות של תאי המוח, גרימת α נמוך יותר λ 13 גבוה יותר. פרוסת המוח היה superfused עם ACSF hypotonic למשך כ 30 דקות, ומאפשר את זהכדי לאזן את המוח. במהלך תקופה זו, המיקרואלקטרודות נותרו באותו מקום בניאוקורטקס כפי שהיו במהלך מדידות קודמות של תנאי שליטה. חמש הקלטות הוקלטו בתנאים היפוטוניים ( איור 9 ב ו-ו ). זה שנוצר בממוצע α = 0.13 ו λ = 1.84 ( איור 9e ). ערכים אלה היו בקנה אחד עם ההשערה כי hypoosmolarity מקטין α ומגביר λ . ריווח ושינויי V בסיס נמדדו ונלקחו בחשבון בעת ניתוח ההליך ראוי.
הפרמטרים התאוששות נמדדו גם על ידי שטיפה ACSF רגיל (300 mOsm) ולקחת הקלטות חדשות באותו מקום בניוקורטקס. בגלל תופעות נפיחות צריך להיות הפיך, זה היה צפוי כי α ו λ היה להתאושש לשלוט ברמות. הערכים avשנחקרו על ארבעה רשומות שנלקחו לאחר 30 דקות של ACSF קבוע על לשטוף היו α = 0.37 ו λ = 1.61 ( איור 9 ג , איור 9e , ו איור 9f ). זה הוכיח כי היה עלייה בלתי צפויה במהלך ההתאוששות של α תחת תנאים אלה ( איור 9e ואיור 9f ). לאחר מכן, microelectrodes הוחזרו אגר כדי לאשר כי מספר התחבורה של microelectrode iontophoresis היה ללא שינוי ( איור 8 ג ). ISM היה אז recalibrated, ואת ההתאמה החדשה למשוואת Nicolsky חשף את המדרון להיות 58.21 mV.
ניסוי זה הוא דוגמה ברורה של מה RTI נראה בתנאים אידיאליים. המרכיבים הבאים של הניסוי היו המפתח להצלחתה. ראשית, נאספו נתונים ניסיונייםAgarose ואת המוח הפגינו חפיפה נאותה עם עקומות תיאורטיות שנוצר על ידי Wanda ( איור 8 א ו איור 9 א ו איור 9 ג ). הדמיון בשיפוע, השיא והחזרה לקו בסיס דומה הם כולם חשובים בקביעת עוצמת ההתאמה. חלקים אלה של עקומת הם לעתים קרובות בעייתי בעת ההקלטה agarose, וזה נפוץ הקלטות מרובות יש לנקוט לפני מציאת התנאים המייצרים עקומות בהתאמה טובה ( כלומר, microelectrodes טוב). שנית, מספר ההובלה הממוצע לפני ואחרי הניסוי היו בתוך 10% זה מזה ( איור 8 ב ואיור 8c ). אם זה לא קרה, לא ניתן לסמוך על הערכים שנרשמו במוח. זוהי ללא ספק הבעיה הנפוצה ביותר המתרחשת בניסויי RTI. שלישית, כיול ISM ב TMA פתרונות סטנדרטיים לפני ואחריTer הניסוי מותאם (נתונים לא מוצגים). בדרך כלל, כיול של ISM עובד הם בתוך 10%, מה שהופך את זה מקור נדיר של כישלון הניסוי.

איור 8: עקומת אידיאלי התאמת נתונים אגר לפני ואחרי ניסוי במוח. ( א ) נתונים נציג בניסוי אגר: [רחוק משמאל] נתונים מייצגים מניסוי יחיד שהושג אגר המדגים את עקומת ריכוז של TMA. לפני מדידות דיפוזיה, זרם הטיה קבוע של +20 nA יושם באמצעות microelectrode iontophoresis. בזמן = 10 שניות, TMA היה פעמו מן microelectrode יון לתוך אגר על ידי יישום +60 nA הראשי הנוכחי עבור 50 s. עקומת דיפוזיה נוצרה על ידי מדידת [TMA] לאורך זמן באמצעות ISM ממוקם 120 מיקרומטר מן המקור. [התיכון] עקומה מתאימה המתקבלת מנתונים pמכרסמים בוולטר. [חפיפה] של הנתונים ואת עקומת מצויד מראה כי עקומת נעשה על ידי וולטר במדויק מודלים דיפוזיה במשפט זה. ( ב ) טבלה של מדידות אגר לפני ניסויים במוח: נתונים המתקבלים משלושה ניסויים (a1, גרף לעיל) לפני ניסויים הלחץ hypotonic ( איור 9 ). כל הניסויים נערכו עם microelectrode יון ו ISM המשמשים את הניסויים ללחץ hypoosmotic. הנתונים מילאו את הקריטריונים הנדרשים כדי להמשיך את הניסוי בפרוסות המוח. קריטריונים אלה כוללים חפיפה נאותה בין הנתונים לעקומה המותאמת (כמפורט לעיל) לבין פחות מ - 10% בשינוי במספר התחבורה. קריטריונים נוספים מתוארים בשלב 7.6. ( ג ) טבלה של מדידות אגר לאחר ניסויים במוח: נתונים המתקבלים משלושה ניסויים שבוצעו אגר לאחר ניסויים הלחץ היפוסמוטי ( איור 9 ). מורכב Ency הפגינו בין ניסויים a1-3 ו a4-6 עולה כי ISM ו iontophoresis microelectrodes היו יציבים לאורך כל הניסויים במוח. הקלטה = הקלטה או משפט; R = המרחק בין micromlectrode ISM ו iontophoresis; Cb = ריכוז הבסיס; Ref x x1E5 = מקדם דיפוזיה חופשי תיאורטי x 10 5 (cm 2 s -1 ) על פי תקן מחושב מראש; n t = מספר התחבורה (מימדים); D (E5) = מקדם דיפוזיה חופשי נמדד x 10 5 (cm 2 s -1 ); R_app = ריווח microelectrode לכאורה (ס"מ) מבוסס על D נמדד התייחסות (E5); N לא נראה = מספר התחבורה לכאורה מבוסס על r_app . אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 9: מתח היפוסמוטי מפחית אלפא ומגדיל למבדה
Ac נתונים מייצגים של ניסויים במוח תחת ( א ) שליטה, ( ב ) hypoosmotic, ו- ( ג ) תנאי התאוששות: קווים מוצקים מייצגים נתונים קווים שחורים מקווקווים הם עקומות מצויד. שלושת התנאים להפגין שונה באופן משמעותי עקומות דיפוזיה, כולל מדרונות שונים, אמפליטודות, ורוחבים. ( ד ) טבלת נתונים מניסויי בקרה: טבלת נתונים של שלושה ניסויי בקרה (b1, גרף לעיל); Α ו λ דומים בכל הניסויים ועולים בקנה אחד עם הנתונים שפורסמו עבור neocortex חולדה. עבור כל הניסויים במוח, ה- T n הממוצע ממדידות אגר לפני ואחרי הניסוי (איור 8b ו 8C) שימש עבור t המוח n D המוח מוחל על 1.25 × 10 -5 ס"מ 2 s -1 , בהתבסס על מסד נתונים של מקדמי דיפוזיה (בוולטר) שהתקבל במוח חולדה כאשר T = 34.5 [C °]. הפרמטר k ' [s -1 ] חשבונות עבור כמות קטנה של TMA הפסידה מן ECS במהלך המדידות דיפוזיה. למרות ש- k הוא בדרך כלל קטן מאוד, כולל הפרמטר בהתאמת העקומות משפר את הדיוק של שיטת ה- RTI. הפרמטר הפסד k ' מייצג כנראה ספיגת הסלולר או אובדן של TMA ל- ACSF. ( ה ) השוואה של שליטה, hypoosmotic, והתאוששות התנאים: ממוצעים מכל הניסויים במוח תחת שליטה, hypoosmotic, והתאוששות תנאים. הנתונים מראים כי מתח hypoosmotic מקטין α ומגביר λ . במהלך תקופת ההחלמה הבאה hyposmotic תנאים, α overhoots הבסיסית (שליטה), בעוד λחוזר אל הבסיס. התוצאות מצביעות על כך ששינויים ב- ECS במהלך אתגרים היפוסמוטיים ניתנים להפיכה חלקית. שיטת ה- RTI אידיאלית ללימוד סוג זה של אפקט הפיך חריף. ( ו ) גרף המדגים קיבוץ נתונים: חלק השבריר (ציר x) וצורות (ציר y) מכל משפט מתוות כנקודה אחת. הגרף מדגים את קיבוץ הנתונים בתוך כל קבוצה ( כלומר, שליטה, hypoosmolar, והתאוששות), דבר המצביע על כך של- RTI יש את הרגישות לזהות את ההשפעות הניתנות לשחזור של אתגר hypoosmolar ב- ECS של המוח. הקלטה = הקלטה או משפט; R = מרחק בין ISM ו microelectroesis יון; Cb = ריכוז הבסיס; אלפא = נפח חלק; למבדה = צרות; K ' = שחרור שאינו ספציפי של בדיקה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
קבצים משלימים: לחץ כאן כדי להוריד את הקבצים.
Discussion

איור 10: נתונים לא אידיאליים הממחישים בעיות טכניות נפוצות. ( א ) דיאגרמות של בעיות טכניות נפוצות עם microtlectrodes iontophoresis: השוואה של שחרור רגיל של TMA מ microelectrode iontophoresis תפקודית עם שלושה מקורות המפגינים בעיות טכניות. [הגדלה גבוהה, a1] הזרם במקור iontophoretic אידיאלי נשמר באופן שווה על ידי שחרור TMA ו ספיגת כלוריד. [הגדלה גבוהה, A2] אירעה microelectrode iontophoresis עם TMA פחות משחרר נמוך n t ו תופס כלוריד יותר מהרגיל. [הגדלה גבוהה, a3] iontophoresis microelectrode הצגת אלקטרווזמוזה משחרר TMA, כלוריד, ממס. [הגדלה גבוהה, a4] microelectrode iontophoresis הצגת שחרור גדל לאורך זמן ( כלומר, "התחממות"). ( ב ) גרף של נתונים לא אידיאליים oBtained ב אגר: הנתונים אינו המודל כראוי על ידי עקומת מצויד על ידי וולטר ולכן לא ניתן לפרש במדויק; הסיבה המדויקת של הפער אינה ברורה. ( ג ) טבלה של נתונים שאינם אידיאליים שהתקבלו אגר: תוצאות נורמליות או צפויות אגר מוצגים בשורה העליונה (גרף בתרשים 8a ) להשוואה הנתונים הלא אידיאלי בשורה השנייה (גרף בתרשים 10b ). החפיפה הגרועה בין הנתונים לעקומה המותאמת בתרשים 10b פירושה שהעקומה המותאמת אינה מדגמת במדויק את נתוני הדיפוזיה; לכן, לא ניתן לפרש את הערכים המחושבים (מסומנים ב- *). זה יכול להיגרם על ידי בעיות עם microelectrode יון ( למשל, התחממות) או ISM ( למשל, תגובה איטית). פתרון בעיות: חילופי microelectrodes אחד בכל פעם, החל microelectrode iontophoresis. הקלטה = הקלטה או משפט; ייצור= המרחק בין ISM ו microelectroesis יון; Cb = ריכוז הבסיס; נ"צ D x1E5 = התיאורטי מקדם דיפוזיה חופשית x 10 5 (ס"מ 2 s -1) המבוסס על תקן טרום מחושב; n t = מספר התחבורה (מימדים); D (E5) = מקדם דיפוזיה חופשי נמדד x 10 5 (cm 2 s -1 ); R_app = ריווח microelectrode לכאורה (ס"מ) מבוסס על D נמדד התייחסות (E5); N לא ברור = מספר התחבורה לכאורה מבוסס על r_app . אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
בעוד הניסוי שמוצג באיור 8 ואיור 9 היו יציבה יון עובד microelectrode ו ISM, ישנם ניסויים רבים שבהם או או boMicroelectrodes th נמצאים בסכנה ואינם מניבים תוצאות אידיאליות. Microelectrode iontophoresis "נורמלי" TMA יש ערך של t n  0.3. איור 10a מדגים שלוש בעיות נפוצות עם microelectrode יון כי ניתן נתקל במהלך ניסויים RTI.
0.3. איור 10a מדגים שלוש בעיות נפוצות עם microelectrode יון כי ניתן נתקל במהלך ניסויים RTI.
שחרור נמוך. Iontophoresis microelectrode משחרר TMA מעט מאוד כאשר הטיה הנוכחית הנוכחית או הנוכחית מוחל, וכתוצאה מכך n t <0.1. הזרם עדיין עובר דרך קצה, אבל רוב זה מתבצע על ידי אניון Cl נכנס קצה מעט מאוד על ידי קטיון TMA לעזוב את קצה. אם t n הוא יציב בכמה משפטים רצופים, יכול לשמש microelectrodes iontophoresis אלה. עם זאת, זה לא מומלץ, שכן הם אינם מתפקדים בצורה אופטימלית, כלומר, נושאים נוספים עשויים להתפתח. הקיצון אפילו גדול יותרמתרחשת כאשר קצה microelectrode iontophoretic נחסם ואין יונים לעזוב או להזין את קצה. במקרה זה, שום עקומה לא תיווצר. במקרים כאלה, לאחר בדיקה כי כל החיבורים החשמליים הם בטוחים ומאובטחים, microelectrode יון צריך להיות מושלך.
שחרור גבוה (electroosmosis). בנוסף TMA, microelectrode iontophoresis משחרר גם מים, וכתוצאה מכך n t > 0.5. אם n t היא יציבה לאורך מספר ניסויים, microelectrodes iontophoresis אלה יכולים לשמש, אבל זה לא מומלץ, כמו בעיות נוספות עשויות להתפתח. הצעד היחיד לפתרון בעיות הוא לצמצם את הזרם הראשי. זה לפעמים מבטל שחרור מים וגורם n לא לרדת מתחת 0.5.
שחרור גובר ("התחממות"). במקרה זה, שחרור ה- TMA עולה עם הזמן. כאשר "התחממות" הוא מהיר,עקומת דיפוזיה יש צורה דומה לזה שמוצג באיור 10 ב , וזה לא יכול להיות מצויד באופן מהימן. במקרה זה, עקומת הדיפוזיה מדגימה עלייה איטית בריכוז ה- TMA בשלב הראשוני של הזרם המרכזי, וריכוז ה- TMA אינו מישור. התאמה לא אמינה יוצרת D לא מדויק מדויק, המשפיע על עקביות של מספר התחבורה הנמדדת וערכי r_app . כאשר "מתחמם" הוא יותר הדרגתי, זה לא יהיה השפעה משמעותית על הצורה של עקומות דיפוזיה פרט, אלא שהיא באה לידי ביטוי טי- n המגבירה מעל מחקרים עוקבים. מצב "התחממות" יכול לפעמים להיות מתוקן על ידי "פועם" microelectrode iontophoresis לתקופה של זמן (כ 30 דקות). זה נעשה על ידי לסירוגין בין זרם הטיה לבין זרם הראשי גבוה (+ 200 nA) במשך כמה שניות בכל פעם. אם microelectrode iontophoresis עדיין לא נותן stablE מספר התחבורה, עדיף פשוט לבדוק אחד חדש.
מדידה מדויקת של מספר התחבורה והיציבות במהלך הניסוי כולו חיוניים כדי להבטיח ערך מדויק עבור α . שמירה על המרווח בין microelectrodes הוא קריטי לקביעת α ו λ . אם המרווח משתנה לאחר מדידה, או agarose או במוח, המרחק קו ישר בין קצות microelectrodes יכול להיות נכנס לתוך גיליון הפלט ו reanalyzed על ידי וולטר. אם הערכים שונים מדי, יש למחוק את המדידה. תנודות טמפרטורה יכול גם להיות גורם תורם לאי דיוק, כך באמצעות בדיקה טמפרטורה מדויקת ואת החדר חימום החדר אמין אמין.
מיקרואלקטרודה iontophoresis הוא המקור השכיח ביותר של בעיות בטכניקה RTI; ביצוע ושימוש ISM יציב חיוני לקבלת נתונים טובים. הובעיה אפשרית עם ISM יכול להיות תגובה איטית, אשר יכול להיגרם על ידי עכבה גבוהה מאוד בקצה. עם ISM מגיב איטי, את כל microelectrodes יון ייראה יש אפקט "התחממות" ( איור 10 ב ), אבל העקומה נגרמת פשוט על ידי חוסר היכולת של ISM לזהות את שינוי ריכוזי TMA מהר מספיק. הגדלת המרחק בין microelectrodes (עד 150 מיקרומטר) יכול לאפשר זמן נוסף עבור ISM להגיב והוא יכול לשפר את עקומת הולם. תגובה איטית עשויה להצביע על כך מחליף יון נסוגה בתוך קצה. זה יכול להיראות תחת מיקרוסקופ המתחם, אם קיים, פירושו silanization היה גרוע, כי ISM חייב להיות מושלך. בנוסף, נסחף אות ISM יכול לגרום התאמות לא מדויקות של הנתונים. זה תלוי עד הנסיין כדי לקבוע אם הסחף משפיע על הנתונים מעבר סובלנות.
מגבלות RTI
Tהנה מספר מגבלות לשיטת ה- RTI, בגלל ההנחות שבבסיס ניתוח הנתונים. הנחות אלו כוללות דרישה להומוגניות רקמות ואיזוטרופי רקמות באזור המוח של עניין וכרך כדוריות המקיפות את האזור. בהקשר של RTI, הומוגניות רקמות דורש הפרמטרים דיפוזיה הם קבועים באזור של עניין. איסוטרופי רקמות פירושו שערך יחיד של D * חל על כל שלושת הצירים המרחביים. כל מולקולה ששוחררה מן microelectrode מקור לוקח נתיב אקראי לפני שהגיע למצב של הקלטה ISM. המתח על ה- ISM, המייצג את מספר המולקולות ( כלומר הריכוז) שנרשם בכל פעם, כולל מולקולות שנסעו בכל שלושת הצירים המרחביים, כמו גם כמה מולקולות שנסעו מעבר ל- ISM וחזרו למדידה נקודה ( איור 1 ג ). במהלך ניתוח נתונים RTI, התוכנית Walter GenerAtes ממוצע α ו λ , הכוללים את דיפוזיה של כל המולקולות נסיעה בכל הצירים ממקור נקודה ל- ISM. אם שיעור דיפוזיה שונה באופן משמעותי בכל אחד משלושת הצירים המרחביים (אניסוטרופיה) או אם הרקמה אינה הומוגנית, איסוף נתונים נוסף וניתוח נתונים נדרשים לחישוב α ו- λ 8 , 14 .
בנוסף לתנאים המוקדמים של הרקמה, שיטת ה- RTI דורשת שהרווח בין מקור נקודה ל- ISM, המכונה r , הוא בערך 80-130 מיקרומטר. כאשר r הוא ירד מתחת 50 מיקרומטר, התגובה ISM לא יכול להיות מהיר מספיק כדי להקליט שינויים תלויי דיפוזיה בריכוז של מולקולת בדיקה. זה עשוי להיות מתוקן בעתיד באמצעות ISMs קונצנטריים עם זמני תגובה מהירה יותר 10 , 15 . R גדול יותרמרחקים גם לצמצם את ההבדלים העצמאיים באזור המוח של הסביבה ECS, גודל עצה ISM, ופגיעה ברקמת המוח במהלך מיקום ISM. לעומת זאת, כאשר R הוא גדל מעבר 150 מיקרומטר, דיפוזיה של מולקולות ממקור הנקודה iontophoretic הוא רגיש יותר להשפעה על ידי גורמים שאינם איזוטרופיים, inhomogeneous סביב אזור המוח של עניין או גבול רקמות perfusate 14 .
שילוב RTI ו טכניקות חלופיות לחקור ECS
שיטת ה- RTI שייכת לקבוצה גדולה יותר של טכניקות המשתמשות בחקר מולקולרי כדי לחקור את ה- ECS; לכל שיטה יש יתרונות וחסרונות משלה. בעוד RTI מאפשר חישוב מדויק של α ו λ בזמן אמת, השיטה דורשת בדיקה מולקולארית טעונה כי ניתן לזהות על ידי מחליף יונים. בניסויים שבהם יונטופורזיס אינו מתאים, כגון מחקר של בדיקה לא נטענת, i אונטופורסיס עשוי להיות מוחלף על ידי פליטת לחץ. למרבה הצער, טכניקות הנוכחי אינם מאפשרים חישוב של α עם פליטת לחץ, כי נפח שפורסמו תלוי בתכונות של בינוני מוזרק 16 . כדי להשתמש בדיקה אשר מחליף לא קיים, בדיקה עשוי להיות מתויג fluorescently ואת הדיפוזיה באמצעות ECS נמדדת על ידי מיקרוסקופ epifluorescent. טכניקה זו, המכונה הדמיה אופטית אינטגרטיבית (IOI), מוגבלת על ידי גודל וזמינות של מולקולות שכותרתו fluorescently ואת פוטנציאל ספיגה 17 , 18 . הטכניקה IOI יש את היתרון כי מקרומולקולות יכול לשמש בדיקות, וזה גילה כי λ עולה עם גודל מולקולרי. לבסוף, מחלקה חשובה של שיטות דיפוזיה השתמשה radiotracers, אבל הם כבר לא בשימוש משותף 2 .
יישומים עתידיים של RTI
Ass = "jove_content"> שיטת ה- RTI יכולה להיות קשה לביצוע, והיא דורשת התמדה, אך היא כלי רב עוצמה לכימות השינויים המתרחשים בפרמטרים המתארים את ECS במוח. פרוטוקול זה מתאר את שיטת RTI כמו להחיל על פרוסות, אבל אפשר גם ליישם באופן אמין טכניקה זו vivo , הרחבת הפוטנציאל שלה 1 , 4 , 6 . זה יכול לשמש גם כדי לבדוק את ההשפעות של מגוון רחב של שינויים בפיזיולוגיה של המוח, כגון אלה המושרה על ידי שינויים בסביבה הכימית, פרמקולוגיה, טראומה, או נוקאאוט גנטי 1 . כל עוד השינוי המושרה ב ECS נמשך תקופה של כ 2 דקות או יותר, RTI יכול לספק כימות מדויק של חלק נפח ECS ו צרות.
בעוד תובנות משמעותיות על המבנה והתפקוד של ECS המוח נוצרו ב -50 השנים האחרונות, שםנשארות שאלות רבות ללא מענה. לדוגמה, עדיין לא ברור אם וכיצד מנגנונים הומיאוסטטיים להסדיר α וכיצד שינויים α להשפיע על תפקוד המוח. מודלים המחשב סייעו להעריך את התרומות היחסי של גיאומטריה התא וגורמים אחרים המשפיעים על λ , אבל יותר עבודה נדרשת 1 . לבסוף, תפקידה של ECS בפתוגנזה של מחלה נוירולוגית (ולהיפך) אינו נחקר במידה רבה. בעתיד הקרוב, מדידות RTI עשויות לשפר שיגור תרופות לאזורים ספציפיים במוח 19.
Disclosures
המחברים מצהירים כי אין להם אינטרסים פיננסיים מתחרים.
Acknowledgements
העבודה נתמכה על ידי NIH NINDS מענק R01 NS047557.
Materials
| Name | Company | Catalog Number | Comments |
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate - do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5mm x 16mm) |
| objective 5x dry | Olympus | MPlan N | |
| objective 10x water immersion | Olympus | UMPlan FL N | 10x objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
References
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C., Michael, A. C., Borland, L. M. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. , 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes, ., Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved