Method Article
네이티브 전기 영동, In-gel Assay 및 Electroelution으로 미토콘드리아 전자 수송 사슬의 수퍼 콤플렉스 분석
요약
이 프로토콜은 기능적 미토콘드리아 전자 수송 사슬 복합체 (Cx) IV와 그 복합체 (supercomplexes)의 분리를 기술하여 네이티브 전기 영동을 사용하여 어셈블리 및 구조에 대한 정보를 나타냅니다. 네이티브 젤은 면역 블로 팅 (immunoblotting), 겔 (in-gel) 분석법, 전기 분해 (electroelution)로 정제하여 개별 복합체를 추가로 특성 분석 할 수 있습니다.
초록
미토콘드리아 전자 수송 사슬 (ETC)은 다양한 연료의 분해로 인해 생성 된 에너지를 세포의 ATP 인 생물 에너지로 변환시킵니다. ETC는 respirasomes (CI, C-III, C-IV) 및 전자 전달 및 ATP 생산의 효율성을 증가시키는 synthasomes (CV)라고 불리는 supercomplexes로 조립되는 5 개의 거대한 단백질 복합체로 구성됩니다. ETC 기능을 측정하기 위해 50 년 이상 다양한 방법이 사용되었지만 이러한 프로토콜은 개별 복합체와 수퍼 콤플렉스의 조립에 대한 정보를 제공하지 않습니다. 이 프로토콜은 ETC 복잡한 구조를 연구하기 위해 20 년 이상 전에 수정 된 방법 인 고유 겔 폴리 아크릴 아미드 겔 전기 영동 (PAGE) 기술을 설명합니다. 네이티브 전기 영동으로 ETC 복합체를 활성 형태로 분리 할 수 있으며,이 복합체는 면역 블로 팅 (immunoblotting), 겔화 분석 (IGA) 및 전기 분해로 정제 할 수 있습니다. 다시 조합하여네이티브 젤 PAGE와 다른 미토콘드리아 분석 결과를 비교해 보면 ETC 활동, 동적 인 조립 및 분해, 그리고 이것이 미토콘드리아 구조와 기능을 어떻게 조절하는지에 대한 완성도를 얻을 수 있습니다. 이 작품은 또한 이러한 기술의 한계를 논의 할 것입니다. 요약하면, 네이티브 PAGE 기술은 면역 블로 팅, IGA, 전기 분해가 뒤 따르는 것으로 미토콘드리아 ETC 수퍼 콤플렉스의 기능과 구성을 조사하는 강력한 방법입니다.
서문
ATP 형태의 미토콘드리아 에너지는 세포 생존에 필수적 일뿐만 아니라 세포 사멸의 조절에도 필수적이다. 산화 적 인산화에 의한 ATP의 생성에는 기능적 전자 전달 사슬 (ETC, Cx-1 내지 IV) 및 미토콘드리아 ATP 신타 제 (Cx-V)가 필요하다. 최근의 연구에 따르면 이러한 큰 단백질 복합체는 respirasomes 및 synthasomes 1 , 2 라고 불리는 수퍼 콤플렉스로 구성되어 있습니다. 이러한 대규모 단지와 수퍼 콤플렉스의 조립, 역학 및 활동 규제를 분석하는 것은 어려운 일입니다. 분광 광도계를 사용하여 수행 한 산소 전극 및 효소 분석으로 얻은 산소 소비 측정은 ETC 복합체 활성에 대한 유용한 정보를 제공 할 수 있지만이 분석법은 관련된 단백질 복합체 또는 수퍼 콤플렉스의 존재, 크기 및 하위 구성에 관한 정보를 제공 할 수 없습니다. 그러나, 청색 및 투명한 천연 (BN 및 CN) PAGE 3 은 복잡한 구성 및 조립 / 해체에 대한 중요한 정보와 생리 및 병리학 적 조건 하에서 이들 중요한 호흡 복합체의 초분자 조직의 동적 조절에 대한 강력한 도구를 창출했습니다.
이러한 복합체를 고차 수퍼 콤플렉스로 조립하면 미토콘드리아 구조와 기능을 조절하는 것으로 보인다 5 . 예를 들어 respirasome assembly는 전자 이동의 효율과 미토콘드리아 내부 막을 가로 지른 양성자 원동력의 생성을 증가시킵니다 5 . 또한, synthasomes의 조립은 ATP 생산의 효율과 세포질 2 로의 에너지 등가물의 전달을 증가시킬뿐만 아니라 미토콘드리아 내부 막을 관상의 cristae 6 로 몰드시킨다 </ sup> 7 . 마우스 배아에서 심장 발달 중 supercomplex assembly에 대한 연구는 심장에서 Cx-I- 함유 supercomplexes의 생성이 대략 배아 일 13.5 8 에서 시작한다는 것을 보여준다. 다른 사람들은 노화 또는 허혈 / 재관류 손상으로 인해 Cx-I- 함유 수퍼 콤플렉스의 양이 심장에서 감소하거나 신경 퇴행성 질환의 진행에 중요한 역할을 할 수 있음을 보여주었습니다 11 .
이 프로토콜은 ETC 복합체 및 supercomplexes의 조립 및 활동을 조사하는 데 사용할 수있는 원시 젤 페이지에 대한 방법을 설명합니다. 미토콘드리아 supercomplexes의 대략 분자량은 CN 또는 BN polyacrylamide 젤에 단백질 복합체를 분리하여 평가할 수 있습니다. CN PAGE는 또한 겔에서 직접적으로 모든 미토콘드리아 복합체의 효소 활성을 시각화합니다 (in-gel assay;IGA) 12 . 이 연구는 IGA를 통해 NADH를 산화시키는 Cx-I의 능력과 IGA에 의한 Cx-V의 ATP 가수 분해 활성으로 인한 신타 소솜의 존재를 강조함으로써 호흡기 활동을 입증합니다. Cx-I 및 Cx-V를 함유 한 복합체 및 수퍼 콤플렉스는 또한 단백질을 니트로 셀룰로오스 멤브레인으로 옮기고 면역 블로 팅을 수행함으로써 입증 될 수있다. 이 방법의 장점은 일반적으로 BN 또는 CN PAGE가 생리 학적 크기 및 조성을 기반으로 단백질 복합체를 분리한다는 점입니다. 멤브레인으로의 전달은 이러한 밴드 패턴을 보존합니다. BN 또는 CN PAGE에서 단백질 복합체를 분석하는 것은 2D-PAGE (Fiala 등 13 참조) 또는 자당 밀도 원심 분리 14 , 15 를 사용하여 수행 할 수 있습니다. 특정 밴드를 추가로 분석하기 위해 BN PAGE에서 추출 할 수 있으며이 단백질 복합체의 단백질을 정제 할 수 있습니다d. 네이티브 전기 분해는 몇 시간 내에 수행 될 수 있는데, 이것은 겔로부터 주변 완충액으로의 단백질의 수동 확산 (참조 문헌 16에서 사용 된 바와 같이)에 상당한 차이를 만들 수있다.
요약하면, 이들 방법은 미토콘드리아 막으로부터의 고 분자량 수퍼 콤플렉스의 추가 특성 결정을 가능하게하는 몇 가지 접근법을 기술한다.
프로토콜
모든 실험은 C57BL / 6N 마우스 (야생형)의 심장을 사용하여 수행 하였다. 쥐는 자궁 경부 전위 이전에 이산화탄소로 마취되었고, 모든 절차는 로체스터 대학의 실험실 동물 의학부에 따라 주법, 연방 법령 및 NIH 정책에 따라 엄격하게 수행되었다. 의정서는 로체스터 대학 동물 동물 보호 및 사용위원회 (동물 자원위원회)의 승인을 받았습니다.
1. CN 및 BN 페이지
참고 : BN 및 CN PAGE에 사용되는 모든 장비는 세제가 없어야합니다. 이것을 보장하기 위해 모든 장비를 0.1M 염산으로 씻은 다음 탈 이온화 된 H 2 O로 광범위하게 헹구십시오.
- 예비
- 4 ° C에서 25 MM imidazole, pH 7.0으로 구성된 양극 완충액을 준비하십시오. 4 ° C에서 보관하십시오.
- CN 또는 BN PAGE 용 음극 완충액을 준비하십시오.
- CN PAGE의 경우 7.5 mM imidazole과 50 mM tricine을 사용하십시오. 1 리터의 완충액에 sodium deoxycholate 0.5g과 lauryl maltoside 0.2g을 넣는다. 4 ° C에서 7.0으로 pH를 조정하고 4 ° C에서 보관하십시오.
- BN PAGE의 경우, 7.5 mM imidazole과 50 mM tricine을 사용하고 4 ℃에서 7.0으로 pH를 조정한다. 4 ° C에서 보관하십시오.
- 하늘색 BN 음극 완충액의 경우, 7.5 mM imidazole과 50 mM tricine을 사용하십시오. 4 ° C에서 7.0으로 pH를 조정하고 완충액 1 리터당 20 mg의 쿠마시를 첨가한다. 4 ° C에서 보관하십시오.
- 50 MM NaCl, 50 MM 이미 다졸, 2 MM aminocaproic 산성 및 1 MM EDTA로 추출 버퍼 (EB)를 준비합니다. 4 ° C에서 7.0으로 pH를 조정하고 4 ° C에서 보관하십시오.
- 75 MM 이미 다졸과 1.5 M 아미노 카프로 산과 함께 3X 젤 버퍼 (BN 및 CN 젤에 사용)를 준비합니다. 4 ° C에서 7.0으로 pH를 조정하고 4 ° C에서 보관하십시오.
- 0.01g의 Ponceau S, 5g의 글리세롤, 5mL의 H 2 O 로딩 완충액 (LB)을 준비하십시오.온도.
- 500 mM 6- 아미노 헥산 산 1 mL에 50 mg의 쿠마시를 첨가하여 쿠마시 블루를 준비한다. 4 ° C에서 7.0으로 pH를 조정하고 4 ° C에서 보관하십시오.
- H 2 O에서 20 mM과 200 mM 라 우릴 말 토 시드를 준비한다. 분량을 200 μL로하여 냉동 보관한다. 사용하기 전에 세제를 해동하십시오.
| 3 % ~ 8 % (미니) | 4 % ~ 10 % (맥시) | |||
| 0.5 젤 (밝은) | 0.5 젤 (무거운) | 0.5 젤 (밝은) | 0.5 젤 (무거운) | |
| AAB (mL) | 0.42 | 1.3 | 2.5 | 7.7 |
| CN / BN 완충액 (mL) | 1.6 | 1.6 | 8.5 | 8.5 |
| H2O (mL) | 2.7 | 1.4 | 14 | 6.3 |
| 글리세롤 (g) | 0 | 0.47 | 0 | 2.5 |
| 부피 (mL) | 4.72 | 4.77 | 25 세 | 25 세 |
| APS (μL) | 27 | 27 | 65 | 65 |
| TEMED (μL) | 4 | 4 | 10 | 10 |
표 1 : 미니 또는 맥시 (Maxi-PAGE) 1 개를 주입 할 때 필요한 성분의 양. 이 표에 사용 된 부피는 1 최소 또는 최대 맥 1 겔, 1.5 mm 두께로 계산됩니다. AAB의 부피는 40 % 저장 용액을 기준으로합니다. 가볍고 무거운 것이 집중자를 가리킨다.AAB의 이온. 그라디언트 믹서의 각 컬럼을 AAB 용액으로 채운 후에 APS 및 TEMED를 첨가한다.
- 쏟아져 흐르는 젤
참고 : CN 또는 BN 젤에 3-8 % 또는 4-10 % 아크릴 아미드 / 비스 아크릴 아미드 (AAB) 그라디언트를 각각 사용하십시오. 표 1 은 미니 젤 (폭 85mm x 높이 73mm x 두께 1.5mm) 또는 맥시 겔 (160mm) 용으로 사용 된 완충액, AAB, H 2 O, 글리세롤, 암모늄 퍼 술 페이트 (APS) 및 테트라 메틸 에틸렌 디아민 (TEMED) 폭 x 높이 200 mm x 두께 1.5 mm). CN 또는 BN 겔을 사용한 유리판 어셈블리는 1x 젤 버퍼가 몇 mL 인 백에서 냉장 보관하거나 저장 용 1x 겔 버퍼로 적신 페이퍼 타월로 싸서 보관할 수 있습니다. 젤은 최대 일주일 동안 사용하기에 안정적입니다.- 겔을 부어 넣으려면 겔이 중력에 의해 준비된 젤 챔버로 흐를 수 있도록 상승 된 교반 판에 그라디언트 믹서를 놓습니다.
- 그라디언트 믹서의 유출 챔버를 4.77 / 25 mL로 채우십시오 (미니 / 맥시) (AAB의 농도가 더 높음).
- 가볍고 가벼운 챔버 사이의 스톱 코크 연결부를 부드럽게 열고 한 방울의 용액이 다른 쪽을 통과하도록하십시오.
참고 : 이것은 연결 튜브와 스톱 콕에서 공기 방울을 밀어내어 두 챔버 사이의 흐름을 막습니다. 동등한 압력으로 버블이 움직이는 것을 막을 수 있기 때문에 양측이 이미 채워져 있다면이를 수행 할 수 없습니다. - 그라디언트 믹서의 다른 챔버를 4.72 / 25 mL (mini / maxi)의 가벼운 용액으로 채 웁니다.
- 무거운 솔루션과 유출 챔버에 저어 막대를 놓고 감동 시작. 버블 링을 일으키지 않는 교반 막대 속도를 사용하십시오.
- 각 chamber에 APS와 TEMED를 신속하게 첨가하여 중합을 시작하십시오.
- 그라디언트 믹서의 두 챔버 사이의 연결을 열고 유출 챔버를 열기 전에 젤을 부어 수 초 동안 혼합을 허용하십시오.
참고 : Gravity wi두 챔버 모두 똑같이 배수하고, 무거운 용액에 빛을 혼합하면 아크릴 아마이드 밀도가 겔의 바닥에서 상단으로 서서히 감소합니다. 그라디언트 믹서에있는 전체 내용물을 사용하여 젤을 부으십시오.- 마지막에 조심스럽게 빗을 넣고 거품과 섞임을 피하기 위해 겔을 넣으십시오.
- 즉시 에탄올로 그라디언트 믹서를 씻어 젤을 헹구십시오. 물로 헹구고 두 번째 젤을 부으십시오. 겔을 중합 시키십시오 (보통 mini-gel에는 20 분 미만이 필요합니다).
- 젤을 실행하려면 전극 어셈블리 클램프에 장착하고 중앙 또는 상부 챔버를 CN 또는 연한 파란색 BN 음극 완충액으로 채 웁니다. 외부 / 하부 챔버에 양극 버퍼를 추가하기 전에 누출 여부를 확인하기 위해 몇 분 기다립니다.
- 부드럽게 잘 빗을 꺼내 주사기 또는 피펫을 사용하여 음극 버퍼와 우물을 씻으십시오.
- 차가운 방 (4 ° C)에서 젤을 실행하거나 완전히 얼음으로 포장.
- CN 미니 페이지의 경우 처음 1 시간 동안 100V를 사용하고 완료 될 때까지 200V를 사용합니다. 일반적으로 추가로 1-1.5 시간이 소요됩니다. 또는 CN 미니 페이지를 30-40 V에서 밤새 실행하십시오.
참고 : 여기서는 고 분자량 단백질 복합체에 중점을두고 있으므로 분자량이 140 kDa 미만인 단백질 복합체가 젤을 모두 소모합니다. 저 분자량 복합체를 유지하기 위해 전기 영동을위한보다 짧은 운전 시간을 사용할 수 있습니다. - BN 맥시 - 페이지 (BN maxi-PAGE)의 경우, 100V를 사용하고 밤새 (약 18 시간) 젤을 흐르게하십시오.
참고 : 전류가 매우 낮아 (<15mA), 이러한 조건을 처리 할 수있는 전원 공급 장치가 필요합니다. 이 시점에서 젤은 IGA 또는 면역 블로 팅에 사용할 수 있습니다. 경우에 따라 전기 분해를 위해 유리판에 면도날을 사용하여 밴드 또는 레인을 젤에서 잘라낼 수 있습니다.
- CN 미니 페이지의 경우 처음 1 시간 동안 100V를 사용하고 완료 될 때까지 200V를 사용합니다. 일반적으로 추가로 1-1.5 시간이 소요됩니다. 또는 CN 미니 페이지를 30-40 V에서 밤새 실행하십시오.
- 샘플 준비
참고 : 멤브레인 바인딩 된 mitochondrial supercomplexes는에서 추출해야합니다내부 미토콘드리아 막. 미토콘드리아 supercomplexes을 보존하기 위하여는, 신선한 격리 한 mitochondria 또는 동결되고 해빙 된 견본을 한 번만 사용하십시오. 아래의 계산 / 부피는 미니 젤 (1.5 ㎜ 두께의 겔에서 10 웰 빗의 웰은 35-40 μL까지 유지) 및 맥시 겔 (15 웰 빗의 웰은 200 μL). 또한, 각 시료의 분량 (보통 10 μL)을 저장하여 로딩 제어로서 전압 의존성 음이온 채널 (VDAC)을 검출하기위한 변성 SDS 겔에서 작동시킵니다.- 4 ℃에서 10-15 분 동안 17,000 xg에서 원심 분리하고 마이크로 튜브에 분리 된 미토콘드리아 또는 조직 균질 액을 적절한 양 ( 예 : 미니 젤의 경우 10-50 μg 및 맥시 - 젤의 경우 50 - 200 μg)에 놓습니다.
참고 :이 단계는 일부 가용성 mitochondrial 매트릭스 및 / 또는 cytosolic 단백질을 제거합니다. - 흡인하고 뜨는 버리고 원하는 양의 추출 버퍼를 추가하십시오젤에로드합니다. 부드럽게 얼음에 침전물을 다시 일시 중지하십시오. 원할 경우이 시점에서 일반적인 프로테아제 억제제 혼합물을 첨가하십시오.
참고 : 여기에 사용 된 장비를 기준으로 mini-gel에는 30 μL를, maxi-gel에는 100 μL를 사용하여 단백질 / 완충 용액 비율을 완충 용액 1 μL에 대해 2 μg 이하로 제한했습니다. - 세제를 첨가하십시오 ( 예 : 2 μg의 라 우릴 말 토 시드 / 1 μg의 단백질; 자세한 정보는 대표 결과 및 토론 참조).
참고 : 일반적으로 라 우릴 말 토 시드가 사용되지만 digitonin도 사용할 수 있습니다. - 얼음 위에서 20 분 동안 품어 낸다. 처음에는 가볍게 혼합하고 가끔 배양 중에 튜브를 가라 앉히거나 교반합니다.
- 4에서 10 분 동안 17,000 XG에서 원심 분리기 ° C 모든 막과 조직 조각을 제거합니다.
- 상층 액을 새 튜브로 옮긴다. CN 샘플의 경우 10 μL의 샘플 볼륨마다 1 μL의 LB를 첨가하십시오. 샘플의 총 볼륨은 app이어야합니다.미니 젤의 경우 약 40 μL, 맥시 겔의 경우 130 μL입니다. BN 샘플의 경우 염료와 세제의 비율이 1 : 4 (w / w)가되도록 샘플에 쿠마시를 넣으십시오.
- 샘플을 최소 또는 최대 겔의 웰에 각각 30 및 120 μL 씩 넣으십시오. 로딩 컨트롤로 VDAC를 검출하기 위해 변성 SDS 겔에 대한 각 샘플에서 나머지 10 μL를 사용하십시오.
- 분자량 마커를 준비하려면 BN / CN 젤 완충액 60 μL에 고 분자량 보정 믹스 (자세한 내용은 표 참조) 1 병을 용해시키고 120 μL의 H 2 0 및 20 μL LB. 1 차선 당 15 μL를로드하십시오.
- 단계 1.2.9.2에서 설명한대로 젤을 실행하십시오.
- 4 ℃에서 10-15 분 동안 17,000 xg에서 원심 분리하고 마이크로 튜브에 분리 된 미토콘드리아 또는 조직 균질 액을 적절한 양 ( 예 : 미니 젤의 경우 10-50 μg 및 맥시 - 젤의 경우 50 - 200 μg)에 놓습니다.
2. Cx-I 및 Cx-V에 대한 In-gel 분석
참고 : 분석은 실온에서 수행됩니다. 문서화를 위해 개발중인 밴드의 사진, 스캔 또는 이미지를 촬영하십시오. (중요) 단백질은 전송할 수 없습니다o IGA를 완료 한 후 니트로 셀룰로스 멤브레인.
- Cx-1 분석
- 예비.
- pH 7.4의 H 2 O에 5mM Tris의 분석 완충액을 준비한다. 상온에서 보관하십시오.
- 1 mL의 분석 완충액에 10 mg의 NADH를 녹인다. 사용하기 전까지 -20 μC에서 100 μL 분취 량으로 보관하십시오. 동결과 해동을 피하십시오.
- 마이크로 튜브에 Nitroblue tetrazolium 25 mg을 달아보십시오.
- 95 mL의 H2O에 5 mL의 아세트산을 희석하여 고정액을 준비한다; 상온에서 보관하십시오.
- 분석 수행.
- Nitroblue tetrazolium 25mg (최종 농도 : 2.5mg / mL)과 10mg / mL NADH (0.1mg / mL) 100μL와 함께 분석 완충액 10mL를 합칩니다. 이것을 CN 젤에서 절제 한 전체 겔, 차선 또는 관심 영역에 첨가하십시오.
참고 :이 작업은 투명 플라스틱 또는 유리 용기에서 수행 할 수 있습니다. BN PAGE 후에는이 분석을 수행 할 수 없습니다. - 3 분 이상 부드러운 교반 (로커) 후 파란색 띠의 발달을 따라하십시오.
- 겔을 아세트산 용액 10 - 20 mL에 넣거나 5 mM Tris, pH 7.4로 씻어서 반응을 멈춘다. 문서화를 위해 사진을 찍으십시오 (재료 표 참조).
- Nitroblue tetrazolium 25mg (최종 농도 : 2.5mg / mL)과 10mg / mL NADH (0.1mg / mL) 100μL와 함께 분석 완충액 10mL를 합칩니다. 이것을 CN 젤에서 절제 한 전체 겔, 차선 또는 관심 영역에 첨가하십시오.
- 예비.
- Cx-V 분석
참고 : Cx-V 분석은 중복 CN 또는 BN 젤을 사용하여 수행해야하며, Cx-V- 독립적 활동을 입증하기 위해 5 μg / mL oligomycin (Cx-V 억제제)과 함께 배양합니다.- 예비.
- 35 MM 트리스와 270 MM 글리신과 분석 버퍼를 준비; 실온에서 pH를 8.3으로 조정한다. 완충액을 50mL 분량으로 냉동 보관하십시오. 그러나 동결 및 해동 후 pH를 확인하십시오.
- H 2 O 중 1M MgSO 4 를 준비한다. 사용하기 전까지 4 ° C에서 보관하십시오.
- Pb (NO 3 ) 2 27.28mg을 마이크로 튜브에 넣습니다.
- ATP 60mg을 마이크로 튜브에 넣습니다.
- 1 mg의 o를 용해시킨다.1 mL의 에탄올에 용해시켰다. 사용하기 전까지 -20 ° C에서 보관하십시오.
- 50 mL의 메탄올과 50 mL의 H2O를 혼합하여 고정액을 준비한다; 상온에서 보관하십시오.
- 분석 수행.
- 분석 버퍼 ± 5 μg / ML oligomycin 10-20 ML에 부드러운 교반 (로커)와 2 시간 BN 또는 CN 젤에서 관심의 겔, 차선, 또는 관심 영역을 품어 (50-100 μL 1 MG / mL)을 실온에서 첨가 하였다.
- 배양 후 버퍼를 14 mL의 새로운 분석 완충액으로 교체하고 1 M MgSO 4 (14 mM) 190 μL, Pb (NO 3 ) 2 (5 mM) 27.28 mg, ATP 60 mg 8 mM) 및 올리고 마이신 75 μL (필요한 경우).
- oligomycin으로 처리 한 젤의 밴드가 Cx-V 의존성이 아닌 밴드를 제공하므로 부드러운 교반 (로커)으로 품어두고 흰색 침전물을 관찰합니다.
참고 : 침전물의 모양은 몇 시간이 걸릴 수 있습니다. - 겔을 메탄올 -( 예 : 50 % 메탄올), 산성 용액이 납 침전물을 녹일 것이기 때문이다. 결과를 사진으로 찍으십시오.
참고 : 납 침전물은 겔의 쿠마시 염색을 방해하지 않습니다.
- 예비.
3. Nitrocellulose 또는 Polyvinylidene Difluoride (PVDF) 멤브레인으로 단백질 전달
- 25 MM 트리스와 200 밀리그램 글리신의 전송 버퍼를 준비합니다. pH를 8.3으로 조정하고 0.0005 g / L SDS와 200 mL / L 메탄올을 첨가한다. 실내 온도에 보관하십시오.
- 면도날이나 가위로 니트로 셀룰로오스 또는 PVDF 막 (기공 크기 : 0.45 μm)을 젤 크기보다 약간 큰 크기로 자릅니다.
참고 : 니트로 셀룰로오스 멤브레인은 Ponceau S 염색이 단백질 로딩을 평가하는 반면 PVDF 멤브레인은보다 명확하게 정의 된 밴드를 산출합니다.
- 면도날이나 가위로 니트로 셀룰로오스 또는 PVDF 막 (기공 크기 : 0.45 μm)을 젤 크기보다 약간 큰 크기로 자릅니다.
- 실험 계획안.
- 니트로 셀룰로오스 막, 여과지 및 스폰지를전송 버퍼에서 최소 10 분. PVDF 막을 15 초 동안 100 % 메탄올에 넣거나 전달 버퍼에 넣기 전에 제조업체의 권장 사항에 따라 배치하십시오. 트랜스퍼 버퍼가있는 평평한 그릇에 트랜스퍼 키트의 오픈 카세트를 놓습니다.
- 카세트의 뒷면에 스폰지와 1-2 개의 여과지를 놓습니다. 거품을 제거하십시오.
- 젤을 여과지 위에 놓습니다. 겔 및 / 또는 멤브레인의 모서리 부분을 클리핑하여 겔의 방향을 나타냅니다.
- 멤브레인을 젤 위에 올려 놓습니다. 모든 거품을 제거하십시오.
- 멤브레인 위에 필터 종이와 스폰지를 놓습니다. 이 샌드위치에있는 모든 거품을 제거하십시오.
- 카세트를 닫고 전송 키트의 카세트 홀더에 넣으십시오.
- 단백질을 25V에서 약 12-18 시간 동안 옮긴다.
4. 면역 블로 팅
- 예비.
- Ponceau Stain (500 mL)에 25 mL의 아세트산 및 0.5 g의 폰 소우 S를 475 mL의 H2O에 첨가하고; 실온에서 보관하십시오 (재사용 가능).
- 200 MM NaCl, 25 MM 트리스 -베이스, 및 2.7 MM KCl와 Tris - 버퍼 식염수 (TBS)를 준비합니다. pH를 8.0으로 조정하고 실온에서 보관하십시오.
- TBS에 0.5 mL / L Tween 20을 첨가하여 TBS-tween (TBST)을 준비하십시오. 상온에서 보관하십시오.
- TBST 100 mL에 5 g의 고형 우유를 녹여서 우유 고형분 / TBST를 준비한다. 4 ° C에서 보관하고 3 일 이내에 사용하십시오.
- 3 g의 소 혈청 알부민 (BSA, 분획물 V)을 TBST 100 mL에 녹여 BSA / TBST를 준비한다. 4 ° C에서 보관하고 3 일 이내에 사용하십시오.
- 실험 계획안.
- 전송이 완료되면, 모든 전송 된 단백질을 시각화하기 위해 Ponceau S 솔루션에 막을 놓습니다. 멤브레인의 마커 위치를 연필로 표시하고 Ponceau-S-stained membrane을 사진 또는 스캔으로 기록합니다.
- 각 10 분 동안 멤브레인을 3 번 씻으십시오.TBS를 부드럽게 흔들어 준다.
- 멤브레인을 우유 고형물 / TBST로 상온에서 1 ~ 2 시간 동안 또는 온화한 교반하에 차가운 방에서 밤새 차단하십시오.
- 완만하게 교반하면서 TBST로 10 분 동안 막을 씻으십시오.
- 온화한 교반하에 차가운 방에서 밤새 일차 항체와 함께 품어 라. BSA / TBST에서 항체 ( 예 : 1 : 1,000의 항 ATP5A 및 -NDUFB6)를 희석하십시오.
참고 : 대부분의 항체는 하룻밤 배양하면 원래 젤의 막에 더 좋은 신호를줍니다. - 완만하게 교반하면서 TBST로 10 분 동안 막을 씻으십시오.
- 상온에서 최소한 60 분 동안 2 차 항체와 함께 항온 처리한다. 우유 고형물 / TBST로 항체 (1 : 5,000에서 1 : 50,000)를 희석하십시오.
- TBST로 부드럽게 교반하면서 상온에서 10 분 동안 3 번 멤브레인을 씻으십시오.
- 마지막 세척하는 동안, manufa의 지시에 따라 향상된 chemoluminescence (ECL) 기판을 준비cturer.
- 제조 업체가 제공 한 지침을 사용하여 ECL 기판과 멤브레인을 품어.
- ECL 기판 제조업체가 제공 한 지침을 사용하여 필름의 신호를 감지합니다.
5. 전기 분해
- 예비.
- 25 mM tricine, 3.75 mM 이미 다졸 (pH 7.0, 4 ℃) 및 5 mM 6- 아미노 헥산 산의 용출 완충액을 준비한다.
참고 : 외부 단백질 오염을 방지하기 위해 전기 장비와 멤브레인 캡을 취급하는 동안 항상 장갑을 착용하십시오.
- 25 mM tricine, 3.75 mM 이미 다졸 (pH 7.0, 4 ℃) 및 5 mM 6- 아미노 헥산 산의 용출 완충액을 준비한다.
- 네이티브 electroelution에 대한 electroeluter를 사용하기 전날에 다음을 수행하십시오.
- 60 ° C에서 1 시간 동안 용리 완충액에 멤브레인 캡 (컷오프 : 3.5 kDa)을 담급니다. 새 용출 완충액으로 뚜껑을 옮기고 냉장고에 12 시간 이상 담근다.
참고 : 3.5 kDa의 컷 - 오프 분자량은 작은 p의 손실을 방지한다관심있는 단백질 복합체에서 쉽게 해리 될 수있는 로틴 (roteins). - 전기 분해기 모듈, 유리 튜브, 탱크 및 뚜껑을 에탄올로 완전히 씻으십시오. 물로 헹구고 장비를 말리십시오.
- 60 ° C에서 1 시간 동안 용리 완충액에 멤브레인 캡 (컷오프 : 3.5 kDa)을 담급니다. 새 용출 완충액으로 뚜껑을 옮기고 냉장고에 12 시간 이상 담근다.
- 기본 전기 분해의 날에 다음을 수행하십시오.
- 사용할 각 유리 튜브의 바닥 (프 로스트)에 프릿을 놓습니다. 필요한 경우 유리 튜브를 용리 완충액에 넣고 프릿을 튜브의 안쪽에서 아래쪽으로 밀어 넣습니다.
- 유리 재 튜브가있는 유리 튜브를 전기 에너지 모듈에 밀어 넣으십시오. 용출 완충액으로 그로밋을 적신 다음 유리관을 제자리로 밀어 넣으십시오. 유리 튜브의 윗부분이 그로밋과 평평한 지 확인하십시오.
- 스토퍼로 빈 그로밋을 닫습니다.
- 실리콘 어댑터 바닥에 젖은 멤브레인 캡을 놓고 어댑터를 용리 완충액으로 채 웁니다. 어댑터의 버퍼를 천천히 피펫 팅하여 투석막 주위의 기포를 제거하십시오.
- 버퍼 채워진 어댑터를 유리 튜브의 바닥에 밀어 넣으십시오. 유리 튜브 안의 유리에 나타나는 모든 거품을 제거하십시오.
- 용리 완충액으로 각 유리관을 채 웁니다.
- BN PAGE의 절취 된 밴드를 유리 튜브에 넣으십시오 (1.2.9.3 단계 참조). 큰 조각을 작은 조각으로 자릅니다. 유리 튜브 내의 충전 높이가 약 1cm인지 확인하십시오.
- 전체 모듈을 탱크에 넣으십시오.
- 약 600 mL의 차가운 용리 완충액을 탱크에 첨가한다. 투석 막에 거품이 생기지 않도록 실리콘 어댑터 캡이 버퍼에 있는지 확인하십시오.
- 탱크 하단에 저어 막대를 놓습니다.
참고 : 교반하면 거품이 투석 막 바닥에 달라 붙지 않습니다. - 콜드 룸에서 350 V에서 4 시간 동안 단백질을 용출시킨다.
- 용리가 완료된 후 완충액 탱크에서 전기 에너지 모듈을 꺼내 싱크대 또는 보울에 넣으십시오.
- 마개가 사용 된 경우에는 마개를 사용하여 드라상부 버퍼 챔버에서. 그렇지 않으면 큰 피펫을 사용하여 버퍼를 제거하십시오.
- 각 유리 튜브에서 버퍼를 제거하고 버립니다. 실리콘 어댑터가 제 위치에 유지되고 프릿 아래의 액체가 방해 받거나 흔들리지 않도록하십시오.
- 조심스럽게 유리 어댑터의 바닥에서 멤브레인 캡과 함께 실리콘 어댑터를 제거합니다. 마이크로 튜브에 실리콘 캡의 내용물 (약 400 μL)을 채 웁니다. 용리 완충액 200 μL를 추가로 실리콘 뚜껑을 헹구고 마이크로 튜브에 추가하십시오. 모든 유리 튜브에 대해 반복합니다.
- 멤브레인 캡을 재사용 할 수 있으므로 0.5 mg / mL sodium azide가 포함 된 용리 완충액에 멤브레인 캡을 보관하여 보존하십시오. 그들을 냉각하십시오.
참고 : 용리액은 단백질 농도가 낮으며 원심 분리 필터 장치를 사용하여 농축 할 수 있습니다.
결과
미토콘드리아 supercomplexes를 시각화하기 위해 쥐에서 새로 격리 mitochondria가 사용되었다 17 , 18 . Mitochondrial supercomplexes는 일부 연구자들에게는 용인 될 수 있지만, 분해 및 해동의 반복주기에 민감합니다. 보관을 위해 동결이 필요한 경우 최상의 결과를 얻으려면 샘플을 한 번 이상 동결 및 해동하지 않아야합니다.
미토콘드리아 ETC 복합체를 BN PAGE로 시각화하기 위해 분리 된 심장 미토콘드리아의 단백질 100 μg을 4-10 % 젤에 로딩했다 ( 그림 1A ). 로딩 및 음극 완충액의 쿠마시 스테인은 실행 중 단백질 복합체를 표지하기에 충분합니다. 대비를 디지털 방식으로 증가시킨 후에 수퍼 콤플렉스가 나타납니다 (표시되지 않음). CN PAGE의 경우 20 μgf 단백질은 분리 된 미토콘드리아로부터 3 내지 8 % CN 겔 상에 로딩되고 분리되었다 ( 도 1B ). CN PAGE를 Coomassie로 염색하고 단백질 복합체를 시각화하기 위해 제거 하였다. 명암을 디지털 방식으로 증가시킨 후에, Cx-I의 단량체보다 큰 분자량을 갖는 여러 단백질 복합체가 나타났다 ( 그림 1B , 오른쪽). 사용 된 AAB의 농도는 가장 큰 수퍼 콤플렉스가 우물로부터 단지 겔로 들어가는 것을 허용했습니다. 그러나, 3 % 미만의 AAB의 그래디언트로 끝나는 겔은 이동 또는 밴드 또는 레인을 절제하기에 충분히 안정하지 못합니다. 또한, 3-8 % CN 젤의 상부 부분에있는 AAB의 낮은 농도는 단백질 복합체의 일부 이동성을 유지합니다. 이는 고유의 전기 분해를 고려할 때 중요합니다 19 .
Cx-I의 단량체 및 수퍼 콤플렉스 및 C의 단량체, 이합체 및 수퍼 콤플렉스xV는 효소 적으로 활성이며 IGA ( 그림 1C- F )로 시각화 할 수 있습니다. 이 분석은 분리 된 심장 미토콘드리아에서 Cx-1과 Cx-V가 각각의 단량체보다 큰 단백질 복합체에 존재 함을 보여줍니다. Cx-I에 대한 IGA 분석에서 NADH는 산화되고 전자는 nitroblue tetrazolium을 감소시키기 위해 전달된다. 이것은 Cx-I 단량체와 Cx-I 함유 호흡기 / 수퍼 콤플렉스의 분자량에서 국부적 인 청색을 낳는다 ( 그림 1C ). Cx-V의 활성은 F1 서브 유닛이 ATP를 가수 분해하는 능력으로부터 평가되며, CN 또는 BN 겔을 사용하여 수행 될 수있다 ( 도 1D- F ). 이 반응에서 생성 된 ADP는 납과 상호 작용하여 Cx-V 단량체, 이합체, 신타 소솜 및 하위 복합체 (Cx-V의 조립되지 않은 F1 부분 일 가능성이 높음)의 수준에서 흰색 침전물을 생성합니다. 올리고 마이신은 l이 밴드가 abeling되어 Cx-V가 포함되어 있음을 확인했습니다 ( 그림 1E ).
여기에 설명 된 모든 실험에서 양성 이온 성 세제 인 lauryl maltoside는 2 μg / 1 μg의 단백질 농도로 사용되었으며, 이는 일관되고 재현성있는 결과를 제공하면서 수퍼 콤플렉스를 보존하는 가능한 최고 농도입니다 ( 그림 1F ). 그러나 라 우릴 말 토 시드의 효과는 로트 번호, 저장 조건 및 나이에 달려 있습니다. 따라서 한 실험실에서 사용 된 정확한 농도는 원고에서보고 된 농도와 반드시 동일하지는 않습니다. 세제의 적절한 농도는 멤브레인을 가용화하지만 복합체와 수퍼 콤플렉스는 손상시키지 않고 다양한 농도의 라 우릴 말 토 시드 ( 그림 1F )를 사용하여 결정해야합니다. CN PAGE의 경우, 웰당 40 μL의 총 샘플 부피가 준비되었다여기에 단백질 / 세제 비율 1 μg / 2 μg 또는 세제 / 버퍼 비율 1 μg / 1 μL (1.9 mM과 동일)가됩니다. 40 μL에서 미니 젤의 각 웰당 30 μL가 적용되었습니다. 나머지는 로딩 대조군 인 VDAC의 검출을위한 분액으로 사용되었다 ( 도 2D ).
면역 블로 팅의 경우 CN이 BN PAGE보다 선호되는데, 그 이유는 단백질이 항체에 의한 검출을 방해 할 수있는 쿠마시 (Coomassie)가 없기 때문입니다. 그림 2 는 분리 된 심장, 간 및 뇌 미토콘드리아의 Cx-I 및 Cx-V 단백질 NDUFB6 및 ATP5A를 함유 한 수퍼 콤플렉스 검출을 보여줍니다. 전달 후 면역 블 롯팅 전의 Ponceau S 라벨링은 분자량 마커를 표시하고 단백질 로딩을 제어하는 데 사용할 수 있습니다 ( 그림 2A ). 이것은 nitrocellul에 ETC의 단백질 복합체의 단량체를 시각화합니다그러나 Ponceau S 라벨링은 면역 블로 팅으로 얻을 수있는 미토콘드리아 supercomplexes ( 그림 2A )의 시각화에 항상 충분하지 않습니다.
Cx-I는 그 자체로 이합체 및 4 량체로 조립되지 않지만 Cx-III 및 Cx-IV 14 , 20 , 21 과 함께 점점 더 높은 분자량의 수퍼 콤플렉스를 형성한다. 여기서 NDUFB6에 대한 항체를 사용하여 심장에서 채취 한 시료가 간 또는 뇌에서 미토콘드리아보다 더 많은 Cx-I 단량체와 고 분자량 수퍼 콤플렉스 (상위 밴드)를 포함한다는 것을 보여줍니다 ( 그림 2B ). mid-range respirasome supercomplexes의 양은 다른 조직보다 심장에서 훨씬 높았다 ( 그림 2B ).
항 -ATP5A 항체를 사용하여,Cx-V의 단량체는 모든 조직으로부터 미토콘드리아에서 검출 가능하지만, 심장 미토콘드리아에서 명확히 볼 수있는 이량 체 (D) 및 큰 수퍼 콤플렉스 (SC)를 나타내는 밴드의 뚜렷한 패턴은 간 및 뇌 미토콘드리아에서 현저하지 않다 도 2c ). 면역 블롯의 과다 노출 (1 분 대 20 초)은 여러 가지 Cx-V- 함유 수퍼 콤플렉스를 보여 주며, 이는 테트라 머 및 신타 소솜을 나타낼 수 있습니다 ( 그림 2C ). 심장, 간, 및 뇌 미토콘드리아에서 Cx-V- 함유 단백질 복합체의 이러한 패턴은 조직 특이성 일 수 있고 아직 탐구되지 않은 차이를 나타낸다.
이러한 도말의 단백질 로딩은 Ponceau S 염색 및 SDS PAGE에 의한 상기 분취 량의 VDAC 검출에 의해 수행 될 수있다 ( 도 2D 에서 입증 됨).
모든 항생제가 아님다이는 천연 PAGE 후 단백질 복합체의 4 차 또는 3 차 구조 내의 단백질을 검출하는데 적합하다. 이 문제를 극복하기 위해 네이티브 젤의 전체 및 부분 레인을 2 차원 (2D 겔, 데모 용 참조 13 참조)의 변성 젤에 장착 할 수 있습니다. 2D 전기 영동은 초분자 복합체에서 단백질을 시각화하는 데 유용한 도구입니다. 그러나 그림 2 에서 볼 수 있듯이 수퍼 콤플렉스는 다양한 양으로 존재하며 수퍼 콤플렉스의 개별 단백질 신호는 두 번째 변성 차원에서 시각화하기 어려울 수 있습니다. 이 문제를 극복하기 위해, 네이티브 젤로부터 단백질 복합체의 전기 용출이 여기에 사용되었습니다. 이것은 다중 레인에서 수퍼 콤플렉스 (supercomplex) 밴드를 분리하여 향후 연구를위한 더 많은 재료를 생산합니다.
전기 분해를 사용할 때, IGA에 의해 확인되고 BN PAGE에서 시각화 된 관심 밴드 만이 excised; 이 젤 조각으로부터 얻은 단백질은 겔로부터의 용출에 의해 추가로 정제됩니다. 도 3A 는 단량체를 나타내는 밴드가 전기 분해를 위해 절제 된 BN PAGE의 레인을 도시한다. 전기 분해 후 단량체의 Cx-V 활성을 평가하기 위해 용출액을 두 번째 CN PAGE에 적용했다. 단량체의 용리액은 여전히 효소 적으로 활성 인 Cx-V를 포함하고 있지만 부 콤플렉스도 나타납니다 ( 그림 3B ). 네이티브 CN PAGE ( 그림 3C ) 또는 변성 SDS 페이지 ( 그림 3D ) 후 eluate의 실버 얼룩은 용출액에 단백질의 존재를 나타내며 ATP5A에 대한 immunoblotting은 두 샘플 모두에서 Cx-V의 존재를 나타냅니다 ( 그림 3D ).
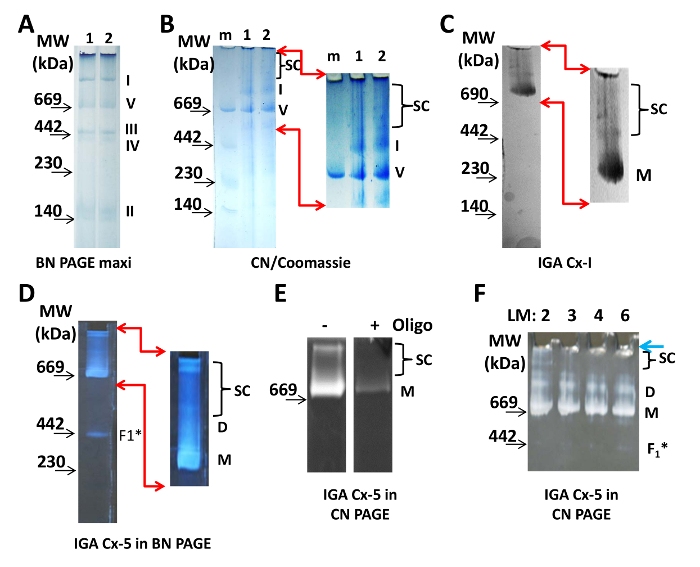
그림 1 : Mitoch의 시각화ondrial Supercomplexes. ( A ) 분리 된 심장 미토콘드리아의 샘플을 가지고 4-10 % BN maxi-gel 2 차선. 동일한 샘플의 분취 량을 두 개의 레인에서 웰당 100 ㎍의 단백질로 처리 하였다. ETC의 단백질 복합체 I, II, III, IV 및 V의 단량체가 명확하게 보여지고 겔의 오른쪽에 표시됩니다. ( B ) CN PAGE에서 심장 미토콘드리아 샘플 (1과 2, 20 μg protein / lane)을 분리하고 쿠마시 염색으로 시각화 하였다. SC는 젤의 윗 부분의 확대와 디지털 향상 후 supercomplexes의 위치를 나타냅니다 (영역은 빨간색 화살표로 표시됨). ( C ) 미토콘드리아 단백질 20 μg을 3-8 % CN PAGE에서 분리하고 Cx-I IGA로 처리 하였다. 확대되고 디지털로 강화 된 이미지는 Cx-I 반응 생성물의 밴드를 보여줍니다. ( D ) 미토콘드리아 단백질 20 μg을 3-8 % BN PAGE에서 분리하고 Cx-V IGA로 가공 하였다. 매그 니 피 Ex 및 디지털 방식으로 강화 된 이미지는 Cx-V 반응 생성물의 밴드를 보여줍니다. ( E ) 미토콘드리아 단백질 50 μg을 5-15 % CN PAGE에서 분리하고 Cx-V IGA (-) 및 (+) 5 μg / mL oligomycin (Oligo)으로 가공 하였다. ( F ) 미토콘드리아 단백질 (20 μg / lane)을 젤 상단에 표시된대로 1 μg의 라 우릴 말토 사이드 (lauryl maltoside) 2 - 6 μg로 가용화하고 3-8 % CN 겔에서 분리 한 후 Cx- V IGA. 모든 이미지는 밝은 테이블 ( A - C ) 또는 검은 색 표면 ( D - F ) 중 하나를 사용하여 촬영되었습니다. 카메라 사양은 재료 표에 나와 있습니다. 분자량 마커 (MW)의 위치는 모든 패널의 왼쪽에 표시됩니다. 약어 : D = 이량 체; F 1 * = Cx-V의 서브 콤플렉스; LM = 라 우릴 말 토 시드; m = 분자량 마커; M = 단량체; SC = 수퍼 콤플렉스.g1large.jpg "target ="_ blank ">이 그림의 확대 버전을 보려면 여기를 클릭하십시오.
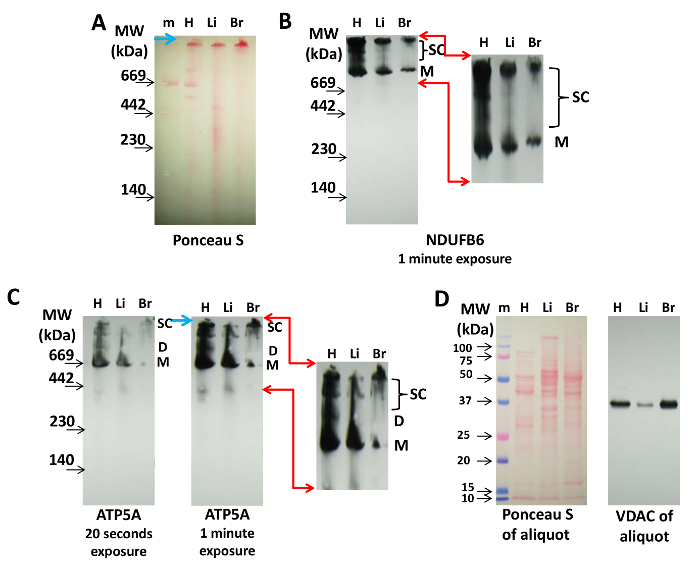
그림 2 : Immunoblotting에 의한 Mitochondrial Supercomplexes의 검출. 심장 (H), 간 (Li) 및 뇌 (B) 미토콘드리아의 단백질 20 μg을 3-8 % CN PAGE에서 분리하고 니트로 셀룰로오스 막에 옮겼다. ( A ) 막의 Ponceau S 염색은 단백질 복합체와 분자량 마커 (m)의 존재를 나타냅니다. 파란색 화살표는 젤의 상단을 가리 킵니다. ( B ) Cx-1 단백질 인 NDUFB6를 (A)에 나타낸 얼룩에서 면역 표지 하였다 (1 분 노출 시간). ( C ) 항 -ATP5A 항체로 Cx-V를 시각화 하였다 (표시된 바와 같이 20 초 및 1 분 노출). (B)와 (C)의 빨간색 화살표는 확대 된 영역을 표시하고 디지털로 확대 표시됩니다Cx-I- 및 Cx-V- 함유 수퍼 콤플렉스의 라이 제이션, 및 파란색 화살표는 겔의 상부를 가리킨다. ( D ) Ponceau S 및 (A), (B) 및 (C)에 사용 된 각 추출물의 VDAC 분취 량을 SDS PAGE로 분리하고 니트로 셀룰로오스로 옮긴 면역 표지. 약어 : M = Cx-I 또는 Cx-V의 단량체, D = Cx-V의 이량 체, SC = Cx-I 또는 Cx-V를 함유하는 수퍼 콤플렉스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 : Cx-V의 전기 분해. ( A ) 미토콘드리아 샘플의 BN 페이지. 박스 밴드는 excised 및 electroeluted Cx-V의 단량체를 나타냅니다. ( B ) 용출액을 CN PAGE에 적용한 후, Cx-V에 대한 IGA는 단량체 (M)및 Cx-V의 F1을 함유하는 서브 콤플렉스를 포함한다. ( C ) 용출액의 CN PAGE의은 염색은 단량체 (M)를 나타낸다. ( D ) 변성 나트륨 도데 실 설페이트 (SDS)의 ATP5A (오른쪽 패널)에 대한 은색 염색 (왼쪽 패널) 및 면역 블롯. 용출액의 PAGE는 Cx-V의 존재를 나타낸다. SDS 페이지는 다른 곳에서 출판 된 프로토콜을 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
기능적 ETC는 미토콘드리아 ATP 생성에 필요합니다. ETC의 복합체는 respirasomes (Cx-I, -III 및 -IV) 1 과 신타 소솜 (Cx-V) 2의 두 가지 유형의 수퍼 콤플렉스를 형성 할 수 있습니다. ETC를 supercomplexes로 편성하는 것은 전반적인 ETC 효율성을 증가시키는 것으로 생각되는 반면, 각 복합체의 조립은 손상되지 않은 ETC에 필요하다. 이러한 수퍼 콤플렉스가 어떻게 조립 및 분해되는지는 잘 알려져 있지 않지만 여기에 제시된 프로토콜은 이러한 프로세스를 더 잘 이해할 수 있습니다.
ETC 어셈블리 연구의 주요 과제는 이러한 단백질 복합체의 크기입니다. 예를 들어, 미토콘드리아 호흡기는 Cx-I (약 880 kDa)와 하나 이상의 Cx-III 분자 (460 kDa) 및 Cx-IV (200 kDa, 이량 체로 활성)로 구성되어 분자와의 복합체를 형성 할 수있다 약의 무게2,000 kDa. 또한, Cx-V는 약 600 kDa의 분자량을 가지지 만, 이량 체, 사량 체, 올리고머 및 이량 체 7,23의 리본으로 조립되어 분자량 2,000 kDa 이상의 초 콤플렉스를 생성하는 것으로 나타났습니다. 이러한 수퍼 콤플렉스의 엄청난 크기를 고려할 때,이 실험실과 다른 사람들이이 수퍼 콤플렉스를 식별하고 특성화하기 위해 전통적으로 몇 가지 부분적으로 관련한 접근법이 사용되었습니다 ( 8 , 14 , 24) .
이 연구는 활성 단백질 복합체가 약한 세제를 사용하여 미토콘드리아 막에서 부드럽게 추출되는 고유의 겔 PAGE 기술을 입증했습니다. 복합체는 주로 크기와 고유 전하 (CN PAGE) 또는 단백질 바인딩 된 쿠마시 블루 (BN PAGE)의 크기 및 음전하 때문에 젤에서 이동합니다. 이 젤들은 C로 염색 될 수 있습니다.oomassie blue ( 예 : CN 젤) 또는 silver stain ( 예 : BN 및 CN PAGE).
Lauryl maltoside는이 세제가 가장 안정적으로 작용했기 때문에 여기에 설명 된 실험에 사용되었습니다. 또는 digitonin을 사용하여 단백질 복합체 12 를 추출 할 수 있습니다. 성인 심장, 간 및 뇌에서 분리 된 미토콘드리아 데이터가 여기에 표시되었지만 이러한 기술은 배아 및 성인 심장 균질 물질에 대해 수행되었습니다 8 . 다른 사람들은 배양 된 세포에서 분리 된 미토콘드리아를 사용하여이 기술을 수행했습니다. 그러나 높은 DNA 함량을 가진 조직 균질 액 또는 배양 된 세포를 사용하는 경우 전기 영동 중 줄기를 방지하기 위해 핵산 분해 효소를 첨가하는 것이 유용 할 수 있습니다 25 .
다른 복합체의 활성은 Cx-I 및 Cx-V 및 tec에 대해 여기에서 설명 된 것처럼 겔에서 직접 분석 할 수 있습니다또한 Cx-II, -III 및 -IV 12 의 활동을 조사 할 수 있습니다. 그러나 이러한 IGA 분석은주의 깊게 수행해야합니다. 첫째, 효소 반응은 비 ETC 효소 또는 불완전하게 조립 된 복합체 때문일 수있다. 예를 들어, 원래의 Cx-V를 억제하기 위해 oligomycin으로 처리 된 평행 겔로 Cx-V IGA를 수행하는 것은 일상적입니다 ( 그림 3 ). 또한, 다른 NADH oxidases는 Cx-1 in-gel activity를 설명 할 수 있습니다. 하나는 로테 논과 같은 Cx-I 억제제가있는 상태에서 병렬 IGA를 수행 할 수 있습니다. 그러나 그림 1 에서 분리 된 미토콘드리아가 사용되었으므로 세포질 NADH oxidases는 존재하지 않았다. 따라서, 데이터는 Cx-I- 함유 단량체 및 수퍼 콤플렉스를 나타낼 가능성이 가장 높다. 또한 이러한 결과의 정량화는 사진 또는 스캔에서 밴드의 신호 강도를 측정하여 가능합니다. 이 접근법의 단점은반응 생성물의 이동성, 겔의 깊이에 걸쳐 생성물을 적절하게 정량화 할 수 없으며, 반응의 잠재적 인 비선형 성을 나타낸다. 후자를 극복하기 위해 일련의 사진을 사용하여 반응 속도를 얻으려는 제안이 있지만 여기에서는 시도하지 않았습니다.
고유 젤의 단백질은 또한 막으로 옮겨 질 수 있으며, 밴드의 단백질 조성은 면역 블로 팅 (여기에서 설명) 또는 2D PAGE (참조 13 에서 입증)로 검사 할 수 있습니다. ETC 복합체의 단량체는 전통적으로 분리 된 미토콘드리아의 고유 겔, 젤에서의 위치 및 분자 표지 단백질에 대한 위치 ( 그림 1 )로 풍부하게 식별되었습니다. 또한, 다른 복합체의 서브 유닛에 특이적인 항체로 후속 면역 블롯을 표지하는 것은 복합체 및 조성물을 확인하는 것을 돕는다supercomplexes의. 따라서, 항 -NDUFB6 및 -ATP5A는 여기에서 설명 된 바와 같이 Cx-1 및 Cx-V를 각각 함유하는 단량체 및 수퍼 콤플렉스를 식별한다. Cx-II에서 IV에 항체는 동일한 목적으로 사용될 수 있습니다. 경우에 따라, 일부 항체가 변성 된 단백질에 특이 적이거나 또는 에피토프가 천연 복합체에서 다른 단백질에 의해 감추어 질 수 있기 때문에, 변성 겔에서 잘 작동하는 항체는 네이티브 겔에서 잘 작동하지 않을 수있다.
대부분의 이용 가능한 분자량 마커가 Cx-V 단량체의 크기보다 낮기 때문에 이러한 supercomplex의 정확한 분자량 결정은 어렵습니다. 천연 겔에서 단백질 복합체의 이동은 크기, 내재 전하 및 세제가 28 에 따라 달라집니다. 여기의 예에서, 복합체의 단량체는 겔, 마커 및 면역 블로 팅에 기초하여 동정되었다. Cx-V의 이량 체는 Cx-I 및 -V의 단량체에 비해 상대적 이동 및 면역계블로 팅. 겔, IGA 및 면역 블롯의 단량체와 이량 체 위의 다른 모든 것들은 수퍼 콤플렉스로 간주됩니다.
네이티브 면역 블롯은 또한 표준 기술을 사용하여 밴드 밀도를 분석함으로써 수퍼 콤플렉스에 대해 정량화 될 수 있습니다. 이 방법은 여기에 표시되지 않았지만 최근의 출판물에서는이 기술을 보여줍니다 8 . 단백질 로딩의 정상화는 레인의 Ponceau red 염색을 사용하거나 변성 면역 블롯상의 VDAC 밴드의 밀도를 측정하기 위해 미토콘드리아 추출물의 샘플을 저장하여 수행 할 수 있습니다 ( 그림 2A 및 D ). 또한, 같은 immunoblot에서 단량체에 대한 supercomplexes의 비율을 조사하는 것은 band density를 정량화하는 또 다른 방법이지만, blot development 동안 서로 다른 시간에 사진을 찍어 밴드가 과다 노출되지 않도록주의해야합니다.
마지막으로, 천연 겔의 밴드를 전기 분해하여 purifie를 생성 할 수 있습니다d는 고차원 복합체로 조립 될 수 있고 복잡한 기능의 추가 연구에 사용될 수있는 활성 단백질 복합체입니다. 예를 들어 Cx-V 단량체는 이전에 전기 영동되어 리포좀으로 재구성되어 전기적 기능성 29을 입증했습니다. 네이티브 전기 분해에 대한 또 다른 접근법은 주변 버퍼 ( 16 ) 로의 수동 확산에 의한 용출이지만, 이는 네이티브 전기 분해에 비해 느립니다. 마지막으로, 전기 분해의 주요 문제점은 복합체가 정제 과정에서 해리 될 수 있기 때문에 전기 분해 된 단백질 복합체의 효소 기능을 유지하는 것입니다. 따라서이 기술로 분리 한 후 기능 분석은 엄격하게 테스트해야합니다.
이들 프로토콜을 효소 분석 및 산소 소비 측정과 결합하여 개별적인 ETC 복합체의 기능 및 전체 ETC 30 의 활성 및 다른 메타ods, crystalles 31 및 복합체와 supercomplexes의 구조에 대한 전자 현미경 32 평가와 같은 ETC의 내부 작용의 완성 된 그림이 나타났습니다. 우리는 복합체의 조립 방법, 전자가 사슬을 따라 흐르는 방법, 그리고 양성자가 멤브레인을 통해 펌핑되어 그래디언트를 생성 한 다음 Cx-V를 통해 매트릭스로 역류하여 ATP를 생성하는 방법에 더 가깝습니다. 의심의 여지없이 이러한 기술은 ETC의 구조, 기능 및 동적 규제에 대한 추가 세부 정보를 제공하기 위해 더욱 개선 될 것입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 미국 심장 학회 설립자 제휴사 (12GRNT12060233)와 로체스터 대학의 Strong Children 's Research Center의 연구비 지원으로 이루어졌습니다.
자료
| Name | Company | Catalog Number | Comments |
| Protean II mini-gel chamber | Biorad | 1658004 | Complete set to pour and run mini-gel electrophoresis |
| Protean XL maxi-gel | Biorad | 1653189 | Complete set to pour and run maxi-gel electrophoresis |
| Gradient maker, Hoefer SG15 | VWR | 95044-704 | Pouring mini-gel gradients |
| Gradient maker, maxi-gel | VWR | GM-100 | Pouring maxi-gel gradients |
| Transfer kit | Biorad | 1703930 | Complete set to wet transfer of proteins onto membranes |
| Electroeluter model 422 | Biorad | 1652976 | Electroelution of proteins from native or SDS PAGES |
| Glass plates | Biorad | 1653308 | Short plates |
| Glass plates | Biorad | 1653312 | Spacer plates |
| Glass plates | Biorad | 1651823 | Inner plates |
| Glass plates | Biorad | 1651824 | Outer Plates |
| Power supply | Biorad | 1645070 | Power supply suitable for native electrophoresis |
| ECL-Western | Thermo Scientific | 32209 | Chemolumniscense substrate |
| SuperSignal-West Dura | Thermo Scientific | 34075 | Enhanced chemolumniscense substrate |
| Film/autoradiography film | GE Health care | 28906845 | Documentation of Western blots |
| Film processor CP1000 | Agfa | NC0872640 | |
| Canon Power Shot 640 | Canon | NA | Taking photos to document gels, membranes and blots. |
| Canon Power Shot 640 Camera hood | Canon | shielding camera for photos being taken on a light table | |
| Acrylamide/bisacrylamide | Biorad | 1610148 | 40% pre-mixed solution |
| Glycine | Sigma | G7403 | |
| SDS (sodium dodecyl sulfate) | Invitrogen | 15525-017 | |
| Tris-base | Sigma | T1503 | Buffer |
| Tricine | Sigma | T0377 | |
| Sodium deoxychelate | Sigma | D66750 | Detergent |
| EDTA | Sigma | E5134 | |
| Sucrose | Sigma | S9378 | |
| MOPS | Sigma | M1254 | Buffer |
| Imidazole | Sigma | I15513 | Buffer |
| Lauryl maltoside | Sigma | D4641 | Detergent |
| Coomassie G250 | Biorad | 161-0406 | |
| Aminohexanoic acid | Sigma | O7260 | |
| Native molecular weight kit | GE Health care | 17-0445-01 | High molecular weight calibraition kit for native electrophoresis. |
| Name | Company | Catalog Number | Comments |
| NADH | Sigma | N4505 | |
| Nitroblue tetrazolium | Sigma | N6639 | |
| Tris HCl | Sigma | T3253 | |
| ATP | Sigma | A2383 | |
| Name | Company | Catalog Number | Comments |
| Lead(II) nitrate (Pb(NO3)2): | Sigma | 228621 | |
| Oligomycin | Sigma | O4876 | |
| Name | Company | Catalog Number | Comments |
| Ponceau S | Sigma | P3504 | |
| anti-ATP5A | Abcam | ab14748 | antibody to ATP synthase subunit ATP5A |
| anti-NDUFB6 | Abcam | ab110244 | antibody to Cx-1 subunit NDUFB6 |
| anti-VDAC | Calbiochem | 529534 | antibody to VDAC |
| ECL HRP linked antibody | GE Health Care | NA931V | secondary antibody to ATP5A, NDUFB6 and VDAC |
| Blocking reagent | Biorad | 170-6404 | |
| BSA | |||
| sodium chloride | Sigma | S9888 | |
| potassium chloride | Sigma | P9541 | |
| EGTA | Sigma | E3889 | |
| Name | Company | Catalog Number | Comments |
| Silver staining Kit | Invitrogen | LC6070 |
참고문헌
- Lenaz, G., Genova, M. L. Supramolecular organisation of the mitochondrial respiratory chain: a new challenge for the mechanism and control of oxidative phosphorylation. Adv Exp Med Biol. 748, 107-144 (2012).
- Saks, V., et al. Intracellular Energetic Units regulate metabolism in cardiac cells. J Mol Cell Cardiol. 52 (2), 419-436 (2012).
- Schagger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal Biochem. 217 (2), 220-230 (1994).
- Wittig, I., Schagger, H. Native electrophoretic techniques to identify protein-protein interactions. Proteomics. 9 (23), 5214-5223 (2009).
- Genova, M. L., Lenaz, G. Functional role of mitochondrial respiratory supercomplexes. Biochim Biophys Acta. 1837 (4), 427-443 (2014).
- Hahn, A., et al. Structure of a Complete ATP Synthase Dimer Reveals the Molecular Basis of Inner Mitochondrial Membrane Morphology. Molecular cell. 63 (3), 445-456 (2016).
- Strauss, M., Hofhaus, G., Schroder, R. R., Kuhlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. EMBO J. 27 (7), 1154-1160 (2008).
- Beutner, G., Eliseev, R. A., Porter, G. A. Initiation of electron transport chain activity in the embryonic heart coincides with the activation of mitochondrial complex 1 and the formation of supercomplexes. PloS one. 9 (11), e113330(2014).
- Genova, M. L., Lenaz, G. The Interplay Between Respiratory Supercomplexes and ROS in Aging. Antioxid Redox Signal. 23 (3), 208-238 (2015).
- Rosca, M. G., et al. Cardiac mitochondria in heart failure: decrease in respirasomes and oxidative phosphorylation. Cardiovasc Res. 80 (1), 30-39 (2008).
- Kuter, K., et al. Adaptation within mitochondrial oxidative phosphorylation supercomplexes and membrane viscosity during degeneration of dopaminergic neurons in an animal model of early Parkinson's disease. Biochim Biophys Acta. 1862 (4), 741-753 (2016).
- Wittig, I., Karas, M., Schagger, H. High resolution clear native electrophoresis for in-gel functional assays and fluorescence studies of membrane protein complexes. Mol Cell Proteomics. 6 (7), 1215-1225 (2007).
- Fiala, G. J., Schamel, W. W., Blumenthal, B. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for analysis of multiprotein complexes from cellular lysates. J Vis Exp. (48), (2011).
- Acin-Perez, R., Fernandez-Silva, P., Peleato, M. L., Perez-Martos, A., Enriquez, J. A. Respiratory active mitochondrial supercomplexes. Molecular cell. 32 (4), 529-539 (2008).
- Dudkina, N. V., Eubel, H., Keegstra, W., Boekema, E. J., Braun, H. P. Structure of a mitochondrial supercomplex formed by respiratory-chain complexes I and III. Proc Nat Acad Sci USA. 102 (9), 3225-3229 (2005).
- Giorgio, V., et al. Dimers of mitochondrial ATP synthase form the permeability transition pore. Proc Nat Acad Sci USA. 110 (15), 5887-5892 (2013).
- Beutner, G., Sharma, V. K., Giovannucci, D. R., Yule, D. I., Sheu, S. S. Identification of a ryanodine receptor in rat heart mitochondria. J Biol Chem. 276 (24), 21482-21488 (2001).
- Rehncrona, S., Mela, L., Siesjo, B. K. Recovery of brain mitochondrial function in the rat after complete and incomplete cerebral ischemia. Stroke. 10 (4), 437-446 (1979).
- Schagger, H. Blue-native gels to isolate protein complexes from mitochondria. Methods Cell Biol. 65, 231-244 (2001).
- Althoff, T., Mills, D. J., Popot, J. L., Kuhlbrandt, W. Arrangement of electron transport chain components in bovine mitochondrial supercomplex I1III2IV1. EMBO J. 30 (22), 4652-4664 (2011).
- Schafer, E., et al. Architecture of active mammalian respiratory chain supercomplexes. J Biol Chem. 281 (22), 15370-15375 (2006).
- Wittig, I., Schagger, H. Supramolecular organization of ATP synthase and respiratory chain in mitochondrial membranes. Biochim Biophys Acta. 1787 (6), 672-680 (2009).
- Davies, K. M., et al. Macromolecular organization of ATP synthase and complex I in whole mitochondria. Proc Nat Acad Sci USA. 108 (34), 14121-14126 (2011).
- Lapuente-Brun, E., et al. Supercomplex assembly determines electron flux in the mitochondrial electron transport chain. Science. 340 (6140), 1567-1570 (2013).
- Antonioli, P., Bachi, A., Fasoli, E., Righetti, P. G. Efficient removal of DNA from proteomic samples prior to two-dimensional map analysis. J Chromatogr A. 1216 (17), 3606-3612 (2009).
- Wittig, I., Carrozzo, R., Santorelli, F. M., Schagger, H. Functional assays in high-resolution clear native gels to quantify mitochondrial complexes in human biopsies and cell lines. Electrophoresis. 28 (21), 3811-3820 (2007).
- Glancy, B., Balaban, R. S. Protein composition and function of red and white skeletal muscle mitochondria. Am J Physiol Cell Physiol. 300 (6), C1280-C1290 (2011).
- Wittig, I., Beckhaus, T., Wumaier, Z., Karas, M., Schagger, H. Mass estimation of native proteins by blue native electrophoresis: principles and practical hints. Mol Cell Proteomics. 9 (10), 2149-2161 (2010).
- Alavian, K. N., et al. An uncoupling channel within the c-subunit ring of the F1FO ATP synthase is the mitochondrial permeability transition pore. Proc Nat Acad Sci USA. 111 (29), 10580-10585 (2014).
- Chance, B., Williams, G. R. Respiratory enzymes in oxidative phosphorylation. IV. The respiratory chain. J Biol Chem. 217 (1), 429-438 (1955).
- Zickermann, V., et al. Structural biology. Mechanistic insight from the crystal structure of mitochondrial complex I. Science. 347 (6217), 44-49 (2015).
- Zhu, J., Vinothkumar, K. R., Hirst, J. Structure of mammalian respiratory complex I. Nature. 536 (7616), 354-358 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유