Method Article
تحليل سوبيركومبلكسس من سلسلة النقل الإلكترون الميتوكوندريا مع الكهربائي الأصلي، في هلام فحوصات، والكهرباء
In This Article
Summary
يصف هذا البروتوكول فصل المجمعات الوظيفية سلسلة النقل الإلكترون الميتوكوندريا (سك) الرابع و سوبيركومبليكسس منها باستخدام الكهربائي الأصلي للكشف عن معلومات حول تجميعها وهيكلها. يمكن أن يتعرض هلام الأم إلى إمونوبلوتينغ، في هلام المقايسات، وتنقية عن طريق إليكترولوتيون لمزيد من وصف المجمعات الفردية.
Abstract
سلسلة نقل الإلكترون الميتوكوندريا (إتك) يحول الطاقة المستمدة من انهيار أنواع الوقود المختلفة في العملة الحيوية الحيوية للخلية، أتب. ويتكون إتك من 5 مجمعات بروتينية ضخمة، والتي تتجمع أيضا في سوبيركومبلكسيس تسمى ريسبراسوميس (سي، C-إي، و C-إيف) والسينثاسومات (كف) التي تزيد من كفاءة نقل الإلكترون وإنتاج أتب. وقد استخدمت أساليب مختلفة لأكثر من 50 عاما لقياس وظيفة إتك، ولكن هذه البروتوكولات لا توفر معلومات عن تجميع المجمعات الفردية و سوبيركومبلكسس. يصف هذا البروتوكول تقنية هلام الأصلي بولي أكريلاميد هلام الكهربائي (بادج)، وهي الطريقة التي تم تعديلها منذ أكثر من 20 عاما لدراسة إتك بنية معقدة. يسمح الكهربائي الكهربائي فصل المجمعات إتك في أشكالها النشطة، ويمكن بعد ذلك دراسة هذه المجمعات باستخدام إمونوبلوتينغ، في هلام المقايسات (إيغا)، وتنقية عن طريق إليكترلوتيون. من خلال الجمع بين إعادةوالطبقات من هلام الأم الصفحة مع تلك المقايسات الميتوكوندريا الأخرى، فمن الممكن الحصول على صورة كومبلتر من نشاط إتك، والتجمع الديناميكي والتفكيك، وكيف ينظم هذا الهيكل الميتوكوندريا وظيفة. وسيناقش هذا العمل أيضا القيود المفروضة على هذه التقنيات. وباختصار، فإن تقنية الأصلي بادج، تليها إمونوبلوتينغ، إيغا، والكهربائية، المعروضة أدناه، هو وسيلة قوية للتحقيق في وظائف وتكوين الميتوكوندريا الخ سوبيركومبلكسس.
Introduction
الطاقة الميتوكوندريا في شكل أتب ليست ضرورية فقط لبقاء الخلية، ولكن أيضا لتنظيم موت الخلايا. ويتطلب توليد أتب بواسطة الفسفرة المؤكسدة سلسلة نقل إلكترون وظيفية (إتك؛ سك-I إلى إيف) وميتوكوندريا أتب سينثاس (سك-V). وقد أظهرت الدراسات الحديثة أن يتم تنظيم هذه المجمعات البروتين الكبيرة في سوبيركومبلكسس، ودعا ريسبراسوميس و سينثاسوميس 1 ، 2 . ومن الصعب تحليل التجمع، والديناميات، وتنظيم الأنشطة من هذه المجمعات الضخمة والسوبركومبلكس. في حين قياسات استهلاك الأوكسجين التي اتخذت مع قطب الأكسجين وانزيم المقايسات التي أجريت باستخدام مقياس الطيف يمكن أن تعطي معلومات قيمة عن النشاط معقدة إتك، هذه المقايسات لا يمكن أن توفر معلومات بشأن وجود وحجم وتكوين وحدات فرعية من البروتين معقدة أو سوبيركومبلكسس المعنية. ومع ذلك، فإن تطوير الأزرق وواضح الأصلي (BN و ن، على التوالي) وقد خلقت الصفحة 3 أداة قوية للكشف عن معلومات هامة حول تكوين معقدة والتجميع / التفكيك وعن التنظيم الديناميكي للمنظمة سوبرامولكولار من هذه المجمعات التنفسية الحيوية تحت الظروف الفسيولوجية والمرضية 4 .
ويبدو أن تجميع هذه المجمعات في سوبيركومبلكسس أعلى ترتيب لتنظيم هيكل الميتوكوندريا وظيفة 5 . على سبيل المثال، التجمع ريسبراسوم يزيد من كفاءة نقل الإلكترون وتوليد قوة الدافع البروتون عبر الغشاء الداخلي الميتوكوندريا 5 . وبالإضافة إلى ذلك، فإن تجميع سينثاسوميس ليس فقط يزيد من كفاءة إنتاج أتب ونقل معادلات الطاقة في السيتوبلازم 2 ، ولكنه أيضا قوالب الغشاء الداخلي الميتوكوندريا في كريستي أنبوبي 6 ، </ سوب> 7 . الدراسات من التجمع سوبيركومبلكس خلال التطور القلبي في الأجنة الماوس تظهر أن جيل من سوبيركومبلكسس التي تحتوي على سك-I في القلب يبدأ في حوالي يوم الجنينية 13.5 8 . وقد أظهرت أخرى أن كمية من سكس-I-سوبيركومبلكسس التي تحتوي على نقصان في القلب بسبب الشيخوخة أو نقص التروية / إصابات ضخه 9 ، 10 أو قد تلعب دورا في تطور الأمراض العصبية 11 .
يصف هذا البروتوكول طرق هلام الأم الصفحة التي يمكن استخدامها للتحقيق في التجمع والنشاط من المجمعات إتك و سوبيركومبلكسس. ويمكن تقييم الوزن الجزيئي التقريبي لل سوبيركومبلكسس الميتوكوندريا عن طريق فصل المجمعات البروتين في المواد الهلامية بولي أكريلاميد ن أو بن. ن صفحة كما يسمح لتصور النشاط الأنزيمي من جميع المجمعات الميتوكوندريا مباشرة في هلام (في هلام المقايسات.إيغا) 12 . هذا العمل يدل على نشاط ريسبراسوميس من خلال تسليط الضوء على قدرة سك-I لأكسدة ناد من خلال إيغا ووجود سينثاسوميس بسبب النشاط أتب-هدروليزينغ من سك-V من قبل إيغا. ويمكن أيضا أن تظهر المجمعات متعددة و سوبيركومبلكسس التي تحتوي على سك-I و سك-V عن طريق نقل البروتينات على الأغشية النتروسليلوز وأداء إمونوبلوتينغ. ميزة هذا النهج هو أن بن أو ن صفحة عموما يفصل المجمعات البروتين على أساس حجمها الفسيولوجية وتكوينها؛ نقل إلى غشاء يحافظ على هذا النمط من العصابات. تحليل المجمعات البروتين في بن أو ن صفحة يمكن أيضا أن يتم باستخدام 2D-بادج (انظر فيالا وآخرون 13 لمظاهرة) أو عن طريق السكروز كثافة الطرد المركزي 14 ، 15 . لمزيد من تحليل فرقة محددة، فإنه يمكن استئصاله من بن صفحة، والبروتينات من هذا البروتين يمكن أن يكون بوريفيد عن طريق إلكترويلوتينغ لهم في ظل الظروف المحلية. يمكن إجراء إلكترلوشن المحلية في غضون ساعات قليلة، والتي يمكن أن تحدث فرقا كبيرا في الانتشار السلبي (كما هو مستخدم في المرجع 16) من البروتينات من هلام في المخزن المؤقت المحيطة بها.
وباختصار، تصف هذه الأساليب العديد من النهج التي تسمح لتوصيف المزيد من سوبيركومبلكسس عالية الوزن الجزيئي من الأغشية الميتوكوندريا.
Protocol
أجريت جميع التجارب باستخدام قلوب من الفئران C57BL / 6N (نوع البرية). تم تخدير الفئران مع كو 2 قبل خلع عنق الرحم، وأجريت جميع الإجراءات بما يتفق بدقة مع شعبة الطب المخبري للحيوان في جامعة روتشستر وامتثالا لقانون الدولة، والنظام الاتحادي، وسياسة المعاهد الوطنية للصحة. تمت الموافقة على البروتوكول من قبل لجنة رعاية الحيوان واستخدام المؤسسي من جامعة روتشستر (لجنة الجامعة للموارد الحيوانية).
1. ن و بن الصفحة
ملاحظة: يجب أن تكون جميع المعدات المستخدمة ل بن و ن بادج خالية من المنظفات. لضمان هذا، وغسل جميع المعدات مع 0.1 M حمض الهيدروكلوريك، تليها الشطف على نطاق واسع مع منزوع الأيونات H 2 O.
- تجهيز
- إعداد العازلة الأنود تتألف من 25 ملي إيميدازول، ودرجة الحموضة 7.0، في 4 درجات مئوية. مخزن في 4 درجات مئوية.
- إعداد العازلة الكاثود ل ن أو بن الصفحة.
- ل ن بادج، استخدم 7.5 ملي إيميدازول و 50 ملي تريسين. إضافة 0.5 غرام من ديوكسيكولات الصوديوم و 0.2 غرام من مالتوسيد لوريل للتر الواحد من العازلة. ضبط درجة الحموضة إلى 7.0 في 4 درجات مئوية وتخزينها في 4 درجات مئوية.
- ل بن بادج، استخدم 7.5 ملي إيميدازول و 50 ملي تريسين وضبط درجة الحموضة إلى 7.0 في 4 درجات مئوية. تخزين في 4 درجات مئوية.
- للضوء الأزرق بن العازلة الكاثود، واستخدام 7.5 ملي إيميدازول و 50 ملي تريسين. ضبط درجة الحموضة إلى 7.0 في 4 درجات مئوية وإضافة 20 ملغ من كوماسي لكل لتر من العازلة. تخزين في 4 درجات مئوية.
- إعداد العازلة استخراج (إب) مع 50 ملي كلوريد الصوديوم، 50 ملي إيميدازول، 2 ملي حمض أمينوكابرويك، و 1 ملي إدتا. ضبط درجة الحموضة إلى 7.0 في 4 درجات مئوية وتخزينها في 4 درجات مئوية.
- إعداد 3X هلام العازلة (المستخدمة ل بن و ن المواد الهلامية) مع 75 ملي إيميدازول و 1.5 M حمض أمينوكابرويك. ضبط درجة الحموضة إلى 7.0 في 4 درجات مئوية وتخزينها في 4 درجات مئوية.
- إعداد عازلة تحميل (لب) من 0.01 غرام من بونسيو S، 5 غرام من الجلسرين، و 5 مل من H 2 O. تخزين في الغرفةدرجة الحرارة.
- إعداد كوماسي الأزرق بإضافة 50 ملغ من كوماسي إلى 1 مل من 500 ملي حمض 6-أمينوهيكسانويك. ضبط درجة الحموضة إلى 7.0 في 4 درجات مئوية وتخزينها في 4 درجات مئوية.
- إعداد 20 ملي و 200 ملي ملتوسيد لوريل في H 2 O. جعل أليكوتس من 200 ميكرولتر وتخزينها المجمدة. ذوبان الجليد المنظفات قبل الاستخدام.
| 3٪ إلى 8٪ (ميني) | من 4٪ إلى 10٪ (ماكسي) | |||
| 0.5 الهلام (الضوء) | 0.5 هلام (ثقيل) | 0.5 الهلام (الضوء) | 0.5 هلام (ثقيل) | |
| أب (مل) | 0.42 | 1.3 | 2.5 | 7.7 |
| ن / بن العازلة (مل) | 1.6 | 1.6 | 8.5 | 8.5 |
| H 2 O (مل) | 2.7 | 1.4 | 14 | 6.3 |
| الجلسرين (ز) | 0 | 0.47 | 0 | 2.5 |
| الحجم (مل) | 4.72 | 4.77 | 25 | 25 |
| أبس (ميكرولتر) | 27 | 27 | 65 | 65 |
| تيمد (ميكرولتر) | 4 | 4 | 10 | 10 |
الجدول 1: كميات المكونات اللازمة لتصب 1 Mini- أو ماكسي-بادج. يتم حساب الأحجام المستخدمة في هذا الجدول ل 1 مصغرة أو 1 ماكسي جل، 1.5 مم. ويستند حجم أب على حل الأسهم 40٪. الضوء والثقيلة تشير إلى كونسنتراتأيون من آب. أبس و تيمد تضاف بعد كل عمود من خلاط التدرج مليئة الحل آب.
- صب وتشغيل المواد الهلامية
ملاحظة: استخدام 3-8٪ أو 4-10٪ أكريلاميد / بيساكريلاميد (أب) التدرج ل ن أو بن المواد الهلامية، على التوالي. الجدول 1 يلخص كميات العازلة، أب، H 2 O، الجلسرين، أمونيومبرسلفات (أبس) و تيتراميثيلثيلينديامين (تيمد) المستخدمة في هلام مصغرة (85 مم × × 73 مم ارتفاع × 1.5 مم) أو ماكسي هلام (160 مم واسعة × 200 مم ارتفاع × 1.5 مم). جمعيات لوحات زجاجية مع المواد الهلامية ن أو بن يمكن المبردة في كيس مع بضعة مل من 1X العازلة هلام أو ملفوفة في منشفة ورقية مبللة مع 1X العازلة هلام للتخزين. المواد الهلامية مستقرة للاستخدام لمدة تصل إلى أسبوع.- لصب الجل، وضع خلاط التدرج على لوحة التحريك مرتفعة لضمان أن هلام سوف تتدفق عن طريق الجاذبية في غرفة هلام أعدت.
- ملء غرفة تدفق للخلاط التدرج مع 4.77 / 25 مل (ميني / ماكسي) من الحل الثقيل (مع تركيز أعلى من أب).
- فتح بلطف اتصال وقف الديك بين الثقيلة والخفيفة غرفة والسماح قطرة من الحل للذهاب من خلال إلى الجانب الآخر.
ملاحظة: هذا يدفع فقاعات الهواء من أنبوب ربط ووقف الديك، والتي من شأنها منع تدفق بين المجلسين. وهذا لا يمكن القيام به إذا كان قد تم شغل كلا الجانبين بالفعل، لأن الضغط المتساوي سيمنع الفقاعة من الانتقال. - ملء غرفة أخرى من خلاط التدرج مع 4.72 / 25 مل (ميني / ماكسي) من حل الضوء.
- وضع شريط ضجة في غرفة تدفق مع الحل الثقيل وتبدأ التحريك. استخدام سرعة شريط التحريك الذي لا يسبب فقاعات.
- إضافة بسرعة أبس و تيمد إلى كل غرفة لبدء البلمرة.
- فتح الاتصال بين غرفتين من خلاط التدرج والسماح خلط لبضع ثوان قبل فتح غرفة تدفق لصب هلام.
ملاحظة: الجاذبية وايليرة لبنانية استنزاف كل من الغرف على قدم المساواة، وسوف خلط الضوء في الحل الثقيل يقلل ببطء كثافة الأكريلاميد من أسفل إلى أعلى هلام. استخدام المحتوى بأكمله الذي هو في خلاط التدرج لصب هلام.- في النهاية، بعناية جبل مشط، مع الآبار داخل هلام لتجنب فقاعات و خلط الطبقة.
- اغسل على الفور خلاط التدرج مع الإيثانول لشطف أي هلام. شطف بالماء وصب الجل الثاني. السماح المواد الهلامية تتبلمر (عادة ما تكون هناك حاجة أقل من 20 دقيقة للالهلام مصغرة).
- لتشغيل المواد الهلامية، جبل لهم في المشبك التجمع الكهربائي وملء مركز / الغرفة العليا مع ن أو الضوء الأزرق بن العازلة الكاثود. انتظر بضع دقائق للتحقق من وجود تسرب قبل إضافة المخزن المؤقت الأنود إلى الغرفة الخارجية / السفلى.
- سحب بلطف أمشاط جيدا وغسل الآبار مع العازلة الكاثود باستخدام حقنة أو ماصة.
- تشغيل المواد الهلامية في غرفة باردة (4 درجة مئوية) أو معبأة تماما في الجليد.
- ل ن مصغرة بادج، استخدم 100 V للساعة الأولى و 200 V حتى الانتهاء، وعادة ما يكون 1-1.5 ح إضافية. بدلا من ذلك، تشغيل ن مصغرة بادج في 30-40 V بين عشية وضحاها.
ملاحظة: التركيز هنا على المجمعات البروتين عالية الوزن الجزيئي، لذلك المجمعات البروتين مع الوزن الجزيئي أقل من 140 كيلو دالتون سوف نفد من هلام. يمكن استخدام أوقات تشغيل أقصر للرحلان الكهربائي للحفاظ على المجمعات ذات الوزن الجزيئي المنخفض. - ل بن ماكسي-بادج، استخدم 100 V وتشغيل المواد الهلامية بين عشية وضحاها (حوالي 18 ساعة).
ملاحظة: سيكون التيار منخفض جدا (<15 مللي أمبير)، لذلك هناك حاجة إلى إمدادات الطاقة التي يمكن التعامل مع هذه الشروط. عند هذه النقطة، يمكن استخدام المواد الهلامية ل إيغا أو إمونوبلوتينغ. في بعض الحالات، يمكن قطع العصابات أو الممرات من المواد الهلامية باستخدام شفرة حلاقة على لوحة زجاجية للكهرباء.
- ل ن مصغرة بادج، استخدم 100 V للساعة الأولى و 200 V حتى الانتهاء، وعادة ما يكون 1-1.5 ح إضافية. بدلا من ذلك، تشغيل ن مصغرة بادج في 30-40 V بين عشية وضحاها.
- إعداد عينة
ملاحظة: يجب أن تستخرج سوبيركومبلكسس الميتوكوندريا الغشاء ملزمة من ثه غشاء الميتوكوندريا الداخلي. للحفاظ على سوبيركومبلكسس الميتوكوندريا، استخدم إما الميتوكوندريا المعزولة حديثا أو العينات التي تم تجميدها وذوبان مرة واحدة فقط. وتعطى الحسابات / الأحجام أدناه للهلام مصغرة (بئر مشط 10 بئر في هلام 1.5 مم يحمل ما يصل إلى 35-40 ميكرولتر) و ماكسي هلام (بئر مشط 15-جيدا يحمل ما يصل الى 200 ميكرولتر). وبالإضافة إلى ذلك، حفظ قسامة من كل عينة (عادة 10 ميكرولتر)، ليتم تشغيلها على تغيير طبيعة سدز هلام للكشف عن قناة أنيون تعتمد على الجهد (فداك)، والتحكم في التحميل.- وضع كمية مناسبة (على سبيل المثال، 10-50 ميكروغرام من البروتين لالهلام مصغرة و50 - 200 ميكروغرام ل ماكسي هلام) من الميتوكوندريا معزولة أو الأنسجة جناسة في ميكروتوبس وأجهزة الطرد المركزي في 17،000 x ج لمدة 10-15 دقيقة في 4 درجات مئوية.
ملاحظة: هذه الخطوة يزيل بعض من مصفوفة الميتوكوندريا القابلة للذوبان و / أو البروتينات عصاري خلوي. - نضح وتجاهل طاف وإضافة العازلة استخراج إلى المبلغ المطلوبلتحميل على هلام. ريسوسبيند بلطف الرواسب على الجليد. إذا رغبت في ذلك، إضافة مزيج مثبط الأنزيم البروتيني العام في هذه المرحلة.
ملاحظة: استنادا إلى المعدات المستخدمة هنا، تم استخدام 30 ميكرولتر ل هلام مصغرة و 100 ميكرولتر ل ماكسي هلام، مما يحد من نسبة البروتين / العازلة إلى أكثر من 2 ميكروغرام من البروتين إلى 1 ميكرولتر من العازلة. - إضافة المنظفات (على سبيل المثال، 2 ميكروغرام من مالتوسيد لوريل / 1 ميكروغرام من البروتين؛ انظر نتائج ممثل ومناقشة لمزيد من المعلومات).
ملاحظة: عموما، يستخدم مالتوزيد لوريل، ولكن يمكن أيضا استخدام ديجيتونين. - احتضان على الجليد لمدة 20 دقيقة. مزيج بلطف في البداية وأحيانا أثناء الحضانة عن طريق تريتوراتينغ و / أو تحريك الأنبوب.
- أجهزة الطرد المركزي في 17،000 x ج لمدة 10 دقيقة في 4 درجات مئوية لإزالة أي شظايا الغشاء والأنسجة.
- نقل طاف إلى أنبوب جديد. لعينات ن، إضافة 1 ميكرولتر من لب لكل 10 ميكرولتر من حجم العينة. يجب أن يكون الحجم الكلي للعينة التطبيقما يقرب من 40 ميكرولتر ل هلام مصغرة و 130 ميكرولتر ل ماكسي هلام. لعينات بن، إضافة كوماسي للعينات بحيث تكون نسبة الصبغة إلى المنظفات 1: 4 (ث / ث).
- تحميل 30 و 120 ميكرولتر من العينات في آبار مصغرة أو ماكسي هلام، على التوالي. استخدام 10 ميكرولتر المتبقية من كل عينة ل تغيير طبيعة سدز هلام للكشف عن فداك كما تحكم التحميل.
- لإعداد علامات الوزن الجزيئي، حل 1 قارورة من مزيج الجزيئات عالية الوزن معايرة (انظر جدول المواد لمزيد من المعلومات) في 60 ميكرولتر من بن / ن عازلة عازلة هل وإضافة 120 ميكرولتر من H 2 0 و 20 ميكرولتر من رطل. تحميل 15 ميكرولتر لكل حارة.
- تشغيل المواد الهلامية على النحو المبين في الخطوة 1.2.9.2.
- وضع كمية مناسبة (على سبيل المثال، 10-50 ميكروغرام من البروتين لالهلام مصغرة و50 - 200 ميكروغرام ل ماكسي هلام) من الميتوكوندريا معزولة أو الأنسجة جناسة في ميكروتوبس وأجهزة الطرد المركزي في 17،000 x ج لمدة 10-15 دقيقة في 4 درجات مئوية.
2. في جل فحوصات ل سك-I و سك-V
ملاحظة: يتم تنفيذ المقايسات في درجة حرارة الغرفة. التقاط الصور، والمسح الضوئي، أو الصور من العصابات النامية للتوثيق. (هام) لا يمكن نقل البروتيناتo أغشية النيتروسليلوز بعد الانتهاء من إيغا.
- سك-I الفحص
- تجهيز.
- إعداد عازلة العازلة من 5 ملي تريس في H 2 O، مع الرقم الهيدروجيني 7.4؛ احفظه في درجة حرارة الغرفة.
- حل 10 ملغ من ناد في 1 مل من العازلة الفحص. تخزين في أليكوتس من 100 ميكرولتر في -20 درجة مئوية حتى الاستخدام. تجنب تجميد والذوبان.
- تزن 25 ملغ من تيترازوليوم نيتروبلو في أنبوب ميكروتوب.
- إعداد تثبيتي عن طريق تمييع 5 مل من حمض الخليك في 95 مل من H 2 O. احفظه في درجة حرارة الغرفة.
- إجراء الفحص.
- الجمع بين 10 مل من العازلة مقايسة مع 25 ملغ من نيتروبلو تيترازوليوم (التركيز النهائي: 2.5 ملغ / مل) و 100 ميكرولتر من 10 ملغ / مل ناد (0.1 ملغ / مل). إضافة هذا إلى كامل هلام، حارة، أو مجال الاهتمام استئصال من هلام ن.
ملاحظة: يمكن القيام بذلك في وعاء بلاستيكي أو زجاجي واضح. يرجى ملاحظة أن هذا الاختبار لا يمكن أن يؤديها بعد بن الصفحة. - اتبع تطور العصابات الزرقاء بعد التحريض لطيف (الروك) لمدة> 3 دقائق.
- إصلاح هلام في 10 - 20 مل من محلول حمض الخليك أو غسل في 5 ملي تريس، ودرجة الحموضة 7.4 لوقف رد فعل. التقاط صور فوتوغرافية للتوثيق (انظر جدول المواد).
- الجمع بين 10 مل من العازلة مقايسة مع 25 ملغ من نيتروبلو تيترازوليوم (التركيز النهائي: 2.5 ملغ / مل) و 100 ميكرولتر من 10 ملغ / مل ناد (0.1 ملغ / مل). إضافة هذا إلى كامل هلام، حارة، أو مجال الاهتمام استئصال من هلام ن.
- تجهيز.
- سك-V مقايسة
ملاحظة: يجب أن يتم مقايسة سك-V باستخدام المواد الهلامية ن أو بن مكررة، حيث يتم حضانة واحدة مع 5 ميكروغرام / مل أوليغومايسين (مثبط سك-V) لإظهار النشاط سك-V- مستقلة.- تجهيز.
- إعداد عازلة العازلة مع 35 ملي تريس و 270 ملي جليكاين. ضبط درجة الحموضة إلى 8.3 في درجة حرارة الغرفة. تخزين المخزن المؤقت المجمدة في قسامة 50 مل، ولكن تحقق من درجة الحموضة بعد التجميد والذوبان.
- إعداد 1 M مغسو 4 في H 2 O؛ مخزن في 4 درجات مئوية حتى الاستخدام.
- تزن 27.28 ملغ من الرصاص (نو 3 ) 2 في ميكروتوب.
- تزن 60 ملغ من أتب في ميكروتوب.
- حل 1 ملغ من سليغوميسين في 1 مل من الإيثانول. تخزين في -20 درجة مئوية حتى الاستخدام.
- إعداد مثبت عن طريق خلط 50 مل من الميثانول مع 50 مل من H 2 O. احفظه في درجة حرارة الغرفة.
- إجراء الفحص.
- احتضان هلام، حارة، أو مجال اهتمام من بن أو هلام ن لمدة 2 ساعة مع التحريض لطيف (الروك) في 10-20 مل من العازلة فحص ± 5 ميكروغرام / مل أوليغوميسين (50-100 ميكرولتر من 1 ملغ / مل في الإيثانول) في درجة حرارة الغرفة.
- بعد الحضانة، واستبدال المخزن المؤقت مع 14 مل من العازلة مقايسة جديدة وإضافة، في النظام، 190 ميكرولتر من 1 M مغسو 4 (14 ملم)، 27.28 ملغ من الرصاص (نو 3 ) 2 (5 ملم)، 60 ملغ من أتب ( 8 ملم)، و 75 ميكرولتر من أوليغومايسين (عند الضرورة).
- احتضان مع التحريض لطيف (الروك) ومشاهدة لراسب أبيض، كما العصابات على المواد الهلامية المعالجة أوليغوميسين سيعطي غير سكس-V تعتمد العصابات.
ملاحظة: قد يستغرق ظهور راسب عدة ساعات. - إصلاح هلام في الميثانول-(على سبيل المثال، 50٪ من الميثانول)، لأن الحلول الحمضية سوف تحل راسب الرصاص. تصوير النتائج.
ملاحظة: راسب الرصاص لا تتداخل مع تلطيخ كوماسي من المواد الهلامية.
- تجهيز.
3. نقل البروتين إلى النيتروسليلوز أو البولي فينيلين ديفلوريد (بفدف) الأغشية
- إعداد عازلة نقل من 25 ملي تريس و 200 ملي جليكاين. ضبط درجة الحموضة إلى 8.3 وإضافة 0.0005 غ / L سدز و 200 مل / لتر الميثانول. احفظه في درجة حرارة الغرفة.
- قطع نيتروسليلوز أو بفدف غشاء (حجم المسام: 0.45 ميكرون) مع شفرة حلاقة أو مقص إلى حجم أكبر قليلا من ذلك من هلام.
ملاحظة: الأغشية نيتروسليلوز تسمح ل بونسيو S تلطيخ لتقييم تحميل البروتين، في حين أن الأغشية بفدف تسفر عن فرق أكثر وضوحا بشكل حاد.
- قطع نيتروسليلوز أو بفدف غشاء (حجم المسام: 0.45 ميكرون) مع شفرة حلاقة أو مقص إلى حجم أكبر قليلا من ذلك من هلام.
- بروتوكول.
- نقع غشاء النيتروسليلوز، ورقة الترشيح، والإسفنج ل10 دقيقة على الأقل في نقل العازلة. وضع غشاء بفدف في 100٪ الميثانول لمدة 15 ثانية أو وفقا لتوصية الشركة المصنعة قبل وضعها في المخزن المؤقت نقل. ضع الكاسيت المفتوح لمجموعة النقل في وعاء مسطح مع ناقل مؤقت.
- ضع الاسفنجة و 1-2 طبقات من ورق الترشيح على الجانب الخلفي من الكاسيت. إزالة الفقاعات.
- ضع الجل على ورق الترشيح. تشير إلى اتجاه الجل من خلال لقطة زاوية من الجل و / أو الغشاء.
- وضع الغشاء على رأس هلام. إزالة جميع الفقاعات.
- وضع ورقة مرشح واسفنجة على رأس الغشاء. إزالة جميع الفقاعات في هذه السندويش.
- أغلق الكاسيت ووضعه في حامل الكاسيت من مجموعة النقل.
- نقل البروتينات في 25 V لمدة 12-18 ح.
4. إمونوبلوتينغ
- تجهيز.
- إعداد وصمة عار بونسو (500 مل) عن طريق إضافة 25 ملمن حمض الخليك و 0.5 غرام من بونسيو S إلى 475 مل من H 2 O؛ مخزن في درجة حرارة الغرفة (يمكن إعادة استخدامها).
- إعداد تريس مخزنة المالحة (تبس) مع 200 ملي كلوريد الصوديوم، 25 ملي قاعدة تريس، و 2.7 ملي بوكل. ضبط درجة الحموضة إلى 8.0 وتخزينها في درجة حرارة الغرفة.
- إعداد تبس-توين (تبست) بإضافة 0.5 مل / لتر توين 20 إلى تبس. احفظه في درجة حرارة الغرفة.
- إعداد المواد الصلبة الحليب / تبست عن طريق إذابة 5 غرام من المواد الصلبة الحليب في 100 مل من تبست. تخزين في 4 درجات مئوية واستخدامها في غضون 3 أيام.
- إعداد بسا / تبست عن طريق إذابة 3 غرام من ألبومين المصل البقري (بسا، الجزء الخامس) في 100 مل من تبست. تخزين في 4 درجات مئوية واستخدامها في غضون 3 أيام.
- بروتوكول.
- عند الانتهاء من نقل، وضع الغشاء في حل بونسيو S لتصور جميع البروتينات نقلها. تسمية موقف علامات على الغشاء مع قلم رصاص وتوثيق الغشاء الملون بونسو-S بواسطة صورة أو المسح الضوئي.
- غسل الغشاء 3 مرات لمدة 10 دقيقة كل وايث تبس تحت التحريض لطيف.
- منع الغشاء مع المواد الصلبة الحليب / تبست لمدة 1-2 ساعة في درجة حرارة الغرفة أو بين عشية وضحاها في غرفة باردة مع التحريض لطيف.
- غسل الغشاء لمدة 10 دقيقة مع تبست تحت التحريض لطيف.
- احتضان مع الأجسام المضادة الأولية بين عشية وضحاها في الغرفة الباردة تحت الإثارة لطيف. تمييع الأجسام المضادة (على سبيل المثال، 1: 1000 لمكافحة ATP5A و -NDUFB6) في بسا / تبست.
ملاحظة: معظم الأجسام المضادة تعطي إشارة أفضل على الأغشية من المواد الهلامية الأصلية عندما احتضنت بين عشية وضحاها. - غسل الغشاء لمدة 10 دقيقة مع تبست تحت التحريض لطيف.
- احتضان مع الأجسام المضادة الثانوية لمدة لا تقل عن 60 دقيقة في درجة حرارة الغرفة الانفعالات لطيف لطيف. تمييع الأجسام المضادة (1: 5،000 إلى 1: 50،000) في المواد الصلبة الحليب / تبست.
- غسل الغشاء 3 مرات لمدة 10 دقيقة في درجة حرارة الغرفة مع تبست ونر التحريض لطيف.
- خلال غسل الماضي، وإعداد تعزيز تلألؤ كيميائي (إكل) الركيزة وفقا لتعليمات مانوفاcturer.
- احتضان الغشاء مع الركيزة إكل باستخدام التعليمات المقدمة من قبل الشركة المصنعة.
- كشف إشارة على الفيلم باستخدام التعليمات المقدمة من قبل الشركة المصنعة للركيزة إكل.
5. إليكترولوتيون
- تجهيز.
- إعداد عازلة شطف من 25 ملي تريسين، 3.75 إم إيميدازول (درجة الحموضة 7.0 في 4 درجات مئوية)، و 5 ملي حمض 6-أمينوهيكسانويك.
ملاحظة: ارتداء قفازات في جميع الأوقات أثناء التعامل مع إليكترويلوتر و غشاء قبعات لمنع التلوث مع البروتينات الخارجية.
- إعداد عازلة شطف من 25 ملي تريسين، 3.75 إم إيميدازول (درجة الحموضة 7.0 في 4 درجات مئوية)، و 5 ملي حمض 6-أمينوهيكسانويك.
- في اليوم قبل استخدام الكهربائي إليكتروليوتيون الأصلي، تنفيذ ما يلي:
- نقع غشاء قبعات (قطع: 3.5 كيلو دالتون) في العازلة شطف لمدة 1 ساعة عند 60 درجة مئوية. نقل القبعات إلى العازلة شطف جديدة ونقع لهم لمدة 12 ساعة أو أكثر في الثلاجة.
ملاحظة: الوزن الجزيئي قطع 3.5 كيلو دالتون يمنع فقدان ص صغيرالروتينات التي قد تنفصل بسهولة عن مجمع البروتين من الفائدة. - غسل وحدة الكهربائي، أنابيب الزجاج، خزان، وغطاء جيدا مع الإيثانول. شطف بالماء والسماح للجافة المعدات.
- نقع غشاء قبعات (قطع: 3.5 كيلو دالتون) في العازلة شطف لمدة 1 ساعة عند 60 درجة مئوية. نقل القبعات إلى العازلة شطف جديدة ونقع لهم لمدة 12 ساعة أو أكثر في الثلاجة.
- في يوم إليكترلوتيون الأصلي، القيام بما يلي.
- وضع فريت في الجزء السفلي (بلوري) من كل أنبوب زجاجي لاستخدامها. إذا لزم الأمر، ضع أنبوب الزجاج في العازلة شطف ودفع فريت من الداخل إلى أسفل الأنبوب.
- دفع أنبوب الزجاج مع فريت في وحدة من إليكترويلوتر. الرطب جروميت مع شطف العازلة والانزلاق في أنبوب زجاجي في المكان. تأكد من أن قمم أنابيب الزجاج حتى مع جروميت.
- إغلاق الحلقات فارغة مع سدادات.
- وضع غطاء غشاء رطب في الجزء السفلي من محول سيليكون وملء محول مع شطف العازلة. ببطء ماصة المخزن المؤقت في محول صعودا وهبوطا لإزالة أي فقاعات الهواء حول غشاء غسيل الكلى.
- حرك المحول مملوء بالعازل إلى الجزء السفلي من الأنبوب الزجاجي. إزالة جميع الفقاعات التي تظهر على فريت داخل أنبوب زجاجي.
- ملء كل أنبوب زجاجي مع شطف عازلة.
- وضع العصابات استئصال من بن صفحة في أنابيب الزجاج (انظر الخطوة 1.2.9.3). قطع قطع كبيرة إلى قطع أصغر. تأكد من أن ارتفاع التعبئة داخل أنبوب زجاجي حوالي 1 سم.
- وضع وحدة بأكملها في الخزان.
- إضافة حوالي 600 مل من العازلة شطف الباردة إلى الخزان. تأكد من أن قبعات محول السيليكون في المخزن المؤقت لمنع فقاعات في غشاء غسيل الكلى.
- وضع شريط ضجة في الجزء السفلي من الخزان.
ملاحظة: سوف التحريك منع فقاعات من الالتصاق إلى الجزء السفلي من غشاء غسيل الكلى. - أزل البروتينات لمدة 4 ساعات في 350 V في غرفة باردة.
- بعد الانتهاء من شطف، وإزالة وحدة الكهربي من خزان العازلة ووضعه في بالوعة أو وعاء.
- إذا تم استخدام سدادة، وإزالته إلى درافي غرفة عازلة العليا. خلاف ذلك، استخدام ماصة كبيرة لإزالة المخزن المؤقت.
- إزالة المخزن المؤقت من كل أنبوب زجاجي وتجاهل. تأكد من أن محول السيليكون يبقى في مكان وأن السائل تحت فريت ليست بالانزعاج أو اهتزت.
- إزالة بعناية محول سيليكون، جنبا إلى جنب مع غطاء غشاء من الجزء السفلي من أنبوب زجاجي. ماصة المحتوى (حوالي 400 ميكرولتر) من غطاء سيليكون في ميكروتوب. مع آخر 200 ميكرولتر من شطف العازلة، وشطف غطاء السيليكون وإضافة إلى ميكروتوب. كرر لجميع أنابيب الزجاج.
- كما يمكن إعادة استخدام قبعات الغشاء، والحفاظ على قبعات الغشاء عن طريق وضعها في العازلة شطف تحتوي على 0.5 ملغ / مل أزيد الصوديوم. تبريدها.
ملاحظة: شطافة لديها تركيز البروتين منخفضة ويمكن أن تتركز باستخدام أجهزة تصفية الطرد المركزي.
النتائج
لتصور سوبيركومبلكسس الميتوكوندريا، تم استخدام الميتوكوندريا المعزولة حديثا من الفئران 17 ، 18 . الميتوكوندريا سوبيركومبلكسس حساسة لدورات متكررة من التجمد والذوبان، مما يؤدي إلى تفككهم، على الرغم من أن هذا قد يكون مقبولا بالنسبة لبعض الباحثين. إذا كان التجميد ضروري للتخزين، لضمان أفضل النتائج، وينبغي أن العينات لا تخضع لأكثر من دورة واحدة من التجمد والذوبان.
لتصور المجمعات إتك الميتوكوندريا مع بن الصفحة، تم تحميل 100 ميكروغرام من البروتين من الميتوكوندريا القلب معزولة على هلام 4-10٪ ( الشكل 1A ). وصمة عار كوماسي في التحميل والعازلة الكاثود كافية لتسمية المجمعات البروتين أثناء التشغيل. تظهر سوبيركومبلكسس بعد زيادة التباين رقميا (لا يظهر). ل ن بادج، عينتين من 20 ميكروغرام oبروتين من الميتوكوندريا المعزولة تم تحميلها على 3 - 8٪ هلام ن وفصلها ( الشكل 1B ). تم ملطخة ن بادج مع كوماسي و ديستند لتصور المجمعات البروتين. بعد زيادة التباين رقميا، ظهرت العديد من المجمعات البروتين مع الوزن الجزيئي أكبر من مونومر من سك-I ( الشكل 1B ، والحق). تركيزات آب المستخدمة يسمح لأكبر سوبيركومبلكسس فقط أدخل هلام من البئر. ومع ذلك، هلام تنتهي مع التدرج أقل من 3٪ آب ليست مستقرة بما فيه الكفاية للتلاعب لنقل أو للاستفزاز الفرقة أو حارة. وبالإضافة إلى ذلك، فإن تركيز منخفض من أب في الأجزاء العليا من المواد الهلامية 3-8٪ ن يحافظ على بعض التنقل من المجمعات البروتين، وهو أمر مهم إذا النظر الكهربائي إليكترويلوتيون 19 .
مونومرات و سوبيركومبلكسس من سك-I و مونومرات، ديمرز، و سوبيركومبلكسس من Cالخامس عشر هي الأنزيمية نشطة ويمكن تصور من قبل إيغا ( الشكل 1C -F ). تظهر المقايسات أنه في ميتوكوندريا القلب المعزولة، سك-I و سك-V موجودة في مجمعات البروتين أكبر من مونومرات كل منها. في مقايسة إيغا ل سك-I، يتأكسد ناد ويتم نقل الإلكترونات للحد من تيترازوليوم نيتروبلو. هذا يؤدي إلى اللون الأزرق الموضعي في الوزن الجزيئي للمونومرات سك-I و سك-I التي تحتوي على ريسبيراسوميس / سوبيركومبلكسس ( الشكل 1C ). يتم تقييم نشاط سك-V من قدرة الوحدة الفرعية F 1 لتحلل أتب ويمكن أن يتم باستخدام المواد الهلامية ن أو بن ( الشكل 1D -F ). يتفاعل أدب الناتج من تفاعل التفاعل مع الرصاص ويؤدي إلى راسب أبيض على مستوى مونومرات سك-V و ديمرز و سينثاسوميس و سوبكومبلكسس (على الأرجح الجزء F1 غير المجمع من سك-V). لاحظ أن أوليغوميسين يلغي لأبيلينغ من هذه العصابات، مؤكدا أنها تحتوي على سك-V ( الشكل 1E ).
لجميع التجارب وصفها هنا، تم استخدام المنظفات زويتيريونيك، مالتوسيد لوريل، في تركيز 2 ميكروغرام / 1 ميكروغرام من البروتين، وهو أعلى تركيز ممكن يحافظ على سوبيركومبلكسس في حين توفر نتائج متسقة وقابلة للتكرار ( الشكل 1F ). ومع ذلك، فإن فعالية اللتوريل مالتوزيد يعتمد على عدد الكثير، وظروف التخزين، والعمر. وبالتالي، فإن التركيز الدقيق المستخدمة في مختبر واحد ليست بالضرورة هي نفسها كما ذكرت في المخطوطات. تركيز مناسب من المنظفات سوف سولوبيليز الأغشية ولكن الحفاظ على المجمعات و سوبيركومبليكسس سليمة ويجب أن تحدد باستخدام مجموعة متنوعة من تركيزات من مالتوسيد لوريل ( الشكل 1F ). ل ن بادج، كان حجم العينة الكلي من 40 ميكرولتر لكل بئر تستعدإد هنا، مما أدى إلى نسبة البروتين / المنظفات من 1 ميكروغرام / 2 ميكروغرام أو نسبة المنظفات / العازلة من 1 ميكروغرام / 1 ميكرولتر (يساوي 1.9 ملم). من 40 ميكرولتر، تم تطبيق 30 ميكرولتر لكل بئر من مصغرة هلام. واستخدم المتبقية كقسامة للكشف عن فداك، والتحكم في التحميل ( الشكل 2D ).
ل إمونوبلوتينغ، ويفضل ن ل بن بادج لأن البروتينات لا يتم تحميلها مع كوماسي، والتي قد تتداخل مع الكشف عن طريق الأجسام المضادة. ويبين الشكل 2 الكشف عن سوبيركومبلكسس التي تحتوي على بروتينات سك-I و سك-V NDUFB6 و ATP5A من القلب المعزولة والكبد والدماغ الميتوكوندريا. بونسيو S التسمية بعد نقل وقبل إمونوبلوتينغ يمكن استخدامها للاحتفال علامات الوزن الجزيئي والتحكم في تحميل البروتين ( الشكل 2A ). وهذا تصور مونومرات من المجمعات البروتين من إتك على نيتروسيلولوالأغشية أوز، ولكن بونسيو S وضع العلامات ليست دائما كافية لتصور سوبيركومبلكسس الميتوكوندريا ( الشكل 2A )، والتي يمكن تحقيقها من قبل إمونوبلوتينغ.
سك-I لا تتجمع في ديمرز و تيترامرز، في حد ذاته، ولكنها تشكل على نحو متزايد أعلى سوبيركومبلكسس الوزن الجزيئي مع سك-إي و سك-إيف 14 ، 20 ، 21 . هنا، باستخدام الأجسام المضادة ضد NDUFB6 يدل على أن العينة من القلب تحتوي على أكثر مونومر سك-I وعالية الوزن الجزيئي سوبيركومبلكسس (العصابات العليا) أن الميتوكوندريا من الكبد أو الدماغ ( الشكل 2B ). كان كمية متوسطة المدى ريسبراسوم سوبيركومبلكسس أعلى بكثير في القلب مما كانت عليه في الأنسجة الأخرى ( الشكل 2B ).
باستخدام الأجسام المضادة المضادة ATP5A،يمكن الكشف عن مونومرات سك-V في الميتوكوندريا من جميع الأنسجة، في حين أن نمطا مميزا من العصابات ممثل ديمرز (D) وأكبر سوبيركومبلكسس (سك)، والتي هي واضحة للعيان في الميتوكوندريا القلب، ليست بارزة في الميتوكوندريا الكبد والدماغ ( الشكل 2C ). التعرض المفرط (1 دقيقة مقابل 20 ثانية) من إمونوبلوت يظهر عدة سكس-كومبلكبكسس التي تحتوي على سك-V، والتي يمكن أن تمثل تيترامرز و سينثاسوميس ( الشكل 2C ). هذه الأنماط من المجمعات البروتينية التي تحتوي على سك-V في القلب والكبد والدماغ الميتوكوندريا تظهر الاختلافات التي قد تكون محددة الأنسجة ولم يتم استكشافها حتى الآن.
بروتين تحميل هذه البقع يمكن اتباعها من قبل بونسيو S تلطيخ وكشف فداك قسامة المذكورة أعلاه من قبل سدز بادج، كما هو مبين في الشكل 2D .
ليس كل أنتيبويموت هي مناسبة للكشف عن البروتين داخل هيكل الرباعي أو العالي من مجمع البروتين بعد الصفحة الأصلية. للتغلب على هذه المشكلة، الممرات الكاملة والجزئية من هلام الأم يمكن تركيبها على هلام تغيير طبيعة لبعد الثاني (المواد الهلامية 2D، انظر المرجع 13 لمظاهرة). 2D الكهربائي هو أداة قيمة لتصور البروتينات في مجمع سوبرامولكولار. ومع ذلك، كما هو مبين في الشكل 2 ، سوبيركومبلكسس موجودة في كميات متغيرة، وإشارة من البروتينات الفردية من سوبيركومبلكسس قد يكون من الصعب تصور في الثانية، البعد تغيير طبيعة. للتغلب على هذه المشكلة، تم استخدام إليكترلوشن من المجمعات البروتين من المواد الهلامية الأصلية هنا. هذا يعزل العصابات سوبيركومبلكس من الممرات متعددة لانتاج المزيد من المواد لمزيد من الدراسة.
عند استخدام إليكترويلوتيون، إلا أن الفرقة من الفائدة، والتي تم تحديدها من قبل إيغا و / أو تصور على صفحة بن، هو إكسISED. يتم تنقية البروتينات من هذه القطعة من الجل من قبل شطف من هلام. ويبين الشكل 3A حارة من صفحة بن التي تم استئصال العصابات التي تمثل المونومر للتلوث بالكهرباء. لتقييم النشاط سك-V من مونومر بعد إليكترلوتيون، تم تطبيق شطافة إلى ن نون بادج. شطافة مونومر لا يزال يحتوي على الأنزيمي نشط سك-V، ولكن سوبكومبلكسس تظهر أيضا ( الشكل 3B ). تلطيخ الفضة من شطافة بعد ن ن بادج ( الشكل 3C ) أو تغيير طبيعة سدز بادج ( الشكل 3D ) يشير إلى وجود البروتينات في الشطف، و إمونوبلوتينغ ضد ATP5A يشير إلى وجود سك-V في كل من العينات ( الشكل 3D ).
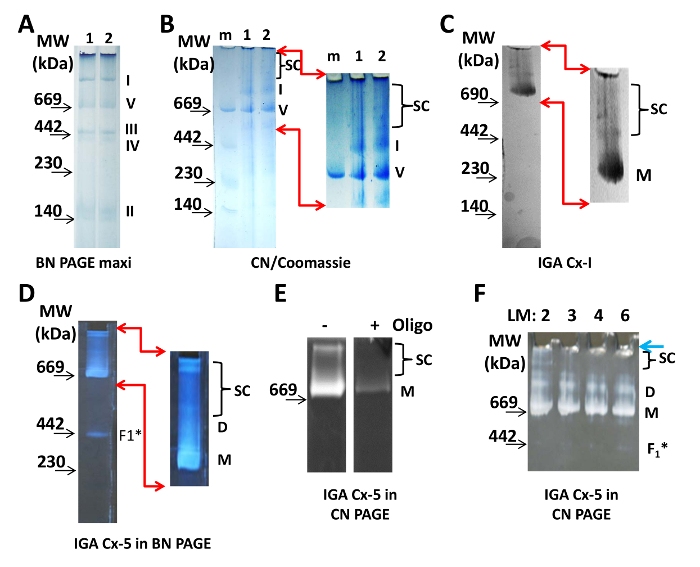
الشكل 1: التصور للميتوشأوندريال سوبيركومبلكسس. ( A ) اثنين من الممرات من 4-10٪ بن ماكسي هلام، مع عينات من الميتوكوندريا القلب معزولة. تم تشغيل قسامات من نفس العينة في كل من الممرات، في 100 ميكروغرام من البروتين لكل بئر. المونومرات من المجمعات البروتين الأول والثاني والثالث والرابع والخامس من إتك واضحة للعيان ويتم وصفها إلى اليمين من هلام. ( B ) تم فصل اثنين من عينات من الميتوكوندريا القلب (1 و 2، 20 ميكروغرام من البروتين / حارة) على صفحة ن وتصور من قبل تلطيخ كوماسي. سك يشير إلى موقف سوبيركومبلكسس بعد التكبير وتعزيز الرقمية من الجزء العلوي من هلام (يشار المنطقة من خلال الأسهم الحمراء). ( C ) تم فصل 20 ميكروغرام من البروتين الميتوكوندريا على صفحة ن 3-8٪ وتمت معالجتها ل سغ-I إيغا. صور مكبرة ومعززة رقميا تظهر فرق من المنتج رد فعل سك-I. ( D ) تم فصل 20 ميكروغرام من البروتين الميتوكوندريا على صفحة بن 3-8٪ ومعالجتها ل إيغا سك-V. Magnifi إد والصور المحسنة رقميا تظهر عصابات من رد الفعل سك-V المنتج. ( E ) تم فصل 50 ميكروغرام من البروتين الميتوكوندريا على 5-15٪ ن صفحة ومعالجتها ل إيغا سك-V دون (-) ومع (+) 5 ميكروغرام / مل أوليغوميسين (أوليغو). ( F ) بروتين الميتوكوندريا (20 ميكروغرام / حارة) ذوبان مع 2-6 ميكروغرام من مالتوسيد اللوريل / 1 ميكروغرام من البروتين، كما هو مبين في الجزء العلوي من هلام، وفصلها على هلام 3-8٪ ن تليها Cx- V إيغا. تم تصوير جميع الصور باستخدام طاولة خفيفة ( A - C ) أو سطح أسود ( D - F ). مواصفات الكاميرا في جدول المواد. يشار إلى موقع علامات الوزن الجزيئي (مو) على الجانب الأيسر من جميع اللوحات. الاختصارات: D = ديمرس؛ F 1 * = سوبكومبلكس من سك-V؛ لم = لوريل مالتوسيد؛ m = علامة الوزن الجزيئي؛ M = مونومرات؛ سك = سوبيركومبلكسس.g1large.jpg "تارجيت =" _ بلانك "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
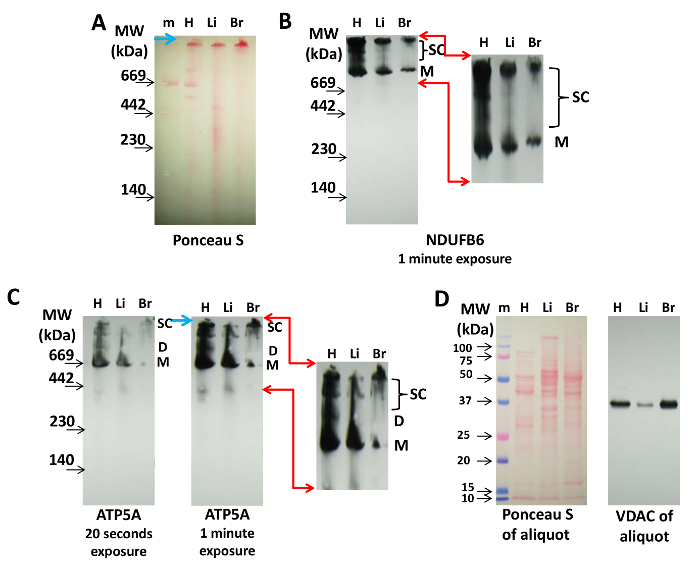
الشكل 2: الكشف عن سوبيركومبلكسس الميتوكوندريا التي كتبها إمونوبلوتينغ. 20 ميكروغرام من البروتين من القلب (H) والكبد (لي)، والدماغ (B) الميتوكوندريا تم فصلها على صفحة ن 3-8٪ ونقلها إلى غشاء النيتروسليلوز. ( A ) تلطيخ S بونسيو من الغشاء يشير إلى وجود المجمعات البروتين وعلامات الوزن الجزيئي (م). السهم الأزرق يشير إلى الجزء العلوي من هلام. ( B ) وكان سك-I البروتين، NDUFB6، إمونولابيلد على لطخة هو مبين في (A) (1 دقيقة الوقت التعرض). ( C ) تم تصور سك-V مع الأجسام المضادة المضادة ATP5A (20 ثانية والتعرض 1 دقيقة، كما هو مبين). الأسهم الحمراء في (B) و (C) تشير إلى المنطقة تضخيم وتعزيز رقميا ل فيسواليزاتيون من سك-I- و سكس-V التي تحتوي على سوبيركومبلكسس، والسهم الأزرق يشير إلى الجزء العلوي من هلام. ( D ) بونسيو S و إمونولابيلينغ من قسامة فداك من كل استخراج المستخدمة في (A)، (B)، و (C)، والتي تم فصلها عن طريق سدز بادج ونقلها إلى النيتروسليلوز. الاختصارات: M = مونومرات من سك-I أو سك-V، D = ديمرس من سك-V، سك = سوبيركومبلكسس التي تحتوي على سك-I أو سك-V. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: إليكترولوتيون من سك-V. ( A ) بن صفحة من عينة الميتوكوندريا. ويمثل الشريط المحاصر المونومر من سك-V الذي تم استئصاله ولكترلوتد. ( B ) خضعت شطافة ل ن بادج، و إيغا اللاحقة ل سك-V يوضح مونومرات (M)و سوبكومبلكسس التي تحتوي على F 1 من سك-V. ( C ) تلطيخ الفضة من ن بادج من شطافة يوضح مونومرات (M). ( D ) تلطيخ الفضة (اللوحة اليسرى) و إمونوبلوت ل ATP5A (اللوحة اليمنى) من تغيير طبيعة الصوديوم دوديسيل كبريتات (سدز) الصفحة من شطافة يدل على وجود سك-V. ل سدز بادج، يرجى الرجوع إلى البروتوكولات المنشورة في مكان آخر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
و إتك وظيفية ضروري لتوليد أتب الميتوكوندريا. مجمعات إتك قادرة على تشكيل نوعين من سوبيركومبليكسس: ريسبراسوميس (سك-I، -III، و- إيف) 1 و سينثاسوميس (سك-V) 2 . التجمع من كل مجمع مطلوب ل إتك سليمة، في حين يعتقد أن تنظيم إتك في سوبيركومبلكسس لزيادة كفاءة إتك الشاملة 5 ، 22 . كيف أن هذه سوبيركومبلكسس تجميع وتفكيك ليست مفهومة جيدا، ولكن البروتوكولات المعروضة هنا قد تسمح لفهم أفضل لهذه العمليات.
التحدي الرئيسي لدراسة التجمع إتك هو حجم هذه المجمعات البروتين. على سبيل المثال، قد تتكون ريسبراسوميس الميتوكوندريا من سك-I (حوالي 880 كيلو دالتون) وجزيء واحد أو أكثر من سك-إي (460 كيلو دالتون) و سك-إيف (200 كيلو دالتون، نشط ك ديمر)، مما أدى إلى سوبيركومبلكس مع الجزيئية الوزن من حوالي2،000 كيلو دالتون. وبالإضافة إلى ذلك، سك-V له وزن جزيئي حوالي 600 كيلو دالتون ولكن تبين لتجميع في ديمرز، تيترامرز، أوليغومرز، وشرائط ديمرز 7 ، 23 ، مما أدى إلى سوبيركومبلكسس مع الوزن الجزيئي لا يقل عن 2000 كيلو دالتون. وبالنظر إلى حجم هائل من هذه سوبيركومبلكسس، العديد من النهج ذات الصلة جزئيا استخدمت تقليديا لتحديد وتوصيف هذه سوبيركومبلكسس، من خلال هذا المختبر وغيرها من قبل 8 ، 14 ، 24 .
وقد أظهر هذا العمل تقنية هلام الأم صفحة، حيث يتم استخراج المجمعات البروتين النشطة بلطف من الغشاء الميتوكوندريا باستخدام المنظفات معتدل. المجمعات تهاجر في المواد الهلامية ويرجع ذلك أساسا إلى حجمها والتهمة جوهرية (ن بادج) أو بسبب حجم وشحنة سالبة من بروتين ملزمة كوماسي الأزرق (بن بادج). يمكن تلطيخ هذه المواد الهلامية باستخدام Cأوماسي الأزرق (على سبيل المثال، في المواد الهلامية ن) أو وصمة عار الفضة (على سبيل المثال، في بن و ن بادج) للكشف عن العصابات البروتينات.
وقد استخدم لوريل مالتوسيد للتجارب أظهرت هنا لأن هذه المنظفات عملت أكثر موثوقية. بدلا من ذلك، ديجيتونين يمكن استخدامها لاستخراج المجمعات البروتين 12 . وقد أظهرت البيانات من الميتوكوندريا معزولة من قلوب الكبار والكبد، والعقول هنا، ولكن تم تنفيذ هذه التقنيات على جنينية والبالغين القلب جناسة 8 . وأجرى آخرون هذه التقنية باستخدام الميتوكوندريا المعزولة من الخلايا المستزرعة 24 . ومع ذلك، عند استخدام تجانس الأنسجة أو الخلايا المستزرعة مع محتوى الحمض النووي عالية، قد يكون من المفيد إضافة نوكلياز لمنع تسليط الضوء خلال الكهربائي 25 .
نشاط مختلف المجمعات يمكن أن يعاد مباشرة في هلام، كما هو موضح هنا ل سك-I و سك-V، و تيكهنيك متاحة أيضا لدراسة أنشطة سك-إي، -III، و -IV 12 . ومع ذلك، يجب أن يتم تحليل هذه إيغا بعناية. أولا، يمكن أن يكون رد فعل الأنزيمية بسبب الإنزيمات غير إتك أو مجمعات تجميعها بشكل غير كامل. على سبيل المثال، فمن الروتينية لأداء سغ-V إيغا مع هلام متوازي التي تم التعامل معها مع أوليغوميسين لتمنع سليمة سك-V ( الشكل 3 ). بالإضافة إلى ذلك، الأكسدة ناد أخرى قد تمثل سكس-1 في هلام النشاط. يمكن للمرء أن يؤدي إغا موازية في وجود مثبط سك-I، مثل روتينون. ومع ذلك، في الشكل 1 ، تم استخدام الميتوكوندريا معزولة، لذلك الأكسدة ناد السيتوبلازمية لم تكن موجودة. وبالتالي، فإن البيانات على الأرجح تمثل سك-I تحتوي على مونومرات و سوبيركومبلكسس. وبالإضافة إلى ذلك، يمكن قياس هذه النتائج كميا من خلال قياس شدة الإشارة من النطاقات على الصور أو المسح الضوئي. وتشمل عيوب هذا النهج الفروق بين وداخل المواد الهلامية، والتنقل من رد الفعل المنتج، وعدم القدرة على تحديد كمية كافية المنتج في جميع أنحاء عمق هلام، وعدم خطية المحتملة من رد فعل 27 . للتغلب على هذا الأخير، اقترح البعض الحصول على معدلات ردود الفعل باستخدام الصور التسلسلية، ولكن هذا لم يحاكم هنا.
ويمكن أيضا أن يتم نقل البروتين في المواد الهلامية الأصلية إلى الأغشية، وتكوين البروتين من العصابات يمكن فحصها من قبل إمونوبلوتينغ (أظهرت هنا) أو 2D بادج (موضح في المرجع 13 ). وقد تم تحديد أحادية من المجمعات إتك تقليديا من قبل وفرة في المواد الهلامية الأصلية من الميتوكوندريا معزولة، موقعها في هلام، وموقفهم بالنسبة للبروتين علامة الجزيئية ( الشكل 1 ). وعلاوة على ذلك، ووضع العلامات من إمونوبلوتس اللاحقة مع الأجسام المضادة المحددة للمفردات من المجمعات المختلفة يساعد على تحديد معقدة وتكوينمن سوبيركومبلكسس. لذلك، مكافحة NDUFB6 و -ATP5A تحديد مونومرات و سوبيركومبلكسس التي تحتوي على سك-1 و سك-V، على التوالي، كما هو موضح هنا. ويمكن استخدام الأجسام المضادة من سكس-إي إلى إيف لنفس الغرض. في بعض الحالات، الأجسام المضادة التي تعمل بشكل جيد في تغيير طبيعة المواد الهلامية قد لا تعمل بشكل جيد في المواد الهلامية الأصلية بسبب حقيقة أن بعض الأجسام المضادة هي محددة للبروتين التشويه والتحريف أو أن حاتمة يمكن أن تكون ملثمين من قبل بروتينات أخرى في مجمع الأصلي.
التحديد الدقيق للوزن الجزيئي لهذه سوبيركومبليكسس أمر صعب، لأن معظم علامات الوزن الجزيئي المتاحة تكمن تحت حجم مونومرات سك-V. هجرة المجمعات البروتين في هلام الأصلي يعتمد على حجم، تهمة جوهرية، والمنظفات المستخدمة 28 . في الأمثلة هنا، تم تحديد مونومرات من المجمعات على أساس المواد الهلامية، وعلامات، و إمونوبلوتينغ. تم تحديد ديمرز من سك-V على أساس الهجرة النسبية بالمقارنة مع مونومرات من سك-I و -V وعلى المناعيةالنشاف. كل شيء آخر فوق مونومرات و ديمرز في المواد الهلامية، إيغاس، و إمونوبلوتس تعتبر سوبيركومبلكسس.
ويمكن أيضا أن تكون كمية من الخلايا المناعية الأصلية ل سوبيركومبلكسس من خلال تحليل كثافة الفرقة باستخدام التقنيات القياسية. لم يظهر هذا الأسلوب هنا، ولكن نشر مؤخرا يدل على هذه التقنية 8 . ويمكن أن يتم تطبيع تحميل البروتين باستخدام تلطيخ الأحمر بونسيو من حارة أو عن طريق حفظ عينة من مستخلص الميتوكوندريا لقياس كثافة الفرقة فداك على إمونوبلوت تغيير طبيعة ( الشكل 2A و D ). وعلاوة على ذلك، فإن فحص نسبة سوبيركومبلكسس إلى مونومرات في نفس إمونوبلوت هو وسيلة أخرى لقياس كثافة الفرقة، ولكن يجب أن نكون حذرين لالتقاط الصور في أوقات مختلفة خلال تطوير وصمة عار بحيث العصابات ليست أكثر عرضة للخطر.
وأخيرا، العصابات من المواد الهلامية الأصلية يمكن أن تكون إليكترولوتد لتوليد بوريفيد، والمجمعات البروتين النشطة التي يمكن تجميعها في المجمعات أعلى ترتيب ويمكن استخدامها لمزيد من الدراسات من وظيفة معقدة. على سبيل المثال، كانت مونومرات سك-V سابقا بالكهرباء وإعادة تشكيلها في الجسيمات الشحمية لإظهار الوظيفة الكهربائية 29 . وهناك نهج بديل للكهرباء المحلي هو شطف عن طريق نشر السلبي في العازلة المحيطة 16 ، ولكن هذا بطيء بالمقارنة مع إليكترلوتيون الأصلي. وأخيرا، فإن مشكلة رئيسية مع إليكترلوتيون هو الحفاظ على وظيفة الأنزيمية من مجمع البروتين الكهربائي، والمجمع قد فصل خلال تنقية. ولذلك، فإن أي فحص وظيفة بعد العزلة من قبل هذه التقنية لا بد من اختبارها بدقة.
من خلال الجمع بين هذه البروتوكولات مع المقايسات الأنزيمية وقياسات استهلاك الأكسجين، والتي تحقق وظيفة المجمعات إتك الفردية ونشاط إتك كامل 30 ، وغيرها من ميثأودس، مثل البلورات 31 والإلكترون المجهري 32 تقييم هيكل المجمعات و سوبيركومبلكسس، صورة كومبلتر من العمل الداخلي لل إتك يمكن وظهرت. نحن أقرب إلى فهم كيفية تجميع المجمعات، وكيف تتدفق الإلكترونات أسفل السلسلة، وكيف يتم ضخ البروتونات عبر الغشاء لتوليد التدرج ومن ثم العودة إلى المصفوفة من خلال سك-V لتوليد أتب. ومما لا شك فیھ أن ھذه التقنیات سوف یتم تنقیحھا لتقدیم تفاصیل إضافیة حول الھیکل والوظیفة والتنظیم الدینامیکي ل إتك.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وأيد هذا العمل من المنح المقدمة من مؤسسة مؤسس جمعية القلب الأمريكية [12GRNT12060233] ومركز أبحاث الأطفال القوي في جامعة روتشستر.
Materials
| Name | Company | Catalog Number | Comments |
| Protean II mini-gel chamber | Biorad | 1658004 | Complete set to pour and run mini-gel electrophoresis |
| Protean XL maxi-gel | Biorad | 1653189 | Complete set to pour and run maxi-gel electrophoresis |
| Gradient maker, Hoefer SG15 | VWR | 95044-704 | Pouring mini-gel gradients |
| Gradient maker, maxi-gel | VWR | GM-100 | Pouring maxi-gel gradients |
| Transfer kit | Biorad | 1703930 | Complete set to wet transfer of proteins onto membranes |
| Electroeluter model 422 | Biorad | 1652976 | Electroelution of proteins from native or SDS PAGES |
| Glass plates | Biorad | 1653308 | Short plates |
| Glass plates | Biorad | 1653312 | Spacer plates |
| Glass plates | Biorad | 1651823 | Inner plates |
| Glass plates | Biorad | 1651824 | Outer Plates |
| Power supply | Biorad | 1645070 | Power supply suitable for native electrophoresis |
| ECL-Western | Thermo Scientific | 32209 | Chemolumniscense substrate |
| SuperSignal-West Dura | Thermo Scientific | 34075 | Enhanced chemolumniscense substrate |
| Film/autoradiography film | GE Health care | 28906845 | Documentation of Western blots |
| Film processor CP1000 | Agfa | NC0872640 | |
| Canon Power Shot 640 | Canon | NA | Taking photos to document gels, membranes and blots. |
| Canon Power Shot 640 Camera hood | Canon | shielding camera for photos being taken on a light table | |
| Acrylamide/bisacrylamide | Biorad | 1610148 | 40% pre-mixed solution |
| Glycine | Sigma | G7403 | |
| SDS (sodium dodecyl sulfate) | Invitrogen | 15525-017 | |
| Tris-base | Sigma | T1503 | Buffer |
| Tricine | Sigma | T0377 | |
| Sodium deoxychelate | Sigma | D66750 | Detergent |
| EDTA | Sigma | E5134 | |
| Sucrose | Sigma | S9378 | |
| MOPS | Sigma | M1254 | Buffer |
| Imidazole | Sigma | I15513 | Buffer |
| Lauryl maltoside | Sigma | D4641 | Detergent |
| Coomassie G250 | Biorad | 161-0406 | |
| Aminohexanoic acid | Sigma | O7260 | |
| Native molecular weight kit | GE Health care | 17-0445-01 | High molecular weight calibraition kit for native electrophoresis. |
| Name | Company | Catalog Number | Comments |
| NADH | Sigma | N4505 | |
| Nitroblue tetrazolium | Sigma | N6639 | |
| Tris HCl | Sigma | T3253 | |
| ATP | Sigma | A2383 | |
| Name | Company | Catalog Number | Comments |
| Lead(II) nitrate (Pb(NO3)2): | Sigma | 228621 | |
| Oligomycin | Sigma | O4876 | |
| Name | Company | Catalog Number | Comments |
| Ponceau S | Sigma | P3504 | |
| anti-ATP5A | Abcam | ab14748 | antibody to ATP synthase subunit ATP5A |
| anti-NDUFB6 | Abcam | ab110244 | antibody to Cx-1 subunit NDUFB6 |
| anti-VDAC | Calbiochem | 529534 | antibody to VDAC |
| ECL HRP linked antibody | GE Health Care | NA931V | secondary antibody to ATP5A, NDUFB6 and VDAC |
| Blocking reagent | Biorad | 170-6404 | |
| BSA | |||
| sodium chloride | Sigma | S9888 | |
| potassium chloride | Sigma | P9541 | |
| EGTA | Sigma | E3889 | |
| Name | Company | Catalog Number | Comments |
| Silver staining Kit | Invitrogen | LC6070 |
References
- Lenaz, G., Genova, M. L. Supramolecular organisation of the mitochondrial respiratory chain: a new challenge for the mechanism and control of oxidative phosphorylation. Adv Exp Med Biol. 748, 107-144 (2012).
- Saks, V., et al. Intracellular Energetic Units regulate metabolism in cardiac cells. J Mol Cell Cardiol. 52 (2), 419-436 (2012).
- Schagger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal Biochem. 217 (2), 220-230 (1994).
- Wittig, I., Schagger, H. Native electrophoretic techniques to identify protein-protein interactions. Proteomics. 9 (23), 5214-5223 (2009).
- Genova, M. L., Lenaz, G. Functional role of mitochondrial respiratory supercomplexes. Biochim Biophys Acta. 1837 (4), 427-443 (2014).
- Hahn, A., et al. Structure of a Complete ATP Synthase Dimer Reveals the Molecular Basis of Inner Mitochondrial Membrane Morphology. Molecular cell. 63 (3), 445-456 (2016).
- Strauss, M., Hofhaus, G., Schroder, R. R., Kuhlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. EMBO J. 27 (7), 1154-1160 (2008).
- Beutner, G., Eliseev, R. A., Porter, G. A. Initiation of electron transport chain activity in the embryonic heart coincides with the activation of mitochondrial complex 1 and the formation of supercomplexes. PloS one. 9 (11), e113330(2014).
- Genova, M. L., Lenaz, G. The Interplay Between Respiratory Supercomplexes and ROS in Aging. Antioxid Redox Signal. 23 (3), 208-238 (2015).
- Rosca, M. G., et al. Cardiac mitochondria in heart failure: decrease in respirasomes and oxidative phosphorylation. Cardiovasc Res. 80 (1), 30-39 (2008).
- Kuter, K., et al. Adaptation within mitochondrial oxidative phosphorylation supercomplexes and membrane viscosity during degeneration of dopaminergic neurons in an animal model of early Parkinson's disease. Biochim Biophys Acta. 1862 (4), 741-753 (2016).
- Wittig, I., Karas, M., Schagger, H. High resolution clear native electrophoresis for in-gel functional assays and fluorescence studies of membrane protein complexes. Mol Cell Proteomics. 6 (7), 1215-1225 (2007).
- Fiala, G. J., Schamel, W. W., Blumenthal, B. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for analysis of multiprotein complexes from cellular lysates. J Vis Exp. (48), (2011).
- Acin-Perez, R., Fernandez-Silva, P., Peleato, M. L., Perez-Martos, A., Enriquez, J. A. Respiratory active mitochondrial supercomplexes. Molecular cell. 32 (4), 529-539 (2008).
- Dudkina, N. V., Eubel, H., Keegstra, W., Boekema, E. J., Braun, H. P. Structure of a mitochondrial supercomplex formed by respiratory-chain complexes I and III. Proc Nat Acad Sci USA. 102 (9), 3225-3229 (2005).
- Giorgio, V., et al. Dimers of mitochondrial ATP synthase form the permeability transition pore. Proc Nat Acad Sci USA. 110 (15), 5887-5892 (2013).
- Beutner, G., Sharma, V. K., Giovannucci, D. R., Yule, D. I., Sheu, S. S. Identification of a ryanodine receptor in rat heart mitochondria. J Biol Chem. 276 (24), 21482-21488 (2001).
- Rehncrona, S., Mela, L., Siesjo, B. K. Recovery of brain mitochondrial function in the rat after complete and incomplete cerebral ischemia. Stroke. 10 (4), 437-446 (1979).
- Schagger, H. Blue-native gels to isolate protein complexes from mitochondria. Methods Cell Biol. 65, 231-244 (2001).
- Althoff, T., Mills, D. J., Popot, J. L., Kuhlbrandt, W. Arrangement of electron transport chain components in bovine mitochondrial supercomplex I1III2IV1. EMBO J. 30 (22), 4652-4664 (2011).
- Schafer, E., et al. Architecture of active mammalian respiratory chain supercomplexes. J Biol Chem. 281 (22), 15370-15375 (2006).
- Wittig, I., Schagger, H. Supramolecular organization of ATP synthase and respiratory chain in mitochondrial membranes. Biochim Biophys Acta. 1787 (6), 672-680 (2009).
- Davies, K. M., et al. Macromolecular organization of ATP synthase and complex I in whole mitochondria. Proc Nat Acad Sci USA. 108 (34), 14121-14126 (2011).
- Lapuente-Brun, E., et al. Supercomplex assembly determines electron flux in the mitochondrial electron transport chain. Science. 340 (6140), 1567-1570 (2013).
- Antonioli, P., Bachi, A., Fasoli, E., Righetti, P. G. Efficient removal of DNA from proteomic samples prior to two-dimensional map analysis. J Chromatogr A. 1216 (17), 3606-3612 (2009).
- Wittig, I., Carrozzo, R., Santorelli, F. M., Schagger, H. Functional assays in high-resolution clear native gels to quantify mitochondrial complexes in human biopsies and cell lines. Electrophoresis. 28 (21), 3811-3820 (2007).
- Glancy, B., Balaban, R. S. Protein composition and function of red and white skeletal muscle mitochondria. Am J Physiol Cell Physiol. 300 (6), C1280-C1290 (2011).
- Wittig, I., Beckhaus, T., Wumaier, Z., Karas, M., Schagger, H. Mass estimation of native proteins by blue native electrophoresis: principles and practical hints. Mol Cell Proteomics. 9 (10), 2149-2161 (2010).
- Alavian, K. N., et al. An uncoupling channel within the c-subunit ring of the F1FO ATP synthase is the mitochondrial permeability transition pore. Proc Nat Acad Sci USA. 111 (29), 10580-10585 (2014).
- Chance, B., Williams, G. R. Respiratory enzymes in oxidative phosphorylation. IV. The respiratory chain. J Biol Chem. 217 (1), 429-438 (1955).
- Zickermann, V., et al. Structural biology. Mechanistic insight from the crystal structure of mitochondrial complex I. Science. 347 (6217), 44-49 (2015).
- Zhu, J., Vinothkumar, K. R., Hirst, J. Structure of mammalian respiratory complex I. Nature. 536 (7616), 354-358 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved