Method Article
Analysieren von Supercomplexen der mitochondrialen Elektronentransportkette mit Native Elektrophorese, In-Gel-Assays und Elektrolyse
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Trennung von funktionellen mitochondrialen Elektronentransportkettenkomplexen (Cx) IV und deren Superkomplexe unter Verwendung der nativen Elektrophorese, um Informationen über deren Zusammenbau und Struktur zu zeigen. Das native Gel kann Immunoblotting, In-Gel-Assays und Reinigung durch Elektroelution unterworfen werden, um einzelne Komplexe weiter zu charakterisieren.
Zusammenfassung
Die mitochondriale Elektronentransportkette (ETC) transduziert die aus dem Zusammenbruch verschiedener Brennstoffe abgeleiteter Energie in die bioenergetische Währung der Zelle ATP. Das ETC besteht aus 5 massiven Proteinkomplexen, die sich auch in Supercomplexe mit dem Namen respirasomes (CI, C-III und C-IV) und Synthasomen (CV) zusammensetzen, die die Effizienz des Elektronentransports und der ATP-Produktion erhöhen. Seit über 50 Jahren werden verschiedene Methoden zur ETC-Funktion eingesetzt, aber diese Protokolle geben keine Informationen über die Montage von einzelnen Komplexen und Supercomplexen. Dieses Protokoll beschreibt die Technik der nativen Gel-Polyacrylamid-Gelelektrophorese (PAGE), ein Verfahren, das vor mehr als 20 Jahren modifiziert wurde, um die ETC-Komplexstruktur zu untersuchen. Die native Elektrophorese erlaubt die Trennung von ETC-Komplexen in ihre aktiven Formen, und diese Komplexe können dann unter Verwendung von Immunoblotting, In-Gel-Assays (IGA) und Reinigung durch Elektroelution untersucht werden. Durch die Kombination der ReSorten der nativen Gel-PAGE mit denen anderer mitochondrialer Assays ist es möglich, ein komplettes Bild der ETC-Aktivität, ihrer dynamischen Assemblierung und Demontage zu erhalten und wie dies die mitochondriale Struktur und Funktion reguliert. Diese Arbeit wird auch Beschränkungen dieser Techniken diskutieren. Zusammenfassend lässt sich sagen, dass die Technik der nativen PAGE, gefolgt von Immunoblotting, IGA und Elektroelution, die nachstehend dargestellt ist, eine leistungsfähige Möglichkeit ist, die Funktionalität und Zusammensetzung von mitochondrialen ETC-Supercomplexen zu untersuchen.
Einleitung
Mitochondriale Energie in Form von ATP ist nicht nur essentiell für das Zellüberleben, sondern auch für die Regulation des Zelltods. Die Erzeugung von ATP durch oxidative Phosphorylierung erfordert eine funktionelle Elektronentransportkette (ETC, Cx-I bis IV) und mitochondriale ATP-Synthase (Cx-V). Jüngste Studien haben gezeigt, dass diese großen Proteinkomplexe zu Superkomplexen, sogenannten respirasomen und Synthasomen 1 , 2 , organisiert sind . Es ist anspruchsvoll, die Montage-, Dynamik- und Aktivitätsregulierung dieser massiven Komplexe und Superkomplexe zu analysieren. Während Sauerstoffverbrauchsmessungen, die mit einer Sauerstoffelektrode durchgeführt wurden, und Enzymtests, die unter Verwendung eines Spektrophotometers durchgeführt wurden, wertvolle Informationen über die ETC-Komplexaktivität liefern können, können diese Assays keine Information über die Anwesenheit, die Größe und die Untereinheitszusammensetzung des Proteinkomplexes oder der betroffenen Superkomplexe liefern. Allerdings ist die Entwicklung von blau und klar native (BN und CN) SEITE 3 hat ein leistungsfähiges Werkzeug geschaffen, um wichtige Informationen über komplexe Komposition und Montage / Demontage und über die dynamische Regulierung der supramolekularen Organisation dieser lebenswichtigen Atmungskomplexe unter physiologischen und pathologischen Zuständen aufzudecken.
Die Zusammenstellung dieser Komplexe in übergeordnete Superkomplexe scheint die mitochondriale Struktur und Funktion 5 zu regulieren. Beispielsweise erhöht die respirasome Anordnung den Wirkungsgrad des Elektronentransfers und die Erzeugung der Protonenmotivkraft über die mitochondriale innere Membran 5 . Darüber hinaus erhöht die Zusammenstellung von Synthasomen nicht nur die Effizienz der ATP-Produktion und die Übertragung von Energieäquivalenten in das Zytoplasma 2 , sondern auch die mitochondriale innere Membran in die tubuläre Cristae 6 , </ Sup> 7 Untersuchungen der superkomplexen Assemblierung bei der Herzentwicklung bei Mausembryonen zeigen, dass die Erzeugung von Cx-I-haltigen Supercomplexen im Herzen bei etwa embryonalen Tag 13,5 8 beginnt. Andere haben gezeigt, dass die Menge an Cx-I-haltigen Superkomplexen im Herzen aufgrund von Alterung oder Ischämie / Reperfusionsverletzungen 9 , 10 abnimmt oder eine Rolle bei der Progression neurodegenerativer Erkrankungen spielen kann 11 .
Dieses Protokoll beschreibt Methoden für native Gel-PAGE, die verwendet werden können, um die Zusammenstellung und Aktivität der ETC-Komplexe und Superkomplexe zu untersuchen. Das ungefähre Molekulargewicht von mitochondrialen Superkomplexen kann durch Trennen der Proteinkomplexe in CN- oder BN-Polyacrylamidgelen bestimmt werden. CN-PAGE ermöglicht auch die Visualisierung der enzymatischen Aktivität aller mitochondrialen Komplexe direkt im Gel (In-Gel-Assays;IGA) 12 . Diese Arbeit zeigt die Aktivität von respirasomen, indem sie die Fähigkeit von Cx-I, NADH durch IGA zu oxidieren, und die Anwesenheit von Synthasomen aufgrund der ATP-hydrolysierenden Aktivität von Cx-V durch IGA hervorhebt. Die Mehrfachkomplexe und die Cx-I und Cx-V enthaltenden Komplexe können auch durch Übertragung der Proteine auf Nitrozellulosemembranen und Durchführen von Immunoblotting nachgewiesen werden. Der Vorteil dieses Ansatzes besteht darin, dass BN oder CN PAGE im Allgemeinen Proteinkomplexe auf der Grundlage ihrer physiologischen Größe und Zusammensetzung trennt; Der Transfer zu einer Membran bewahrt dieses Muster von Bändern. Die Analyse von Proteinkomplexen in einer BN- oder CN-PAGE kann auch mit 2D-PAGE durchgeführt werden (siehe Fiala et al., 13 für eine Demonstration) oder durch Saccharose-Dichte-Zentrifugation 14 , 15 . Um ein bestimmtes Band weiter zu analysieren, kann es aus der BN PAGE herausgeschnitten werden, und die Proteine aus diesem Proteinkomplex können gereinigt werdenD durch elektrolytieren sie unter nativen Bedingungen. Eine native Elektroelution kann innerhalb von wenigen Stunden durchgeführt werden, was einen signifikanten Unterschied zur passiven Diffusion (wie in Referenz 16 verwendet) von Proteinen aus einem Gel in den umgebenden Puffer machen könnte.
Zusammenfassend beschreiben diese Methoden mehrere Ansätze, die die weitere Charakterisierung von hochmolekularen Superkomplexen aus mitochondrialen Membranen ermöglichen.
Protokoll
Alle Experimente wurden unter Verwendung von Herzen aus C57BL / 6N-Mäusen (Wildtyp) durchgeführt. Die Mäuse wurden vor der zervikalen Luxation mit CO 2 betäubt, und alle Verfahren wurden in strikter Übereinstimmung mit der Abteilung für Labortiermedizin an der Universität von Rochester und in Übereinstimmung mit dem Staatsrecht, dem Bundesgesetz und der NIH-Politik durchgeführt. Das Protokoll wurde vom Institutional Animal Care and Use Committee der University of Rochester (Universitätsausschuss für Tierressourcen) genehmigt.
1. CN und BN PAGE
HINWEIS: Alle Geräte, die für BN und CN PAGE verwendet werden, müssen frei von Spülmittel sein. Um dies zu gewährleisten, waschen Sie alle Geräte mit 0,1 M Salzsäure, gefolgt von weitgehendem Spülen mit deionisiertem H 2 O.
- Vorbereitung
- Vorbereiten des Anodenpuffers, bestehend aus 25 mM Imidazol, pH 7,0, bei 4 ° C; Bei 4 ° C aufbewahren.
- Kathodenpuffer für CN oder BN PAGE vorbereiten.
- Für CN PAGE verwenden Sie 7,5 mM Imidazol und 50 mM Tricin; 0,5 g Natriumdeoxycholat und 0,2 g Laurylmaltosid pro Liter Puffer zugeben. Den pH-Wert auf 7,0 bei 4 ° C einstellen und bei 4 ° C lagern.
- Für BN PAGE verwenden Sie 7,5 mM Imidazol und 50 mM Tricin und stellen den pH-Wert auf 7,0 bei 4 ° C ein. Bei 4 ° C aufbewahren.
- Für hellblauen BN-Kathodenpuffer verwenden Sie 7,5 mM Imidazol und 50 mM Tricin. Den pH-Wert auf 7,0 bei 4 ° C einstellen und 20 mg Coomassie pro Liter Puffer zugeben. Bei 4 ° C aufbewahren.
- Extrahieren von Extraktionspuffer (EB) mit 50 mM NaCl, 50 mM Imidazol, 2 mM Aminocapronsäure und 1 mM EDTA. Den pH-Wert auf 7,0 bei 4 ° C einstellen und bei 4 ° C lagern.
- 3x Gelpuffer (verwendet für BN- und CN-Gele) mit 75 mM Imidazol und 1,5 M Aminocapronsäure vorbereiten. Den pH-Wert auf 7,0 bei 4 ° C einstellen und bei 4 ° C lagern.
- Bereiten Sie einen Beladungspuffer (LB) von 0,01 g Ponceau S, 5 g Glycerin und 5 ml H 2 O vor. Im Raum aufbewahrenTemperatur.
- Bereiten Sie Coomassie-Blau vor, indem Sie 50 mg Coomassie zu 1 ml 500 mM 6-Aminohexansäure hinzufügen. Den pH-Wert auf 7,0 bei 4 ° C einstellen und bei 4 ° C lagern.
- Bereiten Sie 20 mM und 200 mM Laurylmaltosid in H 2 O vor. Machen Sie Aliquots von 200 & mgr; l und lagern Sie sie gefroren. Das Waschmittel vor dem Gebrauch auftauen
| 3% bis 8% (mini) | 4% bis 10% (maxi) | |||
| 0,5 Gele (Licht) | 0,5 Gele (schwer) | 0,5 Gele (Licht) | 0,5 Gele (schwer) | |
| AAB (mL) | 0,42 | 1.3 | 2.5 | 7.7 |
| CN / BN-Puffer (ml) | 1.6 | 1.6 | 8.5 | 8.5 |
| H & sub2 ; O (ml) | 2.7 | 1.4 | 14 | 6.3 |
| Glycerin (g) | 0 | 0,47 | 0 | 2.5 |
| Volumen (ml) | 4.72 | 4.77 | 25 | 25 |
| APS (& mgr; l) | 27 | 27 | 65 | 65 |
| TEMED (μL) | 4 | 4 | 10 | 10 |
Tabelle 1: Mengen der Zutaten, die 1 Mini- oder Maxi-PAGE gießen müssen. Die in dieser Tabelle verwendeten Volumina werden für 1 Mini- oder 1 Maxi-Gel, 1,5 mm dick berechnet. Das Volumen der AAB basiert auf einer 40% Stammlösung. Licht und schwer beziehen sich auf das KonzentratIon von AAB. APS und TEMED werden nach jeder Säule des Gradientenmischers mit AAB-Lösung gefüllt.
- Gießen und laufende Gele
HINWEIS: Verwenden Sie 3-8% oder 4-10% Acrylamid / Bisacrylamid (AAB) Gradienten für CN oder BN Gele. Tabelle 1 fasst die Mengen an Puffer, AAB, H 2 O, Glycerin, Ammoniumpersulfat (APS) und Tetramethylethylendiamin (TEMED) für ein Mini-Gel (85 mm breit x 73 mm hoch x 1,5 mm dick) oder maxi-Gel (160 Mm breit x 200 mm hoch x 1,5 mm dick). Baugruppen aus Glasplatten mit CN- oder BN-Gelen können in einem Beutel mit ein paar ml 1x Gelpuffer gekühlt oder in Papiertuch eingewickelt werden, das mit 1x Gelpuffer für die Lagerung benetzt ist. Die Gele sind für bis zu einer Woche stabil.- Um das Gel zu gießen, legen Sie den Gradientenmischer auf eine erhöhte Rührplatte, um sicherzustellen, dass das Gel durch die Schwerkraft in die vorbereitete Gelkammer fließt.
- Füllen Sie die Ausströmkammer des Gradientenmischers mit 4,77 / 25 mL (Mini / maxi) der schweren Lösung (mit einer höheren Konzentration von AAB).
- Schieben Sie den Stop-Cock-Anschluss vorsichtig zwischen der schweren und hellen Kammer und lassen Sie einen Tropfen Lösung, um auf die andere Seite zu gelangen.
HINWEIS: Dies drückt Luftblasen aus dem Verbindungsrohr und dem Absperrhahn, wodurch ein Durchfluss zwischen den beiden Kammern verhindert wird. Dies kann nicht geschehen, wenn beide Seiten bereits gefüllt sind, weil der gleiche Druck die Blase daran hindern wird, sich zu bewegen. - Füllen Sie die andere Kammer des Gradientenmischers mit 4,72 / 25 mL (Mini / Maxi) der Lichtlösung.
- Mit der schweren Lösung einen Rührstab in die Ausströmkammer geben und unter Rühren beginnen. Verwenden Sie eine Rührstab-Geschwindigkeit, die keine Blasenbildung verursacht.
- Schnelles Hinzufügen von APS und TEMED zu jeder Kammer, um die Polymerisation einzuleiten.
- Öffnen Sie die Verbindung zwischen den beiden Kammern des Gradientenmischers und lassen Sie ein paar Sekunden mischen, bevor Sie die Ausströmkammer öffnen, um das Gel zu gießen.
HINWEIS: Gravity wiLl beide Kammern gleichmäßig ablassen und das Mischen des Lichts in die schwere Lösung wird langsam die Acrylamiddichte von der Unterseite zur Oberseite des Gels verringern. Verwenden Sie den gesamten Inhalt, der im Gradientenmischer ist, um das Gel zu gießen.- Am Ende, sorgfältig montieren Sie den Kamm, mit den Brunnen in das Gel, um Blasen zu vermeiden und Schichtmischen.
- Sofort den Gradientenmischer mit Ethanol waschen, um jedes Gel auszuspülen. Mit Wasser abspülen und das zweite Gel gießen Lassen Sie die Gele polymerisieren (in der Regel weniger als 20 min wird für Mini-Gele benötigt).
- Um die Gele zu führen, montieren Sie sie in die Elektrodenmontageklemme und füllen Sie die mittlere / obere Kammer mit CN oder hellblauem BN-Kathodenpuffer. Warten Sie einige Minuten, um auf Lecks zu prüfen, bevor Sie Anodenpuffer der äußeren / unteren Kammer hinzufügen.
- Ziehen Sie die Brunnenkämme vorsichtig heraus und waschen Sie die Wells mit Kathodenpuffer mit einer Spritze oder einer Pipette.
- Führen Sie die Gele in einem kalten Raum (4 ° C) oder vollständig in Eis verpackt.
- Für CN Mini-PAGE, 100 V für die erste Stunde und 200 V bis fertig, in der Regel eine zusätzliche 1-1,5 h. Alternativ die CN Mini-PAGE bei 30-40 V über Nacht laufen lassen.
HINWEIS: Der Fokus liegt hier auf hochmolekularen Proteinkomplexen, so dass Proteinkomplexe mit einem Molekulargewicht von weniger als 140 kDa aus dem Gel austreten. Kürzere Laufzeiten für die Elektrophorese können verwendet werden, um niedermolekulare Komplexe zurückzuhalten. - Für BN maxi-PAGE verwenden Sie 100 V und führen die Gele über Nacht (ca. 18 h).
HINWEIS: Der Strom wird sehr niedrig (<15 mA), so dass eine Stromversorgung, die diese Bedingungen verarbeiten kann, benötigt wird. Zu diesem Zeitpunkt können die Gele für IGA oder Immunoblotting verwendet werden. In einigen Fällen können Bänder oder Bahnen aus den Gelen mit einer Rasierklinge auf einer Glasplatte für die Elektroelution ausgeschnitten werden.
- Für CN Mini-PAGE, 100 V für die erste Stunde und 200 V bis fertig, in der Regel eine zusätzliche 1-1,5 h. Alternativ die CN Mini-PAGE bei 30-40 V über Nacht laufen lassen.
- Probenvorbereitung
HINWEIS: Membran-gebundene mitochondriale Superkomplexe müssen aus th extrahiert werdenE innere mitochondriale Membran. Um mitochondriale Supercomplexe zu konservieren, verwenden Sie entweder frisch isolierte Mitochondrien oder Proben, die nur einmal eingefroren und aufgetaut wurden. Die unten aufgeführten Berechnungen / Volumina sind für Mini-Gele gegeben (der Brunnen eines 10-Well-Kamms in einem 1,5 mm dicken Gel hält bis zu 35-40 μl) und Maxi-Gelen (der Brunnen eines 15-Well-Kamms hält sich an 200 & mgr; l). Darüber hinaus speichern Sie ein Aliquot jeder Probe (meist 10 μl), um auf einem denaturierenden SDS-Gel für die Detektion des spannungsabhängigen Anionkanals (VDAC) als Ladesteuerung zu laufen.- Legen Sie eine geeignete Menge ( z. B. 10-50 μg Protein für Miniringe und 50 - 200 μg für Maxi-Gel) von isolierten Mitochondrien oder Gewebehomogenat in Mikroröhrchen ein und zentrifugieren bei 17.000 xg für 10-15 min bei 4 ° C.
HINWEIS: Dieser Schritt entfernt einige der löslichen mitochondrialen Matrix- und / oder zytosolischen Proteine. - Aspirieren und verwerfen Sie den Überstand und fügen Sie Extraktionspuffer zu der gewünschten Menge hinzuAuf das Gel aufladen Das Sediment sanft auf Eis auffrischen Falls gewünscht, füge hier eine allgemeine Protease-Inhibitor-Mischung hinzu.
HINWEIS: Basierend auf der hier verwendeten Ausrüstung wurden 30 μl für ein Mini-Gel und 100 μl für ein Maxi-Gel verwendet, wobei das Protein / Puffer-Verhältnis auf nicht mehr als 2 μg Protein auf 1 μl Puffer beschränkt wurde. - Add Detergens ( z. B. 2 μg Laurylmaltosid / 1 μg Protein, siehe die repräsentativen Ergebnisse und Diskussion für weitere Informationen).
HINWEIS: Im Allgemeinen wird Laurylmaltosid verwendet, aber auch Digitonin kann verwendet werden. - Inkubieren auf Eis für 20 min. Vorsicht mischen am Anfang und gelegentlich während der Inkubation durch Triturieren und / oder Rühren der Röhre.
- Zentrifugieren bei 17.000 xg für 10 min bei 4 ° C, um jegliche Membran- und Gewebefragmente zu entfernen.
- Übertragen Sie den Überstand auf eine neue Röhre. Für CN-Proben wird 1 μl LB für je 10 μl Probenvolumen zugegeben; Das Gesamtvolumen der Probe sollte appEtwa 40 μl für ein Mini-Gel und 130 μl für ein Maxi-Gel. Bei BN-Proben füge Coomassie den Proben hinzu, so dass das Verhältnis von Farbstoff zu Waschmittel 1: 4 (w / w) beträgt.
- Laden Sie 30 und 120 μl der Proben in die Vertiefungen des Mini- oder Maxi-Gels. Verwenden Sie die restlichen 10 μl aus jeder Probe für das denaturierende SDS-Gel, um VDAC als Ladesteuerung zu detektieren.
- Zur Herstellung der Molekulargewichtsmarker löst man 1 Durchstechflasche einer hochmolekularen Kalibriermischung (siehe Tabelle der Materialien für weitere Informationen) in 60 μl BN / CN-Gelpuffer und fügt 120 μl H 2 0 und 20 μl hinzu PFUND. 15 μl pro Spur laden.
- Führen Sie die Gele wie in Schritt 1.2.9.2 umrissen aus.
- Legen Sie eine geeignete Menge ( z. B. 10-50 μg Protein für Miniringe und 50 - 200 μg für Maxi-Gel) von isolierten Mitochondrien oder Gewebehomogenat in Mikroröhrchen ein und zentrifugieren bei 17.000 xg für 10-15 min bei 4 ° C.
2. In-Gel-Assays für Cx-I und Cx-V
HINWEIS: Die Assays werden bei Raumtemperatur durchgeführt. Nehmen Sie Fotos, Scans oder Bilder von den Entwicklungsbändern für die Dokumentation. (Wichtig) Proteine können nicht aufgetragen werdenO Nitrozellulosemembranen nach Abschluss einer IGA.
- Cx-I-Assay
- Vorbereitung.
- Einen Testpuffer von 5 mM Tris in H 2 O mit einem pH-Wert von 7,4 vorbereiten; bei Raumtemperatur lagern.
- 10 mg NADH in 1 ml Assaypuffer auflösen. In Aliquots von 100 μl bei -20 ° C bis zur Verwendung aufbewahren; Vermeiden Einfrieren und Auftauen.
- 25 mg Nitroblau-Tetrazolium in ein Mikroröhrchen wiegen.
- Das Fixiermittel durch Verdünnen von 5 ml Essigsäure in 95 ml H & sub2; O zubereiten; bei Raumtemperatur lagern.
- Durchführung des Assays
- Kombinieren Sie 10 ml Assaypuffer mit 25 mg Nitroblau-Tetrazolium (Endkonzentration: 2,5 mg / ml) und 100 μl 10 mg / ml NADH (0,1 mg / ml). Fügen Sie dies dem gesamten Gel, einer Spur oder einem interessierenden Bereich hinzu, der aus einem CN-Gel herausgeschnitten ist.
HINWEIS: Dies kann in einem klaren Kunststoff- oder Glasbehälter erfolgen. Bitte beachten Sie, dass dieser Test nach BN PAGE nicht durchgeführt werden kann. - Folgen Sie der Entwicklung der blauen Bänder nach sanfter Bewegung (Rocker) für> 3 min.
- Fixieren Sie das Gel in 10 - 20 ml Essigsäurelösung oder waschen Sie sich in 5 mM Tris, pH 7,4, um die Reaktion zu stoppen. Nehmen Sie Fotos für die Dokumentation (siehe Tabelle der Materialien).
- Kombinieren Sie 10 ml Assaypuffer mit 25 mg Nitroblau-Tetrazolium (Endkonzentration: 2,5 mg / ml) und 100 μl 10 mg / ml NADH (0,1 mg / ml). Fügen Sie dies dem gesamten Gel, einer Spur oder einem interessierenden Bereich hinzu, der aus einem CN-Gel herausgeschnitten ist.
- Vorbereitung.
- Cx-V-Assay
HINWEIS: Der Cx-V-Assay sollte mit doppelten CN- oder BN-Gelen durchgeführt werden, wobei man mit 5 μg / ml Oligomycin (einem Cx-V-Inhibitor) inkubiert wird, um eine Cx-V-unabhängige Aktivität zu zeigen.- Vorbereitung.
- Einen Testpuffer mit 35 mM Tris und 270 mM Glycin vorbereiten; Den pH-Wert bei Raumtemperatur auf 8,3 einstellen. Lagern Sie den Puffer in 50-ml-Aliquoten eingefroren, aber überprüfen Sie den pH-Wert nach dem Einfrieren und Auftauen.
- 1 M MgSO 4 in H 2 O vorbereiten; Bei 4 ° C bis zur Verwendung aufbewahren.
- 27,28 mg Pb (NO 3 ) 2 in ein Mikroröhrchen wiegen.
- 60 mg ATP in ein Mikroröhrchen wiegen
- 1 mg o. AuflösenLigomycin in 1 ml Ethanol. Bei -20 ° C bis zum Gebrauch aufbewahren.
- Vorbereiten eines Fixiermittels durch Mischen von 50 ml Methanol mit 50 ml H & sub2; O; bei Raumtemperatur lagern.
- Durchführung des Assays
- Inkubieren eines Gels, einer Spur oder eines interessierenden Bereichs aus einem BN- oder CN-Gel für 2 h unter leichtem Rühren (Rocker) in 10-20 ml Assaypuffer ± 5 μg / ml Oligomycin (50-100 μl 1 mg / Ml in Ethanol) bei Raumtemperatur.
- Nach der Inkubation wird der Puffer mit 14 ml frischem Testpuffer ersetzt und in der Reihenfolge 190 μl 1 M MgSO 4 (14 mM), 27,28 mg Pb (NO 3 ) 2 (5 mM), 60 mg ATP ( 8 mM) und 75 & mgr; l Oligomycin (falls erforderlich).
- Inkubieren mit sanfter Bewegung (Rocker) und beobachten Sie auf einen weißen Niederschlag, da Banden auf Oligomycin-behandelten Gelen nicht-Cx-V-abhängige Banden geben.
HINWEIS: Das Aussehen des Niederschlags kann mehrere Stunden dauern. - Das Gel in Methanol-Basiertes Fixiermittel ( z. B. 50% Methanol), da saure Lösungen den Blei-Niederschlag auflösen. Fotografieren Sie die Ergebnisse.
HINWEIS: Der Blei-Niederschlag stört nicht die Coomassie-Färbung der Gele.
- Vorbereitung.
3. Proteinübertragung auf Nitrocellulose oder Polyvinyliden-Difluorid (PVDF) Membranen
- Bereiten Sie einen Transferpuffer von 25 mM Tris und 200 mM Glycin vor. Den pH-Wert auf 8,3 einstellen und 0,0005 g / l SDS und 200 mL / l Methanol zugeben. Bei Raumtemperatur lagern.
- Schneiden Sie eine Nitrozellulose- oder PVDF-Membran (Porengröße: 0,45 μm) mit einer Rasierklinge oder einer Schere bis zu einer Größe, die etwas größer ist als die des Gels.
ANMERKUNG: Nitrocellulosemembranen erlauben die Ponceau S-Färbung, um die Proteinbeladung zu beurteilen, während PVDF-Membranen schärfer definierte Banden ergeben.
- Schneiden Sie eine Nitrozellulose- oder PVDF-Membran (Porengröße: 0,45 μm) mit einer Rasierklinge oder einer Schere bis zu einer Größe, die etwas größer ist als die des Gels.
- Protokoll.
- Tauchen Sie die Nitrozellulosemembran, das Filterpapier und die Schwämme für einMindestens 10 min im Transferpuffer. Legen Sie die PVDF-Membran in 100% Methanol für 15 s oder entsprechend der Empfehlung des Herstellers, bevor Sie ihn in den Transferpuffer legen. Legen Sie die offene Kassette des Transferkits in eine flache Schale mit Transferpuffer.
- Legen Sie den Schwamm und 1-2 Schichten Filterpapier auf die Rückseite der Kassette. Entfernen Sie die Blasen.
- Legen Sie das Gel auf das Filterpapier. Geben Sie die Orientierung des Gels an, indem Sie eine Ecke des Gels und / oder der Membran schneiden.
- Legen Sie die Membran auf das Gel. Alle Blasen entfernen
- Legen Sie Filterpapier und einen Schwamm auf die Membran. Entfernen Sie alle Blasen in diesem Sandwich.
- Schließen Sie die Kassette und legen Sie sie in den Kassettenhalter des Transferkits.
- Übertragen Sie die Proteine bei 25 V für ca. 12-18 h.
4. Immunoblotting
- Vorbereitung.
- Bereiten Sie einen Ponceau-Stain (500 ml) durch Zugabe von 25 ml vorVon Essigsäure und 0,5 g Ponceau S zu 475 ml H 2 O; Bei Raumtemperatur lagern (kann wiederverwendet werden).
- Bereiten Sie Tris-gepufferte Kochsalzlösung (TBS) mit 200 mM NaCl, 25 mM Tris-Base und 2,7 mM KCl vor. Den pH-Wert auf 8,0 einstellen und bei Raumtemperatur lagern.
- TBS-Tween (TBST) durch Zugabe von 0,5 ml / l Tween 20 zu TBS zubereiten; bei Raumtemperatur lagern.
- Bereiten Sie Milchfeststoffe / TBST vor, indem Sie 5 g Milchfeststoffe in 100 ml TBST auflösen. Bei 4 ° C aufbewahren und innerhalb von 3 Tagen verwenden.
- Bereiten Sie BSA / TBST vor, indem Sie 3 g Rinderserumalbumin (BSA, Fraktion V) in 100 ml TBST auflösen. Bei 4 ° C aufbewahren und innerhalb von 3 Tagen verwenden.
- Protokoll.
- Wenn die Übertragung beendet ist, legen Sie die Membran in die Ponceau S-Lösung, um alle übertragenen Proteine zu visualisieren. Beschriften Sie die Position der Marker auf der Membran mit einem Bleistift und dokumentieren Sie die Ponceau-S-gefärbte Membran durch Foto oder Scan.
- Waschen Sie die Membran 3 mal für 10 min jedes wiTh TBS unter sanfter Aufregung.
- Blockieren Sie die Membran mit Milchfeststoffen / TBST für 1-2 h bei Raumtemperatur oder über Nacht in einem kalten Raum mit sanfter Bewegung.
- Die Membran für 10 min mit TBST unter leichtem Rühren waschen.
- Inkubieren mit primärem Antikörper über Nacht im kalten Raum unter leichtem Rühren. Verdünnen Sie den Antikörper ( zB 1: 1.000 für anti-ATP5A und -NDUFB6) in BSA / TBST.
HINWEIS: Die meisten Antikörper geben ein besseres Signal auf Membranen aus nativen Gelen, wenn sie über Nacht inkubiert werden. - Die Membran für 10 min mit TBST unter leichtem Rühren waschen.
- Inkubieren mit sekundärem Antikörper für mindestens 60 min bei Raumtemperatur und schon bei geringem Rühren. Verdünnen Sie den Antikörper (1: 5.000 bis 1: 50.000) in Milchfeststoffen / TBST.
- Die Membran 3 mal für 10 min bei Raumtemperatur mit TBST abschrecken.
- Während der letzten Wäsche, das verbesserte Chemolumineszenz (ECL) Substrat gemäß den Anweisungen des Manufa vorbereitenCturer
- Inkubieren Sie die Membran mit ECL-Substrat mit Anweisungen des Herstellers.
- Erfassen Sie das Signal auf dem Film unter Verwendung von Anweisungen, die vom Hersteller des ECL-Substrats bereitgestellt werden.
5. Elektrolyse
- Vorbereitung.
- Bereiten Sie einen Elutionspuffer von 25 mM Tricin, 3,75 mM Imidazol (pH 7,0 bei 4 ° C) und 5 mM 6-Aminohexansäure vor.
HINWEIS: Bei der Handhabung der Elektroderuter- und Membrankappen die Handschuhe tragen, um eine Kontamination mit externen Proteinen zu vermeiden.
- Bereiten Sie einen Elutionspuffer von 25 mM Tricin, 3,75 mM Imidazol (pH 7,0 bei 4 ° C) und 5 mM 6-Aminohexansäure vor.
- Am Tag vor der Verwendung des Elektrogenerators für die native Elektroelution:
- Die Membrankappen (Cut-off: 3,5 kDa) im Elutionspuffer 1 h bei 60 ° C einweichen. Übertragen Sie die Kappen auf frischen Elutionspuffer und tränken Sie sie für 12 Stunden oder länger im Kühlschrank.
HINWEIS: Ein Cut-off-Molekulargewicht von 3,5 kDa verhindert den Verlust von kleinen pRoteine, die sich leicht von dem interessierenden Proteinkomplex distanzieren können. - Das Elektrodenmodul, Glasröhrchen, Tank und Deckel gründlich mit Ethanol waschen. Mit Wasser abspülen und die Ausrüstung trocknen lassen.
- Die Membrankappen (Cut-off: 3,5 kDa) im Elutionspuffer 1 h bei 60 ° C einweichen. Übertragen Sie die Kappen auf frischen Elutionspuffer und tränken Sie sie für 12 Stunden oder länger im Kühlschrank.
- Am Tag der nativen Elektroelution, folgendes tun.
- Legen Sie eine Fritte in den Boden (frosted) von jedem Glasrohr verwendet werden. Wenn nötig, legen Sie das Glasrohr in den Elutionspuffer und schieben Sie die Fritte von innen nach unten auf die Röhre.
- Schieben Sie die Glasröhre mit der Fritte in das Modul des Elektrogenerators. Die Durchführungshülse mit Elutionspuffer benetzen und die Glasröhre schieben. Stellen Sie sicher, dass die Oberseiten der Glasrohre sogar mit der Tülle sind.
- Schließen Sie die leeren Durchführungen mit Stopper.
- Legen Sie eine nasse Membrankappe an der Unterseite des Silikonadapters und füllen Sie den Adapter mit Elutionspuffer. Langsam den Puffer im Adapter nach oben und unten pipettieren, um Luftblasen um die Dialysemembran zu entfernen/ Li>
- Schieben Sie den Puffer-gefüllten Adapter auf die Unterseite des Glasrohres. Entfernen Sie alle Blasen, die auf der Fritte im Glasrohr erscheinen.
- Füllen Sie jedes Glasrohr mit Elutionspuffer.
- Legen Sie die ausgeschnittenen Bänder der BN PAGE in die Glasröhren (siehe Schritt 1.2.9.3). Schneide große Stücke in kleinere Stücke. Stellen Sie sicher, dass die Füllhöhe innerhalb des Glasrohres ca. 1 cm beträgt.
- Legen Sie das gesamte Modul in den Tank.
- Füge etwa 600 mL kalten Elutionspuffer zum Tank hinzu. Stellen Sie sicher, dass die Silikonadapterkappen im Puffer sind, um Blasen an der Dialysemembran zu verhindern.
- Setzen Sie einen Rührstab an der Unterseite des Tanks.
HINWEIS: Das Rühren verhindert, dass Blasen an der Unterseite der Dialysemembran haften. - Eluiere die Proteine für 4 h bei 350 V in einem kalten Raum.
- Nachdem die Elution beendet ist, entfernen Sie das Elektrodenmodul aus dem Pufferspeicher und legen Sie es in ein Waschbecken oder eine Schüssel.
- Wenn ein Stopper benutzt wurde, entfernen Sie ihn zu draIn der oberen Pufferkammer. Andernfalls verwenden Sie eine große Pipette, um den Puffer zu entfernen.
- Den Puffer von jedem Glasrohr entfernen und entsorgen. Achten Sie darauf, dass der Silikonadapter an Ort und Stelle bleibt und dass die Flüssigkeit unterhalb der Fritte nicht gestört oder geschüttelt wird.
- Entfernen Sie vorsichtig den Silikonadapter zusammen mit der Membrankappe von der Unterseite des Glasrohres. Den Inhalt (ca. 400 μl) der Silikonkappe in ein Mikroröhrchen pipettieren. Mit weiteren 200 μl Elutionspuffer spülen Sie die Silikonkappe und fügen Sie dem Mikroröhrchen hinzu. Wiederholen Sie für alle Glasröhren.
- Wenn die Membrankappen wiederverwendet werden können, bewahren Sie die Membrankappen auf, indem Sie sie in den Elutionspuffer geben, der 0,5 mg / ml Natriumazid enthält. Kühlen sie auf
HINWEIS: Das Eluat hat eine geringe Proteinkonzentration und kann mit Hilfe von Zentrifugalfiltergeräten konzentriert werden.
Ergebnisse
Um mitochondriale Supercomplexe zu visualisieren, wurden frisch isolierte Mitochondrien von Mäusen 17 , 18 verwendet. Mitochondriale Supercomplexe sind empfindlich gegenüber wiederholten Zyklen des Einfrierens und Auftauens, was zu ihrer Desintegration führt, obwohl dies für einige Forscher tolerierbar sein kann. Wenn das Einfrieren für die Lagerung notwendig ist, um beste Ergebnisse zu erzielen, sollten die Proben nicht mehr als einem Zyklus von Einfrieren und Auftauen unterzogen werden.
Zur Visualisierung der mitochondrialen ETC-Komplexe mit BN-PAGE wurden 100 μg Protein aus isolierten Herz-Mitochondrien auf ein 4-10% Gel (Abbildung 1A ) geladen. Der Coomassie-Fleck im Beladungs- und Kathodenpuffer reicht aus, um die Proteinkomplexe während des Laufes zu markieren. Supercomplexe erscheinen nach dem Erhöhen des Kontrasts digital (nicht gezeigt). Für CN PAGE wurden zwei Proben von 20 μg oF-Protein aus isolierten Mitochondrien wurden auf ein 3 - 8% CN-Gel geladen und abgetrennt (Abbildung 1B ). Die CN-PAGE wurde mit Coomassie gefärbt und entfärbt, um die Proteinkomplexe zu visualisieren. Nach der Erhöhung des Kontrasts digital erschienen mehrere Proteinkomplexe mit einem Molekulargewicht größer als das Monomer von Cx-I (Abbildung 1B , rechts). Die Konzentrationen von AAB, die für die größten Superkomplexe verwendet wurden, gingen einfach in das Gel aus dem Brunnen ein. Jedoch ist ein Gel, das mit einem Gradienten von weniger als 3% AAB endet, nicht stabil genug, um für den Transfer zu manipulieren oder um ein Band oder eine Spur zu exzimieren. Darüber hinaus behält die geringe Konzentration von AAB in den oberen Teilen der 3-8% CN-Gele eine gewisse Beweglichkeit der Proteinkomplexe bei, was bei der Betrachtung der nativen Elektroelution wichtig ist.
Monomere und Superkomplexe von Cx-I und Monomeren, Dimeren und Superkomplexen von CXV sind enzymatisch aktiv und können durch IGA visualisiert werden (Abbildung 1C- F ). Die Assays zeigen, dass in isolierten Herz-Mitochondrien Cx-I und Cx-V in Proteinkomplexen vorhanden sind, die größer sind als ihre jeweiligen Monomere. Im IGA-Assay für Cx-I wird NADH oxidiert und Elektronen transferiert, um nitroblaues Tetrazolium zu reduzieren. Dies führt zu einer lokalisierten blauen Farbe bei dem Molekulargewicht der Cx-I-Monomere und der Cx-I-haltigen Resirasomen / Superkomplexe (Abbildung 1C ). Die Aktivität von Cx-V wird aus der Fähigkeit der F & sub1 ; -Untereinheit beurteilt, ATP zu hydrolysieren und kann unter Verwendung von CN- oder BN-Gelen durchgeführt werden ( Fig. 1D- F ). Das aus dieser Reaktion erzeugte ADP wechselwirkt mit Blei und führt zu einem weißen Niederschlag auf der Ebene von Cx-V-Monomeren, Dimeren, Synthasomen und Unterkomplexen (höchstwahrscheinlich der unzusammengebaute F 1 -Abschnitt von Cx-V). Beachten Sie, dass Oligomycin die l beseitigtAbbruch dieser Bänder, die bestätigen, dass sie Cx-V enthalten (Abbildung 1E ).
Für alle hier beschriebenen Experimente wurde das zwitterionische Detergens, Laurylmaltosid, in einer Konzentration von 2 μg / 1 μg Protein verwendet, was die höchstmögliche Konzentration ist, die die Superkomplexe bewahrt und gleichzeitig konsistente und reproduzierbare Ergebnisse liefert (Abbildung 1F ). Die Wirksamkeit von Laurylmaltosid hängt jedoch von der Losnummer, den Lagerbedingungen und dem Alter ab. So ist die genaue Konzentration, die in einem Laboratorium verwendet wird, nicht notwendigerweise die gleiche wie in Manuskripten berichtet. Die richtige Konzentration des Detergens wird die Membranen solubilisieren, aber die Komplexe und die Superkomplexe intakt halten und unter Verwendung einer Vielzahl von Konzentrationen von Laurylmaltosid ( Fig. 1F ) bestimmt werden. Für CN-PAGE wurde ein Gesamtprobenvolumen von 40 & mgr; l pro Vertiefung hergestelltHierin, was zu einem Protein / Detergens-Verhältnis von 1 μg / 2 μg oder einem Detergenz / Puffer-Verhältnis von 1 μg / 1 μL (gleich 1,9 mM) führt. Von den 40 & mgr; l wurden 30 & mgr; l pro Vertiefung des Miniggels aufgetragen; Der Rest wurde als Aliquot für die Erkennung von VDAC, eine Ladesteuerung (Abbildung 2D ) verwendet.
Für das Immunoblotting wird CN zu BN PAGE bevorzugt, da die Proteine nicht mit Coomassie beladen sind, was den Nachweis durch Antikörper stören kann. Fig. 2 zeigt den Nachweis von Supercomplexen, die die Cx-I- und Cx-V-Proteine NDUFB6 und ATP5A aus isolierten Herz-, Leber- und Gehirn-Mitochondrien enthalten. Die Ponceau S-Markierung nach der Übertragung und vor dem Immunoblotting kann zur Markierung der Molekulargewichtsmarker und zur Kontrolle der Proteinbeladung verwendet werden (Abbildung 2A ). Dies wird die Monomere der Proteinkomplexe des ETC auf Nitrocellul visualisierenOse-Membranen, aber Ponceau S-Markierung ist nicht immer ausreichend für die Visualisierung von mitochondrialen Superkomplexen (Abbildung 2A ), die durch Immunoblotting erreicht werden können.
Cx-I versammelt sich nicht in Dimere und Tetramere an sich, sondern bildet zunehmend höhere Molekulargewichts-Superkomplexe mit Cx-III und Cx-IV 14 , 20 , 21 . Hier zeigt die Verwendung eines Antikörpers gegen NDUFB6, dass die Probe aus dem Herzen mehr Cx-I-Monomer und hochmolekulare Supercomplexe (obere Banden) enthielt, die die Mitochondrien aus der Leber oder dem Gehirn (Abbildung 2B ). Die Menge der Mittelklasse-Respirus-Supercomplexe war auch im Herzen viel höher als in den anderen Geweben (Abbildung 2B ).
Mit anti-ATP5A-Antikörpern,Monomere von Cx-V sind in Mitochondrien aus allen Geweben nachweisbar, während ein deutliches Muster von Bändern, die für Dimere (D) und größere Supercomplexe (SC) repräsentativ sind, die in Herz-Mitochondrien deutlich sichtbar sind, in Leber- und Gehirn-Mitochondrien nicht so hervorstechend sind ( Fig. 2C ). Überbelichtung (1 min gegen 20 s) des Immunoblots zeigt mehrere Cx-V-haltige Superkomplexe, die Tetramere und Synthasomen darstellen können (Abbildung 2C ). Diese Muster von Cx-V-haltigen Proteinkomplexen in Herz-, Leber- und Gehirn-Mitochondrien zeigen Unterschiede, die gewebespezifisch sein können und noch nicht untersucht wurden.
Die Proteinbeladung dieser Blots kann durch Ponceau S-Färbung und VDAC-Detektion des oben erwähnten Aliquots durch SDS PAGE verfolgt werden, wie in 2D gezeigt ist .
Nicht alle antiboSterben sind geeignet, ein Protein innerhalb der quaternären oder tertiären Struktur eines Proteinkomplexes nach nativer PAGE zu detektieren. Um dieses Problem zu überwinden, können ganze und teilweise Bahnen aus dem nativen Gel auf einem denaturierenden Gel für eine zweite Dimension (2D-Gelen, siehe Referenz 13 für eine Demonstration) angebracht werden. 2D-Elektrophorese ist ein wertvolles Werkzeug zur Visualisierung von Proteinen in einem supramolekularen Komplex. Jedoch sind, wie in Fig. 2 gezeigt , Superkomplexe in variablen Mengen vorhanden, und das Signal von einzelnen Proteinen aus Superkomplexen kann in der zweiten, denaturierenden Dimension schwer zu visualisieren sein. Um dieses Problem zu überwinden, wurde hier die Elektroelution von Proteinkomplexen aus nativen Gelen verwendet. Dies isoliert superkomplexe Bänder aus mehreren Bahnen, um mehr Material für weitere Untersuchungen zu liefern.
Bei der Verwendung von Elektroelution ist nur das interessierende Band, das durch IGA identifiziert wurde und / oder auf einer BN-PAGE visualisiert wurde, exIst; Die Proteine aus diesem Stück Gel werden weiter durch Elution aus dem Gel gereinigt. Fig. 3A zeigt eine Spur einer BN-PAGE, aus der Banden, die das Monomer darstellen, zur Elektroelution ausgeschnitten wurden. Um die Cx-V-Aktivität des Monomers nach der Elektroelution zu bestimmen, wurde das Eluat auf eine zweite CN-PAGE aufgetragen. Das Eluat des Monomers enthält noch enzymatisch aktives Cx-V, aber auch Unterkomplexe erscheinen (Abbildung 3B ). Die Silberfärbung des Eluats nach der nativen CN-PAGE (Abbildung 3C ) oder der denaturierenden SDS-PAGE (Abbildung 3D ) zeigt die Anwesenheit von Proteinen im Eluat an und das Immunoblotting gegen ATP5A zeigt die Anwesenheit von Cx-V in beiden Proben an (Abbildung 3D ).
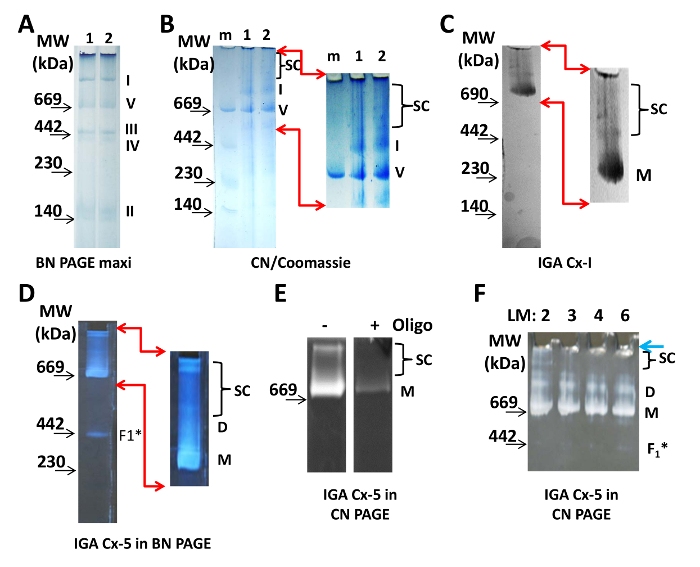
Abbildung 1: Visualisierung von MitochOndrial Supercomplexes ( A ) Zwei Bahnen eines 4-10% BN-Maxi-Gels, mit Proben von isolierten Herz-Mitochondrien. Aliquots der gleichen Probe wurden in beiden Bahnen mit 100 & mgr; g Protein pro Vertiefung durchgeführt. Die Monomere der Proteinkomplexe I, II, III, IV und V des ETC sind deutlich sichtbar und sind rechts vom Gel markiert. ( B ) Zwei Proben von Herz-Mitochondrien (1 und 2, 20 μg Protein / Spur) wurden auf einer CN-PAGE aufgetrennt und durch Coomassie-Färbung sichtbar gemacht. SC zeigt die Position der Superkomplexe nach Vergrößerung und digitaler Verstärkung des oberen Teils des Gels an (der Bereich wird durch rote Pfeile angezeigt). ( C ) 20 μg mitochondriales Protein wurden auf einer 3-8% CN-PAGE aufgetrennt und für Cx-I IGA verarbeitet. Vergrßerte und digital verbesserte Bilder zeigen Banden des Cx-I-Reaktionsprodukts. ( D ) 20 & mgr; g mitochondriales Protein wurden auf einer 3-8% BN PAGE aufgetrennt und für Cx-V IGA verarbeitet. Magnifi Ed und digital verbesserte Bilder zeigen Banden des Cx-V-Reaktionsprodukts. ( E ) 50 μg mitochondriales Protein wurden auf einer 5-15% CN-PAGE aufgetrennt und für Cx-V IGA ohne (-) und mit (+) 5 μg / ml Oligomycin (Oligo) verarbeitet. ( F ) Mitochondriales Protein (20 & mgr; g / Spur) wurde mit 2 bis 6 & mgr; g Laurylmaltosid / 1 & mgr; g Protein, wie oben auf dem Gel angegeben, solubilisiert und auf einem 3-8% CN-Gel, gefolgt von Cx- V IGA. Alle Bilder wurden mit einem Lichttisch ( A - C ) oder einer schwarzen Oberfläche ( D - F ) fotografiert. Kamera-Spezifikationen sind in der Tabelle der Materialien. Die Lage der Molekulargewichtsmarker (MW) sind auf der linken Seite aller Tafeln angegeben. Abkürzungen: D = dimere; F 1 * = Unterkomplex von Cx-V; LM = Laurylmaltosid; M = Molekulargewichtsmarker; M = Monomere; SC = supercomplexesG1large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
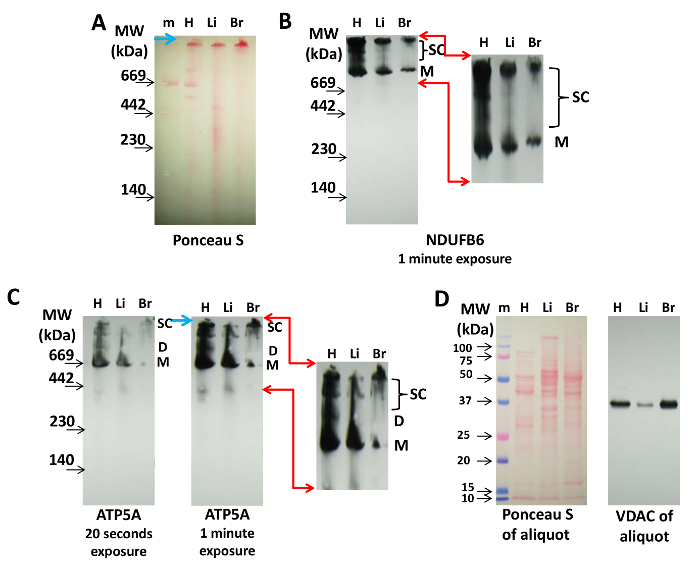
Abbildung 2: Nachweis von mitochondrialen Supercomplexen durch Immunoblotting. 20 μg Protein aus dem Herzen (H), Leber (Li) und Gehirn (B) Mitochondrien wurden auf einer 3-8% CN PAGE aufgetrennt und auf Nitrozellulosemembran transferiert. ( A ) Die Ponceau S-Färbung der Membran zeigt die Anwesenheit von Proteinkomplexen und Molekulargewichtsmarkern (m) an. Der blaue Pfeil zeigt auf die Oberseite des Gels. ( B ) Das Cx-I-Protein, NDUFB6, wurde auf dem in (A) (1 min Belichtungszeit) gezeigten Blot immunolettiert. ( C ) Cx-V wurde mit anti-ATP5A-Antikörper (20 s und 1-min-Exposition, wie angegeben) sichtbar gemacht. Die roten Pfeile in (B) und (C) zeigen den vergrößerten und digital vergrößerten Bereich für die visua anVerteilung von Cx-I- und Cx-V-haltigen Superkomplexen, und der blaue Pfeil zeigt auf die Oberseite des Gels. ( D ) Ponceau S und Immunmarkierung des VDAC-Aliquots jedes in (A), (B) und (C) verwendeten Extraktes, die durch SDS-PAGE getrennt wurden und auf Nitrocellulose übertragen wurden. Abkürzungen: M = Monomere von Cx-I oder Cx-V, D = Dimere von Cx-V, SC = Komplexe, die Cx-I oder Cx-V enthalten. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3: Elektrolyse von Cx-V. ( A ) BN-SEITE einer mitochondrialen Probe Das verpackte Band repräsentiert das Monomer von Cx-V, das herausgeschnitten und elektrolytiert wurde. ( B ) Das Eluat wurde der CN-PAGE unterworfen, und nachfolgendes IGA für Cx-V zeigt Monomere (M)Und Unterkomplexe, die F 1 von Cx-V enthalten. ( C ) Die Silberfärbung der CN-PAGE des Eluats zeigt Monomere (M). ( D ) Silberfärbung (linke Tafel) und Immunoblot für ATP5A (rechte Tafel) eines denaturierenden Natriumdodecylsulfats (SDS) PAGE des Eluats zeigt die Anwesenheit von Cx-V an. Für SDS-PAGE verweisen wir auf Protokolle, die an anderer Stelle veröffentlicht wurden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Für die mitochondriale ATP-Erzeugung ist ein funktionelles ETC erforderlich. Die Komplexe des ETC sind in der Lage, zwei Arten von Supercomplexen zu bilden: die respirasomen (Cx-I, -III und -IV) 1 und die Synthasomen (Cx-V) 2 . Die Montage jedes Komplexes ist für eine intakte ETC erforderlich, während die Organisation des ETC in Supercomplexe die Gesamt-ETC-Effizienz 5 , 22 erhöhen soll. Wie diese Supercomplexe zusammenbauen und auseinanderbauen, ist nicht gut verstanden, aber die hier vorgestellten Protokolle können ein besseres Verständnis dieser Prozesse ermöglichen.
Die große Herausforderung des Studiums der ETC-Montage ist die Größe dieser Proteinkomplexe. Zum Beispiel können mitochondriale respirasome aus Cx-I (etwa 880 kDa) und einem oder mehreren Molekülen von Cx-III (460 kDa) und Cx-IV (200 kDa, aktiv als Dimer) bestehen, was zu einem Superkomplex mit einem molekularen führt Gewicht von ungefähr2.000 kDa Zusätzlich hat Cx-V ein Molekulargewicht von etwa 600 kDa, es wurde jedoch gezeigt, dass es sich zu Dimeren, Tetrameren, Oligomeren und Bändern der Dimere 7 , 23 zusammensetzt, was zu Superkomplexen mit einem Molekulargewicht von mindestens 2000 kDa führt. In Anbetracht der enormen Größe dieser Superkomplexe wurden traditionell einige teilweise verwandte Ansätze verwendet, um diese Superkomplexe zu identifizieren und zu charakterisieren, durch dieses Labor und durch andere 8 , 14 , 24 .
Diese Arbeit hat die Technik der nativen Gel-PAGE gezeigt, bei der aktive Proteinkomplexe vorsichtig aus der mitochondrialen Membran mit milden Reinigungsmitteln extrahiert werden. Die Komplexe wandern in den Gelen vor allem aufgrund ihrer Größe und intrinsischen Ladung (CN PAGE) oder aufgrund der Größe und negativen Ladung von Protein-gebundenen Coomassie blau (BN PAGE). Diese Gele können mit C gefärbt werdenOomassieblau ( z. B. in CN-Gelen) oder Silberfärbung ( zB in BN und CN PAGE), um Proteinbanden zu zeigen.
Lauryl-Maltosid wurde für die hier vorgestellten Experimente verwendet, da dieses Waschmittel am zuverlässigsten arbeitete. Alternativ kann Digitonin verwendet werden, um Proteinkomplexe 12 zu extrahieren. Daten von Mitochondrien, die von erwachsenen Herzen, Lebern und Gehirnen isoliert wurden, wurden hier gezeigt, aber diese Techniken wurden auf embryonalen und erwachsenen Herzhomogenaten durchgeführt 8 . Andere haben diese Technik mit isolierten Mitochondrien aus kultivierten Zellen durchgeführt 24 . Wenn jedoch Gewebehomogenate oder kultivierte Zellen mit einem hohen DNA-Gehalt verwendet werden, kann es nützlich sein, eine Nuklease zuzugeben, um ein Streifen während der Elektrophorese 25 zu verhindern.
Die Aktivität der verschiedenen Komplexe kann direkt im Gel untersucht werden, wie hier für Cx-I und Cx-V gezeigt, und tecHniques sind auch verfügbar, um die Aktivitäten von Cx-II, -III und -IV 12 zu untersuchen. Allerdings muss die Analyse dieser IGAs sorgfältig durchgeführt werden. Zuerst könnte die enzymatische Reaktion auf Nicht-ETC-Enzyme oder unvollständig zusammengesetzte Komplexe zurückzuführen sein. Zum Beispiel ist es Routine, das Cx-V IGA mit einem parallelen Gel durchzuführen, das mit Oligomycin behandelt wurde, um intaktes Cx-V zu hemmen (Abbildung 3 ). Zusätzlich können andere NADH-Oxidasen für die Cx-1-In-Gel-Aktivität verantwortlich sein. Man könnte eine parallele IGA in Gegenwart eines Cx-I-Inhibitors, wie Rotenon, durchführen. In Abbildung 1 wurden jedoch isolierte Mitochondrien verwendet, so dass zytoplasmatische NADH-Oxidasen nicht vorhanden waren; So stellen die Daten wahrscheinlich Cx-I-haltige Monomere und Superkomplexe dar. Darüber hinaus ist die Quantifizierung dieser Ergebnisse durch Messung der Signalintensität der Bänder auf Fotografien oder Scans möglich. Nachteile zu diesem Ansatz sind die Unterschiede zwischen undInnerhalb der Gele, der Beweglichkeit des Reaktionsprodukts, der Unfähigkeit, das Produkt in der gesamten Tiefe des Gels adäquat zu quantifizieren, und die potentielle Nichtlinearität der Reaktion 27 . Um diese zu überwinden, haben einige vorgeschlagen, Raten von Reaktionen mit seriellen Fotos zu erhalten, aber dies wurde hier nicht versucht.
Das Protein in nativen Gelen kann auch auf Membranen übertragen werden, und die Proteinzusammensetzung der Banden kann durch Immunoblotting (hier gezeigt) oder 2D PAGE (in Referenz 13 gezeigt ) untersucht werden. Monomere der ETC-Komplexe wurden traditionell durch ihre Häufigkeit in nativen Gelen von isolierten Mitochondrien, ihre Lage im Gel und ihre Position relativ zum molekularen Markerprotein identifiziert (Abbildung 1 ). Darüber hinaus hilft die Markierung von nachfolgenden Immunoblots mit Antikörpern, die für Untereinheiten verschiedener Komplexe spezifisch sind, dazu, den Komplex und die Zusammensetzung zu identifizierenVon supercomplexes Daher identifizieren Anti-NDUFB6 und -ATP5A Monomere und Supercomplexe, die Cx-1 bzw. Cx-V enthalten, wie hier gezeigt wird. Antikörper gegen Cx-II bis IV können für denselben Zweck verwendet werden. In einigen Fällen können Antikörper, die in denaturierenden Gelen gut funktionieren, in nativen Gelen nicht gut funktionieren, da einige Antikörper spezifisch für denaturiertes Protein sind oder dass ein Epitop durch andere Proteine in einem nativen Komplex maskiert werden kann.
Die genaue Bestimmung des Molekulargewichts dieser Superkomplexe ist schwierig, da die meisten verfügbaren Molekulargewichtsmarker unterhalb der Größe der Cx-V-Monomere liegen. Die Migration von Proteinkomplexen in einem nativen Gel hängt von der Größe, der intrinsischen Ladung und dem verwendeten Waschmittel ab 28 . In den Beispielen wurden hier Monomere der Komplexe auf der Basis von Gelen, Markern und Immunoblotting identifiziert. Dimere von Cx-V wurden auf der Grundlage einer relativen Migration im Vergleich zu Monomeren von Cx-I und -V und auf Immuno identifiziertBlotting Alles andere über den Monomeren und Dimeren in Gelen, IGAs und Immunoblots gelten als Supercomplexe.
Native Immunoblots können auch für Supercomplexe quantifiziert werden, indem die Banddichte mittels Standardtechniken analysiert wird. Diese Methode wurde hier nicht gezeigt, aber eine neuere Publikation zeigt diese Technik 8 . Die Normalisierung der Proteinbeladung kann unter Verwendung der Ponceau-Rotfärbung der Spur oder durch Speichern einer Probe des mitochondrialen Extrakts erfolgen, um die Dichte der VDAC-Bande auf einem denaturierenden Immunoblot zu messen ( 2A und D ). Darüber hinaus ist die Untersuchung des Verhältnisses von Superkomplexen zu Monomeren in demselben Immunoblot eine weitere Möglichkeit, die Banddichte zu quantifizieren, aber man muss vorsichtig sein, während der Blot-Entwicklung Bilder zu verschiedenen Zeiten aufzunehmen, so dass die Banden nicht überbelichtet sind.
Schließlich können Banden aus nativen Gelen elektrolytiert werden, um Purifie zu erzeugenD, aktive Proteinkomplexe, die sich in Komplexe höherer Ordnung zusammensetzen können und für weitere Untersuchungen der komplexen Funktion verwendet werden können. Zum Beispiel wurden Cx-V-Monomere zuvor elektroeluiert und in Liposomen rekonstituiert, um die elektrische Funktionalität 29 zu demonstrieren. Ein alternativer Ansatz zur nativen Elektroelution ist die Elution durch passive Diffusion in den umgebenden Puffer 16 , aber dies ist im Vergleich zur nativen Elektroelution langsam. Schließlich behält ein großes Problem bei der Elektroelution die enzymatische Funktion des elektrolytischen Proteinkomplexes bei, da der Komplex während der Reinigung dissoziieren kann. Daher müsste jeder Assay der Funktion nach der Isolierung durch diese Technik rigoros getestet werden.
Durch die Kombination dieser Protokolle mit enzymatischen Assays und Sauerstoffverbrauchsmessungen, die die Funktion einzelner ETC-Komplexe und die Aktivität des gesamten ETC 30 und anderer Meth-Ods, wie die kristallographische 31 und die elektronenmikroskopische 32 Auswertung der Struktur von Komplexen und Superkomplexen, ein komplettes Bild der inneren Funktionsweise des ETC kann und ist entstanden. Wir sind näher an dem Verständnis, wie die Komplexe zusammengebaut werden, wie Elektronen die Kette hinunterfließen und wie Protonen über die Membran gepumpt werden, um den Gradienten zu erzeugen und dann durch Cx-V zurück zur Matrix zu kommen, um ATP zu erzeugen. Zweifellos werden diese Techniken weiter verfeinert, um zusätzliche Details über die Struktur, Funktion und dynamische Regulierung des ETC zu liefern.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde unterstützt durch Zuschüsse von der American Heart Association Founder's Affiliate [12GRNT12060233] und der Starken Kinder-Forschungszentrum an der University of Rochester.
Materialien
| Name | Company | Catalog Number | Comments |
| Protean II mini-gel chamber | Biorad | 1658004 | Complete set to pour and run mini-gel electrophoresis |
| Protean XL maxi-gel | Biorad | 1653189 | Complete set to pour and run maxi-gel electrophoresis |
| Gradient maker, Hoefer SG15 | VWR | 95044-704 | Pouring mini-gel gradients |
| Gradient maker, maxi-gel | VWR | GM-100 | Pouring maxi-gel gradients |
| Transfer kit | Biorad | 1703930 | Complete set to wet transfer of proteins onto membranes |
| Electroeluter model 422 | Biorad | 1652976 | Electroelution of proteins from native or SDS PAGES |
| Glass plates | Biorad | 1653308 | Short plates |
| Glass plates | Biorad | 1653312 | Spacer plates |
| Glass plates | Biorad | 1651823 | Inner plates |
| Glass plates | Biorad | 1651824 | Outer Plates |
| Power supply | Biorad | 1645070 | Power supply suitable for native electrophoresis |
| ECL-Western | Thermo Scientific | 32209 | Chemolumniscense substrate |
| SuperSignal-West Dura | Thermo Scientific | 34075 | Enhanced chemolumniscense substrate |
| Film/autoradiography film | GE Health care | 28906845 | Documentation of Western blots |
| Film processor CP1000 | Agfa | NC0872640 | |
| Canon Power Shot 640 | Canon | NA | Taking photos to document gels, membranes and blots. |
| Canon Power Shot 640 Camera hood | Canon | shielding camera for photos being taken on a light table | |
| Acrylamide/bisacrylamide | Biorad | 1610148 | 40% pre-mixed solution |
| Glycine | Sigma | G7403 | |
| SDS (sodium dodecyl sulfate) | Invitrogen | 15525-017 | |
| Tris-base | Sigma | T1503 | Buffer |
| Tricine | Sigma | T0377 | |
| Sodium deoxychelate | Sigma | D66750 | Detergent |
| EDTA | Sigma | E5134 | |
| Sucrose | Sigma | S9378 | |
| MOPS | Sigma | M1254 | Buffer |
| Imidazole | Sigma | I15513 | Buffer |
| Lauryl maltoside | Sigma | D4641 | Detergent |
| Coomassie G250 | Biorad | 161-0406 | |
| Aminohexanoic acid | Sigma | O7260 | |
| Native molecular weight kit | GE Health care | 17-0445-01 | High molecular weight calibraition kit for native electrophoresis. |
| Name | Company | Catalog Number | Comments |
| NADH | Sigma | N4505 | |
| Nitroblue tetrazolium | Sigma | N6639 | |
| Tris HCl | Sigma | T3253 | |
| ATP | Sigma | A2383 | |
| Name | Company | Catalog Number | Comments |
| Lead(II) nitrate (Pb(NO3)2): | Sigma | 228621 | |
| Oligomycin | Sigma | O4876 | |
| Name | Company | Catalog Number | Comments |
| Ponceau S | Sigma | P3504 | |
| anti-ATP5A | Abcam | ab14748 | antibody to ATP synthase subunit ATP5A |
| anti-NDUFB6 | Abcam | ab110244 | antibody to Cx-1 subunit NDUFB6 |
| anti-VDAC | Calbiochem | 529534 | antibody to VDAC |
| ECL HRP linked antibody | GE Health Care | NA931V | secondary antibody to ATP5A, NDUFB6 and VDAC |
| Blocking reagent | Biorad | 170-6404 | |
| BSA | |||
| sodium chloride | Sigma | S9888 | |
| potassium chloride | Sigma | P9541 | |
| EGTA | Sigma | E3889 | |
| Name | Company | Catalog Number | Comments |
| Silver staining Kit | Invitrogen | LC6070 |
Referenzen
- Lenaz, G., Genova, M. L. Supramolecular organisation of the mitochondrial respiratory chain: a new challenge for the mechanism and control of oxidative phosphorylation. Adv Exp Med Biol. 748, 107-144 (2012).
- Saks, V., et al. Intracellular Energetic Units regulate metabolism in cardiac cells. J Mol Cell Cardiol. 52 (2), 419-436 (2012).
- Schagger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal Biochem. 217 (2), 220-230 (1994).
- Wittig, I., Schagger, H. Native electrophoretic techniques to identify protein-protein interactions. Proteomics. 9 (23), 5214-5223 (2009).
- Genova, M. L., Lenaz, G. Functional role of mitochondrial respiratory supercomplexes. Biochim Biophys Acta. 1837 (4), 427-443 (2014).
- Hahn, A., et al. Structure of a Complete ATP Synthase Dimer Reveals the Molecular Basis of Inner Mitochondrial Membrane Morphology. Molecular cell. 63 (3), 445-456 (2016).
- Strauss, M., Hofhaus, G., Schroder, R. R., Kuhlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. EMBO J. 27 (7), 1154-1160 (2008).
- Beutner, G., Eliseev, R. A., Porter, G. A. Initiation of electron transport chain activity in the embryonic heart coincides with the activation of mitochondrial complex 1 and the formation of supercomplexes. PloS one. 9 (11), e113330(2014).
- Genova, M. L., Lenaz, G. The Interplay Between Respiratory Supercomplexes and ROS in Aging. Antioxid Redox Signal. 23 (3), 208-238 (2015).
- Rosca, M. G., et al. Cardiac mitochondria in heart failure: decrease in respirasomes and oxidative phosphorylation. Cardiovasc Res. 80 (1), 30-39 (2008).
- Kuter, K., et al. Adaptation within mitochondrial oxidative phosphorylation supercomplexes and membrane viscosity during degeneration of dopaminergic neurons in an animal model of early Parkinson's disease. Biochim Biophys Acta. 1862 (4), 741-753 (2016).
- Wittig, I., Karas, M., Schagger, H. High resolution clear native electrophoresis for in-gel functional assays and fluorescence studies of membrane protein complexes. Mol Cell Proteomics. 6 (7), 1215-1225 (2007).
- Fiala, G. J., Schamel, W. W., Blumenthal, B. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for analysis of multiprotein complexes from cellular lysates. J Vis Exp. (48), (2011).
- Acin-Perez, R., Fernandez-Silva, P., Peleato, M. L., Perez-Martos, A., Enriquez, J. A. Respiratory active mitochondrial supercomplexes. Molecular cell. 32 (4), 529-539 (2008).
- Dudkina, N. V., Eubel, H., Keegstra, W., Boekema, E. J., Braun, H. P. Structure of a mitochondrial supercomplex formed by respiratory-chain complexes I and III. Proc Nat Acad Sci USA. 102 (9), 3225-3229 (2005).
- Giorgio, V., et al. Dimers of mitochondrial ATP synthase form the permeability transition pore. Proc Nat Acad Sci USA. 110 (15), 5887-5892 (2013).
- Beutner, G., Sharma, V. K., Giovannucci, D. R., Yule, D. I., Sheu, S. S. Identification of a ryanodine receptor in rat heart mitochondria. J Biol Chem. 276 (24), 21482-21488 (2001).
- Rehncrona, S., Mela, L., Siesjo, B. K. Recovery of brain mitochondrial function in the rat after complete and incomplete cerebral ischemia. Stroke. 10 (4), 437-446 (1979).
- Schagger, H. Blue-native gels to isolate protein complexes from mitochondria. Methods Cell Biol. 65, 231-244 (2001).
- Althoff, T., Mills, D. J., Popot, J. L., Kuhlbrandt, W. Arrangement of electron transport chain components in bovine mitochondrial supercomplex I1III2IV1. EMBO J. 30 (22), 4652-4664 (2011).
- Schafer, E., et al. Architecture of active mammalian respiratory chain supercomplexes. J Biol Chem. 281 (22), 15370-15375 (2006).
- Wittig, I., Schagger, H. Supramolecular organization of ATP synthase and respiratory chain in mitochondrial membranes. Biochim Biophys Acta. 1787 (6), 672-680 (2009).
- Davies, K. M., et al. Macromolecular organization of ATP synthase and complex I in whole mitochondria. Proc Nat Acad Sci USA. 108 (34), 14121-14126 (2011).
- Lapuente-Brun, E., et al. Supercomplex assembly determines electron flux in the mitochondrial electron transport chain. Science. 340 (6140), 1567-1570 (2013).
- Antonioli, P., Bachi, A., Fasoli, E., Righetti, P. G. Efficient removal of DNA from proteomic samples prior to two-dimensional map analysis. J Chromatogr A. 1216 (17), 3606-3612 (2009).
- Wittig, I., Carrozzo, R., Santorelli, F. M., Schagger, H. Functional assays in high-resolution clear native gels to quantify mitochondrial complexes in human biopsies and cell lines. Electrophoresis. 28 (21), 3811-3820 (2007).
- Glancy, B., Balaban, R. S. Protein composition and function of red and white skeletal muscle mitochondria. Am J Physiol Cell Physiol. 300 (6), C1280-C1290 (2011).
- Wittig, I., Beckhaus, T., Wumaier, Z., Karas, M., Schagger, H. Mass estimation of native proteins by blue native electrophoresis: principles and practical hints. Mol Cell Proteomics. 9 (10), 2149-2161 (2010).
- Alavian, K. N., et al. An uncoupling channel within the c-subunit ring of the F1FO ATP synthase is the mitochondrial permeability transition pore. Proc Nat Acad Sci USA. 111 (29), 10580-10585 (2014).
- Chance, B., Williams, G. R. Respiratory enzymes in oxidative phosphorylation. IV. The respiratory chain. J Biol Chem. 217 (1), 429-438 (1955).
- Zickermann, V., et al. Structural biology. Mechanistic insight from the crystal structure of mitochondrial complex I. Science. 347 (6217), 44-49 (2015).
- Zhu, J., Vinothkumar, K. R., Hirst, J. Structure of mammalian respiratory complex I. Nature. 536 (7616), 354-358 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten