Method Article
ネイティブ電気泳動、インゲルアッセイおよび電気溶出を用いたミトコンドリア電子輸送鎖のスーパーコンプレックスの解析
要約
このプロトコールは、機能的ミトコンドリア電子輸送鎖複合体(Cx)IVおよびそれらのスーパーコンプレックスの、それらのアセンブリおよび構造に関する情報を明らかにするための天然の電気泳動の分離を記載する。天然ゲルは、イムノブロッティング、ゲル内アッセイ、および電気溶出による精製を受けて、個々の複合体をさらに特徴付けることができる。
要約
ミトコンドリア電子輸送鎖(ETC)は、様々な燃料の分解から誘導されたエネルギーを細胞のATPの生体エネルギー通貨に変換する。 ETCは、レスピラソーム(CI、C-III、およびC-IV)と呼ばれるスーパーコンプレックスと、電子輸送およびATP産生の効率を高めるシンターソーム(CV)にアセンブルする5つの巨大タンパク質複合体からなる。 ETC機能を測定するために50年以上にわたって様々な方法が用いられてきたが、これらのプロトコルは個々の複合体およびスーパーコンプレックスの集合に関する情報を提供しない。このプロトコールは、ETC複合体構造を研究するために20年以上前に改変された方法であるネイティブゲルポリアクリルアミドゲル電気泳動(PAGE)の技術を記載している。ネイティブ電気泳動は、ETC複合体の活性型への分離を可能にし、イムノブロッティング、インゲルアッセイ(IGA)、および電気溶出による精製を用いてこれらの複合体を研究することができる。また、ネイティブゲルPAGEの他のミトコンドリアアッセイの結果と比較すると、ETC活性、その動的なアセンブリおよび分解、およびこれがミトコンドリアの構造および機能をどのように調節するかについてのコンプリータ画像を得ることが可能である。この作業では、これらの技術の限界についても検討する予定です。要約すると、以下に示すイムノブロッティング、IGA、および電気溶出が続くネイティブPAGEの技法は、ミトコンドリアETCスーパーコンプレックスの機能性および組成を調べる強力な方法である。
概要
ATPの形態のミトコンドリアのエネルギーは、細胞生存に必須であるだけでなく、細胞死の調節にも必須である。酸化的リン酸化によるATPの生成には、機能的電子伝達鎖(ETC; Cx-1〜IV)およびミトコンドリアATPシンターゼ(Cx-V)が必要である。最近の研究は、これらの大きなタンパク質複合体が、レスピラソームおよびシンセサム1,2と呼ばれるスーパーコンプレックスに組織化されていることを示している。これらの大規模な複合体およびスーパーコンプレックスのアセンブリ、ダイナミクス、およびアクティビティの規制を分析することは困難です。分光光度計を用いて実施された酸素電極および酵素アッセイを用いた酸素消費測定はETC複合体活性に関する貴重な情報を与えることができるが、これらのアッセイはタンパク質複合体または関連するスーパーコンプレックスの存在、サイズおよびサブユニット組成に関する情報を提供することができない。しかし、青色で透明なネイティブ(BNおよびCN)PAGE 3は、複雑な組成およびアセンブリ/分解に関する重要な情報、ならびに生理学的および病理学的条件下でのこれらの生命を脅かす呼吸器複合体の超分子構成の動的調節に関する強力なツールを創出した4 。
これらの複合体を高次スーパーコンプレックスに集合させることは、ミトコンドリア構造および機能を調節するようである5 。例えば、レスピアソームアセンブリは、電子伝達の効率およびミトコンドリア内膜5にわたるプロトン原動力の生成を増加させる。さらに、シンサソームの集合体は、ATP産生の効率および細胞質2へのエネルギー等価物の移動を増加させるだけでなく、ミトコンドリア内膜を管状クリステイ6 、/ u> 7 。マウス胚における心臓発達中のスーパーコンプレックス集合体の研究は、心臓におけるCx-1含有スーパーコンプレックスの発生が、およそ胚の13。 8日に始まることを示している。他は、Cx-I含有スーパーコンプレックスの量が、老化または虚血/再かん流傷害のために心臓において減少すること、 9,10 、または神経変性疾患の進行に役割を果たす可能性があることを示している11 。
このプロトコールは、ETC複合体およびスーパーコンプレックスのアセンブリおよび活性を調べるために用いることができる天然のゲルPAGEのための方法を記載する。ミトコンドリアのスーパーコンプレックスのおおよその分子量は、CNまたはBNポリアクリルアミドゲル中のタンパク質複合体を分離することによって評価することができる。 CN PAGEはまた、ゲル中で直接的に全てのミトコンドリア複合体の酵素活性の可視化を可能にする(in-gelアッセイ;IGA) 12 。この研究は、IGAを介してNADHを酸化するCx-Iの能力およびIGAによるCx-VのATP加水分解活性に起因するシンサソームの存在を強調することによって、呼吸器の活性を実証している。 Cx-IおよびCx-Vを含む複数の複合体およびスーパー複合体はまた、タンパク質をニトロセルロース膜上に移し、イムノブロッティングを行うことによって実証することができる。このアプローチの利点は、BNまたはCN PAGEが一般に、それらの生理学的サイズおよび組成に基づいてタンパク質複合体を分離することである。膜への移動はこのバンドのパターンを保持する。 BNまたはCN PAGEにおけるタンパク質複合体の分析は、2D-PAGE(デモンストレーションのためにFiala ら 13参照)またはショ糖密度遠心分離14,15を用いて行うこともできる。特定のバンドをさらに分析するために、それをBN PAGEから切り出すことができ、このタンパク質複合体からのタンパク質を精製することができるそれらを自然条件下で電気溶出することにより、ネイティブの電気溶出は数時間以内に行うことができ、ゲルから周囲のバッファーへのタンパク質の受動拡散(参考文献16で使用されているような)に有意差を生じさせる可能性がある。
要約すると、これらの方法は、ミトコンドリア膜からの高分子量スーパーコンプレックスのさらなる特徴付けを可能にするいくつかのアプローチを記載する。
プロトコル
すべての実験は、C57BL / 6Nマウス(野生型)の心臓を用いて行った。マウスを頚部脱臼の前にCO 2で麻酔し、すべての処置を、ロチェスター大学の実験動物学部に厳密に準拠し、州法、連邦法、およびNIH方針に従って実施した。このプロトコールは、ロチェスター大学(動物資源学会)の機関動物管理および使用委員会によって承認された。
1. CNおよびBNページ
注:BNおよびCN PAGEに使用されるすべての機器には、洗剤が含まれていないことが必要です。これを確実にするために、全ての装置を0.1M塩酸で洗浄した後、脱イオンH 2 Oで広範囲にすすいだ。
- 準備
- 4℃で25 mMイミダゾール(pH 7.0)からなる陽極バッファーを調製する。 4℃で保存する。
- CNまたはBN PAGE用の陰極バッファーを準備する。
- CN PAGEには、7.5 mMイミダゾールと50 mMトリシンを使用します。 1リットルの緩衝液あたり0.5gのデオキシコール酸ナトリウムおよび0.2gのラウリルマルトシドを加える。 4℃でpHを7.0に調整し、4℃で保存する。
- BN PAGEの場合、7.5 mMイミダゾールと50 mMトリシンを使用し、4℃でpHを7.0に調整します。 4℃で保存する。
- 薄青色のBN陰極バッファーには、7.5 mMイミダゾールと50 mMトリシンを使用します。 4℃でpHを7.0に調整し、バッファー1リットルあたり20mgのクマシーを加える。 4℃で保存する。
- 50mM NaCl、50mMイミダゾール、2mMアミノカプロン酸、および1mM EDTAを含む抽出緩衝液(EB)を調製する。 4℃でpHを7.0に調整し、4℃で保存する。
- 75mMイミダゾールおよび1.5Mアミノカプロン酸を用いて3倍のゲル緩衝液(BNおよびCNゲルに使用)を調製する。 4℃でpHを7.0に調整し、4℃で保存する。
- Ponceau S 0.01g、グリセロール5g、H 2 O 5mLのローディングバッファー(LB)を調製する。温度。
- 1mLの500mM 6-アミノヘキサン酸に50mgのクマシーを添加してクーマシーブルーを調製する。 4℃でpHを7.0に調整し、4℃で保存する。
- H 2 O中に20 mMおよび200 mMラウリルマルトシドを調製する。200μLのアリコートを調製し、それらを冷凍保存する。使用前に洗剤を解凍する。
| 3%〜8%(ミニ) | 4%〜10%(マキシ) | |||
| 0.5ゲル(軽量) | 0.5ゲル(重) | 0.5ゲル(軽量) | 0.5ゲル(重) | |
| AAB(mL) | 0.42 | 1.3 | 2.5 | 7.7 |
| CN / BN緩衝液(mL) | 1.6 | 1.6 | 8.5 | 8.5 |
| H 2 O(mL) | 2.7 | 1.4 | 14 | 6.3 |
| グリセロール(g) | 0 | 0.47 | 0 | 2.5 |
| 容量(mL) | 4.72 | 4.77 | 25 | 25 |
| APS(μL) | 27 | 27 | 65 | 65 |
| TEMED(μL) | 4 | 4 | 10 | 10 |
表1:Mini-MaxiまたはMaxi-PAGEを1回注ぐのに必要な成分の量。この表で使用される体積は、1最小または1マキシゲル、厚さ1.5mmについて計算される。 AABの容量は、40%ストック溶液に基づく。軽くて重いものは集中者を指すAABのイオン。勾配混合機の各カラムにAAB溶液を充填した後にAPSおよびTEMEDを添加する。
- ゲルの注入および注入
注:CNまたはBNゲルにはそれぞれ3-8%または4-10%アクリルアミド/ビスアクリルアミド(AAB)勾配を使用してください。 表1は、ミニゲル(85mm幅×73mm高さ×1.5mm厚)またはマキシ - ゲル(160mm)に使用される緩衝液、AAB、H 2 O、グリセロール、過硫酸アンモニウム(APS)およびテトラメチルエチレンジアミン(TEMED)幅200mm×高さ1.5mm)。 CNまたはBNゲルを用いたガラスプレートのアセンブリは、数mLの1×ゲルバッファーで袋に入れて冷蔵保存したり、保存用に1×ゲルバッファーで湿らせたペーパータオルで包んだりできます。ゲルは、1週間まで使用すると安定しています。- ゲルを注ぐために、勾配混合機を上昇した攪拌プレート上に置き、ゲルが重力によって調製されたゲルチャンバーに流れるようにします。
- グラジエントミキサーの流出チャンバーに4.77 / 25 mL(ミニ/マキシ)(AABの濃度がより高い)。
- 重いチャンバーと軽いチャンバーの間のストップコックの接続を静かに開き、溶液の一滴が反対側に流れるようにします。
注:これにより、接続チューブとストップコックから気泡が押し出され、2つのチャンバ間の流れが防止されます。これは、両側がすでに満たされている場合には実行できません。等しい圧力がバブルの移動を妨げるからです。 - グラジエントミキサーのもう一方のチャンバーに軽溶液の4.72 / 25 mL(ミニ/マキシ)を充填する。
- 重い溶液で流出チャンバに攪拌棒を置き、攪拌を開始する。バブリングを起こさない撹拌棒の速度を使用してください。
- APSとTEMEDを各チャンバーにすばやく加えて重合を開始します。
- 勾配ミキサーの2つのチャンバーの間の接続を開き、流出チャンバーを開けてゲルを注ぐ前に数秒間混合を可能にする。
ノート:重力両方のチャンバーを均等に排水し、重溶液中への光の混合は、アクリルアミド濃度をゲルの底部から頂部までゆっくりと減少させる。グラジェントミキサー内のコンテンツ全体を使用してゲルを注ぎます。- 最後に、泡と層の混合を避けるために、ウェルをゲルの中に入れて慎重に櫛を取り付けます。
- 直ちに、グラジエントミキサーをエタノールで洗浄してゲルをすすいでください。水ですすぎ、第2のゲルを注ぐ。ゲルを重合させる(通常、ミニゲルには20分未満が必要)。
- ゲルを動かすには、それらを電極アセンブリクランプに取り付け、中央/上部チャンバをCNまたはライトブルーのBNカソードバッファーで満たす。アウター/下部チャンバーにアノードバッファーを加える前に、漏れをチェックするのを数分間待ちます。
- 静かにウェルの櫛を引き出し、シリンジまたはピペットを用いて陰極バッファーでウェルを洗浄する。
- 寒い部屋(4℃)でゲルを走らせたり、氷上で完全に詰めてください。
- CNミニページの場合、最初の1時間は100V、終了するまでは200Vを使用します。通常はさらに1〜1.5時間です。あるいは、CNミニページを30〜40Vで一晩実行してください。
注:ここでは高分子量タンパク質複合体に焦点を当てているため、分子量が140 kDa未満のタンパク質複合体はゲルから使い果たされます。低分子複合体を保持するために、より短い電気泳動時間を使用することができる。 - BN maxi-PAGEについては、100Vを使用し、一晩(約18時間)ゲルを流す。
注記:電流は非常に低く(<15 mA)、これらの条件に対応できる電源が必要です。この時点で、ゲルはIGAまたはイムノブロッティングに使用することができます。いくつかの場合、バンドまたはレーンは、電気溶出のためのガラスプレート上のカミソリの刃を用いてゲルから切り取ることができる。
- CNミニページの場合、最初の1時間は100V、終了するまでは200Vを使用します。通常はさらに1〜1.5時間です。あるいは、CNミニページを30〜40Vで一晩実行してください。
- サンプル調製
注:膜結合ミトコンドリアのスーパーコンプレックスは、内部ミトコンドリア膜。ミトコンドリアのスーパー複合体を保存するには、新しく単離したミトコンドリアまたは凍結および解凍したサンプルを1回だけ使用する。下記の計算/容量は、ミニゲル(1.5mm厚ゲルの10ウェルコームのウェルは35〜40μLを保持する)およびマキシゲル(15ウェルコームのウェルは200μL)。さらに、ローディングコントロールとして、電圧依存性陰イオンチャンネル(VDAC)の検出のために変性SDSゲル上で実行するために、各試料のアリコート(通常は10μL)を保存します。- 単離されたミトコンドリアまたは組織ホモジネートの適切な量( 例えば、ミニゲル用のタンパク質10〜50μgおよびマキシゲル用の50〜200μg)をマイクロチューブに入れ、4℃で10〜15分間17,000xgで遠心分離する。
注:この手順は、可溶性ミトコンドリアのマトリックスおよび/またはサイトゾルタンパク質のいくつかを除去する。 - 吸引し、上清を捨て、所望の量に抽出緩衝液を加えるゲルに負荷する。静かに氷の上に沈殿物を再懸濁する。必要に応じて、この時点で一般的なプロテアーゼ阻害剤混合物を添加する。
注記:ここで使用した装置に基づいて、ミニゲルには30μL、マキシゲルには100μLを使用し、タンパク質/バッファー比を1μLのバッファーに対して2μg以下に制限した。 - 界面活性剤( 例えば、 2μgのラウリルマルトシド/1μgのタンパク質;詳細は、代表的な結果と考察を参照)を加えてください。
注:一般にラウリルマルトシドが使用されますが、ジギトニンも使用できます。 - 氷上で20分間インキュベートする。インキュベーション中に、チューブを粉砕および/または撹拌することによって、初めおよび時々静かに混合する。
- 4℃で10分間、17,000×gで遠心分離して、膜および組織断片を除去する。
- 上清を新しいチューブに移す。 CNサンプルの場合は、10μLのサンプル量ごとに1μLのLBを加えます。サンプルの総量はappでなければなりませんミニゲルについては約40μL、マキシゲルについては130μLである。 BNサンプルの場合、色素と洗剤の比率が1:4(w / w)になるようにサンプルにクマシーを加えます。
- サンプルの30μLと120μLをそれぞれミニゲルまたはマキシゲルのウェルにロードする。ローディングコントロールとしてVDACを検出するために、変性SDSゲルの各サンプルから残りの10μLを使用してください。
- 分子量マーカーを調製するには、60μLのBN / CNゲルバッファーに高分子量較正ミックス(詳細については表を参照)の1バイアルを溶解し、120μLのH 2 Oおよび20μLのポンド。 1レーンあたり15μLをロードする。
- ステップ1.2.9.2で概説したようにゲルを流してください。
- 単離されたミトコンドリアまたは組織ホモジネートの適切な量( 例えば、ミニゲル用のタンパク質10〜50μgおよびマキシゲル用の50〜200μg)をマイクロチューブに入れ、4℃で10〜15分間17,000xgで遠心分離する。
2. Cx-IおよびCx-Vのインゲルアッセイ
注:アッセイは室温で行います。ドキュメンテーションのために、開発中のバンドの写真、スキャン、または画像を撮影する。 (重要)タンパク質は一切転載できませんo IGA完成後のニトロセルロース膜。
- Cx-1アッセイ
- 準備。
- pH 7.4のH 2 O中の5mM Trisのアッセイ緩衝液を調製する;室温で保管してください。
- 10mgのNADHを1mLのアッセイ緩衝液に溶解する。使用するまで-20℃で100μLのアリコートで保存してください。凍結や解凍を避ける。
- マイクロチューブに25mgのNitroblueテトラゾリウムを秤量する。
- 95mLのH 2 O中に5mLの酢酸を希釈することにより固定剤を調製する;室温で保管してください。
- アッセイを行う。
- 10mgのアッセイ緩衝液を25mgのNitroblueテトラゾリウム(最終濃度:2.5mg / mL)および100μLの10mg / mL NADH(0.1mg / mL)と合わせる。これをゲル、レーン、またはCNゲルから切除された関心領域全体に加える。
注:これは、透明なプラスチック容器またはガラス容器で行うことができます。このアッセイはBN PAGE後に行うことはできませんのでご注意ください。 - 穏やかな攪拌(ロッカー)の後、> 3分間、青いバンドの展開に従ってください。
- 10〜20 mLの酢酸溶液にゲルを固定するか、5 mM Tris、pH 7.4で洗浄して反応を停止させます。ドキュメンテーションのための写真を撮る(表の表を参照)。
- 10mgのアッセイ緩衝液を25mgのNitroblueテトラゾリウム(最終濃度:2.5mg / mL)および100μLの10mg / mL NADH(0.1mg / mL)と合わせる。これをゲル、レーン、またはCNゲルから切除された関心領域全体に加える。
- 準備。
- Cx-Vアッセイ
注:Cx-Vアッセイは、Cx-V非依存性活性を示すために5μg/ mLオリゴマイシン(Cx-Vインヒビター)とともにインキュベートした2本のCNまたはBNゲルを使用して行う必要があります。- 準備。
- 35mMトリスおよび270mMグリシンを含むアッセイ緩衝液を調製する;室温でpHを8.3に調整する。バッファーを50 mLのアリコートで凍結保存しますが、凍結および解凍後にpHを確認してください。
- H 2 O中1M MgSO 4を調製する;使用するまで4℃で保存してください。
- 27.28mgのPb(NO 3 ) 2をマイクロチューブに秤量する。
- マイクロチューブに60mgのATPを秤量する。
- 1mgのoを溶解する。リゴマイシンを1mLのエタノールに溶解した。使用するまで-20℃で保存してください。
- 50mLのメタノールを50mLのH 2 Oと混合することにより固定剤を調製する;室温で保管してください。
- アッセイを行う。
- BNまたはCNゲルからゲル、レーンまたは関心のある領域を10-20 mLのアッセイバッファ±5μg/ mLのオリゴマイシン(1 mg / mLの50-100μL)中で穏やかに攪拌(ロッカー)しながら2時間インキュベートする。 mL)を室温で加えた。
- インキュベーション後、緩衝液を14mLの新鮮なアッセイ緩衝液で置換し、190μLの1M MgSO 4 (14mM)、27.28mgのPb(NO 3 ) 2 (5mM)、60mgのATP 8 mM)および75μLのオリゴマイシン(必要な場合)を含む。
- オリゴマイシン処理されたゲル上のバンドがCx-Vに依存しないバンドを与えるので、穏やかな攪拌(ロッカー)でインキュベートし、白色沈殿物を観察する。
注:沈殿物の外観は数時間かかることがあります。 - ゲルをメタノール -酸性溶液が鉛の沈殿物を溶解するため、メタノールベースの固定剤( 例えば、 50%メタノール)を使用する。結果を写真にする。
注:鉛の沈殿物は、ゲルのクマシー染色を妨げません。
- 準備。
3.ニトロセルロースまたはポリビニリデンジフルオリド(PVDF)膜へのタンパク質移動
- 25mM Trisおよび200mMグリシンのトランスファーバッファーを調製する。 pHを8.3に調整し、0.0005g / L SDSおよび200mL / Lメタノールを加える。室温で保管する。
- カミソリの刃またははさみで、ニトロセルロースまたはPVDF膜(孔径0.45μm)をゲルのサイズよりわずかに大きいサイズに切断する。
注:ニトロセルロースメンブレンはPonceau S染色でタンパク質の負荷を評価し、PVDFメンブレンではより明確に定義されたバンドが得られます。
- カミソリの刃またははさみで、ニトロセルロースまたはPVDF膜(孔径0.45μm)をゲルのサイズよりわずかに大きいサイズに切断する。
- プロトコル。
- ニトロセルロース膜、濾紙、およびスポンジを浸して転送バッファーで少なくとも10分。 PVDF膜を100%メタノール中に15秒間置くか、またはそれを移送緩衝液中に置く前に製造業者の推奨に従って。トランスファーキットのオープンカセットをトランスファーバッファー付きの平らなボウルに入れます。
- カセットの裏側にスポンジと濾紙の1-2層を置きます。気泡を取り除く。
- ゲルを濾紙上に置く。ゲルおよび/または膜の角を切り取ることによってゲルの配向を示す。
- 膜をゲルの上に置きます。すべての泡を取り除く。
- ろ紙とスポンジを膜の上に置きます。このサンドイッチのすべての泡を取り除く。
- カセットを閉じて、トランスファーキットのカセットホルダーに入れます。
- タンパク質を25Vで約12〜18時間移す。
4.イムノブロッティング
- 準備。
- Ponceau Stain(500 mL)に25 mLの酢酸と0.5gのポンソーSと475mLのH 2 O;室温で保管してください(再使用可能)。
- 200mM NaCl、25mM Tris-Base、および2.7mM KClを含むトリス緩衝食塩水(TBS)を調製する。 pHを8.0に調整し、室温で保存する。
- TBSに0.5mL / L Tween 20を加えてTBS-トウィーン(TBST)を調製する。室温で保管してください。
- 乳固形分5gをTBST 100mLに溶解して乳固形分/ TBSTを調製する。 4℃で保存し、3日以内に使用してください。
- 3gのウシ血清アルブミン(BSA、画分V)を100mLのTBSTに溶解してBSA / TBSTを調製する。 4℃で保存し、3日以内に使用してください。
- プロトコル。
- トランスファーが終了したら、膜をPonceau S溶液に入れて、転写されたすべてのタンパク質を可視化します。膜上のマーカーの位置を鉛筆で標識し、Ponceau-S染色された膜を写真またはスキャンによって記録する。
- 膜を各10分間3回洗浄する。静かに攪拌しながらTBSで洗浄した。
- メンブレンをミルク固体/ TBSTで室温で1〜2時間、または穏やかに攪拌しながら冷室内で一晩ブロックする。
- 穏やかに攪拌しながらTBSTで膜を10分間洗浄する。
- 穏やかに攪拌しながら低温室で一晩抗体と一晩インキュベートする。 BSA / TBST中で抗体( 例えば、抗ATP5Aおよび-NDUFB6について1:1,000)を希釈する。
注:ほとんどの抗体は、一晩インキュベートすると、ネイティブゲルからの膜でより良いシグナルを与えます。 - 穏やかに攪拌しながらTBSTで膜を10分間洗浄する。
- 静かに撹拌しながら室温で少なくとも60分間、二次抗体とインキュベートする。乳固形分/ TBSTで抗体(1:5,000〜1:50,000)を希釈する。
- 穏やかに撹拌しながらTBSTで室温で10分間膜を3回洗浄する。
- 最後の洗浄の間、マンファの指示に従って増強化学発光(ECL)基質を調製するcturer。
- 製造元の指示に従ってECL基質とメンブレンをインキュベートする。
- ECL基板の製造元が提供する指示を使用して、フィルム上の信号を検出します。
5.電気溶出
- 準備。
- 25mMトリシン、3.75mMイミダゾール(4℃でpH7.0)、および5mM 6-アミノヘキサン酸の溶出緩衝液を調製する。
注:電気プロテクターとメンブレンキャップを取り扱っている間は、常に手袋を着用して外部タンパク質の混入を防ぎます。
- 25mMトリシン、3.75mMイミダゾール(4℃でpH7.0)、および5mM 6-アミノヘキサン酸の溶出緩衝液を調製する。
- 電気溶流器を使用してから電気分解を行う日の前に、次の手順を実行します。
- 60℃で1時間溶出バッファーにメンブレンキャップ(カットオフ:3.5kDa)を浸します。新しい溶出バッファーにキャップを移し、冷蔵庫に12時間以上浸します。
注:3.5kDaのカットオフ分子量は、小さなp関心対象のタンパク質複合体から容易に解離する可能性のあるロイテリン。 - 電気溶出モジュール、ガラス管、タンク、および蓋をエタノールで完全に洗浄する。水ですすぎ、機器を乾燥させます。
- 60℃で1時間溶出バッファーにメンブレンキャップ(カットオフ:3.5kDa)を浸します。新しい溶出バッファーにキャップを移し、冷蔵庫に12時間以上浸します。
- ネイティブの電気溶出の日に、次の操作を行います。
- 使用する各ガラス管の底にフリットを置く。必要に応じて、ガラスチューブを溶出バッファーに入れ、フリットをチューブの内側から下方に押します。
- フリットの付いたガラス管を電気外科用モジュールのモジュールに押し込みます。グロメットを溶出バッファーで濡らし、ガラスチューブを所定の位置にスライドさせます。ガラス管の上部がグロメットで均等になっていることを確認してください。
- 空のグロメットをストッパーで閉じます。
- シリコーンアダプターの底に濡れた膜キャップを置き、溶出バッファーでアダプターを満たしてください。アダプターのバッファーをゆっくりとピペットで上下に動かし、透析膜の周囲の気泡を取り除きます。
- バッファ充填アダプターをガラス管の底にスライドさせます。ガラス管の内側にあるフリットに現れる気泡をすべて取り除いてください。
- 各ガラス管に溶出バッファーを充填する。
- BN PAGEの切り取られたバンドをガラス管に入れる(ステップ1.2.9.3参照)。大きな断片を小さな断片に分ける。ガラス管内の充填高さが約1 cmであることを確認します。
- モジュール全体をタンクに入れます。
- 約600mLの冷溶出用緩衝液をタンクに加える。透析膜の泡を防ぐために、シリコンアダプターのキャップがバッファーに入っていることを確認してください。
- タンクの底に撹拌バーを置きます。
注:攪拌は、泡が透析膜の底にくっつかないようにします。 - 冷たい部屋でタンパク質を350Vで4時間溶出する。
- 溶出が完了したら、バッファタンクからエレクトロルーターモジュールを取り出し、シンクまたはボウルに入れます。
- ストッパーを使用した場合は、ストッパーを取り外して上部バッファーチャンバー内に配置される。それ以外の場合は、大きなピペットを使用してバッファーを取り外します。
- 各ガラス管から緩衝液を取り出し、廃棄する。シリコーンアダプターが所定の位置に留まり、フリットの下の液体が乱されたり動揺していないことを確認してください。
- ガラスチューブの底面からメンブレンキャップとともにシリコンアダプターを慎重に取り外します。シリコンキャップの内容物(約400μL)をマイクロチューブにピペットで移す。別の200μLの溶出緩衝液で、シリコンキャップをすすぎ、マイクロチューブに加える。すべてのガラス管について同じ手順を繰り返します。
- メンブレンキャップは再使用することができるので、0.5mg / mLのアジ化ナトリウムを含む溶出バッファーに入れてメンブレンキャップを保存してください。冷やす。
注意:溶出液はタンパク質濃度が低く、遠心フィルター装置を使用して濃縮することができます。
結果
ミトコンドリアのスーパーコンプレックスを視覚化するために、マウスから新たに単離したミトコンドリアを使用した( 17,18 ) 。ミトコンドリアのスーパーコンプレックスは、凍結融解の繰り返しサイクルに敏感であり、崩壊に至るが、これは一部の研究者にとって許容されるかもしれない。保存に凍結が必要な場合は、最良の結果を得るために、サンプルを凍結および融解のサイクルを2回以上行うべきではありません。
ミトコンドリアETC複合体をBN PAGEで可視化するために、単離された心臓ミトコンドリア由来のタンパク質100μgを4〜10%ゲルに負荷した( 図1A )。ローディングおよびカソード緩衝液中のクマシー染色は、実行中にタンパク質複合体を標識するのに十分である。スーパーコンプレックスは、コントラストをデジタル的に増加させた後に現れる(図示せず)。 CN PAGEについては、20μgの2つのサンプルfタンパク質を単離したミトコンドリアから3〜8%CNゲルに負荷し、分離した( 図1B )。 CN PAGEをクマシーで染色し、タンパク質複合体を視覚化するために脱色した。コントラストをデジタル的に増加させた後、Cx-Iのモノマーよりも大きな分子量を有するいくつかのタンパク質複合体が現れた( 図1B 、右)。使用されたAABの濃度は、最大のスーパーコンプレックスがウェルからゲルに入ることを可能にした。しかしながら、3%未満のAABの勾配で終わるゲルは、移動またはバンドまたはレーンを切除するために操作するのに十分安定ではない。さらに、3-8%CNゲルの上部の低濃度のAABはタンパク質複合体のいくらかの移動性を維持し、これは天然の電気溶出を考慮すると重要である19 。
Cx-1の単量体およびスーパーコンプレックスおよびCの単量体、二量体および超複合体xVは酵素的に活性であり、IGAによって視覚化することができる( 図 1C〜F)。このアッセイは、単離された心臓ミトコンドリアにおいて、Cx-1およびCx-Vがそれぞれの単量体よりも大きなタンパク質複合体中に存在することを示す。 Cx-1のIGAアッセイでは、NADHが酸化され、電子がニトロブルーテトラゾリウムを還元するように移動する。これは、Cx-1モノマーおよびCx-1含有呼吸器/スーパーコンプレックスの分子量において局在化した青色をもたらす( 図1C )。 Cx-Vの活性は、F 1サブユニットがATPを加水分解する能力から評価し、CNまたはBNゲルを用いて行うことができる( 図 1D〜F)。この反応から生成されたADPは、鉛と相互作用し、Cx-V単量体、二量体、シンサソーム、およびサブ複合体(Cx-Vの未結合F 1部分)のレベルで白色沈殿を生じる。オリゴマイシンは、lこれらのバンドが剥がれ、Cx-Vを含むことが確認された( 図1E )。
ここに記載されたすべての実験では、双性イオン性界面活性剤、ラウリルマルトシドを2μg/1μgの濃度で使用しました。これは、スーパーコンプレックスを保存しながら一貫した再現性のある結果をもたらす最高濃度です( 図1F )。しかしながら、ラウリルマルトシドの有効性は、ロット番号、貯蔵条件、および年齢に依存する。したがって、1つの研究室で使用される正確な濃度は、必ずしも原稿で報告された濃度と同じではありません。適切な濃度の界面活性剤は膜を可溶化するが、複合体およびスーパーコンプレックスは無傷のままにしておき、様々な濃度のラウリルマルトシドを用いて決定しなければならない( 図1F )。 CN PAGEについては、ウェル当たり40μLの全サンプル容量が、1μg/2μgのタンパク質/洗剤比または1μg/1μL(1.9mMに等しい)の界面活性剤/緩衝液比が得られる。 40μLから、ミニゲルのウェルあたり30μLを適用した。残りは、ローディングコントロールであるVDAC( 図2D )の検出のためのアリコートとして使用した。
イムノブロッティングでは、抗体が検出するのを妨げる可能性のあるクマシーがタンパク質に負荷されないため、CNがBN PAGEよりも好ましい。 図2は、単離された心臓、肝臓、および脳のミトコンドリアからのCx-IおよびCx-Vタンパク質NDUFB6およびATP5Aを含むスーパーコンプレックスの検出を示す。転写後およびイムノブロッティング前のPonceau S標識は、分子量マーカーを標識し、タンパク質負荷を制御するために使用することができる( 図2A )。これは、ETCのタンパク質複合体のモノマーをニトロセルロースに可視化するポンソーS標識は、イムノブロッティングによって達成することができるミトコンドリアのスーパーコンプレックス( 図2A )の視覚化には必ずしも十分ではない。
Cx-Iはそれ自体二量体および四量体に集合しないが、Cx-IIIおよびCx-IVとの分子量の高いスーパーコンプレックスをますます形成する14,20,21。ここでは、NDUFB6に対する抗体を用いて、心臓からのサンプルが、肝臓または脳からのミトコンドリアよりも多くのCx-1モノマーおよび高分子量のスーパーコンプレックス(トップバンド)を含むことを示している( 図2B )。ミッドレンジレスピアソームスーパーコンプレックスの量は、他の組織よりも心臓において非常に高かった( 図2B )。
抗ATP5A抗体を用いて、心筋ミトコンドリアではっきりと見える二量体(D)およびより大きいスーパーコンプレックス(SC)を代表するバンドの明確なパターンは、肝臓および脳ミトコンドリアにおいて顕著ではないが(Cx-Vの単量体はすべての組織からミトコンドリアにおいて検出可能である図2C )。イムノブロットの過剰曝露(1分間と 20秒間)は、四量体およびシンサソームを表すことができるいくつかのCx-V含有スーパーコンプレックスを示す( 図2C )。心臓、肝臓、および脳ミトコンドリアにおけるCx-V含有タンパク質複合体のこれらのパターンは、組織特異的であり得、未だ調査されていない相違を示す。
これらのブロットのタンパク質ローディングの後に、 図2Dに示すように、Ponceau S染色およびSDS PAGEによる上記のアリコートのVDAC検出を行うことができる。
すべての抗生物質ダイは、天然のPAGE後のタンパク質複合体の四次または三次構造内のタンパク質を検出するのに適している。この問題を克服するために、ネイティブゲルからのレーン全体および部分レーンを第2の次元の変性ゲル上に載せることができる(2Dゲル、デモンストレーションのための参考文献13参照)。 2D電気泳動は、超分子複合体中のタンパク質を可視化するための貴重なツールです。しかしながら、 図2に示されるように、スーパーコンプレックスは可変量で存在し、スーパーコンプレックスからの個々のタンパク質のシグナルは、第2の変性次元において視覚化しにくい場合がある。この問題を克服するために、天然ゲルからのタンパク質複合体の電気溶出をここで使用した。これにより、複数のレーンからスーパーコンプレックスバンドが分離され、さらなる研究のためにより多くの材料が得られる。
電気溶出を使用する場合、IGAによって同定された、および/またはBN PAGE上で視覚化された関心のあるバンドのみが励起されるised;このゲル片からのタンパク質は、ゲルからの溶出によってさらに精製される。 図3Aは、モノマーを表すバンドが電気溶出のために摘出されたBN PAGEのレーンを示す。電気溶出後のモノマーのCx-V活性を評価するために、溶出液を第2のCN PAGEに適用した。モノマーの溶出液には依然として酵素的に活性なCx-Vが含まれていますが、サブコンプレックスも出現します( 図3B )。天然のCN PAGE( 図3C )または変性SDS PAGE( 図3D )の後の溶出液の銀染色は、溶出液中のタンパク質の存在を示し、ATP5Aに対するイムノブロッティングは両方の試料においてCx-Vの存在を示す( 図3D )。
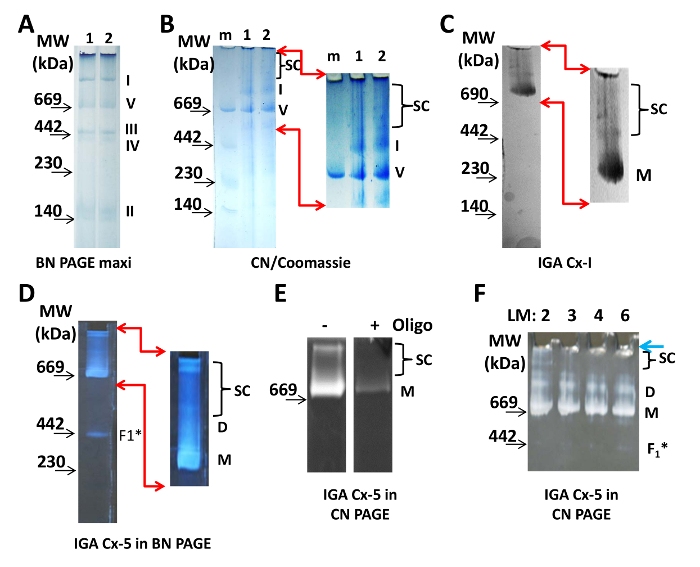
図1:Mitochの可視化ondrialスーパーコンプレックス。 ( A )4~10%BN maxi-gelの2つのレーン、分離した心臓のミトコンドリアのサンプル。同じサンプルのアリコートを、1ウェルあたり100μgのタンパク質で両方のレーンに流した。 ETCのタンパク質複合体I、II、III、IVおよびVのモノマーがはっきりと見え、ゲルの右側に標識されている。 ( B )心臓ミトコンドリアの2つのサンプル(1および2、20μgのタンパク質/レーン)をCN PAGE上で分離し、クマシー染色によって視覚化した。 SCは、ゲルの上部の倍率およびデジタル増強後のスーパーコンプレックスの位置を示す(この領域は赤色の矢印によって示される)。 ( C )ミトコンドリアタンパク質20μgを3〜8%CN PAGEで分離し、Cx-1 IGA処理した。拡大されデジタル的に強調された画像は、Cx-I反応生成物のバンドを示す。 ( D )ミトコンドリアタンパク質20μgを3〜8%BN PAGEで分離し、Cx-V IGAで処理した。マグニフィ Cx-V反応生成物のバンドを示す。 ( E )ミトコンドリアタンパク質50μgを5〜15%CN PAGEで分離し、5μg/ mLのオリゴマイシン(Oligo)を添加しない(+)Cx-V IGAで処理した。 ( F )ミトコンドリアタンパク質(20μg/レーン)を、ゲルの上部に示されるように、1μgのラウリルマルトシド2〜6μgで可溶化し、3〜8%CNゲル上で分離した後、Cx- V IGA。すべての画像はライトテーブル( A - C )またはブラックサーフェス( D - F )のいずれかを使用して撮影されました。カメラの仕様は材料表に記載されています。分子量マーカー(MW)の位置は、全てのパネルの左側に示されている。略語:D =二量体; F 1 * = Cx-Vのサブコンビネーション; LM =ラウリルマルトシド; m =分子量マーカー; M =モノマー; SC =スーパーコンプレックス。g1large.jpg "target =" _ blank ">この図の拡大版を見るには、ここをクリックしてください。
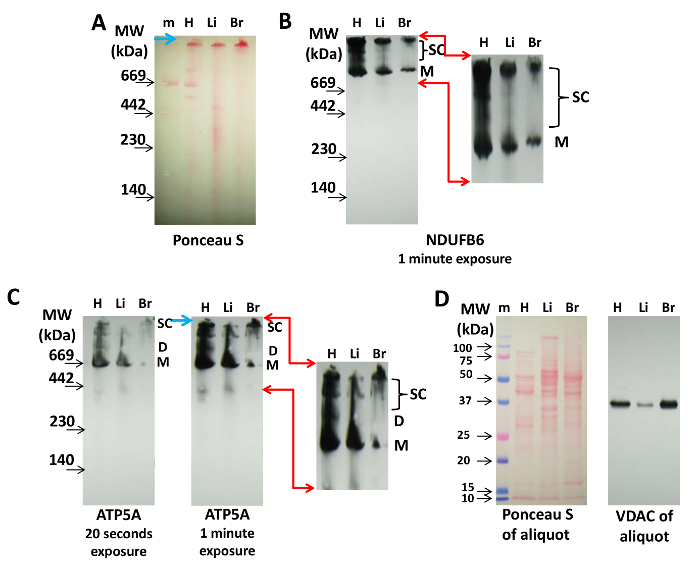
図2:イムノブロッティングによるミトコンドリアのスーパーコンプレックスの検出。心臓(H)、肝臓(Li)および脳(B)ミトコンドリアからのタンパク質20μgを3〜8%CN PAGE上で分離し、ニトロセルロース膜上に移した。 ( A )膜のPonceau S染色は、タンパク質複合体および分子量マーカー(m)の存在を示す。青い矢印はゲルの上部を指します。 ( B )Cx-1タンパク質であるNDUFB6を(A)に示すブロットで免疫標識した(1分暴露時間)。 ( C )Cx-Vを抗ATP5A抗体で視覚化した(示されているように、20秒間および1分間の暴露)。 (B)と(C)の赤い矢印は、拡大表示され、視覚的にデジタル的に強調された領域を示しますCx-IおよびCx-V含有スーパーコンプレックスのライゼーション、および青色矢印はゲルの上部を指す。 SDS PAGEにより分離し、ニトロセルロースに移した( D )Ponceau Sおよび(A)、(B)および(C)で使用した各抽出物のVDACアリコートの免疫標識。略語:M = Cx-1またはCx-Vのモノマー、D = Cx-Vの二量体、SC = Cx-IまたはCx-Vを含むスーパーコンプレックス。 この図の拡大版を見るには、ここをクリックしてください。

図3:Cx-Vの電気溶出。 ( A )ミトコンドリア試料のBN PAGE。ボックスバンドは、切除され、電気溶出されたCx-Vのモノマーを表す。 ( B )溶出液をCN PAGEに供し、続いてCx-VのIGAはモノマー(M)を示し、およびCx-VのF 1を含むサブコンプレックスを含む。 ( C )溶出液のCN PAGEの銀染色は、モノマー(M)を示す。 ( D )溶離液の変性ドデシル硫酸ナトリウム(SDS)PAGEの銀染色(左パネル)およびATP5A(右パネル)のイムノブロットは、Cx-Vの存在を示す。 SDS PAGEについては、別の場所で公開されているプロトコルを参照してください。 この図の拡大版を見るには、ここをクリックしてください。
ディスカッション
機能的ETCは、ミトコンドリアATP生成に必要である。 ETCの複合体は、respirasomes(Cx-1、-III、-IV) 1とシンターソーム(Cx-V) 2の2種類のスーパーコンプレックスを形成することができます。 ETCをスーパーコンプレックスに編成することは、ETC全体の効率を向上させると考えられている5,22。これらのスーパーコンプレックスがどのように組み立てられ分解されるかはよく分かっていませんが、ここに提示されているプロトコールはこれらのプロセスをよりよく理解できるようにするかもしれません。
ETCアセンブリを研究することの主要な課題は、これらのタンパク質複合体のサイズである。例えば、ミトコンドリア呼吸器は、Cx-1(約880kDa)およびCx-III(460kDa)およびCx-IV(200kDa、二量体として活性)の1つ以上の分子から成り、その結果、分子とのスーパーコンプレックス約重さ2,000 kDa。さらに、Cx-Vは約600kDaの分子量を有するが、二量体、四量体、オリゴマー、および二量体のリボン7,23に集合し、分子量2,000kDa以上のスーパーコンプレックスをもたらすことが示されている。これらのスーパーコンプレックスの巨大なサイズを考慮すると、いくつかの関連するアプローチが、このラボや他の研究者によって、これらのスーパーコンプレックスを同定し特徴付けするために伝統的に用いられてきた8,14,24。
この研究は、活性タンパク質複合体が中性洗剤を用いてミトコンドリア膜から静かに抽出される天然ゲルPAGEの技術を実証している。複合体は、主にそれらのサイズおよび内在電荷(CN PAGE)またはタンパク質結合クマシーブルー(BN PAGE)のサイズおよび負電荷のためにゲル中を移動する。これらのゲルは、Cタンパク質バンドを明らかにするために青色( 例えば、 CNゲル中)または銀染色( 例えば、 BNおよびCN PAGE中)。
ラウリルマルトシドは、この洗剤が最も確実に働いたので、ここで実証された実験に使用された。あるいは、ジギトニンを用いてタンパク質複合体12を抽出することができる。成人の心臓、肝臓、および脳から単離されたミトコンドリアからのデータがここに示されているが、これらの技術は、胚および成人の心臓ホモジネート8で行われている。他の研究者は、培養細胞24から単離されたミトコンドリアを用いてこの技術を実施している24 。しかし、組織ホモジネートや培養細胞のDNA含量が高い場合は、電気泳動中にストリークが発生しないようにヌクレアーゼを添加することが有効です25 。
異なる複合体の活性は、ここでCx-IおよびCx-Vについて示されたようにゲル中で直接的にアッセイすることができ、tecまた、Cx-II、-III、および-IV 12の活動を調べることもできます。しかし、これらのIGAの解析は注意深く行う必要があります。第1に、酵素反応は、非ETC酵素または不完全に組み立てられた複合体に起因する可能性がある。例えば、インタクトなCx-Vを阻害するためにオリゴマイシンで処理された平行ゲルを用いてCx-V IGAを実施することは日常的である( 図3 )。さらに、他のNADHオキシダーゼは、Cx-1のゲル内活性を説明することができる。ロテノンのようなCx-1阻害剤の存在下で平行IGAを行うことができる。しかし、 図1では、単離されたミトコンドリアが使用されたので、細胞質NADHオキシダーゼは存在しなかった。したがって、データはCx-1含有モノマーおよびスーパーコンプレックスを表す可能性が最も高い。さらに、これらの結果の定量化は、写真またはスキャン上のバンドの信号強度を測定することによって可能である。このアプローチの欠点には、反応生成物の移動度、ゲルの深さ全体にわたって生成物を適切に定量することができないこと、および反応27の潜在的な非線形性が含まれる。後者を克服するために、シリアル写真を使用して反応速度を得ることを提案しているものもあるが、ここでは試していない。
天然のゲル中のタンパク質もまた膜に移すことができ、バンドのタンパク質組成はイムノブロッティング(ここに示す)または2D PAGE(参考文献13に示す )によって調べることができる。 ETC複合体の単量体は、単離されたミトコンドリアの天然ゲル、それらのゲル中の位置、および分子マーカータンパク質に対するそれらの位置( 図1 )に豊富に存在することによって伝統的に同定されている。さらに、異なる複合体のサブユニットに特異的な抗体によるその後のイムノブロットの標識は、複合体および組成物を同定するのに役立つスーパーコンプレックスのしたがって、抗NDUFB6および-ATP5Aは、ここに示されるように、Cx-1およびCx-Vをそれぞれ含有する単量体および超複合体を同定する。 Cx-II〜IVに対する抗体は、同じ目的のために使用することができる。いくつかの抗体が変性タンパク質に特異的であるか、またはエピトープが天然複合体中の他のタンパク質によってマスキングされ得るという事実のために、変性ゲルにおいてうまく働く抗体は、天然ゲルにおいてうまく機能しない可能性がある。
ほとんどの利用可能な分子量マーカーがCx-Vモノマーのサイズよりも低いため、これらのスーパーコンプレックスの分子量の正確な決定は困難である。天然ゲル中のタンパク質複合体の移動は、使用されるサイズ、内因性電荷および界面活性剤に依存する28 。ここの例では、複合体のモノマーは、ゲル、マーカー、およびイムノブロッティングに基づいて同定された。 Cx-Vの二量体は、Cx-Iおよび-Vの単量体と比較した相対移動および免疫ブロッティング。ゲル、IGAおよびイムノブロットの単量体および二量体より上のものはすべて、スーパーコンプレックスであると考えられる。
ネイティブイムノブロットはまた、標準的な技術を用いてバンド密度を分析することによってスーパーコンプレックスについて定量することができる。この方法はここには示されていませんが、最近の刊行物はこの手法を実証しています8 。タンパク質ローディングの標準化は、レーンのPonceauレッド染色を使用するか、またはミトコンドリア抽出物のサンプルを保存して変性イムノブロット上のVDACバンドの密度を測定することによって行うことができる( 図2A およびD )。さらに、同じ免疫ブロットでモノマーに対するスーパーコンプレックスの比を調べることは、バンド密度を定量する別の方法ですが、ブロットの開発中に異なる時間に写真を撮るように注意して、バンドが過剰露出しないようにする必要があります。
最後に、天然ゲル由来のバンドを電気溶出して精製することができるd、より高次の複合体に集合し、複雑な機能のさらなる研究に使用することができる活性タンパク質複合体。例えば、Cx-Vモノマーは、以前に電気溶出され、電気的機能性29を示すためにリポソームに再構成された。天然の電気溶出に対する別のアプローチは、周囲の緩衝液16への受動拡散による溶出であるが、これは天然の電気溶出に比べて遅い。最後に、電気溶出の大きな問題は、複合体が精製中に解離することがあるので、電気溶出されたタンパク質複合体の酵素的機能を維持することである。従って、この技術による単離後の機能のアッセイは、厳密に試験しなければならない。
これらのプロトコールを、個々のETC複合体の機能およびETC30全体の活性および他のメトトレキサートの活性を調べる酵素アッセイおよび酸素消費測定と組み合わせることによりODSのような複合体やスーパーコンプレックスの構造の結晶学的な31と電子顕微鏡的32の評価など、ETCの内部動作のコンプリータ画像が現れました。我々は、複合体がどのように組み立てられているか、電子が鎖をどのように流れていくか、どのように陽子が膜を横切って勾配を生成するのかを理解し、Axを生成するためにCx-Vを介してマトリックスに戻る。間違いなく、これらの技術は、ETCの構造、機能、および動的制御に関する追加の詳細を提供するよう、さらに洗練されるであろう。
開示事項
著者は何も開示することはない。
謝辞
この研究は、米国心臓協会創設者のアフィリエイト[12GRNT12060233]およびロチェスター大学の強力な児童研究センターからの助成金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Protean II mini-gel chamber | Biorad | 1658004 | Complete set to pour and run mini-gel electrophoresis |
| Protean XL maxi-gel | Biorad | 1653189 | Complete set to pour and run maxi-gel electrophoresis |
| Gradient maker, Hoefer SG15 | VWR | 95044-704 | Pouring mini-gel gradients |
| Gradient maker, maxi-gel | VWR | GM-100 | Pouring maxi-gel gradients |
| Transfer kit | Biorad | 1703930 | Complete set to wet transfer of proteins onto membranes |
| Electroeluter model 422 | Biorad | 1652976 | Electroelution of proteins from native or SDS PAGES |
| Glass plates | Biorad | 1653308 | Short plates |
| Glass plates | Biorad | 1653312 | Spacer plates |
| Glass plates | Biorad | 1651823 | Inner plates |
| Glass plates | Biorad | 1651824 | Outer Plates |
| Power supply | Biorad | 1645070 | Power supply suitable for native electrophoresis |
| ECL-Western | Thermo Scientific | 32209 | Chemolumniscense substrate |
| SuperSignal-West Dura | Thermo Scientific | 34075 | Enhanced chemolumniscense substrate |
| Film/autoradiography film | GE Health care | 28906845 | Documentation of Western blots |
| Film processor CP1000 | Agfa | NC0872640 | |
| Canon Power Shot 640 | Canon | NA | Taking photos to document gels, membranes and blots. |
| Canon Power Shot 640 Camera hood | Canon | shielding camera for photos being taken on a light table | |
| Acrylamide/bisacrylamide | Biorad | 1610148 | 40% pre-mixed solution |
| Glycine | Sigma | G7403 | |
| SDS (sodium dodecyl sulfate) | Invitrogen | 15525-017 | |
| Tris-base | Sigma | T1503 | Buffer |
| Tricine | Sigma | T0377 | |
| Sodium deoxychelate | Sigma | D66750 | Detergent |
| EDTA | Sigma | E5134 | |
| Sucrose | Sigma | S9378 | |
| MOPS | Sigma | M1254 | Buffer |
| Imidazole | Sigma | I15513 | Buffer |
| Lauryl maltoside | Sigma | D4641 | Detergent |
| Coomassie G250 | Biorad | 161-0406 | |
| Aminohexanoic acid | Sigma | O7260 | |
| Native molecular weight kit | GE Health care | 17-0445-01 | High molecular weight calibraition kit for native electrophoresis. |
| Name | Company | Catalog Number | Comments |
| NADH | Sigma | N4505 | |
| Nitroblue tetrazolium | Sigma | N6639 | |
| Tris HCl | Sigma | T3253 | |
| ATP | Sigma | A2383 | |
| Name | Company | Catalog Number | Comments |
| Lead(II) nitrate (Pb(NO3)2): | Sigma | 228621 | |
| Oligomycin | Sigma | O4876 | |
| Name | Company | Catalog Number | Comments |
| Ponceau S | Sigma | P3504 | |
| anti-ATP5A | Abcam | ab14748 | antibody to ATP synthase subunit ATP5A |
| anti-NDUFB6 | Abcam | ab110244 | antibody to Cx-1 subunit NDUFB6 |
| anti-VDAC | Calbiochem | 529534 | antibody to VDAC |
| ECL HRP linked antibody | GE Health Care | NA931V | secondary antibody to ATP5A, NDUFB6 and VDAC |
| Blocking reagent | Biorad | 170-6404 | |
| BSA | |||
| sodium chloride | Sigma | S9888 | |
| potassium chloride | Sigma | P9541 | |
| EGTA | Sigma | E3889 | |
| Name | Company | Catalog Number | Comments |
| Silver staining Kit | Invitrogen | LC6070 |
参考文献
- Lenaz, G., Genova, M. L. Supramolecular organisation of the mitochondrial respiratory chain: a new challenge for the mechanism and control of oxidative phosphorylation. Adv Exp Med Biol. 748, 107-144 (2012).
- Saks, V., et al. Intracellular Energetic Units regulate metabolism in cardiac cells. J Mol Cell Cardiol. 52 (2), 419-436 (2012).
- Schagger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal Biochem. 217 (2), 220-230 (1994).
- Wittig, I., Schagger, H. Native electrophoretic techniques to identify protein-protein interactions. Proteomics. 9 (23), 5214-5223 (2009).
- Genova, M. L., Lenaz, G. Functional role of mitochondrial respiratory supercomplexes. Biochim Biophys Acta. 1837 (4), 427-443 (2014).
- Hahn, A., et al. Structure of a Complete ATP Synthase Dimer Reveals the Molecular Basis of Inner Mitochondrial Membrane Morphology. Molecular cell. 63 (3), 445-456 (2016).
- Strauss, M., Hofhaus, G., Schroder, R. R., Kuhlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. EMBO J. 27 (7), 1154-1160 (2008).
- Beutner, G., Eliseev, R. A., Porter, G. A. Initiation of electron transport chain activity in the embryonic heart coincides with the activation of mitochondrial complex 1 and the formation of supercomplexes. PloS one. 9 (11), e113330(2014).
- Genova, M. L., Lenaz, G. The Interplay Between Respiratory Supercomplexes and ROS in Aging. Antioxid Redox Signal. 23 (3), 208-238 (2015).
- Rosca, M. G., et al. Cardiac mitochondria in heart failure: decrease in respirasomes and oxidative phosphorylation. Cardiovasc Res. 80 (1), 30-39 (2008).
- Kuter, K., et al. Adaptation within mitochondrial oxidative phosphorylation supercomplexes and membrane viscosity during degeneration of dopaminergic neurons in an animal model of early Parkinson's disease. Biochim Biophys Acta. 1862 (4), 741-753 (2016).
- Wittig, I., Karas, M., Schagger, H. High resolution clear native electrophoresis for in-gel functional assays and fluorescence studies of membrane protein complexes. Mol Cell Proteomics. 6 (7), 1215-1225 (2007).
- Fiala, G. J., Schamel, W. W., Blumenthal, B. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for analysis of multiprotein complexes from cellular lysates. J Vis Exp. (48), (2011).
- Acin-Perez, R., Fernandez-Silva, P., Peleato, M. L., Perez-Martos, A., Enriquez, J. A. Respiratory active mitochondrial supercomplexes. Molecular cell. 32 (4), 529-539 (2008).
- Dudkina, N. V., Eubel, H., Keegstra, W., Boekema, E. J., Braun, H. P. Structure of a mitochondrial supercomplex formed by respiratory-chain complexes I and III. Proc Nat Acad Sci USA. 102 (9), 3225-3229 (2005).
- Giorgio, V., et al. Dimers of mitochondrial ATP synthase form the permeability transition pore. Proc Nat Acad Sci USA. 110 (15), 5887-5892 (2013).
- Beutner, G., Sharma, V. K., Giovannucci, D. R., Yule, D. I., Sheu, S. S. Identification of a ryanodine receptor in rat heart mitochondria. J Biol Chem. 276 (24), 21482-21488 (2001).
- Rehncrona, S., Mela, L., Siesjo, B. K. Recovery of brain mitochondrial function in the rat after complete and incomplete cerebral ischemia. Stroke. 10 (4), 437-446 (1979).
- Schagger, H. Blue-native gels to isolate protein complexes from mitochondria. Methods Cell Biol. 65, 231-244 (2001).
- Althoff, T., Mills, D. J., Popot, J. L., Kuhlbrandt, W. Arrangement of electron transport chain components in bovine mitochondrial supercomplex I1III2IV1. EMBO J. 30 (22), 4652-4664 (2011).
- Schafer, E., et al. Architecture of active mammalian respiratory chain supercomplexes. J Biol Chem. 281 (22), 15370-15375 (2006).
- Wittig, I., Schagger, H. Supramolecular organization of ATP synthase and respiratory chain in mitochondrial membranes. Biochim Biophys Acta. 1787 (6), 672-680 (2009).
- Davies, K. M., et al. Macromolecular organization of ATP synthase and complex I in whole mitochondria. Proc Nat Acad Sci USA. 108 (34), 14121-14126 (2011).
- Lapuente-Brun, E., et al. Supercomplex assembly determines electron flux in the mitochondrial electron transport chain. Science. 340 (6140), 1567-1570 (2013).
- Antonioli, P., Bachi, A., Fasoli, E., Righetti, P. G. Efficient removal of DNA from proteomic samples prior to two-dimensional map analysis. J Chromatogr A. 1216 (17), 3606-3612 (2009).
- Wittig, I., Carrozzo, R., Santorelli, F. M., Schagger, H. Functional assays in high-resolution clear native gels to quantify mitochondrial complexes in human biopsies and cell lines. Electrophoresis. 28 (21), 3811-3820 (2007).
- Glancy, B., Balaban, R. S. Protein composition and function of red and white skeletal muscle mitochondria. Am J Physiol Cell Physiol. 300 (6), C1280-C1290 (2011).
- Wittig, I., Beckhaus, T., Wumaier, Z., Karas, M., Schagger, H. Mass estimation of native proteins by blue native electrophoresis: principles and practical hints. Mol Cell Proteomics. 9 (10), 2149-2161 (2010).
- Alavian, K. N., et al. An uncoupling channel within the c-subunit ring of the F1FO ATP synthase is the mitochondrial permeability transition pore. Proc Nat Acad Sci USA. 111 (29), 10580-10585 (2014).
- Chance, B., Williams, G. R. Respiratory enzymes in oxidative phosphorylation. IV. The respiratory chain. J Biol Chem. 217 (1), 429-438 (1955).
- Zickermann, V., et al. Structural biology. Mechanistic insight from the crystal structure of mitochondrial complex I. Science. 347 (6217), 44-49 (2015).
- Zhu, J., Vinothkumar, K. R., Hirst, J. Structure of mammalian respiratory complex I. Nature. 536 (7616), 354-358 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved