Method Article
ניתוח Supercomplexes של Mitochondrial אלקטרונים שרשרת התחבורה עם אלקטרופורזה הילידים, ב-מבחני ג'ל, ו Electroelution
In This Article
Summary
פרוטוקול זה מתאר את ההפרדה של מיטוכונדריאלי תפקודי שרשרת התחבורה אלקטרונים מתח (Cx) IV ו supercomplexes מהם באמצעות אלקטרופורזה יליד לחשוף מידע על הרכבה שלהם המבנה. ג'ל הילידים יכול להיות נתון immunoblotting, מבחני ג'ל, וטיהור על ידי electroelution כדי לאפיין עוד קומפלקסים בודדים.
Abstract
רשת ההולכה המיטוכונדריאלית (ETC) מייצרת את האנרגיה הנגזרת מהתפלגות של דלקים שונים למטבע הביו-אנרגטי של התא, ATP. ה- ETC מורכב מ -5 מתחמי חלבון מסיבי, אשר גם להרכיב סופר קומפלקסים הנקראים respirasomes (CI, C-III, ו- C-IV) ו synthasomes (קורות חיים) המגבירים את היעילות של התחבורה אלקטרונים הייצור ATP. שיטות שונות שימשו במשך למעלה מ -50 שנה כדי למדוד את הפונקציה ETC, אבל פרוטוקולים אלה אינם מספקים מידע על הרכבה של קומפלקסים בודדים supercomplexes. פרוטוקול זה מתאר את הטכניקה של ג 'ל הילידים polyacrylamide ג'ל אלקטרופורזה (PAGE), שיטה ששונה לפני יותר מ -20 שנה ללמוד מבנה מורכבים ETC. יליד אלקטרופורזה מאפשר הפרדה של מתחמי ETC לתוך צורות פעיל שלהם, ואז קומפלקסים אלה ניתן ללמוד באמצעות immunoblotting, מבחני ג'ל (IGA), וטיהור על ידי electroelution. על ידי שילוב מחדשSults של ג 'ל הילידים PAGE עם אלה של מבחני המיטוכונדריה אחרים, ניתן להשיג תמונה completer של פעילות ETC, הרכבה דינמי שלה פירוק, וכיצד זה מווסת מבנה המיטוכונדריה ותפקוד. עבודה זו תדון גם במגבלות של טכניקות אלה. לסיכום, הטכניקה של הילידים PAGE, ואחריו immunoblotting, IGA, electroelution, המוצגת להלן, היא דרך רבת עוצמה לחקור את הפונקציונליות ואת ההרכב של supercomplexes המיטוכונדריה ETC.
Introduction
אנרגיה מיטוכונדריאלית בצורה של ATP אינה חיונית רק להישרדות התא, אלא גם להסדרת מוות התא. הדור של ATP על ידי זירזון חמצוני דורש שרשרת תובלה אלקטרונית תפקודית (ETC, Cx-I ל- IV) ו synthase ATP המיטוכונדריה (Cx-V). מחקרים שנעשו לאחרונה הראו כי אלה קומפלקסים חלבונים גדולים מאורגנים supercomplexes, נקרא respirasomes ו synthasomes 1 , 2 . זה מאתגר לנתח את הרכבה, דינמיקה, ויסות הפעילות של אלה קומפלקסים מסיבי supercomplexes. בעוד מדידות צריכת חמצן שנלקחו עם אלקטרודה חמצן מבחני אנזים שנערכו באמצעות ספקטרופוטומטר יכול לתת מידע בעל ערך על פעילות מורכבים ETC, מבחני אלה לא יכולים לספק מידע לגבי נוכחות, גודל, הרכב הרכב משנה של קומפלקס חלבון או supercomplexes המעורבים. עם זאת, פיתוח של יליד כחול ברור (BN ו- CN, בהתאמה) עמוד 3 יצרה כלי רב עוצמה לחשוף מידע חשוב על הרכב מורכבים הרכבה / פירוק ועל הרגולציה הדינמית של הארגון supramolecular של אלה מתחמי הנשימה חיוני בתנאים פיזיולוגיים ופתולוגיים 4 .
הרכבה של קומפלקסים אלה לתוך supercomplexes בסדר גבוה יותר נראה להסדיר מבנה המיטוכונדריה ותפקוד 5 . לדוגמה, הרכבה respirasome מגביר את היעילות של העברת אלקטרונים ואת הדור של כוח המניע פרוטון על פני קרום פנימי המיטוכונדריה 5 . בנוסף, הרכבה של synthasomes לא רק מגביר את היעילות של ייצור ה- ATP והעברת שווי אנרגיה לתוך הציטופלסמה 2 , אבל זה גם עובש את הממברנה הפנימית המיטוכונדריאלי לתוך cristae 6 צינורי ,/ Sup> 7 . מחקרים של הרכבה supercomplex במהלך התפתחות הלב בעוברים עכבר עולה כי הדור של Cx-I המכילים supercomplexes בלב מתחיל בערך ביום עובריים 13.5 8 . אחרים הראו כי כמות supercomplexes המכיל Cx-I פוחתת בלב עקב הזדקנות או איסכמיה / reperfusion פציעות 9 , 10 או יכול לשחק תפקיד בהתקדמות של מחלות ניווניות 11 .
פרוטוקול זה מתאר שיטות ג 'ל הילידים PAGE שניתן להשתמש בהם כדי לחקור את הרכבה ופעילות של מתחמי ETC ו supercomplexes. המשקל המולקולרי המשוער של supercomplexes המיטוכונדריה ניתן להעריך על ידי הפרדת מתחמי חלבון CN או BN polyacrylamide ג'לים. CN PAGE גם מאפשר הדמיה של הפעילות האנזימטית של כל מתחמי המיטוכונדריה ישירות הג'ל (ב-מבחני ג'ל;IGA) 12 . עבודה זו מדגימה את הפעילות של respirasomes על ידי הדגשת היכולת של Cx-I לחמצן NADH דרך IGA ואת נוכחות של synthasomes בשל פעילות ATP- hydrolyzing של CX-V על ידי IGA. קומפלקסים מרובים supercomplexes המכילים Cx-I ו CX-V יכול גם להיות הוכח על ידי העברת חלבונים על גבי קרומי ניטרוצלולוזה וביצוע immunoblotting. היתרון של גישה זו היא כי BN או CN PAGE בדרך כלל מפריד מתחמי חלבון על פי גודל פיזיולוגי שלהם הרכב; ההעברה לקרום משמרת תבנית זו של להקות. ניתוח מתחמי חלבון בדף BN או CN יכול להיעשות גם באמצעות 2D-PAGE (ראה Fiala et al 13 להפגנה) או על ידי צנטריפוגה צפיפות סוכרוז 14 , 15 . כדי לנתח עוד להקה ספציפית, זה יכול להיות נכרת מן דף BN, ואת החלבונים ממכלול חלבון זה יכול להיות purifieד על ידי electroeluting אותם בתנאים הילידים. Electroution יליד יכול להתבצע בתוך כמה שעות, אשר יכול לעשות הבדל משמעותי דיפוזיה פסיבית (כמו בשימוש הפניה 16) של חלבונים מן ג'ל לתוך חיץ הסובבים.
לסיכום, שיטות אלה מתארות מספר גישות המאפשרות את אפיון נוסף של supercomplexes משקל מולקולרית גבוהה ממברנות המיטוכונדריה.
Protocol
כל הניסויים בוצעו באמצעות לבבות מ C57BL / 6N עכברים (סוג בר). עכברים היו מורדמים עם CO 2 לפני פריקה צוואר הרחם, וכל ההליכים בוצעו בהתאם קפדנית עם המחלקה של מעבדה לבעלי חיים באוניברסיטת רוצ'סטר ועל פי החוק המדינה, החוק הפדרלי, ואת מדיניות NIH. הפרוטוקול אושר על ידי טיפול בבעלי חיים מוסדיים ועדת שימוש של אוניברסיטת רוצ'סטר (ועדת האוניברסיטה על בעלי חיים משאבים).
1. CN ו- BN PAGE
הערה: כל הציוד המשמש עבור BN ו- CN PAGE חייב להיות נטול חומר ניקוי. כדי להבטיח זאת, לשטוף את כל הציוד עם חומצה הידרוכלורית 0.1 M, ואחריו שטיפה בהרחבה עם H 2 O deionized.
- הכנה
- הכן חיץ באנודה בהיקף של 25 מ"מ imidazole, pH 7.0, ב 4 ° C; חנות ב 4 ° C.
- הכן חיץ קטודה עבור CN או BN PAGE.
- עבור CN PAGE, השתמש 7.5 mM imidazole ו 50 מ"מ טריסין; מוסיפים 0.5 גרם של נתרן deoxycholate ו 0.2 גרם של maltoside lauryl לליטר חיץ. להתאים את ה- pH ל 7.0 ב 4 ° C ולאחסן ב 4 ° C.
- עבור BN PAGE, השתמש 7.5 mM imidazole ו 50 מ"מ טריסין ולהתאים את ה- pH ל 7.0 ב 4 מעלות צלזיוס. חנות ב 4 ° C.
- עבור חיץ כחול BN כחול BN, להשתמש 7.5 מ"מ imidazole ו 50 מ"מ טריסין. להתאים את ה- pH ל 7.0 ב 4 ° C ולהוסיף 20 מ"ג של קומאסי לליטר חיץ. חנות ב 4 ° C.
- הכן חיץ מיצוי (EB) עם 50 מ"מ NaCl, 50 מ"מ imidazole, 2 מ"מ חומצה aminocaproic, ו 1 מ"מ EDTA. להתאים את ה- pH ל 7.0 ב 4 ° C ולאחסן ב 4 ° C.
- הכן חיץ ג 'ל 3x (המשמש BN ו- CN ג'ל) עם 75 מ"מ imidazole ו 1.5 M חומצה אמינאקפרואית. להתאים את ה- pH ל 7.0 ב 4 ° C ולאחסן ב 4 ° C.
- הכנת חיץ טוען (LB) של 0.01 גרם של Ponceau S, 5 גרם של גליצרול, ו 5 מ"ל של H 2 O. חנות בחדרטֶמפֶּרָטוּרָה.
- הכן קומאסי כחול על ידי הוספת 50 מ"ג של קומאסי ל 1 מ"ל של 500 מ"מ 6-aminohexanoic חומצה. להתאים את ה- pH ל 7.0 ב 4 ° C ולאחסן ב 4 ° C.
- הכן 20 מ"מ ו 200 מ"מ lauryl maltoside ב H 2 O. לעשות aliquots של 200 μL ולאחסן אותם קפואים. להפשיר את חומר הניקוי לפני השימוש.
| 3% עד 8% (מיני) | 4% עד 10% (מקסי) | |||
| 0.5 ג 'ל (אור) | 0.5 ג'ל (כבד) | 0.5 ג 'ל (אור) | 0.5 ג'ל (כבד) | |
| AAB (mL) | 0.42 | 1.3 | 2.5 | 7.7 |
| CN / BN חיץ (מ"ל) | 1.6 | 1.6 | 8.5 | 8.5 |
| H 2 O (mL) | 2.7 | 1.4 | 14 | 6.3 |
| גליצרול (ז) | 0 | 0.47 | 0 | 2.5 |
| נפח (מ"ל) | 4.72 | 4.77 | 25 | 25 |
| APS (μL) | 27 | 27 | 65 | 65 |
| TEMED (μL) | 4 | 4 | 10 | 10 |
טבלה 1: כמויות של החומרים הדרושים לשפוך 1 מיני או Maxi-PAGE. הכרכים המשמשים בטבלה זו מחושבים עבור 1 מיני או 1 מקסי ג 'ל, 1.5 מ"מ עובי. נפח AAB מבוסס על פתרון המניות 40%. אור וכבד מתייחסים לריכוזיון של AAB. APS ו TEMED מתווספים לאחר כל עמודה של מערבל שיפוע מלא פתרון AAB.
- לשפוך ולהפעיל ג'לים
הערה: השתמש 3-8% או 4-10% acrylamide / bisacrylamide (AAB) שיפוע עבור CN או BN ג'ל, בהתאמה. טבלה 1 מסכמת את כמויות של חיץ, AAB, H 2 O, גליצרול, ammoniumpersulfate (APS) ו tetramethylethylenediamine (TEMED) המשמש מיני ג'ל (85 מ"מ רוחב x 73 מ"מ גבוה x 1.5 מ"מ עובי) או מקסי ג 'ל (160 מ"מ רוחב x 200 מ"מ גבוה x 1.5 מ"מ עובי). הרכבות של צלחות זכוכית עם ג'ל CN או BN ניתן קירור בשקית עם כמה מ"ל של חיץ 1x ג'ל או עטוף במגבת נייר הרטובות עם חיץ 1x ג'ל לאחסון. הג'לים יציבים לשימוש עד שבוע.- כדי לשפוך את הג'ל, במקום מערבל שיפוע על צלחת מערמת מוגבה על מנת להבטיח כי ג'ל יזרום על ידי כוח הכבידה לתוך החדר ג'ל מוכן.
- ממלאים את החדר outflow של מערבל שיפוע עם 4.77 / 25 מ"ל (מיני / מקסי) של הפתרון הכבד (עם ריכוז גבוה יותר של AAB).
- בעדינות לפתוח את הזין להפסיק את הקשר בין החדר הכבד האור לאפשר טיפה של פתרון לעבור לצד השני.
הערה: זה דוחף בועות אוויר מן הצינור המחבר ואת הזין להפסיק, אשר ימנע זרימה בין שני החדרים. זה לא יכול להיעשות אם שני הצדדים כבר מלאים, כי הלחץ שווה ימנע את הבועה לעבור. - ממלאים את החדר השני של מערבל שיפוע עם 4.72 / 25 מ"ל (מיני / מקסי) של הפתרון האור.
- מניחים בר במערב בתא החוצה עם פתרון כבד להתחיל לערבב. השתמש מהירות מערבל בר זה לא גורם מבעבע.
- להוסיף במהירות APS ו TEMED לכל חדר ליזום פילמור.
- פתח את החיבור בין שני החדרים של מערבל שיפוע ולאפשר ערבוב במשך כמה שניות לפני פתיחת החדר יצוא לשפוך את הג'ל.
הערה: כוח הכבידהLl לתרוקן בשני החדרים באופן שווה, ערבוב של אור לתוך הפתרון הכבד יהיה לאט להקטין את הצפיפות acrylamide מלמטה עד החלק העליון של הג'ל. השתמש בתוכן כולו כי הוא מערבל שיפוע לשפוך את הג'ל.- בסוף, בזהירות הר מסרק, עם הבארות בתוך הג 'ל, כדי למנוע בועות שכבת ערבוב.
- מיד לשטוף את מערבל שיפוע עם אתנול לשטוף את כל הג'ל. יש לשטוף במים ולשפוך את הג'ל השני. בואו ג 'לים לפזר (בדרך כלל פחות מ 20 דקות נדרש מיני ג'לים).
- כדי להפעיל את ג 'לים, הר אותם לתוך מהדק הרכבה אלקטרודה ולמלא את החדר / החדר העליון עם CN או כחול בהיר BN cathode חיץ. המתן כמה דקות כדי לבדוק דליפות לפני הוספת חיץ באנודה לתא החיצוני / התחתון.
- בעדינות לשלוף היטב מסרקים לשטוף את הבארות עם חיץ קטודה באמצעות מזרק או פיפטה.
- הפעל את הג'לים בחדר קר (4 מעלות צלזיוס) או ארוז לחלוטין בקרח.
- עבור CN mini-PAGE, השתמש 100 V עבור השעה הראשונה ו 200 V עד סיים, בדרך כלל נוסף 1-1.5 ח. לחלופין, הפעל את CN-mini PAGE ב 30-40 V למשך הלילה.
הערה: ההתמקדות כאן היא על מורכבות חלבון מולקולרית גבוהה, כך מתחמי חלבון עם משקל מולקולרי של פחות מ 140 kDa ייגמר של הג'ל. זמני ריצה קצרים יותר עבור אלקטרופורזה ניתן להשתמש כדי לשמור על מתחמי משקל נמוך מולקולרי. - עבור BN maxi-PAGE, השתמש 100 V ולהפעיל את הג'לים לילה (כ -18 שעות).
הערה: הנוכחי יהיה נמוך מאוד (<15 mA), ולכן ספק כוח שיכול להתמודד עם תנאים אלה נדרשת. בשלב זה, ג 'ל ניתן להשתמש IGA או immunoblotting. במקרים מסוימים, להקות או נתיבים ניתן לחתוך מתוך ג'לים באמצעות סכין גילוח על צלחת זכוכית עבור electroelution.
- עבור CN mini-PAGE, השתמש 100 V עבור השעה הראשונה ו 200 V עד סיים, בדרך כלל נוסף 1-1.5 ח. לחלופין, הפעל את CN-mini PAGE ב 30-40 V למשך הלילה.
- הכנת דוגמאות
הערה: יש לחילוץ מלקטורי סופר-קומפלקסים של המיטוכונדריהקרום מיטוכונדריאלי פנימי. כדי לשמור על supercomplexes המיטוכונדריה, להשתמש או מיטוכונדריה מבודדים טרי או דגימות כי הוקפאו והפשר רק פעם אחת. החישובים / כרכים להלן ניתנים מיני ג'ל (היטב של מסרק היטב 10-ב ג'ל 1.5 מ"מ עובי מחזיק עד 35-40 μL) ו maxi- ג'לים (היטב מסרק 15-היטב מחזיקה עד 200 μL). בנוסף, שמור aliquot של כל מדגם (בדרך כלל 10 μL), כדי להיות מופעל על ג'ל SDS denaturing לאיתור של ערוץ אניון תלוי מתח (VDAC), כבקרה טוען.- מניחים את הכמות המתאימה ( למשל, 10-50 מיקרוגרם של חלבון מיני ג'ל ו 50-200 מיקרוגרם עבור מקסי ג'ל) של המיטוכונדריה מבודד או homogenate רקמות microtubes ו צנטריפוגות ב XG 17,000 במשך 10-15 דקות ב 4 ° C.
הערה: שלב זה מסיר חלק מטריקס המיטוכונדריה מסיסים ו / או חלבונים cytosolic. - לשאוב ולזנוח supernatant ולהוסיף חיץ החילוץ לסכום הרצויכדי לטעון על הג'ל. בעדינות resuspend המשקע על הקרח. אם תרצה, להוסיף תערובת מעכב פרוטאז כללי בשלב זה.
הערה: בהתבסס על הציוד המשמש כאן, 30 μL שימש מיני ג'ל ו 100 μL עבור מקסי ג'ל, הגבלת יחס חלבון / חיץ לא יותר מ 2 מיקרוגרם של חלבון ל 1 μL של חיץ. - הוסף חומר ניקוי ( למשל, 2 מיקרוגרם של maltoside lauryl / 1 מיקרוגרם של חלבון, לראות את תוצאות נציג ודיון לקבלת מידע נוסף).
הערה: בדרך כלל, lauryl maltoside משמש, אבל digitonin עשוי לשמש גם. - דגירה על קרח במשך 20 דקות. מערבבים בעדינות בהתחלה ומדי פעם במהלך הדגירה על ידי triturating ו / או agitating את הצינור.
- צנטריפוגה ב XG 17,000 במשך 10 דקות על 4 מעלות צלזיוס כדי להסיר כל שברים רקמות קרום.
- מעבירים את supernatant לצינור חדש. עבור דגימות CN, להוסיף 1 μL של LB עבור כל 10 μL של נפח המדגם; את הנפח הכולל של המדגם צריך להיות App40 μL בערך מיני ג'ל ו 130 μL עבור מקסי ג'ל. עבור דגימות BN, הוסף Coomassie לדגימות כך יחס של צבע על חומר ניקוי הוא 1: 4 (w / w).
- טען 30 ו 120 μL של דגימות לתוך הבארות של מיני או מקסי ג'ל, בהתאמה. השתמש 10 μL הנותרים מדגם זה עבור ג'ל SDS denaturing לאיתור VDAC כמו בקרת טעינה.
- כדי להכין את סמנים משקל מולקולרי, להמיס 1 בקבוקון של תערובת גבוהה משקל מולקולרי משקל כיול (ראה טבלה של חומרים לקבלת מידע נוסף) ב μL 60 של חיץ BN / CN ג'ל ולהוסיף 120 μL של H 2 0 ו 20 μL של LB. טען 15 μL לכל נתיב.
- הפעל את הג'לים כפי שמתואר בשלב 1.2.9.2.
- מניחים את הכמות המתאימה ( למשל, 10-50 מיקרוגרם של חלבון מיני ג'ל ו 50-200 מיקרוגרם עבור מקסי ג'ל) של המיטוכונדריה מבודד או homogenate רקמות microtubes ו צנטריפוגות ב XG 17,000 במשך 10-15 דקות ב 4 ° C.
2. ב-מבחני ג'ל עבור Cx-I ו- Cx-V
הערה: מבחני מבוצעים בטמפרטורת החדר. צלם תמונות, סריקות או תמונות של להקות מתפתחות עבור תיעוד. (חשוב) חלבונים לא יכול להיות מועבר ontO nitrocellulose ממברנות לאחר השלמת IGA.
- CX-I assay
- הכנה.
- הכן חיץ assay של 5 מ"מ טריס ב H 2 O, עם pH של 7.4; החנות בטמפרטורת החדר.
- ממיסים 10 מ"ג של NADH ב 1 מ"ל של חיץ assay. חנות aliquots של μL 100 ב -20 מעלות צלזיוס עד לשימוש; להימנע מקפיא והפשרה.
- שוקלים 25 מ"ג של nitroblue tetrazolium לתוך microtube.
- הכן את מקבע על ידי דילול 5 מ"ל של חומצה אצטית ב 95 מ"ל של H 2 O; החנות בטמפרטורת החדר.
- ביצוע assay.
- שלב 10 מ"ל של חיץ assay עם 25 מ"ג של nitroblue tetrazolium (ריכוז סופי: 2.5 מ"ג / מ"ל) ו 100 μL של 10 מ"ג / מ"ל NADH (0.1 מ"ג / מ"ל). הוסף את זה ג'ל כולו, נתיב, או תחום עניין הוסרו מן ג'ל CN.
הערה: זה יכול להיעשות בתוך פלסטיק ברור או מיכל זכוכית. שים לב assay זה לא יכול להתבצע לאחר BN PAGE. - בצע את הפיתוח של להקות כחולות לאחר תסיסה עדינה (נדנדה) במשך 3 דקות.
- תקן את הג'ל 10 - 20 מ"ל של תמיסת חומצה אצטית או לשטוף ב 5 מ"מ טריס, pH 7.4 כדי לעצור את התגובה. לצלם תיעוד (ראה טבלה של חומרים).
- שלב 10 מ"ל של חיץ assay עם 25 מ"ג של nitroblue tetrazolium (ריכוז סופי: 2.5 מ"ג / מ"ל) ו 100 μL של 10 מ"ג / מ"ל NADH (0.1 מ"ג / מ"ל). הוסף את זה ג'ל כולו, נתיב, או תחום עניין הוסרו מן ג'ל CN.
- הכנה.
- Assay Cx-V
הערה: assay Cx-V צריך להיעשות באמצעות CN או BN כפולים ג'ל, שבו אחד מודגרת עם 5 מיקרוגרם / מ"ל oligomycin (מעכב Cx-V) כדי להדגים פעילות Cx-V עצמאית.- הכנה.
- הכן חיץ assay עם 35 מ"מ טריס ו 270 מ"מ גליצין; להתאים את ה- pH ל 8.3 בטמפרטורת החדר. חנות למאגר קפוא ב 50 מ"ל aliquots, אבל לבדוק את ה- pH לאחר הקפאה להפשיר.
- הכן 1 M MSOSO 4 ב H 2 O; חנות ב 4 ° C עד לשימוש.
- לשקול 27.28 מ"ג של Pb (NO 3 ) 2 לתוך microtube.
- לשקול 60 מ"ג של ATP לתוך microtube.
- ממיסים 1 מ"ג של oליגומיצין ב 1 מ"ל של אתנול. חנות ב -20 מעלות צלזיוס עד לשימוש.
- הכן מקבע על ידי ערבוב 50 מ"ל של מתנול עם 50 מ"ל של H 2 O; החנות בטמפרטורת החדר.
- ביצוע assay.
- דגירה ג'ל, נתיב, או אזור עניין של BN או ג'ל CN במשך 2 שעות עם תסיסה עדינה (נדנדה) ב 10-20 מ"ל של חיץ assay ± 5 מיקרוגרם / מ"ל oligomycin (50-100 μL של 1 מ"ג / מ"ל באתנול) בטמפרטורת החדר.
- לאחר הדגירה, להחליף את המאגר עם 14 מ"ל של חיץ assay טרי להוסיף, על מנת, 190 μL של 1 M MSOSO 4 (14 מ"מ), 27.28 מ"ג של Pb (NO 3 ) 2 (5 מ"מ), 60 מ"ג של ATP 8 מ"מ), ו 75 μL של אוליגומיצין (במידת הצורך).
- דגירה עם תסיסה עדינה (נדנדה) ולצפות משקע לבן, כמו להקות על oligomycin שטופלו ג'לים ייתן שאינם CX-V תלוי הלהקות.
הערה: המראה של המשקע עשוי להימשך מספר שעות. - תקן את הג'ל ב- methanol-( למשל, 50% מתנול), כי פתרונות חומצי יהיה להמיס את המשקע להוביל. צלם את התוצאות.
הערה: משקע להוביל אינו מפריע מכתים של ג 'ל קומסי.
- הכנה.
3. העברת חלבון ל Nitrocellulose או Polyvinylidene Difluoride (PVDF) ממברנות
- הכן מאגר חיץ של 25 מ"מ טריס ו 200 מ"מ גליצין. להתאים את ה- pH ל 8.3 ולהוסיף 0.0005 גרם / L SDS ו 200 mL / L מתנול. חנות בטמפרטורת החדר.
- חותכים nitrocellulose או קרום PVDF (גודל הנקבוביות: 0.45 מיקרומטר) עם סכין גילוח או מספריים לגודל מעט גדול יותר מזה של הג'ל.
הערה: ניטרוסלולוזה ממברנות לאפשר Ponceau S מכתים כדי להעריך את טעינת חלבון, בעוד ממברנות PVDF תשואה יותר להקות מוגדר בחדות.
- חותכים nitrocellulose או קרום PVDF (גודל הנקבוביות: 0.45 מיקרומטר) עם סכין גילוח או מספריים לגודל מעט גדול יותר מזה של הג'ל.
- פרוטוקול.
- משרים את קרום nitrocellulose, נייר הסינון, ואת sponges עבורלא לפחות 10 דקות במאגר ההעברה. מניחים את קרום PVDF ב מתנול 100% עבור 15 s או על פי המלצת היצרן לפני הצבתו במאגר ההעברה. מניחים את קלטת פתוחה של ערכת ההעברה לתוך קערה שטוחה עם חיץ העברה.
- מניחים את ספוג 1-2 שכבות של נייר סינון בצד האחורי של הקלטת. הסר את הבועות.
- מניחים את הג'ל על נייר הסינון. ציין את הכיוון של ג'ל על ידי גזירת פינה של ג'ל ו / או את הממברנה.
- מניחים את הממברנה על גבי הג'ל. הסר את כל הבועות.
- מניחים נייר סינון וספוג על גבי הממברנה. הסר את כל הבועות בסנדוויץ 'זה.
- סגרו את הקלטת והכניסו אותה לתוך מחזיק הקלטת של ערכת ההעברה.
- מעבירים את החלבונים ב 25 V בערך 12-18 שעות.
4. Immunoblotting
- הכנה.
- הכן כתם פונצ'ו (500 מ"ל) על ידי הוספת 25 מ"לשל חומצה אצטית ו 0.5 גרם של Ponceau S ל 475 מ"ל של H 2 O; החנות בטמפרטורת החדר (ניתן לעשות בה שימוש חוזר).
- הכן טריס שנאגרו מלוחים (TBS) עם 200 מ"מ NaCl, 25 מ"מ טריס Base, ו 2.7 מ"מ KCl. להתאים את ה- pH ל 8.0 ו לאחסן בטמפרטורת החדר.
- הכן TBS-tween (TBST) על ידי הוספת 0.5 מ"ל / L Tween 20 כדי TBS; החנות בטמפרטורת החדר.
- הכן מוצקים חלב / TBST ידי המסת 5 גרם של מוצקים חלב ב 100 מ"ל של TBST. חנות ב 4 ° C ולהשתמש בתוך 3 ימים.
- הכן BSA / TBST ידי המסת 3 גרם של אלבומין בסרום שור (BSA, חלק V) ב 100 מ"ל של TBST. חנות ב 4 ° C ולהשתמש בתוך 3 ימים.
- פרוטוקול.
- כאשר ההעברה הסתיימה, למקם את הממברנה לתוך פתרון Ponceau S לדמיין את כל החלבונים שהועברו. תווית את המיקום של סמנים על הממברנה עם עיפרון ולתעד את הממברנה פונצ'ו- S מוכתם על ידי צילום או לסרוק.
- לשטוף את הממברנה 3 פעמים במשך 10 דקות כל wiTBS תחת תסיסה עדינה.
- לחסום את הממברנה עם מוצקים חלב / TBST עבור 1-2 שעות בטמפרטורת החדר או לילה בחדר קר עם תסיסה עדינה.
- לשטוף את הממברנה במשך 10 דקות עם TBST תחת תסיסה עדינה.
- דגירה עם נוגדן ראשוני בן לילה בחדר קר תחת תסיסה עדינה. לדלל את הנוגדנים ( למשל, 1: 1000 עבור אנטי ATP5A ו - NDUFB6) ב BSA / TBST.
הערה: נוגדנים ביותר לתת איתות טוב יותר על ממברנות מ ילידים ג'ל כאשר מודגרת בן לילה. - לשטוף את הממברנה במשך 10 דקות עם TBST תחת תסיסה עדינה.
- דגירה עם נוגדן משני לפחות 60 דקות בטמפרטורת החדר uner עדין תסיסה. לדלל את הנוגדנים (1: 5,000-1: 50,000) ב מוצקים חלב / TBST.
- לשטוף את הממברנה 3 פעמים במשך 10 דקות בטמפרטורת החדר עם TBST תסיסה עדינה.
- במהלך הכביסה האחרונה, להכין את המצע chemoluminesencence משופר (ECL) על פי הוראות של manufaCturer.
- דגירה את הממברנה עם מצע ECL באמצעות הוראות המסופקים על ידי היצרן.
- לזהות את האות על הסרט באמצעות הוראות שסופקו על ידי היצרן של המצע ECL.
5. Electroelution
- הכנה.
- הכן חיץ elution של הטריסין 25 מ"מ, 3.75 mM imidazole (pH 7.0 ב 4 מעלות צלזיוס), ו 5 mM 6-aminohexanoic חומצה.
הערה: ללבוש כפפות בכל עת בעת הטיפול electroeluter ואת כובעי ממברנה כדי למנוע זיהום עם חלבונים חיצוניים.
- הכן חיץ elution של הטריסין 25 מ"מ, 3.75 mM imidazole (pH 7.0 ב 4 מעלות צלזיוס), ו 5 mM 6-aminohexanoic חומצה.
- ביום לפני השימוש electroeluter עבור electroelution יליד, בצע את הפעולות הבאות:
- משרים את כובעי הממברנה (לחתוך את: 3.5 kDa) ב חיץ elution עבור 1 שעה ב 60 ° C. מעבירים את המכסים למאגר אלוטיון טריים ולספוג אותם במשך 12 שעות או יותר במקרר.
הערה: חתך משקל מולקולרי של 3.5 kDa מונע את ההפסד של p קטןרוטינים שעשויים להתנתק בקלות ממכלול החלבון המעניין. - שטפו את מודול electroeluter, צינורות זכוכית, טנק, ומכסה ביסודיות עם אתנול. יש לשטוף במים ולתת לציוד יבש.
- משרים את כובעי הממברנה (לחתוך את: 3.5 kDa) ב חיץ elution עבור 1 שעה ב 60 ° C. מעבירים את המכסים למאגר אלוטיון טריים ולספוג אותם במשך 12 שעות או יותר במקרר.
- ביום electroelution יליד, בצע את הפעולות הבאות.
- מניחים frit בתחתית (מקפיא) של כל צינור זכוכית לשמש. אם יש צורך, במקום צינור זכוכית במאגר elution ולדחוף את frit מבפנים אל החלק התחתון של הצינור.
- דחוף את צינור הזכוכית עם frit לתוך המודול של electroeluter. רטוב את grommet עם חיץ elution ולהחליק את צינור זכוכית למקום. ודא כי צמרות של צינורות זכוכית הם אפילו עם grommet.
- סגור את grommets ריקים עם פקקים.
- מניחים כובע רטוב רטוב בחלק התחתון של מתאם הסיליקון ולמלא את המתאם עם חיץ elution. לאט לאט פיפטה המאגר במתאם למעלה ולמטה כדי להסיר בועות אוויר סביב קרום דיאליזה.
- החלק את המתאם המלא-חיץ לתחתית צינור הזכוכית. הסר את כל הבועות המופיעות על frit בתוך הצינור זכוכית.
- ממלאים כל צינור זכוכית עם חיץ elution.
- מניחים את להקות נכרת של דף BN לתוך צינורות זכוכית (ראה צעד 1.2.9.3). חותכים חתיכות גדולות לחתיכות קטנות יותר. ודא כי גובה מילוי בתוך צינור זכוכית הוא סביב 1 ס"מ.
- מניחים את כל המודול לתוך הטנק.
- הוסף על 600 מ"ל של חיץ elution קר הטנק. ודא כי מתאם סיליקון כובעים נמצאים במאגר כדי למנוע בועות בקרום דיאליזה.
- מניחים בסיר במערב בתחתית הטנק.
הערה: ערבוב ימנע בועות מלהידבק לתחתית הממברנה הדיאליזה. - Elute חלבונים במשך 4 שעות ב 350 V בחדר קר.
- לאחר השלמת האלוטיון, הסר את מודול electroeluter מן הטנק חיץ ומכניסים אותו לכיור או קערה.
- אם נעשה שימוש בפקק, הסר אותו לגרורבתא העליון המאגר. אחרת, להשתמש פיפטה גדולה להסיר את המאגר.
- הסר את המאגר מכל צינור זכוכית וזורקים. ודא כי מתאם הסיליקון נשאר במקום וכי הנוזל מתחת לפריט אינו מוטרד או מזועזע.
- בזהירות להסיר את מתאם הסיליקון, יחד עם מכסה הממברנה מלמטה של צינור זכוכית. פיפטה את התוכן (כ 400 μL) של מכסה סיליקון לתוך microtube. עם עוד 200 μL של חיץ elution, לשטוף את מכסה הסיליקון ולהוסיף microtube. חזור על כל צינורות זכוכית.
- כמו בקבוקים ממברנה ניתן לעשות שימוש חוזר, לשמר את המכסות קרום ידי הצבת אותם למאגר elution המכיל 0.5 מ"ג / מ"ל כספית נתרן. קירור אותם.
הערה: eluate יש ריכוז חלבון נמוך יכול להיות מרוכז באמצעות מסנן צנטריפוגלי התקנים.
תוצאות
כדי להמחיש supercomplexes המיטוכונדריה, המיטוכונדריה מבודדים טרי מן העכברים היו בשימוש 17 , 18 . Supercomplexes מיטוכונדריאלי רגישים מחזורי חוזרות ונשנות של הקפאה והפשרה, המוביל להתפוררות שלהם, אם כי זה עשוי להיות נסבל עבור כמה חוקרים. אם הקפאה יש צורך לאחסון, כדי להבטיח את התוצאות הטובות ביותר, דגימות לא צריך לעבור יותר ממחזור אחד של הקפאה להפשיר.
כדי לדמיין את מתחמי ETC המיטוכונדריה עם BN PAGE, 100 מיקרוגרם של חלבון מן המיטוכונדריה הלב מבודדים נטענו על ג'ל 4-10% ( איור 1 א ). כתם הקומאסי במאגר הטעינה והקתודה מספיק כדי לתייג את מתחמי החלבון במהלך הריצה. Supercomplexes מופיעים לאחר הגדלת הניגודיות דיגיטלית (לא מוצג). עבור CN PAGE, שתי דגימות של 20 מיקרוגרם oחלבון מן המיטוכונדריה מבודד נטענו על ג'ל 3 - 8% CN ו מופרדים ( איור 1 ב ). דף CN היה מוכתם קומסי ו destained לדמיין את קומפלקסים חלבונים. לאחר הגדלת הניגודיות דיגיטלית, כמה קומפלקסים חלבונים עם משקל מולקולרי גדול יותר מונומר של Cx-I הופיע ( איור 1B , ימין). ריכוזי AAB בשימוש מותר supercomplexes הגדול ביותר פשוט להיכנס ג'ל מן הבאר. עם זאת, ג'ל מסתיים עם שיפוע של פחות מ 3% AAB אינו יציב מספיק כדי לתפעל עבור העברה או על הוצאת הלהקה או הנתיב. בנוסף, ריכוז נמוך של AAB בחלקים העליונים של ג'ל CN 3-8% שומרת על ניידות של קומפלקסים חלבונים, אשר חשוב אם שוקלים electroution יליד 19 .
מונומרים ו supercomplexes של Cx-I ו מונומרים, dimers, ו supercomplexes של CXV הם פעילים enzymatically והוא יכול להיות דמיינו IGA ( איור 1C -F ). מבחני מראים כי, במיטוכונדריה הלב מבודדים, Cx-I ו CX-V נמצאים קומפלקסים חלבונים גדולים יותר מאשר מונומרים בהתאמה. ב assay IGA עבור Cx-I, NADH הוא מתחמצן ואלקטרונים מועברים כדי להפחית titrazolium nitroblue. התוצאה היא בצבע כחול מקומי על המשקל המולקולרי של מונומרים Cx-I ואת cx-I המכילים respirasomes / supercomplexes ( איור 1C ). הפעילות של Cx-V מוערך מיכולת של יחידת משנה F 1 כדי hydrolyze ATP וניתן לעשות זאת באמצעות CN או BN ג'ל ( איור 1D -F ). ADP שנוצר מתגובה זו אינטראקציה עם עופרת ותוצאות משקע לבן ברמה של מונומרים Cx-V, dimers, synthasomes, subcomplexes (סביר להניח את החלק 1 F לא מפורקים של Cx-V). שים לב כי oligomycin מבטלת את LAbeling של להקות אלה, המאשר כי הם מכילים CX-V ( איור 1E ).
עבור כל הניסויים המתוארים כאן, חומר הניקוי zwitterionic, lauryl maltoside, שימש בריכוז של 2 מיקרוגרם / 1 מיקרוגרם של חלבון, שהוא הריכוז הגבוה ביותר האפשרי אשר משמר את supercomplexes תוך מתן תוצאות עקביות לשחזור ( איור 1F ). עם זאת, האפקטיביות של lauryl maltoside תלוי במספר הרבה, תנאי אחסון, וגיל. הריכוז המדויק המשמש במעבדה אחת אינו בהכרח זהה לזה המדווח בכתבי יד. הריכוז הנכון של חומר ניקוי יהיה solubilize את הממברנות אבל לשמור על מתחמי supercomplexes שלם חייב להיות נקבע על ידי שימוש במגוון ריכוזים של maltoside lauryl ( איור 1F ). עבור CN PAGE, נפח מדגם הכולל של 40 μL לכל טוב היה להכיןEd כאן, וכתוצאה מכך יחס חלבון / דטרגנט של 1 מיקרוגרם / 2 מיקרוגרם או יחס דטרגנט / חיץ של 1 מיקרוגרם / 1 μL (שווה ל 1.9 מ"מ). מ 40 μL, 30 μL הוחל לכל טוב של ג'ל מיני; הנותרים שימש aliquot לזיהוי של VDAC, בקרת הטעינה ( איור 2 ד ).
עבור immunoblotting, CN הוא העדיף BN PAGE כי החלבונים אינם נטענים עם Coomassie, אשר עשוי להפריע גילוי על ידי נוגדנים. איור 2 מציג את זיהוי supercomplexes המכילים את Cx-I ו- Cx-V חלבונים NDUFB6 ו ATP5A מבודדים, כבד, המוח המיטוכונדריה. Ponceau S תיוג לאחר ההעברה ולפני immunoblotting ניתן להשתמש כדי לסמן את סמנים משקל מולקולרי כדי לשלוט על טעינת חלבון ( איור 2 א ). זה יהיה לדמיין את מונומרים של קומפלקסים חלבונים של ETC על ניטרוסלולקרום Ose, אבל Ponceau S תיוג לא תמיד מספיק עבור הדמיה של supercomplexes המיטוכונדריה ( איור 2 א ), אשר ניתן להשיג על ידי immunoblotting.
Cx-I לא להרכיב דימרים ו tetramers, כשלעצמה, אבל צורות גבוה יותר ויותר מולקולרית משקל supercomplexes עם Cx-III ו CX-IV 14 , 20 , 21 . הנה, באמצעות נוגדנים נגד NDUFB6 מראה כי המדגם מהלב הכיל מונומר Cx-I ו supercomplexes משקל מולקולרי גבוהה (להקות העליון) כי המיטוכונדריה מהכבד או המוח ( איור 2 ב ). כמות אמצע טווח supercomasome supercomplexes היה גם הרבה יותר גבוה בלב מאשר ברקמות אחרות ( איור 2 ב ).
שימוש נוגדן אנטי ATP5A,מונומרים של Cx-V הם לזיהוי במיטוכונדריה מכל הרקמות, בעוד דפוס מובהק של להקות נציג של דימרס (D) ו supercomplexes גדול (SC), אשר נראים בבירור במיטוכונדריה הלב, אינם בולטים בכבד ואת המיטוכונדריה המוח ( איור 2 ג ). Overexposure (1 דקות לעומת 20) של immunoblot מציג כמה Ccom-V המכילים supercomplexes, אשר יכול לייצג tetramers ו synthasomes ( איור 2 ג ). דפוסים אלה של Cx-V המכילים קומפלקסים חלבונים בלב, הכבד, ואת המיטוכונדריה במוח מראים הבדלים שעשויים להיות רקמות ספציפיות עדיין לא נחקרו.
חלבון טוען של כתמים אלה יכולים להיות מלווה מכתים S Ponceau ו VDAC זיהוי של aliquot הנ"ל על ידי SDS PAGE, כפי שמוצג באיור 2D .
לא כל אנטיבומתים מתאימים כדי לזהות חלבון בתוך מבנה quaternary או שלישוני של קומפלקס חלבון לאחר הילידים PAGE. כדי להתגבר על בעיה זו, נתיבים שלמים וחלקיים מן היל ג'ל יכול להיות מותקן על ג'ל denaturing עבור מימד השני (2D ג'לים, ראה התייחסות 13 להפגנה). אלקטרופורזה דו-ממדית היא כלי רב ערך להדמיה של חלבונים במתחם supramolecular. עם זאת, כפי שמוצג באיור 2 , supercomplexes נוכחים כמויות משתנה, ואת האות של חלבונים בודדים מן supercomplexes עשוי להיות קשה לדמיין את הממד השני, denaturing. כדי להתגבר על בעיה זו, electroelution של קומפלקסים חלבונים מן הילידים יליד שימש כאן. זה מבודד להקות supercomplex מסלולים מרובים להניב חומר נוסף לצורך מחקר נוסף.
בעת שימוש בחשמל, רק הלהקה של עניין, אשר זוהתה על ידי IGA ו / או דמיינו בדף BN, הוא excedJ J החלבונים מן פיסת ג'ל זו הם מטוהרים נוספת על ידי elution מן הג'ל. איור 3 א מראה נתיב של BN PAGE שממנו להקות המייצג מונומר היו נכרת עבור electroelution. כדי להעריך את פעילות Cx-V של מונומר לאחר electroelution, eluate הוחל על CN השני. Eluate של מונומר עדיין מכיל אנזימטית פעיל Cx-V, אבל subcomplexes מופיעים גם ( איור 3 ב ). מכתים כסף של eluate לאחר יליד CN PAGE ( איור 3 ג ) או denaturing SDS PAGE ( איור 3D ) מציין את נוכחותם של חלבונים ב eluate, ו immunoblotting נגד ATP5A מציין את נוכחותו של CX-V בשתי דוגמאות ( איור 3 ).
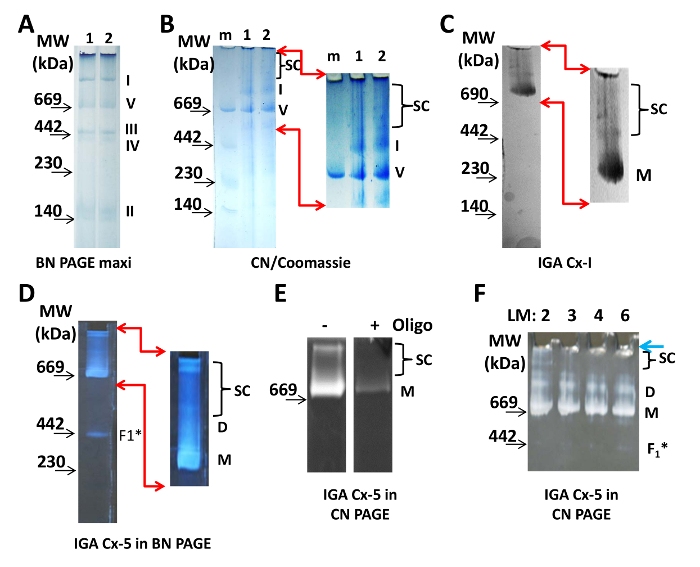
איור 1: הדמיה של מיטוך- סופר קומפלקסים. ( א ) שני נתיבים של 4-10% BN maxi- ג'ל, עם דגימות של המיטוכונדריה הלב מבודדים. Aliquots של המדגם אותו היו לרוץ בשני נתיבים, ב 100 מיקרוגרם של חלבון לכל טוב. מונומרים של קומפלקסים חלבונים אני, II, III, IV, ו- V של ETC נראים בבירור מסומנים בצד ימין של הג'ל. ( ב ) שתי דגימות של המיטוכונדריה הלב (1 ו 2, 20 מיקרוגרם של חלבון / נתיב) הופרדו על דף CN ו דמיינו ידי מכתים קומסי. SC מציין את המיקום של supercomplexes לאחר הגדלה ושיפור דיגיטלי של החלק העליון של הג'ל (האזור מסומן על ידי חיצים אדומים). ( ג ) 20 מיקרוגרם של חלבון המיטוכונדריה הופרדו על דף CN 3-8% ו עובדו עבור I-I Cx. תמונות מוגדלות ומשופרת דיגיטלית מדגימות להקות של מוצר תגובה Cx-I. ( D ) 20 מיקרוגרם של חלבון המיטוכונדריה הופרדו על דף BN 3-8% ומעובדים עבור Cx-V IGA. מגניפי Ed ו תמונות משופרת דיגיטלית להדגים להקות של מוצר תגובה Cx-V. ( E ) 50 מיקרוגרם של חלבון המיטוכונדריה הופרדו על דף CN 5-15% ועובדו CGA-V IGA ללא (-) עם (+) 5 מיקרוגרם / מ"ל אוליגומיצין (אוליגו). ( F ) חלבון מיטוכונדריאלי (20 מיקרוגרם / נתיב) היה solubilized עם 2 - 6 מיקרוגרם של maltoside lauryl / 1 מיקרוגרם של חלבון, כפי שצוין בחלק העליון של הג'ל, מופרדים על ג'ל CN 3-8% ואחריו Cx- אשר. כל התמונות צולמו באמצעות שולחן קל ( A - C ) או משטח שחור ( D - F ). מפרטים המצלמה נמצאים בטבלה של חומרים. המיקום של סמנים משקל מולקולרי (MW) מסומנים בצד שמאל של כל לוחות. קיצורים: D = dimers; F = 1 = תת-גומחה של Cx-V; LM = lauryl maltoside; M = סמן משקל מולקולרי; M = מונומרים; SC = supercomplexes.G1large.jpg "target =" _ blank "> אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
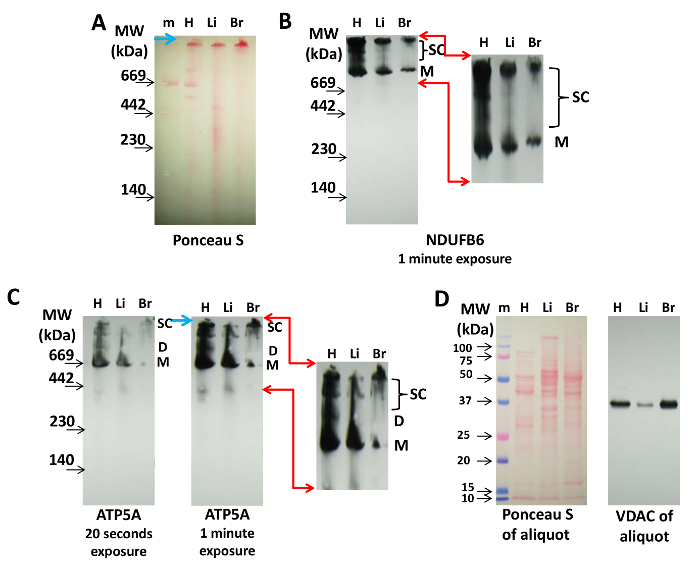
איור 2: זיהוי של Supercomplexes מיטוכונדריאלי ידי Immunoblotting. 20 מיקרוגרם של חלבון מהלב (H), כבד (Li), המוח (B) המיטוכונדריה הופרדו על עמוד CN 3-8% והועברו על קרום nitrocellulose. ( A ) Ponceau S מכתים של הממברנה מציין נוכחות של קומפלקסים חלבונים סמנים משקל מולקולרי (מ '). החץ הכחול מצביע על החלק העליון של הג'ל. ( ב ) Cx-I חלבון, NDUFB6, היה immunolabeled על כתם שמוצג ב (א) (1 דקות זמן חשיפה). ( C ) Cx-V היה דמיינו עם נוגדן אנטי ATP5A (20 s ו 1 דקות חשיפה, כפי שצוין). החצים האדומים (B) ו- (C) מציינים את השטח המוגדל ומשופר דיגיטלית עבור visuaLis של Cx-I ו- Cx-V המכילים supercomplexes, ואת החץ הכחול מצביע על החלק העליון של הג'ל. ( D ) Ponceau S ו immunolabeling של aliquot VDAC של כל תמצית המשמשים (A), (B), ו (ג), אשר הופרדו על ידי SDS PAGE והועברו ניטרוצלולוזה. קיצורים: M = מונומרים של Cx-I או Cx-V, D = dimers של Cx-V, SC = supercomplexes המכילים Cx-I או Cx-V. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 3: Electroelution של CX-V. ( א ) BN עמוד של מדגם המיטוכונדריה. הלהקה מתאגרף מייצג את מונומר של Cx-V כי היה נכרת electroeluted. ( ב ) eluate היה נתון CN דף, ולאחר מכן IGA עבור Cx-V מדגים מונומרים (ז)ו subcomplexes המכיל F 1 של Cx-V. ( ג ) מכתים כסף של דף CN של eluate מדגים מונומרים (ז). ( D ) מכתים כסף (פאנל שמאל) ו immunoblot עבור ATP5A (פאנל ימין) של dodecyl גופרתי denaturing (SDS) PAGE של eluate מציין את נוכחותו של Cx-V. עבור SDS PAGE, עיין בפרוטוקולים שפורסמו במקום אחר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Discussion
A פונקציונלי ETC הוא הכרחי עבור הדור המיטוכונדריה ATP. קומפלקסים של ETC מסוגלים ליצור שני סוגים של supercomplexes: respirasomes (Cx-I, IIII, ו- IV) 1 ואת synthasomes (Cx-V) 2 . הרכבה של כל מורכבות נדרשת עבור ETC שלם, בעוד הארגון של ETC לתוך supercomplexes נחשב להגביר את יעילות ETC הכוללת 5 , 22 . איך אלה supercomplexes להרכיב ולפרק אינו מובן היטב, אבל הפרוטוקולים המוצגים כאן עשוי לאפשר הבנה טובה יותר של תהליכים אלה.
האתגר העיקרי של לימוד ETC הרכבה הוא בגודל של קומפלקסים חלבונים אלה. לדוגמה, רטיאסומות של המיטוכונדריה עשויות להיות מורכבות מ- Cx-I (בערך 880 kDa) ומולקולה אחת או יותר של Cx-III (460 kDa) ו- CX-IV (200 kDa, פעילה כדימר), וכתוצאה מכך supercomplex עם מולקולרי משקל של כ2,000 kDa. בנוסף, Cx-V יש משקל מולקולרי של כ -600 kDa אבל הוכח להרכיב אל dimers, tetramers, oligomers, וסרטים של dimers 7 , 23 , וכתוצאה מכך supercomplexes עם משקל מולקולרי של לפחות 2,000 kDa. בהתחשב בגודל העצום של supercomplexes אלה, כמה גישות הקשורות באופן מסורתי שימשו כדי לזהות ולאפיין אלה supercomplexes, על ידי המעבדה הזאת על ידי אחרים 8 , 14 , 24 .
עבודה זו הוכיחה את הטכניקה של ג 'ל הילידים PAGE, שבו מתחמי חלבון פעיל מופקים בעדינות מן הממברנה המיטוכונדריאלי באמצעות דטרגנטים מתונים. קומפלקסים נודדים בג'לים בעיקר בשל הגודל שלהם ואת המטען המהותי (CN PAGE) או בשל גודל ומטען שלילי של חלבון כחול קשורה Coomassie (BN PAGE). ג'לים אלה יכולים להיות מוכתמים באמצעות Cכחול oomassie ( למשל, ג 'ל CN) או כתם כסף ( למשל, ב BN ו- CN PAGE) לחשוף להקות חלבונים.
לורטיל maltoside שימש הניסויים שהוכיחו כאן כי חומר זה עובד בצורה מהימנה ביותר. לחלופין, digitonin ניתן להשתמש כדי לחלץ קומפלקסים חלבונים 12 . נתונים מן המיטוכונדריה מבודדים מבוגרים, כבדים ומוחות הוצגו כאן, אבל טכניקות אלה בוצעו על homogenates עוברי לב מבוגר 8 . אחרים ביצעו טכניקה זו באמצעות מיטוכונדריה מבודדים מתרבית בתרבית 24 . עם זאת, כאשר משתמשים רקמות homogenates או תאים מתורבת עם תוכן DNA גבוה, זה עשוי להיות שימושי כדי להוסיף nuclease כדי למנוע streaking במהלך אלקטרופורזה 25 .
הפעילות של מתחמי שונים ניתן assayed ישירות בג'ל, כפי שמוצג כאן Cx-I ו- Cx-V, ו טקHniques זמינים גם לבחון את הפעילויות של Cx-II, -III, ו- 12 . עם זאת, ניתוח IGAs אלה חייבים להיעשות בזהירות. ראשית, התגובה האנזימטית יכולה להיות תוצאה של אנזימים שאינם ETC או מכלולים מורכבים שלא הושלמו. לדוגמה, זה שגרתי לבצע את IX Cx-V עם ג'ל מקביל כי כבר טופל עם oligomycin כדי לעכב שלם Cx-V ( איור 3 ). בנוסף, oxidases NADH אחרים עשויים להסביר פעילות Cx-1 בג'ל. אפשר לבצע IGA מקביל בנוכחות מעכב Cx-I, כגון rotenone. עם זאת, באיור 1 , המיטוכונדריה מבודדים שימשו, כך cidoplasmic NADH oxidases לא היו נוכחים; לפיכך, הנתונים מייצגים ככל הנראה CX-I המכיל מונומרים supercomplexes. בנוסף, כימות של תוצאות אלה אפשרי על ידי מדידת עוצמת האות של להקות על צילומים או סריקות. חסרונות לגישה זו כוללים את ההבדלים בין ובתוך ג 'ל, את הניידות של מוצר התגובה, חוסר היכולת לכמת כראוי את המוצר לאורך כל עומק של ג' ל, ואת הפוטנציאל הלא ליניאריות של התגובה 27 . כדי להתגבר על אלה האחרונים, חלקם הציעו להשיג שיעורי תגובות באמצעות תמונות טורי, אבל זה לא נוסה כאן.
חלבון ג 'ל הילידים יכול להיות מועבר גם ממברנות, ואת הרכב החלבון של להקות ניתן לבדוק על ידי immunoblotting (המוצג כאן) או 2 ד PAGE (הפגינו התייחסות 13 ). מונומרים של מתחמי ETC באופן מסורתי זוהו על ידי השפע שלהם ג 'ל הילידים של המיטוכונדריה מבודד, המיקום שלהם בג'ל, ואת המיקום שלהם יחסית חלבון סמן מולקולרי ( איור 1 ). יתר על כן, תיוג של immunoblots הבאים עם נוגדנים ספציפיים עבור יחידות משנה של קומפלקסים שונים מסייע לזהות את המורכב ואת הרכבשל סופר קומפלקסים. לכן, אנטי NDUFB6 ו -AATP5A לזהות מונומרים של supercomplexes המכילים Cx-1 ו CX-V, בהתאמה, כפי שהודגם כאן. נוגדנים ל- Cx-II ל- IV יכולים לשמש לאותה מטרה. במקרים מסוימים, נוגדנים שפועלים היטב בג'ל דנטורינג עשויים שלא לפעול היטב בג'לים מקומיים בשל העובדה שנוגדנים מסוימים הם ספציפיים לחלבון מפוגל או שאפיטופ יכול להיות מסוכך על ידי חלבונים אחרים במתחם הילידים.
הקביעה המדויקת של המשקל המולקולרי של supercomplexes אלה היא קשה, שכן רוב סמנים משקל מולקולרי זמין מתחת לגודל של מונומרים Cx-V. ההגירה של קומפלקסים חלבונים בג'ל הילידים תלוי בגודל, מטען פנימי, דטרגנט בשימוש 28 . בדוגמאות כאן, מונומרים של מתחמי זוהו על בסיס ג 'לים, סמנים, ו immunoblotting. Dimers של Cx-V זוהו על סמך הגירה יחסית לעומת מונומרים של Cx-I ו- V ועל החיסוןסופג. כל דבר אחר מעל מונומרים ו dimers ב ג 'לים, IGAs, ו immunoblots נחשבים supercomplexes.
Immunoblots יליד יכול להיות גם לכמת עבור supercomplexes על ידי ניתוח צפיפות הלהקה באמצעות טכניקות סטנדרטיות. שיטה זו לא הוצגה כאן, אבל פרסום האחרון מדגים את הטכניקה הזו 8 . נורמליזציה של טעינת חלבון יכול להיעשות באמצעות מכתים אדום Ponceau של הנתיב או על ידי שמירת מדגם של תמצית המיטוכונדריה למדוד את הצפיפות של הלהקה VDAC על immunoblot denaturing ( איור 2 א ו D ). יתר על כן, בחינת היחס בין supercomplexes מונומרים באותה אימבלוט היא דרך אחרת לכמת צפיפות הלהקה, אבל יש להיזהר לצלם בזמנים שונים במהלך פיתוח כתם, כך הלהקות אינם חשופים יתר על המידה.
לבסוף, להקות מ ילידים ג'לים יכול להיות electroeluted לייצר purifieד, מתחמי חלבון פעיל שיכול להרכיב מתחמי מסדר גבוה יותר וניתן להשתמש בו למחקרים נוספים על תפקוד מורכב. לדוגמה, מונומרים Cx-V היו בעבר electroeluted מחדש לתוך liposomes כדי להדגים את הפונקציונליות החשמלית 29 . גישה חלופית electroelution יליד הוא elution על ידי דיפוזיה פסיבית לתוך חיץ 16 , אבל זה איטי לעומת electroelution יליד. לבסוף, בעיה גדולה עם electroelution היא שמירה על הפונקציה האנזימטית של מורכבות חלבון electroeluted, כמו המתקן עלול לנתק במהלך הטיהור. לכן, כל assay של פונקציה לאחר בידוד על ידי טכניקה זו היה צריך להיות בדק בקפידה.
על ידי שילוב של פרוטוקולים אלה עם מבחנים אנזימים ומדידות צריכת חמצן, אשר לחקור את הפונקציה של מתחמי ETC הפרט ואת הפעילות של כל 30 ETC,Ods, כגון קריסטלוגרפי 31 ו אלקטרונים מיקרוסקופיים 32 הערכה של המבנה של קומפלקסים supercomplexes, תמונה completer של פעולתו הפנימית של ETC יכול וצץ. אנחנו קרובים יותר להבנה איך מורכבים קומפלקסים, איך האלקטרונים זורמים במורד השרשרת, ואיך פרוטונים נשאבים על פני הממברנה כדי ליצור את שיפוע ולאחר מכן לזרום בחזרה אל המטריצה באמצעות CX-V כדי ליצור ATP. אין ספק, טכניקות אלה יהיה מעודן יותר לספק פרטים נוספים על המבנה, פונקציה, ויסות דינמי של ETC.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מן השותף האמריקאי של איגוד הלב של שותף [12GRNT12060233] ואת חזקה לילדים מרכז המחקר באוניברסיטת רוצ'סטר.
Materials
| Name | Company | Catalog Number | Comments |
| Protean II mini-gel chamber | Biorad | 1658004 | Complete set to pour and run mini-gel electrophoresis |
| Protean XL maxi-gel | Biorad | 1653189 | Complete set to pour and run maxi-gel electrophoresis |
| Gradient maker, Hoefer SG15 | VWR | 95044-704 | Pouring mini-gel gradients |
| Gradient maker, maxi-gel | VWR | GM-100 | Pouring maxi-gel gradients |
| Transfer kit | Biorad | 1703930 | Complete set to wet transfer of proteins onto membranes |
| Electroeluter model 422 | Biorad | 1652976 | Electroelution of proteins from native or SDS PAGES |
| Glass plates | Biorad | 1653308 | Short plates |
| Glass plates | Biorad | 1653312 | Spacer plates |
| Glass plates | Biorad | 1651823 | Inner plates |
| Glass plates | Biorad | 1651824 | Outer Plates |
| Power supply | Biorad | 1645070 | Power supply suitable for native electrophoresis |
| ECL-Western | Thermo Scientific | 32209 | Chemolumniscense substrate |
| SuperSignal-West Dura | Thermo Scientific | 34075 | Enhanced chemolumniscense substrate |
| Film/autoradiography film | GE Health care | 28906845 | Documentation of Western blots |
| Film processor CP1000 | Agfa | NC0872640 | |
| Canon Power Shot 640 | Canon | NA | Taking photos to document gels, membranes and blots. |
| Canon Power Shot 640 Camera hood | Canon | shielding camera for photos being taken on a light table | |
| Acrylamide/bisacrylamide | Biorad | 1610148 | 40% pre-mixed solution |
| Glycine | Sigma | G7403 | |
| SDS (sodium dodecyl sulfate) | Invitrogen | 15525-017 | |
| Tris-base | Sigma | T1503 | Buffer |
| Tricine | Sigma | T0377 | |
| Sodium deoxychelate | Sigma | D66750 | Detergent |
| EDTA | Sigma | E5134 | |
| Sucrose | Sigma | S9378 | |
| MOPS | Sigma | M1254 | Buffer |
| Imidazole | Sigma | I15513 | Buffer |
| Lauryl maltoside | Sigma | D4641 | Detergent |
| Coomassie G250 | Biorad | 161-0406 | |
| Aminohexanoic acid | Sigma | O7260 | |
| Native molecular weight kit | GE Health care | 17-0445-01 | High molecular weight calibraition kit for native electrophoresis. |
| Name | Company | Catalog Number | Comments |
| NADH | Sigma | N4505 | |
| Nitroblue tetrazolium | Sigma | N6639 | |
| Tris HCl | Sigma | T3253 | |
| ATP | Sigma | A2383 | |
| Name | Company | Catalog Number | Comments |
| Lead(II) nitrate (Pb(NO3)2): | Sigma | 228621 | |
| Oligomycin | Sigma | O4876 | |
| Name | Company | Catalog Number | Comments |
| Ponceau S | Sigma | P3504 | |
| anti-ATP5A | Abcam | ab14748 | antibody to ATP synthase subunit ATP5A |
| anti-NDUFB6 | Abcam | ab110244 | antibody to Cx-1 subunit NDUFB6 |
| anti-VDAC | Calbiochem | 529534 | antibody to VDAC |
| ECL HRP linked antibody | GE Health Care | NA931V | secondary antibody to ATP5A, NDUFB6 and VDAC |
| Blocking reagent | Biorad | 170-6404 | |
| BSA | |||
| sodium chloride | Sigma | S9888 | |
| potassium chloride | Sigma | P9541 | |
| EGTA | Sigma | E3889 | |
| Name | Company | Catalog Number | Comments |
| Silver staining Kit | Invitrogen | LC6070 |
References
- Lenaz, G., Genova, M. L. Supramolecular organisation of the mitochondrial respiratory chain: a new challenge for the mechanism and control of oxidative phosphorylation. Adv Exp Med Biol. 748, 107-144 (2012).
- Saks, V., et al. Intracellular Energetic Units regulate metabolism in cardiac cells. J Mol Cell Cardiol. 52 (2), 419-436 (2012).
- Schagger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal Biochem. 217 (2), 220-230 (1994).
- Wittig, I., Schagger, H. Native electrophoretic techniques to identify protein-protein interactions. Proteomics. 9 (23), 5214-5223 (2009).
- Genova, M. L., Lenaz, G. Functional role of mitochondrial respiratory supercomplexes. Biochim Biophys Acta. 1837 (4), 427-443 (2014).
- Hahn, A., et al. Structure of a Complete ATP Synthase Dimer Reveals the Molecular Basis of Inner Mitochondrial Membrane Morphology. Molecular cell. 63 (3), 445-456 (2016).
- Strauss, M., Hofhaus, G., Schroder, R. R., Kuhlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. EMBO J. 27 (7), 1154-1160 (2008).
- Beutner, G., Eliseev, R. A., Porter, G. A. Initiation of electron transport chain activity in the embryonic heart coincides with the activation of mitochondrial complex 1 and the formation of supercomplexes. PloS one. 9 (11), e113330(2014).
- Genova, M. L., Lenaz, G. The Interplay Between Respiratory Supercomplexes and ROS in Aging. Antioxid Redox Signal. 23 (3), 208-238 (2015).
- Rosca, M. G., et al. Cardiac mitochondria in heart failure: decrease in respirasomes and oxidative phosphorylation. Cardiovasc Res. 80 (1), 30-39 (2008).
- Kuter, K., et al. Adaptation within mitochondrial oxidative phosphorylation supercomplexes and membrane viscosity during degeneration of dopaminergic neurons in an animal model of early Parkinson's disease. Biochim Biophys Acta. 1862 (4), 741-753 (2016).
- Wittig, I., Karas, M., Schagger, H. High resolution clear native electrophoresis for in-gel functional assays and fluorescence studies of membrane protein complexes. Mol Cell Proteomics. 6 (7), 1215-1225 (2007).
- Fiala, G. J., Schamel, W. W., Blumenthal, B. Blue native polyacrylamide gel electrophoresis (BN-PAGE) for analysis of multiprotein complexes from cellular lysates. J Vis Exp. (48), (2011).
- Acin-Perez, R., Fernandez-Silva, P., Peleato, M. L., Perez-Martos, A., Enriquez, J. A. Respiratory active mitochondrial supercomplexes. Molecular cell. 32 (4), 529-539 (2008).
- Dudkina, N. V., Eubel, H., Keegstra, W., Boekema, E. J., Braun, H. P. Structure of a mitochondrial supercomplex formed by respiratory-chain complexes I and III. Proc Nat Acad Sci USA. 102 (9), 3225-3229 (2005).
- Giorgio, V., et al. Dimers of mitochondrial ATP synthase form the permeability transition pore. Proc Nat Acad Sci USA. 110 (15), 5887-5892 (2013).
- Beutner, G., Sharma, V. K., Giovannucci, D. R., Yule, D. I., Sheu, S. S. Identification of a ryanodine receptor in rat heart mitochondria. J Biol Chem. 276 (24), 21482-21488 (2001).
- Rehncrona, S., Mela, L., Siesjo, B. K. Recovery of brain mitochondrial function in the rat after complete and incomplete cerebral ischemia. Stroke. 10 (4), 437-446 (1979).
- Schagger, H. Blue-native gels to isolate protein complexes from mitochondria. Methods Cell Biol. 65, 231-244 (2001).
- Althoff, T., Mills, D. J., Popot, J. L., Kuhlbrandt, W. Arrangement of electron transport chain components in bovine mitochondrial supercomplex I1III2IV1. EMBO J. 30 (22), 4652-4664 (2011).
- Schafer, E., et al. Architecture of active mammalian respiratory chain supercomplexes. J Biol Chem. 281 (22), 15370-15375 (2006).
- Wittig, I., Schagger, H. Supramolecular organization of ATP synthase and respiratory chain in mitochondrial membranes. Biochim Biophys Acta. 1787 (6), 672-680 (2009).
- Davies, K. M., et al. Macromolecular organization of ATP synthase and complex I in whole mitochondria. Proc Nat Acad Sci USA. 108 (34), 14121-14126 (2011).
- Lapuente-Brun, E., et al. Supercomplex assembly determines electron flux in the mitochondrial electron transport chain. Science. 340 (6140), 1567-1570 (2013).
- Antonioli, P., Bachi, A., Fasoli, E., Righetti, P. G. Efficient removal of DNA from proteomic samples prior to two-dimensional map analysis. J Chromatogr A. 1216 (17), 3606-3612 (2009).
- Wittig, I., Carrozzo, R., Santorelli, F. M., Schagger, H. Functional assays in high-resolution clear native gels to quantify mitochondrial complexes in human biopsies and cell lines. Electrophoresis. 28 (21), 3811-3820 (2007).
- Glancy, B., Balaban, R. S. Protein composition and function of red and white skeletal muscle mitochondria. Am J Physiol Cell Physiol. 300 (6), C1280-C1290 (2011).
- Wittig, I., Beckhaus, T., Wumaier, Z., Karas, M., Schagger, H. Mass estimation of native proteins by blue native electrophoresis: principles and practical hints. Mol Cell Proteomics. 9 (10), 2149-2161 (2010).
- Alavian, K. N., et al. An uncoupling channel within the c-subunit ring of the F1FO ATP synthase is the mitochondrial permeability transition pore. Proc Nat Acad Sci USA. 111 (29), 10580-10585 (2014).
- Chance, B., Williams, G. R. Respiratory enzymes in oxidative phosphorylation. IV. The respiratory chain. J Biol Chem. 217 (1), 429-438 (1955).
- Zickermann, V., et al. Structural biology. Mechanistic insight from the crystal structure of mitochondrial complex I. Science. 347 (6217), 44-49 (2015).
- Zhu, J., Vinothkumar, K. R., Hirst, J. Structure of mammalian respiratory complex I. Nature. 536 (7616), 354-358 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved