Method Article
과분극
* 이 저자들은 동등하게 기여했습니다
요약
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
초록
지난 수십 년 동안, 종양의 병기, restaging, 치료 반응 모니터링 및 암의 다양한 재발 검출을위한 새로운 방법 (18) F-fluorodeoxyglucose ([(18) F와 최첨단 양전자 방출 단층 촬영과 함께 등장 ] -FDG PET). 13 C 자기 공명 분광 영상 (13 CMRSI)은 생체 내에서 실시간으로 대사의 모니터링을 가능하게하는 최소 침습 촬상 방법이다. 13 C 핵 자기 공명 (NMR)에 기초하여 임의의 다른 방법으로 인한 13 C 및 낮은 자연 존재비의 비교적 낮은 회전 자기 비에 저열 분극 후속 낮은 신호대 잡음비의 도전에 직면 생물학적 시료. 이러한 한계를 극복하고, 이후 시료 용해 동적 핵 분극 (DNP)는 최근에 일반적으로 사용할 NMR 측정하는 자기 공명 영상 (MRI) 시스템을 사용한다양한 생물학적 시스템의 연구 및 이미지 주요 대사 경로. 13 CMRSI에서 사용되는 특히 흥미롭고 유망한 분자는 지난 10 년 동안 널리 최근 시험 관내, 비 임상 및 위해 사용되어왔다 [1-13 C] 프로피온산, 세포 에너지 대사를 조사하는 임상 연구이다 암과 다른 질병이다. 이 글에서, 우리는 3.35 T 전임상 DNP의 분극을 사용하여 용해 DNP의 기술 개요 및 시험관 연구에서의 사용을 보여줍니다. 과분극 대해 유사한 프로토콜뿐만 아니라 생체 내 연구의 대부분에 적용될 수있다. 이를 위해, 우리는 락 테이트 탈수소 효소 (LDH)를 사용하고 13 CMRSI를 사용하여 전립선 암 세포주 [1-13 C] 락트산 PC3, 시험관 내에서 [1-13 C] 피루브산 대사 반응을 촉매.
서문
현재, 암의 다양한 종양 스테이징 restaging, 치료 반응 모니터링, 반복 검출을위한 가장 널리 사용되는 방법은 임상 [18 F] -FDG PET이다. (1) 그러나, 최근 여러 소설과 다른 접근 방법이 등장했다. 그 방법 중 하나는 13 CMRSI입니다. 이 방법은 시험 관내에서 또는 실시간으로 생체 내에서 신진 대사를 평가하는 최소 침습 MRI 따르는 생물학적 샘플에 13 C 분자의 도입을 포함한다. 그럼에도 불구하고, 예컨대 [18 F] -FDG PET 또는 컴퓨터 단층 촬영 등의 다른 방법에 비해 13 CMRSI의 가장 큰 문제는, 낮은 신호 대 잡음비이다.
핵 자기 공명 신호는 분극 레벨 총인구 두 에너지 상태에서 스핀 ½ 핵 인구 차의 비 (도 1a)에 정비례한다. 편광은 일의 제품입니다핵의 전자 회전 자기 비 (γ) 및 온도에 대한인가 자계 강도. 1 H 핵의 일반적인 편광은 상대적으로 열악한 신호 대 잡음비를 제공한다 (3) T에서 0.001 % ~ 0.005 %의 순서이다. 오늘날의 최첨단 MRI는 인해 생물학적 시료에서 1 H의 높은 풍부 1 H의 높은 회전 자기 비율 성공적인 이미징 방법이었다 (γ 1H = 42.576 MHz의 / T). 그러나, 카본과 같은 다른 핵을 관찰하는 것이 더 요구된다. 유일한 안정 자기 활성 탄소 동위 원소, C (13)는 모두 탄소수 단지 1.1 %를 차지한다. 또한, 13 C (γ = 10.705 MHz의 13C / T)의 회전 자기 비는 낮은 검출 효율을 초래 한 H의 4 배 이하이다. 요약하면, 낮은 13 C 풍부 낮은 γ의 13C 열 13 C 측정은 하나의 감도 0.0176 %를 달성시킬생체 내에서 H-NMR 측정.
동적 핵 분극
13 C 측정의 비교적 불량한 감도를 극복하는 방법은 DNP이다. 그것은 원래 앨버트 W. 오버 하우저 (Overhauser)에 의해 1953 년에 금속에 대해 설명했다. 그 논문에서, 그 명시된 "전도 전자의 전자 스핀 공명이 포화되면, 핵 그들의 회전 자기 비는 전자 스핀의이라면 그들이 것 같은 정도 편파 될 것 같다."이 나중에 그 해는 조각가와 Slichter 실험적으로 오버 하우저 (Overhauser)의 가설 3을 확인했다. 1958 년, 아브라 감 및 프록터는 액체에서 전자이 효과를 설명하고 그 이름 "고체 효과." 4 K 이하의 온도에서, 전자의 스핀 분극은 거의 100 %에 도달하고 핵 스핀 분극 (도 1b) 4보다 크기보다 3 명령이다. 티전자의 회전 자기 비 (γ = 28024.944 MHz의 E / T)는 회전 자기 핵 비율보다 3 자릿수 때문에 자신이 발생한다. 전자가 해당 전자에 가까운 주파수를 갖는 마이크로파 방사선을 이용하여 핵 스핀으로 회전에서 같은 오버 하우저 (Overhauser) 효과, 고체 효과 가교 효과 및 열적 혼합 효과로서, 전자와 원자핵 사이의 약한 상호 작용은 편광의 전송을 허용 상자성 공명 (EPR) 주파수 5,6-. DNP의 이론은 더 이상 전자 및 열 혼합을 포함하기 위해 개발되었습니다. 그럼에도 불구하고, 현재까지, DNP의 더 통합 된 양적 이론적 인 설명은 7, 8을 발표 없습니다.
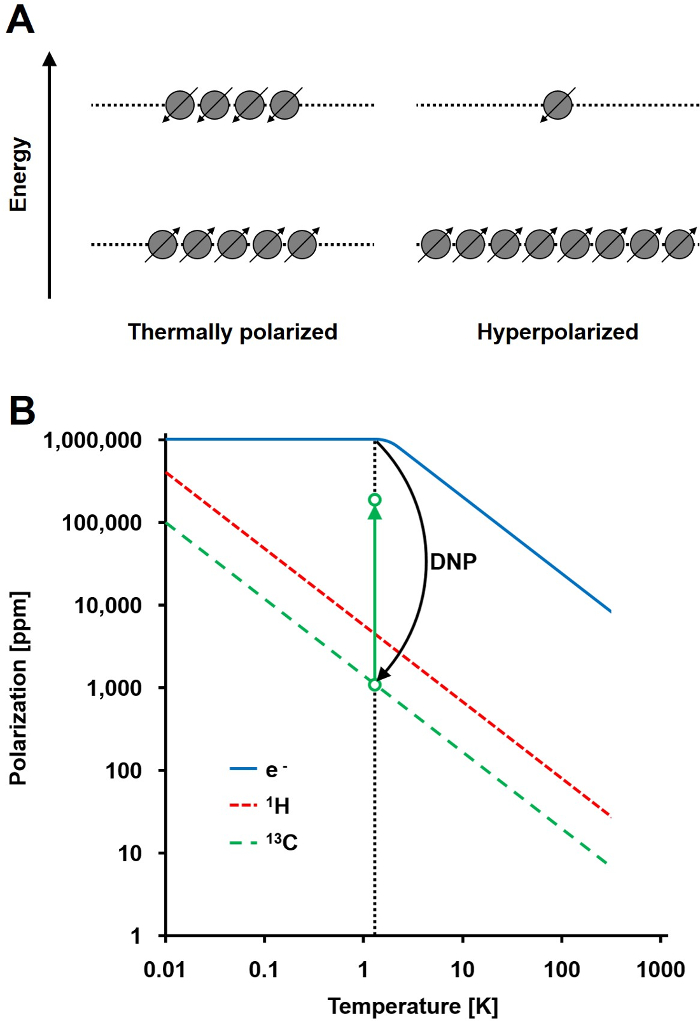
그림 1 : 동적 핵 분극과 과분극 이해. 스핀 인구 A) 개략적 비교열 평형의 편광 상태와 분극 상태이다. B) 편광은 온도에 따라 달라집니다. 전자의 분극의 (e -) 1.4 K이다 DNP 이하 100 % 105 -fold까지 자신의 편광을 증가 C 13 핵에 전자로부터 편광 전송할 수에 도달한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
13 C NMR을 이용하여 생물학적 시스템의 연구에서 DNP을 소개하고, 이후 빠른 샘플 용해 개발했다. 오십년 오버 하우저 (Overhauser)의 가설, 월 H. Ardenkjaer - 라센 등 후. 최소한의 과분극 손실 6 액체 상태로 분극 냉동 샘플을 가져 오는 기술적으로 어려운 문제를 해결했다. 해산 DNP는 연구의 새로운 분야가 13 CMRS라는 오픈나는, 조사 및 각종 질병 상태 9,10의 특성을 할 수있는 새로운 방법을 제공한다. 부대 전자, 트리 틸 라디칼 (8- 카르복시 -2,2,6,6- 테트라 (히드 록시 에틸) -benzo- [1,2-4,5] 비스 - (1,3)의 안정된 운반 -dithiole -4- 일) - 메틸 나트륨 염 (OX063) 또는 (2,2,6,6- 테트라 메틸 피 페리 딘 -1- 일) 옥실 (TEMPO)는 일반적으로 사용된다. 이러한 목적 13 C 표지 분자와 혼합하고, 해당 EPR 주파수에 가까운 주파수를 갖는 마이크로파 방사선에 노출된다. 이 기술을 사용하여, 13 C 핵의 편광을 37 내지 11 %까지 증가 될 수있다. 이는 열 평형 편광 (11, 12)에 비해 105 -fold 분극 향상을 초래한다. 그러나, 마이크로파의 조사를 중지 및 / 또는 13 C-분자가 액체 상태로 전송하자마자, 편광은 편광 된 13 C 핵의 종 완화 시간 (T 1)와 붕괴. 따라서,빠른 용해 기술의 발명 또는 생물학적 응용 프로그램 (13)에 대한 중요 실험 측정 (즉, 주사)하기 전에 시간을 단축 후속 기술.
후보 분자가 성공적으로 13 CMRSI 연구를 위해 수행해야하는 세 가지 주요 요구 사항이 있습니다. 첫째, 관심있는 13 C 핵은 충분히 긴 T 1 (> 10 초)을 가지고있다. 13 C-라벨의 선택은 매우 중요하다. 가장 좋은 후보 핵 결합을 통해 1 H-핵와 직접적인 접촉 탄소입니다. 본래 물질로부터 상당히 상이한 화학 시프트 하류 대사 산물의 생성, T (3) 1 회 - 또한 급속이 내 대사되어야한다. 공간 분포가 전자 13 C 사이의 거리를 감소되도록 샘플 혼합물은 트랜스 있도록, 비정질 유리 때 고체 상태를 형성해야편광 남았다. 후보 분자는 자연적으로 비정질 유리를 형성하지 않는 경우, 글리세롤이나 디메틸 설폭 사이드 (14)를 고하는 유리처럼 제에 가용성 인 필요가있다. 이러한 요구 사항은 후보 분자의 상대적으로 적은 수의 결과. 그러나, 적합한 분자의 성공적인 검색 후에, 과분극하는 작용 프로토콜을 개발하는 것은 9,14,15 기술적으로 어려울 수있다.
36 [2- (13) C] 프로피온산 (37), [1- (13) C] 에틸 피루 베이트 38, [1-13 C - 최근, 여러 기판은 [1-13 C] 프로피온산 (12, 16)로 성공적으로 편광왔다 ] 락트 39 [1- (13) C] 푸마 40-43, 13 C-중탄산 36,44,45 [1-13 C] 아세트산 나트륨 43,46 - 49 13 C - 우레아 6,36,50,51 , [5- (13) C] glutamiNE 15,52,53 [1-13 C] 글루타메이트 (53, 54), [1- (13) C] 2- 옥소 글 루타 레이트 (55), [1- (13) C] 알라닌 등 14,56. 과분극을 위해 특히 재미 있고 일반적으로 사용되는 기판은 [1- (13) C] 피루브산이다. 널리 각종 질병 14,17,22에서 세포의 에너지 대사를 조사하기 위해 전임상 연구에 사용된다. [1-13 C]는 피루브산은 대사되고이어서 전에 세포막 비교적 긴 T 1 및 신속한 전송을 포함 성공적인 과분극의 모든 요건을 만족한다. [1- (13) C] 피루 베이트와 전임상 연구는 현재 병원 57로 번역되고있다.
피루브산의 대사
또한 암 세포의 DNA 및 대사 경로의 변화 변이 사이에 직접 링크가 존재하는 것으로 알려져있다. 이미 1920 년대에, 오토 바르 부르크의 discov60 - 건강한 조직 (58)에 비해 종양에서 포도당과 젖산의 생산의 증가 신진 대사를가 있음을 겹으로. 이어서, 같은 오탄당 포스페이트 경로의 트리 카르 복실 산 사이클 산화 적 인산화 및 뉴클레오타이드 및 지질의 합성 등의 다른 대사 경로에서 다양한 교대가 설명되었다.
피루브산은 해당 작용의 최종 제품입니다. 종양에서, LDH (61)에 의해 촉매 무산소을 겪게하고 보효소 니코틴 아미드 아데닌 디 뉴클레오티드 환원 형의 반응 (NADH), 락트산 및 조효소 (NAD +)의 산화 된 형태의 결과. 선택적으로, 피루 베이트는 알라닌 트랜스 아미나 제 (ALT)에 의해 촉매를 형성하는 알라닌 글루타메이트와 아미노기 전이 반응을 겪는다. 두 반응은 쉽게 되돌릴 수 있습니다. 피루브산은 이산화탄소 및 아세틸 -CoA, R로 피루 베이트 탈수소 효소 (PDH) 촉매로 탈 카르 복 실화를 겪는이 단계에서의 비가역 반응을 epresenting. 이 반응 속도에 교대 종양 대사 17,21,22,25,62 연결될 수있다. 대사 경로는 그림 2에 요약되어있다.

그림 2 : 피루브산의 주요 대사 반응의 다이어그램. 피루 베이트 / 락 테이트 변환 LDH에 의해 촉진되고, 피루브산 / 알라닌 변환 ALT 의해 촉매된다. 피루브산은 비가 역적 및 PDH에 의한 CO 2, 닐 -CoA 아세틸 변환 및 CO 2는 수소 나트륨 (80)의 pH에 의존 평형에 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
과분극 [1- (13) C] 피루브산과 그 대사 산물의 검출은 이전에 쥐에서 증명되었다 그는예술 37,63 - (65), 간 (66), 근육, 신장 62,67. 한 연구는 정상 및 금식 쥐의 간 (66) 사이의 락 테이트 - 투 - 알라닌 비율에 유의 한 차이를 보여 간암 68,69에서 매우 높은 및 과분극 [1- (13) C] 젖산 수준을 보여 주었다. 종양 등급이 절제된 종양의 조직 학적 등급과 높은 상관 관계를 나타내는 분극 젖산 수준, 과분극 [1-13 C] 프로피온산 (22)을 사용하여 마우스 전립선 (TRAMP)의 형질 선암에서 식별 될 수 있다는 증거가있다. ALT에 의해 피루브산에서 촉매 알라닌은 쥐의 간세포 암 (23)에 유용한 지표로 제안되었다.
피루 베이트 락 테이트 대사 플럭스를 측정하는 모니터링 허혈 63,65,70과 세포 독성 화학 요법 17,40 타겟 약물 치료에 대한 응답으로서 사용되고 24,25,41, 또는 동물 모델에서 방사선 치료 26. 또한 교 모세포종 및 유방암의 마우스 모델 (25)의 포스파티딜 이노시톨 3- 키나제 (PI3K)의 억제제 LY294002 응답의 검출을 위해 사용되었다. 뇌에 피루브산 대사의 변화는 26 전립선 암 24,71 또한 치료 후 관찰되었다 종양이.
전립선 암
전립선 암은 전 세계적으로 72 남성의 죽음과 관련된 노인 남성과 두 번째 주요 암의 주된 암이다. 현재까지 신뢰성있는 비 침습적 방법은 엄격한 탐지 및 환자의 준비를 가능하게하는 새로운 대사 이미징 기술에 대한 긴급한 필요성을 강조, 전립선 암 73, 74의 조기 진단 및 특성에 사용할 수 없습니다. 전립선 암 환자 13 CMRSI 결합 용출 DNP의 가능성을 입증하는 모델로 사용 된57이야. 이 연구는 전립선 암의 촬상하는 제 이용한 임상 시험 [1-13 C] 프로피온산 13 CMRSI에서 계속하고, 이는 최근 (NCT01229618)을 완료 하였다.
이 작품 뒤에 동기는 세포와 임상 설정에서 13 CMRSI 방법의 응용 프로그램을보다 상세하고 광범위한 청중에 대해 설명했다. PC3 전립선 암 세포주에서의 시험 관내 [1-13 C] 락트산 내지 [1-13 C] 프로피온산의 LDH - 촉매 대사를 측정 우리는 시험 관내 연구에서 용해 DNP의 가능한 응용을 설명하고 결정적인 단계를 처리하고 실험 기간 동안 도전.
프로토콜
1. 샘플 원액 준비
- 1 밀리몰 / L GadM의 최종 농도를 농축하여 [1- (13) C] 피루브산으로 가도 테 린산의 메 글루 민 (GadM, 0.5 몰 / L)를 추가한다. 틸 라디칼 (8- 카르복시 -2,2,6,6- 테트라 (히드 록시 에틸) -benzo- [1,2-4,5] 비스 (1,3-) -dithiole -4- 일) - 추가 - 이 혼합물에 메틸 나트륨 염 (OX063)는 15 밀리몰 / L의 최종 농도를 얻었다. 완전히 용해 될 때까지 소용돌이.
참고 :이 원액 준비는 3.35-T 임상의 DNP의 분극과 사용을 위해 설계되었습니다. 7 T 임상 분극이 사용될 때 높은 자계에서의 이점을 무시할 수 있기 때문은 가도 테 린산의 메 글루 민은 필요하지 않다. 가돌리늄 계 조영제의 추가도 달성 고체 편광 및 편광 비율을 증가시킨다. 그러나, 액체 상태, 조영제는 T 1 완화 시간을 단축시킨다.
2. 세포 배양 성장
- 125 cm이 성장 지역과 문화 플라스크에 PC3 세포를 성장. 10 % 소 태아 혈청 (FCS)을 함유하는 F-12K 배지를 사용하여 5 % CO 2의 가습 분위기에서 37 ℃에서 세포를 유지한다. 용해 단계 전에, 문화 플라스크에서 매체를 제거합니다.
주 : 각 세포주는 세포 증식에 대한 특정 준비 프로토콜을 필요로한다. 세포주 제공자와 요구 사항을 참조하십시오.
실험에 셀의 제조 3
- 세포 배지를 제거하고 인산 완충 ~ 식염수 (PBS) 10 mL로 가진 세포를 세척 하였다.
- 플라스크에 트립신의 5 mL를 넣고 3 ~ 5 분 동안 인큐베이터에 세포 배양 플라스크를 반환합니다.
- 트립신을 비활성화 F-12K 매체의 ~ 5 mL를 추가합니다.
- 자동 세포 계수기를 사용하여 세포를 카운트. 스테인 용액 10 μL와 세포 용액 10 μL를 혼합한다. 피펫과 잘 혼합 번째로 혼합물의 10 μL를 전송는 "카운트 유리"의 전자 챔버.
- 분리 플라스크에 (S)의 세포 수를 계산. 세포의 수를 함유하는 적절한 부피를 전송 (예를 들어, 5 × 106 최대 10 8) 플라스틱 바이알에.
- 5 분 1,200 XG에서 세포를 원심 분리기 및 상층 액을 버린다.
- 800 μL의 총 부피를 10 % FCS를 함유하는 F-12K 배지에서 세포를 다시 중단하고 반응 컵 (2 mL)에 전송할. 따뜻한 물이 가득 플라스틱 병에 반응 컵을 놓습니다.
4. 해산 에이전트 준비
주 : 용해 에이전트는 분극 샘플을 용해시키기 위해 사용되는 액체이다. 생물학적 응용에서 용해는 일반적으로 1g / L 에틸렌 디아민 테트라 아세트산 (EDTA)를 함유하는, H 2 O를 계 또는 산화 중수소 (D 2 O) 등 PBS 또는 트리스 기반 버퍼 (히드 록시 메틸) 아미노 메탄 (트리스)로 수행된다.
- Prepara20 밀리몰 / L PBS 버퍼의 기
- (용해 화제, 100㎖를 준비 모노 소듐 포스페이트 36 ㎎을 용해 (의 NaH 2 PO 4), 인산이 나트륨 247 mg의 (나 2 HPO 4), 20 밀리몰 / L 수산화 나트륨 용액에 EDTA 10 mg의 수산화 나트륨) D 2 O. 믹스 제대로 완전히 용해 될 때까지.
주 : EDTA (1 ㎍ / L)를 과분극을 망칠 수있는 가능한 강자성 이온을 제거하기 위해 버퍼에 추가된다. 7.4의 pH에 도달 한 몰비 다음 NaOH를 1에서 피루브산을 중화하기 위해 사용된다.
- (용해 화제, 100㎖를 준비 모노 소듐 포스페이트 36 ㎎을 용해 (의 NaH 2 PO 4), 인산이 나트륨 247 mg의 (나 2 HPO 4), 20 밀리몰 / L 수산화 나트륨 용액에 EDTA 10 mg의 수산화 나트륨) D 2 O. 믹스 제대로 완전히 용해 될 때까지.
5. 변수 온도를 삽입 (VTI) 재사용 대기 시간
- DNP-NMR 편광판 프로그램 메인 창에서 클릭 "재사용 대기 시간."
참고 :이 진공 펌프 스위치를 약 5.0 밀리바에 VTI를 배기한다. 이어서, VTI 액체 헬륨 저장고 사이의 니들 밸브가 완전히 액체 헬륨이 VTI로 흐르게 열리고. 유량은 R이고이 헬륨 비점 온도에 도달 할 때까지 VTI에서 액체 헬륨의 최적의 양을 유지하기 위해 니들 밸브에 의해 egulated. 그리고, VTI 거의 완전 진공으로 배기하고, 온도는 대략 1.4 K이다 VTI 65 %의 액체 헬륨까지 가득 도달한다. 이 시점에서, 악기 샘플 삽입을위한 준비가되어 있습니다.
6. 샘플 준비 및 삽입
- 마이크로 피펫을 사용하여 플라스틱 컵에 13 C 표지 샘플 원액 ~ 8 μL를 추가한다.
- 삽입 막대에 플라스틱 컵을 부착하고 주 프로그램 창에서 "샘플을 삽입"을 눌러 샘플 삽입 프로세스를 시작합니다. "일반 샘플"를 선택하고 클릭 "계속."
주 :이 프로세스 동안, 니들 밸브가 제 VTI으로 액체 헬륨의 유동을 중단 닫히고 VTI 내의 압력은 증가한다. VTI 내의 샘플 홀더는 액체 헬륨, 유입 밸브로부터 상승VTI 상단에 개구하고, 기체 헬륨 유동 공기 수분 외부 오염을 방지하기 위해 유입 밸브로부터 도입된다. - 메시지가 표시되면 아래 VTI에 부착 된 플라스틱 컵에 삽입로드를 밀어 넣습니다. VTI의 하단에있는 샘플 홀더에 도달해야합니다. 그렇지 않으면, 헬륨 가스는 VTI에서 샘플을 밀 수있다.
- 분리 및 삽입 막대를 제거합니다.
- 대화 창에서 "다음"을 클릭하여 절차를 마칩니다. 샘플 삽입 과정은 10 초보다 오래 걸릴해서는 안된다.
주 : 유입 밸브는 다음 샘플 컵 샘플 홀더는 액체 헬륨에 침수되어, 가스 헬륨 흐름이 중단 닫히고 니들 밸브는 액체 헬륨이 VTI 내로 유동 할 수 있도록 개방된다. 오 후 - 10 분의 VTI는 자유 전자의 모든 편광 될 수 있도록, 1.4 K 이하로 냉각된다. - 샘플과 플라스틱 컵이 t를 확인하여 VTI에 제대로 소개 된 것을 확인모자 그것은 삽입 막대에 부착 또는 헬륨 가스에 의해 VTI에서 밀려되지 않습니다. 그런 다음 "마침"을 클릭합니다.
7. 전자 레인지 스윕 (선택 사항)
주 : 마이크로파 소인 대상 화합물의 13 C 핵의 과분극 속도를 최대화하기 위해 최적의 마이크로파 주파수의 결정을 허용한다.
- 전자 레인지 청소를 측정하기 위해, RINMR 프로그램 유형 "HYPERSENSENMR를,"시작 "을 선택 구성"을 클릭합니다 "마 Microsweep을."
- 프로세스를 시작하려면 주 프로그램 창에서 "조정"탭을 선택합니다.
- 클릭 "생성"시작 및 종료 주파수 (예를 들어, 94.100 GHz의-94.200 GHz의) 주파수 스텝 크기 (예를 들어, 20 메가 헤르츠) 전력 (100 MW), 시간 (60 초)을 선택한다. ""계속 "사용"및 "시작을 클릭합니다."
주 : 이러한 설정으로, 분극 먼저 샘플을 편광94.100 GHz의 마이크로파 주파수에서 100 mW의 전력을 사용하여 60 초 동안. 그리고, 90 ° 무선 주파수 (RF)의 펄스를인가하고, 내장 된 분광계를 사용하여 13 C 분극 신호를 획득한다. 이러한 단계는 특정 주파수 범위의 각 단계를 반복한다. 이후 과분극의 경우, 측정 된 최대 신호 진폭과 마이크로파 주파수를 선택합니다.
8. 편광
- 편광 형성을 측정하기 위해, RINMR 프로그램 유형 "HYPERSENSENMR를,"시작 "을 선택 구성"을 클릭합니다 "솔리드 빌드 업을."
- DNP-NMR 편광판 프로그램 메인 창에서 과분극 프로세스를 시작하려면 "양극화"를 클릭합니다.
- (전자 레인지 청소 동안 획득) 최적의 마이크로 웨이브 주파수와 샘플에 대한 힘 (예를 들어, 100 mW의)을 선택하고 '다음'을 클릭합니다.
- "양극화 빌드 업 모니터링"을 활성화하고 클릭 "마침."
- > 95 % (~ 60 분 [1-13 C] 프로피온산)로 샘플을 편광.
참고 : 편광 동안, 전자 레인지는 13 C가 과분극 부대 전자의 스핀과 정렬 회전 원인이되는 VTI에 샘플로 안내된다. 과분극 축적을 측정하기 위해 5 °의 플립 각 (FA)로 RF 펄스 (예를 들어, 매 300 S) 주기적으로인가되고, 결과적인 신호는 편광 축적 곡선으로 도시된다.
9. 해산
- 편광은> 95 %에 도달하면, DNP-NMR 편광판 프로그램 메인 창에 "해산"을 클릭하여 용해 과정을 시작합니다.
- 드롭 다운 메뉴에서 용해 과정을 선택하고 '다음'을 클릭합니다.
주 : 편광판 하나 이싱 가스의 타이밍을 선택함으로써 원하는 용해 프로세스를 정의 할 수있다. - t에서 가열 된 용기에 가기 밸브를 통해 용해 에이전트의로드 ~ 5 ㎖편광판의 그 용해 부분입니다. 다음 식을 이용하여 필요한 용출 제제의 정확한 양을 계산한다 :
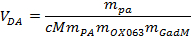
V DA가 용해 화제, m PA, m의 OX063의 원하는 부피이고, m 가드는 피루브산 질량 어디, OX063 및 가도 테 린산의 메 글루 민은 각각 샘플 원액에 첨가 하였다. - 입구 밸브 위의 활성 위치에 용해 스틱을 놓습니다.
참고 :이 장비가 VTI의 샘플 컵의 용해 장비를 연결할 수 있습니다. - 용해 과정을 시작합니다 "마침"을 클릭합니다.
주 : 용해 에이전트 헬륨 가스가 3 기압으로 가압되고,이어서 압력의 증가를 초래 200 ° C까지 가열된다. 압력은 10 기압에 도달하면, 니들 밸브는 VTI으로 액체 헬륨의 유동을 중단 닫는다. 샘플 홀더 컵을 제기액체 헬륨에서. 용해 스틱 VTI로 하강 샘플 컵에 접속된다. 조절 된 용해 화제 샘플의 신속한 용해를 일으키는 컵 용해 스틱 통해 용출 완충액 및 헬륨 가스를 포함하는 가열 용기의 결과 압력에 의해 추진된다. 용액을 플라스틱 배관을 통해 수집 플라스크에 유출된다. 첨부 컵 용해 스틱은 다음 VTI에서 발생합니다. - 은 "청소"위치에 부착 된 컵 용해 스틱을 이동하고 클릭하여 프로세스를 완료 "마침."
13 C 분극 신호 10. 검출
- 시험 관내에서 13 C 대사 자기 공명 분광법
- 셀 솔루션의 800 μL와 컬렉션 플라스크에서 20 밀리몰 / L 용해 과분극 샘플의 200 μL를 섞는다.
참고 : 결과 최종 농도의 [1- (13) C]는 피루브산 4 밀리몰 / L이다. - 도 5 mm의 NMR 튜브에 마이크로 피펫 및 전송 ~ 600 μL를 사용하여, 현탁액을 혼합한다.
- 1-T의 NMR 분광계로 5 mm의 NMR 튜브를 삽입합니다. 소프트웨어의 기본 창에서, 백 10 ° RF 펄스 매 3의 시리즈를 적용, 측정을 시작합니다 "실행"을 클릭합니다.
주 : 셀과 분극 샘플의 초기 혼합 분광 획득의 시작 사이의 시간을 측정한다. 혼합 과정은 분극 손실을 최소화하기 위해 30 초를 초과하지 않는 것을 보장한다.
- 셀 솔루션의 800 μL와 컬렉션 플라스크에서 20 밀리몰 / L 용해 과분극 샘플의 200 μL를 섞는다.
- 13 C 대사 자기 공명 영상
- 자기 공명 영상 분석기를 사용하여 시험 관내 실험을위한 컨테이너를 작성하기 위해, 5 mL를 주사기를 타고의 접근 가능 영역에 분광계의 이소 중심으로부터 도달 할 정도로 긴 카테터 (d = 1.2 mm)에 연결 분광계.
- 차와 함께 체외 컨테이너 채우기실험을위한 목적하는 농도 즉 세포 용액 (예를 들어, 108) 또는 효소 용액.
- 자기 공명 영상 자석의 등각에서 체외 용기를 놓습니다. 컨테이너에 13 C-조정 무선 주파수 수신기 코일을 배치합니다. 인근에 집중 (13) C 표지 교정 팬텀 (예를 들어, 10 몰 / L (13) C-요소)를 놓습니다.
- 핵 자기 공명 스캐너의 이소 - 센터 근처 "체외 용기"를 삽입합니다.
- 스캐너의 표준 3면 현지화 시퀀스를 실행하고 필요에 따라 이소 - 센터로 체외 컨테이너의 위치를 조정합니다.
- 체외 컨테이너 현지화를 커버하는 1 H의 T2 강조 "해부학"순서를 실행합니다. 축 방향, 반복 시간 (TR) = 2000 MS, 에코 시간 (TE) = 20 밀리, 슬라이스 두께 = 1mm, 시험 관내 컨테이너를 포함하는보기의 필드 2D 스핀 에코을하고 다음 설정을 사용하여여기 당 16 에코. 해당 필드의 shimming이 단계에서 양성자에서 수행되어 있는지 확인합니다.
- 해부학 적 영상에서 관심 영역을 중심으로 5 연속 슬라이스를 선택합니다. 선택된 해부학 조각을 덮는 13 C 분광 교정 취득 처방. 다음 설정을 사용하여 축 방향으로 2D 블록 Siegert 보정 시퀀스를 12 × 12 중심의 인코딩, TR = 1000 MS, 슬라이스 두께 = 5mm, 해부학 적 이미지, 스캔 (NS) = 64, 대역폭의 수를 일치 시야 = 5000 Hz에서, 그리고 FA는 = 90 °.
- 13 C 분광 보정 시퀀스를 선택 펄스 시퀀스 라이브러리에서 75 (자세한 내용은 슐트 등. 2011 참조). 클릭하여 컴퓨터에서 스캐너에 펄스 시퀀스를 다운로드 "다운로드." 분광 프리 스캔을 실행하는 "스펙트럼 사전 스캔"을 클릭합니다. 스펙트럼 크기 플롯에서 cente에 13 C 교정 팬텀에서 피크를 조정스캐너 주파수 R. 최대로 수신기의 이득을 설정합니다. 13 C 분광 보정 시퀀스를 실행하려면 "시작"을 클릭합니다. 보고 된 송신 이득과 중심 주파수를합니다.
- 선택한 해부학 조각을 커버하는 13 C 화학적 이동 영상 (CSI) 인수를 설정합니다. 다음 설정을 사용하여 축 방향으로 12 × 12 중심의 인코딩, TR = 400 밀리, 슬라이스 두께 = 5mm,보기 일치하는 해부학 적 이미지의 필드, NS = 300, 및 대역폭 = 5,000 Hz에서와 2D 에코 평면 분광 영상 (EPSI) .
참고 : EPSI 샘플을 반복 한 RF 여기 후 K-공간에서 하나의 라인이 동시에 공간 및 스펙트럼 정보를 취득합니다. 취득 방법에 대한 자세한 내용은, 더스트 등의 알에 의해 문서를 참조하십시오. 2015 76. - 13 C CSI 시퀀스를 다운로드하고 분광 프리 스캔을 실행합니다. 스캐너의 주파수를 조정하고 조정 시퀀스에 의해 지정된 게인 송신산출.
- 과분극 용액을 수집 플라스크에 퇴적 한 후, 주사기에 ~ 3 ㎖를 작성하고 시험관 용기에 연결된 도관에 주입. 인수를 시작합니다. 취득이 완료되면, 후속 재구성을위한 미가공 데이터 파일을 저장한다.
11. 데이터 재구성
- 수집 된 데이터를 분석하기 위해 두 바와 동역학 모델 중 하나를 적용한다.
- LDH 동력학을 설명하기위한 첫 번째 방법에서, 운동 값 (k)는 모든 분자 분극의 신호 (M의 X)로 21,77 락트산 신호 (M LAC)의 합을 비교한다.
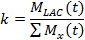
- 다른 방법에서, 시간에 따라 락 테이트 및 피루 베이트의 신호를 측정하고 운동 모델 17,25,71 이러한 맞. 대사 환율을 해결하기 위해, PA → LAC 및 유효 케이락 테이트, (R)의 LAC의 신호 감쇠율, 젖산염 수득 두 사이트 교환 차동 모델을 사용하여, 다음의 선형 미분 방정식을 사용
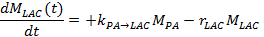
- LDH 동력학을 설명하기위한 첫 번째 방법에서, 운동 값 (k)는 모든 분자 분극의 신호 (M의 X)로 21,77 락트산 신호 (M LAC)의 합을 비교한다.
참고 : 유효 락 테이트 신호 감쇄율 r에 LAC는 (T 1, LAC), 피루브산 K LAC → PA,인가 FA와 TR에 젖산에서 반대 대사 환율 젖산 세로 완화 시간에 따라 달라집니다 및 신호 강도의 피루 베이트 (M PA) 및 계정에 각각의 연속적인 자극 후 돌이킬 수없는 신호 감소를 복용 락 테이트 (M LAC) : 
따라서, R LAC는 신호 감쇠의 하나의 분리라는 용어가 발생합니다. 이는 t를 보정 할 수 있기 때문에그 각도와 반복 횟수를 뒤집은 플럭스 LAC → PA있을지라도, 우리는 피루브산 (K LAC → PA)로 락트산으로부터 환율의 결과에 기초하여, 계산에 포함 할 필요가 없다고 생각 해리슨 등. 2012 78. 그들의 결과는 K LAC → PA 한 가정 할만큼 중요한 역할을하지 않는 것으로 나타났다. 이 모드는 젖산의 T 1 휴식 시간을 정량화 할 수 있습니다. 이 모델은 시험 관내 실험의 경우, 중요하지 않으며 무시 될 수 있으며, 측정에 피루브산 투여 독립적이다. 이것은, 그러나, 생체 측정 (79)의 중요한 역할을 않는다.
결과
은 "마이크로파 소인"의 결과는도 3에 도시되어있다. 이는 [1-13 C] 프로피온산 샘플에 대한 최적의 마이크로파 주파수가 로컬 3.35-T의 분극 대 94.156 GHz의 것을 나타낸다. 모든 다음의 실험은 과분극 (N = 14)의 100 mW의 전력이 마이크로파의 주파수를 사용하여 수행 하였다. 마이크로파 조사에 90 %보다 높은 고체 과분극 선도, 60 내지 80 분 동안 적용 하였다. 결과는 그림 4에 제시되어있다. 과분극 [13 C] 프로피온산 5 × 106 (N = 2), 107 (N = 2), 2 × 107 (N = 1), 3 × 107 (N = 2), 4 × 혼합하고 107 (N = 1), 6 × 107 (N = 2), 8 × 107 (N = 2) 및 108 (N = 1) 전립선 암 세포주 PC3의.
수득 된 데이터는도 5에 나타내었다 그림 6. 스펙트럼 및 시간 해상도 수집 된 데이터 (그림 5E-H도 6E-H) 관찰 각 분자 만 시간 해상도, 그림 5A-D와 그림 6A-D에 도시, 단지 스펙트럼 해상도 (그림 5I된다 -L도 5I-L). 우리는 173 ppm으로, 181 ppm으로, 185 ppm의 약 상대적으로 화학적 변화로, 세 가지 주요 과분극 [1- (13) C] 피루 베이트, [1- (13) C] 피루브산 수화물을 나타내는 신호, 및 [1- (13) C] 젖산을 관찰 pH가 7.4 및 온도 20 ℃에서 트리메틸 실릴 프로판 술폰산 (TMSP)이다. 세 대사 사이의 신호의 비율은 표 1에 요약되어있다. 데이터는 락트산 신호 및 시료에 존재하는 세포의 수 사이에 명확한 상관 관계를 (도 7)을 나타낸다. 그러나, 결과이하의 2 × 107 세포 실험에서 낮아 신호대 잡음비 때문일 상당한 편차를 나타낸다. 따라서, 우리는 추가 실험이보다 더 많은 세포를 사용하는 것이 좋습니다. 상대 락트산 신호 (운동 값) 셀의 개수 (도 8)에 의해 정규화 될 때, 명확하게 모든 셀에 걸쳐 유사한 흡수 및 대사를 보여준다. 그러나, 세포의 수가 증가하여 셀당 락 테이트 생산을 감소시키는 경향이있다. 우리는 세포 대사 활성 감소의 원인 중 하나가 셀의 매우 높은 농도는 시료의 점도 증가의 결과로, 매우 작은 부피는 것을 믿는다. 두 사이트 교환 차동 모델의 결과를 표 2에 요약 및도 9에 나타낸다. 세포의 수가 증가하여 K PA → LAC 증가 : 데이터는 이전 모델과 동일한 경향을 따른다. 그러나,이 모델을 초래할세포의 수 역학의 급격한 증가 (S). 대사 환율 K PA → LAC 셀의 개수로 표준화하면, 우리는 다시 세포의 증가 (도 10)와 K PA → LAC 감소의 분명한 경향을 볼 수있다.
도 11은 실험에 공간 지역화의 부가 가능성을 보여준다. 그것은 다음 10 몰 / L (13) C-요소 팬텀 80 밀리몰 / L의 과분극 [1- (13) C] 피루브산 주입 팬텀을 보여줍니다. 이 기술은 시간적 해상도 및 특별 (도 11A)와 스펙트럼 달성 또는 시간에서 선택된 대사 신호의 신호 감쇠 (도 11B)로 할 수있다. 시간 영역에서의 스펙트럼은 더 나은 신호 대 잡음비 (도 11C)을 수용하도록 합산 될 수있다. 특별한 해결책은 원하는 주파수 영역 (O)의 선택을 허용예 F [1-13 C] 프로피온산 (도 11D)와 같은 특정 대사에 속하는 13 C 스펙트럼 [1-13 C] 프로피온산 수화물 (도 11E), 또는 기준 13 C - 우레아 (도 11F). 그것은 1 H 이미지와 공동 등록 할 수있다. 사용 된 펄스 시퀀스 (EPSI)은 전체 슬라이스마다 4.9 (S)의 이미지를 획득 할 수있다. 요약하면, 이러한 기술은 임의의 대사를위한 공간, 시간 및 스펙트럼 분해능으로 데이터를 제공 할 수있다.

그림 3 : 로컬 3.35-T 분극에서 [1- (13) C] 피루 베이트와 전자 레인지 스윕의 결과. [1-13 C] 프로피온산의 표적 화합물 13 C 핵의 과분극 속도를 최대화하기 위해 최적의 마이크로파 주파수를 결정하는 측정 결과. 마이크로파 소인은 EPR 흡수 형상을 갖는다스펙트럼. 형상 및 피크의 분리가 사용되는 라디칼을 기반으로 (이 경우, 라디칼 틸), 그리고 가장 큰 영향은 고체 효과 및 열적 혼합을 갖는다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 : [1- (13) C] 피루 베이트 샘플의 솔리드 스테이트 양극화 축적. N = 13, 고체 편광의 평균 4,500들마다 300의 측정 표준 편차로 표시되는 오류 buildups. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
 />도 5의 셀의 개수 (5 × 106 행 3 × 107 세포)에 대한 13 C NMR 분광학 결과. 수집 된 데이터는, 스펙트럼 및 시간 해상도 (AD) 플롯 시간 만 [1- (13) C] 피루 베이트, [1- (13) C] 피루 베이트 수화물에 대한 해상도, [1- (13) C] 락 테이트 (EH) 플롯과 플롯 모든 시간 단계 (IL) 합산에만 스펙트럼 해상도와. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
/>도 5의 셀의 개수 (5 × 106 행 3 × 107 세포)에 대한 13 C NMR 분광학 결과. 수집 된 데이터는, 스펙트럼 및 시간 해상도 (AD) 플롯 시간 만 [1- (13) C] 피루 베이트, [1- (13) C] 피루 베이트 수화물에 대한 해상도, [1- (13) C] 락 테이트 (EH) 플롯과 플롯 모든 시간 단계 (IL) 합산에만 스펙트럼 해상도와. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 6 : 세포 수 (4 × 10월 7일부터 1일까지 X 108 세포)에 대한 13 C NMR 분광학 결과. 스펙트럼 및 시간 해상도로 그려 수집 된 데이터 ( AD) 만 [1- (13) C] 피루 베이트, [1- (13) C] 피루 베이트 수화물에 대한 시간 해상도와 플롯, 그리고 [1- (13) C] 락 테이트 (EH), 그리고 모든 시간 단계를 합산, 단지 스펙트럼 해상도로 그려 (IL). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
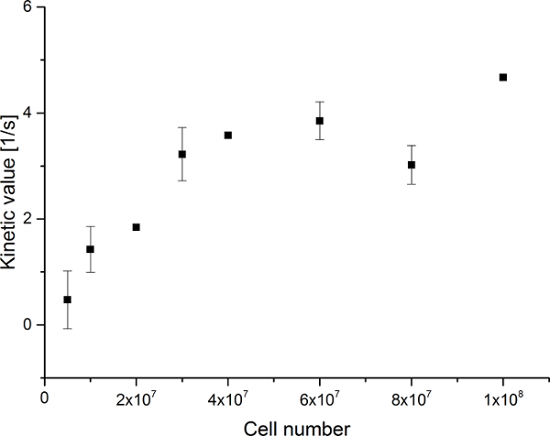
그림 7 : 간단한 대사 비율 운동 모델링의 결과. 자료는 셀의 개수 대 [1-13 C] 프로피온산의 합에 [1-13 C] 락트산 신호의 비율 [1-13 C] 피루브산 수화물 및 [1-13 C] 락트산을 나타낸다 실험. 오차는 표준 편차를 나타낸다. 피임대이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
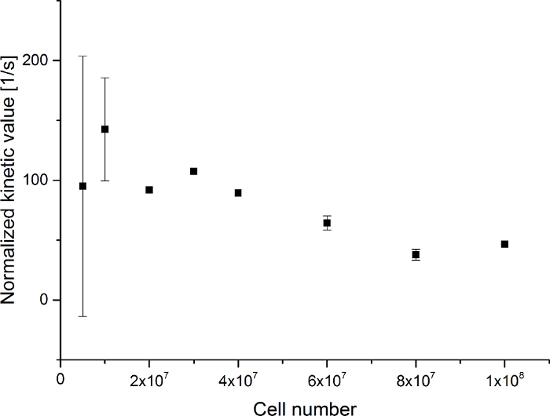
그림 8 : 세포의 수에 대한 간단한 대사 비율 운동 모델링의 결과는 정규화. 데이터는 [1-13 C] 프로피온산의 합에 [1-13 C] 락트산 신호의 비율 [1-13 C] 피루브산 수화물 및 [1-13 C]를 나타내는 세포의 개수로 표준화 락트 실험에서 세포의 수 대. 오차는 표준 편차를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 9 : 두 사이트 교환 차동 모델의 결과. 데이터를 repr 실험에서 세포의 수 대 대사 환율 (K PA → LAC)를 ESENT. 오차는 표준 편차를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 10의 셀의 개수에 정규화 2 사이트 환 시차 모델의 결과. 데이터는 실험에서 세포의 수 대 세포의 개수로 표준화 대사 환율 (PA → LAC를 k)를 나타낸다. 오차는 표준 편차를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 11 : 과분극 [1- (13) C] 피루브산 프로브의 자기 공명 영상의 결과. 전체 조각 모든 시간 단계에서 얻은 A) 스펙트럼. B) 시간이 지남에 따라 다음은 [1- (13) C] 피루브산의 부패와 [1- (13) C] 피루 베이트 수화물 신호. 세 번째 신호는 10 M (13) C-요소 현지화 참조입니다. C) 전체 공간 및 시간 해상도에서 획득 한 스펙트럼. D) 모든 시간 단계에 걸쳐 합산 [1- (13) C] 피루브산 신호의 13 C 이미지와 겹쳐 1 H 이미지입니다. E) 모든 시간 단계에 걸쳐 합산 [1- (13) C] 피루 베이트 수화물 신호의 13 C 이미지와 겹쳐 1 H 이미지입니다. F)를 겹쳐 1 H 이미지 모든 시간 단계 (참조)을 통해 합산 (13) C-요소 신호의 13 C 이미지입니다. CE의 13 C-신호는 특정 대사 물질의 신호의 최대 정규화된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 휴대폰 번호 | ||||||||
| 5 × 106 (N = 2) | 10 7 (N = 2) | 2 × 107 (N = 1) | 3 × 107 (N = 2) | 4 × 107 (N = 1) | 6 × 107 (N = 2) | 8 × 107 (N = 2) | 108 (N = 1) | |
| [1- (13) C] 피루브산 | 92.9 ± 1.4 | 91.7 ± 1.0 | 86.7 | 77.5 ± 2.7 | (76) | 69.7 ± 0.5 | 65.9 ± 3.7 | 42.9 |
| [1- (13) C] 피루 베이트 수화물 | 6.8 ± 1.2 | 6.7 ± 1.6 | 9.5 | 10.1 ± 1.8 | 8.9 | 7.7 ± 1.5 | 10.4 ± 0.2 | 13.4 |
| [1- (13) C] 젖산 | 0.3 ± 0.3 | 1.6 ± 0.6 | 3.8 | 12.4 ± 4.5 | 15.1 | 22.5 ± 1.1 | 23.7 ± 3.5 | 43.7 |
표 1 셀의 상이한 수에 대해 과분극 대사 산물의 상대적인 비율.
휴대폰 번호 5 × 106 (N = 2) 10 7 (N = 2) 2 × 107 (N = 1) 3 × 107 (N = 1) 4 × 107 (N = 1) 6 × 107 (N = 2) 8 × 107 (N = 2) 108 (N = 1) K PA → LAC [* 10 -4] 0.924 ± 0.870 4.984 ± 1.19 15.135 36.289 58.904 112.174 ± 10.491 114.3 ± 37.059 349.234표 2 :두 사이트 교환 차동 모델의 결과.
토론
과분극 프로브 13 CMRSI 시험 관내 및 생체 내 대사를 실시간으로 모니터링하는 유망한 방법이다. 하나의 매우 중요한 측면이 실험 방법을 사용하는 것이 특히 생체 외 실험에 대해 적절한 표준화이다. 먼저, 시료의 준비 각 실험에서 분극 물질의 동일한 농도를 달성하기 위해 적절하고 일관성있게 수행되어야한다. 이 과분극 버퍼로 샘플 모두의 무게 정확한을 필요로한다. 농도가 정확하지 않으면, 용액의 최종 pH는 T 1에의 영향 및 세포의 반응을 가질 수있는 정확하지 않다. 또한 가능한 한 균일 셀을 처리하는 것이 중요하다. 세포는 항상 세포가 매우 높은 진한로 유지되는 시간의 기간을 최소화하기 위하여 세포 수확 및 후속 실험 사이에 최소한의 지연이되는 방식으로 제조되어야entration과 낮은 볼륨. 같은 다른 준비 시간이나 온도 등의 세포 준비 프로토콜의 변화는, 얻어진 데이터에 상당한 변화가 발생할 수 있습니다. 세포 시료의 혼합은 표준화되어야한다. 이 다를 수 있기 때문에, 세포 현탁액 및 측정의 시작 트레이서의 첨가 사이의 시간을 측정하는 것이 중요하다; 데이터 분석 과정이 고려되어야한다.
데이터 분석 및 모델링 운동의 올바른 선택은 수집 된 데이터의 해석에 중요하다. 단순한 모델은 두 대사 일정한 환율 갖는 선형 일방향 반응에 적합하다. 도입부에서 설명한 바와 같이, 피루브산 여러 효소 반응과, 더 중요하게, 또한 피루브산 수화물 비 효소 가역 교환 반응이 일어나 겪는다. 본 반응 실험에서 중요한 역할을하고, 그 효과는 잘 입증되어 전8 × 10 7 세포 실험 n 개의. 표 1은 피루브산 수화물 상대 농도가 다른 실험과 유사한 것을 나타낸다하더라도 긴밀도 6d에 조사하면, 상기 다른 실험과 비교 실험의 시작에 훨씬 높은 피루브산 수화물 신호를 나타낸다. 시간적 해상도를 표현하는 경우에는, 중요한 정보는 손실 데이터의 재구성에 오류가 발생한다. 이 계산의 시간 해상도를 포함하기 때문에, 다른 한편으로, 2 사이트 교환 차동 동역학 모델보다 견고하고 정확한 설명한다. 따라서, 그것은 신속하게 측정하는 동안 피루 베이트로 교환해도, 피루브산 수화물 비 효소 적 교환을 포함한다.
다양한 영상 전략 사이의 선택합니다 분극 신호를 관찰하거나 preclinica의 과분극 분자의 신진 대사를 추적 할 수 있습니다리터 및 임상 연구. 더스트는 등. 장점과 다른 펄스 sequnces (76)의 단점을 보여 주었다. 무료 유도 붕괴 화학적 이동 영상 (FIDCSI) 순서는 상대적으로 견고하지만 멀티 슬라이스와 일시적으로 해결 이미징을위한 사용이 제한이 있습니다. 에코 평면 분광 영상 (EPSI은)는 재건 아티팩트하는 경향이있다, 효과 그라데이션 문제에 대한 오프 공명 강력하지만. 에코 비대칭 최소 제곱 추정 (IDEAL) (81), 나선형 화학 시프트 영상 (ISPCSI) 펄스 시퀀스 (35), 및 나선형 화학 시프트 영상 (SPCSI) 물과 지방의 반복 분해 높은 부호화 효율을 갖지만 B 0에 민감 불균일성. 시퀀스의 선택은 스캐너 특성 생물학적 문제에 의존하며, 시스템이 조사된다.
성공적인 과분극을 위해 충족해야 할 많은 요구 사항이 있습니다. 그러나, t여기에 과분극 (13) CMRSI 기술이 현재 직면하고 있다는 몇 가지 제한 사항도 있습니다. 기본 불변 제한은 측정의 특정 시간에서 검출 가능한 신호의 양을 정의하는 분자의 13 C 핵의 T 1 완화 시간이다. 신호가 데이터 수집 동안 반복 과분극 신호의 손실이 발생 각 RF 여기에 의해 저하된다. 또 다른 제한은 분자 hyperpolarize 요구되는 비교적 긴 기간이다. 이는 일반적으로 30 ~ 90 분에 걸립니다.
등 [18 F] -FDG PET 등의 분자 이미징의 다른 기술에 비해, 과분극 (13) CMRSI 증가 당분 대사 경로 때문에, 증가 된 포도당 소비 종양을 필요로하지 않습니다. 이 기술은 실시간으로 실제 대사 플럭스를 나타낸다. 한편, [18 F] -FDG 애완 동물에 대한 직접적인 정보를 제공하지 않습니다신진 대사를하지만, 대사 활성 영역에 축적에 대한 유일한 간접적 인 정보를 제공합니다. 이것은 종양 대사 비활성 보이지만 실제로는 증식 용 탄소원으로서, 예 glutaminolysis 같은 다양한 대사 경로를 사용하는 위음성 결과를 일으킬 수있다.
결론적으로 용해 DNP 82 (당뇨병 등) 질환의 무제한 목록 15,36,45 공부의 pH를 측정하거나 암의 다양한 유형의 대사 변화를 모니터링하기 위해 다양한 애플리케이션에 사용될 수있다. 이러한 측정은 최근 인간 임상 연구 (57) (예 : 마우스, 래트, 토끼, 돼지, 개 등), 동물 모델을 이용한 전임상 연구를 통하여, 시험 관내 세포 실험에서, 서로 다른 레벨에서 수행 될 수있다. 미래 임상 응용 프로그램을 감지하고 질병을 국산화뿐만 아니라 치료의 관찰을 허용 할 수 있습니다뿐만 아니라, 매우 강력하고 비 침습적 진단 도구 기능을합니다실시간 (83)에 대응.
공개
Rolf F. Schulte and Marion I. Menzel are employed with GE Global Research.
감사의 말
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, "Imaging for Selection, Monitoring, and Individualization of Cancer Therapies."
자료
| Name | Company | Catalog Number | Comments |
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid - 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
참고문헌
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in't Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine - investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth's magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. - A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유