Method Article
hyperpolarisé
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Résumé
Au cours des dernières décennies, de nouvelles méthodes pour la mise en scène de la tumeur, restadification, suivi de la réponse au traitement, et la détection de la récurrence d'une variété de cancers ont vu le jour en collaboration avec la tomographie state-of-the-art la tomographie par émission de 18 F-fluorodéoxyglucose ([18 F ] -FDG TEP). 13 C résonance magnétique imagerie spectroscopique (13 CMRSI) est une méthode d'imagerie mini - invasive qui permet la surveillance du métabolisme in vivo et en temps réel. Comme pour toute autre méthode basée sur 13 C résonance magnétique nucléaire (RMN), il fait face au défi de la faible polarisation thermique et un rapport subséquent de faible signal sur bruit en raison de la relativement faible rapport gyromagnétique de 13 C et sa faible abondance naturelle des échantillons biologiques. En surmontant ces limitations, la polarisation nucléaire dynamique (DNP) avec échantillon suivant la dissolution a récemment permis couramment utilisé l'imagerie par résonance magnétique (IRM) des systèmes RMN et pour mesurer, L'étude et l'image des voies métaboliques clés dans divers systèmes biologiques. Une molécule particulièrement intéressante et prometteuse utilisée dans 13 CMRSI est [1- 13 C] pyruvate, qui, au cours des dix dernières années, a été largement utilisé pour in vitro, préclinique, et, plus récemment, des études cliniques pour enquêter sur le métabolisme énergétique cellulaire dans le cancer et d'autres maladies. Dans cet article, nous décrivons la technique de dissolution DNP utilisant un DNP préclinique hyperpolarisation 3,35 T et de démontrer son utilisation dans des études in vitro. Un protocole similaire pour hyperpolarisation peut être appliqué pour la plupart dans les études in vivo aussi bien. Pour ce faire, nous avons utilisé la lactate déshydrogénase (LDH) et catalysé la réaction métabolique de [1- 13 C] pyruvate [1- 13 C] lactate dans une lignée de cellules de carcinome de la prostate, PC3, in vitro en utilisant 13 CMRSI.
Introduction
Actuellement, la méthode clinique la plus largement utilisée pour déterminer le stade de la tumeur, restadification, la surveillance de la réponse au traitement, et la détection de la récurrence d'une grande variété de cancers est de [18F] FDG PET. 1 Toutefois, récemment, plusieurs approches nouvelles et alternatives ont vu le jour. Une de ces méthodes est 13 CMRSI. Cette technique implique l'introduction de la 13C-molécule dans un échantillon biologique, suivi par IRM mini - invasive pour évaluer le métabolisme in vitro ou in vivo en temps réel. Néanmoins, le plus grand défi de 13 CMRSI, par rapport aux autres méthodes telles que [18 F] FDG PET ou tomodensitométrie, est son faible rapport signal à bruit.
Le signal de RMN est directement proportionnel au niveau de polarisation, un rapport de la différence de population de spin ½ noyaux dans deux états d'énergie à la population totale (figure 1A). La polarisation est un produit de the rapport gyromagnétique (en γ) des noyaux et la force du champ magnétique appliqué au-dessus de la température. Une polarisation typique de 1 pour les noyaux H est de l'ordre de 0,001% à 0,005% à 3 T, ce qui donne un rapport relativement faible rapport signal à bruit. L'IRM state-of-the-art d'aujourd'hui a été une méthode d'imagerie réussie seulement en raison de la forte abondance de 1 H dans des échantillons biologiques et le rapport gyromagnétique élevé de 1 H (y 1H = 42,576 MHz / T). Cependant, en observant d'autres noyaux tels que le carbone, est plus exigeante. La seule stable, isotope du carbone actif magnétiquement, 13 C, ne représente que 1,1% de tous les atomes de carbone. En outre, le rapport gyromagnétique 13 C (γ = 10,705 MHz 13C / T) est quatre fois inférieure à celle du 1 H, conduisant à une efficacité de détection inférieure. En résumé, la faible abondance 13C et 13C faible γ provoquent des mesures thermiques 13 C pour obtenir 0,0176% de la sensibilité d'un 1Mesure H-RMN in vivo.
Polarisation nucléaire dynamique
Une méthode pour surmonter la sensibilité relativement médiocre de 13 mesures C est DNP. Il a été initialement décrit pour les métaux en 1953 par Albert W. Overhauser. Dans son article, il a déclaré: "Il est démontré que si la résonance de spin électronique des électrons de conduction est saturé, les noyaux seront polarisés au même degré qu'ils seraient si leur rapport gyromagnétique était celle du spin de l' électron." 2 plus tard cette année, Carver et Slichter confirmée expérimentalement l'hypothèse de Overhauser 3. En 1958, Abragam et Proctor décrit cet effet pour les électrons dans les liquides et l'a nommé «l'effet solide." A des températures inférieures à 4 K, électron-polarisation de spin atteint près de 100% et plus de trois ordres de grandeur plus élevé que le spin nucléaire polarisation (figure 1B) 4. Tson produit parce que le rapport gyromagnétique de l'électron (γ e = 28,024,944 MHz / T) est de trois ordres de grandeur supérieurs aux ratios gyromagnétiques nucléaires. Les faibles interactions entre les électrons et les noyaux, tels que l'effet Overhauser, l'effet solide, l'effet croisé, et l'effet de mélange thermique, permettent le transfert de polarisation de spins des électrons à spins nucléaires par irradiation micro-ondes avec une fréquence proche de l'électron correspondant la résonance paramagnétique (EPR) fréquence 5,6. la théorie DNP a été développée pour impliquer davantage les électrons et mélange thermique. Néanmoins, à ce jour, aucune description théorique quantitative unifiée de DNP a été publiée 7,8.
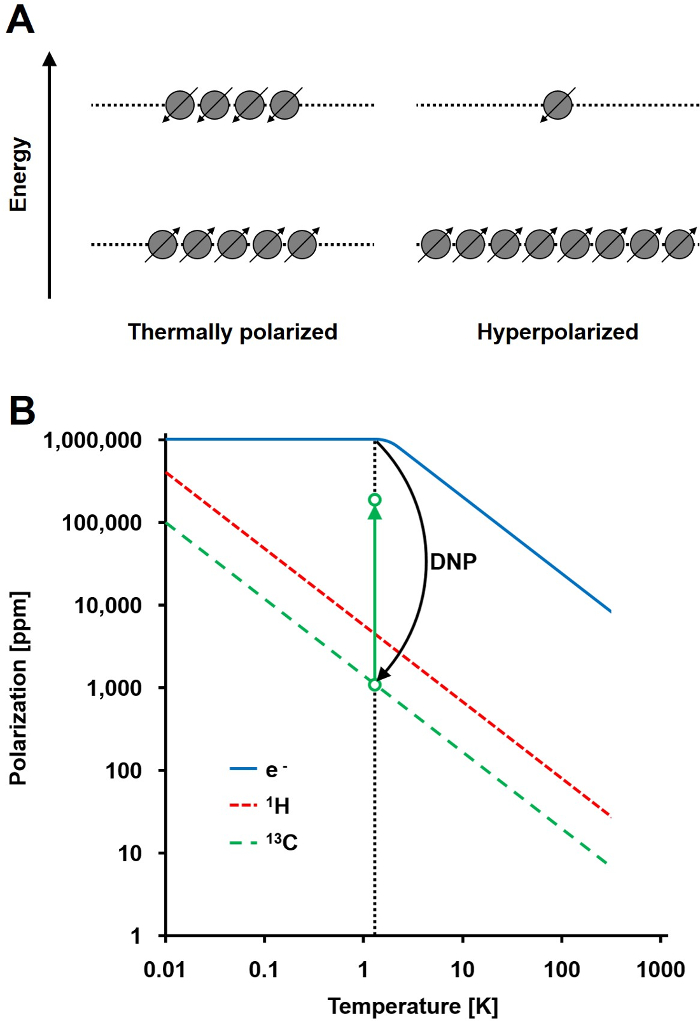
Figure 1: Comprendre Polarisation Dynamique Nucléaire et Hyperpolarisation. A) Une comparaison schématique de la population de spindans l'état d'équilibre de polarisation thermique et l'état hyperpolarisé. B) La polarisation dépend de la température. La polarisation d'un électron (e -) atteint 100% en dessous de 1,4 K. La DNP permet le transfert de la polarisation de l'électronique des 13 noyaux de C, ce qui augmente leur polarisation jusqu'à 10 5 -fold. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Pour introduire DNP dans les études sur les systèmes biologiques à l' aide de RMN 13 C, à la suite échantillon rapide dissolution a dû être mis au point. 50 ans après l'hypothèse de Overhauser, Jan H. Ardenkjaer-Larsen et al. résolu la question techniquement difficile d'amener l'échantillon congelé hyperpolarisé à l'état liquide avec une perte de hyperpolarisation minimale 6. Dissolution DNP a ouvert un nouveau champ de recherche appelé 13 CMRSI, fournissant une nouvelle méthode pour étudier et de caractériser divers états pathologiques 9,10. Comme supports stables d'un électron non apparié, un trityle tris radical (8-carboxy-2,2,6,6-tétra (hydroxyéthyl) -benzo- [1,2-4,5] -bis- (1,3) -dithiole-4-yl) -méthyl sel de sodium (OX063) ou (2,2,6,6-tétraméthylpipéridin-1-yl) oxyle (TEMPO) est habituellement utilisé. Ceux - ci sont mélangés avec la 13 molécule désirée marqué au C et exposés à un rayonnement micro - ondes à une fréquence proche de la fréquence EPR correspondante. En utilisant cette technique, la polarisation des noyaux de 13 C peut être augmentée jusqu'à 11 à 37%. Il en résulte une amélioration de la polarisation -fold 10 5 par rapport à l'équilibre thermique de polarisation 11,12. Cependant, dès que l'irradiation par micro - ondes est arrêté et / ou du 13C-molécule est transféré à l'état liquide, la polarisation se dégrade avec le temps de relaxation longitudinale (T1) du noyau 13 C , qui a été polarisée. Ainsi, leinvention des techniques de dissolution rapide ou toute technique ultérieure de raccourcir le temps avant la mesure expérimentale (c. -à- injection) est crucial pour les applications biologiques 13.
Il existe trois grandes exigences que la molécule candidate doit remplir pour succès 13 études CMRSI. D' abord, le noyau 13 C d'intérêt doit avoir une longueur suffisante T 1 (> 10 s). Le choix du 13 C-étiquette est cruciale. Les meilleurs noyaux candidats sont des carbones sans contact direct avec 1 H noyaux via une liaison. Il doit également être métabolisé rapidement dans 2 - 3 T 1 fois, résultant en un produit métabolique aval avec une différence significative déplacement chimique de la substance d' origine. Le mélange de l' échantillon doit également former un verre amorphe lorsqu'il est dans un état solide , de telle sorte que la distribution spatiale diminue la distance entre les électrons et 13 C, ce qui permet la transfer de polarisation. Si la molécule candidate ne forme pas de verre amorphe naturellement, il doit être très soluble dans un agent de vitrification, tel que le glycerol ou le 14 diméthylsulfoxyde. Ces exigences se traduisent par un nombre relativement faible de molécules candidates. Cependant, même après la découverte réussie d'une molécule appropriée, l' élaboration d' un protocole de travail pour hyperpolarisation peut être techniquement difficile 9,14,15.
Au cours des dernières années, plusieurs substrats ont été correctement polarisé, tel que le [1- 13C] pyruvate 12,16 - 36 [2- 13 C] pyruvate 37 [1- 13C] pyruvate d' éthyle 38 [1- 13 C ] lactate 39, [1- 13 C] fumarate 40-43, 13 C-bicarbonate 36,44,45, [1- 13 C] acétate de sodium 43,46 - 49, 13 C-urée 6,36,50,51 [5- 13 C] glutamine 15,52,53, [1- 13 C] glutamate 53,54, [1- 13 C] 2-oxoglutarate 55, [1- 13 C] alanine, et d' autres 14,56. Un substrat particulièrement intéressant et couramment utilisé pour hyperpolarisation est [1- 13 C] pyruvate. Il est largement utilisé dans les études précliniques pour enquêter sur l'énergie du métabolisme cellulaire dans diverses maladies 14,17,22. [1- 13 C] pyruvate répond à toutes les exigences pour hyperpolarisation succès, y compris un transport relativement longue T 1 et rapide à travers la membrane cellulaire avant étant ensuite métabolisé. Les études précliniques avec [1- 13 C] pyruvate sont actuellement en cours de traduction dans la clinique 57.
Métabolisme de pyruvate
Il est bien connu qu'il existe un lien direct entre des mutations dans l'ADN d'une des cellules cancéreuses et des changements dans les voies métaboliques. Déjà dans les années 1920, Otto Warburg découerts qu'il y a une augmentation du métabolisme du glucose et de production de lactate dans les tumeurs par rapport aux tissus sains 58-60. Par la suite, plusieurs alternances dans d'autres voies métaboliques, telles que la voie des pentoses-phosphates, le cycle de l'acide tricarboxylique, la phosphorylation oxydative, et la synthèse des nucléotides et des lipides, ont été décrits.
Le pyruvate est le produit final de la glycolyse. Dans la tumeur, il subit une glycolyse anaérobie catalysée par la LDH 61 et réagit avec la forme réduite de la coenzyme nicotinamide adénine dinucléotide (NADH), ce qui entraîne le lactate et la forme oxydée de la co - enzyme (NAD +). En variante, le pyruvate subit une réaction de transamination avec le glutamate pour former l'alanine, catalysée par l'alanine transaminase (ALT). Les deux réactions sont facilement réversibles. Pyruvate subit également une décarboxylation catalysée par la pyruvate déshydrogénase (PDH) en dioxyde de carbone et de l'acétyl-CoA réductase, representing une réaction irréversible à cette étape. Alternances de ces vitesses de réaction peuvent être liés au métabolisme des tumeurs 17,21,22,25,62. Les voies métaboliques sont résumés dans la figure 2.

Figure 2: Schéma de la principale réaction métabolique de pyruvate. Pyruvate / conversion du lactate est catalysée par la LDH et la conversion pyruvate / alanine est catalysée par ALT. Pyruvate est irréversiblement converti en acétyl-CoA et du CO 2 par PDH, et le CO 2 est dans un équilibre dépendant du pH avec du bicarbonate 80. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
La détection de hyperpolarisé [1- 13C] pyruvate et de ses métabolites ait déjà été démontrée chez le rat , il aart 37,63 - 65, le foie 66, les muscles et les reins 62,67. Une étude a démontré des différences significatives dans le taux de lactate à alanine entre le foie de rat normal et à jeun 66 et fait preuve d' une [1- 13C] Le niveau très élevé et le lactate hyperpolarisé dans le cancer du foie , 68,69. Il existe des preuves que le grade de la tumeur peut être identifié dans un adénocarcinome transgénique de la prostate de la souris (TRAMP) en utilisant hyperpolarisé [1- 13 C] pyruvate 22, avec les niveaux de lactate hyperpolarisés montrant une forte corrélation avec le grade histologique des tumeurs excisées. Alanine à partir du pyruvate catalysée par ALT a également été suggérée comme un marqueur utile chez le rat 23 carcinome hépatocellulaire.
Mesurer le flux métabolique pyruvate-lactate a été utilisé pour surveiller l' ischémie 63,65,70 , et en réponse à un traitement avec des médicaments de chimiothérapie cytotoxique 17,40, ciblés 24,25,41, 26 ou d'une radiothérapie dans des modèles animaux. Il a également été utilisé pour la détection de la phosphatidylinositol 3-kinase (PI3K) de réponse LY294002 dans des modèles murins glioblastomes et un cancer du sein 25. Les changements dans le métabolisme du pyruvate dans le cerveau des tumeurs 26 et de la prostate 24,71 ont également été observées après le traitement.
Carcinome de la prostate
Le carcinome de la prostate est le cancer prédominant chez les hommes âgés et le deuxième cancer le plus liés à la mort en hommes dans le monde 72. À ce jour, aucune méthode fiable, non-invasives sont disponibles pour un diagnostic précoce et la caractérisation du cancer de la prostate 73,74, en insistant sur le besoin urgent de techniques d'imagerie métabolique nouvelles pour permettre la détection rigoureuse et mise en scène de patients. Le carcinome de la prostate a été utilisé comme modèle pour mettre en évidence les possibilités de dissolution DNP combinée avec 13 CMRSI chez un patients 57. Ce travail a été poursuivi dans un premier essai clinique utilisant [1- 13 C] pyruvate et 13 CMRSI pour l'imagerie du cancer de la prostate, et il a tout récemment a été achevée (NCT01229618).
La motivation derrière ce travail était d'illustrer plus en détail et pour un plus large public à l'application de la méthode CMRSI 13 dans un cadre préclinique avec des cellules. Mesurer le métabolisme de la LDH-catalysée de [1- 13 C] pyruvate à [1- 13 C] lactate in vitro dans la lignée de cellules de carcinome PC3 de la prostate, nous démontrons l'application éventuelle de dissolution DNP dans les études in vitro et d' aborder les étapes cruciales et défis au cours des expériences.
Protocole
1. Echantillon Stock Solution Préparation
- Ajouter gadotérate meglumine (GadM, 0,5 mol / L) et concentrée [1- 13 C] de l' acide pyruvique pour obtenir une concentration finale de 1 mmol / L GadM. Ajouter de tris radical trityle (8-carboxy-2,2,6,6-tétra- (hydroxyéthyl) -benzo- [1,2-4,5] -bis- (1,3) -dithiole-4-yl) - sel de sodium de méthyle (OX063) à ce mélange pour obtenir une concentration finale de 15 mmol / L. Vortex jusqu'à dissolution complète.
NOTE: Cette préparation de la solution mère est conçue pour une utilisation avec un préclinique DNP hyperpolarisation 3.35-T. Quand un hyperpolarisation clinique 7-T est utilisé, la méglumine gadotérate est pas nécessaire parce que, à un champ magnétique plus élevé, ses avantages sont négligeables. L'ajout d'un agent de contraste à base de gadolinium augmente la polarisation possible à l'état solide et aussi le taux de polarisation. Cependant, dans l'état liquide, l'agent de contraste raccourcit le temps de relaxation T 1.
2. Croissance de la culture cellulaire
- cultiver des cellules PC3 dans un flacon de culture avec une zone de 2 125 cm croissance. Utiliser milieu F-12K contenant 10% de sérum de foetus de veau (FCS) et de maintenir les cellules à 37 ° C dans une atmosphère humidifiée à 5% de CO 2. Avant l'étape de dissolution, de retirer le milieu du flacon de culture.
NOTE: Chaque lignée cellulaire nécessite un protocole de préparation particulière pour la propagation des cellules. Consultez les exigences avec le fournisseur de lignée cellulaire.
3. Préparation des cellules pour l'expérimentation
- Retirer le milieu cellulaire et laver les cellules avec ~ 10 mL de solution saline tamponnée au phosphate (PBS).
- Ajouter 5 ml de trypsine dans la fiole et le retour des flacons de culture de cellules dans l'incubateur pendant 3 à 5 min.
- Ajouter ~ 5 mL de milieu F-12K pour désactiver la trypsine.
- Compter les cellules à l'aide d'un compteur automatique de cellules. Mélanger 10 ul de la solution cellulaire avec 10 ul de la solution de colorant. Mélangez bien avec la pipette et transférer 10 pi du mélange dans echambre de e d'un "verre de comptage".
- Retirez et compter les cellules dans le flacon (s). Transférer les volumes appropriés contenant le nombre souhaité de cellules (par exemple, 5 x 10 6 à 10 8) dans des flacons en plastique.
- Centrifuger les cellules à 1200 xg pendant 5 minutes et jeter le surnageant.
- Resuspendre les cellules dans le milieu F-12K contenant 10% de FCS jusqu'à un volume total de 800 pi et de les transférer dans une cuvette de réaction (2 ml). Placer la coupelle de réaction dans un flacon en plastique rempli d'eau chaude.
4. Dissolution Agent Préparation
REMARQUE: L'agent de dissolution est un liquide qui est utilisé pour dissoudre l'échantillon hyperpolarisé. Dans les applications biologiques, la dissolution est généralement réalisée par H à base d'O 2 ou de l' oxyde de deutérium (D 2 O) des tampons à base, comme le PBS ou le tris (hydroxyméthyl) aminométhane (Tris), contenant de l' acide éthylènediaminetétraacétique 1 g / L (EDTA).
- Preparation de tampon / L PBS 20 mmol
- Pour préparer 100 ml de l'agent de dissolution, on dissout 36 mg de phosphate monosodique (NaH 2 PO 4), 247 mg de phosphate disodique (Na 2 HPO 4) et 10 mg d'EDTA dans une solution d'hydroxyde / L de sodium 20 mmol ( NaOH) dans D 2 O. Mix correctement jusqu'à dissolution complète.
NOTE: EDTA (1 g / L) est ajouté au tampon pour éliminer les ions ferromagnétiques possibles, qui peuvent gâcher l'hyperpolarisation. L'on utilise du NaOH pour neutraliser l'acide pyruvique dans un rapport 1: 1 mole pour atteindre un pH de 7,4.
- Pour préparer 100 ml de l'agent de dissolution, on dissout 36 mg de phosphate monosodique (NaH 2 PO 4), 247 mg de phosphate disodique (Na 2 HPO 4) et 10 mg d'EDTA dans une solution d'hydroxyde / L de sodium 20 mmol ( NaOH) dans D 2 O. Mix correctement jusqu'à dissolution complète.
5. Variable Température Insérer (VTI) Cooldown
- Dans la fenêtre principale programme de polariseur DNP-RMN, cliquez sur "Cooldown."
NOTE: Ceci commute sur la pompe à vide et évacue le VTI à environ 5,0 mbar. Par la suite, la soupape à aiguille entre le VTI et le réservoir d'hélium liquide complètement ouvert, permettant à l'hélium liquide à circuler dans le VTI. Le débit est regulated par la soupape à pointeau afin de maintenir la quantité optimale de l'hélium liquide dans le VTI jusqu'à ce qu'il atteigne la température d'ébullition de l'hélium. Ensuite, le VTI est mis sous vide à un vide presque complet et que la température atteigne environ 1,4 K. La VTI est rempli de liquide d'hélium jusqu'à 65%. À ce moment, l'instrument est prêt pour l'insertion de l'échantillon.
6. Préparation d'échantillons et d'insertion
- En utilisant une micropipette, ajouter ~ 8 pi de 13 C marqué solution échantillon de bouillon dans une tasse en plastique.
- Fixez le gobelet en plastique à la tige d'insertion et de lancer le processus d'insertion de l'échantillon en appuyant sur "Insérer échantillon" dans la fenêtre principale du programme. Sélectionnez "échantillon normal" et cliquez sur "Continuer".
NOTE: Au cours de ce processus, la soupape à pointeau se ferme d'abord arrêter l'écoulement de l'hélium liquide dans VTI, et la pression dans le VTI augmente alors. Le porte-échantillon à l'intérieur de la VTI est élevée de l'hélium liquide, la soupape d'admissiondans la partie supérieure de l'ouverture VTI, et un flux d'hélium gazeux est introduit à partir de la soupape d'admission afin d'éviter toute contamination extérieure par l'humidité de l'air. - Lorsque vous êtes invité, pousser la tige d'insertion avec le gobelet en plastique attaché vers le bas dans le VTI. Assurez-vous d'atteindre le support d'échantillon au fond du VTI. Sinon, l'hélium gazeux peut pousser l'échantillon de la VTI.
- Détacher et retirer la tige d'insertion.
- Terminez la procédure en cliquant sur "Suivant" dans la fenêtre de dialogue. La procédure d'insertion de l'échantillon ne devrait pas prendre plus de 10 s.
REMARQUE: La soupape d'admission se ferme ensuite, le flux d'hélium gazeux est interrompue, le porte-échantillon avec la coupelle d'échantillon est immergé dans l'hélium liquide, et la soupape à pointeau est ouverte pour permettre à l'hélium liquide à circuler dans le VTI. Au bout de 5 - 10 min, le VTI est refroidi au-dessous de 1,4 K, ce qui permet tous les électrons libres polarisée. - Assurez-vous que le gobelet en plastique avec l'échantillon a été introduit correctement dans le VTI en vérifiant tle chapeau est pas attaché à la tige d'insertion ou poussée hors du VTI par de l'hélium gazeux. Puis cliquez sur "Terminer".
7. Micro-ondes Sweep (en option)
NOTE: Un balayage de micro - ondes permet de déterminer la fréquence des micro - ondes optimale pour maximiser le taux des 13 noyaux de carbone dans le composé cible d'hyperpolarisation.
- Pour mesurer le balayage de micro-ondes, démarrez le programme RINMR, tapez "HYPERSENSENMR," et cliquez sur "Sélectionner Config" et "Do Microsweep."
- Pour lancer le processus, sélectionnez l'onglet "calibrer" dans la fenêtre principale du programme.
- Cliquez sur "Générer" et choisissez le début et la fréquence de fin (par exemple, 94.100 GHz-94.200 GHz), la taille de pas de fréquence (par exemple, 20 MHz), la puissance (100 mW), et le temps (60 s). Cliquez sur "Continuer", "Activer" et "Démarrer".
NOTE: Avec ces paramètres, l'hyperpolariseur polarise d'abord l'échantillonpendant 60 s en utilisant une fréquence micro-ondes de 94.100 GHz et une puissance de 100 mW. Ensuite, il applique une impulsion à 90 ° par radiofréquence (RF) et acquiert le signal hyperpolarisé 13 C à l' aide du spectromètre intégré. Ces étapes sont répétées pour chaque étape dans la gamme de fréquence spécifiée. Pour hyperpolarisation ultérieure, choisissez la fréquence des micro-ondes avec l'amplitude maximale du signal mesuré.
8. polarisation
- Pour mesurer la polarisation build-up, lancer le programme RINMR, tapez "HYPERSENSENMR," et cliquez sur "Sélectionner Config" et "Solid Build-up."
- Dans la fenêtre principale programme de polariseur DNP-RMN, cliquez sur "Polarisation" pour lancer le processus d'hyperpolarisation.
- Choisissez la fréquence optimale de micro - ondes (obtenu lors du balayage de micro - ondes) et la puissance (par exemple, 100 mW) pour l'échantillon et cliquez sur "Suivant".
- Activer "suivi build-up Polarisation" et cliquez sur "Terminer".
- Polariser l'échantillon à> 95% (~ 60 min pour [1- 13 C] pyruvate).
NOTE: Au cours de la polarisation, les micro - ondes sont guidées dans le VTI et de l'échantillon, ce qui provoque le 13 C tourne pour aligner les spins d'électrons non appariés hyperpolarisés. Pour mesurer l'accumulation d'hyperpolarisation, des impulsions RF avec un angle de basculement (FA) de 5 ° sont effectués périodiquement (par exemple tous les 300 s), et le signal résultant est tracée comme une courbe de montée en polarisation.
9. Dissolution
- Lorsque la polarisation atteint> 95%, amorcer le processus de dissolution en cliquant sur "Dissolution" dans la fenêtre principale programme de polariseur DNP-RMN.
- Choisissez le processus de dissolution dans le menu déroulant, puis cliquez sur "Suivant".
NOTE: Le polariseur permet de définir le processus de dissolution souhaité en choisissant le moment du gaz de chasse. - Charge ~ 5 ml de l'agent de dissolution par la soupape supérieure dans un récipient chauffé en til dissolution partie du polariseur. Calculer le volume exact de l'agent de dissolution nécessaire en utilisant l'équation suivante:
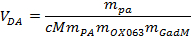
où V DA est le volume utile de l' agent de dissolution, m PA, m OX063 et m Gad sont les masses du pyruvate, OX063 et gadotérate meglumine, respectivement, ajoutés à la solution échantillon de stock. - Placer le bâton de dissolution dans la position active au-dessus de la soupape d'admission.
NOTE: Ceci permet à l'instrument de se connecter son instrumentation de dissolution à la coupelle d'échantillon dans le VTI. - Cliquez sur "Terminer" pour démarrer le processus de dissolution.
REMARQUE: L'agent de dissolution est mis sous pression à 3 bars par de l'hélium gazeux et est ensuite chauffé jusqu'à 200 ° C, ce qui provoque une augmentation de la pression. Lorsque la pression atteint 10 bars, la soupape à pointeau se ferme pour interrompre l'écoulement de l'hélium liquide dans le VTI. Le porte-échantillon soulève la coupede l'hélium liquide. Le bâton de dissolution est descendu dans le VTI et relié à la coupelle d'échantillon. L'agent de dissolution conditionné est poussé par la pression qui résulte de la cuve de chauffage contenant le tampon de dissolution et de l'hélium gazeux, à travers la dissolution de bâton pour la coupe, ce qui provoque une dissolution rapide de l'échantillon. La solution circule ensuite dans le ballon de collecte par l'intermédiaire d'un tube en plastique. Le bâton de dissolution avec la coupe ci-joint est ensuite ressuscité des VTI. - Déplacer le bâton de dissolution avec la coupe attachée à la position "nettoyage" et terminer le processus en cliquant sur "Terminer".
10. La détection du signal 13 C hyperpolarisé
- 13 C spectroscopie par résonance magnétique métabolique in vitro
- Mélanger 200 ul de la 20 mmol / L hyperpolarisé dissous échantillon à partir du flacon de prélèvement avec 800 ul de la solution de cellules.
NOTE: La concentration finale résultantde [1- 13C] pyruvate est de 4 mmol / L. - Mélanger la suspension de puits à l'aide d'une micropipette et le transfert ~ 600 pi dans un tube RMN de 5 mm.
- Insérer le tube RMN de 5 mm dans le spectromètre de RMN 1-T. Dans la fenêtre principale du logiciel, cliquez sur "Exécuter" pour lancer la mesure, l'application de la série de cent 10 ° RF impulsions toutes les 3 s.
REMARQUE: mesurer le temps écoulé entre le mélange initial de l'échantillon hyperpolarisé avec les cellules et le début de l'acquisition spectroscopique. Veiller à ce que la procédure de mélange ne dépasse pas 30 s pour minimiser la perte de polarisation.
- Mélanger 200 ul de la 20 mmol / L hyperpolarisé dissous échantillon à partir du flacon de prélèvement avec 800 ul de la solution de cellules.
- 13 C imagerie par résonance magnétique métabolique
- Pour construire un conteneur pour les expériences in vitro en utilisant le spectromètre IRM, prendre une seringue de 5 ml et le connecter à un cathéter (d = 1,2 mm) qui est assez long pour atteindre iso-centre du spectromètre à la zone d' approche de la spectromètre.
- Remplissez le récipient in vitro avec ela solution e cellulaire de la concentration souhaitée pour l'expérience (par exemple, 10 8) ou avec une solution enzymatique.
- Placer un récipient in vitro à l'isocentre de l'aimant IRM. Placer une bobine de réception radiofréquence 13 C-réglée sur le récipient. Placer un concentré 13 d' étalonnage fantôme C-marqué (par exemple, 10 mol / L 13 C-urée) à proximité.
- Insérez le "conteneur in vitro" à proximité de l'iso-centre du scanner RMN.
- Exécuter la séquence de localisation 3-plan standard du scanner et de régler la position du conteneur in vitro à l'isocentre, selon les besoins.
- Exécuter un 1 H T2-séquence pondérée "anatomique" couvrant in vitro contenant la localisation dans. Utilisez les paramètres suivants: 2D écho de spin avec une orientation axiale, temps de répétition (TR) = 2.000 ms, temps d' écho (TE) = 20 ms, tranche épaisseur = 1 mm, champ de vision couvrant le récipient in vitro, et16 échos par excitation. Veiller à ce que le terrain shimming se fait sur des protons lors de cette étape.
- Dans les images anatomiques, sélectionnez 5 tranches contiguës centrées sur la région d'intérêt. Prescrire une acquisition d'étalonnage spectroscopique 13 C couvrant les tranches anatomiques sélectionnés. Utilisez les paramètres suivants: séquence d'étalonnage 2D Block-Siegert avec une orientation axiale 12 x 12 centric codé, TR = 1000 ms, épaisseur de coupe = 5 mm, champ de vision correspondant à des images anatomiques, nombre de balayages (NS) = 64, la bande passante = 5000 Hz et FA = 90 °.
- Sélectionnez la séquence d'étalonnage spectroscopique 13 C (pour plus d' informations, voir Schulte et al. , 2011) 75 de la bibliothèque de séquences d'impulsions. Télécharger la séquence d'impulsions pour le scanner de l'ordinateur en cliquant sur "Télécharger". Cliquez sur "Spectra Prescan" pour exécuter le préscan spectroscopique. Dans la parcelle de magnitude du spectre, régler le pic du 13 C calibration fantôme du center de la fréquence du scanner. Définissez les gains du récepteur au maximum. Cliquez sur "Démarrer" pour lancer la séquence d'étalonnage spectroscopique 13 C. Notez le gain d'émission rapporté et la fréquence centrée.
- Définir une acquisition 13 C imagerie de déplacement chimique (CSI) couvrant les tranches anatomiques sélectionnés. Utilisez les paramètres suivants: 2D écho-planaire imagerie spectroscopique (EPSI) avec une orientation axiale 12 x 12 centric codé, TR = 400 ms, épaisseur de coupe = 5 mm, champ de vision correspondant à des images anatomiques, NS = 300, et la bande passante = 5000 Hz .
NOTE: Les échantillons de EPSI une seule ligne dans l'espace k de manière répétée après une excitation RF d'acquérir à la fois des informations spatiales et spectrales simultanément. Pour plus d' informations sur les techniques d'acquisition, voir l'article de Durst et al. 2015 76. - Télécharger la séquence 13 C CSI et exécuter le préscan spectroscopique. Ajuster la fréquence de balayage et transmettre le gain spécifié par la séquence d'étalonnagesortie.
- Après que la solution hyperpolarisé est déposé dans le flacon de collecte, établit ~ 3 ml dans une seringue, puis l' injecter dans le cathéter relié au récipient in vitro. Lancement de l'acquisition. Après l'acquisition est terminée, enregistrez le fichier de données brutes pour la reconstruction ultérieure.
Reconstruction 11. Données
- Appliquer l'une des deux modèles cinétiques décrites pour analyser les données acquises.
- Dans la première méthode pour décrire la cinétique de la LDH, de la valeur cinétique (k), comparer la somme du signal de lactate (M BAC) au signal de toutes les molécules hyperpolarisés (M x) 21,77.
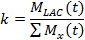
- Dans l'autre méthode, mesurer le lactate et pyruvate signaux dans le temps et adapter ceux - ci à un modèle cinétique 17,25,71. Pour résoudre le taux de change métabolique, k PA → LAC, et efficacetaux de décroissance du signal de lactate, r LAC, utiliser les équations différentielles linéaires suivantes à l' aide du modèle d' échange différentiel à deux sites, ce qui donne pour le lactate:
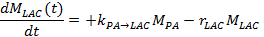
- Dans la première méthode pour décrire la cinétique de la LDH, de la valeur cinétique (k), comparer la somme du signal de lactate (M BAC) au signal de toutes les molécules hyperpolarisés (M x) 21,77.
Note: Le signal de lactate taux de décroissance r LAC efficace dépend du temps de relaxation longitudinale lactate (T 1, BAC), le taux de change métabolique opposé de lactate en pyruvate k LAC → PA, la FA appliquée et TR, et l'intensité du signal de pyruvate (M PA) et de lactate (M BAC), en tenant compte de la réduction du signal irréversible après chaque excitation successive: 
Par conséquent, r BAC se traduit par un seul terme, inséparable de la décroissance du signal. Étant donné qu'il est possible de corriger til retourner angle et le temps de répétition, et même si il y a un flux LAC → PA, nous supposons que le taux de lactate en pyruvate (k LAC → PA) d'échange n'a pas besoin d'être inclus dans le calcul, sur la base des résultats de Harrison et al. 2012 78. Leurs résultats montrent que le k LAC → PA ne joue pas un rôle aussi crucial que l' on peut supposer. Ce mode permet au T 1 temps de relaxation du lactate à quantifier. Ce modèle est indépendant de l' administration du pyruvate à la mesure, ce qui, dans le cas des expérimentations in vitro, est pas cruciale et peut être négligée. Il, cependant, jouent un rôle important pour les mesures in vivo 79.
Résultats
Les résultats du "coup de balai à micro - ondes" sont illustrés sur la figure 3. Elle montre que la fréquence des micro - ondes optimale pour la [1- 13C] pyruvate échantillon est à 94,156 GHz pour le 3,35-T hyperpolariseur locale. Toutes les expériences de l'hyperpolarisation suivante (n = 14) ont été effectuées en utilisant cette fréquence de micro-ondes d'une puissance de 100 mW. L'irradiation par micro-ondes a été appliqué pendant 60 à 80 min, ce qui conduit à une hyperpolarisation à l'état solide supérieur à 90%. Les résultats sont présentés sur la figure 4. Pyruvate hyperpolarisé [13 C] a été mélangée avec 5 x 10 6 (n = 2), 10 7 (n = 2), 2 x 10 7 (n = 1), 3 × 10 7 (n = 2), 4 × 10 7 (n = 1), 6 × 10 7 (n = 2), 8 × 10 7 (n = 2), et 10 8 (n = 1) , du cancer de la prostate , une lignée cellulaire PC3.
Les données obtenues sont résumées dans la Figure 5 Et la figure 6. Les données acquises avec une résolution spectrale et temporelle sont représentés sur la figure 5A-D et la figure 6A-D, avec seulement une résolution temporelle pour chaque molécule observée (figure 5E-H et la figure 6E-H), et avec seulement une résolution spectrale (figure 5I -L et Figure 5I-L). Nous avons observé trois grands signaux hyperpolarisés représentant [1- 13 C] pyruvate, [1- 13 C] pyruvate hydrate, et [1- 13 C] lactate, avec des déplacements chimiques à 173 ppm, 181 ppm et 185 ppm, environ par rapport à l'acide triméthylsilyl propanoïque (TMSP) à pH 7,4 et une température de 20 ° C. Les ratios de signal entre les trois métabolites sont résumés dans le tableau 1. Les données montrent une nette corrélation entre le signal de lactate et le nombre de cellules présentes dans l'échantillon (figure 7). Cependant, les résultatsdes expériences avec moins de 2 × 10 7 cellules présentent écart significatif, probablement due à un faible rapport signal-bruit. Par conséquent, nous vous suggérons d'utiliser plus de cellules que cela pour d'autres expériences. Lorsque le signal de lactate par rapport (valeur cinétique) est normalisé par le nombre de cellules (figure 8), cela démontre clairement l' absorption et le métabolisme similaire dans l' ensemble des cellules. Cependant, il existe une tendance à la diminution de la production de lactate par cellule avec un nombre croissant de cellules. Nous croyons que l'une des causes de la diminution de l'activité métabolique cellulaire est une très forte concentration de cellules dans un volume très faible, ce qui entraîne une augmentation de la viscosité de l'échantillon. Les résultats du modèle d' échange différentiel à deux sites sont résumés dans le tableau 2 et représentés sur la figure 9. Les données suivent une tendance similaire au modèle précédent: augmentation de k PA → LAC avec un nombre croissant de cellules. Toutefois, ce modèle entraînes à une augmentation abrupte de la cinétique avec le nombre de cellules. Lorsque le taux de change métabolique k PA → LAC est normalisée au nombre de cellules, nous pouvons encore voir une nette tendance à la diminution de k PA → LAC avec un nombre croissant de cellules (figure 10).
La figure 11 montre la possibilité de l'addition de la localisation spatiale de l'expérience. Elle montre un spectre injecté avec 80 mmol / L hyperpolarisé [1- 13C] pyruvate à côté d'un 10 mol / L 13 C-urée fantôme. La technique permet la réalisation d'un spectre avec une résolution temporelle et spéciale (Figure 11A) ou de la décroissance du signal des signaux de métabolites choisis dans le temps (Figure 11B). Les spectres dans le domaine temporel peut également être additionnées pour obtenir un meilleur rapport (Figure 11C) signal-bruit. La résolution spéciale permet le choix de la région de fréquence o désiréef spectre 13 C appartenant à certains métabolites, tels que [1- 13C] pyruvate (figure 11D), [1- 13C] pyruvate d' hydrate (figure 11E), ou de référence 13 C-urée (figure 11F). Elle peut être co-enregistrée avec une image 1 H. La séquence d'impulsions utilisée (EPSI) permet l'acquisition d'une image de l'ensemble tranche toutes les 4,9 s. En résumé, cette technique peut fournir des données avec une résolution spatiale, temporelle et spectrale de tout métabolite.

Figure 3: Résultats d'un balayage de micro - ondes avec [1- 13 C] pyruvate à la section locale 3.35-T polarisante. Le résultat des mesures qui déterminent la fréquence des micro - ondes optimale pour maximiser le taux de 13 noyaux de C hyperpolarisation dans le composé de [1- 13C] pyruvate cible. Le balayage de micro-ondes a une forme d'une absorption EPRspectre. La forme et la séparation des pics sont basés sur le radical utilisé (dans ce cas, le radical trityle), et la plus grande influence ont un effet solide et mélange thermique. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4: Solide Accumulation Etat Polarisation d'un [1- 13 C] pyruvate échantillon. Une moyenne de n = 13 polarisation à l'état solide concrétionnements avec l'erreur représentée par l'écart-type mesuré toutes les 300 s pour un maximum de 4,500 s. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5: Résultats de la 13C - NMR Spectroscopy pour le nombre de cellules (5 x 10 6 à 3 x 10 7 cellules). Les données acquises tracées avec une résolution spectrale et temporelle (AD), tracé avec une résolution temporelle seulement pour [1- 13 C] pyruvate, [1- 13 C] pyruvate hydrate, et [1- 13 C] lactate (EH), et tracés avec une résolution spectrale seulement, résumant toutes les étapes de temps (IL). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 6: Résultats de la 13C - NMR Spectroscopy pour le nombre de cellules (4 x 10 7 à 1 x 10 8 cellules). Les données acquises tracées avec une résolution spectrale et temporelle ( AD), tracée avec une résolution temporelle seulement pour [1- 13 C] pyruvate, [1- 13 C] pyruvate hydrate, et [1- 13 C] lactate (EH), et tracée avec une résolution spectrale seulement, résumant toutes les étapes du temps (IL). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
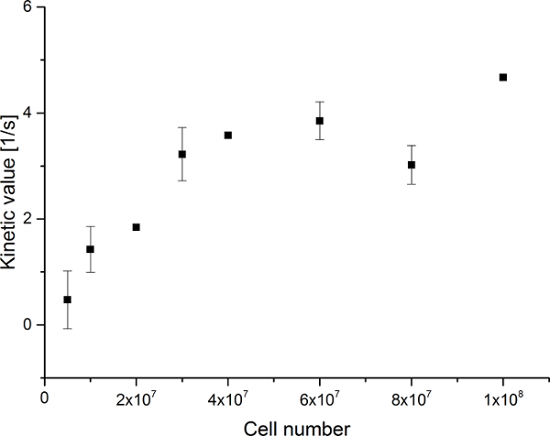
Figure 7: Résultats du Ratio de Métabolite Simple Kinetic Modeling. Les données représentent le rapport entre le [1- 13C] Signal de lactate à la somme de [1- 13C] pyruvate [1- 13C] pyruvate d' hydrate, et [1- 13C] lactate en fonction du nombre de cellules dans la expériences. L'erreur représente l'écart-type. Plocation cliquez ici pour voir une version plus grande de cette figure.
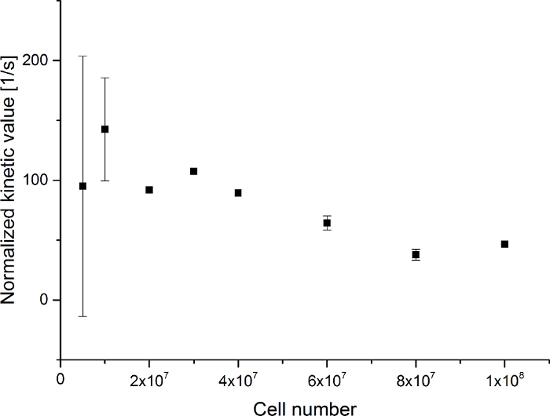
Figure 8: Résultats du Ratio de Métabolite Simple Kinetic Modeling Normalized au nombre de cellules. Les données représentent le rapport entre le [1- 13C] Signal de lactate à la somme de [1- 13C] pyruvate [1- 13C] pyruvate d' hydrate, et [1- 13C] lactate normalisée par rapport au nombre de cellules par rapport au nombre de cellules dans les expériences. L'erreur représente l'écart-type. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 9: Résultats de la Two-site Exchange différentiel Modèle. La rééd de données ESENT le taux de change métabolique (k PA → BAC) par rapport au nombre de cellules dans les expériences. L'erreur représente l'écart-type. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 10: Résultats de la Two-site Exchange différentiel Modèle normalisé au nombre de cellules. Les données représentent le taux d'échange métabolique (k → PA BAC) normalisé par rapport au nombre de cellules par rapport au nombre de cellules dans les expériences. L'erreur représente l'écart-type. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 11: Résultat d'imagerie par résonance magnétique de l'hyperpolarisé [1- 13 C] pyruvate Probe. A) Le spectre acquis sur l'ensemble tranche et toutes les mesures de temps. B) La décroissance de la [1- 13 C] pyruvate et [1- 13 C] signal de l' hydrate de pyruvate au fil du temps. Le troisième signal est le C-urée référence 10 M 13 localisation. C) Le spectre acquis de l'ensemble de la résolution spatiale et temporelle. D) L'image 1 H superposé à l'image 13 C du [1- 13C] pyruvate signal sommé sur tous les intervalles de temps. E) L'image 1 H superposé à l'image 13 C du [1- 13C] pyruvate signal additionné d'hydrate sur l' ensemble des pas de temps. L'image 1 H superposée avec le F) 13 C image du signal sommé 13C-urée sur tous les intervalles de temps (de référence). 13 C-CE signal est normalisé par rapport au maximum du signal du métabolite spécifique. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Numéro de téléphone | ||||||||
| 5 × 10 6 (n = 2) | 10 7 (n = 2) | 2 × 10 7 (n = 1) | 3 × 10 7 (n = 2) | 4 × 10 7 (n = 1) | 6 × 10 7 (n = 2) | 8 × 10 7 (n = 2) | 10 8 (n = 1) | |
| [1- 13C] pyruvate | 92,9 ± 1,4 | 91,7 ± 1,0 | 86,7 | 77,5 ± 2,7 | 76 | 69,7 ± 0,5 | 65,9 ± 3,7 | 42,9 |
| [1- 13C] pyruvate hydrate | 6,8 ± 1,2 | 6,7 ± 1,6 | 9.5 | 10,1 ± 1,8 | 8.9 | 7,7 ± 1,5 | 10,4 ± 0,2 | 13.4 |
| [1- 13C] lactate | 0,3 ± 0,3 | 1,6 ± 0,6 | 3.8 | 12,4 ± 4,5 | 15.1 | 22,5 ± 1,1 | 23,7 ± 3,5 | 43,7 |
Tableau 1: Le taux relatif de hyperpolarisé Métabolites par rapport au nombre différent de cellules.
Numéro de téléphone 5 × 10 6 (n = 2) 10 7 (n = 2) 2 × 10 7 (n = 1) 3 × 10 7 (n = 1) 4 × 10 7 (n = 1) 6 × 10 7 (n = 2) 8 × 10 7 (n = 2) 10 8 (n = 1) k PA → LAC [* 10 -4] 0,924 ± 0,870 4,984 ± 1,19 15.135 36,289 58,904 112,174 ± 10,491 114,3 ± 37,059 349,234Tableau 2:Résultats du modèle d' échange différentiel à deux sites.
Discussion
13 CMRSI avec des sondes hyperpolarisé est un procédé prometteur pour surveiller en temps réel le métabolisme in vitro et in vivo. Un aspect très important lors de l' utilisation de ce processus expérimental est la normalisation appropriée, en particulier en ce qui concerne les expériences in vitro. Tout d'abord, la préparation de l'échantillon doit être effectué correctement et uniformément pour obtenir la même concentration en matériau hyperpolarisé dans chaque expérience. Cela nécessite un pesage précis à la fois de l'échantillon à hyperpolarisé et tampon. Si la concentration est incorrect, le pH final de la solution est imprécise, ce qui peut avoir une influence sur T 1 et les réponses des cellules. Il est également crucial de traiter les cellules aussi uniforme que possible. Les cellules doivent toujours être préparés de telle manière qu'il y ait un minimum de retard entre la récolte des cellules et l'expérience suivante afin de réduire au minimum la durée du temps, les cellules sont maintenues à un niveau très élevé concntration et faible volume. La variation dans le protocole de préparation de cellules, comme un des temps de préparation ou de température pourrait entraîner des variations importantes dans les données obtenues. Le mélange de l'échantillon avec les cellules doivent également être normalisées. Il est important de mesurer le temps écoulé entre les additions du traceur à la suspension cellulaire et le début de la mesure, car cela peut varier; lors de l'analyse de données, cela devrait être considéré.
Le bon choix de l'analyse des données et de la modélisation cinétique est crucial dans l'interprétation des données acquises. Le modèle simple est adapté à une réaction d'une manière linéaire, avec un taux de deux métabolites de change constant. Comme cela est décrit dans l'introduction, le pyruvate subit plusieurs réactions enzymatiques et, plus important encore, elle subit également une réaction réversible d'échange non enzymatique pyruvate hydrate. Cette réaction a joué un rôle crucial dans les expériences, et son effet est bien démontré in l'expérience avec 8 × 10 7 cellules. Bien que le tableau 1 indique que la concentration relative pyruvate de l' hydrate est similaire à d' autres expériences, si elle était étroitement étudiée sur la figure 6D, on représente un signal beaucoup plus élevé pyruvate de l' hydrate , au début de l'expérience comparée aux autres expériences. Cependant, lorsque la résolution temporelle est résumée, cette information importante est perdue et provoque une erreur dans la reconstitution des données. D'autre part, le modèle d'échange différentiel à deux sites est une description plus robuste et précise de la cinétique, car il comprend la résolution temporelle dans le calcul. Ainsi, il comprend l'échange non enzymatique avec de l'hydrate pyruvate, même si elle échange rapide avec du pyruvate pendant la mesure.
Il existe diverses stratégies d'imagerie à choisir entre d'observer le signal hyperpolarisé ou de suivre le métabolisme d'une molécule hyperpolarisé dans preclinical et des études cliniques. Durst et al. démontré les avantages et les inconvénients de différentes impulsions sequnces 76. La séquence d'imagerie de déplacement chimique induction de décroissance libre (FIDCSI) est relativement robuste mais a une utilité limitée pour multi-coupes et de l'imagerie temporellement résolue. Echo-planaire imagerie spectroscopique (EPSI) est robuste pour les questions de gradient et hors résonance effets, mais elle est sujette à des artefacts de reconstruction. La décomposition itérative de l' eau et la graisse avec l' estimation d' écho asymétrique et des moindres carrés (IDEAL) 81, spirale imagerie de déplacement chimique (ISPCSI), séquence d'impulsions 35, et l' imagerie par déplacement chimique spirale (SPCSI) ont des rendements élevés d'encodage , mais sont sensibles à B 0 inhomogénéité. Le choix de la séquence dépendra des caractéristiques du scanner, la question biologique, et le système étudié.
Il y a beaucoup de conditions qui doivent être remplies pour que hyperpolarisation réussie. Cependant, le tvoici également plusieurs limitations que la 13 technique CMRSI hyperpolarisé est confrontée de nos jours. La première limite est inchangeable et T 1 en un temps de relaxation du noyau 13 C dans la molécule, qui définit la quantité de signal détectable est disponible au moment précis de la mesure. Le signal est abaissé par chaque excitation RF qui provoque une perte du signal d'hyperpolarisation de manière répétée lors de l'acquisition des données. Une autre limitation est la période de temps relativement longue qui est nécessaire pour hyperpolariser une molécule. Ceci prend généralement entre 30 et 90 min.
Par rapport aux autres techniques d'imagerie, telles que la molécule [18 F] FDG PET hyperpolarisé CMRSI 13 ne nécessite pas de tumeurs avec une augmentation des voies métaboliques de la glycolyse et , par conséquent, une augmentation de la consommation de glucose. Cette technique présente un véritable flux métabolique en temps réel. D'autre part, [18 F] FDG PET ne donne pas d' informations directes surmétabolisme, mais seulement des informations indirectes sur l'accumulation dans la zone métaboliquement active. Cela pourrait provoquer un faux résultat négatif, où la tumeur semble être métaboliquement inactive, mais est en fait en utilisant différentes voies métaboliques, tels que glutaminolysis, comme source de carbone pour la prolifération.
En conclusion, la dissolution DNP peut être utilisé dans une variété d'applications pour étudier une liste illimitée des maladies (comme le diabète) 82, mesurer le pH 15,36,45, ou de surveiller les changements métaboliques dans divers types de cancer. Ces mesures peuvent être réalisées à différents niveaux, à partir des expériences de cellules in vitro, par des études précliniques utilisant des modèles animaux (tels que les souris, les rats, les lapins, les cochons et les chiens), au cours des dernières études cliniques humaines 57. Les futures applications cliniques disposent d'un outil de diagnostic très puissant et non invasif qui pourrait non seulement détecter et localiser la maladie, mais aussi permettre l'observation du traitementréponse en temps réel 83.
Déclarations de divulgation
Rolf F. Schulte and Marion I. Menzel are employed with GE Global Research.
Remerciements
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, "Imaging for Selection, Monitoring, and Individualization of Cancer Therapies."
matériels
| Name | Company | Catalog Number | Comments |
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid - 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
Références
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in't Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine - investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth's magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. - A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon