Method Article
超极化
* 这些作者具有相同的贡献
摘要
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
摘要
在过去的几十年里,肿瘤分期,再分期,治疗反应的监测,以及多种癌症复发的检测新方法已经出现连同18架F-氟([18 F在国家的最先进的正电子发射断层扫描] -FDG PET)。 13 C核磁共振光谱成像(13 CMRSI)是一种微创成像方法,能够代谢的体内和实时监控。作为与基于13 C核磁共振(NMR)的任何其他方法,它面临低热极化和随后的低信噪比的挑战,因为在13℃和其低天然丰度的相对低的旋磁比生物样品。通过克服这些限制,动态核极化(DNP)与随后的样品溶解最近启用常用NMR和磁共振成像(MRI)系统来测量在各种生物系统的研究中,以及图像关键代谢途径。在13 CMRSI使用一个特别有趣的和有希望的分子是[1- 13 C]丙酮酸盐,其中,在过去的十年里,已被广泛用于体外 ,临床前,以及最近,临床研究调查细胞的能量代谢在癌症和其他疾病。在这篇文章中,我们使用的是3.35牛逼临床DNP超极化勾勒溶解DNP的技术,并展示在体外研究它的用法。类似的协议为超极化可以适用于在体内研究的大部分为好。要做到这一点,我们使用乳酸脱氢酶(LDH)和催化[1- 13 C]丙酮酸使用13 CMRSI [1- 13 C]乳酸盐在前列腺癌细胞系,PC3, 体外代谢反应。
引言
目前,为肿瘤分期,再分期,治疗反应监测,复发的检测多种癌症的最广泛使用的临床方法是[18 F] -FDG的PET。 [1]然而,最近,一些新颖的方式和其他方式已经出现。其中的一个方法是13 CMRSI。该技术包括引入13 C-分子成的生物样品,接着微创MRI评估在体外或在实时体内的代谢。尽管如此,13 CMRSI的最大的挑战,相对于其他方法,如[18 F] -FDG的PET或计算机断层扫描,是它的低信噪比。
NMR信号成正比偏振在两个能态的自旋1/2核人口差与总人口的比例( 图1A)的水平。偏振是第一个产品细胞核电子旋磁比(γ)和在温度所施加的磁场强度。的1 H核的典型极化是在0.001%至0.005%的顺序在3 T,它给出了一个相对较差的信噪比。今天的国家的最先进的MRI是一个成功的成像方法,不仅是因为高丰1小时生物样品中和1小时的高旋磁比(γ= 1H兆赫42.576 / T)。然而,观察其他核,如碳,更苛刻。唯一稳定的,磁活性碳同位素,13℃,只占1.1%的所有碳原子。此外,13℃(γ13C = 10.705兆赫/ T)的旋磁比大于1小时的低四倍,从而导致更低的检测效率。总之,低13 C丰度和低γ13C引起热13 C测量来实现的一个1的灵敏度的0.0176%H-NMR测定体内 。
动态核极化
克服13 C测量相对较差的灵敏度的方法是DNP。它是由阿尔伯特·W·欧沃豪斯对金属的最初描述于1953年。在他的文章中,他指出:"这表明,如果传导电子的电子自旋共振是饱和的,细胞核将被极化,以相同的程度,如果他们的旋磁比为使电子自旋的,他们将是"2后来那年,卡弗和Slichter实验证实的Overhauser的假设3。 1958年,Abragam和宝洁描述了这种效应在液体电子和它命名为"坚实的效果。"在温度低于4 K,电子自旋极化达到近100%,是大小比核自旋极化( 图1B)4更高的超过三个数量级。 ŧ发生了由于电子的旋磁比(γE = 28024.944兆赫/ T)为大小比核旋磁比更高的三个数量级。电子和原子核,如Overhauser效应,固体效果,交叉效果,热混合效果之间的弱相互作用,允许极化的传递使用微波照射以频率靠近相应的电子从电子自旋核自旋顺磁共振(EPR)频率5,6。 DNP理论得到了进一步发展涉及到更多的电子和热混合。然而,迄今为止,DNP的不统一的量化理论描述已发表7,8。
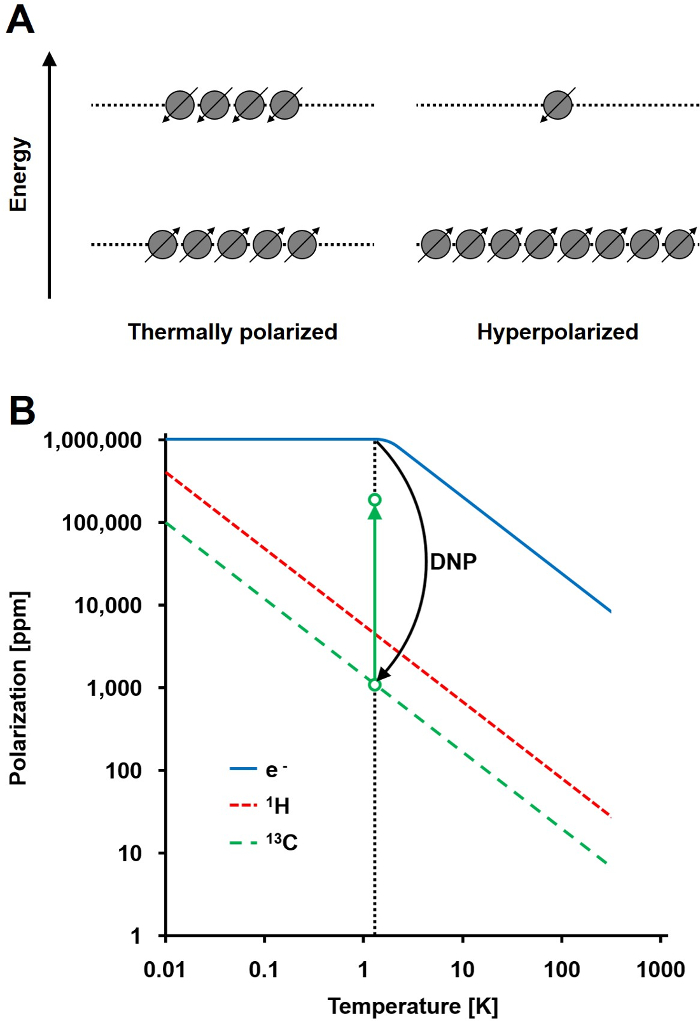
图1:了解动态核极化和超极化。 A)自旋人口的示意图对比在热平衡偏振状态和超极化的状态。 B)中的偏振取决于温度。 (E - )的电子的极化达到低于1.4 K的DNP 100%允许偏振从电子到13 C核,这增加了它们的偏振高达10 5倍的转移。 请点击此处查看该图的放大版本。
在使用13 C-NMR生物系统的研究介绍DNP,随后快速样品溶解已被开发。 50年代以后的Overhauser的假设,扬H. Ardenkjaer拉森等人。解决使超极化冷冻样品到液体状态以最小的超极化损失6的技术上具有挑战性的问题。解散DNP打开一个新的研究领域被称为13 CMRS我,提供了新的方法来研究和描述各种疾病状态9,10。不成对电子,三苯甲基自由基三(8-羧基-2,2,6,6-四(羟基乙基)-benzo- [1,2-4,5] - 双 - (1,3),作为稳定的载体-dithiole -4-基)盐 - 甲基钠(OX063)或(2,2,6,6-四甲基哌啶-1-基)氧基(TEMPO)通常被使用。这些都与期望的13 C标记的分子混合并暴露于微波辐射与接近相应的EPR频率的频率。使用这种技术的13 C核的极化可以增加高达37%11。这导致了10 5倍极化增强相比,热平衡极化11,12。然而,只要在微波辐射停止和/或13 C-分子转移到液体状态,极化与已偏振的13 C核的纵向弛豫时间(T 1)衰减。因此,该快速溶解技术发明或任何后续技术缩短实验测量( 即注射)之前是生物应用13关键的时间。
有迹象表明,候选分子需要满足成功13 CMRSI研究三大要求。第一,所关心的13 C核必须具有足够长的T 1(> 10秒)。的13 C-标签的选择是至关重要的。最佳候选细胞核碳经由键用1 H-细胞核没有直接接触。它也需要在2被迅速代谢- 3个T 1次,导致下游代谢产物与从原始物质的显著不同的化学位移。样品混合物还必须形成无定形固体状态时玻璃,使得空间分布减小电子和13 C之间的距离,从而使反两极分化的外汇储备。如果候选分子不自然地形成非晶化玻璃,它需要在装配玻璃剂高度可溶的,如甘油或二甲基亚砜14。这些要求导致相对小数目的候选分子。然而,即使是合适的分子的成功发现后,开发工作的协议为超极化可以是技术上具有挑战性9,14,15。
近年来,一些衬底已成功偏振光,如[1- 13 C]丙酮酸12,16 - 36,[2- 13 C]丙酮酸37,[1- 13 C]丙酮酸乙酯38,[1- 13 C ]乳酸39,[1- 13 C]富马酸40 - 43,13 C-碳酸氢盐36,44,45,[1- 13 C]乙酸钠43,46 - 49,13 C尿素6,36,50,51 ,[5- 13 C] glutamiNE 15,52,53,[1- 13 C]谷氨酸53,54,[1- 13 C] 2-酮戊二酸55,[1- 13 C]丙氨酸,和其他人14,56。对于超极化一个特别有趣的和常用的基材是[1- 13 C]丙酮酸盐。它被广泛用于临床前研究以调查在各种疾病14,17,22细胞能量代谢。 [1- 13 C]丙酮酸满足所有成功超极化的要求,包括随后被代谢前穿过细胞膜相对长T 1和快速运输。用[1- 13 C]丙酮酸临床前研究,目前正在翻译成诊所57。
丙酮酸代谢
众所周知,有一种癌细胞的DNA,并在其代谢途径变化突变之间的直接联系。早在20世纪20年代,奥托华宝discovERED有葡萄糖和生产乳酸的肿瘤中增加的代谢相比健康组织58 - 60。接着,在其他代谢途径,如戊糖磷酸途径,三羧酸循环,氧化磷酸化,和核苷酸和脂类的合成各种替换,已经描述。
丙酮酸是糖酵解的终产物。在肿瘤,它经历由乳酸脱氢酶61催化的无氧酵解和与辅酶烟酰胺腺嘌呤二核苷酸的还原形式反应 (NADH),产生乳酸和辅酶(NAD +)的氧化形式。可替代地,丙酮酸经过与谷氨酸以形成丙氨酸氨基转移反应,由丙氨酸转氨酶(ALT)的催化。这两种反应是可逆的。丙酮酸也经历脱羧通过丙酮酸脱氢酶(PDH)催化二氧化碳和乙酰-CoA河epresenting在该步骤的不可逆反应。在这些反应速率还可以对与肿瘤代谢17,21,22,25,62。代谢途径总结于图2。

图2:丙酮酸的主要代谢反应的示意图。丙酮酸/乳酸盐转化是通过LDH催化,和丙酮酸/丙氨酸转化是通过ALT催化。丙酮酸不可逆地转化为乙酰-CoA和CO 2通过PDH,和CO 2与碳酸氢盐80 pH依赖平衡。 请点击此处查看该图的放大版本。
超极化[1- 13 C]丙酮酸及其代谢物的检测已经在大鼠先前证实他本领域37,63 - 65,肝脏66,肌肉和肾62,67。一项研究证明了在正常和禁食大鼠肝66之间的乳酸对丙氨酸的比例显著差异,表现在肝癌68,69高度升高和超极化[1- 13 C]乳酸水平。有证据表明,肿瘤分级可以在使用超极化[1- 13 C]丙酮酸22小鼠前列腺(TRAMP)的转基因腺癌被识别,与超极化乳酸水平表示与切除的肿瘤的组织学分级的高相关性。由ALT从丙酮酸催化丙氨酸也被建议作为大鼠肝癌23的有用标志物。
测量丙酮酸乳酸代谢通量已用于监测缺血63,65,70和与细胞毒性化疗17,40,靶向药物对治疗的响应 24,25,41,或在动物模型中放疗26。它也被用于检测在成胶质细胞瘤和乳腺癌的小鼠模型25中的磷脂酰肌醇3-激酶(PI3K)抑制剂LY294002反应。在脑丙酮酸代谢的变化肿瘤26和前列腺癌24,71也被治疗后观察到的。
前列腺癌
前列腺癌是男性死亡相关的全球72老年男性和的第二大癌症的主要癌症。迄今为止,还没有可靠的,非侵入性的方法可用于前列腺癌73,74的早期诊断和表征,强调新颖代谢成像技术,迫切需要使严格的检测和患者分期。前列腺癌被用作模型以证明溶解的DNP 13 CMRSI在患者合并的可能性第57条 。这项工作是继续在第一期临床试验采用[1- 13 C]丙酮酸和13 CMRSI为前列腺癌的成像和它最近刚刚已经完成(NCT01229618)。
这背后的工作的动机是更详细和更广泛的受众13 CMRSI方法与细胞的临床前设置应用程序来说明。测定[1- 13 C]丙酮酸LDH催化代谢[1- 13 C]乳酸盐在 PC3前列腺癌细胞系的体外 ,我们表明溶解的DNP在体外研究的可能的应用和处理的关键步骤和在实验过程中的挑战。
研究方案
1.样品原液制备
- gadoterate葡甲胺(GadM,0.5摩尔/升)加入到浓缩的[1- 13 C]丙酮酸得到1-毫摩尔/升GadM的终浓度。添加三苯甲基自由基三(8-羧基-2,2,6,6-四(羟基乙基)-benzo- [1,2-4,5] - 双 - (1,3)-dithiole -4-基) - 盐甲基钠(OX063)到该混合物中,得到15毫摩尔/ L的终浓度。涡旋直至完全溶解。
注意:此储备溶液制备被设计用于与3.35-T临床前的DNP超极化的使用。当使用7-T临床超极化,不需要gadoterate葡甲胺,因为,在更高的磁场,它的好处是可以忽略不计。加入含钆造影剂的增加实现的固态极化,也是极化率。然而,在液体状态下,造影剂缩短的T 1弛豫时间。
2.成长的细胞培养
- 成长PC3细胞在培养瓶中有125 平方厘米的增长领域。使用含有10%胎牛血清(FCS)的F-12K培养基,并维持在37℃下将细胞在湿润气氛下,在5%的CO 2。溶解步骤之前,请从培养瓶中的媒介。
注:每个细胞需要细胞传播特定的制备方案。咨询与细胞线路提供商的要求。
3.将细胞用于实验的制备
- 除去细胞培养基和洗涤与细胞〜10毫升的磷酸盐缓冲盐水(PBS)的。
- 加入5毫升的胰蛋白酶到烧瓶中,并在细胞培养瓶返回到培养箱3至5分钟。
- 添加〜5毫升的F-12K培养基的停用胰蛋白酶。
- 计数使用自动细胞计数器细胞。混合用染色液10μL的细胞溶液10μL。用吸管拌匀传送混合液10μL到第一个"计数玻璃"电子室。
- 除去并在该烧瓶(多个)计数细胞。转移含有细胞的期望数量的适当的卷( 例如,5×10 6至10 8)到塑料瓶中。
- 离心将细胞在1200×g离心5分钟并弃上清。
- 重悬在含有10%FCS,以800微升的总体积中的F-12K培养基中的细胞,并将它们传送到反应杯(2毫升)中。放置反应杯到塑料瓶中装满温水。
4.溶解剂配制
注:溶解剂是用来溶解的超极化样品的液体。在生物应用中,溶解通常用H 2 O类或氧化氘(D 2 O)系缓冲剂,如PBS或三(羟甲基)氨基甲烷(TRIS)进行的,含有1克/升乙二胺四乙酸(EDTA)。
- Prepara20毫摩尔/升的PBS缓冲液和灰
- 制备100毫升的溶解剂,溶解36毫克磷酸二氢钠(的NaH 2 PO 4),247毫克磷酸二钠( 磷酸氢二钠),并且在20毫摩尔氢氧化钠/升钠溶液10毫克的EDTA(氢氧化钠)的D 2 O.混合妥善直至完全溶解。
注:EDTA(1克/升)被添加到缓冲器,以消除可能的铁磁离子,其可以破坏超极化。该NaOH用于中和在一个1的丙酮酸:1摩尔比以达到pH为7.4。
- 制备100毫升的溶解剂,溶解36毫克磷酸二氢钠(的NaH 2 PO 4),247毫克磷酸二钠( 磷酸氢二钠),并且在20毫摩尔氢氧化钠/升钠溶液10毫克的EDTA(氢氧化钠)的D 2 O.混合妥善直至完全溶解。
5.变温插杆(VTI)冷却时间
- 在DNP-NMR偏振片程序主窗口中,单击"冷却"。
注意:此接通真空泵和抽空VTI至大约5.0毫巴。随后,VTI和液态氦容器之间针阀完全打开,允许液体氦流入VTI。流速为r通过针阀egulated保持在VTI液态氦的最优量,直到它到达氦沸腾温度。然后,VTI被抽空到几乎完全真空,并在温度达到约1.4 K的VTI充满液体氦高达65%。此时,该仪器是准备样品插入。
6.样品制备和插入
- 用微量中,加入13 C标记的样品原液〜8μL到一个塑料杯。
- 将塑料杯的插入杆,并开始按在主程序窗口"插入样品"的样品插入过程。选择"正常样本",然后点击"继续"。
注意:在此过程中,针阀先关闭,以停止液体氦的流量为VTI,并在VTI的压力则增大。在VTI内的样品支架从液体氦,入口阀凸在VTI的顶部打开,气态氦流从入口阀引入,以防止空气中的水分外界污染。 - 出现提示时,推插杆与连接的塑料杯,下入VTI。确保在VTI底部到达样品架。否则,气态氦可以推动样品从VTI的。
- 分离并取出插入杆。
- 点击"下一步",在对话窗口中完成该过程。样品插入过程不应该需要更长的时间超过10秒。
注:入口阀然后关闭,气态氦流中断时,与样品杯的样品架被浸入液态氦和针阀打开以允许液体氦流入VTI。后5 - 10分钟时,VTI被冷却到低于1.4 K,使所有的自由电子被极化。 - 确认该塑料杯用样品通过检查吨正确地引入到VTI帽子它不附着到插入杆或氦气从VTI推出。然后点击"完成"。
7.微波扫描(可选)
注:微波扫频允许最佳的微波频率的决心最大化目标化合物的13 C核的超极化率。
- 为了测量微波扫描,启动RINMR程序,键入"HYPERSENSENMR",然后点击"选择配置"和"待办事项Microsweep"。
- 要启动过程中,选择程序主窗口中的"校准"选项卡。
- 点击"生成",选择开始和结束频率( 例如,94.100千兆赫-94.200千兆赫)时,频率步长( 例如,20兆赫)时,电源(100毫瓦),和时间(60秒)。点击"继续","启用"和"开始"。
注意:使用这些设置,超极化第一极化样本使用的94.100千兆赫的微波频率和100mW的功率60秒。然后,它适用于一个90°的射频(RF)脉冲,并使用内置的分光计获得超极化13 C信号。反复在指定的频率范围的每个步骤,这些步骤。对于后续的超极化,选择与实测的最大信号幅度的微波频率。
8.极化
- 为了测量极化集结,开始RINMR程序,键入"HYPERSENSENMR",然后点击"选择配置"和"固体堆积。"
- 在DNP-NMR偏振片程序主窗口中,单击"两极分化"启动超极化过程。
- 选择最佳的微波频率(微波扫描期间获得)和样品的功率( 如 100毫瓦),然后单击"下一步"。
- 启用"两极分化集结监控",然后单击"完成"。
- 极化样品> 95%(〜60分钟为[1- 13 C]丙酮酸盐)。
注意:在偏振,微波被导入VTI和到样品,从而导致13 C-旋转到与超极化不成对电子自旋对齐。为了测量超极化积累,具有5°的翻转角(FA)RF脉冲,周期性地施加( 例如,每300秒),并将所得的信号被绘制为一个偏振积聚曲线。
9.解散
- 当极化达到> 95%,通过点击DNP-NMR偏振片程序主窗口中的"解散"启动溶解过程。
- 从下拉菜单中选择溶解过程,然后单击"下一步"。
注:偏振器允许一个通过选择追气体的定时来定义所期望的溶解过程。 - 负载〜5毫升通过顶部阀门的溶解剂,成吨的加热的容器偏振片的他溶解一部分。计算的溶解剂的确切量使用以下等式需要:
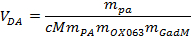
其中V DA为溶解剂中,M PA,男OX063的所需体积,以及m 迦是丙酮酸群众,OX063和gadoterate葡甲胺,分别添加到样品储液。 - 将溶解粘在进气门上方的主动地位。
注意:这允许仪器解散仪器连接到在VTI样品杯。 - 点击"完成"开始溶解过程。
注:溶解剂由氦气加压到3巴,并随后加热至200℃,引起压力的增加。当压力达到10巴时,针形阀关闭,以停止液氦流入VTI。样品架引发杯从液态氦。溶解棒下降到VTI和连接到样品杯中。该空调溶解剂由压力,从而从含有溶解缓冲液和氦气,通过溶解粘在杯加热容器产生推压,使所述样品的快速溶解。该溶液然后流出到通过塑料管的收集烧瓶。与所连接的杯溶解棒然后从VTI上升。 - 移动溶解粘在杯附加的"清洁"的位置,并通过点击完成该过程"完成"。
10. 13 C超极化信号的检测
- 在体外 13 C代谢磁共振波谱
- 混合从与细胞溶液800微升的收集烧瓶20毫摩尔/升溶解的超极化样品的200微升。
注:最终得到的浓度的[1- 13 C]丙酮酸是4毫摩尔/升。 - 混合使用公微量和转让〜600微升到5毫米NMR管中的悬浮液。
- 插入5毫米NMR管到1-T的NMR波谱仪。在软件的主窗口中,单击"运行"开始测量,应用系列,每3是一百10°RF脉冲。
注:测量与细胞超极化样品的初始混合和分光采集的开始之间的时间。确保混合过程不超过30秒,以减少极化损失。
- 混合从与细胞溶液800微升的收集烧瓶20毫摩尔/升溶解的超极化样品的200微升。
- 13 C代谢磁共振成像
- 要建立使用MRI谱仪的体外实验容器,取5毫升注射器,并将其连接到一个导管(D = 1.2 MM)是足够长的距离光谱仪的ISO为中心,以达到的平易近人区光谱仪。
- 装满次体外容器为实验所需浓度电子的细胞溶液( 例如,10 8),或与酶溶液。
- 放置一个体外容器在MRI磁体的等角点。放置在容器上的13 C-调谐射频接收器线圈。放置一个集中13 C标记定位模型( 例如,10 mol / L的13 C尿素)附近。
- 插入" 体外容器"傍核磁共振扫描器的等中心。
- 运行扫描仪的标准的3平面定位序列和调节体外容器的位置向异中心,根据需要。
- 运行1小时T2加权"解剖"涵盖体外容器位序列。使用以下设置:二维自旋回波具有轴向取向,重复时间(TR)= 2000毫秒,回声时间(TE)= 20毫秒,层厚= 1毫米,视图覆盖在体外容器字段,和每激发16相呼应。确保场匀场在这一步上质子完成。
- 在解剖图像中,选择中心感兴趣区域5个连续切片。开一个13 C光谱校准收购覆盖所选的解剖切片。使用以下设置:二维块西格特校准序列与轴向方向12×12为中心进行编码,TR = 1000毫秒,层厚= 5毫米,视图匹配解剖图像,扫描(NS)= 64,带宽的数目字段= 5000赫兹,和FA = 90°。
- 选择13 C光谱校准序列(有关详细信息,请参阅舒尔特等 2011),来自75个脉冲序列库。点击下载脉冲序列从计算机扫描仪"下载"。点击"光谱预扫描",以运行光谱预扫描。在频谱幅度图,调整从13 C校准幻影峰到CENTE扫描频率河设置接收机增益为最大。点击"开始",以运行13 C光谱校准序列。注意报告发送增益和中心频率。
- 设置13 C化学位移成像(CSI)收购覆盖所选的解剖切片。使用以下设置:二维回波平面波谱成像(EPSI)具有轴向取向12×12为中心进行编码,TR = 400毫秒,层厚= 5毫米,视图匹配解剖图像的领域中,NS = 300,和带宽= 5,000赫兹。
注:EPSI样品单行在k-空间之后,将重复一个RF激励同时获取空间和光谱信息。有关收购技术的详细信息,请参阅德斯特等人的文章。 2015年76。 - 下载13 C CSI序列和运行光谱预扫描。调整扫描仪的频率和由校准序列指定发送的增益输出。
- 超极化溶液沉积在收集烧瓶后,制定〜3毫升到注射器,然后将其注入到连接到体外的容器的导管。开始采集。采集完成后,保存用于后续的重建的原始数据文件。
11.数据重构
- 应用两个所述动力学模型中的一个来分析所获取的数据。
- 在用于说明的LDH动力学第一方法中,动力学值(k)时,乳酸盐信号(M LAC)的总和相比较的所有超极化分子的信号(M x)的 21,77。
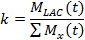
- 在另一种方法,测量随着时间的推移乳酸和丙酮酸信号,将它们装配到动力学模型17,25,71。为了解决代谢汇率,K PA→LAC,有效乳酸,R LAC的信号衰减率,使用通过两个现场交流差分模式,产生乳酸下面的线性微分方程:
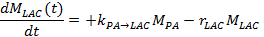
- 在用于说明的LDH动力学第一方法中,动力学值(k)时,乳酸盐信号(M LAC)的总和相比较的所有超极化分子的信号(M x)的 21,77。
注:有效乳酸盐信号衰减率r 的LAC是依赖于乳酸纵向弛豫时间(T 1,LAC),相反的代谢汇率从乳酸为丙酮酸ķLAC→PA,施加的FA和TR以及的信号强度丙酮酸(M PA)和乳酸(M LAC),同时考虑到每个相继激励后的不可逆信号还原: 
因此,R LAC导致信号衰减的单,形影不离的术语。由于可以校正在t他翻转角和重复时间,即使是有磁通LAC→PA,我们假定从乳酸为丙酮酸(K LAC→PA)的汇率不需要被包括在计算的基础上,其结果Harrison 等。 2012 78。他们的研究结果显示,第k LAC→PA不玩为一体会承担至关重要的作用。该模式允许量化乳酸的T 1弛豫时间。这个模型是独立丙酮酸施用到测量,其中,在体外实验的情况下,并不重要,并且可以忽略不计。它,然而,起到用于在体内测量79中起重要作用。
结果
的"微波扫描"的结果在图3中示出。它表明,对于[1- 13 C]丙酮酸样品的最佳微波频率为94.156千兆赫的本地3.35-T的超极化。以下所有超极化实验(N = 14)用100毫瓦的功率这种微波频率进行。微波辐射被施加60至80分钟,导致固态超极化高于90%。结果列于图4中。超极化[13℃]的丙酮酸,用5×10 6(N = 2),10 7(N = 2),2×10 7(N = 1),3×10 7(N = 2),4×混合10 7(N = 1),6×10 7(N = 2),8×10 7(N = 2),和10 8(N = 1)的前列腺癌细胞系PC3的。
所得到的数据汇总于图5中 图6。带频谱和时间分辨率获得的数据显示在图5A-D和图6A-D,与仅用于观察( 图5E-H和图6E-H)的每个分子中的时间分辨率,以及只用光谱分辨率( 图5I -L和图5I-L)。我们已经在173 ppm时,181 ppm时,和185ppm的,大约相对观察较[1- 13 C]丙酮酸,[1- 13 C]丙酮酸盐的水合物三大超极化信号,[1- 13 C]乳酸,具有化学位移在pH 7.4和温度20℃的三甲基甲硅烷丙酸(TMSP)。三种代谢物之间的信号的比率列于表1。数据显示乳酸盐信号和样品中存在的细胞数之间的明显的相关性( 图7)。然而,结果从具有小于2×10 7个细胞的实验中表现出显著偏差,可能是由于低信噪比。因此,我们建议使用更多的细胞比这进一步的实验。当相对乳酸盐信号(动能值)由细胞的数量( 图8)标准化,它清楚地表明了类似的吸收和代谢贯穿所有的细胞。然而,有降低每单元乳酸生产具有增加数目的细胞的趋势。我们认为,减少的细胞代谢活性的原因之一是电池的非常高的浓度下以非常小的体积,从而导致样品的粘度增加。两个现场交流微分模型的结果总结在表2和图9所示。数据遵循类似以前的型号的趋势:增钾 PA→LAC与越来越多的细胞。然而,这种模式导致S IN的动力学与细胞的数目更陡的增加。当代谢交换率k 的PA→LAC标准化为细胞数目,我们可以再次看到具有增加数目的细胞( 图10)降低ķPA→LAC的一个明显趋势。
图11展示了另外的空间定位在实验的可能性。它示出了具有80毫摩尔/升超极化[1- 13 C]丙酮酸旁边10摩尔/ L的13 C尿素幻象喷射的幻象。该技术允许使用的时间和特别决议( 图11A)的频谱的程度或所选择的代谢信号中的信号衰减( 图11B)的。在时域中的频谱也可以被求和,以获得更好的信噪比( 图11C)。特别决议案允许所需的频率区域邻的选择F中的13 C光谱属于某些代谢物,如[1- 13 C]丙酮酸( 图11D),[1- 13 C]丙酮酸水合物( 图11E),或参考13 C尿素( 图11F)。它可以被用的1 H图像共同注册。使用(EPSI)脉冲序列允许收购一整片每4.9所组成的形象。总之,该技术可以提供数据以供任何代谢物的空间,时间和光谱分辨率。

图3:在本地3.35-T超极化用[1- 13 C]丙酮酸微波扫描结果。测量确定最佳微波频率以最大化[1- 13 C]丙酮酸目标化合物的13 C核的超极化率的结果。微波扫描具有EPR吸收的形状光谱。的形状和峰的分离是基于使用的自由基(在此情况下,三苯甲基自由基),和最大的影响有一个坚实的效果和热混合。 请点击此处查看该图的放大版本。

图4:[1- 13 C]丙酮酸盐样品的固态极化积累。 N = 13固态极化的平均建隆通过测量每300秒高达4500 S上的标准差为代表的错误。 请点击此处查看该图的放大版本。

图5:13 CNMR光谱的结果的细胞的数目(5×10 6至3×10 7个细胞)。采集的数据与光谱分辨率和时间分辨率(AD)绘制,用时间分辨率仅为[1- 13 C]丙酮酸,[1- 13 C]丙酮酸盐的水合物,和[1- 13 C]乳酸(EH)绘制,并绘制只有光谱分辨率,汇总所有时间步(IL)。 请点击此处查看该图的放大版本。

图6:13 CNMR光谱的结果的细胞的数目(4×10 7至1×10 8个细胞)。与光谱分辨率和时间分辨率绘制所获取的数据( AD)绘制与时间分辨率只对[1- 13 C]丙酮酸盐,[1- 13 C]丙酮酸水合物和[1- 13 C]乳酸(EH),并用光谱分辨率仅绘制,汇总所有时间步(IL)。 请点击此处查看该图的放大版本。
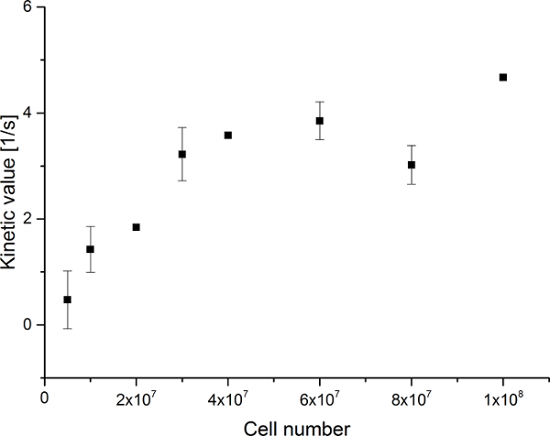
图7:简单的代谢率动力学模拟结果。数据表示[1- 13 C]乳酸盐信号为[1- 13 C]丙酮酸的总和[1- 13 C]乳酸盐与细胞在数之比,[1- 13 C]丙酮酸水合物和实验。所述误差表示标准偏差。 P租赁点击此处查看该图的放大版本。
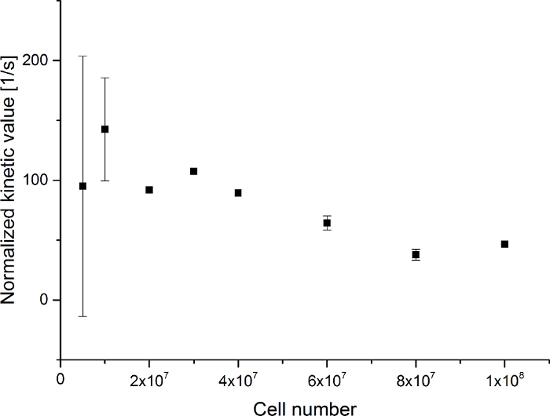
图8:简单代谢比率动力学模拟的结果归一化至细胞的数目。数据代表的[1- 13 C]乳酸盐信号为[1- 13 C]丙酮酸之和的比率,[1- 13 C]丙酮酸水合物和[1- 13 C]乳酸盐标准化为细胞数目与细胞中的实验次数。所述误差表示标准偏差。 请点击此处查看该图的放大版本。

图9:两个现场交流微分模型的结果。数据再版 ESENT代谢汇率(K PA→LAC)与细胞在实验的数目。所述误差表示标准偏差。 请点击此处查看该图的放大版本。

图10: 标准化为细胞数量 的2个站点交换微分模型的结果 。该数据代表了代谢汇率(K PA→LAC)标准化为细胞与细胞在实验次数的数目。所述误差表示标准偏差。 请点击此处查看该图的放大版本。

图11:超极化[1- 13 C]丙酮酸探头的磁共振成像结果 。 A)全片和所有的时间步骤被收购的频谱。 二)[1- 13 C]丙酮酸的衰变和[1- 13 C]丙酮酸盐的水合物的信号随着时间的推移。第三信号是在10μM的13 C尿素本地化参考。 C)从整个空间和时间分辨率所获得的光谱。 D)与总结[1- 13 C]丙酮酸在所有时间步信号的13 C图像重叠在1小时的图像。 E)与总结[1- 13 C]丙酮酸盐的水合物在所有时间步信号的13 C图像重叠在1小时的图像。 F)与覆盖在1小时的图像在所有时间步(参考)相加将13 C尿素信号的13 C图像。在CE中的13 C-信号是归一化到最大的特定代谢物的信号。 请点击此处查看该图的放大版本。
| 手机号码 | ||||||||
| 5×10 6(N = 2) | 10 7(N = 2) | 2×10 7(N = 1) | 3×10 7(N = 2) | 4×10 7(N = 1) | 6×10 7(N = 2) | 8×10 7(N = 2) | 10 8(N = 1) | |
| [1- 13 C] 丙酮酸 | 92.9±1.4 | 91.7±1.0 | 86.7 | 77.5±2.7 | 76 | 69.7±0.5 | 65.9±3.7 | 42.9 |
| [1- 13 C] 丙酮酸水合物 | 6.8±1.2 | 6.7±1.6 | 9.5 | 10.1±1.8 | 8.9 | 7.7±1.5 | 10.4±0.2 | 13.4 |
| [1- 13 C] 乳酸 | 0.3±0.3 | 1.6±0.6 | 3.8 | 12.4±4.5 | 15.1 | 22.5±1.1 | 23.7±3.5 | 43.7 |
表1:超极化代谢物相对于细胞的不同数量的相对比。
手机号码 5×10 6(N = 2) 10 7(N = 2) 2×10 7(N = 1) 3×10 7(N = 1) 4×10 7(N = 1) 6×10 7(N = 2) 8×10 7(N = 2) 10 8(N = 1) ķPA→LAC [* 10-4] 0.924±0.870 4.984±1.19 15.135 36.289 58.904 112.174±10.491 114.3±37.059 349.234表2:两现场交流微分模型的结果。
讨论
13 CMRSI与超极化探针是实时监测代谢的体外 和体内有前途的方法。其中很重要的一个方面,当使用这种实验过程是适当的标准化,体外实验特别是有关。首先,需要正确地和一致地完成,以实现每个实验超极化材料的相同浓度试样的制备。这需要一个精确称重两种样品是超极化和缓冲。如果浓度是不正确的,该溶液的最终pH是不准确的,它可以有对T 1的细胞的反应的影响和。它也是尽可能均匀地处理的细胞是至关重要的。细胞应该总是以这样的方式来制备,有为了最小化的时间将细胞保持在非常高的浓度的持续时间细胞收获和随后的实验之间的最小延迟entration和低量。变异在细胞制剂协议,例如不同的准备时间或温度下,可能会导致在所获得的数据大幅变化。与细胞样品的混合还应当标准化。它以测量示踪剂的细胞悬浮液和测量的开始的加入之间的时间,因为这可能会发生变化是很重要的;数据分析过程中,这应该被考虑。
数据分析和动力学建模的正确选择是在所获取的数据的解释是至关重要的。在简单的模型是适用于具有两个代谢物的恒定汇率线性单程反应。如在引言中所述,丙酮酸经过多个酶促反应,并且更重要的是,它也经历与丙酮酸水合物非酶可逆交换反应。这种反应起到了实验至关重要的作用,其效果充分证明我Ñ与8×10 7个细胞的实验。虽然表1中表示该丙酮酸水合物相对浓度类似于其他的实验中,当在图6D密切调查,它显示了在实验的开始相对于其他实验高得多的丙酮酸水合物信号。然而,当时间分辨率总结出来的,这些重要的信息丢失,并且会导致错误的数据的重构。另一方面,在两个现场交流微分模型是动力学的更健壮和精确的描述,因为它包括在计算中的时间分辨率。因此,它包括具有丙酮酸水合物的非酶促交换,即使它迅速测量期间与丙酮酸交换。
有各种不同的成像策略之间作出选择观察超极化信号或跟踪preclinica超极化分子的代谢L和临床研究。德斯特等。表现出的优点和不同脉冲sequnces 76缺点。自由感应衰减化学位移成像(FIDCSI)序列是比较稳健的,但有多层和时间分辨成像用途有限。平面回波光谱成像(EPSI)为梯度的问题和偏共振效应鲁棒但是,很容易出现重建伪像。的水和脂肪回波不对称和最小二乘估计(IDEAL)81,螺旋化学位移成像(ISPCSI),脉冲序列35,和螺旋化学位移成像(SPCSI)迭代分解具有高的编码效率,但是B 0,敏感不均匀性。序列的选择将取决于扫描器的特性,生物的问题,正在研究的系统。
有迹象表明,需要满足成功超极化诸多要求。然而,T这里也有一些限制,该超极化13 CMRSI技术是当今面对的问题。主的和不可改变的限制是分子,其定义了检测信号的提供的测量的特定时间量中的13 C核的第t 1弛豫时间。该信号被每个RF激励该数据采集期间使极化信号的丧失反复降低。另一个限制是,需要超极化的分子的相对长的时间段。这通常需要30至90分钟。
相比于分子成像的其他技术,如[18 F] -FDG的PET,超极化13 CMRSI不需要增加糖酵解代谢途径,因此,增加的葡萄糖消耗的肿瘤。该技术示出了在实时真实代谢通量。在另一方面,[18 F] -FDG PET没有给出任何关于直接的信息新陈代谢,但只有约在代谢活跃的区域积累的间接信息。这可能会导致假阴性结果,其中该肿瘤似乎是代谢活性,但是实际上使用不同的代谢途径,如谷氨酰胺解,作为用于扩散的碳源。
总之,溶解DNP可在各种应用中用于研究的疾病(如糖尿病)82无限列表,测量pH 15,36,45,或监控不同类型的癌症的代谢变化。这些测量可以以不同级别来实现,从体外细胞实验中,通过使用动物模型(例如小鼠,大鼠,兔,猪和狗),最近的人类临床研究57临床前研究。未来的临床应用将有一个非常强大的,非侵入性的诊断工具,它不仅可以检测和定位的疾病,但也让治疗观察响应实时83。
披露声明
Rolf F. Schulte and Marion I. Menzel are employed with GE Global Research.
致谢
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, "Imaging for Selection, Monitoring, and Individualization of Cancer Therapies."
材料
| Name | Company | Catalog Number | Comments |
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid - 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
参考文献
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in't Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine - investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth's magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. - A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。