Method Article
hiperpolarizado
* Estos autores han contribuido por igual
En este artículo
Resumen
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Resumen
En las últimas décadas, los nuevos métodos para la estadificación del tumor, nueva puesta en escena, la supervisión la respuesta al tratamiento, y la detección de la recurrencia de una variedad de cánceres han surgido en relación con la tomografía por emisión de positrones estado de la técnica con 18 F-FDG ([18F ] FDG PET). 13 C resonancia magnética espectroscópica (13 CMRSI) es un método de formación de imágenes mínimamente invasiva que permite la supervisión del metabolismo in vivo y en tiempo real. Al igual que con cualquier otro método basado en 13 C de resonancia magnética nuclear (RMN), se enfrenta al reto de baja polarización térmica y una posterior baja relación señal-ruido debido a la relativamente baja relación giromagnética de 13 C y su baja abundancia natural en muestras biológicas. Al superar estas limitaciones, la polarización nuclear dinámica (DNP) con la posterior disolución de la muestra ha permitido recientemente utilizada sistemas de imagen de resonancia magnética (MRI) de RMN y para medir, El estudio y la imagen vías metabólicas clave en diversos sistemas biológicos. Una molécula particularmente interesante y prometedora utilizado en 13 CMRSI es [1- 13 C] piruvato, que, en los últimos diez años, ha sido ampliamente utilizado para in vitro, preclínica, y, más recientemente, los estudios clínicos para investigar el metabolismo de la energía celular en el cáncer y otras enfermedades. En este artículo, se describe la técnica de disolución DNP usando un preclínica hiperpolarizadora DNP 3,35 T y demostrar su uso en estudios in vitro. Un protocolo similar para la hiperpolarización se puede aplicar en su mayor parte en estudios in vivo también. Para ello, se utilizó lactato deshidrogenasa (LDH) y la reacción catalizada metabólica de [1- 13 C] piruvato a lactato [1- 13 C] en una línea celular de carcinoma de próstata, PC3, in vitro utilizando 13 CMRSI.
Introducción
Actualmente, el método clínico más ampliamente utilizado para la estadificación del tumor, nueva puesta en escena, la supervisión la respuesta al tratamiento, y la detección de la recurrencia de una amplia variedad de cánceres es [18F] FDG PET. 1 Sin embargo, recientemente, han surgido varios nuevos enfoques y alternativas. Uno de esos métodos es 13 CMRSI. Esta técnica consiste en la introducción de la molécula de C-13 en una muestra biológica, seguido de MRI mínimamente invasivo para evaluar el metabolismo in vitro o in vivo en tiempo real. Sin embargo, el mayor reto de 13 CMRSI, en comparación con los otros métodos tales como [18 F] FDG PET o tomografía computarizada, es su baja relación señal-ruido.
La señal de RMN es directamente proporcional al nivel de polarización, una proporción de la diferencia de población espín ½ núcleos en dos estados de energía de la población total (Figura 1A). La polarización es un producto de THrelación e giromagnética (γ) de los núcleos y la intensidad del campo magnético aplicado encima de la temperatura. Una polarización típico de 1 H núcleos es del orden de 0,001% a 0,005% a 3 T, lo que da una relativamente pobre relación señal-ruido. RM de hoy el estado de la técnica ha sido un método de imagen éxito sólo debido a la gran abundancia de 1H en muestras biológicas y la alta relación giromagnética de 1H (1H gamma = 42,576 MHz / T). Sin embargo, la observación de otros núcleos, tales como el carbono, es más exigente. El único isótopo de carbono estable magnéticamente activa, 13C, representa sólo el 1,1% de todos los átomos de carbono. Además, la relación giromagnética de 13 C (γ 13C = 10,705 MHz / T) es cuatro veces menor que la de 1 H, dando lugar a una eficiencia de detección inferior. En resumen, la baja abundancia de 13C y 13C bajo γ causan mediciones térmicas 13 C para alcanzar 0,0176% de la sensibilidad de un 1Medición H-NMR in vivo.
La polarización nuclear dinámica
Un método para superar la relativamente pobre sensibilidad de 13 mediciones C es DNP. Fue descrito originalmente para metales en 1953 por Albert W. Overhauser. En su artículo, declaró: "Se demuestra que si se satura la resonancia de espín electrónico de los electrones de conducción, los núcleos se polarizan en el mismo grado que serían si su relación giromagnética eran la del espín del electrón." 2 más adelante ese año, Carver y Slichter confirmó experimentalmente la hipótesis 3 de Overhauser. En 1958, Abragam y Procter describen este efecto para los electrones en los líquidos y la llamó el "efecto sólido." A temperaturas inferiores a 4 K, la polarización de espín electrónico alcanza casi el 100% y es más de tres órdenes de magnitud más alta que la polarización de espín nuclear (Figura 1B) 4. Tsu se produce porque la relación giromagnética del electrón (γ e = 28024.944 MHz / T) es tres órdenes de magnitud más alta que las proporciones giromagnéticas nucleares. Las interacciones débiles entre los electrones y los núcleos, tales como el efecto Overhauser, el efecto sólido, el efecto cruz, y el efecto de mezclado térmico, permiten la transferencia de polarización a partir de electrones hace girar a espines nucleares usando irradiación de microondas con una frecuencia cercana a la de electrones correspondiente resonancia paramagnética (EPR) 5,6 frecuencia. DNP teoría ha sido desarrollada para involucrar a más electrones y la mezcla térmica. Sin embargo, hasta la fecha, no unificada descripción teórica cuantitativa de DNP ha sido publicada 7,8.
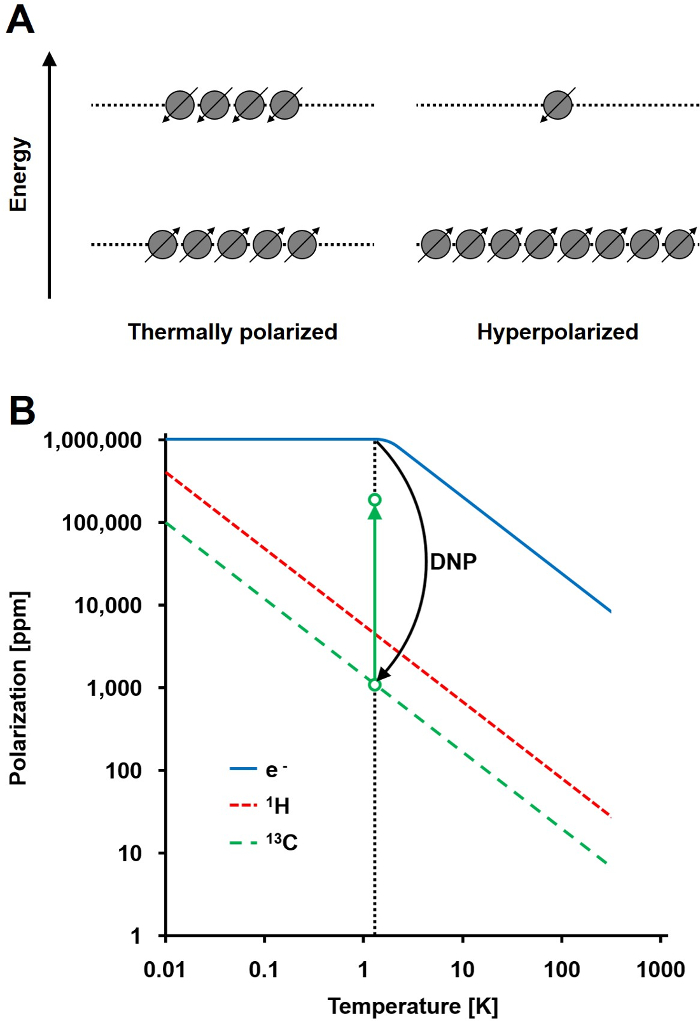
Figura 1: comprensión dinámica de polarización nuclear y hiperpolarización. A) Una comparación esquemática de la población de centrifugadoen el estado de equilibrio térmico y la polarización del estado hiperpolarizado. B) La polarización depende de la temperatura. La polarización de un electrón (e -) alcanza 100% por debajo de 1,4 K. El DNP permite la transferencia de la polarización de la e- a los 13 núcleos de C, lo que aumenta su polarización de hasta 10 5 -fold. Haga clic aquí para ver una versión más grande de esta figura.
Para introducir DNP en los estudios de sistemas biológicos usando 13C, la posterior disolución rápida de la muestra tuvo que ser desarrollado. 50 años después de la hipótesis de Overhauser, Jan H. Ardenkjaer-Larsen et al. resuelto el problema técnicamente difícil de llevar la muestra congelada hiperpolarizado en el estado líquido con una pérdida mínima de hiperpolarización 6. Disolución DNP abre un nuevo campo de investigación llamado 13 CMRSI, proporcionando un nuevo método para investigar y caracterizar diversos estados de enfermedad 9,10. Como excipientes estables de un electrón no apareado, un tris radical tritilo (8-carboxi-2,2,6,6-tetra- (hidroxietil) -benzo- [1,2-4,5] bis- (1,3) -dithiole-4-il) metil sal de sodio (OX063) o (2,2,6,6-tetrametil-piperidin-1-il) oxilo (TEMPO) se utiliza por lo general. Estos se mezclan con la 13 molécula de C marcado deseado y se expusieron a irradiación de microondas con una frecuencia cercana a la frecuencia EPR correspondiente. Usando esta técnica, la polarización de los núcleos 13 C se puede aumentar hasta 37% 11. Esto se traduce en una mejora de la polarización -fold 10 5 en comparación con la polarización de equilibrio térmico 11,12. Sin embargo, tan pronto como la irradiación con microondas se detiene y / o el C-molécula 13 se transfiere al estado líquido, la polarización decae con el tiempo de relajación longitudinal (T 1) del núcleo 13 C que se polariza. Por lo tanto, lainvención de técnicas de disolución rápida o cualquier técnica posterior acortar el tiempo antes de la medición experimental (es decir, inyección) es crucial para aplicaciones biológicas 13.
Hay tres principales requisitos que la molécula candidata necesita para cumplir con éxito de 13 estudios CMRSI. En primer lugar, el núcleo 13 C de interés tiene que tener un tiempo suficientemente largo T 1 (> 10 s). La elección de la etiqueta C-13 es crucial. Los mejores candidatos son núcleos de átomos de carbono que no tienen contacto directo con 1-H núcleos través de un enlace. También necesita ser metabolizado rápidamente dentro de 2 - 3 veces T 1, dando como resultado un producto metabólico corriente abajo con un desplazamiento químico significativamente diferente de la sustancia original. La mezcla de la muestra también debe formar un vidrio amorfo cuando está en un estado sólido de modo que la distribución espacial disminuye la distancia entre el electrón y 13 C, permitiendo que el transfer de polarización. Si la molécula candidata no forma vidrio amorfo de forma natural, que tiene que ser altamente soluble en un agente de acristalado, tal como glicerol o sulfóxido de dimetilo 14. Estos requisitos dan como resultado un número relativamente pequeño de moléculas candidatas. Sin embargo, incluso después del descubrimiento con éxito de una molécula adecuada, el desarrollo de un protocolo de trabajo para la hiperpolarización puede ser técnicamente difícil 9,14,15.
En los últimos años, varios sustratos han sido exitosamente polarizado, tales como [1- 13 C] piruvato 12,16 - 36, [2- 13 C] piruvato 37, [1- 13 C] piruvato de etilo 38, [1- 13 C ] lactato 39, [1- 13 C] fumarato 40 - 43, 13, C-bicarbonato de 36,44,45, [1- 13 C] acetato de sodio 43,46 - 49, 13 C-urea 6,36,50,51 , [5- 13 C] glutamine 15,52,53, [1- 13 C] glutamato 53,54, [1- 13 C] 2-oxoglutarato 55, [1- 13 C] alanina, y otros 14,56. Un sustrato particularmente interesante y de uso general para la hiperpolarización es [1- 13 C] piruvato. Es ampliamente utilizado en estudios preclínicos para investigar la energía metabolismo celular en diversas enfermedades 14,17,22. [1- 13 C] piruvato cumple con todos los requisitos para la hiperpolarización éxito, incluyendo un transporte relativamente largo T 1 y rápida a través de la membrana celular antes de ser metabolizados posteriormente. Los estudios preclínicos con piruvato [1- 13 C] Actualmente se están traduciendo en la clínica 57.
El metabolismo de piruvato
Es bien sabido que hay una relación directa entre las mutaciones en el ADN y los cambios en sus vías metabólicas de un cáncer de células. Ya en la década de 1920, Otto Warburg descuEred que hay un aumento del metabolismo de la glucosa y la producción de lactato en los tumores en comparación con tejido sano 58-60. Posteriormente, diversas alteraciones en otras vías metabólicas, tales como la vía de las pentosas fosfato, el ciclo del ácido tricarboxílico, la fosforilación oxidativa, y la síntesis de nucleótidos y lípidos, se han descrito.
El piruvato es el producto final de la glicólisis. En el tumor, se somete a la glucólisis anaeróbica catalizada por la LDH 61 y reacciona con la forma reducida del dinucleótido de adenina nicotinamida coenzima (NADH), dando como resultado lactato y la forma oxidada de la coenzima (NAD +). Alternativamente, el piruvato se somete a una reacción de transaminación con glutamato para formar alanina, catalizada por la alanina transaminasa (ALT). Ambas reacciones son fácilmente reversible. El piruvato también se somete a descarboxilación catalizada por la piruvato deshidrogenasa (PDH) en dióxido de carbono y acetil-CoA, rREPRESENTAN una reacción irreversible en este paso. Alternancias en estas velocidades de reacción pueden estar relacionados con el metabolismo del tumor 17,21,22,25,62. Las vías metabólicas se resumen en la Figura 2.

Figura 2: Esquema de la importante reacción metabólica del piruvato. Piruvato de conversión / lactato es catalizada por la LDH, y la conversión de piruvato / alanina es catalizada por la ALT. El piruvato se convierte irreversiblemente a acetil-CoA y CO 2 por PDH, y CO 2 se encuentra en un equilibrio dependiente del pH con bicarbonato de 80. Haga clic aquí para ver una versión más grande de esta figura.
La detección de hiperpolarizado [1- 13 C] piruvato y sus metabolitos se ha demostrado previamente en la rata élarte 37,63 - 65, 66 de hígado, músculo y riñón 62,67. Un estudio demostró diferencias significativas en la proporción de lactato-alanina entre el hígado de rata normal y ayunaron 66 y demostró un nivel muy elevado de lactato hiperpolarizado y [1- 13 C] en el cáncer de hígado 68,69. Hay pruebas de que el grado del tumor se puede identificar en un adenocarcinoma transgénico de próstata de ratón (TRAMP) utilizando hiperpolarizado piruvato [1- 13 C] 22, con los niveles de lactato hiperpolarizados que muestran una alta correlación con el grado histológico de los tumores extirpados. La alanina catalizada a partir de piruvato por ALT también se ha sugerido como un marcador útil en la rata carcinoma hepatocelular 23.
La medición de la flujo metabólico piruvato-lactato se ha utilizado para el control de isquemia 63,65,70 y como respuesta al tratamiento con fármacos citotóxicos quimioterapia 17,40, dirigidos 24,25,41, 26 o radioterapia en modelos animales. También se ha utilizado para la detección del inhibidor LY294002 respuesta fosfatidilinositol 3-quinasa (PI3K) en el glioblastoma y el cáncer de mama modelos de ratón 25. Los cambios en el metabolismo del piruvato en tumores cerebrales 26 y cáncer de próstata 24,71 también se han observado después del tratamiento.
Carcinoma de próstata
El carcinoma de próstata es el cáncer predominante en hombres de edad avanzada y el segundo cáncer más importantes relacionados con la muerte en los hombres en todo el mundo 72. Hasta la fecha, no existen métodos fiables y no invasivas están disponibles para el diagnóstico precoz y la caracterización de cáncer de próstata 73,74, haciendo hincapié en la necesidad urgente de nuevas técnicas de imagen metabólica para permitir la detección rigurosa y la estadificación de los pacientes. Carcinoma de próstata se utilizó como modelo para demostrar las posibilidades de DNP disolución combinados con 13 CMRSI en pacientes 57. Este trabajo fue continuado en un primer ensayo clínico que emplea [1- 13 C] piruvato y 13 CMRSI para la obtención de imágenes de cáncer de próstata, y ha recientemente se ha completado (NCT01229618).
La motivación detrás de este trabajo era ilustrar con más detalle y para un público más amplio de la aplicación del método CMRSI 13 en un entorno preclínico con las células. La medición del metabolismo de la LDH-catalizada de [1- 13 C] piruvato a [1- 13 C] lactato in vitro en la línea celular de carcinoma de próstata PC3, se demuestra la posible aplicación de DNP disolución en estudios in vitro y la dirección de los pasos cruciales y desafíos durante los experimentos.
Protocolo
1. Ejemplo de Preparación de la Solución
- Añadir gadoterato meglumina (GADM, 0.5 mol / L) a ácido concentrado [1- 13 C] pirúvico para dar una concentración final de 1-mmol / L GADM. Añadir tritilo tris radical (8-carboxi-2,2,6,6-tetra- (hidroxietil) -benzo- [1,2-4,5] bis- (1,3) -dithiole-4-il) - sal de sodio y metilo (OX063) a esta mezcla para dar una concentración final de 15 mmol / L. Vortex hasta disolución completa.
NOTA: Esta preparación solución madre está diseñado para su uso con un hiperpolarizador preclínica DNP 3.35-T. Cuando se utiliza un hiperpolarizador clínica 7-T, la meglumina gadoterato no es necesario porque, en un campo magnético superior, sus beneficios son insignificantes. La adición de un agente de contraste a base de gadolinio aumenta la polarización de estado sólido alcanzable y también la tasa de polarización. Sin embargo, en el estado líquido, el agente de contraste se acorta el tiempo de relajación T 1.
2. Cultivo El cultivo celular
- cultivan las células PC3 en un frasco de cultivo con un 125 cm-2 Área de crecimiento. Utilice medio F-12K que contiene 10% de suero de ternera fetal (FCS) y mantener las células a 37 ° C en una atmósfera humidificada a 5% de CO 2. Antes de la etapa de disolución, se elimina el medio del matraz de cultivo.
NOTA: Cada línea celular requiere un protocolo de preparación particular para la propagación celular. Consulte los requisitos con el proveedor de la línea celular.
3. Preparación de las células para el experimento
- Retire el medio de las células y se lavan las células con ~ 10 ml de solución salina tamponada con fosfato (PBS).
- Añadir 5 ml de tripsina al matraz y devolver los frascos de cultivo celular a la incubadora durante 3-5 min.
- Añadir ~ 5 ml de medio F-12K para desactivar la tripsina.
- Contar las células usando un contador de células automático. Mezclar 10 l de la solución de células con 10 l de la solución de tinción. Mezclar bien con la pipeta y transferir 10 l de la mezcla en THe cámara de un "vidrio contando".
- Retirar y contar las células en el matraz (s). La transferencia de los volúmenes apropiados que contienen el número deseado de células (por ejemplo, 5 x 10 6 hasta 10 8) en viales de plástico.
- Centrifugar las células a 1200 xg durante 5 min y descartar el sobrenadante.
- Vuelva a suspender las células en el medio F-12K que contiene 10% de FCS a un volumen total de 800 l y transferirlos en un vaso de reacción (2 ml). Coloque el recipiente de reacción en un vial de plástico llena de agua tibia.
4. Disolución Agente Preparación
NOTA: El agente de disolución es un líquido que se utiliza para disolver la muestra hiperpolarizado. En aplicaciones biológicas, la disolución se lleva a cabo por lo general con H 2 O o basado en óxido de deuterio (D 2 O) tampones basados, tales como PBS o tris (hidroximetil) aminometano (Tris), que contiene ácido etilendiaminotetraacético 1 g / L (EDTA).
- PREPARAción de tampón / L de PBS 20 mmol
- Para preparar 100 ml del agente de disolución, se disuelven 36 mg de fosfato monosódico (NaH 2 PO 4), 247 mg de fosfato disódico (Na 2 HPO 4), y 10 mg de EDTA en una solución de hidróxido / L de sodio 20 mmol ( NaOH) en D2O mezcla adecuadamente hasta su completa disolución.
NOTA: EDTA (1 g / L) se añade al tampón para eliminar los posibles iones ferromagnéticos, que puede estropear la hiperpolarización. El NaOH se utiliza para neutralizar el ácido pirúvico en una proporción 1: 1 mol de llegar a un pH de 7,4.
- Para preparar 100 ml del agente de disolución, se disuelven 36 mg de fosfato monosódico (NaH 2 PO 4), 247 mg de fosfato disódico (Na 2 HPO 4), y 10 mg de EDTA en una solución de hidróxido / L de sodio 20 mmol ( NaOH) en D2O mezcla adecuadamente hasta su completa disolución.
5. Temperatura Insertar variable (IVT) El tiempo de reutilización
- En el programa polarizador ventana principal DNP-RMN, haga clic en "tiempo de reutilización."
NOTA: Esto activa la bomba de vacío y evacua el VTI a aproximadamente 5,0 mbar. Posteriormente, la válvula de aguja entre el VTI y el depósito de helio líquido se abre completamente, permitiendo que el helio líquido fluya en el VTI. La velocidad de flujo es regulated por la válvula de aguja para mantener la cantidad óptima de helio líquido en el VTI hasta que alcanza la temperatura de ebullición del helio. A continuación, el VTI se evacua a vacío casi completa, y la temperatura alcanza aproximadamente 1,4 K. La VTI se llena de líquido de helio hasta 65%. En este punto, el instrumento está listo para la inserción de la muestra.
6. Preparación de la muestra e Inserción
- Usando una micropipeta, añadir ~ 8 l de 13 C-etiquetados de solución de muestra caldo en un vaso de plástico.
- Una el vaso de plástico de la varilla de inserción e iniciar el proceso de inserción de muestra pulsando el botón "Insertar la muestra" en la ventana principal del programa. Seleccione "muestra normal" y haga clic en "Continuar".
NOTA: Durante este proceso, la válvula de aguja primero se cierra para interrumpir el flujo de helio líquido en VTI, y la presión en el VTI luego aumenta. El soporte de la muestra dentro de la IFP se eleva desde el helio líquido, la válvula de entradaen la parte superior de la VTI se abre, y un flujo de helio gaseoso se introduce desde la válvula de entrada para evitar la contaminación exterior por la humedad del aire. - Cuando se le solicite, presione el tubo de inserción con la copa de plástico que hay abajo en la IFP. Asegúrese de que para alcanzar el soporte de la muestra en la parte inferior de la IFP. De lo contrario, el helio gaseoso puede empujar la muestra de la IFP.
- Separar y retirar la varilla de inserción.
- Finalizar el proceso haciendo clic en "Siguiente" en la ventana de diálogo. El procedimiento de inserción de la muestra no debe durar más de 10 s.
NOTA: La válvula de entrada se cierra, el flujo de helio gaseoso se interrumpe, el soporte de muestra con la copa de muestra se sumerge en helio líquido, y se abre la válvula de aguja para permitir que el helio líquido fluya en el VTI. Después de 5 a 10 min, el VTI se enfría por debajo de 1,4 K, lo que permite a todos los electrones libres a polarizarse. - Confirmar que el vaso de plástico con la muestra se introduce correctamente en el VTI marcando tsombrero que no está unido a la varilla de inserción o empujado hacia fuera de la VTI por gas helio. A continuación, haga clic en "Finalizar".
7. Horno de microondas de barrido (opcional)
NOTA: Un barrido de microondas permite la determinación de la frecuencia de microondas óptima para maximizar la tasa de hiperpolarización de los 13 C núcleos en el compuesto diana.
- Para medir el barrido de microondas, inicie el programa RINMR, tipo "HYPERSENSENMR," y haga clic en "Seleccionar Config" y "Do Microsweep."
- Para iniciar el proceso, seleccione la pestaña "calibrar" en la ventana principal del programa.
- Haga clic en "Generar" y elegir la frecuencia de comienzo y final (por ejemplo, 94.100 GHz-94.200 GHz), el incremento de frecuencia (por ejemplo, 20 MHz), la potencia (100 mW), y el tiempo (60 s). Haga clic en "Continuar", "Activar" y "Start".
NOTA: Con esta configuración, la primera hiperpolarizadora polariza la muestradurante 60 s usando una frecuencia de microondas de 94.100 GHz y una potencia de 100 mW. A continuación, se aplica un pulso de 90 ° de radio-frecuencia (RF) y adquiere la señal de 13 C hiperpolarizado usando el espectrómetro incorporado. Estos pasos se repiten para cada paso en la gama de frecuencias especificada. Para hiperpolarización posterior, seleccione la frecuencia de microondas con la amplitud de la señal máxima medida.
8. polarización
- Para medir la acumulación de polarización, inicie el programa RINMR, tipo "HYPERSENSENMR," y haga clic en "Seleccionar Config" y "Sólido Build-up".
- En el programa polarizador ventana principal DNP-RMN, haga clic en "polarización" para iniciar el proceso de hiperpolarización.
- Elija la frecuencia óptima de microondas (obtenido durante el barrido de microondas) y la potencia (por ejemplo, 100 mW) para la muestra y haga clic en "Siguiente".
- Habilitar "acumulación de polarización de vigilancia" y haga clic en "Finalizar".
- Polarizar la muestra a> 95% (~ 60 min para [1- 13 C] piruvato).
NOTA: Durante la polarización, las microondas son guiados en el VTI y para la muestra, haciendo que el 13C gira para alinearse con los espines de los electrones no apareados hiperpolarizados. Para medir la acumulación de hiperpolarización, pulsos de RF con un ángulo de flip (FA) de 5 ° se aplican periódicamente (por ejemplo, cada 300 s), y la señal resultante se representa como una curva de acumulación de polarización.
9. Disolución
- Cuando llega a la polarización> 95%, iniciar el proceso de disolución haciendo clic en "disolución" en el programa polarizador ventana principal DNP-RMN.
- Escoja el proceso de disolución en el menú desplegable y haga clic en "Siguiente".
NOTA: El polarizador permite definir el proceso de disolución deseado eligiendo el momento de la persecución de gas. - Cargar ~ 5 ml de la disolución de agente a través de la válvula de la parte superior en un recipiente calentado en tque parte de disolución del polarizador. Calcular el volumen exacto del agente de disolución es necesario el uso de la ecuación siguiente:
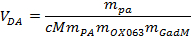
donde V es el volumen DA deseada del agente de disolución, PA m, m OX063, ym Gad son las masas de la piruvato, OX063 y meglumina gadoterato, respectivamente, a la solución de ejemplo stock. - Coloque la palanca de la disolución en la posición activa por encima de la válvula de entrada.
NOTA: Esto permite que el instrumento para conectar su instrumentación disolución de la copa de muestra en el IFP. - Haga clic en "Finalizar" para iniciar el proceso de disolución.
NOTA: El agente de disolución se somete a presión a 3 bar por gas helio y se calienta posteriormente hasta 200 ° C, provocando un aumento en la presión. Cuando la presión alcanza 10 bar, la válvula de aguja se cierra para interrumpir el flujo de helio líquido en el VTI. El soporte de la muestra plantea la copadel helio líquido. El palo de disolución se baja en el VTI y conectado a la copa de muestra. El agente de disolución acondicionado es empujado por la presión, que resulta de la vasija de calentamiento que contiene el tampón de disolución y gas helio, a través de la palanca de la disolución a la taza, causando una rápida disolución de la muestra. La solución fluye entonces hacia fuera en el matraz de recogida a través de un tubo de plástico. El palo de disolución con la copa adjunto se eleva entonces a partir de la IFP. - Mover el palo de la disolución con la copa unido a la posición de "limpieza" y terminar el proceso haciendo clic en "Finalizar".
10. La detección de la 13 C hiperpolarizado Señal
- 13 C espectroscopia de resonancia magnética metabólica in vitro
- Mezclar 200 l de la / L disuelto muestra hiperpolarizado 20-mmol desde el matraz de recogida con 800 l de la solución de células.
NOTA: La concentración final resultantede [1- 13 C] piruvato es 4 mmol / L. - Mezclar bien la suspensión utilizando una micropipeta y la transferencia de ~ 600 l en un tubo de RMN de 5 mm.
- Insertar el tubo de RMN de 5 mm en el espectrómetro de RMN 1-T. En la ventana principal del programa, haga clic en "Ejecutar" para iniciar la medición, la aplicación de serie de un centenar de 10 ° pulsos de RF cada 3 s.
NOTA: medir el tiempo entre la mezcla inicial de la muestra hiperpolarizado con las células y el comienzo de la adquisición espectroscópico. Asegúrese de que el procedimiento de mezcla no exceda de 30 s para minimizar la pérdida de polarización.
- Mezclar 200 l de la / L disuelto muestra hiperpolarizado 20-mmol desde el matraz de recogida con 800 l de la solución de células.
- Resonancia magnética metabólico 13 C
- Para construir un contenedor para los experimentos in vitro utilizando el espectrómetro de resonancia magnética, tomar una jeringa de 5 ml y conectarlo a un catéter (d = 1,2 mm) que es lo suficientemente largo para llegar a partir de iso-centro del espectrómetro al área accesible de la espectrómetro.
- Llene el recipiente in vitro con THsolución de células e de la concentración deseada para el experimento (por ejemplo, 10 8) o con una solución enzimática.
- Colocar un recipiente in vitro en el isocentro del imán IRM. Colocar una bobina de receptor de radiofrecuencia sintonizado-C 13 en el envase. Coloque un concentrado de 13 C-etiquetados de calibración fantasma (por ejemplo, de 10 mol / L 13 C-urea) cercano.
- Inserte el "contenedor in vitro", cerca de la iso-centro del escáner de RMN.
- Ejecutar secuencia de localización en 3 planos estándar del escáner y ajustar la posición del contenedor in vitro para el iso-centro, según sea necesario.
- Ejecutar una secuencia ponderada en T2 1 H "anatómica" que cubre el recipiente en la localización in vitro. Utilice los siguientes parámetros: spin eco 2D con orientación axial, tiempo de repetición (TR) = 2.000 ms, tiempo de eco (TE) = 20 ms, rebanada de espesor = 1 mm, campo de visión que cubre el recipiente in vitro, y16 ecos por excitación. Asegúrese de que calce campo se realiza en protones durante este paso.
- En las imágenes anatómicas, seleccionar 5 cortes contiguos se centraron en la región de interés. Prescribir una adquisición de calibración espectroscópico 13 C cubriendo los cortes anatómicos seleccionados. Utilice los siguientes parámetros: secuencia de calibración 2D Bloque-Siegert con orientación axial 12 x 12 centrada en codificado, TR = 1,000 ms, grosor de corte = 5 mm, el campo de juego de la visión imágenes anatómicas, número de exploraciones (NS) = 64, el ancho de banda = 5,000 Hz, y FA = 90 °.
- Seleccione la secuencia de calibración de espectroscopia de 13C (para más información, véase Schulte et al., 2011) 75 de la biblioteca de secuencia de pulsos. Descargar la secuencia de pulsos al escáner desde el ordenador haciendo clic en "Descargar". Haga clic en "Spectra Prescan" para ejecutar el pre-escaneo espectroscópica. En la gráfica de la magnitud del espectro, ajustar el pico del cuerpo de calibración 13 C al center de la frecuencia de escáner. Ajustar la ganancia del receptor al máximo. Haga clic en "Inicio" para ejecutar la secuencia de calibración de espectroscopia 13C. Tenga en cuenta la ganancia de transmisión y la frecuencia reportado céntrica.
- Establecer una adquisición de imágenes 13 C desplazamiento químico (CSI), que cubre los cortes anatómicos seleccionados. Utilice los siguientes parámetros: 2D eco-planar espectroscópica de imágenes (EPSI) con orientación axial 12 x 12 centrada en codificado, TR = 400 ms, grosor de corte = 5 mm, el campo de juego de la visión imágenes anatómicas, NS = 300, y el ancho de banda = 5.000 Hz .
NOTA: Las muestras de EPSI una sola línea en el espacio k en varias ocasiones después de una excitación de RF para adquirir tanto la información espacial y espectral simultáneamente. Para obtener más información acerca de las técnicas de adquisición, véase el artículo de Durst et al. 2015 76. - Descargar la secuencia C CSI 13 y ejecute el pre-escaneo espectroscópica. Ajustar la frecuencia del escáner y transmitir la ganancia según lo especificado por la secuencia de calibraciónsalida.
- Después de la solución hiperpolarizado se deposita en el matraz de recogida, elaboración de ~ 3 ml con una jeringa y luego inyectarla en el catéter conectado al recipiente in vitro. Iniciar la adquisición. Después de la adquisición se haya completado, guardar el archivo de datos brutos para la reconstrucción posterior.
11. Los datos Reconstrucción
- Aplicar uno de los dos modelos cinéticos descritos para analizar los datos adquiridos.
- En el primer método para describir la cinética de LDH, valor cinética (k), comparar la suma de la señal de lactato (M LAC) a la señal de todas las moléculas hiperpolarizados (M x) 21,77.
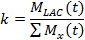
- En el otro método, medir el lactato y piruvato señales en el tiempo y montarlas a un modelo 17,25,71 cinética. Para resolver el tipo de cambio metabólico, PA k → ALC, y la efectivatasa de caída de la señal de lactato, r ALC, utilizar las siguientes ecuaciones diferenciales lineales utilizando el modelo de cambio diferencial de dos sitios, produciendo para el lactato:
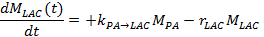
- En el primer método para describir la cinética de LDH, valor cinética (k), comparar la suma de la señal de lactato (M LAC) a la señal de todas las moléculas hiperpolarizados (M x) 21,77.
Nota: La señal de lactato velocidad de desintegración r ALC efectiva depende del tiempo de relajación longitudinal lactato (T1, LAC), el tipo de cambio metabólico opuesta a partir de lactato a piruvato k ALC → PA, el FA aplicada y TR, y la intensidad de la señal de piruvato (M PA) y lactato (M LAC), teniendo en cuenta la reducción de la señal irreversible después de cada excitación sucesiva: 
Por lo tanto, r ALC se traduce en un solo término, inseparable de la caída de la señal. Dado que es posible para corregir tque flip ángulo y el tiempo de repetición, ya pesar de que hay un flujo ALC → PA, se supone que el tipo de cambio a partir de lactato a piruvato (k ALC → PA) no tiene que ser incluido en el cálculo, basado en los resultados de Harrison et al. 2012 78. Sus resultados muestran que el ALC k → PA no juega un papel tan crucial como es de suponer. Este modo permite que el tiempo de relajación T1 de lactato a cuantificarse. Este modelo es independiente de la administración de piruvato a la medición, el cual, en el caso de los experimentos in vitro, no es crucial y se puede descuidar. Lo hace, sin embargo, juegan un papel importante para las mediciones in vivo 79.
Resultados
Los resultados del "barrido de microondas" se ilustran en la Figura 3. Se muestra que la frecuencia de microondas óptima para el [1- 13 C] muestra piruvato es en 94,156 GHz para el local de hiperpolarizador 3,35-T. Todos siguiente experimento hiperpolarización (n = 14) se realizaron con esta frecuencia de microondas con una potencia de 100 mW. La irradiación de microondas se aplicó durante 60 a 80 min, lo que lleva a una hiperpolarización de estado sólido mayor que 90%. Los resultados se presentan en la Figura 4. El hiperpolarizado [13 C] piruvato se mezcló con 5 × 10 6 (n = 2), 10 7 (n = 2), 2 × 10 7 (n = 1), 3 × 10 7 (n = 2), 4 × 10 7 (n = 1), 6 × 10 7 (n = 2), 8 × 10 7 (n = 2), y 10 8 (n = 1) de la cáncer de próstata línea celular PC3.
Los datos resultantes se resumen en la Figura 5 Y la Figura 6. Los datos adquiridos con resolución espectral y temporal se muestran en la Figura 5A-D y la Figura 6A-D, con sólo una resolución temporal para cada molécula observado (Figura 5E-H y la Figura 6E-H), y con sólo una resolución espectral (Figura 5I -L y la Figura 5I-L). Hemos observado tres principales señales que representan hiperpolarizados [1- 13 C] piruvato, [1- 13 C] hidrato de piruvato, y [1- 13 C] lactato, con desplazamientos químicos en 173 ppm, 181 ppm y 185 ppm, aproximadamente con respecto al ácido trimetilsilil propanoico (TMSP) a pH 7,4 y la temperatura de 20 ° C. Las relaciones de señal entre los tres metabolitos se resumen en la Tabla 1. Los datos muestran una clara correlación entre la señal de lactato y el número de células presentes en la muestra (Figura 7). Sin embargo, los resultadosa partir de los experimentos con menos de 2 × 10 7 células presentan desviación significativa, probablemente debido a una baja relación señal-ruido. Por lo tanto, se sugiere el uso de células más que esto para experimentos adicionales. Cuando la señal de lactato relativo (valor cinética) se normaliza por el número de células (Figura 8), que demuestra claramente la absorción y el metabolismo similares a través de todas las células. Sin embargo, hay una tendencia de disminución de la producción de lactato por célula con un número creciente de células. Creemos que una de las causas de la actividad metabólica reducida célula es una muy alta concentración de células en un volumen muy pequeño, lo que resulta en el aumento de la viscosidad de la muestra. Los resultados del modelo de diferencial de cambio de dos sitios se resumen en la Tabla 2 y se muestran en la Figura 9. Los datos siguen una tendencia similar a la del modelo anterior: el aumento de k PA → ALC con un número cada vez mayor de las células. Sin embargo, como resultado de este modelos en un aumento más pronunciado de la cinética con el número de células. Cuando el tipo de cambio metabólico k PA → ALC se normaliza al número de células, que de nuevo podemos ver una clara tendencia decreciente de k PA → ALC con un número cada vez mayor de las células (Figura 10).
La Figura 11 demuestra la posibilidad de la adición de la localización espacial del experimento. Se muestra un espectro inyectado con 80 mmol / L hiperpolarizado [1- 13 C] piruvato al lado de un 10 mol / L 13 C-urea fantasma. La técnica permite la obtención de un espectro con resolución temporal y especial (Figura 11A) o de la caída de la señal de las señales de metabolitos seleccionados en el tiempo (Figura 11B). Los espectros en el dominio del tiempo también se puede resumir para recibir una mejor señal-ruido (Figura 11C). La resolución especial permite la elección de la región de frecuencia deseada of espectro 13C pertenencia a determinados metabolitos, tales como [1- 13 C] piruvato (Figura 11D), [1- 13 C] piruvato hidrato (Figura 11E), o referencia 13 C-urea (Figura 11F). Puede ser co-registrado una imagen de 1 H con. La secuencia de pulsos utilizado (EPSI) permite la adquisición de una imagen de toda la rebanada de 4,9 s. En resumen, esta técnica puede proporcionar datos con una resolución espacial, temporal y espectral para cualquier metabolito.

Figura 3: Resultados de un barrido de microondas con [1- 13 C] piruvato en el local 3.35 hiperpolarizadora-T. El resultado de las mediciones que determinan la frecuencia de microondas óptima para maximizar la tasa de hiperpolarización de 13 núcleos de C en el compuesto objetivo de piruvato [1- 13 C]. El barrido de microondas tiene una forma de una absorción EPRespectro. La forma y la separación de los picos se basan en el radical usado (en este caso, radical tritilo), y la mayor influencia tener un efecto sólido y la mezcla térmica. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Sólido acumulación estado de polarización de un [1- 13 C] Muestra piruvato. Un promedio de n = 13 polarización de estado sólido acumulaciones con el error representada por la desviación estándar medida cada 300 s para un máximo de 4,500 s. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Resultados de la 13 C NMR Spectroscopy para el número de células (5 x 10 6 a 3 x 10 7 células). Los datos adquiridos representan con resolución espectral y temporal (AD), representan con resolución temporal sólo para [1- 13 C] piruvato, [1- 13 C] hidrato de piruvato, y [1- 13 C] de lactato (EH), y se representaron con una resolución espectral única, sumando todos los pasos de tiempo (IL). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Resultados de la 13 C NMR Spectroscopy para el número de células (4 x 10 7 a 1 x 10 8 células). Los datos adquiridos trazados con una resolución espectral y temporal ( AD), trazada con resolución temporal sólo para [1- 13 C] piruvato, [1- 13 C] hidrato de piruvato, y [1- 13 C] lactato (EH), y se representa con una resolución espectral única, sumando todos los pasos de tiempo (IL). Haga clic aquí para ver una versión más grande de esta figura.
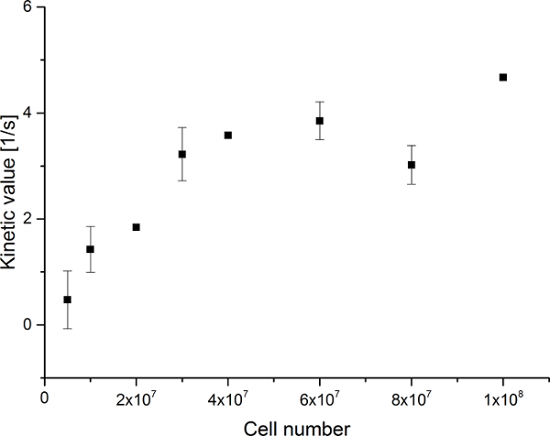
Figura 7: Resultados de la Relación de metabolitos simple cinética de modelado. Los datos representan la relación de la [1- 13 C] de la señal de lactato a la suma de [1- 13 C] piruvato, [1- 13 C] hidrato de piruvato, y [1- 13 C] de lactato en comparación con el número de células en el experimentos. El error representa la desviación estándar. PAGarrendar clic aquí para ver una versión más grande de esta figura.
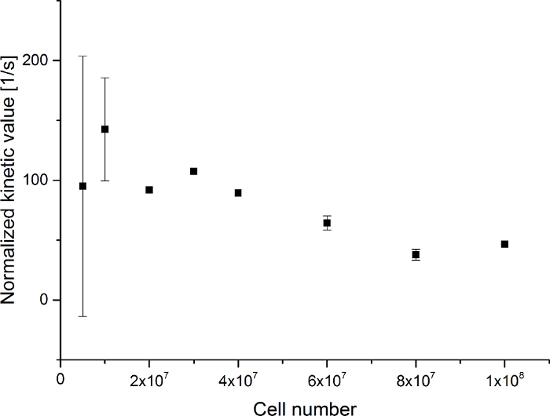
Figura 8: Resultados de la relación de metabolitos simple Kinetic Modeling Normalizado para el número de células. Los datos representan la relación de la [1- 13 C] de la señal de lactato a la suma de piruvato [1- 13 C], [1- 13 C] hidrato de piruvato, y [1- 13 C] de lactato normalizada para el número de células frente al número de células en los experimentos. El error representa la desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Resultados del sitio de Exchange en dos modelos diferencial. La repr datos esent el tipo de cambio metabólico (k PA → LAC) versus el número de células en los experimentos. El error representa la desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10: Resultados de los dos sitios de Exchange Modelo diferencial normalizado a la cantidad de células. Los datos representan el tipo de cambio metabólico (k PA → LAC) normalizada al número de células en comparación con el número de células en los experimentos. El error representa la desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.

Figura 11: Resultado de la resonancia magnética de la hiperpolarizado [1- 13 C] Sonda de piruvato. A) El espectro adquirido a lo largo de todo el corte y todos los pasos de tiempo. B) La decadencia de la piruvato [1- 13 C] y [1- 13 C] señal de hidrato de piruvato en el tiempo. La tercera señal es el 10 M 13 C-urea de referencia de localización. C) El espectro adquirido de toda la resolución espacial y temporal. D) La imagen 1H superpuesta la imagen 13C de la [1- 13 C] piruvato señal sumada sobre todos los pasos de tiempo con. E) La imagen 1H superpuesta la imagen 13C de la [1- 13 C] señal sumada piruvato hidrato sobre todos los pasos de tiempo con. F) La imagen 1H superpuesta con la 13 C imagen de la señal de 13 C-urea sumada sobre todos los pasos de tiempo (de referencia). El 13-C de la señal en CE se normaliza al máximo de la señal del metabolito específico. Haga clic aquí para ver una versión más grande de esta figura.
| Numero de celular | ||||||||
| 5 × 10 6 (n = 2) | 10 7 (n = 2) | 2 × 10 7 (n = 1) | 3 × 10 7 (n = 2) | 4 × 10 7 (n = 1) | 6 × 10 7 (n = 2) | 8 × 10 7 (n = 2) | 10 8 (n = 1) | |
| [1- 13 C] piruvato | 92,9 ± 1,4 | 91,7 ± 1,0 | 86.7 | 77,5 ± 2,7 | 76 | 69,7 ± 0,5 | 65,9 ± 3,7 | 42.9 |
| [1- 13 C] hidrato de piruvato | 6,8 ± 1,2 | 6,7 ± 1,6 | 9.5 | 10.1 ± 1.8 | 8.9 | 7,7 ± 1,5 | 10,4 ± 0,2 | 13.4 |
| [1- 13 C] lactato | 0,3 ± 0,3 | 1,6 ± 0,6 | 3.8 | 12,4 ± 4,5 | 15.1 | 22,5 ± 1,1 | 23,7 ± 3,5 | 43.7 |
Tabla 1: La proporción relativa de metabolitos hiperpolarizado con respecto al número diferente de células.
Numero de celular 5 × 10 6 (n = 2) 10 7 (n = 2) 2 × 10 7 (n = 1) 3 × 10 7 (n = 1) 4 × 10 7 (n = 1) 6 × 10 7 (n = 2) 8 × 10 7 (n = 2) 10 8 (n = 1) k PA → ALC [* 10 -4] 0,924 ± 0,870 4.984 ± 1.19 15.135 36.289 58.904 112.174 ± 10.491 114,3 ± 37.059 349.234Tabla 2:Los resultados del modelo de dos sitios de Cambio Diferencial.
Discusión
13 CMRSI con sondas hiperpolarizados es un método prometedor para controlar el metabolismo en tiempo real in vitro e in vivo. Un aspecto muy importante cuando se emplea este proceso experimental es la estandarización adecuada, especialmente en relación con los experimentos in vitro. En primer lugar, la preparación de la muestra que hay que hacer correctamente y consistentemente para lograr la misma concentración de material hiperpolarizado en cada experimento. Esto requiere un pesaje preciso tanto de la muestra a ser hiperpolarizado y el tampón. Si la concentración no es correcta, el pH final de la solución no es precisa, lo que puede tener una influencia en T 1 y las respuestas de las células. También es crucial para manejar las células lo más uniformemente posible. Las células siempre deben estar preparados de tal manera que hay un retraso mínimo entre la cosecha de células y la posterior experimento con el fin de minimizar la duración de tiempo que las células se mantienen a un nivel muy alto concentration y bajo volumen. La variación en el protocolo de preparación de célula, tal como un diferentes tiempos de preparación o temperaturas, podría dar como resultado variaciones sustanciales en los datos obtenidos. La mezcla de la muestra con las células también debe ser estandarizado. Es importante medir el tiempo entre las adiciones de trazador a la suspensión celular y el comienzo de la medición, ya que esto puede variar; durante el análisis de datos, esto debe ser considerado.
La elección correcta de los análisis de datos y el modelado cinético es crucial en la interpretación de los datos adquiridos. El modelo simple es adecuado para una reacción de una manera lineal con una tasa de cambio constante de dos metabolitos. Como se describe en la introducción, el piruvato se somete a varias reacciones enzimáticas y, más importante, también se somete a una reacción de intercambio reversible no enzimática con hidrato de piruvato. Esta reacción juega un papel crucial en los experimentos, y su efecto es bien i demostrón el experimento con 8 × 10 7 células. Aunque la Tabla 1 indica que la concentración relativa piruvato hidrato es similar a otros experimentos, cuando estrechamente investigado en la Figura 6D, se muestra una señal de piruvato hidrato mucho más alta al comienzo del experimento en comparación con los otros experimentos. Sin embargo, cuando la resolución temporal se resume, esta importante información se pierde y se produce un error en la reconstrucción de los datos. Por otro lado, el modelo de diferencial de cambio de dos sitios es una descripción más robusta y precisa de la cinética, ya que incluye la resolución temporal en el cálculo. Por lo tanto, incluye el intercambio no enzimática con hidrato de piruvato, incluso si se intercambia rápidamente con piruvato durante la medición.
Hay varias estrategias de imagen que elegir entre observar la señal hiperpolarizado o para realizar el seguimiento del metabolismo de una molécula hiperpolarizado en preclinical y los estudios clínicos. Durst et al. demostrado las ventajas y desventajas de los diferentes impulsos sequnces 76. La secuencia de imágenes decaimiento de inducción libre desplazamiento químico (FIDCSI) es relativamente sólido, pero tiene un uso limitado de multicorte y la imagen temporalmente resuelto. imágenes espectroscópicas ecoplanar (EPSI) es robusto para cuestiones de gradiente y fuera de resonancia efectos, pero, es propenso a los artefactos de reconstrucción. La descomposición iterativa de agua y la grasa con la estimación de eco asimétrica y mínimos cuadrados (IDEAL) 81, espiral desplazamiento químico de formación de imágenes (ISPCSI), secuencia de pulsos 35, y las imágenes del desplazamiento químico en espiral (SPCSI) tienen altas eficiencias de codificación, pero son sensibles a B 0 falta de homogeneidad. La elección de la secuencia dependerá de las características de escaneado, la cuestión biológica, y el sistema objeto de la investigación.
Hay muchos requisitos que deben cumplirse para la hiperpolarización éxito. Sin embargo, taquí están también varias limitaciones que la técnica hiperpolarizado 13 CMRSI se enfrenta hoy en día. La limitación principal e inmutable es el tiempo de relajación T 1 del núcleo 13 C en la molécula, que define la cantidad de señal detectable disponible en el momento específico de la medición. La señal se reduce en cada excitación RF que causa una pérdida de la señal de hiperpolarización repetidamente durante la adquisición de datos. Otra limitación es el período de tiempo relativamente largo que se requiere para hiperpolarizar una molécula. Esto toma típicamente de 30 a 90 min.
En comparación con otras técnicas de formación de imágenes molécula, tales como [18 F] FDG PET, hiperpolarizado 13 CMRSI no requiere tumores con un aumento de las vías metabólicas glucolíticas y, por lo tanto, el aumento de consumo de glucosa. La técnica muestra un flujo metabólico real en tiempo real. Por otro lado, [18 F] FDG PET no da información directa acerca demetabolismo, pero sólo información indirecta acerca de la acumulación en la zona metabólicamente activa. Esto podría causar un resultado falso negativo, donde el tumor parece ser metabólicamente inactivos, pero en realidad está utilizando diferentes vías metabólicas, tales como glutaminolysis, como fuente de carbono para la proliferación.
En conclusión, DNP disolución se puede utilizar en una variedad de aplicaciones para estudiar una lista ilimitada de enfermedades (como la diabetes) 82, medir el pH 15,36,45, o monitorear los cambios metabólicos en varios tipos de cáncer. Estas mediciones pueden llevarse a cabo en diferentes niveles, a partir de experimentos celulares in vitro, a través de estudios preclínicos en modelos animales (tales como ratones, ratas, conejos, cerdos y perros), a los estudios clínicos en humanos los últimos 57. Las aplicaciones clínicas futuras contará con una herramienta de diagnóstico muy potente y no invasiva que podría no sólo detectar y localizar la enfermedad, sino también permitir la observación del tratamientorespuesta en tiempo real 83.
Divulgaciones
Rolf F. Schulte and Marion I. Menzel are employed with GE Global Research.
Agradecimientos
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, "Imaging for Selection, Monitoring, and Individualization of Cancer Therapies."
Materiales
| Name | Company | Catalog Number | Comments |
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid - 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1x | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
Referencias
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a, Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in't Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine - investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth's magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. - A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59(2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados