Method Article
hyperpolarisiertem
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Zusammenfassung
In den vergangenen Jahrzehnten wurden neue Methoden zur Tumor - Staging, Restaging, Ansprechen auf die Behandlung Überwachung, und ein erneutes Auftreten Nachweis einer Vielzahl von Krebserkrankungen haben in Verbindung mit dem state-of-the-art - Positronen - Emissions - Tomographie mit 18 F-fluorodeoxyglucose ([18 F entstanden ] -FDG PET). 13 C - Magnetresonanz - spektroskopischen Bildgebung (13 CMRSI) ist eine minimal invasive Bildgebungsverfahren, das die Überwachung des Stoffwechsels in vivo und in Echtzeit ermöglicht. Wie bei jedem anderen Verfahren , basierend auf 13 C kernmagnetische Resonanz (NMR), steht sie vor der Herausforderung mit niedriger thermischer Polarisation und einer anschließenden geringen Signal-zu-Rausch - Verhältnis aufgrund des relativ niedrigen gyromagnetische Verhältnis von 13 C und seiner geringen natürlichen Häufigkeit in biologischen Proben. Durch Überwindung hat diese Beschränkungen, dynamische Kernpolarisation (DNP) mit anschließender Probenauflösungs kürzlich häufig verwendeten NMR und Kernspintomographie (MRI) -Systeme zur Messung aktiviert, Studium und Bild Schlüssel Stoffwechselwege in verschiedenen biologischen Systemen. Ein besonders interessantes und vielversprechendes Molekül in 13 CMRSI verwendete [1- 13 C] Pyruvat, die in den letzten zehn Jahren wurde für in vitro, preclinical weithin verwendet worden, und in jüngster Zeit , klinische Studien der zellulären Energiestoffwechsels zu untersuchen bei Krebs und anderen Krankheiten. In diesem Artikel erläutern wir die Technik der Auflösung DNP unter Verwendung eines 3,35 T präklinische DNP Hyperpolarisierer und zeigen seine Verwendung in In - vitro - Studien. Ein ähnliches Protokoll für die Hyperpolarisation kann auch zum größten Teil in in - vivo - Untersuchungen angewendet werden. Dazu verwendeten wir Lactat - Dehydrogenase (LDH) und katalysiert die metabolische Reaktion von [1- 13 C] Pyruvat [1- 13 C] Lactat in einer Prostatakarzinomzelllinie PC3, in vitro unter Verwendung von 13 CMRSI.
Einleitung
Gegenwärtig ist die am weitesten verbreitete klinische Methode für Tumor - Staging, Restaging, Ansprechen auf die Behandlung Überwachung und Rezidiverkennung von einer Vielzahl von Krebserkrankungen [18 F] -FDG PET. 1 jedoch in jüngster Zeit mehrere neue und alternative Ansätze entstanden. Eine dieser Methoden ist 13 CMRSI. Diese Technik beinhaltet die Einführung des 13 C-Moleküls in einer biologischen Probe, durch minimal invasive MRI folgte dem Stoffwechsel in vitro oder in vivo in Echtzeit zu bewerten. Dennoch ist die größte Herausforderung von 13 CMRSI, im Vergleich zu den anderen Verfahren, wie [18 F] -FDG PET oder Computertomographie, ist seine niedrige Signal-zu-Rausch - Verhältnis.
Das NMR - Signal ist direkt proportional zu der Ebene der Polarisation, ein Verhältnis der Spin ½ Keimpopulation Differenz in zwei Energiezustände an der Gesamtbevölkerung (1A). Die Polarisation ist ein Produkt der the gyromagnetische Verhältnis (γ) der Kerne und das Magnetfeld angelegt Festigkeit über der Temperatur. Eine typische Polarisations von 1 H - Kerne ist in der Größenordnung von 0,001% bis 0,005% bei 3 T, das ein relativ schlechtes Signal-Rausch - Verhältnis ergibt. Heutigen state-of-the-art MRI hat nur eine erfolgreiche Bildgebungsverfahren gewesen aufgrund der hohen Fülle von 1 H in biologischen Proben und der hohen gyromagnetischen Verhältnis von 1 H (& gamma; 1H = 42,576 MHz / T). Jedoch beobachtet andere Kerne, wie beispielsweise Kohlenstoff, ist anspruchsvoller. Der einzige stabile, magnetisch aktiven Kohlenstoffisotops 13 C, macht nur 1,1% aller Kohlenstoffatome. Darüber hinaus ist die gyromagnetische Verhältnis von 13 C (γ 13C = 10,705 MHz / T) ist viermal geringer als die von 1 H, zu einer niedrigeren Nachweiseffizienz führt. Insgesamt verursachen die niedrigen 13 C Fülle und niedrige γ 13C Wärme 13 C - Messungen 0,0176% der Empfindlichkeit eines 1 zu erreichen ,H-NMR - Messung in vivo.
Dynamische Kernpolarisation
Eine Methode , um die relativ geringe Empfindlichkeit von 13 C - Messungen zu überwinden , ist DNP. Es wurde ursprünglich im Jahre 1953 von Albert W. Overhauser- für Metalle beschrieben. In seinem Artikel, er sagte: "Es wird gezeigt , dass , wenn die Elektronenspinresonanz der Leitungselektronen gesättigt ist, werden die Kerne in gleichem Maße polarisiert werden sie , wenn ihr gyromagnetische Verhältnis , dass waren der Elektronenspin sein würde." 2 Später in diesem Jahr, Carver und Slichter experimentell bestätigt Overhauser- Hypothese 3. Im Jahr 1958 beschrieben Abragam und Proctor diesen Effekt für Elektronen in Flüssigkeiten und nannte sie die "solid-Effekt." Bei Temperaturen unterhalb von 4 K, Elektronenspinpolarisation erreicht fast 100% und mehr als drei Grßenordnungen höher als die Kernspinpolarisation (1B) 4. Tseine tritt auf, weil das gyromagnetische Verhältnis des Elektrons (γ e = 28.024,944 MHz / T) um drei Größenordnungen höher ist als die Kern gyromagnetischen Verhältnisse. Die schwachen Wechselwirkungen zwischen Elektronen und Kernen, wie beispielsweise die Overhauser-Effekt, der festen Wirkung, den Quereffekt und der thermischen Mischwirkung ermöglichen die Übertragung der Polarisation von Elektronen an Kernspins dreht unter Verwendung von Mikrowellenbestrahlung mit einer Frequenz nahe der entsprechenden Elektronen Spinresonanz (EPR) Frequenz 5,6. DNP Theorie wurde weiterentwickelt mehr Elektronen und thermische Vermischung einzubeziehen. Trotzdem bisher wurde 7,8 veröffentlicht keine einheitliche quantitative theoretische Beschreibung von DNP.
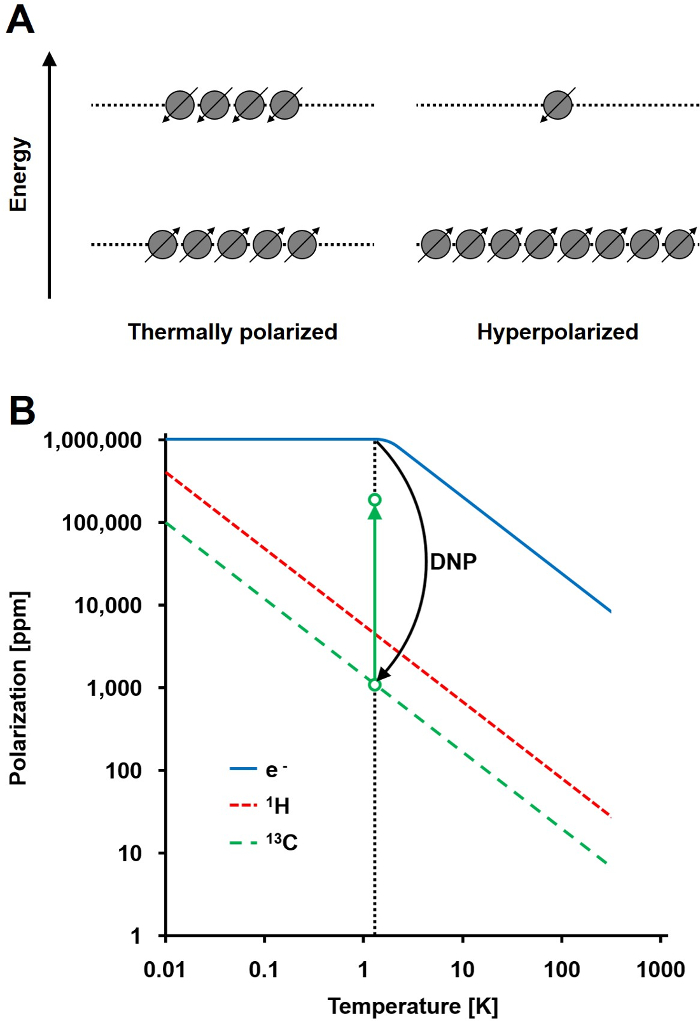
Abbildung 1: Dynamische Kernpolarisation und Hyperpolarisation zu verstehen. A) Ein schematischer Vergleich der Spinpopulationim thermischen Gleichgewicht Polarisationszustand und dem hyperpolarisierten Zustand. B) Die Polarisation ist abhängig von der Temperatur. Die Polarisation eines Elektrons (e -) erreicht 100% unter 1,4 K. Die DNP ermöglicht den Transfer der Polarisation von dem e- an die 13 C - Kerne, die bis zu 10 5 -fache ihrer Polarisation erhöht. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
DNP in Studien von biologischen Systemen Auflösung entwickelt hatte , werden unter Verwendung von 13 C - NMR, anschließende schnelle Probe einzuführen. 50 Jahre nach Overhauser- Hypothese, Jan H. Ardenkjaer-Larsen et al. löste das technisch anspruchsvolle Ausgabe 6 das hyperpolarisierte gefrorene Probe in den flüssigen Zustand mit einem minimalen Verlust von Hyperpolarisation zu bringen. Die Auflösung DNP eröffnet ein neues Forschungsgebiet 13 CMRS genanntI, die Bereitstellung eines neuen Verfahrens zu untersuchen und zu verschiedenen Krankheitszuständen 9,10 charakterisieren. Als stabile Träger eines ungepaarten Elektrons, ein Tritylrest Tris (8-carboxy-2,2,6,6-tetra (hydroxyethyl) -benzo- [1,2-4,5] -bis- (1,3) -dithiole-4-yl) methyl-Natriumsalz (OX063) oder (2,2,6,6-tetramethylpiperidin-1-yl) oxyl (TEMPO) wird üblicherweise verwendet. Diese werden mit der gewünschten 13 C-markiertes Molekül vermischt und ausgesetzt einer Mikrowellenbestrahlung mit einer Frequenz nahe der entsprechenden EPR - Frequenz. Unter Verwendung dieser Technik kann die Polarisation von 13 C - Kerne erhöht werden bis zu 37% 11. Dies führt zu einem 10 5 -fachen Polarisations Verbesserung gegenüber dem thermischen Gleichgewicht Polarisations 11,12. Jedoch, sobald die Mikrowellenbestrahlung gestoppt wird und / oder dem 13 C-Molekül in den flüssigen Zustand überführt wird, fällt die Polarisations mit der longitudinalen Relaxationszeit (T 1) des 13 C - Kern , die polarisiert wurde. Und so kam es dass derErfindung der schnellen Auflösung Techniken oder jede nachfolgende Technik die Zeit vor dem experimentellen Messung Verkürzung (dh Injektion) für biologische Anwendungen 13 von entscheidender Bedeutung ist.
Es gibt drei wichtige Anforderungen , die das Kandidatenmolekül für eine erfolgreiche 13 CMRSI Studien erfüllen muss. Erstens hat der 13 C - Kern von Interesse eine ausreichend lange T 1 haben (> 10 s). Die Wahl der 13 C-Markierung ist von entscheidender Bedeutung. Die besten Kandidaten Kerne sind Kohlenstoffe ohne direkten Kontakt mit 1 H-Kerne über eine Bindung. Es muss auch schnell innerhalb von 2 metabolisiert werden - 3 T 1 Mal in einem nachgeschalteten Stoffwechselprodukt entstehende mit deutlich unterschiedlichen chemischen Verschiebung von der ursprünglichen Substanz. Das Gemisch Probe muss auch ein amorphes Glas , wenn es in einem festen Zustand bilden , so daß die räumliche Verteilung des Abstandes zwischen dem Elektron und 13 C abnimmt, so dass die transfer der Polarisation. Wenn das Kandidatenmolekül natürlicherweise nicht amorphes Glas bilden, muss sie sehr gut löslich in einem Verglasungsmittel sein, wie Glycerin oder Dimethylsulfoxid 14. Diese Anforderungen führen zu einer relativ geringen Anzahl von Kandidatenmolekülen. Aber auch nach dem erfolgreichen Entdeckung eines geeigneten Moleküls kann ein Arbeitsprotokoll für Hyperpolarisation der Entwicklung technisch anspruchs 9,14,15.
Erfolgreich polarisiert, wie [1- 13 C] Pyruvat 12,16 In den letzten Jahren wurden mehrere Substrate gewesen - 36 [2- 13 C] Pyruvat - 37, [1- 13 C] Ethylpyruvat 38, [1- 13 C ] Lactat 39, [1- 13 C] Fumarat 40-43, 13 C-Bicarbonat 36,44,45, [1- 13 C] Natriumacetat 43,46 - 49, 13 C-Harnstoff - 6,36,50,51 [5- 13 C] glutamine 15,52,53, [1- 13 C] Glutamat 53,54, [1- 13 C] 2-Oxoglutarat 55, [1- 13 C] Alanin und andere 14,56. Eine besonders interessante und häufig verwendete Substrat für die Hyperpolarisation ist [1- 13 C] Pyruvat. Es ist weit verbreitet in der präklinischen Studien 14,17,22 der zellulären Energiestoffwechsel bei verschiedenen Erkrankungen zu untersuchen. [1- 13 C] Pyruvat erfüllt alle Anforderungen für eine erfolgreiche Hyperpolarisation, einschließlich einer relativ langen T 1 und schnellen Transport über die Zellmembran , bevor anschließend metabolisiert wird. Präklinische Studien mit [1- 13 C] Pyruvat sind zur Zeit in der Klinik 57 übersetzt.
Metabolismus von Pyruvat
Es ist bekannt, dass es eine direkte Verbindung zwischen Mutationen in einem Krebszellen DNA und Veränderungen in ihrer Stoffwechselwege ist. Bereits in den 1920er Jahren, Otto Warburg DiscovEred , dass es in Tumoren im Vergleich zu gesundem Gewebe 58 einen erhöhten Stoffwechsel von Glukose und Produktion von Laktat - 60. Anschließend verschiedene Änderungen in anderen Stoffwechselwegen, wie dem Pentose-Phosphat-Weg, den Tricarbonsäurezyklus, oxidative Phosphorylierung und die Synthese von Nukleotiden und Lipiden, sind beschrieben worden.
Pyruvat ist das Endprodukt der Glykolyse. Im Tumor, erfährt er anaerobe Glycolyse von LDH katalysierte 61 und reagiert mit der reduzierten Form des Nicotinamid - adenin - dinucleotid - Coenzym (NADH), was zu Laktat und der oxidierten Form des Coenzyms (NAD +). Alternativ erfährt Pyruvat eine Transaminierung mit Glutamat Alanin zu bilden, durch die Alanin-Transaminase katalysierte (ALT). Beide Reaktionen sind leicht reversibel. Pyruvat erfährt auch Decarboxylierung von Pyruvat-Dehydrogenase katalysiert (PDH) zu Kohlendioxid und Acetyl-CoA, reine irreversible Reaktion in diesem Schritt epresenting. Abwechslungen in diesen Reaktionsraten können auf Tumormetabolismus 17,21,22,25,62 verknüpft werden. Die Stoffwechselwege sind in Figur 2 zusammengefasst.

Abbildung 2: Schematische Darstellung der wichtigsten Stoffwechselreaktion von Pyruvat. Pyruvat / Laktat-Umwandlung wird durch LDH katalysiert, und Pyruvat / Alanin Umwandlung wird durch ALT katalysiert. Pyruvat wird irreversibel an Acetyl-CoA und CO 2 durch PDH umgewandelt und CO 2 in einem pH-abhängigen Gleichgewicht mit Bicarbonat 80. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Der Nachweis von hyperpolarisiertem [1- 13 C] Pyruvats und seiner Metaboliten wurde in der Ratte zuvor gezeigt erKunst 37,63 - 65, Leber 66, Muskel und Niere 62,67. Eine Studie zeigte signifikante Unterschiede in der Lactat-zu-Alanin - Verhältnis zwischen der normalen und fasteten Rattenleber 66 und zeigten eine stark erhöhte und hyperpolarisiertem [1- 13 C] Laktatspiegel in Leberkrebs 68,69. Es gibt Anzeichen dafür , dass die Tumorgrad kann in einem transgenen Maus - Adenokarzinom der Prostata (TRAMP) unter Verwendung von hyperpolarisiertem [1- 13 C] Pyruvat - 22, mit dem hyperpolarisierten Laktatspiegel zeigt , die eine hohe Korrelation mit dem histologischen Grad der herausgeschnittenen Tumoren identifiziert werden. Das Alanin aus Pyruvat durch ALT katalysiert wurde auch als ein nützlicher Marker in rat hepatozellulären Karzinoms 23 vorgeschlagen.
Messung der Pyruvat-Lactat metabolischen Flusses wurde zur Überwachung Ischämie 63,65,70 und als Reaktion auf die Behandlung mit einer zytotoxischen Chemotherapie 17,40, zielgerichtete Medikamente verwendet 24,25,41 oder Strahlentherapie 26 in Tiermodellen. Es wurde auch für den Nachweis der Phosphatidylinositol - 3-Kinase (PI3K) -Inhibitor LY294002 Reaktion in Glioblastom und Brustkrebs Mausmodellen 25 verwendet. Veränderungen im Pyruvatstoffwechsels bei Hirntumoren 26 und Prostatakrebs 24,71 haben auch nach der Behandlung beobachtet.
Prostatakarzinom
Das Prostatakarzinom ist die vorherrschende Krebs bei älteren Männern und der zweite bei Männern weltweit 72 zum Tode im Zusammenhang mit führenden Krebs. Bisher wurden keine zuverlässigen, nicht-invasive Methoden zur Verfügung , für eine frühe Diagnose und Charakterisierung von Prostata - Krebs 73,74, die dringende Notwendigkeit für neuartige metabolische Bildgebung Techniken betont strenge Erkennung und Durchführung von Patienten zu ermöglichen. Das Prostatakarzinom wurde als Modell verwendet , mit 13 CMRSI in Patienten kombiniert die Möglichkeiten der Auflösung DNP zu demonstrierens 57. Diese Arbeit wurde in einer ersten klinischen Studie unter Verwendung fortgesetzt [1- 13 C] Pyruvat und 13 CMRSI für die Abbildung von Prostatakrebs, und es hat gerade abgeschlossen kürzlich (NCT01229618).
Die Motivation hinter dieser Arbeit war die Anwendung der 13 CMRSI Methode in einer präklinischen Einstellung mit Zellen im Detail und für ein breiteres Publikum zu illustrieren. Messung der LDH-katalysierten Metabolismus von [1- 13 C] Pyruvat [1- 13 C] Lactat in vitro in der PC3 Prostata - Karzinom - Zelllinie, zeigen wir die mögliche Anwendung der Auflösungs DNP in in vitro - Studien und adressieren die entscheidenden Schritte und Herausforderungen während der Experimente.
Protokoll
1. Probenstammlösung Vorbereitung
- Hinzufügen gadoterate Meglumin (GADM, 0,5 mol / L) zu konzentrierter [1- 13 C] Brenztraubensäure mit einer Endkonzentration von 1 mmol / L GADM zu geben. Hinzufügen Tritylrest Tris (8-carboxy-2,2,6,6-tetra (hydroxyethyl) -benzo- [1,2-4,5] -bis- (1,3) -dithiole-4-yl) - methyl Natriumsalz (OX063) zu dieser Mischung zu einer Endkonzentration von 15 mmol / L zu ergeben. Vortex bis zur vollständigen Auflösung.
HINWEIS: Diese Stammlösung Vorbereitung ist für den Gebrauch entwickelt, um mit einem 3,35-T präklinischen DNP Hyperpolarisierer. Wenn ein 7-T klinischen Hyperpolarisator verwendet wird, wird die gadoterate Meglumin nicht erforderlich, da bei einem höheren Magnetfeld seine Vorteile vernachlässigbar sind. Die Zugabe eines Gadolinium-basierte Kontrastmittel erhöht die erreichbare Festkörper Polarisation und auch die Polarisationsrate. Jedoch im flüssigen Zustand verkürzt das Kontrastmittel die T 1 -Relaxationszeit.
2. Wachsende die Zellkultur
- Grow PC3 - Zellen in einem Kulturkolben mit einer 125-cm 2 Wachstumsbereich. Verwenden F-12K - Medium mit 10% fötalem Kälberserum (FCS) und halten die Zellen bei 37 ° C in einer befeuchteten Atmosphäre bei 5% CO 2. Vor dem Auflösungsschritt, entfernen Sie das Medium aus dem Kulturflasche.
HINWEIS: Jede Zelllinie erfordert eine besondere Vorschrift für die Zellvermehrung. Konsultieren Sie die Anforderungen mit der Zelllinie Anbieter.
3. Vorbereitung der Zellen für das Experiment
- Entfernen Sie die Zellmedium und Waschen der Zellen mit ~ 10 ml phosphatgepufferter Salzlösung (PBS).
- 5 ml Trypsin in den Kolben und das Rück die Zellkulturflaschen in den Inkubator für 3 bis 5 min.
- In ~ 5 ml F-12K-Medium um das Trypsin zu deaktivieren.
- Zählen Sie die Zellen, die eine automatische Zellzähler verwendet wird. Mischen 10 ul der Zelllösung mit 10 & mgr; l der Färbelösung. Gut mischen mit der Pipette und Transfer 10 ul des Gemisches in the Kammer eines "Zählen Glas".
- Entfernen und die Zellen in den Kolben zählen (s). Übertragen die entsprechenden Mengen der gewünschten Anzahl an Zellen enthalten , (beispielsweise 5 x 10 6 bis 10 8) in Kunststoffröhrchen.
- Zentrifugieren Sie die Zellen bei 1.200 × g für 5 min und den Überstand verwerfen.
- Wieder die Zellen in der F-12K-Medium mit 10% FCS auf ein Gesamtvolumen von 800 & mgr; l und übertragen diese in einen Reaktionsbecher (2 ml). Setzen Sie den Reaktionsbecher in eine Plastikflasche mit warmem Wasser gefüllt.
4. Die Auflösung Mittelzubereitung
HINWEIS: Die Auflösungsmittel ist eine Flüssigkeit, die verwendet wird, um die hyperpolarisierte Probe aufzulösen. In biologischen Anwendungen wird die Auflösung in der Regel mit H 2 O-basierten oder Deuteriumoxid (D 2 O) -basierte Puffer, wie PBS oder Tris (hydroxymethyl) aminomethan (Tris), enthaltend 1 g / l Ethylendiamintetraessigsäure (EDTA) durchgeführt.
- preparation von 20 mmol / l PBS-Puffer
- Zur Herstellung von 100 ml des Lösungsmittels löst man 36 mg Mononatriumphosphat (NaH 2 PO 4), 247 mg Dinatriumphosphat (Na 2 HPO 4) und 10 mg EDTA in einer Lösung von 20 mmol / L Natriumhydroxid ( NaOH) in D 2 O Mix richtig bis zur vollständigen Auflösung.
HINWEIS: EDTA (1 g / l) wird zu dem Puffer möglich ferromagnetischen Ionen zu eliminieren, die den hyperpolarisations verderben können. Das NaOH wird die Brenztraubensäure in einem 1-zu neutralisieren: 1 Mol-Verhältnis mit einem pH von 7,4 zu erreichen.
- Zur Herstellung von 100 ml des Lösungsmittels löst man 36 mg Mononatriumphosphat (NaH 2 PO 4), 247 mg Dinatriumphosphat (Na 2 HPO 4) und 10 mg EDTA in einer Lösung von 20 mmol / L Natriumhydroxid ( NaOH) in D 2 O Mix richtig bis zur vollständigen Auflösung.
5. Variable Temperatur Insert (VTI) Aufladezeit
- In der DNP-NMR-Polarisator Programm-Hauptfenster klicken Sie auf "Abklingzeit wurde."
HINWEIS: Diese schaltet die Vakuumpumpe und evakuiert die VTI auf ca. 5,0 mbar. Anschließend öffnet sich das Nadelventil zwischen dem VTI und dem Flüssigheliumbehälter voll, so dass flüssiges Helium in den VTI zu fließen. Die Fließgeschwindigkeit beträgt regulated durch das Nadelventil die optimale Menge an flüssigem Helium in der VTI zu halten, bis sie die Temperatur siedenden Helium erreicht. Dann wird der VTI zu einer fast vollständigen Vakuum evakuiert und die Temperatur erreicht etwa 1,4 K. Der VTI mit flüssigem Helium bis zu 65% gefüllt ist. An diesem Punkt ist das Instrument für die Proben Einsetzen bereit.
6. Probenvorbereitung und Insertion
- Mit Hilfe einer Mikropipette, fügen ~ 8 & mgr; l von 13 C-markierten Probe Stammlösung in einem Plastikbecher.
- Bringen Sie die Plastikbecher an den Einführungsstab und starten Sie die Probeneinführungsprozess durch "Insert Probe" im Hauptprogrammfenster drücken. Wählen Sie "Normal Probe" und klicken Sie auf "Weiter".
HINWEIS: Bei diesem Verfahren wird zunächst das Nadelventil schließt den Fluss von flüssigem Helium in VTI einzustellen, und der Druck in der VTI steigt dann. Der Probenhalter innerhalb des VTI von der flüssigen Heliums erhöht, das Einlassventilan der Spitze des VTI öffnet, und ein gasförmiges Helium Strom von dem Einlaßventil eingeführt außerhalb Kontamination durch Luft Feuchtigkeit zu verhindern. - Wenn Sie gefragt werden, drücken Sie den Einführungsstab mit dem daran befestigten Plastikbecher nach unten in den VTI. Achten Sie darauf, den Probenhalter am unteren Rand des VTI zu erreichen. Andernfalls kann das gasförmige Helium die Probe drücken aus dem VTI.
- Lösen und den Einführungsstab entfernen.
- Beenden Sie den Vorgang mit "Weiter" im Dialogfenster klicken. Die Probe Insertionsvorgangs sollte nicht länger als 10 s.
HINWEIS: Das Einlaßventil schließt sich dann das gasförmige Helium Strom unterbrochen wird, wird der Probenhalter mit den Probenbecher in flüssiges Helium eingetaucht, und das Nadelventil geöffnet wird, das flüssige Helium zu ermöglichen, in die VTI zu fließen. Nach 5 - 10 min wird die VTI unter 1,4 K, abgekühlt alle freien Elektronen ermöglicht polarisiert werden. - Bestätigen Sie, dass die Plastikbecher mit der Probe durch Prüfen t richtig in die VTI eingeführt wurdeHut wird es nicht zu der Einführungsstange angebracht oder von der VTI durch Heliumgas verdrängt. Klicken Sie dann auf "Fertig stellen."
7. Mikrowelle Sweep (optional)
HINWEIS: Ein Mikrowellen Sweep ermöglicht die Bestimmung der optimalen Mikrowellenfrequenz des hyperpolarisations Rate der 13 C - Kerne in der Zielverbindung zu maximieren.
- Um die Mikrowelle Sweep messen, starten Sie das Programm RINMR, Typ "HYPERSENSENMR", und klicken Sie auf "Wählen Sie Config" und "Do Microsweep."
- Um den Prozess, wählen Sie die "kalibrieren" auf die Registerkarte Hauptfenster des Programms starten.
- Klicken Sie auf "Generieren" und wählen Sie den Anfang und das Ende Frequenz (zB 94,100 GHz-94,200 GHz), die Frequenzschrittgröße (zB 20 MHz), die Leistung (100 mW) und die Zeit (60 s). Klicken Sie auf "Weiter", "Enable" und "Start".
HINWEIS: Mit diesen Einstellungen die Hyperpolarisierer erste polarisiert die Probefür 60 s einer Mikrowellenfrequenz von 94,100 GHz und einer Leistung von 100 mW verwendet wird. Dann gilt es eine 90 ° Hochfrequenz (HF) -Impuls und erfasst das hyperpolarisierte 13 C - Signal des Einbau-Spektrometers. Diese Schritte werden für jeden Schritt wiederholt in bestimmten Frequenzbereich. Für nachfolgende Hyperpolarisation, wählen Sie die Mikrowellenfrequenz mit der maximalen Signalamplitude gemessen.
8. Polarization
- Um den Aufbau der Polarisation zu messen, starten Sie das Programm RINMR, Typ "HYPERSENSENMR", und klicken Sie auf "Wählen Sie Config" und "Solid Aufbau."
- In der DNP-NMR-Polarisator Programmhauptfenster auf "Polarization", um den Prozess in Gang Hyperpolarisation.
- Wählen Sie die optimale Mikrowellenfrequenz (während der Mikrowellen Sweep erhalten) und die Leistung (zB 100 mW) für die Probe und klicken Sie auf "Weiter" .
- Enable "den Aufbau der Polarisation Überwachung" und klicken Sie auf "Fertig stellen."
- Polarisieren der Probe auf> 95% (~ 60 min für [1- 13 C] Pyruvat).
HINWEIS: Bei der Polarisation, Mikrowellen werden in die VTI geführt und auf die Probe, so dass die 13 C - Spins mit dem hyperpolarisierten ungepaarten Elektronenspins auszurichten. Um die Hyperpolarisation Anhaftungen, RF - Impulse mit einem Flipwinkel (FA) von 5 ° messen angewendet periodisch (beispielsweise alle 300 s) und das resultierende Signal wird als Polarisationsaufbaukurve aufgetragen.
9. Auflösung
- Wenn die Polarisation erreicht> 95%, initiieren den Auflösungsprozess durch "Auflösung" in der DNP-NMR-Polarisator Programmhauptfenster klicken.
- Wählen Sie den Auflösungsprozess aus dem Drop-Down-Menü und klicken Sie auf "Weiter".
HINWEIS: Der Polarisator ermöglicht es, die gewünschte Auflösungsprozess zu definieren, indem die Zeitsteuerung des Verfolgergas wählen. - Last ~ 5 ml des Lösungsmittels durch das obere Ventil in einen beheizten Behälter in ter Auflösung Teil des Polarisierers. Berechnen Sie die exakte Volumen des Lösungsmittels benötigt folgende Gleichung verwendet wird:
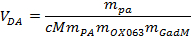
wobei V DA das gewünschte Volumen des Lösungsmittels, m PA, m OX063 und m Gad sind die Massen des Pyruvat, OX063 und gadoterate Meglumin ist jeweils zu der Probenstammlösung. - Legen Sie die Auflösung Stick in der aktiven Position über dem Einlassventil.
HINWEIS: Dies ermöglicht das Gerät seine Auflösung Instrumentierung zu den Probenbecher in der VTI zu verbinden. - Klicken Sie auf "Fertig stellen", um den Auflösungsprozess zu starten.
HINWEIS: Die Auflösungsmittel zu 3 bar mit Heliumgas unter Druck gesetzt wird und anschließend auf 200 ° C erhitzt, eine Druckerhöhung verursacht wird. Wenn der Druck 10 bar erreicht, schließt sich das Nadelventil den Fluss von flüssigem Helium in die VTI einzustellen. Der Probenhalter wirft die Schaleaus dem flüssigen Helium. Die Auflösung Stick wird in den VTI abgesenkt und auf der Probenschale verbunden. Das konditionierte Lösungsmittel wird durch den Druck gedrückt wird, die sich von dem Heizbehälter führt die Auflösungspuffer und Heliumgas, durch die Auflösung Stock auf den Becher enthält, eine schnelle Auflösung der Probe verursacht. Die Lösung fließt dann in die Sammelkolben über Kunststoffschlauch. Die Auflösung Stick mit dem daran befestigten Becher wird dann von der VTI angehoben. - Bewegen Sie die Auflösung Stick mit dem daran befestigten Becher auf die "Reinigung" Position und den Prozess beenden, indem Sie auf "Fertig stellen."
10. Nachweis des 13 C Hyperpolarisierte Signal
- 13 C metabolischen Magnetresonanzspektroskopie in vitro
- Mischungs 200 ul der 20 mmol / l gelöst hyperpolarisierten Probe aus dem Sammelkolben mit 800 ul der Zelllösung.
HINWEIS: Die resultierende Endkonzentrationvon [1- 13 C] Pyruvat 4 mmol / L. - Mischen Sie die Suspension auch mit einer Mikropipette und Transfer ~ 600 & mgr; l in einem 5-mm-NMR-Röhrchen.
- Legen Sie die 5-mm-NMR-Röhrchen in das 1-T-NMR-Spektrometer. Im Hauptfenster der Software, klicken Sie auf "Ausführen", um die Messung zu starten, alle 3 s Reihe von hundert 10 ° HF-Impulse anwenden.
HINWEIS: Messen der Zeit zwischen dem anfänglichen Mischen der hyperpolarisierten Probe mit den Zellen und dem Beginn der spektroskopischen Akquisition. Sicherzustellen, dass der Mischvorgang nicht mehr als 30 s nicht überschreitet Polarisationsverlust zu minimieren.
- Mischungs 200 ul der 20 mmol / l gelöst hyperpolarisierten Probe aus dem Sammelkolben mit 800 ul der Zelllösung.
- 13 C metabolischen Magnetresonanztomographie
- Um einen Behälter für die in - vitro - Experimenten unter Verwendung des MRI - Spektrometer bauen, nehmen Sie eine 5-ml - Spritze und verbinden Sie es mit einem Katheter (d = 1,2 mm) , die lang genug ist , aus dem Spektrometer des Iso-Zentrum zum ansprechbar Bereich des zu erreichen Spektrometer.
- Füllen Sie den In - vitro - Behälter mit the Zell - Lösung der gewünschten Konzentration für das Experiment (beispielsweise 10 8) oder mit einer enzymatischen Lösung.
- Legen Sie eine in vitro Behälter im Isozentrum des MRI - Magneten. Legen Sie eine 13 C-abgestimmten Hochfrequenzempfängerspule auf dem Behälter. Legen Sie eine konzentrierte 13 C-markierten Kalibrierphantom (zB 10-mol / L 13 C-Harnstoff) in der Nähe.
- Legen Sie die "In - vitro - Container" in der Nähe des Iso-Zentrum des NMR - Scanner.
- Führen Sie die Standard - 3-Ebene Lokalisierungssequenz des Scanners und stellen Sie die in - vitro - Behälter die Position der Iso-Zentrum, je nach Bedarf.
- Führen Sie einen 1 H T2-gewichteten "anatomischen" Sequenz für den in - vitro - Behälter Lokalisierung. Verwenden Sie die folgenden Einstellungen: 2D - Spin - Echo mit axialer Ausrichtung, Wiederholungszeit (TR) = 2.000 ms, Echozeit (TE) = 20 ms, Schichtdicke = 1 mm, Sichtfeld für den in - vitro - Behälter, und16 Echos pro Anregung. Stellen Sie sicher, dass Feld Shim auf Protonen bei diesem Schritt durchgeführt wird.
- In den anatomischen Bilder, wählen Sie 5 angrenzend an die Region von Interesse zentriert Scheiben. Verschreiben eines 13 C - spektroskopische Kalibrierung Erwerb Abdeckung der ausgewählten anatomischen Scheiben schneiden. Verwenden Sie die folgenden Einstellungen: 2D-Block-Siegert Kalibriersequenz mit axialer Ausrichtung 12 x 12 centric codiert, TR = 1000 ms, Schichtdicke = 5 mm, Sichtfeld passende anatomische Bilder, die Anzahl der Scans (NS) = 64, Bandbreite = 5000 Hz und FA = 90 °.
- Wählen Sie die 13 C - spektroskopischen Kalibrierungssequenz (für weitere Informationen siehe Schulte et al. 2011) 75 von der Pulssequenzbibliothek. Laden Sie die Pulsfolge an den Scanner vom Computer, indem Sie auf "Download". Klicken Sie auf "Spectra Prescan", um die spektroskopischen Prescan laufen. Im Spektrum Größe Grundstück, stellen Sie die Spitze aus dem 13 C Kalibrierphantom zum center der Scannerfrequenz. Stellen Sie die Empfänger Gewinne auf das Maximum. Klicken Sie auf "Start" , um die 13 C - spektroskopische Kalibrierung nacheinander ausgeführt. Notieren Sie sich die gemeldete Sendeverstärkung und zentrierte Frequenz.
- Legen Sie eine 13 C chemical shift imaging (CSI) Erwerb Abdeckung der ausgewählten anatomischen Scheiben schneiden. Verwenden Sie die folgenden Einstellungen: 2D-Echo-Planar-spektroskopischen Bildgebung (EPSI) mit axialer Ausrichtung 12 x 12 centric codiert, TR = 400 ms, Schichtdicke = 5 mm, Sichtfeld passende anatomische Bilder, NS = 300 und Bandbreite = 5.000 Hz .
HINWEIS: EPSI Proben eine einzelne Zeile im k-Raum wiederholt nach einer HF-Anregung sowohl räumlichen und spektralen Informationen gleichzeitig zu erfassen. Weitere Informationen über die Aufnahmetechniken, siehe den Artikel von Durst et al. 2015 76. - Laden Sie die 13 C - CSI - Sequenz und führen Sie den spektroskopischen Prescan. Stellen Sie den Scanner Frequenz und übertragen die Verstärkung, wie durch die Kalibrierungssequenz angegebenAusgabe.
- Nachdem die hyperpolarisierte Lösung in dem Sammelkolben aufgebracht wird, entwerfen ~ 3 ml in eine Spritze und es dann in den Katheter an den in - vitro - Behälter verbunden injizieren. Starten Sie die Aufnahme. Nach der Akquisition abgeschlossen ist, speichern Sie die Rohdatendatei für eine spätere Rekonstruktion.
11. Datenrekonstruktion
- Wenden Sie eine der beiden beschriebenen kinetischen Modellen der erfassten Daten zu analysieren.
- In dem ersten Verfahren zur Beschreibung der LDH Kinetik kinetische Wert (k), vergleicht die Summe aus dem Lactat - Signal (M LAC) auf das Signal aller hyperpolarisiertem Moleküle (M x) 21,77.
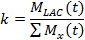
- In dem anderen Verfahren messen die Lactat und Pyruvat - Signale im Laufe der Zeit und passen diese an einem kinetischen Modell 17,25,71. Um die metabolische Wechselkurs zu lösen, k PA → LAC und die effektiveSignalzerfallsrate von Lactat, r LAC, verwenden Sie die folgende lineare Differentialgleichungen der Zwei Ort - Austausch - Differenzmodell, wodurch man für Laktat:
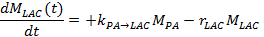
- In dem ersten Verfahren zur Beschreibung der LDH Kinetik kinetische Wert (k), vergleicht die Summe aus dem Lactat - Signal (M LAC) auf das Signal aller hyperpolarisiertem Moleküle (M x) 21,77.
Hinweis: Die effektive Laktat Signal Zerfallsrate r LAC ist abhängig von der Laktat longitudinale Relaxationszeit (T 1, LAC), die gegenüber metabolischen Wechselkurs von Lactat zu Pyruvat k LAC → PA, der angelegten FA und TR und die Signalintensität Pyruvat (M PA) und Laktat (M LAC), unter Berücksichtigung der irreversiblen Signalreduktion nach jedem aufeinanderfolgenden Anregung: 
Daher ergibt r LAC in einem einzigen, untrennbaren Begriff der Signalabfall. Da es möglich ist für t zu korrigieren,er Flip - Winkel und die Wiederholungszeit, und obwohl es ein Fluß LAC → PA ist, gehen wir davon aus, dass der Wechselkurs von Lactat zu Pyruvat (k LAC → PA) muss nicht in die Berechnung einbezogen werden, basierend auf den Ergebnissen der Harrison et al. 2012 78. Ihre Ergebnisse zeigen , dass die k LAC → PA nicht so entscheidend , eine Rolle spielt , wie man annehmen würde. In diesem Modus können die T 1 -Relaxationszeit von Lactat zu quantifizieren. Dieses Modell ist unabhängig von Pyruvat Verabreichung an die Messung, die im Falle von in vitro - Experimenten, ist nicht entscheidend und kann vernachlässigt werden. Sie räumt jedoch ein , spielen eine wichtige Rolle für die in - vivo - Messungen 79.
Ergebnisse
Die Ergebnisse der "Mikrowellen - sweep" sind in Abbildung 3 dargestellt. Es zeigt , dass die optimale Mikrowellenfrequenz für die [1- 13 C] Pyruvat Probe bei 94,156 GHz für die lokale 3.35-T Hyperpolarisierer ist. Alle folgenden hyperpolarisations Experiment (n = 14) wurden unter Verwendung dieser Mikrowellenfrequenz mit einer Leistung von 100 mW durchgeführt. Die Mikrowellenstrahlung wurde 60 bis 80 min aufgebracht wird, auf einen Festkörper-Hyperpolarisation von mehr als 90% führt. Die Ergebnisse sind in Abbildung 4 dargestellt. Die hyperpolarisierten [13 C] Pyruvat wurde mit 5 x 10 6 gemischt (n = 2), 10 7 (n = 2), 2 × 10 7 (n = 1), 3 × 10 7 (n = 2), 4 × 10 7 (n = 1), 6 · 10 7 (n = 2), 8 × 10 7 (n = 2), 10 8 (n = 1) der Zelllinie PC3 Prostatakrebs.
Die resultierenden Daten sind in Figur 5 zusammengefaßt Und 6. Erfassten Daten mit einer spektralen und zeitlichen Auflösung sind in Figur 5A-D und 6A-D, nur mit einer zeitlichen Auflösung für jedes Molekül beobachtet (5E-H und 6E-H) gezeigt ist , und nur mit einer spektralen Auflösung (Figur 5I -L und Figur 5I-L). Wir haben die drei großen hyperpolarisierten Signale beobachtet [1- 13 C] Pyruvat, [1- 13 C] Pyruvat - Hydrat, und [1- 13 C] Laktat, mit chemischen Verschiebungen bei 173 ppm, 181 ppm und 185 ppm, etwa im Verhältnis zur Natriumtrimethylsilylpropionat (TMSP) bei pH 7,4 und die Temperatur 20 ° C. Die Signalverhältnisse zwischen den drei Stoffwechselprodukte sind in Tabelle 1 zusammengefasst. Die Daten zeigen eine klare Korrelation zwischen dem Laktat - Signal und die Anzahl der Zellen in der Probe vorhanden (Abbildung 7). Jedoch sind die Ergebnisseaus den Experimenten mit weniger als 2 × 10 7 Zellen zeigen deutliche Abweichung, wahrscheinlich aufgrund eines niedrigen Signal-Rausch - Verhältnis. Daher schlagen wir vor mehr Zellen als dies für weitere Experimente verwendet. Wenn die relative Lactat Signal (kinetische Wert) durch die Anzahl der Zellen normiert wird (Figur 8), zeigt deutlich ähnliche Aufnahme und Metabolisierung in allen der Zellen. Jedoch gibt es einen Trend pro Zelle Laktatproduktion mit einer zunehmenden Anzahl von Zellen abnimmt. Wir glauben, dass eine der Ursachen der reduzierten Zellstoffwechselaktivität eine sehr hohe Konzentration von Zellen in einem sehr kleinen Volumen, was zu der erhöhten Viskosität der Probe. Die Ergebnisse der Zwei-Stellen - Austauschdifferentialmodell sind in Tabelle 2 und in Figur 9 gezeigt zusammengefasst. Die Daten folgen einem Trend ähnlich dem Vorgängermodell: Erhöhung der k PA → LAC mit einer zunehmenden Anzahl von Zellen. dieses Modell jedoch zur Folge habens in einem steileren Anstieg der Kinetik mit der Anzahl der Zellen. Wenn der Stoffwechsel-Wechselkurs k PA → LAC auf die Anzahl der Zellen normiert ist, können wir einen klaren Trend zur Verringerung der k PA → LAC mit einer zunehmenden Anzahl von Zellen (Abbildung 10) wieder zu sehen.
Figur 11 zeigt die Möglichkeit der Zugabe von räumlichen Lokalisierungs dem Experiment. Es zeigt ein Phantom mit 80 mmol / L hyperpolarisiertem injiziert [1- 13 C] Pyruvat neben einem 10 mol / L 13 C-Harnstoff - Phantom. Die Technik ermöglicht das Erreichen eines Spektrums mit zeitlichen und speziellen Auflösung (11A) oder der Signalabfall der ausgewählten Metaboliten Signale in der Zeit (11B). Die Spektren im Zeitbereich kann auch ein besseres Signal-zu-Rausch - Verhältnis (11C) zu empfangen , aufsummiert werden. Die spezielle Lösung ermöglicht die Auswahl der Region o gewünschte Frequenzf 13 C - Spektrum Zugehörigkeit zu bestimmten Metaboliten, wie beispielsweise [1- 13 C] pyruvat (11D), [1- 13 C] Pyruvat - Hydrat (11E) oder Referenz 13 C-Harnstoff (11F). Es kann mit einem 1 H Bild zusammen registriert werden. Die Impulssequenz verwendet (EPSI) ermöglicht die Erfassung eines Bildes des ganzen Scheibe alle 4,9 s. Zusammenfassend kann diese Technik Daten liefern, mit einer räumlichen, zeitlichen und spektrale Auflösung für jeden Metaboliten.

Abbildung 3: Ergebnisse einer Mikrowelle Sweep mit [1- 13 C] Pyruvat an der Local 3.35-T Hyperpolarisierer. Das Ergebnis der Messungen die optimale Mikrowellenfrequenz Bestimmung der hyperpolarisations Rate von 13 C - Kerne in der Zielverbindung von [1- 13 C] Pyruvat zu maximieren. Die Mikrowellen-Sweep hat eine Form eines EPR AbsorptionsSpektrum. Die Form und die Trennung der Peaks von dem verwendeten Radikal basieren (in diesem Fall Tritylrest) und den größten Einfluss haben eine feste Wirkung und der thermischen Durchmischung. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 4: Solid State Polarization Aufbau eines [1- 13 C] Pyruvat Probe. Ein Durchschnitt von n = 13 Festkörper- Polarisation Panzerungen mit dem Fehler durch die Standardabweichung alle 300 s für bis zu 4.500 s gemessen vertreten. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

5: Ergebnisse der 13 C - NMR - Spektroskopie für die Anzahl der Zellen (5 × 10 6 bis 3 × 10 7 Zellen). Die erfassten Daten aufgezeichnet mit einer spektralen und zeitlichen Auflösung (AD), aufgetragen mit zeitlicher Auflösung nur für [1- 13 C] Pyruvat, [1- 13 C] Pyruvat - Hydrat, und [1- 13 C] Laktat (EH) und aufgetragen mit spektraler Auflösung nur, Summieren aller Zeitschritte (IL). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 6: Ergebnisse der 13 C - NMR - Spektroskopie für die Anzahl der Zellen (4 × 10 7 bis 1 x 10 8 Zellen). Die erfassten Daten mit einer spektralen und zeitlichen Auflösung aufgetragen ( AD), aufgetragen mit zeitlicher Auflösung nur für [1- 13 C] Pyruvat, [1- 13 C] Pyruvat - Hydrat, und [1- 13 C] Laktat (EH) und aufgetragen nur mit einer spektralen Auflösung, alle Zeitschritte Summieren (IL). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
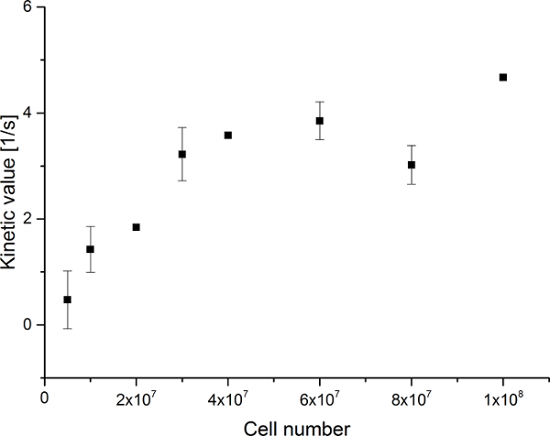
Abbildung 7: Ergebnisse des Simple Metabolit Verhältnis Kinetic Modeling. Daten stellt das Verhältnis des [1- 13 C] Lactat - Signal auf die Summe von [1- 13 C] Pyruvat [1- 13 C] Pyruvat - Hydrat, und [1- 13 C] Lactat gegenüber der Anzahl der Zellen in der Experimente. Der Fehler stellt die Standardabweichung. Pleasen klicken Sie hier eine größere Version dieser Figur zu sehen.
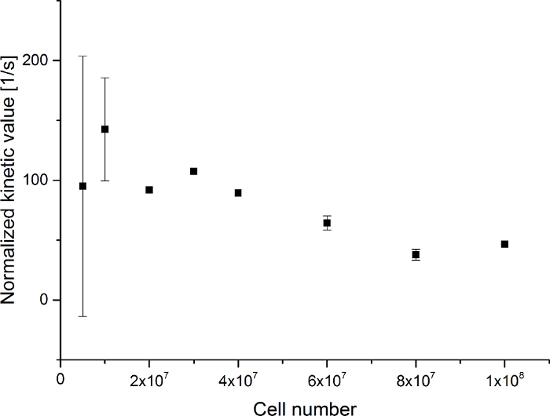
Abbildung 8: Ergebnisse des Simple Metabolit Verhältnis Kinetic Modeling auf die Anzahl der Zellen Normalized. Die Daten stellen das Verhältnis des [1- 13 C] Lactat - Signal auf die Summe von [1- 13 C] Pyruvat [1- 13 C] Pyruvat - Hydrat, und [1- 13 C] Lactat zu der Anzahl der Zellen normiert im Vergleich zu der Anzahl der Zellen in den Experimenten. Der Fehler stellt die Standardabweichung. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 9: Ergebnisse der Zwei-Ort - Austausch - Differential Modell. Die Daten repr ESENT die metabolische Wechselkurs (k PA → LAC) in Abhängigkeit von der Anzahl der Zellen in den Experimenten. Der Fehler stellt die Standardabweichung. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 10: Ergebnisse der Zwei-Ort - Austausch - Differential Modell zur Anzahl der Zellen normalisiert. Die Daten stellen den metabolischen Wechselkurs (k PA → LAC) normiert auf die Anzahl der Zellen im Vergleich zu der Anzahl der Zellen in den Experimenten. Der Fehler stellt die Standardabweichung. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 11: Ergebnis der Magnetresonanz - Bildgebung des hyperpolarisierten [1- 13 C] Pyruvat Probe. A) Das Spektrum über die gesamte Scheibe erworben und alle Zeitschritte. B) Der Zerfall des [1- 13 C] Pyruvat und [1- 13 C] Pyruvat - Hydrat - Signal über die Zeit. Das dritte Signal ist die 10 M 13 C-Harnstoff - Lokalisierung Referenz. C) Das Spektrum aus dem gesamten räumlichen und zeitlichen Auflösung erfasst. D) Das 1 H - Bild mit dem 13 C überlagert Bild des summierten [1- 13 C] Pyruvat - Signal über alle Zeitschritte. E) Das 1 H - Bild mit dem 13 C Bild des summierten [1- 13 C] Pyruvat - Hydrat - Signal über alle Zeitschritte überlagert. F) Das 1 H - Bild mit dem überlagerten 13 C Bild des summierten 13 C-Harnstoff - Signal über alle Zeitschritte (Referenz). Das 13 C-Signal in CE ist normiert auf das Maximum des Signals des spezifischen Metaboliten. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
| Handynummer | ||||||||
| 5 × 10 6 (n = 2) | 10 7 (n = 2) | 2 × 10 7 (n = 1) | 3 × 10 7 (n = 2) | 4 × 10 7 (n = 1) | 6 × 10 7 (n = 2) | 8 × 10 7 (n = 2) | 10 8 (n = 1) | |
| [1- 13 C] Pyruvat | 92,9 ± 1,4 | 91,7 ± 1,0 | 86,7 | 77,5 ± 2,7 | 76 | 69,7 ± 0,5 | 65,9 ± 3,7 | 42.9 |
| [1- 13 C] Pyruvat - Hydrat | 6,8 ± 1,2 | 6,7 ± 1,6 | 9.5 | 10,1 ± 1,8 | 8.9 | 7,7 ± 1,5 | 10,4 ± 0,2 | 13.4 |
| [1- 13 C] Laktat | 0,3 ± 0,3 | 1,6 ± 0,6 | 3.8 | 12,4 ± 4,5 | 15.1 | 22,5 ± 1,1 | 23,7 ± 3,5 | 43.7 |
Tabelle 1: Das relative Verhältnis von hyperpolarisiertem Metaboliten in Bezug auf die unterschiedliche Anzahl von Zellen.
Handynummer 5 × 10 6 (n = 2) 10 7 (n = 2) 2 × 10 7 (n = 1) 3 × 10 7 (n = 1) 4 × 10 7 (n = 1) 6 × 10 7 (n = 2) 8 × 10 7 (n = 2) 10 8 (n = 1) k PA → LAC [* 10 -4] 0,924 ± 0,870 4,984 ± 1,19 15,135 36,289 58,904 112,174 ± 10,491 114,3 ± 37,059 349,234Tabelle 2:Ergebnisse der Zwei-Ort - Austausch - Differential Modell.
Diskussion
13 CMRSI mit hyperpolarisiertem Sonden ist ein vielversprechendes Verfahren Metabolismus in Echtzeit in vitro zu überwachen und in vivo. Ein sehr wichtiger Aspekt , wenn dieses experimentelle Verfahren verwendet , ist die richtige Standardisierung, insbesondere in - vitro - Experimente in Bezug auf . Erstens muss die Vorbereitung der Probe richtig durchgeführt werden, und stets die gleiche Konzentration von hyperpolarisiertem Material in jedem Versuch zu erzielen. Dies erfordert eine präzise sowohl der Probe mit einem Gewicht von hyperpolarisiertem und der Puffer zu sein. Wenn die Konzentration nicht korrekt ist, ist der endgültige pH - Wert der Lösung nicht genau, was einen Einfluss auf 1 T haben kann und die Antworten der Zellen. Es ist auch wichtig, die Zellen möglichst gleichmäßig zu behandeln. Die Zellen sollten immer in einer solchen Weise hergestellt werden, daß es eine minimale Verzögerung zwischen der Zellernte ist und dem nachfolgenden Versuch, um die Dauer der Zeit zu minimieren, die Zellen bei einer sehr hohen conc gehalten werdenentration und geringer Lautstärke. Variation in der Zellpräparationsprotokoll, wie zB eine andere Vorbereitungszeiten oder -temperaturen, könnten erhebliche Variationen in den erhaltenen Daten führen. Das Mischen der Probe mit den Zellen auch standardisiert werden sollten. Es ist wichtig, die Zeit zwischen den Zugaben des Tracers zu der Zellsuspension und dem Beginn der Messung zu messen, da diese variieren können; während der Datenanalyse, sollte dies berücksichtigt werden.
Die richtige Wahl der Datenanalyse und kinetische Modellierung ist von entscheidender Bedeutung bei der Interpretation der erfassten Daten. Das einfache Modell ist für eine lineare Einweg Reaktion mit einem konstanten Wechselkurs von zwei Metaboliten geeignet. Wie in der Einleitung beschrieben ist, unterzogen wird Pyruvat mehrere enzymatische Reaktionen und, was noch wichtiger ist, es auch eine nicht-enzymatische reversible-Austauschreaktion mit Pyruvat-hydrat unterworfen wird. Diese Reaktion spielte eine entscheidende Rolle bei den Versuchen, und seine Wirkung ist i gut demonstriertn das Experiment mit 8 × 10 7 Zellen. Obwohl Tabelle 1 zeigt , daß die Pyruvat - Hydrat relative Konzentration an anderen Experimenten ähnlich ist, wenn eng in 6D sucht, zeigt es eine viel höhere Pyruvat Hydrat Signal zu Beginn des Versuchs im Vergleich zu den anderen Versuchen. Wenn jedoch die zeitliche Auflösung wird zusammengefasst, diese wichtige Information verloren und verursacht einen Fehler bei der Rekonstruktion der Daten. Auf der anderen Seite, die Zwei-Ort-Austausch-Differential-Modell ist ein robuster und genaue Beschreibung der Kinetik, weil sie die zeitliche Auflösung in der Berechnung berücksichtigt. Somit schließt sie die nichtenzymatische Austausch mit Pyruvat-Hydrat, selbst wenn es schnell mit Pyruvat während der Messung austauscht.
Es gibt verschiedene Bildgebungsstrategien zur Auswahl zwischen dem hyperpolarisierten Signal zu beobachten oder den Stoffwechsel eines hyperpolarisierten Molekül in preclinica zu verfolgenl und klinischen Studien. Durst et al. die Vor- und Nachteile der verschiedenen Puls demonstriert sequnces 76. Die freien Induktionszerfalls chemical shift imaging (FIDCSI) Sequenz ist relativ robust, hat aber begrenzte Verwendung für Multi-Slice und zeitlich aufgelöste Bildgebung. Echo-planar spektroskopischen Bildgebung (EPSI) ist für Gradienten Probleme robust und Off-Resonanz-Effekte, aber es Rekonstruktionsartefakte anfällig ist. Die iterative Zerlegung von Wasser und Fett mit Echo asymmetrisch und der kleinsten Quadrate Schätzung (IDEAL) 81, Spiral - chemical shift imaging (ISPCSI), Pulsfolge 35 und Spiral-chemical shift imaging (SPCSI) haben eine hohe Codierungseffizienz , jedoch sind empfindlich gegenüber B 0 Inhomogenität. Die Auswahl der Sequenz wird auf dem Scannereigenschaften hängen, die biologische Frage, und das System untersucht.
Es gibt viele Anforderungen, die für eine erfolgreiche Hyperpolarisation erfüllt werden müssen. Jedoch thier sind auch einige Einschränkungen , dass die hyperpolarisierten 13 CMRSI Technik heutzutage konfrontiert ist . Die primäre und unveränderbar Einschränkung ist die T 1 -Relaxationszeit des 13 C - Kern in dem Molekül, die die Menge des detektierbaren Signals zur Verfügung bei der spezifischen Zeitpunkt der Messung festlegt. Das Signal wird von jedem HF-Anregungs abgesenkt, die wiederholt während der Datenerfassung einen Verlust des hyperpolarisations-Signal verursacht. Eine weitere Einschränkung ist die relativ lange Zeitdauer, die erforderlich ist, um ein Molekül zu hyperpolarisieren. Dies dauert in der Regel 30 bis 90 min.
Im Vergleich zu anderen Techniken der Molekülbildgebung, wie [18 F] -FDG PET, nicht hyperpolarisiertes 13 CMRSI nicht Tumoren mit erhöhter glykolytischen Stoffwechselwege erfordern und daher erhöhten Glukoseverbrauch. Die Technik zeigt einen wirklichen metabolischen Flusses in Echtzeit. Auf der anderen Seite, [18 F] -FDG PET geben keine direkten Informationen überStoffwechsel, sondern nur indirekte Informationen über Akkumulation im metabolisch aktiven Bereich. Dies könnte ein falsch negatives Ergebnis führen, wobei der Tumor metabolisch inaktiv zu sein scheint, aber tatsächlich mit unterschiedlichen Stoffwechselwegen, wie Glutaminolyse, als Kohlenstoffquelle für die Proliferation.
Zusammenfassend kann die Auflösung DNP in einer Vielzahl von Anwendungen verwendet werden , um eine unbegrenzte Liste von Krankheiten zu untersuchen (wie Diabetes) 82, messen pH 15,36,45 oder metabolische Veränderungen in verschiedenen Arten von Krebs zu überwachen. Diese Messungen können auf verschiedenen Ebenen durchgeführt werden, aus in vitro Zellexperimenten durch präklinische Studien unter Verwendung von Tiermodellen (wie Mäuse, Ratten, Kaninchen, Schweine und Hunde), auf die jüngsten klinischen Studien am Menschen 57. Die zukünftige klinische Anwendungen verfügen über eine sehr leistungsfähige und nicht-invasive Diagnose-Tool, das nicht nur erkennen könnte und die Krankheit zu lokalisieren, sondern auch die Beobachtung der Behandlung erlaubenReaktion in Echtzeit 83.
Offenlegungen
Rolf F. Schulte and Marion I. Menzel are employed with GE Global Research.
Danksagungen
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, "Imaging for Selection, Monitoring, and Individualization of Cancer Therapies."
Materialien
| Name | Company | Catalog Number | Comments |
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid - 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
Referenzen
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in't Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine - investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth's magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. - A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten