Method Article
복부 루트 자극에 대한 사선 척수 조각의 준비
요약
우리는 젊은 쥐에서 척수의 경사 조각을 준비하는 방법을 보여줍니다. 이 준비는 복부 뿌리의 자극 수 있습니다.
초록
척수 조각에서 전기 생리 녹음은 네트워크 속성에 휴대 질문의 넓은 범위를 조사 할 가치있는 기술을 입증했다. 우리는 젊은 쥐 (- P11 P2)의 척수의 가능한 경사 조각을 준비하는 방법을 보여줍니다. 이 준비에서의 motoneurons은 축삭은 척수의 복부 뿌리에서 나오는 유지한다. 이 축색 돌기의 자극은 척수 내에서 motoneuron의 somas과 흥미로운 motoneuron의 담보 침입 다시 전파 활동 전위를 이끌어. antidromic 활동 전위의 기록은 다른 식별 방법을 능가 motoneuron 정체성을 특성화하기 위해, 즉시 확정하고 우아한 방법입니다. 또한, motoneuron의 담보를 자극하는 기타 운동 신경원 또는 R와 척수 내에서 운동 신경원의 담보 타겟을 자극하는 간단하고 신뢰성있는 방법은세포를 enshaw. 이 프로토콜에서는, 우리는 복부 루트 자극의 결과는 motoneuron somas뿐만 아니라 렌쇼 세포 여기에서 antidromic 녹음을 제시한다.
서문
역사적으로, 날카로운 전극을 사용 motoneuron 녹음은 고양이 나 쥐 1이나 마우스 2에서 격리 된 전체 척수에 큰 동물 생체 내에서 실시 하였다. somas 필요한 밀봉과 motoneuron에 직접 액세스를 요구 1980 년대 패치 클램프 녹음 기술의 출현은, 시각적 인지도하에 달성 될 수있다. 따라서, 척수 슬라이스 제조 용이 1990 세 이후 달성되었다. 그러나, 초기 슬라이스 준비는 종종 복부 뿌리의 자극을 허용하지 않았다. 우리가 아는 한, 두 연구는 가로 조각의 복부 뿌리를 성공적으로 자극을보고, 아무도는 마우스 4,5에서 얻은되지 않았다.
motoneuron 풀은 복부 루트를 벗어나지 축삭을 유지하는 - (P11 P2)이 문서에서 우리는 신생아 쥐의 생존 척수 조각을 달성하기 위해 기술을 제시한다. 벤트RAL 루트 자극은 같은 복부 루트에서 배출되는 motoneuron 풀의 somas에 다시 antidromic 활동 전위를 트리거합니다. 또한 motoneuron 담보 타겟 다른 운동 신경원 6-10 및 11-13 렌쇼 세포를 여기. 단지의 motoneurons은 복부 뿌리를 자신의 축삭을 보낼 수 있기 때문에, 우리의 motoneurons (10)를 식별 physiologicaly하는 간단하고 확실한 방법으로 antidromic 활동 전위의 기록을 사용합니다.
motoneuron 신원을 확인하기 위해 잠재적으로 비 포함되거나 잘못된 전기 생리 학적 및 criterions에를 사용하는 것 외에도, 척수 운동 신경원에 대한 최근의 연구는 또한 사후 지루하고 시간 소모적 16 염색에 의존. 이러한 식별은 보통 기록 세포 샘플에 대해 수행된다. 다른 식별 전략은 내인성 운동 신경원 형광을 발현하는 마우스 선에 의존 17 ~ 19. 이 연구는 이미 유전자 변형 마우스 줄을 사용하여 필요한 경우 마커의 발현은 여전히 변수 또는 그러나 유전자 인코딩 된 마커를 사용하여 젊은 나이에 어려울 수 있습니다. 대안 적으로, antidromic 활동 전위 기록은 셀 기록의 시작에서 모든 마우스에서 일상적으로 수행 될 수있다. 고양이, 쥐와 마우스에서 손상 척수 준비 작업 실험자은 확실하게 1950 년대 1,2,20,21 이후 같은 식별 기술을 사용했다. 최적의 조건에서 우리는 기록의 motoneurons의 거의 모든에서 antidromic 활동 전위를 유도 할 수 있었다.
또한, 복부 루트 자극을 확실하게 다른 운동 신경원 22, 23 또는 이들의 타겟을 자극하기 위해 사용될 수있다. 렌쇼 세포 10,24,25. 우리는 여기에 motoneuron somas antidromic에서 활동 전위 기록 형태 복부 루트 자극의 응용뿐만 아니라 렌쇼 세포의 자극을 제시한다.
프로토콜
실험은 유럽 지침 (609분의 86 / CEE 및 2010-63-UE)과 프랑스 법률에 따라 수행하고, 파리 데카르트 대학 윤리위원회에 의해 승인되었다.
1. 척수 조각 준비
- 다음 매일 용액 또는 사전에 일일를 준비합니다. 밤새 보관하는 경우, 95 % O 2 5 % CO 2와 거품과는 밀폐 병에 냉장 보관하십시오.
- 저 나트륨 인공 뇌척수액 (ACSF) + 준비 : 3 밀리미터의 KCl을 1 ㎜의 NaH 2 PO 4, 230 mM의 수크로오스, 26 mM의 NaHCO3을 0.8 mM의 CaCl2를 8mm로의 MgCl 2, 25 mM의 글루코스, 0.4 mM의 아스코르브 산, 1 ㎜ 나 - kynurenate, 2 mM의 나트륨 - 피루브산. 95 % O 2, 5 % CO 2 (PH 7.4)와 거품. 나-kynurenate 자주 용해하기 어려운 때문에, 재료 표에 나열된 하나를 구입해야합니다.
- K-글루코 네이트 SOLU 준비기 : KOH으로 pH 7.4으로 조정 된 130 mM의 K 글루코 네이트, 15 mM의 KCl을 0.05 mM의 EGTA, 20 mM의 HEPES, 25 mM의 글루코스, 1 mM의 나트륨 - kynurenate, 2 mM의 피루브산 나트륨 -.
- ACSF 준비 : 130 mM의 염화나트륨, 2.5 mM의 KCl을, 2 mM의 CaCl2를, 1 ㎜의 MgCl 2, 1 ㎜의 NaH 2 PO 4, 26 mM의 NaHCO3을 25 mM의 글루코스, 0.4 mM의 아스코르브 산, 2 mM의 나트륨 피루 베이트. 95 % O 2, 5 % CO 2 (PH 7.4)와 거품.
- 절개의 시작에 앞서, K 글루코 네이트 용액 80 ㎖에 2 % 한천을 용해하고, 60 ° C로 보온.
- 심장 내 관류
- 시대에 P2에서 P11에 이르기까지, 여성과 남성 쥐에이 준비를 수행합니다.
- 25 mM의 나트륨 펜토 바르 비탈 (50 ㎎ / ㎏) 0.1 ㎖를 복강 내 주사하여 마우스를 마취.
- 바늘 또는 테이프를 사용하여, 실리콘 가득 큰 페트리 접시의 뒷면에 마우스를 고정. 해부 현미경을 사용하여해부의 나머지 부분에 대한 전자.
- 흉골의 끝을 잡고 가슴을 들어 올려 미세 가위를 사용하여 조리개를 잘라. 그런 마음을 노출 갈비뼈를 절단하여 양쪽 가슴을 엽니 다.
- 27G 바늘과 좌심실을 천공하기 전에 우심방을 잘라.
- 얼음처럼 차가운 낮은 나 +의 ACSF와 관류. 30 초 후, 낮은 나 + ACSF는 아트리움에서 흐르는 볼 수 있습니다. 나트륨의 낮은 양의 급상승로부터 세포를 방지하고 해부하는 동안 세포 죽음을 줄일 수 있습니다.
- 혈액이 배출 될 때 간은 노란색으로 변할 때까지 해부 현미경으로 심장에 바늘을 들고 보관하십시오.
- 척수의 해부
- 동물의 목을 벨과 그 뱃속에 넣어.
- 빨리 다시 (그림 1A1)의 피부를 제거합니다. 두 컷 어깨 통해 가슴 케이지 (그림 1A2)을 추락합니다. 그런 리터로 코드를 잘라동물의 아래쪽에서 리브의 시작하여 척추를 분리하기 위해 꼬리 섹션 가능한 흐름. 다시 동물 플립 여전히 갈비뼈에 붙어있는 내장을 제거합니다.
- , 다른 척추 열을 이동시켜 작은 실리콘 가득한 페트리 접시과 지느러미 사이드 (그림 1A)를 누르고 4 곤충 핀을 사용합니다.
- 지느러미 측의 추궁 절제술을 수행하고 주동이의 끝 (그림 1B)에서 척수를 노출하는 동안 지속적으로 (약 4 ° C에서) carbogen - 버블 ACSF와 동물을 관류. 이렇게하려면 뼈와 척수 사이의 미세 가위의 끝을 삽입하고 백질 멀리해야하고, 주동이의 끝에서 조금씩 뼈를 잘라. 각면에 다른 뼈의 대역 이미 절단 (그림 1B1)를 멀리 유지하기 위해 핀셋을 사용하는 동안.
- 가장 작은 가능한 스프링 가위와 핀셋을 사용하여, 경질을 들어 올려 컷가위로 척수 손상을 방지하기 위해 양쪽에 경질의 느슨한 부분을 잡고있다. rostro - 꼬리 축을 따라 잘라.
참고 : 두라는 반 투명 연속 막이다 이 나이에 피아 교인이 너무 허약하고 해부와 슬라이스 (그림 1B2) 동안 떨어져 올 것이다. - 경질 제거 사용되면 무딘 유리 또는 플라스틱 팁 부드럽게 하프 컷 척주에 의해 형성된 홈의 왼쪽에있는 코드를 밀어 입쪽 측부터 우측 복부와 등쪽 뿌리 잘라 그들은 (적어도 몇 mm, 그림 1B2) 코드를 입력 곳에서 멀리.
- 항상 입쪽에서 꼬리로 이동, 왼쪽의 동작을 반복한다. 왼손잡이 경우, 왼쪽에서 시작하여 오른쪽으로 이동합니다.
- 한천에 포함
- 척주에서 코드를 슬립. 아래 핀 작은 곤충 핀을 사용하여지느러미와 코드가 최대 표면과 섬세 멤브레인의 조각 여전히 부착 (그림 1C1)을 제거합니다.
- 정리하면, 양쪽 끝 (그림 1C2)을 트림. 코드를 조작하고 방향을주의해야 할 코드의 앞쪽 부분에 굽 곤충 핀을 삽입합니다 (그림 1C2에 화살표). 이어서 빙냉 K 글루코 네이트 용액에 척수 옮긴다.
참고 :이 솔루션은 CSF의 세포 내 성분을 모방와의 motoneurons (26)을 절단됩니다되면 삼투압 충격의 죽어가는 세포를 방지 할 수 있습니다. - 척수는 세포 내 솔루션 내에서되면, 건조 화장실에서 한천로 비커를 타고 얼음과 물의 혼합물에 식혀.
- 온도를 측정하는 동안 교반하십시오. 온도가 38 °에 도달하면 곤충 핀을 잡고, 척수 젖어 아래로 주동이의 측면을 배치 C. 척수가 성으로되어 있는지 확인raight 가능한 한 멀리 꼬리 부분, 벽에서 약간 위쪽 (그림 1D1).
- 한천은 가능한 한 빨리 응고 할 수 있도록 얼음과 물의 혼합물에서 비커를 남겨주세요. 확인이 코드가 가능합니다 (그림 1D1)만큼 직선으로되어 장소에 유지하고 확인합니다.
- 슬라이스
- 응고 후, (도 1D2의 화살표) 블록의베이스 코드의 요부와 35 °의 각도로되는 방식으로 척수를 포함하는 한천 블록을 잘라. 등쪽면은베이스 (그림 1D2)에서 멀리 직면해야한다.
참고 :이에서 나오는 복부 뿌리에 motoneuron 풀의 연속성을 유지하기위한 절차의 중요한 단계이다. - 시아 노 아크릴 레이트 접착제를 사용하여 vibratome의 챔버로 블록을 붙인다. K-글루코 네이트 용액에 담가 및 유지 관리 slushed 냉동 K-글루코 네이트 솔루션을 추가목욕 (2 ℃ 이하) 냉장.
- (곡률과 큰 직경에 의해 식별) 요추 영역의 400 μm의 두께 슬라이스 - 350 컷. 적절한 방향 (1.4.1를 참조하십시오.)에서 복부 표면에 지느러미로부터 절단 및 조각 지속적으로 더 주동이를 만들기 위해 블레이드를 사용합니다. 일반적으로 2 mm 이상 연장 복부 뿌리를 가진 4-5 적합한 조각이있다. 10 ° 각도, 70 Hz의 진동 주파수와 슬라이스의 10mm / 분 속도 : 다음 매개 변수를 사용합니다.
- 응고 후, (도 1D2의 화살표) 블록의베이스 코드의 요부와 35 °의 각도로되는 방식으로 척수를 포함하는 한천 블록을 잘라. 등쪽면은베이스 (그림 1D2)에서 멀리 직면해야한다.
- 잠복
- 34 ° C에서 ACSF에 조각을 전송합니다. 약 30 분 후, RT까지 냉각 슬라이스와 기록 세션을 시작한다.

그림 1. 해부
A1 :. 지느러미 열을 노출 뒤의 피부를 제거 A2 :. 어깨와 갈비뼈 절단는 등의 열 B1을 확보하기 : 실리콘 채워진 페트리 접시에 고정 된 척추 열 (최대 지느러미 쪽, 왼쪽 꼬리 쪽) B2 :. 노출 해부 척수와 같은 C1을 :. 척수 고립 . (주동이의 측면 왼쪽) C2 : 삽입 할 준비가 척수 (최대 복부 측면, 왼쪽 주동이의 측면). 주동이의 측면에 작은 곤충 핀을 참고 D1 :.. 한천 비커에서 척수 (주동이의 측면 다우, 바닥을 향하도록 복부 측면) D2 : 내장 척수와 컷 한천 블록. 35 ° 각도를 블록의베이스와 요추 확대 (화살표)와 척수 양식을합니다. 스케일 바 1cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 상공 회의소에 슬라이스를 배치
참고 : 쉬게ntral 뿌리는 가변 크기입니다.
- (40)에서 사전에 170 μm의에 이르기까지 다양한 팁 직경 다양한 피펫의 상자를 준비합니다. 흡입 피펫을 준비 긴 테이퍼 많은 피펫을 준비합니다. 다이아몬드 나이프를 사용하여, 서로 다른 위치에 상처를 만든다. 그 다음 해부 현미경, 핀셋 팁을 타격하여 휴식.
- 기록 현미경에서 실을 제거하고 해부 현미경으로 배치합니다.
- 흡입 자극 전극에 장착 될 수있는 충분한 길이 (2 mm 이상)의 복부 루트를 포함하는 슬라이스를 선택한다. 복부 뿌리 슬라이스 상향 (그림 2A)의 올바른 방향을 선택하고 조각 (그림 2B) 주변의 한천의 나머지 부분을 남기면서 섬세 복부 뿌리 주변의 한천을 잘라.
참고 : 한천이 조각보다 더 확고하기 때문에,이 조각의 앵커의 스레드가 한천보다는 이렇게 슬라이스하고 A에 휴식을 할 수 있습니다nchor는 조직을 손상하지 않습니다. 슬라이스의 앵커의 스레드 (그림 2c에 빨간색으로 표시) motoneuron 풀 위에 있는지 확인합니다. - 현미경에 백 챔버를 탑재하고 연속적 일의 속도로 ACSF 기록 챔버를 관류 - RT에서 2 ㎖ / 분. 유리 피펫 ACSF 채우고 주사기에 연결을 사용하여, 복부 루트 (도 2c에서 화살표) 중 하나를 흡인. 복부 루트 좋은 자극을 달성하기 위해, 피펫 팁을 복부 주위 루트 빡빡 할 필요가있다. 하나의 기둥은 자극 전극 (패치 클램핑 전극에 연결된 레퍼런스 또는) 욕 중에서 다른 하나이어야한다.
- 목적하는 세포 유형의 패치 클램프 기록을 달성하고 10 previsouly 바와 같이 복부 루트 자극의 효과를 기록한다.
- 여기서, 데이터 수집을위한 증폭기를 사용한다. 3 kHz에서 전체 셀 녹음을 필터링합니다. 10 kHz에서 디지털화. curre 다리 저항을 보정NT-클램프 모드.

그림 2. 복부 루트 준비
A : 복부 루트가 위를 향 한천에 포함 된 요추 척수 조각 B :.. 한천 C에서 해방 복부 뿌리와 요추 척수 조각 : 단단히 (화살표) 복부 뿌리 주위에 배치 자극 전극과 요추 척수 조각 . 마우스 기자 R26 톰 (17). 스케일 바 1mm로 교차 chrna2-Cre 호텔 마우스 (28)의 적색 형광을 발현하는 렌쇼 세포의 위치를 확인합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
Antidromic 활동 전위를 사용하여 Motoneuron 정체성의 확인
셀 타겟팅
의 motoneurons은 복부 혼 (그림 2C에 빨간색으로 표시)에서 발견된다. 복부 루트를 형성하는 축삭의 번들에서 시작하고 번들이 완전히 분산과 하나가 (20 μm의 위, 긴 소마 축) 큰 세포를보고 시작 때까지 이동합니다. 4 MΩ로 (3)의 초기 저항의 전극을 사용하여 라운드 건강보고 셀의 전 세포 기록을 달성한다. 사용되는 내부 용액은 140 mM의 K-글루코 6 mM의 KCl을 10 mM의 HEPES, 1 mM의 EGTA, 0.1 mM의 CaCl2를 4 밀리미터의 Mg-ATP, 0.3 mM의 나트륨이 GTP한다. 증류수를 추가하여 295 mOsm - 285에 KOH 7.3에 산도 및 삼투압을 조절합니다.
확인
. 복부 코드의 기록 셀에 antidromic 활동 전위를 유도하기 위해 (0.3 밀리 - - 50 V, 0.1 1) 3A1 및 3A2 표시 antidromic 작업도 전체 셀 기록이 달성되면, 복부 루트 단일 이상성 자극을 가하기 각각 전압 클램프 또는 전류 클램프의 잠재력. 1 (그림 3A1) V 5과에서에서 자극 강도를 증가 할 때 10 (그림 3A2) V (15)에 antidromic 활동 전위는 각각 0.9 밀리 초 1.1 밀리의 대기 시간 모 아니면도 패션에 나타납니다. 단지의 motoneurons은 복부 뿌리를 통해 자신의 축삭을 보내 주어지면, antidromic 활동 전위는 세포 정체성의 증거입니다.
의 motoneurons (약 10 %)의 소수에서, 복부 루트 자극에 실패antidromic 활동 전위를 유도 아니라 orthodromic 활동 전위를 유도. 3B1과 3B2는 각각 전압 클램프 또는 전류 클램프의 orthodromic 활동 전위를 보여준다. 30 V (그림 3B1) 25 V 40 (그림 3B2)에서 20에서 자극을 증가하는 경우, 활동 전위는 이전의 흥분성 시냅스 후 (EPSC) 현재 또는 시냅스 후 전위 (EPSP) 흥분성을 다음 나타납니다. 활동 전위의 대기 시간 (5.1 밀리 초 5.3 밀리 초 각각) 이상. 이 두 세포에서 복부 뿌리를 자극하는 것은 orthodromic 활동 전위를 유도하기에 충분히 강한 피드 - 포워드 여기 (의 motoneurons 다른의 motoneurons 자신과에 축삭 담보를 전송)를 유도. 이러한 세포에서, antidromic 활동 전위를 유도 할 수있는 실패는 우리가이 세포가 아칸소 결론을 허용하지 않습니다 (그 모 아니면도 패션과 대기 시간이 짧은 5 밀리 초 특징) 전자의 motoneurons. 필요한 자극의 세기는 피드 포워드 여진이 antidromic 활동 전위를 유도하는 데 필요한 것보다 높은 유도하기 참고. 여기에 표시된 모든 자극은 0.1 밀리 그러나 때때로 (0.3 밀리 초까지) 이상 자극 antidromic 활동 전위를 유도해야 할 수도 있습니다.
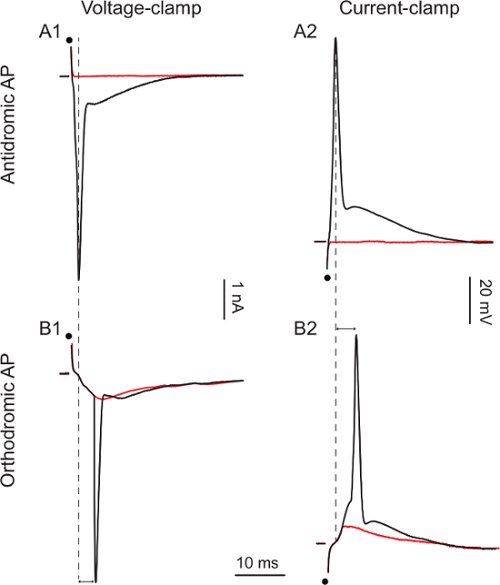
복부 루트 자극에 그림 3. Motoneuron 응답
A1 : 1 V (빨간색 추적) 및 5 V (블랙 추적) 자극 A2 :.. 10 V (빨간색 추적) 15 V (블랙 추적) 자극 B1 : 20 V (빨간색 추적) 30 V (블랙 추적) 자극 . B2 : 25 V (빨간색 추적) 40 V (블랙 추적) 자극. 검은 점은 자극 타이밍을 나타냅니다. 이중 화살촉은 오르토 및 antidromic 스파이크 사이의 대기 시간의 차이를 강조한다.m / 파일 / ftp_upload / 54525 / 54525fig3large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
렌쇼 세포 자극
셀 타겟팅
렌쇼 세포는 복부 혼 27,28에서 발견된다. 20 배와 63X 목표를 사용하여 미분 간섭 대비 (DIC) 이미징 축삭 번들을 시각화합니다. 복부 루트를 형성하는 축삭의 번들에서 시작하고 축삭이 분산되기 시작하지만 여전히 (그림 4A, 화살표) 식별 될 때까지 위로 이동합니다. (- 직경 15 μm의 그림 4A, 화살촉 10) 중간 크기의 셀을 목표로합니다. 7 MΩ 5의 초기 저항의 전극을 사용하여 라운드 건강 보이는 세포의 전체 셀 녹음을 얻을 수 있습니다. 실험에 따라, 우리는 EI 사용THER 고사 + 기반 또는 K + 내부 솔루션 (10)를 기반. 연사 기반 솔루션은 MV -45 주위를 볼 수 있었다 대형 칼륨 전류를 방지. 일부 실험에서, 또한 기록 된 셀에 급상승을 담당 나트륨 채널을 차단하는 5 mM의 QX-314을 추가했다. 연사 + 기반 솔루션이 포함되어 pH가 125 mM의 CS-글루코 네이트, 5 mM의 QX-314 (CL), 10 mM의 HEPES, 10 mM의 EGTA, 1 mM의 염화칼슘 2, 4 mM의 마그네슘 - ATP, 0.4 밀리미터 나-GTP, CsOH 7.3로 조정. 케이 + 기반 솔루션은 모두 전압 - 전류 - 클램프, 분석에 사용하는 조건에서 복부 루트 자극에 렌쇼 세포 반응은 생리적 인 것과 최대한 근접한. 이 솔루션에는 다음이 포함 KOH와 7.3로 조정 pH를 125 mM의 K-글루코 네이트, 10 mM의 HEPES, 1mM의 EGTA, 0.1 mM의 염화칼슘 2, 4 mM의 마그네슘 - ATP, 0.4 밀리미터 나-GTP,. (10) 100 V 및 지속 시간 사이에서 변화 자극의 강도는 50 ~ 300 마이크로 초 사이에서 변화. Bipo LAR 펄스를 모든 경우에 사용되었다.
복부 루트 자극에 렌쇼 세포의 응답
복부 루트의 자극은 렌쇼 세포 (10)에 글루타메이트 및 motoneuron의 담보에서 아세틸 콜린의 corelease를 트리거합니다. GABA와 글리신에 의해 매개 피드 포워드 억제는 또한 10.도 4b는 복부 루트의 단일 자극에 대한 응답을 표시 모집한다. 세포는 -45 mV로 전압에서 세슘 계 용액 전압 클램프 모드에서 촬영하고 유지 하였다. QX-314 세포 내 솔루션은 발사 및 GABA에서 셀을 방지 글리신 응답은 각각 3 μM의 gabazine 1 μM 스트 리키 닌에 의해 차단되었다. 도 4b의 내측 시냅스 전류는 글루타메이트 및 니코틴산 전류의 합이다.
NT를 "FO : 유지-together.within 페이지 ="1 ">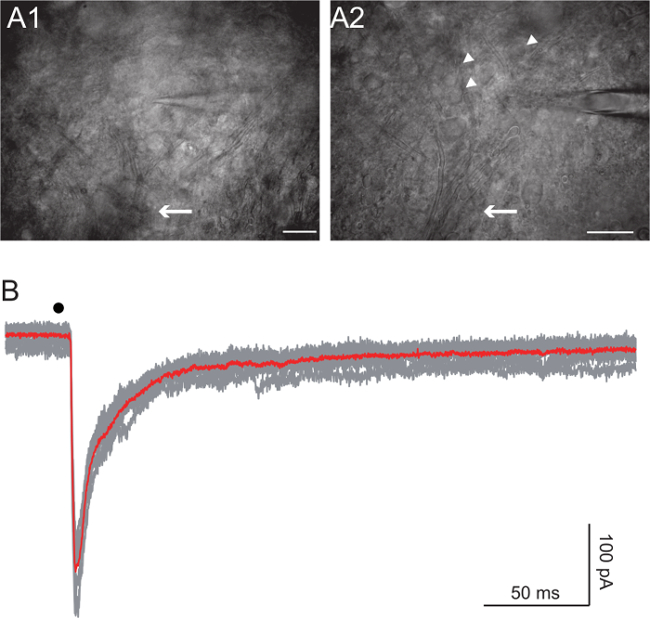
복부 루트에서 그림 4. 렌쇼 세포 자극
답변 : 렌쇼 세포 풀의 이미지는 두 개의 서로 다른 배율 (20 배와 40 배 목표)에서 찍은 동일한 슬라이스에 경사 콘덴서를 사용하여 인수했다. 복부 루트 (화살표)로 병합 motoneuron의 축삭을합니다. 추정 렌쇼 세포는 화살촉으로 표시됩니다. 스케일 바 : A1 100 μm의, A2 B 50 μm의 :. 복부 루트 (검은 점)의 자극에 따르는 렌쇼 셀의 전압 클램프 녹음. 붉은 추적은 회색 사람의 평균입니다. 지주 전압 -45 MV 설정 하였다. QX-314 세포 내 솔루션은 발사 및 GABA에서 셀을 방지 글리신 응답은 각각 3 μM의 gabazine 1 μM 스트 리키 닌에 의해 차단되었다. 검은 점은 자극 타이밍을 나타냅니다.COM / 파일 / ftp_upload / 54525 / 54525fig4large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
그것은, 신뢰할 수있는 포괄적이고 구체적인 방법으로 하나의 척추 세그먼트에서 motoneuron 풀과 렌쇼 세포의 일방적 인 자극을 허용하기 때문에 척수의 경사 슬라이스가 중요합니다. 또한, 기록의 motoneurons의 빠른 우아하고 비 모호한 식별 할 수 있습니다. 다음으로, 우리는 다른 슬라이스 준비 방법에 비해이 기술의 장점을 강조하며, 우리는이 절차를 수행하는 동안 피할 수있는 가장 일반적인 함정을 강조합니다.
가로 슬라이스를 사용하여 대부분의 연구는 고유의 전기적 특성 3,14,15,29에 자신의 ID를 기반으로. 그러나 이러한 주어진 풀 (알파, 베타 및 감마의 motoneurons 30) 내에서 motoneuron 풀 사이뿐만 아니라 motoneuron 서브 타입 사이에 크게 다릅니다. 따라서, 사이즈의 파라미터를 이용하여 연구가 작은 감마 운동 신경원을 배제 할 가능성이있다. 한편, 쿠퍼 셰링 D축색 돌기 (31, 32)을 상승 교차했다 원숭이와 고양이의 허리 척수의 ventro-측면 회색 만에 1940 년에 큰 신경 세포의 그룹을 escribed. motoneuron의 somas에 가까운 것에 더하여, 그들은의 motoneurons에서 조직 학적으로 구별 등장 있다고 지적했다. 최근 기사 마우스 (33) 등 세포의 존재를 확인했다. 때문에 이러한 세포와 그 위치의 큰 크기로, 그들은 실수로 이전의 연구에 포함 된 수 있습니다. 크기에 관계없이 모두의 motoneurons의 신뢰할 수있는 식별을 허용하면서 자신의 축삭은 복부 루트에 돌출하지 않기 때문에 우리의 식별 기준은, 추정 척추 국경 세포를 제외합니다. 또한, 본질적인 전기적 특성을 분석하여 (예를 들면, 입력 저항) antidromic 활동 전위의 간단한 관찰보다 걸리는 시간이다.
일부 STUDIE 극한 전기적 특성을 사용하는 것 외에도가로 슬라이스를 사용하여이야 (예 : 작은 섬-1 / 2-16) 또는 labelings 14,17을 biocytin 사용하여 형태를 시각화하여의 motoneurons을위한 분자 마커의 사후 분석을 수행하여 자신의 ID를 확인합니다. 이러한 식별하지만 지루한하고 직접 식별을 제공하지 않습니다. 그러므로 그들은 거의 체계적으로 수행된다.
일부 연구는 유전자 인코딩 motoneuron 형광 마커 (Hb9-GFP 마우스 라인 (18)을 발현하는 마우스 라인의 활용의 motoneurons (19), 또는 G85R SOD1-YFP 유전자 변형 마우스 포함 콜린성 세포에서 eGFP는 표현 형질 전환 마우스를-EGFP에게 채팅을 시도하는 강하게)의 motoneurons 17에서 YFP 융합 단백질을 표현한다. 유전자 마커의 발현은 일반적으로 시간과 조각 때문에 조절되기 때문에, 일반적으로 배아 또는 청소년에서 촬영, 마커의 발현이 나이의 S에 적합하지 않을 수 있습니다tudy이 수행된다. 다른 연구는 motoneuron 풀 (34)을 시각화 역행 에이전트 주사를 사용했다. 우리는 또한 가자미근 또는 EDL (개인 관찰)에 콜레라 독소 베타 주사를 시행 하였다. 이러한 분류 기술은 특정 motoneuron 풀 레이블을 큰 가치가 있지만 실험을하기 전에 며칠 지루한 수술이 필요합니다. 또한, 슬라이스 실험이 수행되고있는 젊은 나이, 그것은 훨씬 더 열심히 구체적으로 근육을 대상으로 할 수 있습니다. 마지막으로, 외래 에이전트를 주입하여 motoneuron를 교란의 실제 문제가있다.
최적의 조건에서 우리는 기록의 motoneurons의 거의 모든에 antidromic 활동 전위를 얻을 수 있었다. 사용 된 35 ° 각도는 충분한 길이의 복부 뿌리를 획득하는 것이 중요합니다. 결론적으로, 경사 슬라이스 준비는 다른 식별 기술 우수하다 모든 motoneuron을 식별 할 수있는 신속하고 신뢰할 수있는 방법을 제공합니다.
서론에서 언급 한 바와 같이, 두 연구는 가로 조각의 복부 뿌리를 성공적으로 자극을 보도했다. 첫 번째 연구는 쥐의 자궁 경부 신경을 기록 복부 루트 스텁 4 나온다 백질을 자극. 이들은 정상적으로 기록 된 뉴런의 85 %에 antidromic 활동 전위를 유도. 우리는 높은 성공률 경부 레벨에서 축색과 운동 신경원의 somas이 동일 평면 상에 있다는 사실에 의존 믿는다. 이것은 더 많은 꼬리 슬라이스이 아니다. 심지어 자궁 수준에서, 자신의 횡단 슬라이스는 자극이 적은 신뢰할 수있는 복부 뿌리의 그루터기를 유지했다. 두 번째 연구는 병아리 배아 배측 - 허리 세그먼트 (5)를 자극. 그러나, 그것들은 단일 세포 수준에서 antidromic 활동 전위를 유도의 성공을 나타 내기 위해 공간적 해상도 부족 전압 감응 색소 기록을 사용했다.
우리의 슬라이스는 준비이온은 최근 종이 (28)에 명시된 바와 같이 렌쇼 세포를 자극하는 우수한 방법을 제공합니다. 경사 조각을 사용하여, 그것들은 10 % 성공률에서 큰 개선이 있었던 경우의 46 %에 monosynaptic 렌쇼 세포의 응답을 기록 할 수 있었다 횡단면 (35)을 사용하여 발생. 우리는 motoneuron 풀의 자극에 대해 유사한 비교를 찾을 수 있지만, 렌쇼 셀이 관찰의 motoneurons는 더 많은 연결을 유지 믿고 우리를 이끈다.
척수의 비스듬한 슬라이스 확실 하나가 기록 할 수있는 제제를 얻기 전에 많은 연습을 필요로하는 매우 까다로운 기술이다. 아주 미세하고 날카로운 핀셋 및 마이크로 가위를 사용하는 것은 필수적이다. 전체 과정이 냉장 carbogen - 버블 해부 매체에 실시로 해부 소요 시간은 한 (1 시간까지) 상당히 길어질 수 있습니다. 일부 저자는 심장 내 perfusio의 혜택을 인정하지 않았지만n 개의 조각 (36)의 제조에, 우리는 절차의이 단계를 유지하기로 결정했다. 객관적는 나이에 따라 달라진다 특히 때문에 녹화 품질에 대한 심장 내 관류의 효과를 측정하기 어렵다.
가장 중요한 요인은 마우스 연령이다. 우리는 성공적으로 위의 프로토콜을 사용하여 P2와 P11 사이 마우스에서 기록했다. 이 시대 과거, 척수 수초가 너무 조밀하게되고 가장 큰 세포합니다 (의 motoneurons가)에 의한 산소 부족에, 슬라이스 전에 대부분 죽는다. 해당 창 후, 우리는 점점 더 어려워 건강한 조각을 얻을 수 발견했다. 최근, 새로운 기술은 이전 동물 17,36 건강한 조각을 얻었다보고되었다. EFF의 제한하는 세포 37,38 폴리에틸렌 글리콜 oncosis 방지 농도 - 이들은 에너지 (에틸 피루 베이트)의 근원 부가 하부 나 + CL 및 그들의 해부 기록 매체에 추가로 첨가제를 사용슬라이스 과정에서 발생하는 광범위한 막 transections의 ECTS. 이러한 향상된 기능과 함께, 그들은 6 개월 된 동물부터 기록 할 수 있었다.
향후 그 두 방법의 이점을 결합 성인 동물에서 비스듬한 슬라이스 제제 시도 흥미로울 것이다. 두 프로토콜을 결합하면 비교적 쉽게 증명해야하며, 성인 마우스에서의 motoneurons의 축삭 담보의 대상 인구를 motoneuron의 신원을 확인하고 연구하는 신뢰할 수있는 도구를 제공합니다. 또한, 하나는 배아 마우스에 경사 조각을 얻는 시도 할 수 있습니다. 주목할만한, 우리의 준비도 활성화 monosynaptic 공부를 자극 할 수있는 등의 뿌리를 유지 i를의 motoneurons에 신경 분포뿐만 아니라, 등의 척수 신경 인구의 활성화. 결론적으로, 복부 루트 자극은 신뢰할 수있는 도구 motoneuron의 신원을 확인하고 motoneuron의 축삭 담보의 대상 인구를 공부을 제공합니다.
공개
The authors have nothing to disclose.
감사의 말
저자는 사진을 찍는 그들의 도움 마린 마누엘과 올리비아 골드만-Szwajkajzer 감사합니다. 저자는 또한 원고를 교정하기위한 아르 준 Masukar과 토비아스 복을 주셔서 감사합니다. 금융 지원은 라 공들인 (HYPER-국방부, ANR-2010 BLAN-1429-01)을 부어 직원은 국립 제공 한은 NIH - NINDS (R01NS077863)의 티에리 Latran 재단 (OHEX 프로젝트), 근육 병증에 대한 프랑스 협회 ( 승인 번호 16026) 및 대상 ALS는 기꺼이 인정한다. 펠릭스 리로이는 고등 사범 학교, Cachan의에서 "Contrat 박사"의받는 사람이었다.
자료
| Name | Company | Catalog Number | Comments |
| Na-kynurenate | ABCAM | ab120256 | dissolves better then other brands |
| KCl | Sigma | P3911 | |
| NaH2PO4 | Sigma | P5655 | |
| sucrose | Sigma | S9378 | |
| NaHCO3 | Sigma | S6014 | |
| CaCl2 | G Biosciences | R040 | |
| MgCl2 | Quality Biological | 351-033-721 | |
| glucose | Sigma | G5767 | |
| ascorbic acid | Sigma | A5960 | |
| Na-pyruvate | Sigma | P2250 | |
| K-gluconate | Sigma | P1847 | |
| EGTA | Sigma | E3889 | |
| HEPES | Sigma | H4034 | |
| NaCl | Sigma | S9888 | |
| Agar | Sigma | A9799 | |
| QX-314 | Alomone | Q150 | |
| Mg-ATP | Sigma | A9187 | |
| CsOH | Sigma | 232041 | |
| Na-GTP | Sigma | 51120 | |
| gluconic acid | Sigma | G1951 | |
| Cesium hydroxide solution | Sigma | 232041 | |
| KOH | Sigma | P5958 | |
| Vannas Spring Scissors - 2.5mm | FST | 15000-08 | only use for cutting the dura, might get damaged if cutting bones |
| Stimulator | A-M Systems | Isolated Pulse Stimulator Model 2100 | |
| Vibratome | Campden | Vibrating Microtome 7000 - Model 7000smz-2 |
참고문헌
- Brooks, C. M., Downman, C. B., Eccles, J. C. After-potentials and excitability of spinal motoneurones following antidromic activation. J Neurophysiol. 13 (1), 9-38 (1950).
- Bories, C., Amendola, J., Lamotte d'Incamps, B., Durand, J. Early electrophysiological abnormalities in lumbar motoneurons in a transgenic mouse model of amyotrophic lateral sclerosis. Eur J Neurosci. 25 (2), 451-459 (2007).
- Takahashi, T. Membrane currents in visually identified motoneurones of neonatal rat spinal cord. J Physiol. 423, 27-46 (1990).
- Hori, N., Tan, Y., Strominger, N. L., Carpenter, D. O. Intracellular activity of rat spinal cord motoneurons in slices. J Neurosci Methods. 112 (2), 185-191 (2001).
- Arai, Y., Mentis, G. Z., Wu, J. Y., O'Donovan, M. J. Ventrolateral origin of each cycle of rhythmic activity generated by the spinal cord of the chick embryo. PLoS One. 2 (5), e417 (2007).
- Cullheim, S., Lipsenthal, L., Burke, R. E. Direct monosynaptic contacts between type-identified alpha-motoneurons in the cat. Brain Res. 308 (1), 196-199 (1984).
- Cullheim, S., Kellerth, J. O., Conradi, S. Evidence for direct synaptic interconnections between cat spinal alpha-motoneurons via the recurrent axon collaterals: a morphological study using intracellular injection of horseradish peroxidase. Brain Res. 132 (1), 1-10 (1977).
- Gogan, P., Gueritaud, J. P., Horcholle-Bossavit, G., Tyc-Dumont, S. Direct excitatory interactions between spinal motoneurones of the cat. J Physiol. 272 (3), 755-767 (1977).
- Ichinose, T., Miyata, Y. Recurrent excitation of motoneurons in the isolated spinal cord of newborn rats detected by whole-cell recording. Neurosci Res. 31 (3), 179-187 (1998).
- Lamotte d'Incamps, B., Ascher, P. Four excitatory postsynaptic ionotropic receptors coactivated at the motoneuron-Renshaw cell synapse. J Neurosci. 28 (52), 14121-14131 (2008).
- Renshaw, B. Central effects of centripetal impulses in axons of spinal ventral roots. J Neurophysiol. 9, 191-204 (1946).
- Renshaw, B. Interaction of nerve impulses in the gray matter as a mechanism in central inhibition. Fed Proc. 5 (1 Pt 2), 86 (1946).
- Renshaw, B. Observations on interaction of nerve impulses in the gray matter and on the nature of central inhibition). Am J Physiol. 146, 443-448 (1946).
- Pambo-Pambo, A., Durand, J., Gueritaud, J. P. Early excitability changes in lumbar motoneurons of transgenic SOD1G85R and SOD1G(93A-Low) mice. J Neurophysiol. 102 (6), 3627-3642 (2009).
- Quinlan, K. A., Schuster, J. E., Fu, R., Siddique, T., Heckman, C. J. Altered postnatal maturation of electrical properties in spinal motoneurons in a mouse model of amyotrophic lateral sclerosis. J Physiol. 589 (Pt 9), 2245-2260 (2011).
- Martin, E., Cazenave, W., Cattaert, D., Branchereau, P. Embryonic alteration of motoneuronal morphology induces hyperexcitability in the mouse model of amyotrophic lateral sclerosis. Neurobiol Dis. 54, 116-126 (2013).
- Hadzipasic, M., et al. Selective degeneration of a physiological subtype of spinal motor neuron in mice with SOD1-linked ALS. Proc Natl Acad Sci U S A. 111 (47), 16883-16888 (2014).
- Wichterle, H., Lieberam, I., Porter, J. A., Jessell, T. M. Directed differentiation of embryonic stem cells into motor neurons. Cell. 110 (3), 385-397 (2002).
- Tallini, Y. N., et al. BAC transgenic mice express enhanced green fluorescent protein in central and peripheral cholinergic neurons. Physiol Genomics. 27 (3), 391-397 (2006).
- Manuel, M., et al. Fast kinetics, high-frequency oscillations, and subprimary firing range in adult mouse spinal motoneurons. J Neurosci. 29 (36), 11246-11256 (2009).
- Obeidat, A. Z., Nardelli, P., Powers, R. K., Cope, T. C. Modulation of motoneuron firing by recurrent inhibition in the adult rat in vivo. J Neurophysiol. 112 (9), 2302-2315 (2014).
- Leroy, F., Lamotte d'Incamps, B., Imhoff-Manuel, R. D., Zytnicki, D. Early intrinsic hyperexcitability does not contribute to motoneuron degeneration in amyotrophic lateral sclerosis. Elife. 3, (2014).
- Leroy, F., Lamotte d'Incamps, B., Zytnicki, D. Potassium currents dynamically set the recruitment and firing properties of F-type motoneurons in neonatal mice. J Neurophysiol. 114 (3), 1963-1973 (2015).
- Lamotte d'Incamps, B., Ascher, P. Subunit composition and kinetics of the Renshaw cell heteromeric nicotinic receptors. Biochem Pharmacol. 86 (8), 1114-1121 (2013).
- Lamotte d'Incamps, B., Krejci, E., Ascher, P. Mechanisms shaping the slow nicotinic synaptic current at the motoneuron-renshaw cell synapse. J Neurosci. 32 (24), 8413-8423 (2012).
- Dugue, G. P., Dumoulin, A., Triller, A., Dieudonne, S. Target-dependent use of co-released inhibitory transmitters at central synapses. J Neurosci. 25 (28), 6490-6498 (2005).
- Mentis, G. Z., Siembab, V. C., Zerda, R., O'Donovan, M. J., Alvarez, F. J. Primary afferent synapses on developing and adult Renshaw cells. J Neurosci. 26 (51), 13297-13310 (2006).
- Perry, S., et al. Firing properties of Renshaw cells defined by Chrna2 are modulated by hyperpolarizing and small conductance ion currents Ih and ISK. Eur J Neurosci. 41 (7), 889-900 (2015).
- Thurbon, D., Luscher, H. R., Hofstetter, T., Redman, S. J. Passive electrical properties of ventral horn neurons in rat spinal cord slices. J Neurophysiol. 79 (5), 2485-2502 (1998).
- Zengel, J. E., Reid, S. A., Sypert, G. W., Munson, J. B. Membrane electrical properties and prediction of motor-unit type of medial gastrocnemius motoneurons in the cat. J Neurophysiol. 53 (5), 1323-1344 (1985).
- Cooper, S., Sherington, C. S. Gower's tract and spinal border cells. Brain. 63, 123-124 (1940).
- Morin, F., Schwartz, H. G., O'Leary, J. L. Experimental study of the spinothalamic and related tracts. Acta Psychiatr Neurol Scand. 26 (3-4), 371-396 (1951).
- Sengul, G., Fu, Y., Yu, Y., Paxinos, G. Spinal cord projections to the cerebellum in the mouse. Brain Struct Funct. 220 (5), 2997-3009 (2015).
- Russier, M., Carlier, E., Ankri, N., Fronzaroli, L., Debanne, D. A-, T-, and H-type currents shape intrinsic firing of developing rat abducens motoneurons. J Physiol. 549 (Pt 1), 21-36 (2003).
- Dourado, M., Sargent, P. B. Properties of nicotinic receptors underlying Renshaw cell excitation by alpha-motor neurons in neonatal rat spinal cord). J Neurophysiol. 87 (6), 3117-3125 (2002).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. J Neurophysiol. 107 (2), 728-741 (2012).
- Rothman, S. M. The neurotoxicity of excitatory amino acids is produced by passive chloride influx. J Neurosci. 5 (6), 1483-1489 (1985).
- Olney, J. W., Price, M. T., Samson, L., Labruyere, J. The role of specific ions in glutamate neurotoxicity. Neurosci Lett. 65 (1), 65-71 (1986).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유