Method Article
La Preparación de oblicua de la médula espinal ventral de segmentos para Root Estimulación
En este artículo
Resumen
Mostramos cómo preparar rodajas oblicuas de la médula espinal en ratones jóvenes. Esta preparación permite la estimulación de las raíces ventrales.
Resumen
Registros electrofisiológicos de láminas de médula espinal han demostrado ser una técnica valiosa para investigar una amplia gama de preguntas, de celular a las propiedades de red. Mostramos cómo preparar rodajas oblicuas viables de la médula espinal de ratones jóvenes (P2 - P11). En esta preparación, las motoneuronas conservan sus axones que sale de las raíces ventrales de la médula espinal. La estimulación de estos axones provoca back-propagan los potenciales de acción que invaden el somas de las neuronas motoras y emocionantes colaterales el motoneuronas en la médula espinal. Grabación de potenciales de acción antidrómicos es una forma inmediata, definitiva y elegante para caracterizar la identidad de las neuronas motoras, que supera a otros métodos de identificación. Además, la estimulación de las neuronas motoras colaterales es una manera simple y fiable para excitar los objetivos colaterales de las neuronas motoras en la médula espinal, tales como otros motoneuronas o Renshaw células. En este protocolo, se presentan grabaciones antidrómicos de la motoneurona somas, así como excitación de la célula de Renshaw, resultante de la estimulación de la raíz ventral.
Introducción
Históricamente, las grabaciones motoneuronas utilizando Sharp-electrodo se llevaron a cabo in vivo en animales grandes tales como gatos o ratas 1 o en una médula espinal enteros aislados en ratones 2. La aparición de la técnica de grabación de patch-clamp durante la década de 1980, llamado por el acceso directo a la motoneurona somas como el sellado necesario para conseguir bajo control visual. Por lo tanto, la preparación de la rebanada de la médula espinal se ha logrado fácilmente desde principios de 1990 3. Sin embargo, rebanada preparación temprana a menudo no permitía la estimulación de las raíces ventrales. A lo mejor de nuestro conocimiento, sólo dos estudios han informado de la estimulación exitosa de las raíces ventrales en rodajas transversales, y ninguno se obtuvo a partir de ratones 4,5.
En este artículo se presenta una técnica para lograr las rebanadas de la médula espinal viables de ratones recién nacidos (P2 - P11) en el que la piscina de motoneuronas conserva sus raíces ventrales saliendo axones. Respiraderoestimulación de la raíz ral desencadena potencial de acción antidrómica de nuevo en los somas de las neuronas motoras de la piscina que sale de la misma raíz ventral. También excita los objetivos colaterales de neuronas motoras, otras motoneuronas 6-10 y las células de Renshaw 11-13. Dado que sólo motoneuronas envían sus axones hacia abajo las raíces ventrales, se utiliza el registro de los potenciales de acción antidrómicos como una forma sencilla y definitiva a physiologicaly identificar motoneuronas 10.
Además de utilizar criterios electrofisiológicos y morfológicos potencialmente no incluido o engañosas para confirmar la identidad de las neuronas motoras, estudios recientes sobre las neuronas motoras de la médula espinal también se basó en tinciones tedioso y requiere mucho tiempo post hoc 16. Tal identificación se realiza generalmente sólo en una muestra de las células grabadas. Otras estrategias de identificación se basan en las líneas de ratón en el que las motoneuronas expresan la fluorescencia endógena 17-19. Sin embargo, el uso de marcadores codificados genéticamente puede ser difícil a una edad temprana, cuando la expresión del marcador sigue siendo variable o si el estudio ya se requiere el uso de una línea de ratones transgénicos. Alternativamente, la acción antidrómica potenciales grabaciones se pueden realizar de forma rutinaria en todos los ratones desde el inicio de la grabación de la célula. Los experimentadores que trabajan en los preparativos de la médula espinal intacta en el gato, la rata y el ratón, se han utilizado de forma fiable estas técnicas de identificación desde la década de 1950 1,2,20,21. En condiciones óptimas, hemos sido capaces de provocar potenciales de acción antidrómicos de virtualmente todas las neuronas motoras registradas.
Además, la estimulación de la raíz ventral se puede utilizar para excitar de forma fiable otros motoneuronas 22,23 o sus objetivos. las células de Renshaw 10,24,25. Presentamos aquí las aplicaciones de la estimulación de la raíz ventral en forma de acción antidrómica posibles grabaciones de somas de las neuronas motoras, así como la excitación de las células de Renshaw.
Protocolo
Los experimentos se realizaron de acuerdo con las directivas europeas (86/609 / CEE y 2010 a 63-UE) y la legislación francesa, y fueron aprobados por el comité de ética de la Universidad de París Descartes.
1. Preparación de la rebanada de la médula espinal
- Preparar las siguientes soluciones diarias o un día de antelación. Si se mantiene durante toda la noche, la burbuja con un 95% de O2 y 5% de CO2 y mantener refrigerado en frascos bien cerrados.
- Prepare baja Na + fluido cefalorraquídeo artificial (ACSF): KCl 3 mM, 1 mM NaH 2 PO 4, sacarosa 230 mM, 26 mM NaHCO3, 0,8 mM CaCl 2, 8 mM MgCl2, 25 mM de glucosa, ácido ascórbico 0,4 mM, 1 mM Na-quinurenato, 2 mM Na-piruvato. Burbuja con un 95% de O2 y 5% de CO 2 (pH 7,4). Desde Na-quinurenato es a menudo difícil de disolver, asegúrese de comprar la que aparece en la tabla de materiales.
- Preparar Solu K-gluconatoción: 130 mM K-gluconato, mM KCl 15, EGTA 0,05 mM, HEPES 20 mM, glucosa 25 mM, 1 mM Na-quinurenato, 2 mM Na-piruvato, se ajustó a pH 7,4 con KOH.
- Preparar ACSF: NaCl 130 mM, KCl 2,5 mM, 2 mM CaCl2, 1 mM MgCl2, 1 mM NaH 2 PO 4, 26 mM NaHCO 3, glucosa 25 mM, ácido ascórbico 0,4 mM, 2 mM Na-piruvato. Burbuja con un 95% de O2 y 5% de CO 2 (pH 7,4).
- Antes del comienzo de la disección, se disuelven 2% de agar en 80 ml de la solución de K-gluconato, y mantener caliente a 60 ° C.
- perfusión intracardiaca
- Realizar esta preparación en ratones hembras y machos, con edades de P2 a P11.
- Anestesiar al ratón con una inyección intraperitoneal de 0,1 ml de 25 mM de sodio pentobarbital (50 mg / kg).
- El uso de agujas o cinta, se debe inmovilizar el ratón sobre su espalda en una gran placa de Petri llena de silicio. Use un microscop diseccióne para el resto de la disección.
- Sujetando la punta del esternón, levantar el pecho y cortar el diafragma utilizando unas tijeras finas. A continuación, abrir el pecho en ambos lados por el corte a través de las costillas para exponer el corazón.
- Cortar la aurícula derecha antes de la punción del ventrículo izquierdo con una aguja 27G.
- Perfundir con helado de baja ACSF Na +. Después de 30 seg, bajo Na + ACSF debe considerarse que fluye de la aurícula. bajas cantidades de sodio evitar que las células de adición y reducir la muerte celular durante la disección.
- Mantener la celebración de la aguja en el corazón bajo el microscopio de disección hasta que el hígado se vuelve amarillo cuando se drena la sangre.
- Disección de la médula espinal
- Decapitar al animal y lo puso en su estómago.
- Eliminar rápidamente la piel de la espalda (Figura 1A1). Hacer dos cortes a través de los hombros y bajando la caja torácica (Figura 1A2). A continuación, corte el cable como low como sea posible en la sección de caudal con el fin de aislar la columna vertebral con el inicio de las nervaduras de la parte inferior del animal. Da la vuelta al animal de nuevo y retirar las vísceras todavía unido a las costillas.
- Transferir la columna vertebral, a otra, más pequeña placa de Petri llena de silicio y el uso de 4 pines de insectos para sostenerlo hacia arriba dorsal (Figura 1A).
- Continuamente perfundir el animal con ACSF carbógeno-burbujeó (a aproximadamente 4 ° C) mientras se realiza una laminectomía del lado dorsal, y la exposición de la médula espinal desde el extremo rostral (Figura 1B). Para ello, inserte la punta de tijeras finas entre el hueso y la médula espinal y cortar el hueso poco a poco desde el extremo rostral, asegurándose de mantenerse alejado de la sustancia blanca. Alternan en cada lado durante el uso de pinzas para mantener lejos de la banda del hueso ya cortada (Figura 1B1).
- El uso de las tijeras de primavera disponibles más pequeños y pinzas, levante la dura y cortaen ambos lados mientras sostiene la parte suelta de la duramadre con el fin de evitar daños en la médula espinal con las tijeras. Corte a lo largo del eje rostro-caudal.
NOTA: La duramadre es una membrana continua semi transparente; a esta edad la piamadre es demasiado frágil y se deshaga durante la disección y corte en rodajas (Figura 1B2). - Una vez que la duramadre es suprimido el uso de una copa roma o punta de plástico para empujar suavemente el cable en el lado izquierdo de la ranura formada por la columna vertebral mitad cortar, y cortar las raíces ventral y dorsal en el lado derecho, comenzando desde el lado rostral , más lejos de donde entran en el cable (unos pocos mm, al menos, la figura 1B2).
- Repetir la operación en el lado izquierdo, siempre pasando de rostral a caudal. Si zurdo, comience desde el lado izquierdo y luego moverse hacia el lado derecho.
- Incorporación en agar
- Deslizar el cable fuera de la columna vertebral. Use un alfiler de insectos más pequeños de precisarel cordón con la superficie dorsal y quitar delicadamente cualquier pieza de membrana todavía unido a ella (Figura 1C1).
- Una vez limpia, recortar ambos extremos (Figura 1C2). Inserte un alfiler de insectos doblada en la parte anterior de la cuerda para manipular el cable y tenga en cuenta su orientación (flecha en la figura 1C2). A continuación, la transferencia de la médula espinal a una solución de K-gluconato enfriado con hielo.
NOTA: Esta solución imita la composición intracelular de la CSF y evitará que las células mueran de choque osmótico una vez que las motoneuronas se cortarán 26. - Una vez que la médula espinal se encuentra dentro de la solución intracelular, tomar el vaso de precipitados con el agar salir del baño seco y enfriarlo en una mezcla de hielo y agua.
- Mantener la agitación mientras que la medición de la temperatura. Cuando la temperatura alcanza los 38 ° C sumergir la médula espinal, sujetándolo por el pasador de insectos y colocarlo lado rostral hacia abajo. Asegúrese de que la médula espinal es como straight posible, lejos de las paredes, parte caudal ligeramente hacia arriba (Figura 1D1).
- Deje el vaso de precipitados en la mezcla de hielo y agua para permitir que el agar se solidifique lo más rápidamente posible. Asegúrese de que se mantiene en su lugar y que el cable es lo más recto posible (Figura 1D1).
- El rebanar
- Después de la solidificación, cortar el bloque de agar que contiene la médula espinal de una manera tal que la base del bloque es en un ángulo de 35 ° con la parte lumbar de la médula (flecha en la Figura 1D2). La superficie dorsal debe estar mirando hacia fuera de la base (Figura 1D2).
NOTA: Este es un paso crítico en el procedimiento, para mantener la continuidad de las piscinas de las motoneuronas a las raíces ventrales de la que salen. - Pegar el bloque en la cámara de la vibratome utilizando pegamento de cianoacrilato. Sumergirla en una solución de K-gluconato y añadir solución de K-gluconato congelada para mantener slushedel baño de enfriado (por debajo de 2 ° C).
- Cortar 350 - 400 micras rodajas gruesas de la región lumbar (identificable por la curvatura y el diámetro más grande). En su orientación correcta (véase 1.4.1.), Utilice la cuchilla para cortar desde el dorsal a la superficie ventral y hacer rodajas de forma continua más rostral. Típicamente, hay 4-5 rebanadas adecuados con raíces ventrales que se extienden de 2 mm o más. Utilice los siguientes parámetros: 10 ° de ángulo de referencia, la frecuencia de vibración de 70 Hz y 10 mm / min de velocidad de corte.
- Después de la solidificación, cortar el bloque de agar que contiene la médula espinal de una manera tal que la base del bloque es en un ángulo de 35 ° con la parte lumbar de la médula (flecha en la Figura 1D2). La superficie dorsal debe estar mirando hacia fuera de la base (Figura 1D2).
- Incubación
- Transferir las rebanadas de ACSF a 34 ° C. Después de aproximadamente 30 min, enfriar las rodajas a RT y comenzar la sesión de grabación.

La figura 1. La disección
A1:. La eliminación de la piel de la espalda para exponer la columna dorsal A2:El corte de los hombros y las costillas para liberar el dorsal columna B1:. La columna vertebral fijada en la placa de Petri de silicio-llenado (lado dorsal, de lado caudal izquierda) B2:. Lo mismo con la médula espinal expuesta y diseccionado C1:. Aislado de la médula espinal . (lado izquierdo rostral) C2: la médula espinal listo para ser incorporado (lado ventral hacia arriba, lado izquierdo rostral). Tenga en cuenta el pasador de insectos más pequeños en la parte rostral D1:.. De la médula espinal en el vaso de precipitados de agar (lado rostral Dow, lado ventral hacia la parte inferior) D2: bloque de agar Cortar con la médula espinal incrustado. Tenga en cuenta el ángulo de 35 ° las formas de la médula espinal con la base del bloque y la ampliación lumbar (Flecha). Las barras de escala 1 cm. Haga clic aquí para ver una versión más grande de esta figura.
2. Colocar la rebanada en la Cámara
NOTA: Ventral raíces son de tamaño variable.
- Prepare una caja de varias pipetas con diámetros de punta que van desde 40 hasta 170 micras con antelación. Para preparar las pipetas de aspiración, preparar muchas pipetas con una larga puesta a punto. Usando un cuchillo de diamante, hacer un corte en diferentes posiciones. Entonces bajo un microscopio de disección, se rompen por golpear la punta con unas pinzas.
- Retire la cámara del microscopio grabación y colocarlo bajo un microscopio de disección.
- Seleccionar un segmento que contiene una raíz ventral de longitud suficiente (2 mm o más) para ser montado en un electrodo de estimulación de succión. Seleccione la orientación adecuada de la rebanada con las raíces ventrales hacia arriba (figura 2A) y cortar delicadamente el agar alrededor de las raíces ventrales, dejando el resto del agar alrededor de la rebanada (Figura 2B).
NOTA: Debido a que el agar es más firme que la rodaja, esto permitirá que los hilos de anclaje de la rebanada para descansar en el agar en lugar de en la rebanada y por lo tanto la unanchor no dañará el tejido. Asegúrese de que los hilos de anclaje de la rebanada están por encima de la piscina de las neuronas motoras (se muestra en rojo en la figura 2C). - Montar la cámara de nuevo en el microscopio y perfundir continuamente la cámara de registro con ACSF a una velocidad de 1-2 ml / min, a temperatura ambiente. Usando una pipeta de vidrio lleno de ACSF y conectada a una jeringa, chupar uno de la raíz ventral (flecha en la Figura 2C). Con el fin de lograr una buena estimulación de la raíz ventral, la punta de la pipeta tiene que ser apretado alrededor de la raíz ventral. Un polo debe estar en el electrodo de estimulación y el otro en el baño (o conectado a la referencia de electrodo de conexión de sujeción).
- Lograr la grabación de patch-clamp del tipo de célula deseado y registrar el efecto de la estimulación de la raíz ventral como se describe previsouly 10.
- Aquí, utilizar un amplificador para la adquisición de datos. Filtrar registros de células completas a las 3 kHz. Digitalizar a 10 kHz. Compensar la resistencia puente en curremodo nt-clamp.

Figura 2. ventral Root Preparación
R: Lumbar rebanada de la médula espinal incrustado en agar con la raíz ventral hacia arriba. B: Lumbar rebanada de la médula espinal con las raíces ventrales liberados del agar C:. Rebanada de la médula espinal lumbar con un electrodo de estimulación firmemente colocado alrededor de las raíces ventrales (flecha) . Tenga en cuenta la ubicación de las células de Renshaw que expresan fluorescencia roja en el 28 chrna2-Cre ratón cruzado con el reportero del ratón R26 Tom 17. Las barras de escala 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
La confirmación de la identidad Motoneuron base de los potenciales de acción antidrómica
La orientación de la célula
Motoneuronas se encuentran en el cuerno ventral (visible en rojo en la figura 2C). Comience desde el haz de axones que forman la raíz ventral y subir hasta que el haz se dispersa completamente y uno comienza a ver células grandes (eje largo soma, por encima de 20 micras). Lograr la grabación de célula entera de una célula mirando alrededor sano usando un electrodo de la resistencia inicial de 3-4 mO. La solución interna usada contenía: 140 mM K-gluconato, mM KCl 6 mM, HEPES 10 mM, EGTA 1, 0,1 mM CaCl 2, 4 mM Mg-ATP, 0,3 mM Na 2 GTP. Ajustar el pH a 7,3 con KOH, y la osmolaridad a 285 - 295 mOsm añadiendo agua destilada.
Confirmación de la identidad de las neuronas motoras
Una vez que se logra la grabación de células enteras, aplicar una única estimulación bifásica de la raíz ventral Resultados (1 - 50 V, 0,1 - 0,3 ms) para obtener un potencial de acción antidrómica en las células grabadas de la cuerda ventral figuras 3A1 y 3A2 muestran la acción antidrómica. los potenciales de tensión-clamp o corriente-clamp, respectivamente. Cuando el aumento de la intensidad de la estimulación de 1 a 5 V (Figura 3A1) y de 10 a 15 V (Figura 3A2) del potencial de acción antidrómica aparece en un todo o nada de la manera con una latencia de 0,9 mseg y 1,1 mseg, respectivamente. Dado que sólo motoneuronas envían sus axones a través de las raíces ventrales, el potencial de acción antidrómica es una prueba de la identidad de la célula.
En una minoría de neuronas motoras (aproximadamente 10%), la estimulación de la raíz ventral no pudosuscitar potencial de acción antidrómica sino más bien provocada potenciales de acción orthodromic. Las figuras 3B1 y 3B2 muestran los potenciales de acción en orthodromic de fijación de voltaje o corriente-clamp, respectivamente. Cuando el aumento de la estimulación de 20 a 30 V (figura 3B1) y de 25 a 40 V (figura 3B2), aparece un potencial de acción, después de un anterior excitatorio actual post-sináptica (EPSC) o excitatoria post-sináptica potencial (EPSP). Las latencias de los potenciales de acción son más largas (5,1 mseg y 5,3 mseg, respectivamente). En estas dos células, estimulando la raíz ventral provocó una excitación de alimentación hacia adelante (motoneuronas envían axones colaterales a sí mismos ya otros motoneuronas) que era lo suficientemente fuerte como para provocar un potencial de acción ortodrómica. En estas células, el fracaso para obtener un potencial de acción antidrómica (caracteriza por su manera del todo-o-nada y una latencia más corta que 5 ms) no nos permite concluir que estas células ar e motoneuronas. Tenga en cuenta que la intensidad de la estimulación requerida para provocar de alimentación hacia adelante de excitación es superior a la necesaria para provocar un potencial de acción antidrómico. Todos los estímulos que se muestran aquí son de 0,1 ms, pero a veces, la estimulación más largo (hasta 0,3 ms) puede ser necesaria para obtener un potencial de acción antidrómica.
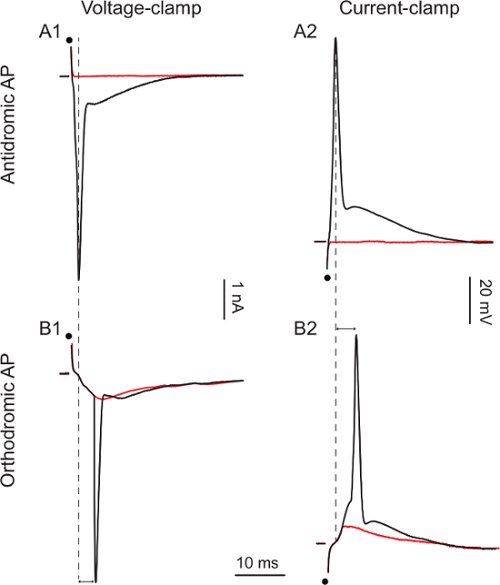
Figura 3. Respuestas motoneuronales a raíz ventral Estimulación
A1: 1 V (línea roja) y 5 V estimulaciones (rastros de negro) A2:.. 10 V (línea roja) y 15 V estimulaciones (rastros de negro) B1: 20 V (línea roja) y 30 V (traza negro) estimulaciones . B2: 25 V (línea roja) y 40 V estimulaciones (rastros de negro). Los puntos negros indican la sincronización de estímulo. puntas de flecha doble enfatizan la diferencia en las latencias entre los picos de orto- y antidrómicos.m / archivos / ftp_upload / 54525 / 54525fig3large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
La estimulación de la célula de Renshaw
La orientación de la célula
Células de Renshaw se encuentran en el asta ventral 27,28. Visualizar los haces de axones con imágenes de contraste de interferencia diferencial (DIC) utilizando un 20X y 63X unos objetivos. Iniciar desde el haz de axones que forman la raíz ventral y subir hasta los axones comienzan a dispersarse, pero son todavía discernible (Figura 4A, flechas). Objetivo de las células de tamaño intermedio (alrededor de 10 a 15 micras de diámetro, la figura 4A, puntas de flecha). Lograr la grabación de célula entera de una célula de aspecto saludable ronda usando un electrodo de la resistencia inicial de 5 a 7 mO. Dependiendo del experimento, se utilizó eiTher Cs + basado o K + -basada soluciones internas 10. La solución basada en Cs impedido grandes corrientes de potasio que eran visibles alrededor de -45 mV. En algunos experimentos, también hemos añadido 5 mM QX-314 para bloquear los canales de sodio responsables de clavar en la célula registrada. La solución de Cs + con base contiene: 125 mM Cs-gluconato, 5 mM QX-314 Cl, mM HEPES 10 mM, EGTA 10, 1 mM CaCl 2, 4 mM Mg-ATP, y 0,4 mM Na-GTP, con el pH ajustado a 7,3 con CsOH. La solución de K + con base debe ser utilizado para analizar, tanto en de voltaje y corriente de la abrazadera, las respuestas de las células de Renshaw a la estimulación de la raíz ventral en las condiciones que se aproxima tanto como sea posible las fisiológicas. Esta solución contiene: 125 mM K-gluconato, mM HEPES 10 mM, EGTA 1, 0,1 mM CaCl 2, 4 mM Mg-ATP, 0,4 mM Na-GTP, con el pH ajustado a 7,3 con KOH. La intensidad del estímulo varía entre 10 y 100 V y su duración variaba entre 50 y 300 microsegundos. Bipo pulsos Lar se utilizaron en todos los casos.
Respuesta de las células de Renshaw a la estimulación de la raíz ventral
La estimulación de la raíz ventral desencadena la corelease de glutamato y acetilcolina de las neuronas motoras colaterales en las células de Renshaw 10. Feed-forward inhibición mediada por el GABA y glicina también se reclutó a 10. La figura 4B muestra las respuestas a la sola estimulación de la raíz ventral. La célula se registró en un modo de fijación de voltaje con la solución basada en cesio, y se mantiene a una tensión de -45 mV. QX-314 en la solución intracelular impidió la célula de la cocción y el GABA y glicina respuestas fueron bloqueados por 3 gabazine M y 1 M estricnina, respectivamente. La corriente sináptica hacia el interior en la Figura 4B es la suma de la glutamatérgica y corrientes nicotínicos.
nt "fo: keep-together.within-page =" 1 ">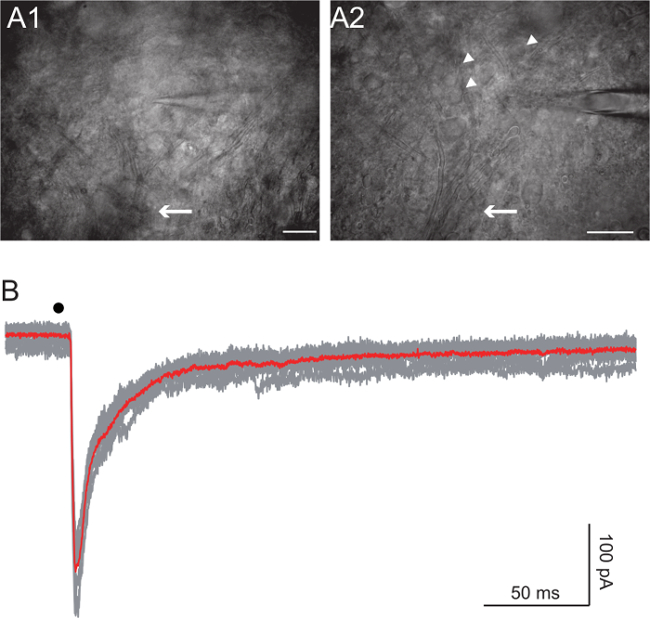
Figura 4. Renshaw estimulación de las células de la raíz ventral
A: Imágenes de la piscina célula de Renshaw adquiridos utilizando un condensador oblicua en el mismo corte tomada en dos diferentes aumentos (20X y 40X). Tenga en cuenta los axones de neuronas motoras que se combinan en la raíz ventral (flecha). putativo células de Renshaw se indican con flechas. Las barras de escala: 100 micras en A1, A2 50 micras de B:. Grabaciones de fijación de voltaje de una célula de Renshaw después de la estimulación de la raíz ventral (punto negro). La línea roja es el promedio de los grises. tensión de retención se fijó en -45 mV. QX-314 en la solución intracelular impidió la célula de la cocción y el GABA y glicina respuestas fueron bloqueados por 3 gabazine M y 1 M estricnina, respectivamente. punto negro indica el tiempo de estímulo.com / archivos / ftp_upload / 54525 / 54525fig4large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
Discusión
rebanar oblicua de la médula espinal es importante ya que permite la estimulación unilateral de piscinas de neuronas motoras y las células de Renshaw en un solo segmento vertebral de una manera fiable, completa y específica. Además, se permite una identificación rápida, elegante y no ambigua de las motoneuronas grabados. A continuación, vamos a destacar las ventajas de esta técnica en comparación con otros métodos de preparación rebanada, y luego vamos a insistir en las trampas más comunes a evitar al realizar este procedimiento.
La mayoría de los estudios que utilizan rodajas transversales basan su identificación en las propiedades eléctricas intrínsecas 3,14,15,29. Sin embargo, estos varían mucho entre los grupos de neuronas motoras, así como entre los subtipos de neuronas motoras dentro de un grupo determinado (alfa, beta y gamma-motoneuronas 30). Por lo tanto, los estudios que utilizan parámetros de tamaño pueden excluir pequeñas gamma motoneuronas. Por otra parte, Cooper y Sherrington described en 1940 un grupo de células nerviosas grandes en la materia gris ventro-lateral de la médula espinal lumbar de los monos y los gatos que habían cruzado ascendente axones 31,32. Además de estar cerca de la somas de las neuronas motoras, observaron que aparecieron histológicamente indistinguibles de las neuronas motoras. Un artículo reciente ha confirmado la existencia de tales células en el ratón 33. Debido al gran tamaño de estas células y su ubicación, que podría haber sido erróneamente incluidos en estudios anteriores. Nuestro criterio de identificación excluye células del borde de la médula putativo, ya que su axón no se proyecta en la raíz ventral, al tiempo que permite una identificación fiable de todas las motoneuronas independientemente de su tamaño. Por otra parte, el análisis de las propiedades eléctricas intrínsecas, (por ejemplo, la resistencia de entrada), es más tiempo que la simple observación de un potencial de acción antidrómica.
Además de utilizar las propiedades eléctricas intrínsecas, algunos studieS a través de cortes transversales, confirmar su identificación mediante la realización de análisis post hoc del marcador molecular de las neuronas motoras (como Islet-1/2 16) o mediante la visualización de la morfología usando biocitina marcajes 14,17. Tales identificaciones son tediosos y sin embargo no proporcionan una identificación directa. Por lo tanto, rara vez se realizan sistemáticamente.
Algunos estudios trataron de hacer uso de las líneas de ratón que expresan un marcador fluorescente motoneurona codificado genéticamente (Hb9-GFP ratón línea 18, chat-EGFP ratones transgénicos, que expresan eGFP en células colinérgicas incluyendo motoneuronas 19, o ratones transgénicos G85R SOD1-YFP, que expresar firmemente la proteína de fusión YFP en motoneuronas 17). Sin embargo, debido a que la expresión del marcador genético está generalmente acondicionado en tiempo y ya que las rebanadas se toman generalmente a partir de embriones o juveniles, la expresión del marcador no puede ser adecuada a la edad de la study se lleva a cabo. Otros estudios han utilizado la inyección retrógrada agente de visualizar la piscina motoneuronas 34. También se realizó cólera inyecciones de toxina beta en el sóleo o la EDL (observación personal). Tales técnicas de marcaje son de gran valor para etiquetar un grupo de neuronas motoras en particular, pero requieren cirugía tediosa unos días antes del experimento. Por otra parte, la temprana edad a la que se están haciendo los experimentos rebanada, hace que sea mucho más difícil de centrarse específicamente en los músculos. Por último, existe una preocupación real de perturbar la motoneurona mediante la inyección de un agente exógeno.
En condiciones óptimas, hemos sido capaces de obtener los potenciales de acción antidrómicos en prácticamente todas las neuronas motoras registradas. El ángulo de 35 ° utilizado es crítica para obtener las raíces ventrales de longitud suficiente. En conclusión, la preparación rebanada oblicua ofrece una manera rápida y fiable para identificar todas las motoneuronas, que es superior a otras técnicas de identificación.
Como se ha dicho en la introducción, sólo dos estudios informaron estimulación exitosa de las raíces ventrales en rodajas transversales. El primer estudio registró las neuronas del cuello uterino en la rata y estimuló la sustancia blanca, donde emerge el talón raíz ventral 4. Indujeron con éxito potencial de acción antidrómica en el 85% de las neuronas registradas. Creemos que su alta tasa de éxito se basó en el hecho de que a nivel cervical, los axones y somas de las neuronas motoras están en el mismo plano. Este no es el caso en rodajas más caudal. Incluso a nivel cervical, sus cortes transversales solamente retienen los trozos de las raíces ventrales, que son menos fiables para estimular. El segundo estudio estimuló el segmento dorso-lumbar 5 de embrión de pollo. Sin embargo, utilizaron voltaje de grabación de tinte sensible, que carecía de la resolución espacial para indicar el éxito de la inducción de una potenciales de acción antidrómicos a nivel de células individuales.
Nuestra preparac rebanadaión también ofrece una forma superior de estimular las células de Renshaw como se indica en un artículo reciente 28. El uso de las rodajas oblicuas, que fueron capaces de grabar monosinápticos Renshaw respuestas de las células en el 46% de los casos, lo cual fue una mejora importante de la tasa de éxito del 10% encontraron con el uso de cortes transversales 35. Aunque no hemos podido encontrar una comparación similar para la estimulación de las neuronas motoras piscinas, esta observación en la célula de Renshaw nos lleva a creer que las motoneuronas también retienen más conectividad.
rebanar oblicua de la médula espinal es una técnica muy exigente que requiere mucha práctica antes de obtener una preparación fiable de la que se puede grabar. Con unas pinzas muy finas y afiladas y microtijera es esencial. El tiempo de permanencia de disección puede ser bastante largo (hasta 1 hora), siempre y cuando todo el procedimiento se lleva a cabo en un medio de disección carbógeno-burbujeó enfriada. Mientras que algunos autores no reconocen ningún beneficio de perfusio intracardiacan en la preparación de rebanadas 36, decidimos mantener este paso del procedimiento. Es difícil medir objetivamente el beneficio de la perfusión intracardiaca por la calidad de las grabaciones, en especial, ya que varía con la edad.
El factor más importante es la edad del ratón. Se registró con éxito de ratones entre P2 y P11 utilizando el protocolo anterior. Más allá de esta edad, la mielina de la médula espinal se vuelve demasiado denso y las células más grandes (las motoneuronas) mueren antes de rebanar, muy probablemente debido a la falta de oxígeno. Después de esa ventana, encontramos cada vez más difícil obtener rodajas saludables. Recientemente, se ha informado de nuevas técnicas para obtener rebanadas saludables en animales de más edad 17,36. Ellos usan aditivos adicionales para su disección y medio de grabación como fuentes complementarias de energía (etil-piruvato), menores de Na + y Cl - concentraciones para prevenir oncosis de las células 37,38 y polietilenglicol para limitar la FEPECTS de los extensos cortes transversales de membrana que se producen durante el corte. Con estas mejoras, que fueron capaces de grabar de hasta 6 meses de edad los animales.
En el futuro, sería interesante intentar rebanada preparativos oblicuas en los animales adultos de combinar las ventajas de las dos técnicas. La combinación de los dos protocolos debería resultar relativamente fácil y proporcionará una herramienta fiable para confirmar la identidad de las neuronas motoras y estudiar la población objetivo de los axones de las neuronas motoras colaterales en ratones adultos. Además, se podría tratar de obtener rodajas oblicuas en el ratón embrión. Digno de mención, nuestra preparación también conserva las raíces dorsales, que pueden ser estimuladas para estudiar la activación monosynaptic I una inervación a las neuronas motoras, así como la activación de la médula espinal dorsal poblaciones neuronales. En conclusión, las estimulaciones raíz ventral ofrecen una herramienta fiable para confirmar la identidad de las neuronas motoras y estudiar la población objetivo de los axones colaterales de las neuronas motoras.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Los autores agradecen a Marin Manuel y Olivia Goldman-Szwajkajzer por su ayuda en la toma de las fotografías. Los autores también agradecen a Arjun Masukar y Tobias Bock para la corrección del manuscrito. Ayudas económicas fueron proporcionados por la Agence Nationale pour la Recherche (Hyper-MND, ANR-2010-BLAN-1429/01), el NIH NINDS (R01NS077863), la Fundación Latran Thierry (OHEX Proyecto), la Asociación Francesa de miopatía ( la subvención número 16026) y Target ALS se agradece. Felix Leroy era el destinatario de un "Contrato de Doctorado" de la Escuela Normal Superior, Cachan.
Materiales
| Name | Company | Catalog Number | Comments |
| Na-kynurenate | ABCAM | ab120256 | dissolves better then other brands |
| KCl | Sigma | P3911 | |
| NaH2PO4 | Sigma | P5655 | |
| sucrose | Sigma | S9378 | |
| NaHCO3 | Sigma | S6014 | |
| CaCl2 | G Biosciences | R040 | |
| MgCl2 | Quality Biological | 351-033-721 | |
| glucose | Sigma | G5767 | |
| ascorbic acid | Sigma | A5960 | |
| Na-pyruvate | Sigma | P2250 | |
| K-gluconate | Sigma | P1847 | |
| EGTA | Sigma | E3889 | |
| HEPES | Sigma | H4034 | |
| NaCl | Sigma | S9888 | |
| Agar | Sigma | A9799 | |
| QX-314 | Alomone | Q150 | |
| Mg-ATP | Sigma | A9187 | |
| CsOH | Sigma | 232041 | |
| Na-GTP | Sigma | 51120 | |
| gluconic acid | Sigma | G1951 | |
| Cesium hydroxide solution | Sigma | 232041 | |
| KOH | Sigma | P5958 | |
| Vannas Spring Scissors - 2.5mm | FST | 15000-08 | only use for cutting the dura, might get damaged if cutting bones |
| Stimulator | A-M Systems | Isolated Pulse Stimulator Model 2100 | |
| Vibratome | Campden | Vibrating Microtome 7000 - Model 7000smz-2 |
Referencias
- Brooks, C. M., Downman, C. B., Eccles, J. C. After-potentials and excitability of spinal motoneurones following antidromic activation. J Neurophysiol. 13 (1), 9-38 (1950).
- Bories, C., Amendola, J., Lamotte d'Incamps, B., Durand, J. Early electrophysiological abnormalities in lumbar motoneurons in a transgenic mouse model of amyotrophic lateral sclerosis. Eur J Neurosci. 25 (2), 451-459 (2007).
- Takahashi, T. Membrane currents in visually identified motoneurones of neonatal rat spinal cord. J Physiol. 423, 27-46 (1990).
- Hori, N., Tan, Y., Strominger, N. L., Carpenter, D. O. Intracellular activity of rat spinal cord motoneurons in slices. J Neurosci Methods. 112 (2), 185-191 (2001).
- Arai, Y., Mentis, G. Z., Wu, J. Y., O'Donovan, M. J. Ventrolateral origin of each cycle of rhythmic activity generated by the spinal cord of the chick embryo. PLoS One. 2 (5), e417 (2007).
- Cullheim, S., Lipsenthal, L., Burke, R. E. Direct monosynaptic contacts between type-identified alpha-motoneurons in the cat. Brain Res. 308 (1), 196-199 (1984).
- Cullheim, S., Kellerth, J. O., Conradi, S. Evidence for direct synaptic interconnections between cat spinal alpha-motoneurons via the recurrent axon collaterals: a morphological study using intracellular injection of horseradish peroxidase. Brain Res. 132 (1), 1-10 (1977).
- Gogan, P., Gueritaud, J. P., Horcholle-Bossavit, G., Tyc-Dumont, S. Direct excitatory interactions between spinal motoneurones of the cat. J Physiol. 272 (3), 755-767 (1977).
- Ichinose, T., Miyata, Y. Recurrent excitation of motoneurons in the isolated spinal cord of newborn rats detected by whole-cell recording. Neurosci Res. 31 (3), 179-187 (1998).
- Lamotte d'Incamps, B., Ascher, P. Four excitatory postsynaptic ionotropic receptors coactivated at the motoneuron-Renshaw cell synapse. J Neurosci. 28 (52), 14121-14131 (2008).
- Renshaw, B. Central effects of centripetal impulses in axons of spinal ventral roots. J Neurophysiol. 9, 191-204 (1946).
- Renshaw, B. Interaction of nerve impulses in the gray matter as a mechanism in central inhibition. Fed Proc. 5 (1 Pt 2), 86 (1946).
- Renshaw, B. Observations on interaction of nerve impulses in the gray matter and on the nature of central inhibition). Am J Physiol. 146, 443-448 (1946).
- Pambo-Pambo, A., Durand, J., Gueritaud, J. P. Early excitability changes in lumbar motoneurons of transgenic SOD1G85R and SOD1G(93A-Low) mice. J Neurophysiol. 102 (6), 3627-3642 (2009).
- Quinlan, K. A., Schuster, J. E., Fu, R., Siddique, T., Heckman, C. J. Altered postnatal maturation of electrical properties in spinal motoneurons in a mouse model of amyotrophic lateral sclerosis. J Physiol. 589 (Pt 9), 2245-2260 (2011).
- Martin, E., Cazenave, W., Cattaert, D., Branchereau, P. Embryonic alteration of motoneuronal morphology induces hyperexcitability in the mouse model of amyotrophic lateral sclerosis. Neurobiol Dis. 54, 116-126 (2013).
- Hadzipasic, M., et al. Selective degeneration of a physiological subtype of spinal motor neuron in mice with SOD1-linked ALS. Proc Natl Acad Sci U S A. 111 (47), 16883-16888 (2014).
- Wichterle, H., Lieberam, I., Porter, J. A., Jessell, T. M. Directed differentiation of embryonic stem cells into motor neurons. Cell. 110 (3), 385-397 (2002).
- Tallini, Y. N., et al. BAC transgenic mice express enhanced green fluorescent protein in central and peripheral cholinergic neurons. Physiol Genomics. 27 (3), 391-397 (2006).
- Manuel, M., et al. Fast kinetics, high-frequency oscillations, and subprimary firing range in adult mouse spinal motoneurons. J Neurosci. 29 (36), 11246-11256 (2009).
- Obeidat, A. Z., Nardelli, P., Powers, R. K., Cope, T. C. Modulation of motoneuron firing by recurrent inhibition in the adult rat in vivo. J Neurophysiol. 112 (9), 2302-2315 (2014).
- Leroy, F., Lamotte d'Incamps, B., Imhoff-Manuel, R. D., Zytnicki, D. Early intrinsic hyperexcitability does not contribute to motoneuron degeneration in amyotrophic lateral sclerosis. Elife. 3, (2014).
- Leroy, F., Lamotte d'Incamps, B., Zytnicki, D. Potassium currents dynamically set the recruitment and firing properties of F-type motoneurons in neonatal mice. J Neurophysiol. 114 (3), 1963-1973 (2015).
- Lamotte d'Incamps, B., Ascher, P. Subunit composition and kinetics of the Renshaw cell heteromeric nicotinic receptors. Biochem Pharmacol. 86 (8), 1114-1121 (2013).
- Lamotte d'Incamps, B., Krejci, E., Ascher, P. Mechanisms shaping the slow nicotinic synaptic current at the motoneuron-renshaw cell synapse. J Neurosci. 32 (24), 8413-8423 (2012).
- Dugue, G. P., Dumoulin, A., Triller, A., Dieudonne, S. Target-dependent use of co-released inhibitory transmitters at central synapses. J Neurosci. 25 (28), 6490-6498 (2005).
- Mentis, G. Z., Siembab, V. C., Zerda, R., O'Donovan, M. J., Alvarez, F. J. Primary afferent synapses on developing and adult Renshaw cells. J Neurosci. 26 (51), 13297-13310 (2006).
- Perry, S., et al. Firing properties of Renshaw cells defined by Chrna2 are modulated by hyperpolarizing and small conductance ion currents Ih and ISK. Eur J Neurosci. 41 (7), 889-900 (2015).
- Thurbon, D., Luscher, H. R., Hofstetter, T., Redman, S. J. Passive electrical properties of ventral horn neurons in rat spinal cord slices. J Neurophysiol. 79 (5), 2485-2502 (1998).
- Zengel, J. E., Reid, S. A., Sypert, G. W., Munson, J. B. Membrane electrical properties and prediction of motor-unit type of medial gastrocnemius motoneurons in the cat. J Neurophysiol. 53 (5), 1323-1344 (1985).
- Cooper, S., Sherington, C. S. Gower's tract and spinal border cells. Brain. 63, 123-124 (1940).
- Morin, F., Schwartz, H. G., O'Leary, J. L. Experimental study of the spinothalamic and related tracts. Acta Psychiatr Neurol Scand. 26 (3-4), 371-396 (1951).
- Sengul, G., Fu, Y., Yu, Y., Paxinos, G. Spinal cord projections to the cerebellum in the mouse. Brain Struct Funct. 220 (5), 2997-3009 (2015).
- Russier, M., Carlier, E., Ankri, N., Fronzaroli, L., Debanne, D. A-, T-, and H-type currents shape intrinsic firing of developing rat abducens motoneurons. J Physiol. 549 (Pt 1), 21-36 (2003).
- Dourado, M., Sargent, P. B. Properties of nicotinic receptors underlying Renshaw cell excitation by alpha-motor neurons in neonatal rat spinal cord). J Neurophysiol. 87 (6), 3117-3125 (2002).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. J Neurophysiol. 107 (2), 728-741 (2012).
- Rothman, S. M. The neurotoxicity of excitatory amino acids is produced by passive chloride influx. J Neurosci. 5 (6), 1483-1489 (1985).
- Olney, J. W., Price, M. T., Samson, L., Labruyere, J. The role of specific ions in glutamate neurotoxicity. Neurosci Lett. 65 (1), 65-71 (1986).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados