Method Article
הכנת פרוסות קורד אלכסון שדרה עבור גחון רוט גירוי
In This Article
Summary
אנחנו מראים איך להכין פרוסות אלכסוניות של חוט השדרה בעכברים צעירים. הכנה זו מאפשרת גירוי של שורשי הגחון.
Abstract
קלטות אלקטרו מתוך פרוסות חוט שדרה הוכיחו להיות טכניקת ערך לחקור מגוון רחב של שאלות, מן הסלולר מאפייני רשת. אנחנו מראים איך להכין פרוסות קיימא אלכסוניות של חוט השדרה של עכברים צעירים (P2 - P11). בהכנה זו, motoneurons לשמור האקסונים שלהם יוצאים מן שורשי הגחון של חוט השדרה. גירוי של אקסונים אלה מעורר גב הפצת פוטנציאל פעולה פולש somas motoneuron ומרגשים בטוחות motoneuron בתוך חוט השדרה. הקלטה של פוטנציאל פעולה antidromic היא דרך מיידית, מוחלטת ואלגנטית לאפיין זהות motoneuron, אשר עולה שיטות זיהוי אחרות. יתר על כן, מגרה בטוחה motoneuron היא דרך פשוטה ואמינה כדי להלהיב את המטרות בטחונות של motoneurons בתוך חוט השדרה, כגון motoneurons אחר או Renshaw תאים. בפרוטוקול זה, אנו מציגים הקלטות antidromic מן motoneuron somas וכן עירור התא Renshaw, הנובע גירוי שורש הגחון.
Introduction
מבחינה היסטורית, הקלטות motoneuron באמצעות אלקטרודה חדה נערכו in vivo על בעלי חיים גדולים כגון חתולים או חולדות 1 או על חוט השדרה כולו מבודד בעכברים 2. הופעה של טכניקת הקלטת תיקון- clamp במהלך 1980, קרא גישה ישירה אל motoneuron somas איטום צריך להיות מושגת תחת הנחיה חזותית. לפיכך, הכנת פרוסת חוט השדרה הושגה בקלות מאז תחילת שנות 1990 3. עם זאת, להכנת פרוסה מוקדם לעתים קרובות לא מאפשרת הגירוי של שורשי הגחון. למיטב ידיעתנו, רק שני מחקרים דיווחו גירוי מוצלח של שורשי הגחון פרוסים רוחבי, ואף אחד הושג מעכברי 4,5.
במאמר זה אנו מציגים טכניקה כדי להשיג פרוסות חוט השדרה קיימא של עכברים בילוד (P2 - P11) שבו הבריכה motoneuron שומרת אקסונים היוצאים שורש הגחון שלה. לפרוקגירוי שורש RAL מפעיל פוטנציאל פעולת antidromic בחזרה somas על ברכת motoneuron יציאה מאותו שורש הגחון. זה גם מלהיב את המטרות בטחונות motoneuron, motoneurons האחר 6-10 ותאי Renshaw 11-13. מאז רק motoneurons לשלוח האקסונים שלהם למטה השורשים הגחון, אנו משתמשים הקלטה של פוטנציאל פעולה antidromic כדרך פשוטה סופי physiologicaly לזהות motoneurons 10.
בנוסף לשימוש פוטנציאלי הלא כלול או מטעה קריטריונים אלקטרו וצורני כדי לוודא את זהותו motoneuron, מחקרים שנעשו לאחרונה על motoneurons חוט השדרה הסתמך גם על 16 מייגע זמן רב פוסט הוק stainings. זיהוי כאלה בדרך כלל מבוצע רק על מדגם של התאים המוקלטים. באסטרטגיות זיהוי אחרים מסתמכים על קווי עכבר שבה motoneurons להביע הקרינה אנדוגני 17-19. עם זאת, באמצעות סמנים מקודדים גנטי עלול להיות קשה בגיל צעיר כאשר ביטוי סמן עדיין משתנה או אם המחקר כבר דורש באמצעות קו עכבר מהונדס. לחלופין, הקלטות פוטנציאל פעולת antidromic יכולות להתבצע באופן שגרתי על כל העכברים מתחיל הקלטת תא. מבצעי ניסוי עובדים על הכנות חוט שדרה שלמות של החתול, חולדה ועכבר, משתמשים באופן מהימן טכניקות זיהוי כאלה מאז 1950 1,2,20,21. בתנאים אופטימליים, הצלחנו לעורר פוטנציאל פעולה antidromic מן כמעט כל motoneurons מוקלט.
יתר על כן, גירוי שורש גחון יכול לשמש כדי להלהיב motoneurons האחר מהימן 22,23 או המטרות שלהם. 10,24,25 התאים Renshaw. אנו מציגים כאן יישומים של גירוי שורש הגחון בצורת הקלטות פוטנציאל פעולת antidromic מ motoneuron somas, וכן עירור של תאי רנשו.
Protocol
הניסויים בוצעו בהתאם להוראות האירופי (86/609 / CEE ו- 2010-63-UE) וחקיקה צרפתית, ואושרו על ידי ועדת האתיקה של אוניברסיטת פריז דקארט.
1. חוט שדרה כנה Slice
- הכן את הפתרונות הבאים יומי או יום אחד מראש. אם כל זמן הלילה, בועה עם 95% O 2, 5% CO 2 ולשמור בקירור בקבוקי סגור היטב.
- הכן נמוך Na + מלאכותי הנוזל השדרתי (ACSF): 3 מ"מ KCl, 1 מ"מ לאא 2 4 PO, 230 סוכרוז מ"מ, 26 מ"מ NaHCO 3, 0.8 מ"מ 2 CaCl, 8 מ"מ MgCl 2, 25 גלוקוז מ"מ, חומצה אסקורבית 0.4 מ"מ, 1 מ"מ Na-kynurenate, 2 מ"מ Na-פירובט. בועה עם 95% O 2 ו -5% CO 2 (pH 7.4). מאז Na-kynurenate הוא לעתים קרובות קשה לפזר, לוודא כדי לרכוש את הכבל מפורט בטבלת החומרים.
- כן solu-גלוקונאט Ktion: 130 מ"מ K-גלוקונאט, 15 מ"מ KCl, 0.05 מ"מ EGTA, 20 HEPES מ"מ, 25 מ"מ גלוקוז, 1 מ"מ Na-kynurenate, 2 מ"מ Na-פירובט, מותאם pH 7.4 עם KOH.
- הכן ACSF: 130 mM NaCl, KCl 2.5 מ"מ, 2 מ"מ 2 CaCl, 1 מ"מ MgCl 2, 1 מ"מ לאא 2 4 PO, 26 מ"מ NaHCO 3, 25 גלוקוז מ"מ, 0.4 חומצה אסקורבית מ"מ, 2 מ"מ Na-פירובט. בועה עם 95% O 2 ו -5% CO 2 (pH 7.4).
- לפני תחילת לנתיחה, לפזר אגר 2% ב 80 מ"ל של תמיסת-גלוקונאט K, להתחמם על 60 מעלות צלזיוס.
- זלוף intracardiac
- יש לבצע הכנה זו על עכברים נשיים וגבריים, שגילן נע בין P2 ל P11.
- להרדים את העכבר עם זריקה intraperitoneal של 0.1 מ"ל של 25 מ"מ נתרן pentobarbital (50 מ"ג / ק"ג).
- שימוש במחטים או קלטת, לשתק את העכבר על גבה על צלחת פטרי גדולה מלאת סיליקון. השתמש microscop לנתחדואר לשארית לנתיחה.
- החזקת קצה עצם החזה, הרם את החזה וחתך את הסרעפת באמצעות מספריים בסדר. לאחר מכן פתח את החזה משני הצדדים על ידי חיתוך דרך הצלעות כדי לחשוף את הלב.
- חותכים את אטריום ימין לפני ניקוב החדר השמאלי עם מחט 27G.
- Perfuse עם ACSF Na + נמוך קר כקרח. לאחר 30 שניות, נמוך Na + ACSF יש לראות זורם החוצה של אטריום. כמויות נמוכות של נתרן למנוע את התאים מפני spiking ולהפחית מוות הסלולר במהלך לנתיחה.
- המשך ללחוץ על למחט בלב תחת מיקרוסקופ לנתח עד שהכבד הופך צהוב כאשר הדם מנוקז.
- לנתיחת חוט שדרה
- לערוף את החיה ולשים אותו על הבטן.
- להסיר במהירות את העור של הגב (איור 1A1). בשני חתכים דרך הכתפיים יורדים כלוב החזה (איור 1A2). ואז לחתוך את חבל הטבור כפי low ככל האפשר בחלק הזנב כדי לבודד את עמוד השדרה עם תחילת הצלעות מהחלק התחתון של החיה. הפוך את החיה שוב להסיר את הקרביים עדיין מחוברים הצלעות.
- מעבירים את עמוד השדרה למשנהו, צלחת פטרי מלאות סיליקון קטן ולהשתמש 4 סיכות חרקים להחזיק עד הגבי זה בצד (איור 1 א).
- ברציפות perfuse חיה עם ACSF-מבעבע carbogen (בסביבות 4 מעלות צלזיוס) תוך ביצוע laminectomy של הצד הגבה, וחשיפת חוט השדרה של הסוף המקורי (איור 1 ב). לשם כך, הכנס את הקצה מספרי בסדר בין העצם ואת חוט השדרה וחתכת את עצם טיפות טיפות המסוף המקורי, והקפד להתרחק בחומר הלבן. מתחלף בכל צד תוך שימוש בפינצטה כדי להרחיק את הלהקה של העצם כבר לחתוך (איור 1B1).
- בעזרת מספרי האביב זמינים הקטנים פינצטה, להרים את הדורה וחותךמשני הצדדים בעת החזקת חלק רופף של דורה כדי למנוע נזק לחוט השדרה עם מספריים. חותכים לאורך ציר rostro- הזנב.
הערה: הדורה היא קרום רציף שקוף למחצה; בגיל זה מאטר פיא היא שברירית מדי יתפורר במהלך הניתוח וחותך (איור 1B2). - לאחר הדורה היא שימוש שהוסר כוס בוטה או קצה פלסטיק לדחוף את הכבל בעדינות בצד השמאל של החריץ שנוצר על ידי עמוד השדרה חצי לחתוך, לחתוך את שורשי גחון ועל גב בצד ימין, החלה מהצד המקורי קליעה, ממקום שבו הם מזינים את הכבל (כמה מ"מ לפחות, איור 1B2).
- חזור על הפעולה בצד שמאל, תמיד הולך מ מקורי כדי הזנב. אם שמאלי, להתחיל מהאגף השמאלי ולאחר מכן לעבור לצד ימין.
- שיבוץ אגר
- להחליק את החוט מתוך עמוד השדרה. בעזרת מערוך חרקים קטן להצמידאת הכבל עם פני השטח הגבה עד ולהסיר כל פיסת הממברנה בעדינות עדיין קשור אליו (איור 1C1).
- לאחר לנקות, לקצץ את שני הקצוות (איור 1C2). הכנס סיכה חרקים bended בחלק הקדמי של חוט כדי לתפעל את כבל ושים לב האוריינטציה שלו (החץ באיור 1C2). ואז להעביר את חוט השדרה פתרון קר כקרח K-גלוקונאט.
הערה: פתרון זה מחק את הרכב התאי של CSF וימנע תאים מהמוות של הלם אוסמוטי פעם motoneurons יקוצץ 26. - לאחר חוט השדרה הוא בתוך פתרון תוך התאי, לקחת הכוס עם אגר מתוך האמבטיה היבשה לקרר אותו על תערובת של קרח ומים.
- לבחוש תוך מדידת הטמפרטורה. כאשר הטמפרטורה מגיעה 38 ° C לטבול את חוט השדרה, מחזיק אותו על ידי סיכת החרק ולמקם אותו מקורי צד למטה. ודא חוט השדרה הוא כמו straight ככל האפשר, הרחק מהקירות, חלק הזנב מעט כלפי מעלה (איור 1D1).
- השאר את הכוס בתערובת של קרח ומים לאפשר אגר לגבש מהר ככל האפשר. ודא שהוא נשאר במקום שהכבל הוא וישר ככל האפשר (איור 1D1).
- פִּלוּחַ
- לאחר התמצקות, חותך את הגוש אגר המכיל את חוט השדרה בצורה כזאת, כי הבסיס של הבלוק הוא בזווית 35 מעלות עם החלק המותני של החוט (חץ באיור 1D2). המשטח הגבה צריכה להיות פונה משם מהבסיס (האיור 1D2).
הערה: זהו צעד קריטי בהליך עבור שמירה על הרצף של ברכות motoneuron לשורשי הגחון שממנו הם יוצאים. - מדביק את הבלוק לתוך התא של vibratome באמצעות דבק cyanoacrylate. לטבול אותו פתרון K-גלוקונאט ולהוסיף פתרון-גלוקונאט K קפוא דשדשנו לשמורבאמבטיה מקוררת (מתחת ל -2 מעלות צלזיוס).
- חותך 350 - 400 מיקרומטר פרוסות עבות של האזור המותני (לזיהוי על ידי העקמומיות שלה בקוטר גדול יותר). ב הכיוון הנכון שלה (ראה 1.4.1.), השתמש להב לחתוך מן הגב אל פני השטח הגחון ולעשות פרוסות ברציפות יותר מקורי. בדרך כלל, ישנם 4-5 פרוסות מתאימות עם שורשי גחון הארכת 2 מ"מ או יותר. השתמש בפרמטרים הבאים: 10 ° זווית, 70 הרץ תדירות הרטט 10 מ"מ / דקה מהירות של חיתוך.
- לאחר התמצקות, חותך את הגוש אגר המכיל את חוט השדרה בצורה כזאת, כי הבסיס של הבלוק הוא בזווית 35 מעלות עם החלק המותני של החוט (חץ באיור 1D2). המשטח הגבה צריכה להיות פונה משם מהבסיס (האיור 1D2).
- דְגִירָה
- מעבירים את הפרוסות ACSF ב 34 ° C. לאחר כ 30 דקות, לצנן את הפרוסות עד RT ולהתחיל את ההקלטות.

באיור 1. Dissection
A1:. הסרת העור של הגב לחשוף בעמודה הגבה A2:חיתוך של הכתפיים והצלעות לשחרר את הגב טור B1:. עמוד השדרה הצמיד על צלחת פטרי מלאות סיליקון (צד הגב למעלה, בצד הזנב השמאלי) B2:. אותו דבר עם חוט השדרה חשוף גזור C1:. חוט השדרה מבודד . (מקורי בצד שמאל) C2: חוט שדרה מוכן להיות מוטבעים (עד צד הגחוני, בצד מקורה שמאל). שים לב סיכת החרק הקטנה בצד המקורי D1:.. חוט שדרה בכוס אגרה (דאו צד מקורי, בצד גחון מול התחתון) D2: בלוק אגר Cut עם חוט השדרה המוטבע. הערת זווית 35 ° צורות חוט השדרה עם הבסיס של הבלוק ואת ההרחבה המותני (חץ). ברי סולם 1 סנטימטר. נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
2. הצבת Slice לתוך הקאמרי
הערה: Veשורשי ntral הם באורך משתנה.
- כן קופסא טפטפות שונים בקטרי טיפ הנעים בין 40 ל 170 מיקרומטר מראש. כדי להכין טפטפות יניקה, להכין טפטפות רבים עם להתחדד ארוך. בעזרת סכין יהלום, לעשות חתך שהוצבו בנקודות שונות. אז תחת מיקרוסקופ לנתח, לשבור אותו על ידי להכות את הקצה עם פינצטה.
- הסר את תא המיקרוסקופ הקלטה ולמקם אותו תחת מיקרוסקופ לנתח.
- בחר פרוסה המכילה שורש גחון של אורך מספיק (2 מ"מ או יותר) כדי להיות מותקנות על האלקטרודה גירוי יניקה. בחר את הכיוון הנכון של הפרוסה עם שורשי הגחון כלפי מעלה (איור 2 א) ובעדינות לחתוך את אגר סביב שורשי הגחון ולהשאיר את השאר של אגר ברחבי הפרוסה (התרשים 2B).
הערה: מאחר אגר הוא נחוש יותר הפרוס, זה יאפשר את החוטים של העוגן של הפרוסה לנוח על אגר ולא על הפרוסה ובכך אnchor לא לגרום נזק לרקמות. ודא החוטים של העוגן של הפרוסה הם מעל ברכת motoneuron (באדום באיור 2C). - הר קאמרית בחזרה אל המיקרוסקופ ברציפות perfuse לתא הקלטה עם ACSF בשיעור של 1 - 2 מ"ל / דקה, ב RT. בעזרת פיפטה זכוכית מלאה ACSF ומחובר מזרק, למצוץ אחד שורש הגחון (חץ באיור 2C). על מנת להשיג גירוי טוב של שורש הגחון, קצה פיפטה צריך להיות הדוק סביב שורש הגחון. מוט אחד צריך להיות ב האלקטרודה מגרה והשני באמבטיה (או מחובר הפניה אלקטרודה-clamping תיקון).
- להשיג הקלטת תיקון- clamp של תא מהסוג הרצוי ולהקליט את השפעת גירוי שורש הגחון כמתואר previsouly 10.
- הנה, השתמש מגבר לרכישת נתונים. מסנן כל תא הקלטות ב 3 קילוהרץ. לספרה ב 10 קילוהרץ. לפצות התנגדות גשר curreמצב NT-מהדק.

איור 2. גחון רוט כן
ת: פרוסת חוט השדרה המותני מוטבע אגר עם השורש הגחוני פונה כלפי מעלה ב:. פרוסת חוט השדרה המותני עם השורשים הגחון משוחרר מן אגר C:. פרוסת חוט השדרה המותני עם אלקטרודה מגרה הניח בחוזקה סביב השורשים הגחון (חץ) . שים לב למיקום של תאי רנשו להביע קרינה אדומה chrna2-Cre עכבר 28 חצה עם כתב העכבר R26 טום 17. ברי סולם 1 מ"מ. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
תוצאות
אישור של זהות Motoneuron שימוש פוטנציאל פעולה Antidromic
מיקוד נייד
Motoneurons נמצאים צופר הגחון (גלוי באדום באיור 2C). התחל מהצרור של אקסונים להרכיב שורש הגחון וללכת עד הצרור מפזר באופן מלא ואחד מתחיל לראות את תא גדול (ציר soma הארוך, מעל 20 מיקרומטר). להשיג הקלטה כל תא של תא עגול ובריא באמצעות אלקטרודה ההתנגדות הראשונית של 3 עד 4 MΩ. הפתרון הפנימי שימוש הכיל: 140 מ"מ K-גלוקונאט, 6 KCl מ"מ, 10 מ"מ HEPES, 1 מ"מ EGTA, 0.1 מ"מ CaCl 2, 4 מ"מ Mg-ATP, 0.3 מ"מ Na 2 GTP. התאם את ה- pH ל -7.3 עם KOH, ואת osmolarity ל 285 - 295 mOsm על ידי הוספת מים מזוקקים.
של זהות motoneuron
לאחר הקלטת כל תא מושגת, להחיל גירוי biphasic יחיד של השורש הגחון (1 - 50 V, 0.1 - 0.3 msec) כדי לעורר פוטנציאל פעולה antidromic בתאים רשמה של חוט הגחון דמויות 3A1 ו 3A2 תכנית פעולה antidromic. פוטנציאלים ב-מהדק מתח או מהדק נוכחי, בהתאמה. כאשר מגדילים את עוצמת הגירוי בין 1 ל -5 V (איור 3A1) ו מ -10 ל -15 V (איור 3A2) פוטנציאל הפעולה antidromic מופיע בצורה כל-או-כלום עם חביון של 0.9 msec ו -1.1 msec, בהתאמה. בהתחשב בכך motoneurons רק לשלוח האקסונים שלהם דרך השורשים הגחון, פוטנציאל הפעולה antidromic הוא הוכחת זהות התא.
במיעוט motoneurons (כ -10%), גירוי שורש הגחון נכשללעורר פוטנציאל פעולה antidromic אלא שהושרו פוטנציאל פעולה orthodromic. דמויות 3B1 ו 3B2 להראות פוטנציאל פעולה orthodromic מתח מהדק או מהדק הנוכחית, בהתאמה. כאשר מגדילים את סטימולציה 20 כדי 30 V (איור 3B1) ומ 25 כדי 40 V (איור 3B2), פוטנציאל פעולה מופיע, בעקבות פוסט סינפטי נוכחי מעורר קודם (EPSC) או מעוררי פוסט סינפטי פוטנציאל (EPSP). השהיות של פוטנציאל הפעולה ארוכות (5.1 msec ו -5.3 msec, בהתאמה). בשני תאים אלה, מגרה את שורש הגחון עורר עירור feed-קדימה (motoneurons לשלוח בטחונות האקסון לעצמם motoneurons אחרים) כי היה חזק מספיק כדי לעורר פוטנציאל פעולה orthodromic. בתאים כאלה, הכישלון לעורר פוטנציאל פעולת antidromic (מאופיינת האופנה שלה כל-או-כלום חביון קצר מ -5 msec) אינו מאפשר לנו להגיע למסקנה כי תאים אלה ar motoneurons דואר. ראוי לציין, כי עוצמת הגירוי הדרוש כדי לעורר עירור feed-קדימה הוא גבוה יותר מאשר זה הדרוש כדי לעורר פוטנציאל פעולה antidromic. כל הגירויים המוצגים כאן הם 0.1 msec אבל לפעמים, גירוי ארוך יותר (עד 0.3 msec) עשוי להידרש כדי לעורר פוטנציאל פעולה antidromic.
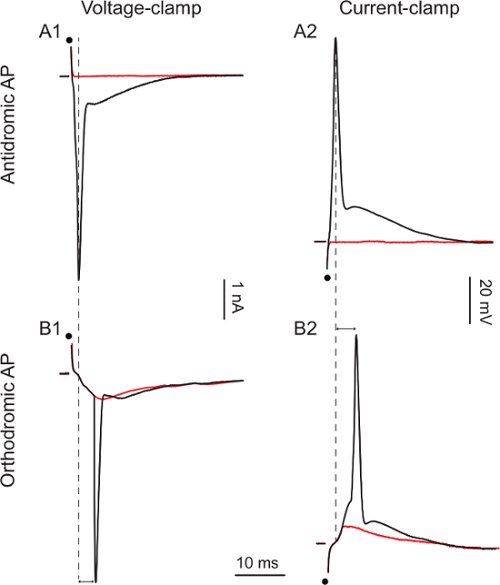
תגובות איור 3. Motoneuron כדי הגחון רוט גירוי
A1: 1 V (זכר אדום) ו -5 V הגירויים (זכר שחור) A2:.. 10 V (זכר אדום) ו -15 V (זכר שחור) גירויים B1: 20 V (זכר אדום) ו -30 V (זכר שחור) גירויים . B2: 25 V (זכר אדום) ו -40 V (זכר שחור) גירויים. נקודות שחורות מצביעות עיתוי גירוי. ראשי חץ זוגי להדגיש את ההבדל latencies בין קוצים יָשָׁר ו antidromic.מ '/ קבצים / ftp_upload / 54,525 / 54525fig3large.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
גירוי תא Renshaw
מיקוד נייד
תאי רנשו נמצאים צופר גחון 27,28. דמיינו את חבילות האקסון עם התערבות ההפרש לעומת זאת הדמיה (DIC) באמצעות 20X לבין מטרות 63X. התחל מהצרור של אקסונים להרכיב שורש הגחון וללכת עד אקסונים מתחילים להתפזר אך עדיין ניתן להבחין (איור 4 א, חיצים). כוון את התאים של גודל בינוני (כ 10 - 15 מיקרומטר קוטר, איור 4 א, ראשי חץ). להשיג הקלטה כל תא של תא עגול ובריא למראה באמצעות אלקטרודה ההתנגדות הראשונית של 5 עד 7 MΩ. בהתאם הניסוי, השתמשנו eiיס Cs + מבוסס או K + מבוססת פתרונות פנימיים 10. הפתרון המבוסס Cs מנע זרמי אשלגן גדולים אשר נראו סביב -45 mV. בניסויים מסוימים, אנחנו גם הוספנו 5 מ"מ QX-314 לחסום את תעלות הנתרן האחראיות spiking בתא המוקלט. קל CS + מבוססי פתרון מכיל: 125 מ"מ Cs-גלוקונאט, 5 מ"מ QX-314 Cl, 10 HEPES מ"מ, 10 מ"מ EGTA, 1 מ"מ CaCl 2, 4 מ"מ Mg-ATP, ו -0.4 מ"מ Na-GTP, עם pH מותאם 7.3 עם CsOH. K + מבוססי הפתרון צריך לשמש לאבחון, הוא voltage- ועדכן מהדק, תגובות תא Renshaw לגירוי שורש גחון בתנאים המתקרבות ככל האפשר אלה הפיסיולוגיים. פתרון זה מכיל: 125 מ"מ K-גלוקונאט, 10 HEPES מ"מ, 1 מ"מ EGTA, 0.1 מ"מ 2 CaCl, 4 מ"מ Mg-ATP, 0.4 מ"מ Na-GTP, עם pH מותאם 7.3 עם KOH. עוצמת הגירוי נעה בין 10 ל -100 V והמשך שלה נעה בין 50 ל 300 μsec. Bipo פולסים Lar שימשו בכל המקרים.
תגובת תאי Renshaw לגירוי שורש גחון
גירוי של שורש הגחון מעורר את corelease של גלוטמט ואצטילכולין מן בטוחות motoneuron על גבי תאי רנשו 10. Feed-קדימה עיכוב בתיווך גאבא גליצין גם מגויס 10. איור 4B מציג תגובות הגירוי היחיד של שורש הגחון. התא נרשם מצב מתח- clamp עם פתרון מבוסס צזיום, ומתוחזק במתח של -45 mV. QX-314 בפתרון התאי מנע התא מפני ירי GABA ותגובות גליצין נחסמו על ידי gabazine מיקרומטר 3 ו -1 מיקרומטר סטריכנין, בהתאמה. הזרם הסינפטי פנימה באיור 4B הוא סכום של glutamatergic וזרמים ניקוטינית.
NT "FO: keep-together.within-page =" 1 ">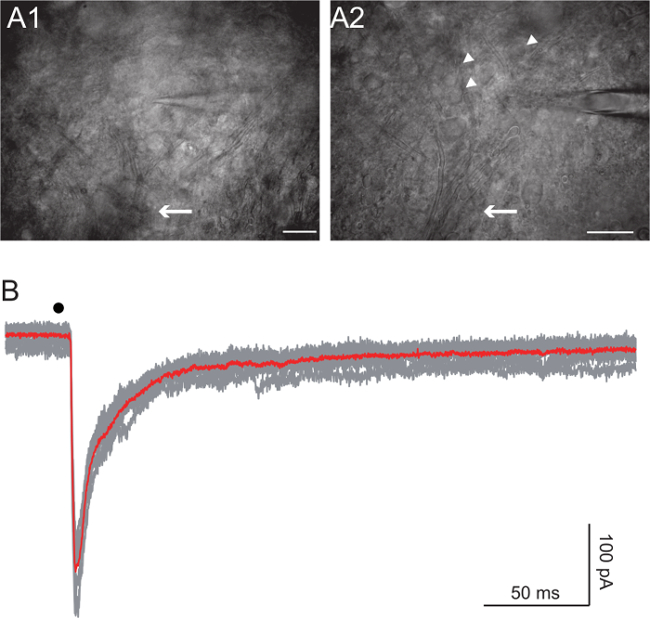
גירוי תא איור 4. Renshaw משורש הגחון
ת: תמונות של ברכת תא Renshaw רכשו באמצעות קבל אלכסוני באותה הפרוסה נלקחה ב שתי בהגדלה שונה (20X ו 40X מטרות). הערה האקסונים motoneuron מיזוג לתוך שורש הגחון (חץ). תאים המשוערים Renshaw מסומנים עם ראשי חץ. ברי סולם: 100 מיקרומטר A1, 50 מיקרומטר A2 B:. קלטות מהדק מתח של תא Renshaw בעקבות גירוי של (נקודה השחורה) שורש הגחון. העקב האדום הוא הממוצע של האפורים. מתח חזק נקבע ל -45 mV. QX-314 בפתרון תוך התאי מנע התא מפני ירי GABA ותגובות גליצין נחסמו על ידי gabazine מיקרומטר 3 ו -1 מיקרומטר סטריכנין, בהתאמה. נקודה שחורה מציינת עיתוי גירוי.com / קבצים / ftp_upload / 54,525 / 54525fig4large.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
חיתוך אלכסוני של חוט השדרה הוא חשוב שכן הוא מאפשר גירוי חד-צדדי של ברכות motoneuron ותאי Renshaw בכל מגזר בחוליות יחיד באופן אמין, מקיף וספציפי. יתר על כן, היא מאפשרת זיהוי מהיר, אלגנטי ולא מעורפל של motoneurons מוקלט. לאחר מכן, אנו נדגיש את היתרונות של טכניקה זו לעומת שיטות כנות פרוסה אחרות, ולאחר מכן אנו נדגיש את החסרונות הנפוצים ביותר כדי להימנע בעת ביצוע הליך זה.
רוב המחקרים באמצעות פרוסות רוחביות לבסס הזדהותם על תכונות חשמליות מהותיות 3,14,15,29. עם זאת, אלה להשתנות במידה רבה בין בריכות motoneuron וכן בין תת motoneuron בתוך הבריכה נתון (אלפא, בטא וגמא-motoneurons 30). לכן, מחקרים באמצעות פרמטרים גודל צפויים לכלול-motoneurons גמא קטן. מצד שני, קופר שרינגטון דescribed בשנת 1940 קבוצה של תאי עצב גדולים בתביעה האפורה לרוחב ventro של חוט השדרה המותני של קופים וחתולים אשר חצה עולה אקסונים 31,32. בנוסף להיותו קרוב somas motoneuron, הם ציינו שהם הופיעו נבדל היסטולוגית מ motoneurons. מאמר שפורסם לאחרונה אישרו את קיומה של תאים כאלה העכבר 33. בשל גודלו הגדול של תאים אלה ומיקומן שיוכלו נכלל בטעות במחקרים לשעבר. קריטריון זיהוי שלנו אינו כולל תאי גבול שדרה משוערים, מאז האקסון שלהם אינו צופה בשורש הגחון, ובמקביל לאפשר זיהוי אמין של כל motoneurons ללא קשר לגודל שלהם. יתר על כן, ניתוח המאפיינים החשמליים המהותיים, (למשל, התנגדות קלט), הוא יותר זמן רב יותר מאשר ההתבוננות הפשוטה של פוטנציאל פעולת antidromic.
בנוסף לשימוש תכונות חשמליות מהותיות, כמה studies באמצעות פרוסות רוחבי, לאשר הזדהותם ידי ביצוע ניתוח פוסט הוק של סמן מולקולארי motoneurons (כגון איילט -1 / 2 16) או על ידי ביטוי חזותי את המורפולוגיה באמצעות biocytin labelings 14,17. הזדהויות כאלה הן אך מייגעות אינם מספקים זיהוי ישיר. הם כן מועלים לעתים נדירות באופן שיטתי.
מספר מחקרים ניסו לעשות שימוש קווי עכבר להביע בסמן פלורסנטי גנטית בקידוד motoneuron (קו עכבר Hb9-GFP 18, צ'אט-EGFP עכברים טרנסגניים המבטאים eGFP בתאים כולינרגית כולל motoneurons 19, או G85R SOD1-YFP עכברים טרנסגניים, אשר בתוקף להביע את החלבון היתוך YFP ב motoneurons 17). עם זאת, משום ביטוי הסמן הגנטי בדרך כלל מותנה בזמן ומאחר הפרוסות נלקחים בדרך כלל מעוברת או קטינים, הביטוי של הסמן לא יכול להיות נאות בגיל שנתי הTudy מתבצע. מחקרים אחרים השתמשו הזרקת סוכן מדרדרת לדמיין ברכת motoneuron 34. אנחנו גם בצענו זריקות בטאו רעלן הכולרה לתוך soleus או האד (התבוננות אישית). טכניקות תיוג כזה הן בעלי ערך רב לתייג ברכת motoneuron מסוימת אך דורשות ניתוח מייגע כמה ימים לפני הניסוי. יתר על כן, בגיל הצעיר שבו הניסויים הפרוסים נעשים, מקשה משמעותית למקד את השרירים במיוחד. לבסוף, קיים חשש ממשי perturbing motoneuron ידי הזרקת סוכן אקסוגניים.
בתנאים אופטימליים הצלחנו להשיג פוטנציאל פעולה antidromic כמעט כל motoneurons המוקלט. זווית 35 ° בשימוש הוא קריטית להשגת שורשי גחון של אורך מספיק. לסיכום, בהכנת הפרוסה האלכסונית מציעה דרך מהירה ואמינה לזהות כל motoneuron, אשר עדיף על טכניקות זיהוי אחרות.
כאמור במבוא, רק שני מחקרים דיווחו גירוי מוצלח של שורשי הגחון פרוסים רוחבי. המחקר הראשון רשם נוירונים צוואר רחם בחולדה והחיש את החומר הלבן שבו בדל שורש הגחון עולה 4. הם בהצלחה מושרה פוטנציאל פעולת antidromic ב 85% של הנוירונים המוקלטים. אנו מאמינים שיעור ההצלחה הגבוה שלהם הסתמך על העובדה כי ברמת צוואר הרחם, האקסונים somas של motoneurons נמצאים על אותו המישור. זהו לא המקרה פרוס זנב יותר. אפילו ברמת צוואר הרחם, הפרוסות הרוחביות שלהם רק שמר ספחים של שורשי הגחון, אשר הם פחות אמינים כדי לעורר. המחקר השני מגורה במגזר dorso-המותני עובר אפרוח 5. עם זאת, הם השתמשו הקלטת צבע רגישה מתח, אשר חסרה את הרזולוציה המרחבית כדי לציין את ההצלחה של גרימת פוטנציאל פעולת antidromic ברמת התא הבודדה.
preparat הפרוסה שלנויון גם מציע דרך מעולה כדי לעורר תאי Renshaw כאמורים אחרון בעיתון 28. שימוש פרוסות האלכסוניות, הם הצליחו להקליט תגובות monosynaptic תאי רנשו ב -46% מהמקרים, שהיה שיפור גדול משיעור ההצלחה 10% נתקלו באמצעות פרוסות רוחביות 35. למרות שאנחנו לא יכולים למצוא השוואה דומה עבור הגירוי של ברכות motoneuron, תצפית זו בתא Renshaw מובילה אותנו להאמין כי motoneurons גם לשמור יותר קישוריות.
חיתוך אלכסוני של חוט השדרה הוא טכניקה מאוד תובענית שדורשת להתאמן הרבה לפני קבלת הכנה מהימנה שממנה אפשר להקליט. שימוש מאוד פינצטה בסדר וחד מיקרו מספריים חיוני. השעה בילתה לנתח יכולה להיות ארוכה למדי (עד שעת 1) כל עוד ההליך כולו מתנהל במדיום לנתיחה מקורר-מבעבע carbogen. בעוד כמה מחברים לא הכירו שום תועלת של perfusio intracardiacn בהכנת פרוסות 36, החלטנו לשמור על שלב זה של ההליך. קשה למדוד את התועלת אובייקטיבית של זלוף intracardiac על איכות ההקלטות, במיוחד כי זה משתנה עם גיל.
הגורם הקריטי ביותר הוא גיל העכבר. הקלטנו בהצלחה מעכברים בין P2 ו P11 באמצעות פרוטוקול לעיל. מעבר לגיל זה, את המיאלין חוט השדרה הופך צפוף מדי והתא הגדול (את motoneurons) למות לפני החיתוך, ככל הנראה בשל מחסור בחמצן. לאחר בחלון זה, מצאנו אותו יותר ויותר קשה להשיג פרוסות בריאות. לאחרונה, טכניקות חדשות דווחו להשיג פרוסות בריאות בחי מבוגרים 17,36. הם השתמשו תוספים מיותרים עד בינוני לנתח והקלטה שלהם כגון מקורות משלימים של אנרגיה (אתיל-פירובט), + Na נמוך Cl - ריכוזי למנוע oncosis של תאים 37,38 ו פוליאתילן גליקול להגביל את EFFects של transections הקרום הנרחב המתרחשים במהלך חיתוך. בעזרת שיפורים אלה, הם הצליחו להקליט עד 6 חיות בן חודש.
בעתיד זה יהיה מעניין לנסות הכנות פרוסות אלכסוניות בבעלי חיים בוגרים כדי לשלב את היתרונות של שתי השיטות. שילוב שני פרוטוקולים צריך להוכיח קל יחסית ויספק כלי אמין כדי לאשר את זהות motoneuron וללמוד האוכלוסייה הממוקדת בביטחונות האקסון של motoneurons בעכברים בוגרים. בנוסף, אפשר לנסות להשיג פרוסות אלכסוניות בתוך העכבר עובר. ראוי לציון, ההכנה שלנו גם שומרת על השורשים מגבים, אשר יכול להיות מגורה ללמוד את monosynaptic ההפעלה לי עצבוב אל motoneurons, כמו גם ההפעלה של אוכלוסיות נוירונים בחוט הגבה שדרה. לסיכום, גירויי שורש גחון מציעים כולים אמינים כדי לאשר את זהות motoneuron וללמוד האוכלוסייה הממוקדת בביטחונות האקסון motoneuron.
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים מודים מרין מנואל ואוליביה גולדמן-Szwajkajzer על עזרתם לוקח את התצלומים. המחברים מודים גם ארג'ון Masukar וטוביאס בוק להגהה את כתב היד. תומך פיננסי נמסרו על ידי Nationale Agence לשפוך la משוכלל ונדיר (HYPER-MND, ANR-2010-BLAN-1429-1401), ה- NIH-NINDS (R01NS077863), קרן תיירי לטראן (פרויקט OHEX), האגודה הצרפתית מיופתיה ( מספר מענק 16026) ומחיר היעד ALS הם הודו בהכרת תודה. פליקס לירוי היה הנמען של "דוקטור Contrat" מן אקול נורמל סופרייר, Cachan.
Materials
| Name | Company | Catalog Number | Comments |
| Na-kynurenate | ABCAM | ab120256 | dissolves better then other brands |
| KCl | Sigma | P3911 | |
| NaH2PO4 | Sigma | P5655 | |
| sucrose | Sigma | S9378 | |
| NaHCO3 | Sigma | S6014 | |
| CaCl2 | G Biosciences | R040 | |
| MgCl2 | Quality Biological | 351-033-721 | |
| glucose | Sigma | G5767 | |
| ascorbic acid | Sigma | A5960 | |
| Na-pyruvate | Sigma | P2250 | |
| K-gluconate | Sigma | P1847 | |
| EGTA | Sigma | E3889 | |
| HEPES | Sigma | H4034 | |
| NaCl | Sigma | S9888 | |
| Agar | Sigma | A9799 | |
| QX-314 | Alomone | Q150 | |
| Mg-ATP | Sigma | A9187 | |
| CsOH | Sigma | 232041 | |
| Na-GTP | Sigma | 51120 | |
| gluconic acid | Sigma | G1951 | |
| Cesium hydroxide solution | Sigma | 232041 | |
| KOH | Sigma | P5958 | |
| Vannas Spring Scissors - 2.5mm | FST | 15000-08 | only use for cutting the dura, might get damaged if cutting bones |
| Stimulator | A-M Systems | Isolated Pulse Stimulator Model 2100 | |
| Vibratome | Campden | Vibrating Microtome 7000 - Model 7000smz-2 |
References
- Brooks, C. M., Downman, C. B., Eccles, J. C. After-potentials and excitability of spinal motoneurones following antidromic activation. J Neurophysiol. 13 (1), 9-38 (1950).
- Bories, C., Amendola, J., Lamotte d'Incamps, B., Durand, J. Early electrophysiological abnormalities in lumbar motoneurons in a transgenic mouse model of amyotrophic lateral sclerosis. Eur J Neurosci. 25 (2), 451-459 (2007).
- Takahashi, T. Membrane currents in visually identified motoneurones of neonatal rat spinal cord. J Physiol. 423, 27-46 (1990).
- Hori, N., Tan, Y., Strominger, N. L., Carpenter, D. O. Intracellular activity of rat spinal cord motoneurons in slices. J Neurosci Methods. 112 (2), 185-191 (2001).
- Arai, Y., Mentis, G. Z., Wu, J. Y., O'Donovan, M. J. Ventrolateral origin of each cycle of rhythmic activity generated by the spinal cord of the chick embryo. PLoS One. 2 (5), e417 (2007).
- Cullheim, S., Lipsenthal, L., Burke, R. E. Direct monosynaptic contacts between type-identified alpha-motoneurons in the cat. Brain Res. 308 (1), 196-199 (1984).
- Cullheim, S., Kellerth, J. O., Conradi, S. Evidence for direct synaptic interconnections between cat spinal alpha-motoneurons via the recurrent axon collaterals: a morphological study using intracellular injection of horseradish peroxidase. Brain Res. 132 (1), 1-10 (1977).
- Gogan, P., Gueritaud, J. P., Horcholle-Bossavit, G., Tyc-Dumont, S. Direct excitatory interactions between spinal motoneurones of the cat. J Physiol. 272 (3), 755-767 (1977).
- Ichinose, T., Miyata, Y. Recurrent excitation of motoneurons in the isolated spinal cord of newborn rats detected by whole-cell recording. Neurosci Res. 31 (3), 179-187 (1998).
- Lamotte d'Incamps, B., Ascher, P. Four excitatory postsynaptic ionotropic receptors coactivated at the motoneuron-Renshaw cell synapse. J Neurosci. 28 (52), 14121-14131 (2008).
- Renshaw, B. Central effects of centripetal impulses in axons of spinal ventral roots. J Neurophysiol. 9, 191-204 (1946).
- Renshaw, B. Interaction of nerve impulses in the gray matter as a mechanism in central inhibition. Fed Proc. 5 (1 Pt 2), 86 (1946).
- Renshaw, B. Observations on interaction of nerve impulses in the gray matter and on the nature of central inhibition). Am J Physiol. 146, 443-448 (1946).
- Pambo-Pambo, A., Durand, J., Gueritaud, J. P. Early excitability changes in lumbar motoneurons of transgenic SOD1G85R and SOD1G(93A-Low) mice. J Neurophysiol. 102 (6), 3627-3642 (2009).
- Quinlan, K. A., Schuster, J. E., Fu, R., Siddique, T., Heckman, C. J. Altered postnatal maturation of electrical properties in spinal motoneurons in a mouse model of amyotrophic lateral sclerosis. J Physiol. 589 (Pt 9), 2245-2260 (2011).
- Martin, E., Cazenave, W., Cattaert, D., Branchereau, P. Embryonic alteration of motoneuronal morphology induces hyperexcitability in the mouse model of amyotrophic lateral sclerosis. Neurobiol Dis. 54, 116-126 (2013).
- Hadzipasic, M., et al. Selective degeneration of a physiological subtype of spinal motor neuron in mice with SOD1-linked ALS. Proc Natl Acad Sci U S A. 111 (47), 16883-16888 (2014).
- Wichterle, H., Lieberam, I., Porter, J. A., Jessell, T. M. Directed differentiation of embryonic stem cells into motor neurons. Cell. 110 (3), 385-397 (2002).
- Tallini, Y. N., et al. BAC transgenic mice express enhanced green fluorescent protein in central and peripheral cholinergic neurons. Physiol Genomics. 27 (3), 391-397 (2006).
- Manuel, M., et al. Fast kinetics, high-frequency oscillations, and subprimary firing range in adult mouse spinal motoneurons. J Neurosci. 29 (36), 11246-11256 (2009).
- Obeidat, A. Z., Nardelli, P., Powers, R. K., Cope, T. C. Modulation of motoneuron firing by recurrent inhibition in the adult rat in vivo. J Neurophysiol. 112 (9), 2302-2315 (2014).
- Leroy, F., Lamotte d'Incamps, B., Imhoff-Manuel, R. D., Zytnicki, D. Early intrinsic hyperexcitability does not contribute to motoneuron degeneration in amyotrophic lateral sclerosis. Elife. 3, (2014).
- Leroy, F., Lamotte d'Incamps, B., Zytnicki, D. Potassium currents dynamically set the recruitment and firing properties of F-type motoneurons in neonatal mice. J Neurophysiol. 114 (3), 1963-1973 (2015).
- Lamotte d'Incamps, B., Ascher, P. Subunit composition and kinetics of the Renshaw cell heteromeric nicotinic receptors. Biochem Pharmacol. 86 (8), 1114-1121 (2013).
- Lamotte d'Incamps, B., Krejci, E., Ascher, P. Mechanisms shaping the slow nicotinic synaptic current at the motoneuron-renshaw cell synapse. J Neurosci. 32 (24), 8413-8423 (2012).
- Dugue, G. P., Dumoulin, A., Triller, A., Dieudonne, S. Target-dependent use of co-released inhibitory transmitters at central synapses. J Neurosci. 25 (28), 6490-6498 (2005).
- Mentis, G. Z., Siembab, V. C., Zerda, R., O'Donovan, M. J., Alvarez, F. J. Primary afferent synapses on developing and adult Renshaw cells. J Neurosci. 26 (51), 13297-13310 (2006).
- Perry, S., et al. Firing properties of Renshaw cells defined by Chrna2 are modulated by hyperpolarizing and small conductance ion currents Ih and ISK. Eur J Neurosci. 41 (7), 889-900 (2015).
- Thurbon, D., Luscher, H. R., Hofstetter, T., Redman, S. J. Passive electrical properties of ventral horn neurons in rat spinal cord slices. J Neurophysiol. 79 (5), 2485-2502 (1998).
- Zengel, J. E., Reid, S. A., Sypert, G. W., Munson, J. B. Membrane electrical properties and prediction of motor-unit type of medial gastrocnemius motoneurons in the cat. J Neurophysiol. 53 (5), 1323-1344 (1985).
- Cooper, S., Sherington, C. S. Gower's tract and spinal border cells. Brain. 63, 123-124 (1940).
- Morin, F., Schwartz, H. G., O'Leary, J. L. Experimental study of the spinothalamic and related tracts. Acta Psychiatr Neurol Scand. 26 (3-4), 371-396 (1951).
- Sengul, G., Fu, Y., Yu, Y., Paxinos, G. Spinal cord projections to the cerebellum in the mouse. Brain Struct Funct. 220 (5), 2997-3009 (2015).
- Russier, M., Carlier, E., Ankri, N., Fronzaroli, L., Debanne, D. A-, T-, and H-type currents shape intrinsic firing of developing rat abducens motoneurons. J Physiol. 549 (Pt 1), 21-36 (2003).
- Dourado, M., Sargent, P. B. Properties of nicotinic receptors underlying Renshaw cell excitation by alpha-motor neurons in neonatal rat spinal cord). J Neurophysiol. 87 (6), 3117-3125 (2002).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. J Neurophysiol. 107 (2), 728-741 (2012).
- Rothman, S. M. The neurotoxicity of excitatory amino acids is produced by passive chloride influx. J Neurosci. 5 (6), 1483-1489 (1985).
- Olney, J. W., Price, M. T., Samson, L., Labruyere, J. The role of specific ions in glutamate neurotoxicity. Neurosci Lett. 65 (1), 65-71 (1986).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved