Method Article
Die Herstellung von Oblique Spinal Cord Slices für Ventralwurzel Stimulation
In diesem Artikel
Zusammenfassung
Wir zeigen, wie schräge Scheiben des Rückenmarks in jungen Mäusen vorzubereiten. Diese Herstellung ermöglicht die Stimulation der ventralen Wurzeln.
Zusammenfassung
Elektrophysiologische Aufnahmen von Rückenmark Scheiben haben sich als wertvolle Technik zu sein, ein breites Spektrum von Fragen zu untersuchen, die von Mobilnetzwerkeigenschaften. Wir zeigen, wie rentabel schräge Scheiben des Rückenmarks von jungen Mäusen herzustellen (P2 - P11). Bei dieser Herstellung behalten die Motoneuronen ihre Axone von den ventralen Wurzel des Rückenmarks kommen aus. Die Stimulation dieser Axone entlockt zurück ausbreitenden Aktionspotentiale der Motoneuron somas und spannend die Motoneuron Kollateralen im Rückenmark eindringen. Aufnahme von antidromic Aktionspotentiale ist eine sofortige, endgültige und elegante Art und Weise Motoneuron Identität zu charakterisieren, die andere Methoden Identifizierung übertrifft. Darüber hinaus ist die Motoneuron Kollateralen stimulierenden eine einfache und sichere Weg, um die Sicherheit Ziele der Motoneuronen im Rückenmark, wie andere Motoneuronen oder R zu erregenenshaw Zellen. In diesem Protokoll stellen wir antidrome Aufnahmen von der Motoneuron somas sowie Renshaw Zellanregung aus ventral root Stimulation.
Einleitung
Historisch gesehen , in vivo an großen Tieren wie Katzen oder Ratten Motoneuron Aufnahmen scharf Elektrode 1 wurden durchgeführt , oder auf einem isolierten ganzen Rückenmark in Mäuse 2. Die Entstehung der Patch-Clamp-Aufnahmetechnik in den 1980er Jahren für den direkten Zugriff auf das Motoneuron genannt somas nach Bedarf Abdichtung unter Sichtführung erreicht werden. Somit wurde das Rückenmark slice Zubereitung leicht seit den frühen 1990ern 3 erreicht. Jedoch oft früh slice Zubereitung nicht für die Stimulation der ventralen Wurzeln ermöglichen. Nach bestem Wissen und Gewissen, haben nur zwei Studien erfolgreich Stimulation der ventralen Wurzeln in Querschnitten berichtet, und keiner wurde von den Mäusen 4,5 erhalten.
In diesem Artikel stellen wir eine Technik tragfähige Rückenmarksscheiben neugeborenen Mäusen zu erreichen (P2 - P11) in dem die Motoneuron-Pool seiner ventralen Wurzel abzuweichen Axone beibehält. auslassenral Wurzel Stimulation löst antidromic Aktionspotential aus dem gleichen Ventralwurzel zurück in die Somen des Motoneuron-Pool zu verlassen. Es regt auch die Motoneuron Sicherheiten Ziele, andere Motoneuronen 6-10 und die Renshaw - Zellen 11-13. Da nur Motoneurone ihre Axone die ventralen Wurzeln nach unten senden, verwenden wir die Aufnahme von antidromic Aktionspotentiale als eine einfache und sichere Weg um physiologicaly Motoneuronen 10 identifizieren.
Neben der Verwendung von potenziell nicht-inclusive oder irreführende elektrophysiologischen und morphologischen Kriterien , um die Motoneuron Identität, die jüngsten Studien über Rückenmark Motoneurone zu bestätigen stützen sich ebenfalls auf mühsame und zeitraubende Post - hoc - Anfärbungen 16. Eine solche Identifizierung wird in der Regel nur durchgeführt mit einer Probe der aufgezeichneten Zellen. Andere Identifikationsstrategien setzen auf Mauslinien, in denen die Motoneurone endogene Fluoreszenz exprimieren 17-19. Doch bereits in jungen Jahren mit genetisch kodierten Markierungen kann schwierig sein, wenn Markerexpression noch variabel ist oder wenn die Studie erfordert bereits eine transgene Mauslinie verwendet wird. Alternativ kann antidrome Aktionspotentialaufzeichnungen routinemäßig auf allen Mäusen vom Beginn der Zellaufnahme erfolgen. Experimentatoren arbeiten an intakten Rückenmark Vorbereitungen bei der Katze, Ratte und Maus haben zuverlässig solche Identifikationstechniken seit den 1950er Jahren 1,2,20,21 verwendet. Bei optimalen Bedingungen konnten wir antidromic Aktionspotentiale aus praktisch alle aufgenommenen Motoneurone zu entlocken.
Darüber hinaus können Ventralwurzel Stimulation verwendet werden , um zuverlässig andere Motoneurone 22,23 oder ihre Ziele begeistern. die Renshaw Zellen 10,24,25. Wir präsentieren hier Anwendungen der Ventralwurzel Stimulation in Form von antidromic Aktionspotential Aufnahmen von Motoneuron somas sowie Anregung von Renshaw Zellen.
Protokoll
Die Experimente wurden in Übereinstimmung mit den europäischen Richtlinien (86/609 / CEE und 2010-63-UE) und Französisch Gesetzgebung durchgeführt und wurden von der Universität Paris Descartes Ethikkommission genehmigt.
1. Spinal Cord Scheibe Vorbereitung
- Bereiten Sie die folgenden Lösungen täglich oder einen Tag im Voraus. Wenn über Nacht, Blase mit 95% O 2 und 5% CO 2 gehalten und in fest verschlossenen Flaschen gekühlt halten.
- Bereiten Low Na + künstlicher Cerebrospinalflüssigkeit (ACSF): 3 mM KCl, 1 mM NaH 2 PO 4, 230 mM Sucrose, 26 mM NaHCO 3, 0,8 mM CaCl 2, 8 mM MgCl 2, 25 mM Glucose, 0,4 mM Ascorbinsäure, 1 mM Na-Kynurenat, 2 mM Na-Pyruvat. Blase mit 95% O 2 und 5% CO 2 (pH 7,4). Da Na-Kynurenat oft schwer zu lösen, stellen Sie sicher, das in der Tabelle aufgeführten Materialien zu kaufen.
- Bereiten K-Gluconat solution: 130 mM K-Gluconat, 15 mM KCl, 0,05 mM EGTA, 20 mM HEPES, 25 mM Glucose, 1 mM Na-Kynurenat, 2 mM Na-Pyruvat, eingestellt auf pH 7,4 mit KOH.
- Bereiten ACSF: 130 mM NaCl, 2,5 mM KCl, 2 mM CaCl 2, 1 mM MgCl 2, 1 mM NaH 2 PO 4, 26 mM NaHCO 3, 25 mM Glucose, 0,4 mM Ascorbinsäure, 2 mM Na-Pyruvat. Blase mit 95% O 2 und 5% CO 2 (pH 7,4).
- Vor dem Beginn der Dissektion, lösen sich 2% Agar in 80 ml der K-Gluconat-Lösung und halten bei 60 ° C warm.
- intrakardialer Perfusion
- Führen Sie diese Vorbereitung auf die weiblichen und männlichen Mäusen im Alter von P2 bis P11.
- Anästhesieren die Maus mit einer intraperitonealen Injektion von 0,1 ml 25 mM Natrium-Pentobarbital (50 mg / kg).
- Mit Nadeln oder Klebeband, immobilisieren die Maus auf dem Rücken auf einer großen Petrischale mit Silikon gefüllt. Verwenden Sie ein Sezieren microscope für den Rest der Präparation.
- Halten Sie die Spitze des Brustbeins, heben Sie die Brust und schneiden Sie die Membran mit einer feinen Schere. Dann öffnen Sie die Brust auf beiden Seiten, indem sie durch die Rippen schneiden das Herz aussetzen.
- Schneiden Sie den rechten Vorhof vor den linken Ventrikel mit einer 27G Nadel Punktierung.
- Perfuse mit eiskaltem niedrigen Na + ACSF. Nach 30 sec, sollte eine niedrige Na + ACSF aus dem Atrium fließen zu sehen. Geringe Mengen an Natrium verhindern, dass die Zellen, die aus Spick und Zelltod bei der Präparation zu reduzieren.
- Halten Sie die Nadel im Herzen unter dem Binokular halten, bis die Leber gelb wird, wenn das Blut abgelassen wird.
- Rückenmark Dissektion
- Enthaupten das Tier und legte es auf seinen Bauch.
- Entfernen Sie schnell , die Haut des Rückens (Abbildung 1A1). Machen Sie zwei Schnitte durch die Schultern und hinunter den Brustkorb (Abbildung 1A2). Dann schneiden Sie die Schnur als low wie möglich in der kaudalen Abschnitt, um die Wirbelsäule mit dem Beginn der Rippen aus dem unteren Teil des Tieres zu isolieren. Drehen Sie das Tier wieder und entfernen Sie die Eingeweide noch an den Rippen befestigt.
- Übertragung der Wirbelsäule zu einer anderen, kleineren Silizium gefüllte Petrischale und benutzen 4 insect pins es dorsalen Seite nach oben (Figur 1A) zu halten.
- Kontinuierlich perfundieren das Tier mit Carbogen blasigen ACSF (bei etwa 4 ° C) , während eine Laminektomie der dorsalen Seite durchgeführt wird , und Aussetzen des Rückenmarks von der rostralen Ende (1B). Dazu legen Sie die Spitze der feinen Schere zwischen dem Knochen und dem Rückenmark und schneiden den Knochen nach und nach aus dem rostralen Ende, um sicherzustellen, von der weißen Substanz zu bleiben weg. Alternate auf jeder Seite , während mit einer Pinzette die Band von Knochen bereits geschnitten (Abbildung 1B1) fern zu halten.
- Unter Verwendung der kleinsten Feder Schere und Pinzette, heben Sie die Dura und schneidenbeide Seiten auf, während Sie die lose Teil der Dura, um mit der Schere eine Beschädigung des Rückenmarks zu vermeiden. Schneiden Sie entlang der rostro-caudale Achse.
HINWEIS: Die Dura ist eine halb transparente kontinuierliche Membran; in diesem Alter ist die pia mater zu zerbrechlich und wird während der Präparation und Slicing (Abbildung 1B2) kommen auseinander. - Sobald die Dura ein stumpfes Glas oder Kunststoffspitze entfernt verwendet wird vorsichtig auf die Schnur auf der linken Seite des von der Halbschnitt Wirbelsäule gebildet Nut schieben, und schneiden Sie die ventralen und dorsalen Wurzeln auf der rechten Seite, von der rostralen Seite beginnen , am weitesten von wo aus sie die Schnur (wenige mm zumindest Abbildung 1B2) eingeben.
- Wiederholen Sie den Vorgang auf der linken Seite, gehen immer von rostral nach kaudal. Wenn linkshändig, von der linken Seite beginnen und dann auf die rechte Seite zu bewegen.
- Die Einbettung in Agar
- Schieben Sie die Kabel aus der Wirbelsäule. Verwenden Sie einen kleineren Insektenstift festzunagelndie Schnur mit der Rückenfläche nach oben und zart jedes Stück Membran noch daran (Abbildung 1C1) angebracht entfernen.
- Einmal gereinigt, schneiden beide Enden (Abbildung 1C2). Fügen Sie ein gebogener Insektenstift im vorderen Teil der Schnur der Schnur zu manipulieren und beachten Sie seine Ausrichtung (Pfeil in Abbildung 1C2). Dann übertragen das Rückenmark zu einer eiskalten K-Gluconatlösung.
HINWEIS: Diese Lösung ahmt die intrazelluläre Zusammensetzung des CSF und die Zellen vor dem Absterben des osmotischen Schock verhindern , sobald die Motoneuronen 26 geschnitten wird. - Sobald das Rückenmark innerhalb der intrazellulären Lösung ist, nehmen Sie den Becher mit dem Agar aus dem trockenen Bad und kühlen sie auf eine Mischung aus Eis und Wasser.
- Halten Sie Rühren, während die Temperatur zu messen. Wenn die Temperatur 38 ° C erreicht das Rückenmark tauchen, es durch das Insekt Stift halten und legen Sie sie nach unten rostralen Seite. Stellen Sie sicher, dass das Rückenmark ist als straight wie möglich weg von den Wänden, Schwanz- Teil leicht nach oben (Abbildung 1D1).
- Verlassen das Becherglas in das Gemisch aus Eis und Wasser das Agar zu ermöglichen, so schnell wie möglich zu verfestigen. Stellen Sie sicher , dass es an seinem Platz bleibt und dass das Kabel so gerade wie möglich (Abbildung 1D1) ist.
- Slicing
- Nach dem Erstarren schneiden den Agarblock das Rückenmark in der Weise , dass die Basis des Blocks in einem 35 ° Winkel mit dem Lendenteil des Cords (Pfeil in Figur 1D2) enthält. Die dorsale Oberfläche sollte entfernt werden , mit Blick auf von der Basis (Abbildung 1D2).
Hinweis: Dies ist ein kritischer Schritt in dem Verfahren zum Aufrechterhalten der Kontinuität der Motoneuron-Pools zu den ventralen Wurzeln, von dem sie zu verlassen. - Kleben Sie den Block in die Kammer des Vibratom mit Sekundenkleber. Tauchen sie in K-Gluconatlösung und fügen Sie slushed gefrorenen K-Gluconatlösung zu haltendas Bad (unter 2 ° C) gekühlt.
- Schneiden Sie 350 bis 400 & mgr; m dicke Scheiben der Lendengegend (erkennbar durch ihre Krümmung und mit größerem Durchmesser). In der richtigen Ausrichtung (siehe 1.4.1.), Verwenden Sie die Klinge von der dorsalen auf der ventralen Oberfläche zu schneiden und Scheiben kontinuierlich mehr rostral machen. Typischerweise gibt es 4-5 geeignete Scheiben mit ventral Wurzeln erstreckt 2 mm oder mehr. Verwenden Sie die folgenden Parameter: 10 ° Winkel, 70 Hz Schwingungsfrequenz und 10 mm / min Geschwindigkeit des Schneidens.
- Nach dem Erstarren schneiden den Agarblock das Rückenmark in der Weise , dass die Basis des Blocks in einem 35 ° Winkel mit dem Lendenteil des Cords (Pfeil in Figur 1D2) enthält. Die dorsale Oberfläche sollte entfernt werden , mit Blick auf von der Basis (Abbildung 1D2).
- Die Inkubation
- Übertragen Sie die Scheiben zu ACSF bei 34 ° C. Nach ca. 30 min, kühlen die Scheiben bis auf RT und die Aufnahme-Session beginnen.

Abbildung 1. Dissection
A1:. Die Entfernung der Haut des Rückens der dorsalen Säule zu belichten A2:Schneiden der Schultern und Rippen der dorsalen Säule frei B1:. Vertebrale Spalte auf die Silizium-gefüllte Petrischale gepinnt (dorsalen Seite nach oben, kaudal links) B2:. Gleiche mit dem Rückenmark ausgesetzt und seziert C1:. Rückenmark isoliert . (rostralen Seite links) C2: Rückenmark bereit eingebettet werden (Bauchseite nach oben, rostralen Seite links). Notieren Sie sich die kleineren Insektenstift an der rostralen Seite D1:.. Rückenmark im Agar - Becher (rostralen Seite dow, Bauchseite gegenüber dem Boden) D2: Cut Agar - Block mit dem eingebetteten Rückenmark. Notieren Sie sich die 35 ° Winkel der Rückenmark bildet mit der Basis des Blocks und der Lendenanschwellung (Pfeil). Maßstabsbalken 1 cm. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
2. Platzieren der Scheibe in die Kammer
HINWEIS: Ventral Wurzeln sind von unterschiedlicher Größe.
- Bereiten Sie eine Schachtel mit verschiedenen Pipetten mit Spitzendurchmessern von 40 bis 170 & mgr; m im Voraus reichen. Zur Vorbereitung Saugpipetten, bereiten viele Pipetten mit einer langen Verjüngung. Mit einem Diamantmesser, machen einen Schnitt an verschiedenen Positionen. Dann unter einem Binokular, brechen sie durch die Spitze mit einer Pinzette zu schlagen.
- Entfernen Sie die Kammer von der Aufnahme Mikroskop und legen Sie sie unter einem Binokular.
- Wählen einer Scheibe, die einen ventralen Wurzel von ausreichender Länge enthält (2 mm oder mehr) auf eine Nutsche Stimulationselektrode angebracht zu werden. Wählen Sie die richtige Ausrichtung der Scheibe mit den ventralen Wurzeln nach oben (2A) und schneiden Sie vorsichtig die Agar um die ventralen Wurzeln , während der Rest des Agar verlassen um die Scheibe (2B).
Hinweis: Da der Agar fester als die Scheibe ist, wird dies die Gewinde des Ankers Scheibe ermöglichen, sich auf dem Agar zu ruhen und nicht auf der Scheibe und damit die anchor wird das Gewebe nicht schädigen. Stellen Sie sicher , dass die Fäden des Ankers Scheibe oberhalb der Motoneuron - Pool (in rot in 2C gezeigt). - Montieren Sie die Kammer wieder auf das Mikroskop und kontinuierlich die Aufnahmekammer perfuse mit ACSF mit einer Rate von 1 bis 2 ml / min bei RT. Verwendung einer Glaspipette mit ACSF gefüllt und mit einer Spritze verbunden, saugen einen der ventralen Wurzel (Pfeil in Figur 2C). Um eine gute Stimulation des ventralen Wurzel zu erreichen, muss die Pipettenspitze um den ventralen Wurzel dicht sein. Einen Pol sollte in der Stimulationselektrode und die andere in dem Bad (oder mit der patch-Klemmelektrode reference).
- Erreichen patch-clamp Aufzeichnung der gewünschten Zelltyp und notieren Sie die Wirkung der ventralen Wurzel Stimulation als previsouly 10 beschrieben.
- Hier wird ein Verstärker für die Datenerfassung verwendet werden. Filter Ganzzellableitungen bei 3 kHz. Digitalisieren bei 10 kHz. Compensate Brückenwiderstand in current-Clamp-Modus.

Abbildung 2. Ventralwurzel Vorbereitung
A: Lendenwirbelscheibe Rückenmark eingebettet in Agar mit der ventralen Wurzel nach oben . B: lumbalen Rückenmark Scheibe mit den ventralen Wurzeln aus dem Agar befreit . C: lumbalen Rückenmark Scheibe mit einer Stimulationselektrode eng um den ventralen Wurzeln (Pfeil) platziert . Beachten Sie die Position der Renshaw - Zellen, die rote Fluoreszenz im CHRNA2-Cre Maus 28 mit der Maus Reporter gekreuzt R26 Tom 17. Maßstabsbalken 1 mm. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Ergebnisse
Bestätigung der Motoneuron Identität Mit antidromen Aktionspotentialen
Zell - Targeting
Motoneurone sind im ventralen Horn (sichtbar in rot in 2C) gefunden. Starten Sie aus dem Bündel von Axonen der ventralen Wurzel bildet, und gehen bis das Bündel streut voll und man beginnt, große Zellen zu sehen (lange soma Achse, über 20 & mgr; m). Erreichen whole-cell Aufnahme eines runden gesund aussehendes Zelle eine Elektrode Anfangswiderstand von 3 bis 4 M & OHgr verwenden. Die interne Lösung verwendet wurde, enthielt: 140 mM K-Gluconat, 6 mM KCl, 10 mM HEPES, 1 mM EGTA, 0,1 mM CaCl 2, 4 mM Mg-ATP, 0,3 mM Na 2 GTP. Stellen Sie den pH-Wert auf 7,3 mit KOH, und die Osmolarität auf 285-295 mOsm mit destilliertem Wasser zugesetzt.
Bestätigung der Motoneuron Identität
Sobald Ganzzellaufnahme erreicht wird, eine einzelne zweiphasige Stimulation des ventralen Wurzel gelten (1 - 50 V, 0,1 bis 0,3 ms) ein antidromic Aktionspotential in den aufgenommenen Zellen des ventralen Schnur zu entlocken Figuren 3A1 und 3A2 zeigen antidromic Aktion. Potentiale in Voltage-Clamp oder Strom-clamp, respectively. Wenn die Stimulationsintensität von 1 bis 5 V zu erhöhen (Abbildung 3A1) und von 10 bis 15 V (Abbildung 3A2) die antidromic Aktionspotential erscheint in einem Alles-oder-nichts - Mode mit einer Latenzzeit von 0,9 ms und 1,1 ms sind. Da nur Motoneurone ihre Axone durch die ventralen Wurzeln zu senden, ist die antidromic Aktionspotential ein Beweis für die Zellidentität.
In einer Minderheit der Motoneurone (ca. 10%), scheiterte Ventralwurzel Stimulationantidromic Aktionspotential auslösen , sondern löste orthodrome Aktionspotentiale. Die Figuren 3B1 und 3B2 zeigen orthodrome Aktionspotentiale in Voltage-Clamp oder Stromklemme verbunden. Wenn die Stimulation von 20 bis 30 V (Abbildung 3B1) zu erhöhen und von 25 bis 40 V (Abbildung 3B2), erscheint ein Aktionspotential, eine frühere exzitatorischen postsynaptischen Strom folgende (EPSC) oder exzitatorischen postsynaptischen Potentials (EPSP). Die Latenzen der Aktionspotentiale sind länger (5,1 msec und 5,3 msec, respectively). In diesen beiden Zellen löste die Ventralwurzel Stimulieren eines Feed-Forward-Anregung (Motoneurone Axonkollateralen sich senden und zu anderen Motoneurone), die stark genug war, ein orthodrome Aktionspotential zu entlocken. In derartigen Zellen eine antidrome Aktionspotential auslösen das Versagen (gekennzeichnet durch seine Alles-oder-nichts-Mode und einer Latenz von weniger als 5 msec) sagt uns ar schließen, dass diese Zellen nicht zulassen, e Motoneurone. Man beachte, daß die Intensität erforderlich Stimulation hervorzurufen Vorwärtserregungs ist höher als die benötigte eine antidrome Aktionspotential hervorzurufen. Alle hier gezeigten Stimulationen sind 0,1 msec aber manchmal mehr Stimulation (bis zu 0,3 ms) erforderlich sein kann, eine antidrome Aktionspotential hervorzurufen.
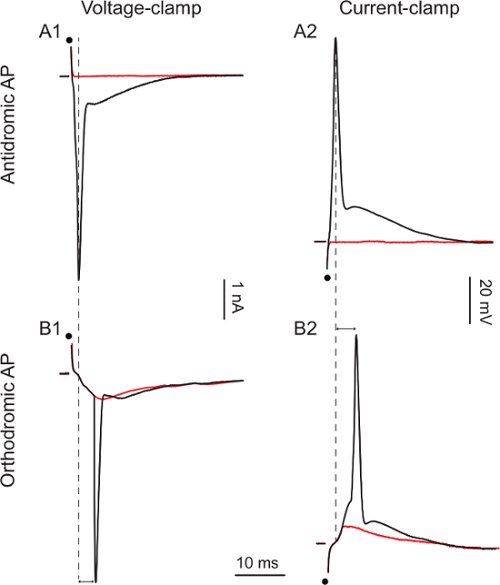
Abbildung 3. Motoneuron Responses to Ventralwurzel Stimulation
A1: 1 V (rote Kurve) und 5 V (schwarze Kurve) Stimulationen A2:.. 10 V (rote Kurve) und 15 V (schwarze Kurve) Stimulationen B1: 20 V (rote Kurve) und 30 V (schwarze Kurve) Stimulationen . B2: 25 V (rote Kurve) und 40 V (schwarze Kurve) Stimulationen. Schwarze Punkte zeigen Reiz Timing. Doppelpfeilspitzen betonen den Unterschied in der Latenzen zwischen Ortho- und antidromic Spikes.m / files / ftp_upload / 54525 / 54525fig3large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Renshaw Zellstimulation
Zell - Targeting
Renshaw Zellen im Vorderhorn 27,28 gefunden. Visualisieren Sie die Axon-Bundles mit Differentialinterferenzkontrast (DIC) Bildgebung ein 20X und ein 63X Ziele verwenden. Starten Sie aus dem Bündel von Axonen der ventralen Wurzel bildet , und gehen bis die Axone zu zerstreuen beginnen , aber sind noch erkennbar (Abbildung 4A, Pfeile). Ziel ist für die Zellen mittlerer Größe (etwa 10 bis 15 & mgr; m im Durchmesser, 4A, Pfeilspitzen). Erzielen Sie whole-cell Aufnahme eines runden gesund aussehende Zelle eine Elektrode aus anfänglichen Widerstand von 5 bis 7 MOhm mit. Je nach Experiment verwendeten wir either Cs + -basierten oder K + -basierte interne Lösungen 10. Die Cs-basierte Lösung verhindert große Kaliumströme, die um -45 mV sichtbar waren. In einigen Experimenten haben wir auch 5 mM QX-314 die Natriumkanäle, die für Spiking in dem aufgezeichneten Zelle zu blockieren. Die Cs + -basierte Lösung enthält: 125 mM Cs-Gluconat, 5 mM QX-314 Cl, 10 mM HEPES, 10 mM EGTA, 1 mM CaCl 2, 4 mM Mg-ATP und 0,4 mM Na-GTP, wobei der pH eingestellt auf 7,3 mit CsOH. Die K + -basierte Lösung sollte sowohl in spannungs- und stromKlemme, die Renshaw Zellantworten auf ventralen Wurzel Stimulation in Bedingungen annähert , so viel wie möglich die physiologischen diejenigen zu analysieren verwendet werden. Diese Lösung enthält: 125 mM K-Gluconat, 10 mM HEPES, 1 mM EGTA, 0,1 mM CaCl 2, 4 mM Mg-ATP, 0,4 mM Na-GTP, wobei der pH auf 7,3 mit KOH eingestellt. Die Reizstärke zwischen 10 und 100 V und die Dauer variiert, variiert zwischen 50 und 300 & mgr; s. Bipo lar Pulse wurden in allen Fällen verwendet.
Antwort der Renshaw - Zellen zu Ventralwurzel Stimulation
Die Stimulation des ventralen Wurzel löst die corelease von Glutamat und Acetylcholin aus Motoneuron Kollateralen auf die Renshaw Zellen 10. Feed-Forward - Hemmung vermittelt durch GABA und Glycin rekrutiert auch 10. 4B zeigt Antworten auf die einzelnen Stimulation des ventralen Wurzel. Die Zelle wurde in einen Voltage-Clamp-Modus mit dem Cäsium-basierten Lösung aufgezeichnet, und bei einer Spannung von -45 mV gehalten. QX-314 in der intrazellulären Lösung verhindert die Zelle von Brennen und GABA und Glycin-Antworten wurden von 3 uM Gabazin blockiert und 1 & mgr; M Strychnin, respectively. Der nach innen gerichtete synaptischen Stroms in 4B ist die Summe der glutamatergen und Nikotin Ströme.
nt "fo: keep-together.within-page =" 1 ">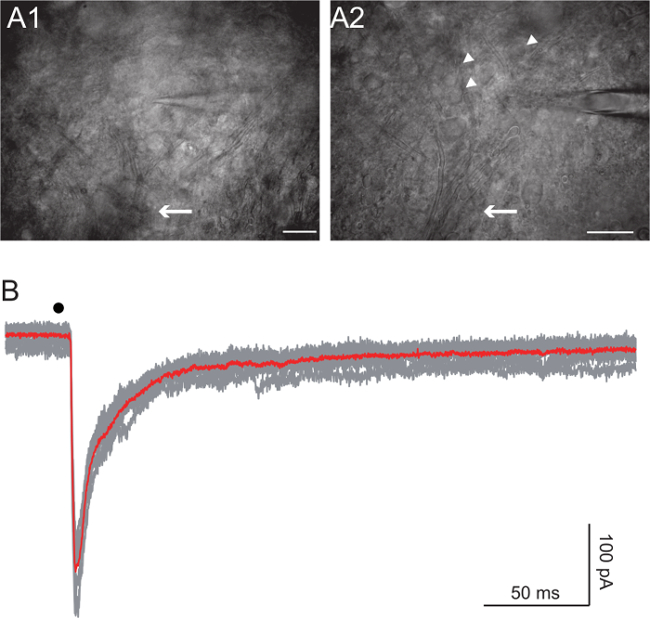
Abbildung 4. Renshaw - Zell - Stimulation aus der Ventralwurzel
A: Bilder der Renshaw - Zellpools erworben einen schrägen Kondensator in derselben Schicht genommen bei zwei verschiedenen Vergrößerungen (20x und 40x - Objektive) verwendet wird . Beachten Sie die Motoneuron Axone in die Ventralwurzel verschmelzenden (Pfeil). Vermeintliche Renshaw-Zellen werden mit Pfeilen angezeigt. Maßstabsbalken: 100 & mgr; m in A1, 50 & mgr; m in A2 . B: Voltage-Clamp - Aufnahmen einer Renshaw Zelle nach Stimulation des ventralen Wurzel (schwarzer Punkt). Die rote Kurve ist der Durchschnitt der grauen. Haltespannung wurde auf -45 mV eingestellt. QX-314 in der intrazellulären Lösung verhindert die Zelle von Brennen und GABA und Glycin-Antworten wurden von 3 uM Gabazin blockiert und 1 & mgr; M Strychnin sind. Schwarzer Punkt zeigt an Reiz Timing.com / files / ftp_upload / 54525 / 54525fig4large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
Diskussion
Oblique slicing des Rückenmarks ist wichtig, da es für die einseitige Stimulation der Motoneuron-Pools und Renshaw Zellen in einer einzigen Wirbelsegments in einer zuverlässigen, umfassende und spezifische Weise ermöglicht. Darüber hinaus ermöglicht es eine schnelle, elegante und eindeutige Identifikation von aufgezeichnetem Motoneurone. Als nächstes werden wir die Vorteile dieser Technik im Vergleich zu anderen Scheibe Zubereitungsmethoden zu markieren, und dann werden wir die häufigsten Fallen stressen zu vermeiden, während der Durchführung dieses Verfahrens.
Die meisten Studien Querschnitten unter Verwendung stützen ihre Identifizierung auf intrinsischen elektrischen Eigenschaften 3,14,15,29. Doch diese variieren stark zwischen den Motoneuron - Pools sowie zwischen Motoneuron - Subtypen innerhalb eines bestimmten Pool (Alpha-, Beta- und Gamma-Motoneuronen 30). Daher sind unter Verwendung von Studien Größenparameter wahrscheinlich kleiner Gamma-Motoneuronen auszuschließen. Auf der anderen Seite, Cooper und Sherrington described 1940 eine Gruppe von großen Nervenzellen im ventrolateralen grauen Substanz des lumbalen Rückenmark von Affen und Katzen , die 31,32 Axone aufsteigend überschritten hatte. Zusätzlich zu den Motoneuron somas nahe zu sein, stellten sie fest, dass sie von Motoneuronen histologisch nicht zu unterscheiden erschienen. Ein kürzlich erschienener Artikel bestätigte die Existenz solcher Zellen in der Maus 33. Aufgrund der großen Grße dieser Zellen und ihre Lage, konnten sie wurden in früheren Studien irrtümlicherweise enthalten. Unser Identifizierung Kriterium schließt mutmaßliche spinal Grenzzellen, da ihre Axone in der ventralen Wurzel nicht projizieren, während gleichzeitig eine zuverlässige Identifizierung aller Motoneuronen, unabhängig von ihrer Größe. Darüber hinaus die intrinsischen elektrischen Eigenschaften zu analysieren, (zB Eingangswiderstand), ist zeitaufwendiger als die einfache Beobachtung eines antidromic Aktionspotential.
Neben intrinsischen elektrischen Eigenschaften verwenden, einige Studiemit biocytin Etikettierungen 14,17 s quer Scheiben verwenden, bestätigen ihre Identifizierung durch die Durchführung post - hoc - Analyse der molekularen Marker für die Motoneurone (wie Islet-1/2 16) oder durch die Morphologie zu visualisieren. Solche Kennzeichnungen sind jedoch langwierig und bieten keine direkte Identifizierung. Sie werden daher nur selten systematisch durchgeführt.
Einige Studien versucht , den Einsatz von Mauslinien , um eine genetisch kodierte Motoneuron fluoreszierenden Marker exprimieren (Hb9-GFP Mauslinie 18, ChAT-EGFP transgenen Mäusen, die eGFP in cholinergen Zellen einschließlich Motoneuronen 19 oder G85R SOD1-YFP transgenen Mäuse exprimieren, die stark exprimieren das YFP - Fusionsprotein in Motoneuronen 17). Da jedoch der genetische Markerexpression üblicherweise in Zeit und da die Scheiben üblicherweise von Embryonen oder juveniles genommen werden konditioniert wird, wird die Expression des Markers nicht im Alter angemessen die study durchgeführt wird. Andere Studien haben rückläufige Mittelinjektion 34 verwendet das Motoneuron - Pool zu visualisieren. Wir Choleratoxin Beta-Injektionen in die soleus oder der EDL (persönliche Beobachtung) auch durchgeführt. Solche Markierungstechniken sind von großem Wert eines bestimmten Motoneuron-Pool zu beschriften, sondern erfordern langwierige Operation ein paar Tage vor dem Experiment. Darüber hinaus ist die junge Alter, in dem die Scheibe Experimente durchgeführt werden, ist es wesentlich schwieriger, speziell die Muskeln Ziel. Schließlich gibt es ein echtes Anliegen der Motoneuron von Stören durch eine exogene Substanz injiziert wird.
Unter optimalen Bedingungen konnten wir antidromic Aktionspotentiale in nahezu alle aufgenommenen Motoneurone zu erhalten. Der 35 ° -Winkel eingesetzt ist kritisch ventral Wurzeln von ausreichender Länge zu erhalten. Abschließend bietet die schräge Scheibe Vorbereitung eine schnelle und zuverlässige Art und Weise jedes Motoneuron zu identifizieren, die zu anderen Identifizierungstechniken überlegen ist.
Wie in der Einleitung erwähnt, nur zwei Studien berichtet erfolgreiche Stimulation der ventralen Wurzeln in Querschnitten. Die erste Studie aufgezeichnet zervikalen Neuronen in der Ratte stimuliert und die weiße Substanz , wo der ventralen Wurzel Stutzen 4 austritt. Sie erfolgreich antidrome Aktionspotential in 85% der aufgenommenen Neuronen induziert. Wir glauben, dass ihre hohe Erfolgsquote auf die Tatsache gestützt, dass bei der zervikalen Ebene, die Axone und Somen von Motoneurone auf der gleichen Ebene liegen. Dies ist nicht der Fall in mehr caudal slices. Schon bei der zervikalen Ebene, deren Querscheiben behielt nur Stubs der ventralen Wurzeln, die weniger zuverlässig sind zu stimulieren. Die zweite Studie stimulierte die Hühnerembryo dorso-Lendenwirbelsegment 5. Allerdings verwendeten sie spannungsempfindlichen Farbstoff-Aufnahme, die die räumliche Auflösung fehlte den Erfolg der Induzierung einer antidromic Aktionspotentiale auf Einzelzellebene anzuzeigen.
Unsere Scheibe preparatIon bietet auch eine hervorragende Möglichkeit , Renshaw - Zellen zu stimulieren , wie kürzlich in einem Papier 28 angegeben. Mit Hilfe der schrägen Scheiben, waren sie in der Lage monosynaptic Renshaw Zellen - Antworten in 46% der Fälle zu erfassen, die eine wesentliche Verbesserung von 10% Erfolgsrate lag bei angetroffen mit Querschnitten 35. Obwohl wir nicht einen ähnlichen Vergleich zur Stimulation der Motoneuron-Pools, diese Beobachtung in der Renshaw-Zelle führt uns finden konnten, zu glauben, dass Motoneurone auch mehr Konnektivität beizubehalten.
Oblique Aufschneiden des Rückenmarks ist eine sehr anspruchsvolle Technik, die zuverlässig viel Übung erfordert, bevor ein Präparat, von dem Erhalt eines aufzeichnen kann. Mit sehr feine und scharfe Pinzette und Mikro-Schere ist von wesentlicher Bedeutung. Die Zeit, zu sezieren kann ziemlich lang sein (bis zu 1 Stunde), solange das gesamte Verfahren in gekühltem Carbogen blasigen Dissektion Medium durchgeführt wird. Während einige Autoren erkennen keinen Nutzen intrakardialer perfusion in der Herstellung von Scheiben 36, beschlossen wir , diesen Schritt des Verfahrens aufrecht zu erhalten. Es ist schwer, den Vorteil der intrakardialen Perfusion für die Qualität der Aufnahmen objektiv zu messen, vor allem, weil es mit dem Alter ändert.
Der wichtigste Faktor ist die Maus Alter. Wir nahmen erfolgreich von Mäusen zwischen P2 und P11 das obige Protokoll verwendet. Historische diesem Alter wird das Rückenmark Myelin zu dicht und die größten Zellen (die Motoneurone) sterben vor dem Schneiden, höchstwahrscheinlich wegen Sauerstoffmangel. Nach diesem Fenster, fanden wir es immer schwieriger, gesunde Scheiben zu erhalten. In jüngster Zeit wurden neue Techniken berichtet worden , bei älteren Tieren 17,36 gesunde Scheiben zu erhalten. Sie benutzten zusätzliche Additive , um ihre Sezieren und Aufzeichnungsmedium wie ergänzende Energiequellen (Ethyl-Pyruvat), geringere Na + und Cl - Konzentrationen Onkose der Zellen 37,38 und Polyethylenglykol zu verhindern , dass die eff zu begrenzenjekte der umfangreichen Membran, die während des Schneidens Querschnitten erhalten auftreten. Mit solchen Verbesserungen konnten sie von bis zu 6 Monate alten Tiere aufzunehmen.
In Zukunft wäre es interessant, schräge Schnittpräparate bei erwachsenen Tieren, um zu versuchen, die Vorteile der beiden Techniken kombinieren. die beiden Protokolle Die Kombination sollte relativ einfach nachweisen und ein zuverlässiges Werkzeug Motoneuron Identität zu bestätigen und zu studieren, die Bevölkerung von Axonkollateralen von Motoneuronen in erwachsenen Mäusen gezielt bereitzustellen. Darüber hinaus könnte man versuchen, schräge Scheiben im Embryo Maus zu erhalten. Bemerkenswert unserer Zubereitung behält auch die dorsalen Wurzeln, die das Rückenmark, sowie die Aktivierung von dorsal neuronaler Populationen stimuliert werden kann , um die Aktivierung monosynaptic I a Innervation der Motoneuronen zu studieren. Abschließend bieten Ventralwurzel Stimulationen ein zuverlässiges Werkzeug Motoneuron Identität zu bestätigen und die Bevölkerung von Motoneuron Axonkollateralen gezielt zu untersuchen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Die Autoren danken Marin Manuel und Olivia Goldman-Szwajkajzer für ihre Hilfe in den Fotos zu machen. Die Autoren danken auch Arjun Masukar und Tobias Bock für das Manuskript Korrektur. Finanzielle Unterstützungen wurden von der Agence Nationale pour la Recherche (HYPER-MND, ANR-2010-BLAN-1429-1401) zur Verfügung gestellt, das NIH-NINDS (R01NS077863), die Thierry Latran Foundation (OHEX Project), die Französisch Verband für Myopathie ( Grant-Nummer 16026) und Target ALS sind dankbar anerkannt. Felix Leroy war der Empfänger einer "Contrat Doctoral" von der Ecole Normale Supérieure, Cachan.
Materialien
| Name | Company | Catalog Number | Comments |
| Na-kynurenate | ABCAM | ab120256 | dissolves better then other brands |
| KCl | Sigma | P3911 | |
| NaH2PO4 | Sigma | P5655 | |
| sucrose | Sigma | S9378 | |
| NaHCO3 | Sigma | S6014 | |
| CaCl2 | G Biosciences | R040 | |
| MgCl2 | Quality Biological | 351-033-721 | |
| glucose | Sigma | G5767 | |
| ascorbic acid | Sigma | A5960 | |
| Na-pyruvate | Sigma | P2250 | |
| K-gluconate | Sigma | P1847 | |
| EGTA | Sigma | E3889 | |
| HEPES | Sigma | H4034 | |
| NaCl | Sigma | S9888 | |
| Agar | Sigma | A9799 | |
| QX-314 | Alomone | Q150 | |
| Mg-ATP | Sigma | A9187 | |
| CsOH | Sigma | 232041 | |
| Na-GTP | Sigma | 51120 | |
| gluconic acid | Sigma | G1951 | |
| Cesium hydroxide solution | Sigma | 232041 | |
| KOH | Sigma | P5958 | |
| Vannas Spring Scissors - 2.5mm | FST | 15000-08 | only use for cutting the dura, might get damaged if cutting bones |
| Stimulator | A-M Systems | Isolated Pulse Stimulator Model 2100 | |
| Vibratome | Campden | Vibrating Microtome 7000 - Model 7000smz-2 |
Referenzen
- Brooks, C. M., Downman, C. B., Eccles, J. C. After-potentials and excitability of spinal motoneurones following antidromic activation. J Neurophysiol. 13 (1), 9-38 (1950).
- Bories, C., Amendola, J., Lamotte d'Incamps, B., Durand, J. Early electrophysiological abnormalities in lumbar motoneurons in a transgenic mouse model of amyotrophic lateral sclerosis. Eur J Neurosci. 25 (2), 451-459 (2007).
- Takahashi, T. Membrane currents in visually identified motoneurones of neonatal rat spinal cord. J Physiol. 423, 27-46 (1990).
- Hori, N., Tan, Y., Strominger, N. L., Carpenter, D. O. Intracellular activity of rat spinal cord motoneurons in slices. J Neurosci Methods. 112 (2), 185-191 (2001).
- Arai, Y., Mentis, G. Z., Wu, J. Y., O'Donovan, M. J. Ventrolateral origin of each cycle of rhythmic activity generated by the spinal cord of the chick embryo. PLoS One. 2 (5), e417 (2007).
- Cullheim, S., Lipsenthal, L., Burke, R. E. Direct monosynaptic contacts between type-identified alpha-motoneurons in the cat. Brain Res. 308 (1), 196-199 (1984).
- Cullheim, S., Kellerth, J. O., Conradi, S. Evidence for direct synaptic interconnections between cat spinal alpha-motoneurons via the recurrent axon collaterals: a morphological study using intracellular injection of horseradish peroxidase. Brain Res. 132 (1), 1-10 (1977).
- Gogan, P., Gueritaud, J. P., Horcholle-Bossavit, G., Tyc-Dumont, S. Direct excitatory interactions between spinal motoneurones of the cat. J Physiol. 272 (3), 755-767 (1977).
- Ichinose, T., Miyata, Y. Recurrent excitation of motoneurons in the isolated spinal cord of newborn rats detected by whole-cell recording. Neurosci Res. 31 (3), 179-187 (1998).
- Lamotte d'Incamps, B., Ascher, P. Four excitatory postsynaptic ionotropic receptors coactivated at the motoneuron-Renshaw cell synapse. J Neurosci. 28 (52), 14121-14131 (2008).
- Renshaw, B. Central effects of centripetal impulses in axons of spinal ventral roots. J Neurophysiol. 9, 191-204 (1946).
- Renshaw, B. Interaction of nerve impulses in the gray matter as a mechanism in central inhibition. Fed Proc. 5 (1 Pt 2), 86 (1946).
- Renshaw, B. Observations on interaction of nerve impulses in the gray matter and on the nature of central inhibition). Am J Physiol. 146, 443-448 (1946).
- Pambo-Pambo, A., Durand, J., Gueritaud, J. P. Early excitability changes in lumbar motoneurons of transgenic SOD1G85R and SOD1G(93A-Low) mice. J Neurophysiol. 102 (6), 3627-3642 (2009).
- Quinlan, K. A., Schuster, J. E., Fu, R., Siddique, T., Heckman, C. J. Altered postnatal maturation of electrical properties in spinal motoneurons in a mouse model of amyotrophic lateral sclerosis. J Physiol. 589 (Pt 9), 2245-2260 (2011).
- Martin, E., Cazenave, W., Cattaert, D., Branchereau, P. Embryonic alteration of motoneuronal morphology induces hyperexcitability in the mouse model of amyotrophic lateral sclerosis. Neurobiol Dis. 54, 116-126 (2013).
- Hadzipasic, M., et al. Selective degeneration of a physiological subtype of spinal motor neuron in mice with SOD1-linked ALS. Proc Natl Acad Sci U S A. 111 (47), 16883-16888 (2014).
- Wichterle, H., Lieberam, I., Porter, J. A., Jessell, T. M. Directed differentiation of embryonic stem cells into motor neurons. Cell. 110 (3), 385-397 (2002).
- Tallini, Y. N., et al. BAC transgenic mice express enhanced green fluorescent protein in central and peripheral cholinergic neurons. Physiol Genomics. 27 (3), 391-397 (2006).
- Manuel, M., et al. Fast kinetics, high-frequency oscillations, and subprimary firing range in adult mouse spinal motoneurons. J Neurosci. 29 (36), 11246-11256 (2009).
- Obeidat, A. Z., Nardelli, P., Powers, R. K., Cope, T. C. Modulation of motoneuron firing by recurrent inhibition in the adult rat in vivo. J Neurophysiol. 112 (9), 2302-2315 (2014).
- Leroy, F., Lamotte d'Incamps, B., Imhoff-Manuel, R. D., Zytnicki, D. Early intrinsic hyperexcitability does not contribute to motoneuron degeneration in amyotrophic lateral sclerosis. Elife. 3, (2014).
- Leroy, F., Lamotte d'Incamps, B., Zytnicki, D. Potassium currents dynamically set the recruitment and firing properties of F-type motoneurons in neonatal mice. J Neurophysiol. 114 (3), 1963-1973 (2015).
- Lamotte d'Incamps, B., Ascher, P. Subunit composition and kinetics of the Renshaw cell heteromeric nicotinic receptors. Biochem Pharmacol. 86 (8), 1114-1121 (2013).
- Lamotte d'Incamps, B., Krejci, E., Ascher, P. Mechanisms shaping the slow nicotinic synaptic current at the motoneuron-renshaw cell synapse. J Neurosci. 32 (24), 8413-8423 (2012).
- Dugue, G. P., Dumoulin, A., Triller, A., Dieudonne, S. Target-dependent use of co-released inhibitory transmitters at central synapses. J Neurosci. 25 (28), 6490-6498 (2005).
- Mentis, G. Z., Siembab, V. C., Zerda, R., O'Donovan, M. J., Alvarez, F. J. Primary afferent synapses on developing and adult Renshaw cells. J Neurosci. 26 (51), 13297-13310 (2006).
- Perry, S., et al. Firing properties of Renshaw cells defined by Chrna2 are modulated by hyperpolarizing and small conductance ion currents Ih and ISK. Eur J Neurosci. 41 (7), 889-900 (2015).
- Thurbon, D., Luscher, H. R., Hofstetter, T., Redman, S. J. Passive electrical properties of ventral horn neurons in rat spinal cord slices. J Neurophysiol. 79 (5), 2485-2502 (1998).
- Zengel, J. E., Reid, S. A., Sypert, G. W., Munson, J. B. Membrane electrical properties and prediction of motor-unit type of medial gastrocnemius motoneurons in the cat. J Neurophysiol. 53 (5), 1323-1344 (1985).
- Cooper, S., Sherington, C. S. Gower's tract and spinal border cells. Brain. 63, 123-124 (1940).
- Morin, F., Schwartz, H. G., O'Leary, J. L. Experimental study of the spinothalamic and related tracts. Acta Psychiatr Neurol Scand. 26 (3-4), 371-396 (1951).
- Sengul, G., Fu, Y., Yu, Y., Paxinos, G. Spinal cord projections to the cerebellum in the mouse. Brain Struct Funct. 220 (5), 2997-3009 (2015).
- Russier, M., Carlier, E., Ankri, N., Fronzaroli, L., Debanne, D. A-, T-, and H-type currents shape intrinsic firing of developing rat abducens motoneurons. J Physiol. 549 (Pt 1), 21-36 (2003).
- Dourado, M., Sargent, P. B. Properties of nicotinic receptors underlying Renshaw cell excitation by alpha-motor neurons in neonatal rat spinal cord). J Neurophysiol. 87 (6), 3117-3125 (2002).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. J Neurophysiol. 107 (2), 728-741 (2012).
- Rothman, S. M. The neurotoxicity of excitatory amino acids is produced by passive chloride influx. J Neurosci. 5 (6), 1483-1489 (1985).
- Olney, J. W., Price, M. T., Samson, L., Labruyere, J. The role of specific ions in glutamate neurotoxicity. Neurosci Lett. 65 (1), 65-71 (1986).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten