Method Article
La preparazione di Oblique Spinal Cord Fette per ventrale Root Stimolazione
In questo articolo
Riepilogo
Mostriamo come preparare le fette oblique del midollo spinale nei topi giovani. Questa preparazione consente la stimolazione delle radici ventrali.
Abstract
registrazioni elettrofisiologiche da fette del midollo spinale hanno dimostrato di essere una tecnica preziosa per indagare su una vasta gamma di questioni, dal cellulare alla proprietà della rete. Mostriamo come preparare fette oblique vitali del midollo spinale di topi giovani (P2 - P11). In questa preparazione, i motoneuroni mantengono le loro assoni che esce dalle radici ventrali del midollo spinale. La stimolazione di questi assoni suscita back-propaganti potenziali d'azione che invadono il somas motoneurone ed eccitanti collaterali del motoneurone nel midollo spinale. La registrazione dei potenziali d'azione antidromic è un modo immediato, definitivo ed elegante per caratterizzare l'identità del motoneurone, che supera gli altri metodi di identificazione. Inoltre, stimolando le collaterali motoneurone è un modo semplice e affidabile per eccitare i bersagli collaterali dei motoneuroni nel midollo spinale, come altri motoneuroni o Renshaw cellule. In questo protocollo, vi presentiamo le registrazioni antidromic dal motoneurone somas così come l'eccitazione delle cellule Renshaw, derivante dalla stimolazione della radice ventrale.
Introduzione
Storicamente, le registrazioni del motoneurone utilizzando sharp-elettrodi sono stati condotti in vivo su animali di grossa taglia come gatti o topi 1 o su un isolato intero midollo spinale nei topi 2. L'emergere della tecnica di registrazione patch-clamp nel corso del 1980, chiamato per l'accesso diretto al motoneurone somas come guarnizioni doveva essere raggiunto sotto la guida visiva. Così, il midollo spinale preparazione fetta è stato raggiunto facilmente a partire dai primi anni 1990 3. Tuttavia, la preparazione fetta precoce spesso non consentiva la stimolazione delle radici ventrali. Per quanto a nostra conoscenza, solo due studi hanno riportato la stimolazione successo delle radici ventrali a fette trasversali, e nessuno è stato ottenuto da topi 4,5.
In questo articolo presentiamo una tecnica per ottenere valide fette del midollo spinale di topi neonati (P2 - P11) in cui la piscina motoneuroni conserva le sue radici ventrali partenza assoni. Sfogola stimolazione della radice ral innesca potenziale d'azione antidromic di nuovo nelle somas della piscina motoneuroni in uscita dalla stessa radice ventrale. Si eccita anche gli obiettivi collaterali motoneurone, altri motoneuroni 6-10 e le cellule Renshaw 11-13. Dal momento che solo motoneuroni inviano i loro assoni le radici ventrali, usiamo la registrazione dei potenziali d'azione antidromic come un modo semplice e definitivo per physiologicaly identificare motoneuroni 10.
Oltre a utilizzare criteri elettrofisiologici e morfologici potenzialmente non inclusivi o fuorvianti per confermare l'identità del motoneurone, recenti studi sui motoneuroni del midollo spinale anche invocato noioso e che richiede tempo post hoc colorazioni 16. Tale identificazione viene solitamente eseguita solo su un campione delle cellule registrate. Altre strategie di identificazione basano su linee di topi in cui i motoneuroni esprimono fluorescenza endogena 17-19. Tuttavia, utilizzando i marcatori geneticamente codificate può essere difficile in giovane età, quando l'espressione marcatore è ancora variabile o se lo studio richiede già utilizzando una linea di topi transgenici. In alternativa, azione antidromic potenziali registrazioni possono essere effettuate sistematicamente su tutti i topi dall'insorgenza della registrazione cellule. Gli sperimentatori che lavorano su intatti i preparativi del midollo spinale nel gatto, ratto e nel topo, hanno usato in modo affidabile queste tecniche di identificazione dal 1950 1,2,20,21. In condizioni ottimali, siamo stati in grado di suscitare potenziali d'azione antidromic praticamente da tutti i motoneuroni registrati.
Inoltre, la stimolazione della radice ventrale può essere utilizzata per eccitare affidabile altre motoneuroni 22,23 o loro bersagli. le cellule Renshaw 10,24,25. Vi presentiamo qui le applicazioni della stimolazione della radice ventrale, sotto forma di azione antidromic potenziali registrazioni dal motoneurone somas, così come l'eccitazione delle cellule Renshaw.
Protocollo
Gli esperimenti sono stati eseguiti in conformità con le direttive europee (86/609 / CEE e 2010-63-UE) e la legislazione francese, e sono state approvate dal comitato etico Paris Descartes University.
1. midollo spinale Fetta Preparazione
- Preparare le seguenti soluzioni giornaliere o un giorno di anticipo. Se tenuto durante la notte, bolla con 95% O 2 e il 5% di CO 2 e conservare in frigo in bottiglie ben chiusi.
- Preparare bassa Na + fluido artificiale cerebrospinale (ACSF): 3 mm KCl, 1 mM NaH 2 PO 4, 230 mm di saccarosio, 26 mm NaHCO 3, 0,8 mm CaCl 2, 8 mm MgCl 2, 25 mM di glucosio, acido ascorbico 0,4 mm, 1 mM Na-kynurenate, 2 mM Na-piruvato. Bubble con 95% O 2 e 5% CO 2 (pH 7,4). Dal momento che Na-kynurenate è spesso difficile da sciogliere, assicurarsi di acquistare quello elencato nella tabella dei materiali.
- Preparare Solu K-gluconatozione: 130 mm K-gluconato, 15 mm KCl, 0,05 mm EGTA, 20 mM HEPES, 25 mM di glucosio, 1 mM Na-kynurenate, 2 mM Na-piruvato, portato a pH 7,4 con KOH.
- Preparare ACSF: 130 mM NaCl, 2,5 mM KCl, 2 mM CaCl 2, 1 mM MgCl 2, 1 mM NaH 2 PO 4 26 mM NaHCO 3, 25 mM glucosio, 0.4 mM acido ascorbico, 2 mM Na-piruvato. Bubble con 95% O 2 e 5% CO 2 (pH 7,4).
- Prima dell'inizio della dissezione, sciogliere 2% agar in 80 ml della soluzione di K-gluconato e mantiene caldo a 60 ° C.
- intracardiaca perfusione
- Eseguire questa preparazione sui topi maschi e femmine, di età compresa da P2 a P11.
- Anestetizzare il mouse con un'iniezione intraperitoneale di 0,1 ml di 25 mM di sodio pentobarbital (50 mg / kg).
- L'utilizzo di aghi o nastro, immobilizzare il mouse sul dorso su un grande piatto di Petri riempita di silicone. Utilizzare un Microscopio di dissezionee per il resto della dissezione.
- Tenendo la punta dello sterno, sollevare il torace e tagliare la membrana usando forbici sottili. Quindi aprire il petto su entrambi i lati da taglio attraverso le costole per esporre il cuore.
- Tagliare l'atrio destro prima di pungere il ventricolo sinistro con un ago 27G.
- Profumato con ghiacciata basso Na + ACSF. Dopo 30 sec, bassa Na + ACSF va visto scorre fuori dell'atrio. Bassa quantità di sodio impediscono alle cellule di chiodare e riducono la morte cellulare durante la dissezione.
- Tenere premuto l'ago nel cuore sotto il microscopio da dissezione fino fegato diventa giallo quando il sangue viene drenato.
- Dissezione del midollo spinale
- Decapitare l'animale e metterlo sul suo stomaco.
- Rimuovere rapidamente la pelle del dorso (Figura 1A1). Fare due tagli attraverso le spalle e scendendo la gabbia toracica (Figura 1A2). Poi tagliare il cordone, come low possibile nella sezione caudale per isolare la colonna vertebrale con l'inizio delle nervature dalla parte inferiore dell'animale. Vibrazione di nuovo l'animale e rimuovere le viscere ancora attaccato alle costole.
- Trasferire la colonna vertebrale ad un altro, più piccolo di silicio pieno capsula di Petri e utilizzare 4 perni di insetti per tenerlo dorsale rivolta verso l'alto (Figura 1A).
- Continuamente profumato l'animale con ACSF CarboGen-gorgogliare (a circa 4 ° C) durante l'esecuzione di una laminectomia del lato dorsale, ed esponendo il midollo spinale dalla fine rostrale (Figura 1B). Per fare ciò, inserire la punta di forbici sottile tra l'osso e il midollo spinale e tagliare l'osso a poco a poco dalla fine rostrale, facendo attenzione a stare lontano dalla sostanza bianca. Alternate su ciascun lato mentre con una pinzetta per tenere lontano il gruppo di osso già tagliato (Figura 1B1).
- Utilizzando le più piccole forbici primavera disponibili e pinzette, sollevare la dura e tagliaresu entrambi i lati sostenendo la parte allentata della dura per evitare di danneggiare il midollo spinale con le forbici. Tagliare lungo l'asse rostro-caudale.
NOTA: La dura è una membrana continua trasparente semi; a questa età la pia madre è troppo fragile e si sfaldi durante la dissezione e taglio (Figura 1B2). - Una volta che la dura madre è uso rimosso un vetro smussato o punta di plastica per spingere delicatamente il cavo sul lato sinistro della scanalatura formata dalla colonna vertebrale mezzo taglio, e tagliare le radici ventrali e dorsali sul lato destro, partendo dal lato rostrale , lontano da dove entrano il cavo (alcuni mm almeno, Figura 1B2).
- Ripetere l'operazione sul lato sinistro, sempre passando da rostrale a caudale. Se mancino, partire dal lato sinistro e poi spostarsi verso il lato destro.
- Incorporare in agar
- Infilare il cavo della colonna vertebrale. Utilizzare un perno insetto più piccolo da definireil cavo con dorsale superficie e rimuovere delicatamente qualsiasi pezzo di membrana ancora collegato ad esso (Figura 1C1).
- Una volta puliti, tagliare entrambe le estremità (Figura 1C2). Inserire un perno insetto piegato nella parte anteriore del cavo di manipolare il cordone e notare il suo orientamento (freccia in Figura 1C2). Poi il trasferimento del midollo spinale a una soluzione K-gluconato ghiacciata.
NOTA: Questa soluzione imita la composizione intracellulare del QCS e impedisce alle cellule di morire di shock osmotico una volta che i motoneuroni saranno tagliati 26. - Una volta che il midollo spinale è all'interno della soluzione intracellulare, prendere il bicchiere con l'agar dal bagno secco e raffreddarlo su una miscela di acqua e ghiaccio.
- Continuate a mescolare mentre la misurazione della temperatura. Quando la temperatura raggiunge i 38 ° C immergere il midollo spinale, tenendolo per il perno di insetti e posizionarlo lato rostrale verso il basso. Assicurarsi che il midollo spinale è come straight possibile, lontano dalle pareti, parte caudale leggermente verso l'alto (Figura 1D1).
- Lasciare il bicchiere nella miscela di acqua e ghiaccio per consentire l'agar solidificare il più rapidamente possibile. Assicurarsi che rimanga al suo posto e che il cavo è più diritta possibile (Figura 1D1).
- Affettare
- Dopo solidificazione, tagliare il blocco agar contenente il midollo spinale in modo tale che la base del blocco è ad un angolo di 35 ° con la parte lombare del cavo (freccia in Figura 1D2). La superficie dorsale deve essere rivolto lontano dalla base (Figura 1D2).
NOTA: Questo è un passo fondamentale nella procedura, per mantenere la continuità delle piscine motoneurone alle radici ventrali da cui escono. - Incollare il blocco nella camera del vibratome con colla cianoacrilato. Immergerlo in soluzione K-gluconato e aggiungere slushed soluzione K-gluconato congelato per mantenereil bagno fresco (al di sotto di 2 ° C).
- Tagliare 350 - 400 micron di spessore fette di regione lombare (identificabili dalla sua curvatura e diametro maggiore). Nel suo corretto orientamento (vedi 1.4.1.), Utilizzare la lama per tagliare dalla dorsale alla superficie ventrale e rendere fette continuamente più rostrale. In genere, ci sono 4-5 fette adatti con radici ventrali si estendono o più di 2 mm. Utilizzare i seguenti parametri: 10 ° angolo, frequenza di vibrazione di 70 Hz e 10 mm / min velocità di taglio.
- Dopo solidificazione, tagliare il blocco agar contenente il midollo spinale in modo tale che la base del blocco è ad un angolo di 35 ° con la parte lombare del cavo (freccia in Figura 1D2). La superficie dorsale deve essere rivolto lontano dalla base (Figura 1D2).
- incubazione
- Trasferire le fettine di ACSF a 34 ° C. Dopo circa 30 minuti, raffreddare le fette fino a RT e iniziare la sessione di registrazione.

Figura 1. Dissezione
A1:. La rimozione della pelle del dorso per esporre la colonna dorsale A2:Taglio delle spalle e le costole per liberare la dorsale della colonna B1:. Colonna vertebrale appuntato sulla capsula di Petri silicone-riempita (lato dorsale fino, lato caudale sinistra) B2:. Lo stesso con il midollo spinale esposto e sezionato C1:. Midollo spinale isolato . (lato rostrale sinistra) C2: midollo spinale pronto per essere incorporato (fino lato ventrale, lato rostrale a sinistra). Nota il perno di insetto più piccolo sul lato rostrale D1:.. Midollo spinale nel bicchiere agar (lato rostrale Dow, lato ventrale rivolto verso il basso) D2: Tagliare blocco di agar con il midollo spinale incorporato. Nota l'angolo di 35 ° le forme del midollo spinale con la base del blocco e l'ampliamento lombare (freccia). Barre di scala 1 cm. Clicca qui per vedere una versione più grande di questa figura.
2. Posizionamento del Slice nella Camera
NOTA: Veradici ntral sono di dimensioni variabili.
- Preparare una scatola di vari pipette con puntali di diametro da 40 a 170 micron in anticipo. Per preparare pipette di aspirazione, preparare molte pipette con un lungo cono. Con un coltello diamante, effettuare un taglio in posizioni diverse. Poi sotto un microscopio da dissezione, romperlo colpendo la punta con una pinzetta.
- Rimuovere la camera dal microscopio registrazione e posizionarlo sotto un microscopio da dissezione.
- Selezionare una slice che contiene una radice ventrale lunghezza sufficiente (2 mm o più) per essere montato su un elettrodo di stimolazione di aspirazione. Selezionare il corretto orientamento della fetta con le radici ventrali verso l'alto (Figura 2A) e delicatamente tagliare l'agar intorno alle radici ventrali lasciando il resto del agar intorno fetta (Figura 2B).
NOTA: Perché la agar è più solido rispetto alle fetta, questo permetterà i fili di ancoraggio della fetta di riposare sul agar, piuttosto che sulla fetta e quindi l'unanchor non danneggia il tessuto. Assicurarsi che i fili della ancoraggio della fetta sono sopra la piscina motoneuroni (in rosso nella figura 2C). - Montare la camera posteriore sul microscopio e continuamente profumato camera di registrazione con ACSF ad una velocità di 1 - 2 ml / min, a temperatura ambiente. Usando una pipetta di vetro riempito con ACSF e collegato ad una siringa, succhiare uno della radice ventrale (freccia in Figura 2C). Al fine di ottenere una buona stimolazione della radice ventrale, la punta della pipetta deve essere stretto intorno alla radice ventrale. Un polo dovrebbe essere l'elettrodo stimolante e l'altro nella vasca (o connesso al riferimento elettrodo patch-bloccaggio).
- Ottenere registrazione patch-clamp della cellula-tipo desiderato e registrare l'effetto di stimolazione della radice ventrale come descritto previsouly 10.
- Qui, utilizzare un amplificatore per l'acquisizione dati. Filtro registrazioni cellule intere a 3 kHz. Digitalizzare a 10 kHz. Compensare resistenza ponte in curreModalità nt morsetto.

Figura 2. ventrale Root Preparazione
A: fetta midollo spinale lombare incorporato nel agar con la radice ventrale rivolto verso l'alto. B: la fetta del midollo spinale lombare con le radici ventrali liberati dal agar C:. Fetta midollo spinale lombare con un elettrodo stimolante strettamente collocato intorno alle radici ventrali (freccia) . Si noti la posizione delle cellule Renshaw che esprimono fluorescenza rossa nel chrna2-Cre del mouse 28 incrociata con la giornalista del mouse R26 Tom 17. Barre scala 1 mm. Clicca qui per vedere una versione più grande di questa figura.
Risultati
La conferma di motoneuroni identità utilizzando Potenziali antidromica azione
cellulare il targeting
Motoneuroni si trovano nel corno ventrale (visibile in rosso nella Figura 2C). Inizia da fascio di assoni che formano la radice ventrale e salire fino a quando il fascio si disperde completamente e si comincia a vedere grandi cellule (asse lungo Soma, superiore a 20 micron). Ottenere registrazione cellula intera di una cella voltarsi sano utilizzando un elettrodo di resistenza iniziale di 3 a 4 MW. La soluzione interna utilizzata conteneva: 140 mm K-gluconato, 6 mM KCl, 10 mM HEPES, 1 mM EGTA, 0.1 mM CaCl 2, 4 mM Mg-ATP, 0,3 mm Na 2 GTP. Portare il pH a 7,3 con KOH, e l'osmolarità a 285 - 295 mOsm aggiungendo acqua distillata.
Conferma dell'identità motoneurone
Una volta che la registrazione cellula intera è raggiunto, applicare un unico stimolazione bifasica della radice ventrale (1 - 50 V, 0,1-0,3 msec) per suscitare un potenziale d'azione antidromic nelle cellule registrati del cordone ventrale figure 3A1 e 3A2 spettacolo azione antidromic. potenziali, rispettivamente voltage-clamp o corrente-clamp,. Quando si aumenta l'intensità di stimolazione da 1 a 5 V (Figura 3A1) e dal 10 a 15 V (Figura 3A2) il potenziale d'azione antidromic appare in modo tutto o niente con una latenza di 0,9 msec e 1.1 msec. Dato che solo i motoneuroni mandano i loro assoni attraverso le radici ventrali, il potenziale d'azione antidromic è una prova dell'identità cellulare.
In una minoranza di motoneuroni (circa il 10%), la stimolazione della radice ventrale non è riuscito asuscitare potenziale d'azione antidromic ma piuttosto suscitato potenziali d'azione ortodromica. Figure 3B1 e 3B2 mostrano potenziali d'azione ortodromica in voltage-clamp o corrente-clamp, rispettivamente. Incrementando la stimolazione da 20 a 30 V (Figura 3B1) e da 25 a 40 V (Figura 3B2), compare un potenziale d'azione, a seguito di una precedente eccitatorio corrente post-sinaptico (EPSC) o eccitatorio postsinaptico potenziale (EPSP). Le latenze dei potenziali d'azione sono più lunghe (5.1 msec e 5.3 msec, rispettivamente). In queste due cellule, stimolando la radice ventrale suscitato una eccitazione feed-forward (motoneuroni inviano collaterali degli assoni a se stessi e ad altri motoneuroni), che era abbastanza forte per provocare un potenziale d'azione ortodromica. In queste cellule, la mancanza di suscitare un potenziale d'azione antidromic (caratterizzato dalla sua del tutto-o-niente e una latenza inferiore a 5 msec) non ci permette di concludere che queste cellule ar e motoneuroni. Si noti che l'intensità di stimolazione richieste per provocare feed-forward eccitazione è superiore a quello necessario per ottenere un potenziale d'azione antidromic. Tutti gli stimoli indicati qui sono 0.1 msec, ma a volte, più di stimolazione (fino a 0,3 msec) possono essere richieste per provocare un potenziale d'azione antidromic.
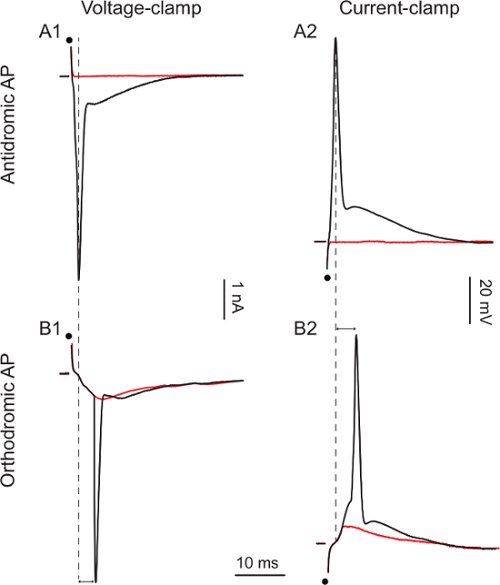
Figura 3. motoneuroni Risposte ad ventrale Root Stimolazione
A1: 1 V (traccia rossa) e 5 V stimoli (traccia nera) A2:.. 10 V (traccia rossa) e 15 V stimoli (traccia nera) B1: 20 V (traccia rossa) e 30 V (traccia nera) stimolazioni . B2: 25 V (traccia rossa) e 40 V stimoli (traccia nera). I punti neri indicano i tempi di stimolo. punte di freccia doppia sottolineano la differenza di latenza tra picchi orto- e antidromic.m / files / ftp_upload / 54525 / 54525fig3large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
Renshaw cellulare Stimolazione
cellulare il targeting
Cellule Renshaw si trovano nel corno ventrale 27,28. Visualizzare i fasci di assoni con interferenza differenziale contrasto per immagini (DIC) utilizzando un 20X e 63X una obiettivi. Inizia da fascio di assoni che formano la radice ventrale e salire fino a quando gli assoni cominciano a disperdersi, ma sono ancora distinguibili (Figura 4A, frecce). Obiettivo per le celle di dimensioni intermedie (circa 10 - 15 micron di diametro, Figura 4A, frecce). Raggiungere la registrazione a cellula intera di un round di cellule dall'aspetto sano utilizzando un elettrodo di resistenza iniziale di 5-7 MW. A seconda del esperimento, abbiamo utilizzato either Cs + -based o K + -based soluzioni interne 10. La soluzione Cs-based impedito correnti di potassio grandi che erano visibili intorno a -45 mV. In alcuni esperimenti, abbiamo aggiunto 5 mM QX-314 per bloccare i canali del sodio responsabili chiodare nella cella registrata. La soluzione + Cs-based contiene: 125 mm Cs-gluconato, 5 mM QX-314 Cl, 10 mM HEPES, 10 mM EGTA, 1 mM CaCl 2, 4 mM Mg-ATP e 0,4 mm Na-GTP, con il pH regolato a 7,3 con CsOH. Il K + soluzione sede deve essere utilizzato per analizzare, sia da tensione e corrente-clamp, le risposte delle cellule Renshaw alla stimolazione della radice ventrale in condizioni approssimare il più possibile quelle fisiologiche. Questa soluzione contiene: 125 mM K-gluconato, 10 mM HEPES, 1 mM EGTA, 0.1 mM CaCl 2, 4 mM Mg-ATP, 0,4 mM Na-GTP, con il pH regolato a 7,3 con KOH. L'intensità dello stimolo varia tra 10 e 100 V e la sua durata varia tra 50 e 300 msec. BIPO impulsi lar sono stati utilizzati in tutti i casi.
Risposta delle cellule Renshaw alla stimolazione della radice ventrale
La stimolazione della radice ventrale innesca la corelease di glutammato e acetilcolina da collaterali del motoneurone sulle cellule Renshaw 10. Inibizione feed-forward mediato da GABA e glicina è anche reclutato 10. Figura 4B mostra risposte alla sola stimolazione della radice ventrale. La cella è stato registrato in un modo tensione-clamp con la soluzione di cesio-based, e mantenuto ad una tensione di -45 mV. QX-314 nella soluzione intracellulare impedito la cella da sparo e GABA e le risposte glicina sono stati bloccati da 3 gabazine micron e 1 micron stricnina, rispettivamente. La corrente sinaptica attivo nella Figura 4B è la somma del glutammatergica e correnti nicotinici.
nt "fo: keep-together.within-page =" 1 ">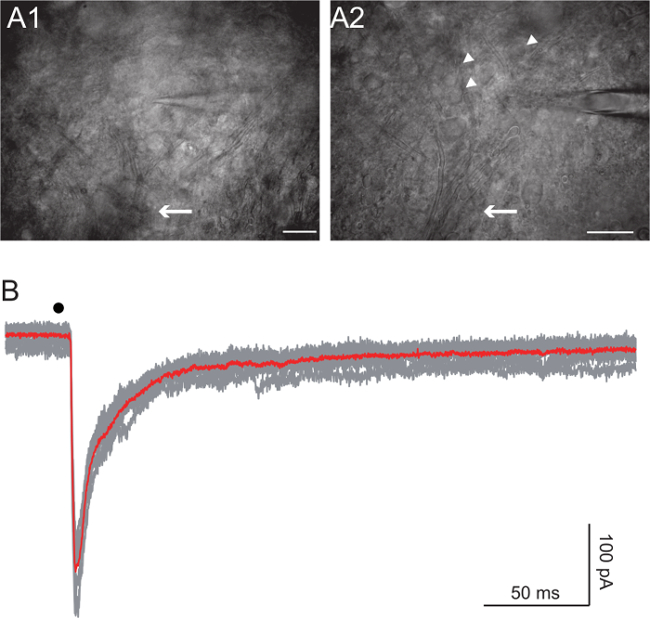
Figura 4. Renshaw cellulare stimolazione dalla radice ventrale
A: Le immagini del pool di cellule Renshaw acquisiti utilizzando un condensatore obliqua nella stessa fetta prese a due ingrandimenti diversi (20X e 40X obiettivi). Nota gli assoni del motoneurone che si fondono nella radice ventrale (freccia). cellule putativo Renshaw sono indicati con frecce. Barre di scala: 100 micron di A1, 50 micron di B A2:. Registrazioni di tensione-clamp di una cellula Renshaw dopo stimolazione della radice ventrale (punto nero). La traccia rossa è la media dei grigi. tensione di mantenimento è stato fissato a -45 mV. QX-314 nella soluzione intracellulare impedito la cella da sparo e GABA e le risposte glicina sono stati bloccati da 3 gabazine micron e 1 micron stricnina, rispettivamente. Nero punto indica i tempi di stimolo.com / file / ftp_upload / 54525 / 54525fig4large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
Discussione
affettare obliqua del midollo spinale è importante in quanto consente per la stimolazione unilaterale delle piscine del motoneurone e cellule Renshaw in un unico segmento vertebrale in modo affidabile, completa e specifica. Inoltre, consente una rapida identificazione, elegante e non ambigua dei motoneuroni registrati. Successivamente, si metterà in evidenza i vantaggi di questa tecnica rispetto ad altri metodi di preparazione fetta, e poi ci sottolineare le insidie più comuni da evitare durante l'esecuzione di questa procedura.
La maggior parte degli studi che utilizzano fette trasversali basano la loro identificazione sulle proprietà elettriche intrinseche 3,14,15,29. Tuttavia, questi variano notevolmente tra le piscine del motoneurone, come pure tra i sottotipi motoneurone all'interno di un determinato pool (alfa, beta e gamma-motoneuroni 30). Pertanto, gli studi che utilizzano parametri dimensionali rischiano di escludere i piccoli gamma-motoneuroni. D'altra parte, Cooper e Sherrington ddescritto nella 1940 un gruppo di grandi cellule nervose nella materia grigia ventro-laterale del midollo spinale lombare di scimmie e gatti, che aveva attraversato ascendente assoni 31,32. Oltre ad essere vicino alla somas motoneurone, hanno notato che sono apparsi istologicamente indistinguibili da motoneuroni. Un recente articolo ha confermato l'esistenza di tali cellule nel topo 33. A causa delle grandi dimensioni di queste cellule e la loro ubicazione, avrebbero potuto essere erroneamente inclusi in studi precedenti. Il nostro criterio di identificazione esclude cellule di confine spinali putativi, dal momento che il loro assone non sporga nella radice ventrale, pur consentendo l'identificazione affidabile di tutti i motoneuroni, indipendentemente dalle loro dimensioni. Inoltre, analizzando le proprietà elettriche intrinseche, (ad esempio, resistenza di ingresso), richiede più tempo rispetto alla semplice osservazione di un potenziale d'azione antidromic.
Oltre a utilizzare intrinseche proprietà elettriche, alcune studies utilizzando fette trasversali, confermare la loro identificazione da parte l'esecuzione di analisi post-hoc del marcatore molecolare per motoneuroni (come Islet-1/2 16) o visualizzando la morfologia utilizzando biocitina etichettature 14,17. Tali identificazioni sono comunque noioso e non forniscono una identificazione diretta. Essi sono quindi raramente sistematicamente eseguite.
Alcuni studi hanno cercato di fare uso di linee di topo che esprimono un marcatore fluorescente motoneuroni geneticamente codificato (HB9-GFP linea di topi 18, Chat-EGFP topi transgenici che esprimono eGFP nelle cellule colinergici tra motoneuroni 19, o G85R SOD1-YFP topi transgenici, che fortemente esprimere la proteina di fusione YFP in motoneuroni 17). Tuttavia, poiché l'espressione marcatore genetico è solitamente condizionato nel tempo e poiché le fette sono generalmente prese da embrioni o minori, l'espressione del marcatore può non essere adeguato all'età del study viene eseguita. Altri studi hanno utilizzato l'iniezione agente retrograda per visualizzare la piscina motoneuroni 34. Abbiamo anche eseguito colera iniezioni di tossina beta nel soleo o l'EDL (osservazione personale). Tali tecniche di etichettatura sono di grande valore per etichettare un determinato pool di motoneuroni, ma richiedono un intervento chirurgico noioso un paio di giorni prima dell'esperimento. Inoltre, la giovane età in cui sono stato fatto esperimenti fetta, rende molto più difficile per indirizzare specificamente i muscoli. Infine, vi è una preoccupazione reale di perturbare il motoneurone iniettando un agente esogeno.
In condizioni ottimali siamo stati in grado di ottenere potenziali d'azione antidromic in quasi tutti i motoneuroni registrati. L'angolo di 35 ° utilizzato è fondamentale per ottenere le radici ventrali di lunghezza sufficiente. In conclusione, la preparazione fetta obliqua offre un modo rapido e affidabile per identificare ogni motoneurone, che è superiore ad altre tecniche di identificazione.
Come detto in premessa, solo due studi hanno riportato la stimolazione di successo delle radici ventrali a fette trasversali. Il primo studio ha registrato i neuroni cervicali nel ratto e ha stimolato la materia bianca in cui lo stub radice ventrale emerge 4. Hanno indotto con successo potenziale d'azione antidromic nel 85% dei neuroni registrati. Crediamo loro alto tasso di successo è basata sul fatto che, a livello cervicale, gli assoni e somas di motoneuroni sono sullo stesso piano. Questo non è il caso in fette più caudale. Anche a livello cervicale, loro fette trasversali conservati solo mozzi delle radici ventrali, che sono meno affidabili per stimolare. Il secondo studio ha stimolato il segmento dorso-lombare embrione di pollo 5. Tuttavia, hanno usato la registrazione colorante sensibile di tensione, che mancava la risoluzione spaziale per indicare il successo di indurre una antidromic potenziali d'azione a livello di singola cellula.
La nostra fetta preparatione offre anche un modo superiore per stimolare le cellule Renshaw, come indicato in un recente documento 28. Utilizzando le fette oblique, sono stati in grado di registrare monosinaptici Renshaw cellule risposte nel 46% dei casi, che era un grande miglioramento dal tasso di successo del 10% riscontrati utilizzando fette trasversali 35. Anche se non siamo riusciti a trovare un confronto simile per la stimolazione delle piscine motoneurone, questa osservazione nella cella Renshaw ci porta a credere che motoneuroni mantengono anche più connettività.
affettare obliquo del midollo spinale è una tecnica molto impegnativo che richiede molta pratica prima di ottenere in modo affidabile una preparazione da cui si può registrare. Utilizzando le pinzette molto sottili e taglienti e micro-forbici è essenziale. Il tempo trascorso dissezione può essere piuttosto lungo (fino a 1 ora) fino a quando l'intera procedura viene condotta in refrigerate medio dissezione carbogeno-bollito. Mentre alcuni autori non riconoscono alcun beneficio di perfusio intracardiacan nella preparazione di fette 36, abbiamo deciso di mantenere questa fase della procedura. È difficile misurare oggettivamente beneficio di perfusione intracardiaca per la qualità delle registrazioni, soprattutto perché varia con l'età.
Il fattore più importante è l'età mouse. Abbiamo registrato con successo da topi tra P2 e P11 che utilizzano il protocollo di cui sopra. Passato questo periodo, la mielina del midollo spinale diventa troppo denso e più grandi cellule (motoneuroni) muore prima di affettare, molto probabilmente a causa di mancanza di ossigeno. Dopo quella finestra, abbiamo trovato sempre più difficile ottenere fette sani. Di recente, le nuove tecniche sono stati segnalati per ottenere fette sani in animali più vecchi 17,36. Hanno usato additivi supplementari per la loro dissezione e supporto di registrazione come fonti complementari di energia (etil-piruvato), inferiori Na + e Cl - concentrazioni per prevenire oncosis delle cellule 37,38 e glicole polietilenico per limitare l'effette dei vasti transections di membrana che si verificano durante affettare. Con tali miglioramenti, sono stati in grado di registrare da un massimo di animali vecchi di 6 mesi.
In futuro sarebbe interessante tentare preparazioni fetta oblique in animali adulti di combinare i vantaggi delle due tecniche. Combinando i due protocolli dovrebbe risultare relativamente facile e fornirà uno strumento affidabile per confermare l'identità del motoneurone e studiare la popolazione destinataria delle collaterali assoni dei motoneuroni in topi adulti. Inoltre, si potrebbe tentare di ottenere fette oblique nel topo embrionale. Degno di nota, la preparazione conserva anche le radici dorsali, che possono essere stimolate per studiare la monosinaptico attivazione di I una innervazione ai motoneuroni, nonché l'attivazione del midollo spinale dorsale popolazioni neuronali. In conclusione, stimolazioni radice ventrale offrono uno strumento affidabile per confermare l'identità motoneuroni e di studiare la popolazione target da garanzie reali motoneurone assoni.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Gli autori ringraziano Marin Manuel e Olivia Goldman-Szwajkajzer per il loro aiuto nel prendere le fotografie. Gli autori ringraziano anche Arjun Masukar e Tobias Bock per la correzione del manoscritto. sostegni finanziari sono stati forniti dalla Agence Nationale pour la Recherche (HYPER-MND, ANR-2010-BLAN-1429-1401), il NIH-NINDS (R01NS077863), il Thierry Latran Foundation (OHEX Project), l'associazione francese per la miopatia ( concessione numero 16026) e target SLA sono ringrazia. Felix Leroy è stato il destinatario di un "Contratto di Dottorato" presso l'Ecole Normale Supérieure, Cachan.
Materiali
| Name | Company | Catalog Number | Comments |
| Na-kynurenate | ABCAM | ab120256 | dissolves better then other brands |
| KCl | Sigma | P3911 | |
| NaH2PO4 | Sigma | P5655 | |
| sucrose | Sigma | S9378 | |
| NaHCO3 | Sigma | S6014 | |
| CaCl2 | G Biosciences | R040 | |
| MgCl2 | Quality Biological | 351-033-721 | |
| glucose | Sigma | G5767 | |
| ascorbic acid | Sigma | A5960 | |
| Na-pyruvate | Sigma | P2250 | |
| K-gluconate | Sigma | P1847 | |
| EGTA | Sigma | E3889 | |
| HEPES | Sigma | H4034 | |
| NaCl | Sigma | S9888 | |
| Agar | Sigma | A9799 | |
| QX-314 | Alomone | Q150 | |
| Mg-ATP | Sigma | A9187 | |
| CsOH | Sigma | 232041 | |
| Na-GTP | Sigma | 51120 | |
| gluconic acid | Sigma | G1951 | |
| Cesium hydroxide solution | Sigma | 232041 | |
| KOH | Sigma | P5958 | |
| Vannas Spring Scissors - 2.5mm | FST | 15000-08 | only use for cutting the dura, might get damaged if cutting bones |
| Stimulator | A-M Systems | Isolated Pulse Stimulator Model 2100 | |
| Vibratome | Campden | Vibrating Microtome 7000 - Model 7000smz-2 |
Riferimenti
- Brooks, C. M., Downman, C. B., Eccles, J. C. After-potentials and excitability of spinal motoneurones following antidromic activation. J Neurophysiol. 13 (1), 9-38 (1950).
- Bories, C., Amendola, J., Lamotte d'Incamps, B., Durand, J. Early electrophysiological abnormalities in lumbar motoneurons in a transgenic mouse model of amyotrophic lateral sclerosis. Eur J Neurosci. 25 (2), 451-459 (2007).
- Takahashi, T. Membrane currents in visually identified motoneurones of neonatal rat spinal cord. J Physiol. 423, 27-46 (1990).
- Hori, N., Tan, Y., Strominger, N. L., Carpenter, D. O. Intracellular activity of rat spinal cord motoneurons in slices. J Neurosci Methods. 112 (2), 185-191 (2001).
- Arai, Y., Mentis, G. Z., Wu, J. Y., O'Donovan, M. J. Ventrolateral origin of each cycle of rhythmic activity generated by the spinal cord of the chick embryo. PLoS One. 2 (5), e417 (2007).
- Cullheim, S., Lipsenthal, L., Burke, R. E. Direct monosynaptic contacts between type-identified alpha-motoneurons in the cat. Brain Res. 308 (1), 196-199 (1984).
- Cullheim, S., Kellerth, J. O., Conradi, S. Evidence for direct synaptic interconnections between cat spinal alpha-motoneurons via the recurrent axon collaterals: a morphological study using intracellular injection of horseradish peroxidase. Brain Res. 132 (1), 1-10 (1977).
- Gogan, P., Gueritaud, J. P., Horcholle-Bossavit, G., Tyc-Dumont, S. Direct excitatory interactions between spinal motoneurones of the cat. J Physiol. 272 (3), 755-767 (1977).
- Ichinose, T., Miyata, Y. Recurrent excitation of motoneurons in the isolated spinal cord of newborn rats detected by whole-cell recording. Neurosci Res. 31 (3), 179-187 (1998).
- Lamotte d'Incamps, B., Ascher, P. Four excitatory postsynaptic ionotropic receptors coactivated at the motoneuron-Renshaw cell synapse. J Neurosci. 28 (52), 14121-14131 (2008).
- Renshaw, B. Central effects of centripetal impulses in axons of spinal ventral roots. J Neurophysiol. 9, 191-204 (1946).
- Renshaw, B. Interaction of nerve impulses in the gray matter as a mechanism in central inhibition. Fed Proc. 5 (1 Pt 2), 86 (1946).
- Renshaw, B. Observations on interaction of nerve impulses in the gray matter and on the nature of central inhibition). Am J Physiol. 146, 443-448 (1946).
- Pambo-Pambo, A., Durand, J., Gueritaud, J. P. Early excitability changes in lumbar motoneurons of transgenic SOD1G85R and SOD1G(93A-Low) mice. J Neurophysiol. 102 (6), 3627-3642 (2009).
- Quinlan, K. A., Schuster, J. E., Fu, R., Siddique, T., Heckman, C. J. Altered postnatal maturation of electrical properties in spinal motoneurons in a mouse model of amyotrophic lateral sclerosis. J Physiol. 589 (Pt 9), 2245-2260 (2011).
- Martin, E., Cazenave, W., Cattaert, D., Branchereau, P. Embryonic alteration of motoneuronal morphology induces hyperexcitability in the mouse model of amyotrophic lateral sclerosis. Neurobiol Dis. 54, 116-126 (2013).
- Hadzipasic, M., et al. Selective degeneration of a physiological subtype of spinal motor neuron in mice with SOD1-linked ALS. Proc Natl Acad Sci U S A. 111 (47), 16883-16888 (2014).
- Wichterle, H., Lieberam, I., Porter, J. A., Jessell, T. M. Directed differentiation of embryonic stem cells into motor neurons. Cell. 110 (3), 385-397 (2002).
- Tallini, Y. N., et al. BAC transgenic mice express enhanced green fluorescent protein in central and peripheral cholinergic neurons. Physiol Genomics. 27 (3), 391-397 (2006).
- Manuel, M., et al. Fast kinetics, high-frequency oscillations, and subprimary firing range in adult mouse spinal motoneurons. J Neurosci. 29 (36), 11246-11256 (2009).
- Obeidat, A. Z., Nardelli, P., Powers, R. K., Cope, T. C. Modulation of motoneuron firing by recurrent inhibition in the adult rat in vivo. J Neurophysiol. 112 (9), 2302-2315 (2014).
- Leroy, F., Lamotte d'Incamps, B., Imhoff-Manuel, R. D., Zytnicki, D. Early intrinsic hyperexcitability does not contribute to motoneuron degeneration in amyotrophic lateral sclerosis. Elife. 3, (2014).
- Leroy, F., Lamotte d'Incamps, B., Zytnicki, D. Potassium currents dynamically set the recruitment and firing properties of F-type motoneurons in neonatal mice. J Neurophysiol. 114 (3), 1963-1973 (2015).
- Lamotte d'Incamps, B., Ascher, P. Subunit composition and kinetics of the Renshaw cell heteromeric nicotinic receptors. Biochem Pharmacol. 86 (8), 1114-1121 (2013).
- Lamotte d'Incamps, B., Krejci, E., Ascher, P. Mechanisms shaping the slow nicotinic synaptic current at the motoneuron-renshaw cell synapse. J Neurosci. 32 (24), 8413-8423 (2012).
- Dugue, G. P., Dumoulin, A., Triller, A., Dieudonne, S. Target-dependent use of co-released inhibitory transmitters at central synapses. J Neurosci. 25 (28), 6490-6498 (2005).
- Mentis, G. Z., Siembab, V. C., Zerda, R., O'Donovan, M. J., Alvarez, F. J. Primary afferent synapses on developing and adult Renshaw cells. J Neurosci. 26 (51), 13297-13310 (2006).
- Perry, S., et al. Firing properties of Renshaw cells defined by Chrna2 are modulated by hyperpolarizing and small conductance ion currents Ih and ISK. Eur J Neurosci. 41 (7), 889-900 (2015).
- Thurbon, D., Luscher, H. R., Hofstetter, T., Redman, S. J. Passive electrical properties of ventral horn neurons in rat spinal cord slices. J Neurophysiol. 79 (5), 2485-2502 (1998).
- Zengel, J. E., Reid, S. A., Sypert, G. W., Munson, J. B. Membrane electrical properties and prediction of motor-unit type of medial gastrocnemius motoneurons in the cat. J Neurophysiol. 53 (5), 1323-1344 (1985).
- Cooper, S., Sherington, C. S. Gower's tract and spinal border cells. Brain. 63, 123-124 (1940).
- Morin, F., Schwartz, H. G., O'Leary, J. L. Experimental study of the spinothalamic and related tracts. Acta Psychiatr Neurol Scand. 26 (3-4), 371-396 (1951).
- Sengul, G., Fu, Y., Yu, Y., Paxinos, G. Spinal cord projections to the cerebellum in the mouse. Brain Struct Funct. 220 (5), 2997-3009 (2015).
- Russier, M., Carlier, E., Ankri, N., Fronzaroli, L., Debanne, D. A-, T-, and H-type currents shape intrinsic firing of developing rat abducens motoneurons. J Physiol. 549 (Pt 1), 21-36 (2003).
- Dourado, M., Sargent, P. B. Properties of nicotinic receptors underlying Renshaw cell excitation by alpha-motor neurons in neonatal rat spinal cord). J Neurophysiol. 87 (6), 3117-3125 (2002).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. J Neurophysiol. 107 (2), 728-741 (2012).
- Rothman, S. M. The neurotoxicity of excitatory amino acids is produced by passive chloride influx. J Neurosci. 5 (6), 1483-1489 (1985).
- Olney, J. W., Price, M. T., Samson, L., Labruyere, J. The role of specific ions in glutamate neurotoxicity. Neurosci Lett. 65 (1), 65-71 (1986).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon