Method Article
RNA 결합 단백질의 검출에 의해
Erratum Notice
요약
RNA 풀다운 프로토콜은 RNA 결합 단백질 (RBPs) 및 비 암호화뿐만 아니라 코딩 RNA를 사이의 상호 작용의 검출을 위해 여기에 최적화되어 있습니다. 안드로겐 수용체 (AR)에서 RNA 조각은 차 갈색 지방 세포의 lystate로부터 RBP를 검색하는 방법을 보여주기 위해 예로서 사용되었다.
초록
RNA 결합 단백질 (RBPs)은 지방의 개발 및 기능의 규제 계층으로 부상하고있다. RBPs 대상의 mRNA의 안정성 및 병진 효율에 영향을 미치는하여 전사 후 수준에서 유전자 발현을 조절하는 중요한 역할을한다. RNA 풀다운 기술은 널리기구 RBPs '아니라 긴 비 코딩 RNA를'(lncRNAs) 함수를 기초 해명 할 필요가 RNA - 단백질 상호 작용을 연구하기 위해 사용되었다. 그러나, 지방 세포에서 높은 지질 풍요 로움이 실험 수행에 기술적 인 도전을 포즈. 다음은 자세한 RNA 풀다운 프로토콜은 기본 지방 세포 배양에 최적화되어 있습니다. 안드로겐 수용체의 (AR) 3 '번역되지 않은 지역 지방 세포 lystate에서의 RBP 파트너, 허 단백질을 검색하는 방법을 보여주기 위해 예를 들어 사용되는 아데 닐 - uridylate 풍부한 elementwas를 포함 (3'UTR)에서 RNA 조각. 여기에 설명 된 방법의 상호 작용을 검출하기 위해 적용될 수있다RBPs 및 비 암호화 RNA를,뿐만 아니라 사이 RBPs 및 코딩 RNA를.
서문
RBPs 세포의 이중 또는 단일 가닥 RNA에 결합하여 RNA - 단백질 복합체 형성에 참여하는 단백질이다. RBPs는 mRNA의 긴 비 암호화 RNA를 (lncRNAs)를 포함하는 RNA 종의 다양한 결합 및 전사 후 수준에서 자신의 영향력을 행사할 수있다. 두 RBPs 및 lncRNAs은 지방 개발 등 새로운 규제를 신흥 1,2,3 작동된다. 이 특정 RNA 분자와 하나 이상의 RBPs 사이의 상호 작용을 검출하는 것이 필요는 RBP- 메커니즘 및 세포질 통로의 lncRNA 매개 규제를 이해하고, 때로는 RNA의 단백질 파트너의 전체 스펙트럼을 식별 할 성적 증명서. 그러나, 실험에 의한 지방 세포에서 지질의 높은 함량에 어려울 수있다. 여기에 설명 된 RNA 풀다운 프로토콜 4,5 차 배양 지방 세포의 용 해물에서 특정 RNA의 단백질 파트너를 검색하기 위해 사용될 수있다.
이 프로토에 대한 이론적 근거다음 COL 요약된다. RNA를 미끼는 DNA 주형으로부터 전사 된 시험관에, 비오틴 - 표지 된 스트렙 타비 딘 - 코팅 된 자성 비드 (4)과 공액. RNA를 미끼이어서 자기 스탠드에서 내려 오게되는 RNA 단백질 복합체의 형성을 허용하는 세포 용 해물과 배양된다. 구체적으로는, RNA 풀다운 프로토콜은 후술 허 단백질 일차 배양 theadipocytelysate에서의 mRNA의 3'UTR 6,7 결합 보편적 RBP 발현을 검색 미끼 AR 3'UTR로부터 RNA 단편을 사용한다. 이 분석의 결합 특이성을 테스트하려면, 비 관련 RNAas 아니라 빈 스트렙 타비 딘 비드 제어 포함되어 있습니다. 이 프로토콜은 특정 RBP의 포착을 확인하거나 캡처 RBPs 각각 8의 전체 레퍼토리를 식별하는 웨스턴 블 롯팅 또는 질량 분석기 (MS)와 호환된다.
몇 가지 기술은 RNA 단백질 상호 작용을 연구하는 데 사용할 수 있습니다에스. 주어진 RBP, RIP (RNA의 면역)와 CLIP (UV 가교 및 면역)에 구속 RNA를 공개하기 위해하는 것은 적용 할 수 있습니다. 반대로, 소정의 RNA의 단백질 파트너를 식별하기 위해, RNA 풀다운는 처프 (RNA 정제하여 염색질 분리) CHART (RNA 타겟 캡처 혼성화 분석)와 RAP (RNA 안티센스 정제)에 적용될 수있다. 나중에 사람과 비교하여, RNA 풀다운 기술은 설정하는 작은 노력이 필요합니다. 생체 외 및 생체 내에서 단백질을 포착하기 위해 사용될 수있다. 그 시험관 대응보다 기술적으로 더 도전 RNA 풀다운,의 생체 방법은 세포에서 가교에 의해 RNA 단백질 상호 작용을 유지, 세포로부터 관심의 앱 타머 - 태그 RNA를 캡처하고,이어서 바인딩 RBPs를 감지합니다. RNA 풀다운 낮은 풍부한 RBPs 농축 및 분리 및 세포 조절을 제어 9,10 다양한 기능적 역할이 RNA 단백질 복합체를 식별하기 위해 사용될 수있다 입니다.
프로토콜
참고 :이 연구의 맥락에서 관심의 RNA는 AR 3'UTR의 단편이다.
비오틴 표지 RNA 1. 준비
- RNA를 얻으려면, 상용 키트를 사용하여 제조 업체의 지침 (11)는 다음의 시험 관내 전사 다음 PCR에 의해 T7-AR-올리고을 증폭.
참고 : PCR 프라이머는 표 4에 나열되어 있습니다 : T7-AR-F와 T7-AR-R을. - 비특이적 결합 제어를 들어, 시험 관내 전사 하였다 psiCHECK -2- 플라스미드로부터 PCR에 의해 반딧불 루시페라아제 (FL) DNA의 부분 서열을 증폭.
참고 : PCR 프라이머는 표 4에 나열되어 있습니다 hluc (+) - T7 프로브 F 및 hluc (+) - 프로브-R 표 4 PCR 증폭을위한 템플릿과 프라이머 시퀀스... - 50 ㎕의 PCR 반응에서, 50 ng의의 DNA (올리고 또는 플라스미드)의 4 μL의 dNTPs (각 2.5 mM의 dNTP), 5 ㎕의 10 배 반응 완충액 1 ㎕를 2.5 U / & # 믹스(181), 리터 DNA 중합 효소, 2 μL 10 μm의 정방향 프라이머, 2 μL 10 μm의 역방향 프라이머, 및 뉴 클레아없는 물.
- 다음 프로그램을 사용하여 열 순환기 PCR 증폭을 실행. STEP1 : 2 분, 95 ℃ 1주기; STEP2 : 30 초 동안 95 ° C의 35주기, 30 초 동안 55 ° C 및 30 초 (AR) 또는 60 초 (FL) 72 ° C; STEP3 : 10 분 동안 72 ℃에서 1주기.
- 제조업체의 지침 11 다음 시험 관내 전사 키트를 사용하여 바이오틴의 RNA를 합성. 이 실험에서는, RNA 합성 템플릿으로 PCR 제품을 사용한다. 20 ㎕의 시험 관내 전사 반응에 200 ng를 PCR 증폭 된 DNA, 각 NTP 2 μL, 1 ㎕의 10 mM이 비오틴 CTP-2 배 μL 반응 완충액, 2 μL의 T7 RNA 폴리머 라제를 혼합한다. 4 시간 동안 37 ℃에서 혼합물을 인큐베이션.
- 37 & #에서 시험 관내 전사, 1 μL 2 U / μL DNase의와 치료 반응 혼합물에 따라(176), C 15 분 주형 DNA를 분해합니다. 마지막으로, 이후의 정제하여 60 ㎕의 총 부피로 오티 닐화 RNA 희석.
- 제조업체의 지침 12 다음 정화 열을 사용하여 염 및 비법 인 세포핵을 제거하기 위해 비오틴 RNA를 정화. 다음 풀다운 분석을 위해 -80 ° C에서 RNA 농도 및 저장을 측정합니다.
- 2 분, 2 분 동안 얼음에 진정 90 ° C에서 RNA 단백질 상호 작용, 열 50 μL 비오틴 RNA (50 PM)에 대한 관심의 RNA에 대한 적절한 이차 구조를 보장하기 위해, 다음 50 μl의 2 배 RNA 구조 버퍼 (표와 공급 3), 13, 14 및 30 분 동안 실온에서 접는 RNA 허용한다.
RNA 접합 비즈 2. 준비
참고 : 자기 구슬과 상등액의 분리 자기 스탠드를 사용합니다.
- 간단한 vorte하여 원래 바이알의 스트렙 타비 딘 - 코팅 된 자성 비드를 재현 탁싱은 제조업체의 지침에 따라. 1.5 ML 튜브에 비즈를 재현 탁 150 μl를 전송합니다. 1 분 동안 자석에 튜브를 놓습니다. 폐기 뜨는. 비드 펠렛을 유지합니다.
참고 : RNA 풀다운 분석에서, 원래 유리 병에서 재현 탁 구슬을 분취 때, MS 다음에 분석을 위해 서부 블롯 다음에 분석을 위해 50 μl의 구슬, 200 μl의 구슬을 사용합니다. - 다시 현탁 제조자의 권장 1X W 및 B의 1 ml의 비드 펠렛 (결합 및 세척) 완충액 (표 3)에 의해 회 비드 워시 회전기에 실온에서 5 분 동안 튜브를 회전 하였다. 폐기 뜨는. 비드 펠렛을 유지합니다.
- 400 ㎕의 완충액 A의 완충액 A로 비드 펠렛을 재 - 현탁하여마다, 구슬의 RNase 불 활성화 회 비드 씻어 0.1 M NaOH를 0.05 M의 NaCl (표 3)를 함유하는 알칼리성 용액이다. 회 전자에서 실온에서 2 분 동안 튜브를 돌린다. 폐기 뜨는. 비드 펠렛을 유지합니다. <리> 회전기 실온에서 2 분 동안 튜브를 회전 뒤에 다시 현탁 400 ㎕의 완충액 B로 비드 펠렛 (표 3)에 의해 회 비드 씻어 비즈마다 NaOH를 제거한다. 폐기 뜨는. 비드 펠렛을 유지합니다.
- 300 ㎕의 2 배 W & B 버퍼를 Resuspend 비드 펠렛, 분할 구슬 똑같이 세 1.5 ml의 튜브 (튜브 당 100 μl의 구슬)로 전송합니다. 100 μL의 RNase없는 물과 비드 함유 공급 튜브 100 μL는 FL의 RNA 각각 AR 3'UTR RNA 바이오틴 100 μL를 비 오티 닐화.
- 회전을 실온에서 1 시간 동안 각 비드 혼합물을 인큐베이션. 1 분 동안 자석에 튜브를 놓습니다. 모든 상층 액을 버린다. 비드 펠렛을 유지합니다.
- 400 ㎕의 1X W 및 B 버퍼 각각 비드 펠렛을 다시 현탁 회마다 비드를 세척 회전기에 실온에서 5 분 동안 튜브를 회전 하였다.
- 1 분 동안 자석에 튜브를 놓습니다. 모든 상층 액을 버린다. 각 비드 PELLE를 재현 탁50 μl의 핵 분리 버퍼 (표 3)와 t.
3. 지방 전구 세포의 분리 및 지방 생성 유도
- 이전 서적 5에 기재된 바와 같이, 견갑골 갈색 지방 패드로부터 전구 지방 세포 (C57BL6 야생형 마우스, 3 주)를 해부.
- 성장과 체외에서 전구 지방 세포 (5) 차별화. 세포는 4~5일 분화 개시 후 다운 스트림 응용 프로그램에 대한 준비가되어 있습니다.
차 지방 세포에서 세포 용 해물 4. 준비
주 : 파쇄 제제의 모든 절차를 확인 얼음에 만들어진 모든 버퍼 얼음에 냉각된다. 얼음 사전 냉각 다운스 유리 균질.
- 성장과 15cm 요리 (5) (3.2 절 참조) 전구 지방 세포를 분화. 각각의 요리는 하나의 RNA 풀다운 분석을위한 충분한 세포를 제공한다. 일 4 분화 폐기 세포 배양액 일 5, 세탁에서 CE한 번 1X PBS와 LLS.
- RT에서 5 분 200 XG에서 원심 분리하여 50 ML 튜브에 세포 및 펠렛 세포를 수집 긁어, 세포를 수확 세포에 10 ~ 15 ㎖의 1X PBS를 추가합니다. 1 ML의 피펫을 이용하여 상층 액을 버린다.
- 재현 탁 셀이 용액에 펠릿 저장성 완충액 (표 3), 및 15 분 동안 얼음 위에서 세포를 배양한다. 전송 15 ml의 다운스 유리 균질에 세포 및 기계적으로 얼음에 20 스트로크와 전단 세포.
- 4 ° C에서 15 분 동안 3,300 XG에 원심 분리하여 펠렛은 세포 핵. 더 사용하기 위해 얼음에 핵 펠렛을 유지 (섹션 4.6 참조). 1.5 ml의 튜브에 뜨는을 전송, 4 ℃에서 15 분 동안 20,000 XG에서 최종 150 mm의 농도와 스핀을 얻을 수 뜨는하는 3M의 KCl을 추가합니다.
- 원심 분리 후, 조심스럽게 1 ml를 피펫을 사용하여 상단 lipidlayeron 제거하고 세포질 세포 용 해물로 뜨는를 수집합니다.
- 핵 펠렛을 재현 탁 1 ml의 핵 분리 버퍼 (4.4 절 참조). 티를 ransfer의 1 ML의 피펫을 사용하여 15 ml의 다운스 유리 균질에 핵, 기계적으로 100 스트로크와 얼음에 전단 핵. 4 ° C에서 15 분 동안 20,000 XG에서 원심 분리하여 핵 파편 펠렛, 핵 세포 용 해물로 뜨는를 수집합니다.
- 어느 쪽의 핵 및 세포질 세포 용 해물을 결합, 또는 다운 스트림 풀다운 응용 프로그램에 대해 개별적으로 각 부분을 사용합니다. 데모 실험에서, 세포 용 해물이 두 분획 1의 부피비로 혼합 하였다 1.
- 0.5 U / μL의 최종 농도를 얻기 위해,이 분획을 세포 용 해물의 RNase 억제제를 추가한다. 웨스턴 블롯 (15)의 입력 컨트롤로 세포 용 해물의 옆 100 μl를 설정합니다.
5. 바인딩 및 RBP의 용출
- 분할 셀 세 동일한 분취 량에 해물 (1.5 ML 튜브에 1 ㎖의 세포 용 해물), 빈과 부화는 FL RNA 접합 및 AR 3'UTR RNA 접합 비즈는 4 °에서 3 시간 동안 각각 (섹션 2.8 참조) 기음회전.
- 1 분 동안 자석에 튜브를 놓습니다. RNA의 완전성을 확인하기 위해 상층 액에서 RNA 분리에 이어 1 ml를 피펫을 이용하여 상층 액을 수집합니다. 제조자의 지시 (표 2) 다음 산 구 아니 디늄 티오 시아 네이트 - 페놀 용액을 이용하여 RNA를 분리. 리보좀 RNA의 28S 및 18S 서브 유니트를 분석해서 RNA의 intactness 평가. 얼음에 비드 펠렛을 유지합니다.
- 회 전자에서 실온에서 2 분 동안 튜브를 회전이어서 40 U의 RNase 억제제 및 0.25 % IGEPAL를 함유 한 용액의 핵 차단 완충액으로 각 비드 펠렛을 재현 탁하여 자성 비드 여섯 번마다 세척 하였다. 자기 구슬과 상층 액의 분리를위한 자기 스탠드를 사용합니다. 모든 상층 액을 버린다. 얼음에 비드 펠렛을 유지합니다.
- 웨스턴 블로 팅을위한 비즈에서 RNA 단백질 복합체를 용출 다음 단계를 사용하십시오. 먼저, 75 μL 핵 분리 버퍼의 각 비드 펠렛을 재현 탁; 다음, 25 ㎕의 4 배 웨스턴 블롯 로딩 버피를 추가FER은 (SDS 함유) 100 μl의 총 부피를 얻었다. 마지막 5 분 동안 95 ℃에서 100 μL이 용액에 비드를 끓인다.
참고 : 사용이 단계는 MS에 대한 비즈에서 RNA 단백질 복합체를 용출 다음과 같습니다. STEP1 : 100 μL 용출 버퍼 (표 3)의 각 비드 펠렛을 재현 탁; STEP2는 : 회전 실온에서 2 ~ 3 시간 동안 비드 샘플을 품어; STEP3 : 원심 분리기와 단백질 함유 상층 액을 수집; STEP4는 : MS에 제출하기 전에 20 ~ 30 μL에 단백질 솔루션을 집중한다. - 원심 분리기는 각각 100 4 ° C에서 30 초 동안 12,000 XG에 비드 샘플의 μL, 그리고 상층 액을 수집합니다. 웨스턴 블롯 분석 (섹션 6.1 및 6.2 참조) 나누어지는 15 μl의 상층 액. 하룻밤 (1000 희석 1) 희석 허 마우스 단일 클론 항체로 인한 막 프로브.
RBP의 검증 6. 웨스턴 블로 팅
- 표준 기술을 이용하여 SDS-PAGE에 의해 분리 RBPs.
- 우리를 실시선미 관심의 RNA와 관련된 RBPs에 대한 프로빙에 의해 표준 기술을 사용하여 블로 팅.
주 :이 데모 실험에서 허 마우스 모노클로 날 항체 허 단백질의 면역 검출에 사용되었다. - 희석 허 항체 생성 된 막 품어 : w / V의 탈지 분유, 1 배 TBS 5 % (1 천 희석) 0.1 % 트윈 - 20 (4)에서 하룻밤, 부드러운 진탕 C를 °. 1X TBST로 막 세 번 씻으십시오. 1 시간 동안 실온에서 (항 - 마우스 IgG-HRP 염소) 이차 항체와 함께 막을 인큐베이션. 워시 막. 개발 및 기록 신호.
결과
데모 실험에서, AR RNA 단편은 결합 단백질 허 캡처 미끼로서 사용 하였다. 모두 허 단백질 비 관련있는 플로리다 RNA 미끼 및 접합 빈 스트렙 타비 딘 비드의 분취 량은 부정적인 컨트롤을 제공합니다. RNA - 단백질 상호 작용은 핵 또는 세포질 중 발생할 수 있으며,이 풀다운 프로토콜 또는 총 분획 (핵 또는 세포질) 세포 용 해물 중 하나에 적용될 수있다. 웨스턴 블로 팅에 의한 단백질의 분석은 15 μl의 미분 획 세포 용 해물의 샘플이없는 구슬 입력 컨트롤로, 허 단백질을 사용하여 마우스 차 문화의 지방 세포 용 해물에서 검출 된 것을 나타내는, 긍정적 인 결과를 준, (섹션 4.8 참조)를 보여줍니다 단일 클론 항체. 아칸소 RNA 용출 분획 허 단백질은 RNA 풀다운 검정에 대한 AR RNA 접합 비드를 이용하여 지방 세포 용 해물에서 검출되었음을 나타내는 긍정적 인 결과를 주었다. FL RNA 용출 분획 및 B 둘여윈 비드 샘플뿐만 아니라 빈 구슬과 훌 단백질과 같은, FL의 RNA 조각과 훌 단백질 사이의 비특이적 상호 작용을 나타내는이 RNA 풀다운 방식에 의해 검출되지 않으며, 부정적인 결과를 주었다. 두 음성 대조군의 결과는 또한 AR의 RNA 단편과 훌 단백질 간의 특이 적 상호 작용을 성공적으로 여기에 설명 된 RNA 풀다운 프로토콜에 의해 검출되는 것을 나타낸다.
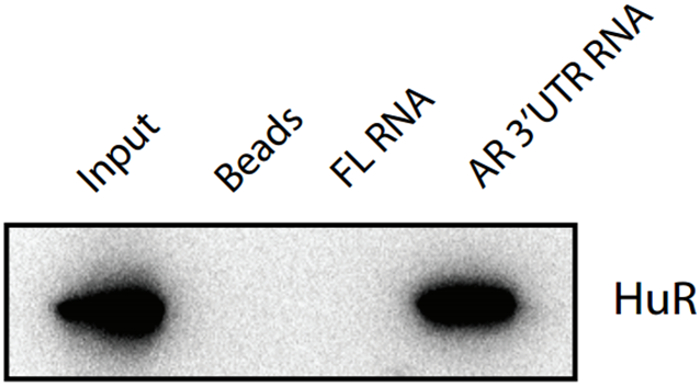
그림 1 : 허의 서쪽 오점 검증은 RNA 풀 다운 분석 실험에 의해 캡처 입력 : 재구성 세포 용 해물 (세포질 + 핵 해물). 비즈 : 빈 스트렙 타비 딘 - 코팅 자석 구슬에서 샘플; FL의 RNA 다음 FL의 mRNA와 결합 된 스트렙 타비 딘 구슬; AR 3'UTR RNA 다음 AR 3'UTR의 mRNA와 결합 된 스트렙 타비 딘 구슬; 일차 항체 : 허 마우스 모노클로 날 항체; 차 항체 : 염소 항의 IgG-HRP를 - 마우스; 약어, FL : 반딧불 루시 페라 제, AR : 안드로겐 수용체, 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 원심 분리기 |
| 열 자전거 타는 사람 |
| 분광 광도계 |
| 회선 근 |
| 단백질 겔 전기 영동 장치 및 블롯 |
| 자석 |
표 1 : 본 연구에 사용 된 주요 장비 본 연구에 사용 된 주요 장비..
| 시험 관내 전사 키트 |
| 바이오틴 RNA |
| DNA와 RNA 조각의 복구에 열을 스핀 |
| 스트렙 타비 딘 자석 구슬 |
| 허 마우스 단일 클론 항체 |
| 염소 항 - 마우스 IgG-HRP |
| 클레아없는 분자 생물학 등급 물 |
| 인산염 완충 생리 식염수 |
| 의 RNase 억제제 |
| 프로테아제 억제제 |
| 의 Pfu DNA 폴리머 라제 |
| 산성 구 아니 디늄 티오 시아 네이트 - 페놀 용액 |
표 2 : 본 연구에 사용 된 주요 시약이 연구에 사용 된 주요 시약..
| 배 RNA 구조 버퍼 |
| 20 mM 트리스 - 염산 (pH를 7.4) |
| 0.2 M KCl을 |
| 20 mM의 MgCl2를 |
| 2 mM의 DTT |
| 0.8 U / μL의 RNase 억제제 |
| 완충액 A |
| 0.1 M NaOH를 |
| 0.05 M 염화나트륨 |
| 버퍼 B |
| 0.1 M의 NaCl |
| 1 배 W & B (바인딩 및 세척) 버퍼 |
| 5 mM 트리스 - 염산 (pH 7.4로) |
| 1 M의 NaCl |
| 1 배 저압 성 버퍼 |
| 10 mM 트리스 - 염산 (pH를 7.4) |
| 10 밀리미터의 KCl |
| 2 밀리미터의 MgCl2 |
| 1 mM의 DTT |
| 1 ㎜ PMSF |
| 1X 프로테아제 억제제 |
| 1X 핵 분리 버퍼 |
| 25 mM 트리스 - 염산 (산도 7.4) |
| 150 밀리미터의 KCl |
| 2 밀리미터의 MgCl2 |
| 1 mM의 DTT |
| 0.5 % IGEPAL (또는 0.25 % RBPs의 용출에 대한 IGEPAL) |
| 1 ㎜ PMSF |
| 1X 프로테아제 억제제 |
| 0.4 U / μL의 RNase 억제제 (40 U / ㎖의 RNase 억제제 RBPs의 용출을위한) |
| 1 배 용출 버퍼 |
| 1X PBS에서 2 MM의 비오틴 |
. 표 3 : 본 연구에 사용 된 주요 솔루션 배 RNA 구조 버퍼 (1.7 절 참조) A (참조 섹션 2.3) 버퍼; 버퍼 B (2.4 절 참조) 1 배 W & B은 (바인딩 및 세척) 버퍼 (섹션 2.2, 2.5, 2.7 참조) 1 배 저압 성 버퍼 (4.3 절 참조) 1 배 원자력 분리 버퍼 (5.4 섹션 2.8, 4.6, 5.3 참조) 1 배 용출 버퍼 (주 다음 섹션 5.4 참조).
> "법이지 템플릿 및 프라이머 시퀀스 T7-AR-올리고 5'-TCT AAT ACG ACT CAC TAT AGG GCT GGG CTT TTT TTT TCT CTT TCT CTC CTT TCT TTT TCT TCT TCC CTC CCT AGC TTA TGA CCG TGG CAG TCT -3 ' T7-AR-F 5'-CTA ATA CGA CTC ACT ATA G -3 ' T7-AR-R 5'-AGA CTG CCA CGG TCA TAA GC -3 ' hluc (+) - 프로브 T7-F 5'-TAATACGACTCACTATAGGGAGCCCCTGCTAACGACATTTACAACGAG-3 ' hluc (+) - 프로브-R 5'-CATAATCATAGGGCCGCGCACACAC-3 '표 4 : 템플릿의 시퀀스 및 PCR 증폭 T7-AR-올리고 프라이머 :. PCR 증폭을위한 DNA 템플릿 (섹션 1 참조.1); T7-AR-F : PCR 증폭 (섹션 1.1 참조) 정방향 프라이머; T7-AR-R은 : PCR 증폭 (섹션 1.1 참조) 프라이머를 역방향 hluc (+) - T7 프로브 F : PCR 증폭 앞으로 프라이머 (1.2 절 참조) hluc (+) - 프로브-R : PCR 증폭 (1.2 절 참조) 역방향 프라이머.
토론
lncRNAs 및 RBPs 그러나 이러한 분자의 분자 메커니즘을 제대로 이해, 건강과 질병에 중요한 역할을합니다. lncRNA 분자와 상호 작용하는 단백질의 식별 규제 메커니즘을 해명을 향한 중요한 단계입니다. RNA의 풀다운 분석 시스템에 의한 RBPs의 보충은 세포 용 해물로부터 단백질을 선택적 스트렙 자성 비드에 결합 된 비오틴 RNA 베이트를 사용하여 추출 될 수 있도록 복잡한 상호 작용의 인 용액 캡쳐에 기초한다. 이러한 처프, 도표 및 RAP와 같은 여러 가지 다른 방법 그러나 이러한 방법은 RNA 풀다운 기술 16,17,18보다 설정에 더 많은 노력이 필요합니다, 같은 목표를 달성 할 수있다.
RNA 풀다운의 주요 장점은 비교적 간단한 프로토콜을 수행하기 쉬운 점이다. 두 CHIRP와 RAP RNA는 단백질 복합체 및 안티센스 올리고 뉴클레오티드의 전체 세트의 설계를 자연적으로 보존하는 가교 공정을 포함하는 (90 nuclenucleotides 같이 긴 RAP에서, 20 뉴클레오티드 긴 짹짹에서) 전체 대상 RNA 16,17,18을 바둑판 식 배열. RNA 접힘은 RNA 풀다운 분석에서 중요한 단계이다. 이 프로토콜의 주요 한계는 표적 RNA를 시험 관내에서 합성하고 올바르게 RBP (들)과 결합하도록 적절한 기본 구조로 절첩되지 않을 수도 있다는 것이다. 미스 폴딩 비 네이티브의 RNA는 nonphysiological 조건에서 시험 관내에서 발생 기능 분석, 또는 형태의 상호 작용을 RNA 단백질 상호 작용을 형성하고 무효화되지 않을 수 있습니다 중 하나. 여기에 설명 된 풀 - 다운 프로토콜 13,14 접는 RNA에 대해 잘 인식 과정을 채택 비록 다른 RNA 전 사체를위한 적절한 폴딩을 보장하지 않는다, (섹션 1.7 참조).
RNA 풀다운 종종 관심 19 RBP가 결합 된 RNA (들)을 검출하기 위해 상보적인 방식으로 RIP에 결합된다. 이 프로토콜의 또 다른 중요한 단계는 총 세포에서 지질 분획의 제거이며해물 (4.5 절 참조) 성숙 지방 세포에서 높은 지질 풍부 주요 기술적 과제를 제시하기 때문이다. 여기에 설명 된 프로토콜은 특히 지방 세포와 함께 사용하기 위해 개발된다. 그러나,이 프로토콜에서 사용되는 모든 버퍼의 엄격함의 기본적인 구성 요소는 변경 및 기타 세포 배양 모델에 적용하도록 구성 될 수있다. 내인성의 RNase 높은 수준이 조직은 다른 RNA 풀다운 프로토콜이 적용될 수있다.
관련 RBPs를 식별하는 관심의 RNA를 사용하여 RNA 풀다운는 인간 세포의 역할이 광범위가 lncRNAs의 중요한 기능 메커니즘을 조사하기위한 효과적이고 효율적인 기술이다. RNA 풀다운 포함한 RNA 기반 캡처 향후 개발은 부품 조립 및 RNA 단백질 복합체의 함수를 정의뿐만 아니라 MS 낮은 풍부한 RNA 단백질 복합체로부터 충분한 RBPs 발생으로 문제를 해결하기 위해 필요하다.
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 작품은 싱가포르 NRF의 교제 (NRF-2011NRF - NRFF001-025)뿐만 아니라 CBRG (NMRC / CBRG가 / 0070 / 2014)에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| Major materials used in this study. | |||
| MEGAscript kit | Ambion | ||
| Biotin-14-CTP | Invitrogen | ||
| NucAway spin columns | Ambion | ||
| Dynabeads M-280 Streptavidin | Invitrogen | ||
| HuR (3A2) mouse monoclonal antibody (sc-5261) | Santa Cruz Biotechnology | ||
| Goat anti-mouse IgG-HRP(sc-2005) | Santa Cruz Biotechnology | ||
| Hypure Molecular Biology Grade Water (nuclease-free) | HyClone | ||
| Phosphate Buffer Saline (1×PBS) | HyClone | ||
| RNase inhibitor | Bioline | ||
| Protease inhibitor | Sigma | ||
| Pfu Turbo DNA polymerase | Agilent Technologies | ||
| TRIsure | Bioline | ||
| Name | Company | Catalog Number | Comments |
| Major equipment used in this study. | |||
| Sorvall Legend Micro 21R centrifuge | Thermo Scientific | ||
| Sorvall Legend X1R centrifuge | Thermo Scientific | ||
| Bio-Rad T100 thermal cycler | Bio-Rad | ||
| Nanodrop 2000 | Thermo Scientific | ||
| BOECO rotator Multi Bio RS-24 | BOECO,Germany | ||
| Protein gel electrophoresis and blotting apparatus | Bio-Rad | ||
| DynaMag-2 magnet | Life Technologies |
참고문헌
- Huot, M. &. #. 2. 0. 1. ;., et al. The Sam68 STAR RNA-binding protein regulates mTOR alternative splicing during adipogenesis. Mol Cell. 46 (2), 187-199 (2012).
- Sun, L., et al. Long noncoding RNAs regulate adipogenesis. Proc Natl Acad Sci U S A. 110 (9), 3387-3392 (2013).
- Engreitz, J. M., et al. The Xist lncRNA exploits three-dimensional genome architecture to spread across the X-chromosome. Science. 341 (6147), 1237973 (2013).
- Zhao, X. Y., Li, S., Wang, G. X., Yu, Q., Lin, J. D. A long noncoding RNA transcriptional regulatory circuit drives thermogenic adipocyte differentiation. Mol Cell. 55, 372-382 (2014).
- Alvarez-Dominguez, J. R., et al. De novo reconstruction of adipose tissue transcriptomes reveals long non-coding RNA regulators of brown adipocyte development. Cell Metab. 21, 764-776 (2015).
- Adams, D. J., Beveridge, D. J., van der Weyden, L., Mangs, H., Leedman, P. J., Morris, B. J. HADHB, HuR, and CP1 bind to the distal 3-untranslated region of human renin mRNA and differentially modulate renin expression. J Biol Chem. 278 (45), 44894-44903 (2003).
- Yeap, B. B., et al. Novel binding of HuR and poly(C)-binding protein to a conserved UC-rich motif within the 3´ untranslated region of the androgen receptor messenger RNA. J Biol Chem. 277, 27183-27192 (2002).
- König, J., Zarnack, K., Luscombe, N. M., Ule, J. Protein-RNA interactions: new genomic technologies and perspectives. Nat Rev Genet. 13, 77-83 (2012).
- Ferrè, F., Colantoni, A., Helmer-Citterich, M. Revealing protein-lncRNA interaction. Briefings in Bioinformatics. , 1-11 (2015).
- McHugh, C. A., Russell, P., Guttman, M. Methods for comprehensive experimental identification of RNA-protein interactions. Genome Biol. 15 (1), 203 (2014).
- Lee, Y. S., et al. AU-rich element-binding protein negatively regulates CCAAT enhancer binding protein mRNA stability during long term synaptic plasticity in Aplysia. Proc Natl Acad Sci U S A. 109 (38), 15520-15525 (2012).
- Hermann, M., Cermak, T., Voytas, D. F., Pelczar, P. Mouse genome engineering using designer nucleases. J Vis Exp. (86), (2014).
- Tsai, M. C., et al. Long Noncoding RNA as Modular Scaffold of Histone Modification Complexes. Science. 329 (5992), 689-693 (2010).
- Wan, Y., et al. Landscape and variation of RNA secondary structure across the human transcriptome. Nature. 505, 706-709 (2014).
- Li, H., et al. Identification of mRNA binding proteins that regulate the stability of LDL receptor mRNA through AU rich elements. J Lipid Res. 50 (5), 820-831 (2009).
- McHugh, C. A., et al. The Xist lncRNA interacts directly with SHARP to silence transcription through HDAC3. Nature. 521 (7551), 232-236 (2015).
- Chu, C., et al. Systematic Discovery of Xist RNA Binding Proteins. Cell. 161 (2), 404-416 (2015).
- Chu, C., Spitale, R. C., Chang, H. Y. Technologies to probe functions and mechanisms of long noncoding RNAs. Nat Struct Mol Biol. 22 (1), 29-35 (2015).
- Zhao, J., et al. Genome-wide identification of Polycomb-associated RNAs by RIP-seq. Mol Cell. 40 (6), 939-953 (2010).
Erratum
Formal Correction: Erratum: Detection of RNA-binding Proteins by In Vitro RNA Pull-down in Adipocyte Culture
Posted by JoVE Editors on 8/20/2016. Citeable Link.
A correction to the author list was made to: Detection of RNA-binding Proteins by In Vitro RNA Pull-down in Adipocyte Culture.
The author list has been updated from:
Qianfan Bai1*, Zhiqiang Bai1*, Lei Sun1,2
1Cardiovascular and Metabolic Disorders Program, Duke-NUS Medical School
2Institute of Molecular and Cell Biology, Singapore
*These authors contributed equally
to:
Qianfan Bai1*, Zhiqiang Bai1*, Shaohai Xu3, Lei Sun1,2
1Cardiovascular and Metabolic Disorders Program, Duke-NUS Medical School
2Institute of Molecular and Cell Biology, Singapore
3Division of Bioengineering, School of Chemical & Biomedical Engineering, Nanyang Technological University
*These authors contributed equally
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유
당사 웹 사이트에서는 사용자의 경험을 향상시키기 위해 쿠키를 사용합니다.
당사 웹 사이트를 계속 사용하거나 '계속'을 클릭하는 것은 당사 쿠키 수락에 동의하는 것을 의미합니다.