Method Article
RNA結合タンパク質の検出によって、
要約
RNAプルダウンプロトコルは、RNA結合タンパク質(RBPs)および非コードだけでなく、コーディングRNA間の相互作用の検出のためにここに最適化されています。アンドロゲン受容体(AR)からのRNA断片は、一次褐色脂肪細胞のlystateから、そのRBPを取得する方法を示すために例として使用しました。
要約
RNA結合タンパク質(RBPs)は、脂肪の発達と機能における規制層として浮上しています。 RBPsは、標的mRNAの安定性および翻訳効率に影響を与えることにより、転写後レベルでの遺伝子発現の調節において重要な役割を果たす。 RNAプルダウン技術が広く機構RBPs 'ならびに長い非コードRNA」(lncRNAs)機能の根底に解明する必要があるRNA-タンパク質相互作用を研究するために使用されています。しかし、脂肪細胞における高脂質存在量は、この実験を行う際の技術的な課題を提起します。ここで詳細なRNAプルダウンプロトコールは、一次脂肪細胞の培養のために最適化されています。脂肪細胞lystateからアデニル酸ウリジル酸が豊富な、そのRBPパートナーを取得する方法を示すために例として使用elementwas、HuRのタンパク質を含むアンドロゲン受容体の(AR)3 '非翻訳領域(3'UTR)からのRNA断片。ここで説明する方法は、間の相互作用を検出するために適用することができますRBPsおよび非コードRNA、ならびに間RBPsとコーディングRNA。
概要
RBPsは、細胞内で二本鎖または一本鎖RNAに結合し、RNA-タンパク質複合体の形成に関与するタンパク質です。 RBPsは、mRNAと長い非コードRNA(lncRNAs)を含むRNA種の多様性を結合し、転写後のレベルで自分の影響力を発揮することができます。 RBPsとlncRNAsの両方が脂肪の発達と機能1,2,3における新規調節因子として浮上しています。細胞経路のRBP-とlncRNA媒介調節のメカニズムを理解するためには、RNAのタンパク質パートナーの完全なスペクトルを識別するために、時々、特定のRNA分子および1つまたはいくつかのRBPsの間の相互作用を検出することがしばしば必要であり、かつ転写産物。しかし、実験が原因脂肪細胞中の脂質の含有量が高いに挑戦することができます。ここで説明するRNAプルダウンプロトコルは、初代培養4,5の脂肪細胞溶解物から特定 のRNAのタンパク質パートナーを取得するために使用することができます。
このプロトの根拠次のようにcolが要約されています。 RNAの餌は、DNAテンプレートから転写された試験管 、ビオチン標識したストレプトアビジンをコーティングした磁気ビーズ4に共役です 。 RNAの餌は、その後、磁気スタンド上にプルダウンされているRNA-タンパク質複合体の形成を可能にするために、細胞溶解物と共にインキュベートします。具体的には、RNAプルダウンプロトコルは、以下に記載のHuRタンパク質、初代培養のtheadipocytelysateから、mRNAを6,7の3'UTRに結合された普遍的に発現RBPを取得するために餌としてAR 3'UTRからRNA断片を使用します。このアッセイの結合特異性を試験するために、非関連RNAasだけでなく、空白のストレプトアビジンビーズを対照として含まれています。このプロトコルは、特定のRBPのキャプチャを確認したり、撮影しRBPs、それぞれ8の完全なレパートリーを識別するために、ウエスタンブロッティングまたは質量分析法(MS)と互換性があります。
いくつかの技術は、RNA-タンパク質相互作用を研究するために利用可能です秒。所与RBPによって拘束RNAを明らかにするために、RIP(RNA免疫沈降)及びCLIP(UV架橋及び免疫沈降)を適用することができます。対照的に、与えられたRNA、RNAプルダウン、チャープ(RNA精製によってクロマチン分離)、グラフ(RNA標的の捕獲ハイブリダイゼーション分析)のタンパク質パートナーを識別し、RAP(RNAアンチセンス精製)を適用することができます。それ以降のものと比較して、RNAプルダウン技術が設定する労力がかかります。 in vitroおよびin vivoでタンパク質を捕捉するために使用することができます。技術的に困難なそのin vitro対応物よりもRNAプルダウンのインビボでのアプローチは、細胞内で架橋することによりRNA-タンパク質相互作用を維持し、細胞からの目的のアプタマータグ付きRNAを捕捉し、その後、結合したRBPsを検出します。 RNAプルダウンは低豊富RBPsを濃縮するために使用することができ、細胞調節9,10を制御することで、多様な機能的役割を有するRNA-タンパク質複合体を単離し、同定するためにアップ。
プロトコル
注:この研究の文脈で目的のRNAは、AR 3'UTRの断片です。
ビオチン標識RNAの調製
- RNAを得るために、市販のキットを用い、製造業者の指示11を以下のインビトロ転写に続いて、PCRによってT7-AR-オリゴを増幅します。
注:PCR用プライマーは、表4に記載されています:T7-AR-FおよびT7-AR-R。 - 非特異的結合を制御するために、 インビトロ転写、続いpsiCHECK-2プラスミドからPCRによってホタルルシフェラーゼ(FL)、DNAの部分配列を増幅します。
注:PCR用プライマーは、表4に記載されています:hluc(+) - T7-プローブ-Fとhluc(+) -プローブ-R 表4 PCR増幅のための鋳型とプライマーの配列。。。 - 50μlのPCR反応のために、50 ngのDNAを(オリゴまたはプラスミド)を混ぜて、4μlのdNTPを(各個々のdNTP 2.5 mMの)、5μlの10×反応緩衝液、1μlの2.5 U /µリットルのDNAポリメラーゼ、2μlの10μMのフォワードプライマー、2μlの10μMのリバースプライマー、およびヌクレアーゼフリー水。
- 以下のプログラムを使用して、サーマルサイクラーでのPCR増幅を実行します。 STEP1:2分間95℃での一回; STEP2:30秒(AR)または60秒(FL)のための30秒、72℃30秒間、95℃の35サイクル、55°C; STEP3:10分間72℃での一回。
- 製造元の説明書11以下のin vitro転写キットを用いてビオチン化RNAを合成します。この実験では、RNA合成のための鋳型としてPCR産物を使用します。 20μlのin vitro転写反応のために、200 ngのPCR増幅されたDNAは、各個々のNTPの2μlを、1μlの10mMのビオチンCTP、2μlの10×反応緩衝液、および2μlのT7 RNAポリメラーゼを混ぜます。 4時間37℃で混合物をインキュベートします。
- インビトロ転写に続いて、37#で1μlの2 U /μlのDNaseで反応混合物を処理176; Cは、15分間鋳型DNAを分解する。最後に、その後の精製のために60μlの総体積にビオチン化RNAを希釈します。
- 製造業者の説明書12以下の精製カラムを用いて、塩および取り込まれなかったヌクレオチドを除去するために、ビオチン化RNAを精製します。その後のプルダウンアッセイのために-80℃でRNA濃度とストアを測定します。
- 2分、2分間氷上で寒さのために90℃でRNA-タンパク質相互作用、熱50μlのビオチン化RNA(50 PM)への関心のRNAのための適切な二次構造を確保するために、その後、50μlの2倍のRNA構造のバッファ( 表と供給3)30分13,14 RTで折りたたみRNAを可能にします。
RNA結合ビーズの調製
注:磁気ビーズと上清を分離するための磁気スタンドを使用してください。
- 簡単なvorteによって、元のバイアル中のストレプトアビジンでコーティングした磁気ビーズを再懸濁し製造者の指示に従って興。 1.5mlチューブにビーズを再懸濁し、150μlのを転送します。 1分間磁石上にチューブを置きます。上清を捨てます。ビーズペレットを保管してください。
注:RNAプルダウンアッセイでは、元のバイアルから再懸濁ビーズを分取、MSが続くアッセイのためにウェスタンブロッティングに続いて、アッセイのための50μlのビーズ、および200μlのビーズを使用します。 - 再懸 濁し、製造元の推奨1xのW&Bの1mlでビーズペレットを(結合および洗浄)バッファー( 表3)によって一度ビーズを洗浄し、ローテーターで、室温で5分間チューブを回転させることによって行いました。上清を捨てます。ビーズペレットを保管してください。
- 400μlの緩衝液A緩衝液Aでビーズペレットを再懸濁することにより、毎回、ビーズ上のRNaseを不活化二回ビーズを洗浄するには、0.1M NaOHおよび0.05 M NaClを( 表3)を含むアルカリ性溶液です。ローテーターで、室温で2分間チューブを回転させます。上清を捨てます。ビーズペレットを保管してください。 <李>は回転子に室温で2分間、チューブを回転させることで、その後再懸濁し、400μlの緩衝液Bでビーズペレットを( 表3)、によって、二回ビーズを洗浄し、ビーズから毎回のNaOHを削除します。上清を捨てます。ビーズペレットを保管してください。
- 300μlの2倍のW&B緩衝液で再懸濁ビーズペレットは、スプリットビーズ均等と3 1.5ミリリットルのチューブ(チューブあたり100μlのビーズ)に移します。 100μlのRNaseフリー水でビーズを含有するチューブを供給し、FLのRNAとそれぞれ、AR 3'UTR RNAをビオチン化し、100μlのビオチン化を100μl。
- 回転させながら室温で1時間各ビーズ混合物をインキュベートします。 1分間磁石上にチューブを入れます。すべての上清を捨てます。ビーズペレットを保管してください。
- 400μlの1×W&B緩衝液を用いて各ビーズペレットを再懸濁することにより、二回毎回ビーズを洗浄し、ローテーターで室温で5分間、チューブを回転させることによって行いました。
- 1分間磁石上にチューブを入れます。すべての上清を捨てます。再懸濁し、各ビーズPELLE50μlの核単離緩衝液( 表3)でトン。
3.前脂肪細胞の単離と脂肪生成誘導
- 以前の刊行物5に記載したように、肩甲骨間の褐色脂肪パッド(3週齢C57BL6野生型マウス)からの前脂肪細胞を分析。
- 成長し、in vitroで前脂肪細胞5を区別します 。細胞は4-5日分化の開始後に下流側のアプリケーションのための準備が整いました。
プライマリ脂肪細胞からの細胞溶解物の4準備
注:細胞溶解物の準備のすべての手順を確認し、氷上で行われ、すべてのバッファを氷上で冷却されています。氷上でプレチルダウンスガラスホモジナイザー。
- 成長すると15cmの皿5(セクション3.2を参照)で前脂肪細胞を分化します。各皿には、1つのRNAプルダウンアッセイのための適切な細胞を提供します。分化の4日目または5日目に、細胞培養培地、および洗浄CEを破棄する1×PBSで一度LLS。
- 収穫細胞に、細胞を10〜15 mlの1×PBSを追加し、室温で5分間、200×gでの遠心分離によって50mlチューブ中の細胞を収集するためにこすり、ペレット細胞。 1ミリリットルピペットを使用して、上清を捨てます。
- 2ml中に再懸濁細胞ペレットを低張緩衝液( 表3)、そして氷上で15分間細胞をインキュベートします。転送15ミリリットルダウンスガラスホモジナイザーに細胞、および機械的に氷上で20ストロークでせん断セル。
- 4℃で15分間、3300×gでの遠心分離によってペレットは、細胞核。さらに使用するために氷上で核ペレットにしてください(セクション4.6を参照)。 1.5ミリリットルチューブに上清を移し、150mMのの最終濃度を得るために、上清に3MのKClを追加し、4℃で15分間20,000×gでスピン。
- 遠心分離後、慎重に1ミリリットルピペットを用いて、トップlipidlayeron削除、および細胞質細胞溶解物として上清を収集します。
- 核ペレットを再懸濁1ミリリットル核単離緩衝液中(4.4節を参照)。 Transfer核機械的に100ストロークで、氷上で15ミリリットルダウンスガラス1ミリリットルピペットを用いて、ホモジナイザー、およびせん断核へ。 4℃で15分間20,000×gで遠心分離することによって、核破片をペレット化し、そして核細胞溶解物として上清を収集します。
- 核と細胞質の細胞溶解物を組み合わせ、または下流プルダウンアプリケーションのために、個別に各画分のいずれかを使用します。このデモ実験では、細胞溶解物のこれら2つの画分1の体積比で混合した:1。
- 0.5 U /μlの最終濃度を得るために、この未分画の細胞溶解物にRNase阻害剤を加えます。ウェスタンブロッティング15のための入力制御として、細胞溶解物の脇に100μLを設定します。
5.結合およびRBPの溶出
- スプリットセル3つの等しいアリコートに溶解液(1.5mlチューブで1ミリリットルの細胞溶解物)、およびブランクでインキュベートは、FL RNA結合型およびAR 3'UTR RNA結合ビーズは4℃で3時間、それぞれ、(2.8節を参照してください) C言語回転に。
- 1分間磁石上にチューブを入れます。 RNAの完全性を確認するために、上清からのRNAの単離に続いて1ミリリットルピペットを使用して、上清を収集します。製造業者の説明書( 表2)は、以下の酸グアニジニウムチオシアネート-フェノール溶液を用いてRNAを単離します。リボソームRNAの28Sおよび18Sサブユニットを分析することによって、RNAの完全性を評価します。氷の上にビーズペレットを保管してください。
- ローテーターで、室温で2分間、チューブを回転させることにより、続いて40 UのRNase阻害剤と0.25%IGEPALを含む1ミリリットルの核単離緩衝液を用いて各ビーズペレットを再懸濁することにより磁気ビーズを6回、毎回洗浄します。磁気ビーズと上清を分離するための磁気スタンドを使用してください。すべての上清を捨てます。氷の上にビーズペレットを保管してください。
- ウェスタンブロッティングのためのビーズからRNA-タンパク質複合体を溶出するには、次の手順を使用します。まず、75μlの核単離緩衝液中の各ビーズペレットを再懸濁。その後、25μlの4倍ウェスタンブロットローディングBUFを追加FERは、(SDSを含む)を100μlの総容積を得ました。最後に、5分間、95℃で100μlの溶液中のビーズを沸騰。
注:使用は、MSのためのビーズからRNA-タンパク質複合体を溶出するための手順を以下に示します。 STEP1:100μlの溶出バッファー( 表3)の各ビーズペレットを再懸濁。 STEP2:回転させながら室温で2-3時間、ビーズのサンプルをインキュベート。 STEP3:遠心分離機とタンパク質含有上清を回収。 STEP4:MSの提出前に20〜30μlにタンパク質溶液を濃縮します。 - 4℃で30秒間12,000×gで遠心分離ビーズサンプルの各100μlを、上清を集めます。ウエスタンブロット分析のためにアリコート15μlの上清(セクション6.1と6.2を参照してください)。プローブ希釈HuRのマウスモノクローナル抗体で得られた膜(1:1,000希釈)を、一晩。
RBPの検証6.ウェスタンブロッティング
- 標準的な技術を用いてSDS-PAGEで区切りRBPs。
- 私たちを実施船尾目的のRNAに関連したRBPsのためにプローブすることによって、標準的な技術を用いてブロッティング。
注:このデモ実験では、HuRのマウスモノクローナル抗体のHuRタンパク質の免疫検出のために使用しました。 - 、脱脂粉乳、1×TBS w / vの5%に:(千希釈1)希釈HuRの抗体と得られた膜をインキュベート 0.1% トゥイーン- 4で20 一晩、穏やかに振盪しながらC°。 1×TBSTで膜を3回洗浄します。室温で1時間二次抗体(ヤギ抗マウスIgG-HRP)を用いて膜をインキュベートします。ウォッシュ膜。開発し、信号を記録します。
結果
このデモ実験において、AR RNA断片は、結合タンパク質HuRのを捕捉するために餌として使用しました。両方のHuRタンパク質に非関連であるFLのRNAの餌、およびコンジュゲートされていない空白のストレプトアビジンビーズのアリコートを陰性対照としました。 RNA-タンパク質相互作用は、核または細胞質のいずれかで発生することができ、このプルダウンプロトコールは、全または分画(核または細胞質)細胞溶解物のいずれにも適用することができます。ウェスタンブロッティングによるタンパク質の分析は、15μlの未分画の細胞溶解物のサンプルは、(セクション4.8を参照)、無ビーズ入力制御としてのHuRタンパク質を用いてマウス初代培養の脂肪細胞溶解物中で検出されたことを示す、陽性の結果を与えたことを示しモノクローナル抗体。 ARのRNAの溶出画分は、HuRのタンパク質がRNAプルダウンアッセイのためにAR RNA結合ビーズを用いて、脂肪細胞の溶解物中で検出されたことを示す、陽性の結果が得られました。 FL RNA溶出画分とbの両方痩せ細ったビーズのサンプルは、FL RNA断片とのHuRタンパク質との間だけでなく、ブランクビーズとHuRのタンパク質との間の非特異的な相互作用は、このRNAプルダウンアプローチによって検出されないことを示す、否定的な結果を与えました。これら2つの負の対照の結果はまた、AR RNA断片とのHuRタンパク質との間の特異的な相互作用が正常にここで説明するRNAプルダウンプロトコルによって検出されることを示しています。
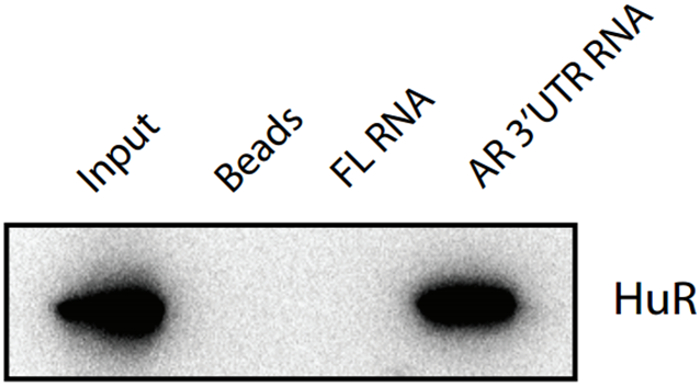
図1: のHuRのウエスタンブロット検証RNAプルダウンアッセイによってキャプチャ入力 :再構成された細胞溶解物(細胞質+核溶解液)。ビーズ:空白のストレプトアビジン被覆磁気ビーズからのサンプル。 FLのRNA:FL mRNAと結合したストレプトアビジンビーズ; AR 3'UTR RNA:AR 3'UTR mRNAと結合したストレプトアビジンビーズ;一次抗体:HuRのマウスモノクローナル抗体。二次抗体:ヤギ抗IgG-HRPを-mouse。略称、FL:ホタルルシフェラーゼ、AR:アンドロゲン受容体; この図の拡大版をご覧になるにはこちらをクリックしてください。
| 遠心 |
| サーマルサイクラー |
| 分光光度計 |
| 回転子 |
| タンパク質ゲル電気泳動およびブロッティング装置 |
| 磁石 |
表1:本研究で用いた主要設備本研究で用いた主な設備。
| インビトロ転写キットで |
| ビオチン化RNA |
| DNAやRNA断片を回収するためのコラムスピン |
| ストレプトアビジン磁気ビーズ |
| HuRのマウスモノクローナル抗体 |
| ヤギ抗マウスIgG-HRP |
| ヌクレアーゼフリーの分子生物学グレードの水 |
| リン酸緩衝食塩水 |
| RNaseインヒビター |
| プロテアーゼ阻害剤 |
| Pfu DNAポリメラーゼ |
| 酸グアニジンチオシアネート - フェノール溶液 |
表2:本研究で使用される主要な試薬本研究で使用される主要な試薬。
| 2X RNA構造バッファ |
| 20mMのトリス-HCl(pH7.4) |
| 0.2 MのKCl |
| 20のMgCl 2 |
| 2 mMのDTT |
| 0.8 U /μlのRNase阻害剤 |
| 緩衝液A |
| 0.1 MのNaOH |
| 0.05 MのNaCl |
| 緩衝液B |
| 0.1MのNaCl |
| 1×W&B(結合および洗浄)バッファ |
| 5 mMのトリス-HCl(pH7.4の) |
| 1MのNaCl |
| 1×低張緩衝液 |
| 10mMのトリス-HCl(pH7.4) |
| 10のKCl |
| 2のMgCl 2 |
| 1mMのDTT |
| 1mMのPMSF |
| 1×プロテアーゼ阻害剤 |
| 1×原子力分離バッファ |
| 25mMのトリス-HCl(pH7.4)で |
| 150のKCl |
| 2のMgCl 2 |
| 1mMのDTT |
| 0.5%IGEPAL(またはRBPsの溶出のための0.25%IGEPAL) |
| 1mMのPMSF |
| 1×プロテアーゼ阻害剤 |
| 0.4 U /μlのRNase阻害剤(または40 U / mlのRNase阻害剤RBPsの溶出のため) |
| 1×溶出バッファー |
| 1×PBS中2mMのビオチン |
表3:本研究で使用した主なソリューション 2xのRNA構造バッファ(セクション1.7を参照)。緩衝液A(2.3節を参照)。緩衝液B(2.4節を参照)。 1×W&B(結合および洗浄)バッファ(セクション2.2、2.5、2.7を参照のこと)。 1×低張緩衝液(4.3節を参照)。 1xの核単離緩衝液(5.4、5.3、セクション2.8、4.6を参照のこと)。 1×溶出バッファー(注以下のセクション5.4を参照してください)。
> "lways テンプレートとプライマー シーケンス T7-AR-オリゴ 5'- TCT AAT ACG ACT CAC TAT AGG GCT GGG CTT TTT TTT TCT CTT TCT CTC CTT TCT TTT TCT TCT TCC CTC CCT AGC TTA TGA CCG TGG CAG TCT -3 ' T7-AR-F 5'- CTA ATA CGA CTC ACT ATA G -3 ' T7-AR-R 5'- AGA CTG CCA CGG TCA TAA GC -3 ' hluc(+) - T7-プローブ-F 5'-TAATACGACTCACTATAGGGAGCCCCTGCTAACGACATTTACAACGAG-3 ' hluc(+) - プローブ-R 5'-CATAATCATAGGGCCGCGCACACAC-3 '表4:PCR増幅のための鋳型とプライマーの配列 T7-AR-オリゴ:PCR増幅のためのDNAテンプレート(セクション1を参照してください。0.1); T7-AR-F:PCR増幅のためのフォワードプライマー(1.1節を参照)。 T7-AR-R:PCR増幅のための逆方向プライマー(1.1節を参照)。 hluc(+) - T7-プローブ-F:PCR増幅のためのフォワードプライマー(セクション1.2を参照)。 hluc(+) - プローブ-R:PCR増幅のための逆方向プライマー(セクション1.2を参照)。
ディスカッション
lncRNAsとRBPsが健康と病気に重要な役割を持っている、しかし、これらの分子の分子メカニズムはあまり理解されていません。 lncRNA分子と相互作用するタンパク質の同定は、調節機構の解明に向けた重要なステップです。 RNAプルダウンアッセイシステムによってRBPsの濃縮は、溶液内の細胞溶解物からのタンパク質は選択的にストレプトアビジン磁気ビーズに結合したビオチン化RNAベイトを用いて抽出することができるように、複雑な相互作用の捕捉に基づいています。このようなチャープ、CHARTとRAPのようないくつかの他の方法は、しかし、これらの方法は、RNAプルダウン技術の16,17,18よりも設定する手間がかかり、同じ目標を達成することができます。
RNAプルダウンの主な強みは、比較的単純なプロトコル及び実行が容易であることです。両方CHIRPとRAPは、RNA-タンパク質複合体およびアンチセンスオリゴヌクレオチドのフルセットの設計を天然に存在する保存する架橋工程を伴う(90 nucleotides長いRAPで、および20ヌクレオチド長チャープで)ターゲット全体RNA 16,17,18をタイリングします。 RNAの折り畳みは、RNAプルダウンアッセイにおける重要なステップです。このプロトコルの主な制限は、標的RNAをin vitroで合成され、正しく適切なそのRBP(複数可)との結合を可能にするために天然構造に折り畳まれないことです。誤って折り畳まれた非ネイティブのRNAは、RNA -タンパク質相互作用を形成し、唯一の非生理学的条件の下で、in vitroで起こる機能アッセイ、またはフォームの相互作用を無効にするために失敗するかのいずれかであり得ます。ここで説明するプルダウンプロトコルは13,14の折りたたみRNAについて十分に認識された手順を採用しているが、それは他のRNA転写物のための適切な折り畳みを保証するものではない、(セクション1.7を参照)。
RNAプルダウンは、多くの場合、関心19のRBPによって結合したRNA(複数可)を検出するための補完的なアプローチとして、RIPに結合されています。このプロトコルでもう一つの重要なステップは、全細胞から脂質画分を除去することです溶解液の成熟脂肪細胞における高脂質豊富で、主要な技術的課題を提示しているため(セクション4.5を参照)。ここで説明するプロトコルは、特に、脂肪細胞での使用のために開発されています。しかしながら、このプロトコルと使用されるすべてのバッファのストリンジェンシーの基本的な構成要素は、変更され、他の細胞培養モデルへの適用のために適合させることができる。内因性RNアーゼの高いレベルを有する組織は、異なるRNAプルダウンプロトコルが適用されてもよいです。
関連するRBPsを識別するために、関心のRNAを使用するRNAのプルダウンが、lncRNAsの中枢機能とメカニズムを調査するための効果的かつ効率的な技術である、ヒト細胞における役割の広い範囲を持っています。 RNAプルダウンなどのRNAベースのキャプチャの将来の発展は、RNA-タンパク質複合体の構成要素、アセンブリ、および機能を定義するだけでなく、MSのための低豊富なRNA-タンパク質複合体から十分RBPsを生成するとの課題に対処するために必要とされるであろう。
開示事項
利害の衝突が宣言されていません。
謝辞
この作品は、シンガポールNRFの交わり(NRF-2011NRF-NRFF001-025)ならびにCBRG(NMRC / CBRGは/ 0070/2014)によって賄われていました。
資料
| Name | Company | Catalog Number | Comments |
| Major materials used in this study. | |||
| MEGAscript kit | Ambion | ||
| Biotin-14-CTP | Invitrogen | ||
| NucAway spin columns | Ambion | ||
| Dynabeads M-280 Streptavidin | Invitrogen | ||
| HuR (3A2) mouse monoclonal antibody (sc-5261) | Santa Cruz Biotechnology | ||
| Goat anti-mouse IgG-HRP(sc-2005) | Santa Cruz Biotechnology | ||
| Hypure Molecular Biology Grade Water (nuclease-free) | HyClone | ||
| Phosphate Buffer Saline (1×PBS) | HyClone | ||
| RNase inhibitor | Bioline | ||
| Protease inhibitor | Sigma | ||
| Pfu Turbo DNA polymerase | Agilent Technologies | ||
| TRIsure | Bioline | ||
| Name | Company | Catalog Number | Comments |
| Major equipment used in this study. | |||
| Sorvall Legend Micro 21R centrifuge | Thermo Scientific | ||
| Sorvall Legend X1R centrifuge | Thermo Scientific | ||
| Bio-Rad T100 thermal cycler | Bio-Rad | ||
| Nanodrop 2000 | Thermo Scientific | ||
| BOECO rotator Multi Bio RS-24 | BOECO,Germany | ||
| Protein gel electrophoresis and blotting apparatus | Bio-Rad | ||
| DynaMag-2 magnet | Life Technologies |
参考文献
- Huot, M. &. #. 2. 0. 1. ;., et al. The Sam68 STAR RNA-binding protein regulates mTOR alternative splicing during adipogenesis. Mol Cell. 46 (2), 187-199 (2012).
- Sun, L., et al. Long noncoding RNAs regulate adipogenesis. Proc Natl Acad Sci U S A. 110 (9), 3387-3392 (2013).
- Engreitz, J. M., et al. The Xist lncRNA exploits three-dimensional genome architecture to spread across the X-chromosome. Science. 341 (6147), 1237973 (2013).
- Zhao, X. Y., Li, S., Wang, G. X., Yu, Q., Lin, J. D. A long noncoding RNA transcriptional regulatory circuit drives thermogenic adipocyte differentiation. Mol Cell. 55, 372-382 (2014).
- Alvarez-Dominguez, J. R., et al. De novo reconstruction of adipose tissue transcriptomes reveals long non-coding RNA regulators of brown adipocyte development. Cell Metab. 21, 764-776 (2015).
- Adams, D. J., Beveridge, D. J., van der Weyden, L., Mangs, H., Leedman, P. J., Morris, B. J. HADHB, HuR, and CP1 bind to the distal 3-untranslated region of human renin mRNA and differentially modulate renin expression. J Biol Chem. 278 (45), 44894-44903 (2003).
- Yeap, B. B., et al. Novel binding of HuR and poly(C)-binding protein to a conserved UC-rich motif within the 3´ untranslated region of the androgen receptor messenger RNA. J Biol Chem. 277, 27183-27192 (2002).
- König, J., Zarnack, K., Luscombe, N. M., Ule, J. Protein-RNA interactions: new genomic technologies and perspectives. Nat Rev Genet. 13, 77-83 (2012).
- Ferrè, F., Colantoni, A., Helmer-Citterich, M. Revealing protein-lncRNA interaction. Briefings in Bioinformatics. , 1-11 (2015).
- McHugh, C. A., Russell, P., Guttman, M. Methods for comprehensive experimental identification of RNA-protein interactions. Genome Biol. 15 (1), 203 (2014).
- Lee, Y. S., et al. AU-rich element-binding protein negatively regulates CCAAT enhancer binding protein mRNA stability during long term synaptic plasticity in Aplysia. Proc Natl Acad Sci U S A. 109 (38), 15520-15525 (2012).
- Hermann, M., Cermak, T., Voytas, D. F., Pelczar, P. Mouse genome engineering using designer nucleases. J Vis Exp. (86), (2014).
- Tsai, M. C., et al. Long Noncoding RNA as Modular Scaffold of Histone Modification Complexes. Science. 329 (5992), 689-693 (2010).
- Wan, Y., et al. Landscape and variation of RNA secondary structure across the human transcriptome. Nature. 505, 706-709 (2014).
- Li, H., et al. Identification of mRNA binding proteins that regulate the stability of LDL receptor mRNA through AU rich elements. J Lipid Res. 50 (5), 820-831 (2009).
- McHugh, C. A., et al. The Xist lncRNA interacts directly with SHARP to silence transcription through HDAC3. Nature. 521 (7551), 232-236 (2015).
- Chu, C., et al. Systematic Discovery of Xist RNA Binding Proteins. Cell. 161 (2), 404-416 (2015).
- Chu, C., Spitale, R. C., Chang, H. Y. Technologies to probe functions and mechanisms of long noncoding RNAs. Nat Struct Mol Biol. 22 (1), 29-35 (2015).
- Zhao, J., et al. Genome-wide identification of Polycomb-associated RNAs by RIP-seq. Mol Cell. 40 (6), 939-953 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved