フェロセンの構造
概要
ソース: タマラ ・ m ・力、化学科テキサス A & M 大学
1951 年、Kealy とポーソン報告自然に新しい有機金属化合物は、フェロセンの合成。1元のレポートでは、提案のフェロセンの構造ポーソン (シグマ債) (図 1, 構造 I) 各シクロペンタジエン リガンドの 1 つの炭素原子に結合して鉄は単独で。1,2,3この最初のレポートはフェロセンの構造に広まった関心につながって、この興味深い新しい分子構造の解明に多くの一流の科学者が参加しました。ウィルキンソンとウッドワード速かった代替の定式化を提案する、鉄は""の間に挟まれたすべての 10 の炭素原子 (図 1、構造 II) に等しいバインディングで、2 つのシクロペンタジエン リガンド。4ここは、フェロセンを合成し、実験データ (IR と1H NMR)、これらの構造が観測されるに基づいて決定します。また、繰返しのボルタモ グラムを集めることによって、フェロセンの電気化学を学びます。この実験の過程では、18 電子規則を紹介し、価電子遷移金属錯体のカウントを議論します。
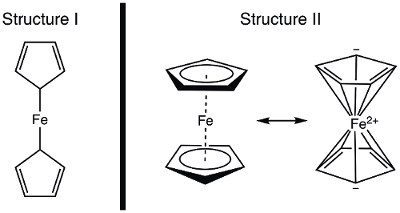
図 1.フェロセンの 2 つの提案された構造。
原則
18 電子規則と総価電子を数える:
ルイス ドット構造を描画するとき、オクテットのルールは、主要なグループ要素の原子の原子価殻の 8 電子であることを覚えていることが重要です。ただし、遷移金属、9 つの原子価軌道 (1 つのs、3 p、および 5 d軌道) と 18 として多くの電子を収容できるため、オクテット則を保持しません。したがって、遷移金属錯体の 18 電子規則が適用されます。オクテット則のような 18 電子規則には例外がありますが、一般的には、18 の価電子を持つ遷移金属錯体が安定性の高い化合物と見なされます。
遷移金属錯体の総価電子数を決定する使用ことができます 2 つの方法があります: イオン (充電) モデルと共有結合 (ニュートラル) モデル。5いずれかのメソッドの適切なアプリケーションは、同じ総電子数に上昇を与える必要があります。両方のモデルは、X ・ L ・ Z タイプと呼ばれる 3 つの配位子の分類を使用します。配位子の種類ごと全電子数カウントする電子の数が異なるを貢献し、使用する方法によって異なります。X 型配位子には、ハロゲン化物、水酸化物、アルコキシドなど陰イオン グループが含まれます。L 型配位子が孤立電子対ドナー アミンやホスフィンなどあります。最後に、Z 型配位子が電子対受容体;したがって、Z 型配位子は BR3などの中立的なルイス酸であります。(図 2) の 2 つの方法を示すために Co (NH3)3Cl3分子を考えます。

図 2 。例では、Co (NH3)3Cl を数える電子3.
イオンのモデル:
まず、中央の原子によって貢献した電子の数を検討してください。Co は周期的なテーブルのグループ 9 に、こうして 9 価電子。イオンのモデルでは、金属の酸化状態を考慮する必要があります。Co (NH3)3Cl3 Co の酸化状態は +3 なので、金属イオンのモデルで貢献する価電子の総数は 6 e− (表 1) です。イオンのモデルでは、両方の X と L 型配位子は Z 型配位子が電子を貢献している間 2 e−総電子数を寄付します。例えば Co (NH3)3Cl3で、現在 2 つの配位子タイプがあります。Cl は X 型リガンド、NH3 L 型リガンド。18 e− (表 1) イオンのモデルを使用すると、全電子数です。
表 1.e− Co (NH3)3Cl3イオン性と共有結合性のモデルを使用してのカウント
| 配位子/中央原子 | 配位子の種類 | e−貢献
(イオン モデル) |
e−貢献
(共有結合モデル) |
| Co | n/a | 6 e− | 9 e− |
| 3 NH3 | L | (2 e−) x 3 | (2 e−) x 3 |
| 3 Cl | X | (2 e−) x 3 | (1 e−) x 3 |
| イオンの電荷 | なし * | − (0) | |
| 合計e− カウント | 18 e− | 18 e− | |
* 金属含有イオンの電荷、イオンのモデルを使用して総電子数に含まれません。電荷は金属 (中央の原子によって貢献した電子) の酸化状態で占めております。
共有結合のモデル:
中央の原子からe−貢献は、共有結合モデル (この場合 9 e−) の中性の原子の価電子e−の総数に等しい。X 型配位子を寄付 1 e−L 型配位子を 2 e−、寄付、Z 型配位子を寄付 0 e−。最後に、分子がイオン性の場合金属の中心を含むイオンの電荷は金属と配位子の電子から減算する必要があります。共有モデルを使用して、Co (NH3)3Cl3の総電子数はまた 18 e− (表 1)。
フェロセンとその Ferrocenium の陽イオンを数える電子:
Fe は、8 e−共有モデルを使用する。で構造 I としてみなすフェロセンの接合と、シクロペンタジエン (Cp) の配位子が X 型ドナーし、したがって各貢献 1 電子 (表 2)。したがって、我々 は 10 の価電子を持つでしょう。ただし、構造 ii、各 Cp リング寄付 5 電子 (L2X 型配位子)、2 つの二重結合がある (それぞれ、L 型ドナー 2 電子)、および 1 つの X 型ドナー (ラジカル)。これは 18 電子 (表 2) の合計を与えます。
表 2。フェロセン (Fc) と共有結合モデルを用いた ferrocenium (Fc+) 陽イオンを数える電子
| 配位子/中央原子 | 構造 I | 構造 II | ||||
| 配位子の種類 | Fc | Fc+ | 配位子の種類 | Fc | Fc+ | |
| Fe | -- | 8 e− | 8 e− | -- | 8 e− | 8 e− |
| Cp | X | (1 e−) x 2 | (1 e−) x 2 | L2X | (5 e−) x 2 | (5 e−) x 2 |
| イオンの電荷 | − (0) | − (+1) | イオンの電荷 | − (0) | − (+1) | |
| 全電子数 | 10 e− | 9 e− | 全電子数 | 18 e− | 17 e− | |
フェロセンは容易に屈する ferrocenium 陽イオン (式 1) 1 e−酸化を経る。
 (1)
(1)
結果として得られる電子を見てみましょう I および II の構造 ferrocenium 陽イオンのカウントします。1 e−酸化にフェロセンがイオンになります。したがって、ferrocenium 陽イオンの電荷 (+1) は価電子 (表 2) から減算する必要があります。料金を引いた 9 e− 17 e−総電子数での結果構造 I と構造 II、それぞれ。
どのフェロセンの構造が正しいですか。
場合の構造は 10 だけの価電子で、正しいフェロセンは Fe で反応性の高いでしょう。電子の欠損は、フェロセンの構造以来、ferrocenium 陽イオンを生成する酸化は、この場合非常に困難でしょう。その一方で、フェロセンの構造 II 18 電子規則に従うし、安定した化合物フェロセンと一致しているため。この場合、ferrocenium 陽イオンにフェロセンの酸化は、17 e−種をもたらすでしょう。電子カウントに基づいて、1 つは、フェロセンの構造 II; 展示予測するかもしれない分光学的に正しい構造を示す方法について考えてみましょう。
構造のデータが公開されて前に、フェロセンの構造は、その磁気的・分光学的性質とその反応性から推論されました。2 つの構造物の予測と思います IR スペクトルを考えてみましょう。私は 2 つの化学的に 23ate-13 非等価なプロトンを表示し、かくあるべき構造は、1 つ以上 IR スペクトルの C-H 伸縮モードに上昇を与えます。対照的に、構造 II は C-H 結合の 1 つの型を表示し、こうしてシングル C H ストレッチを表示する必要があります。NMR 分光法は 1950 年代に容易に利用されていた、このあまりにも提供する手掛かり: 1H スペクトル、および 1 つの共鳴構造 ii が予測される構造の共鳴の 2 つ。この実験では、合成フェロセン、分光学的データを使用して、その構造の証拠を提供します。
手順
1. 割れシクロペンタジエン 2 量体 (図 3)
シクロペンタジエンは、ジシクロペンタジエンを与えるために自分自身とディールス ・ アルダー反応を経る。この反作用はリバーシブルな割れはジシクロペンタジエン ダイマー (b. p. 170 ° C) からシクロペンタジエン モノマー (b. p. 42 ° C) を蒸留によって逆の反応を駆動するラ Châtelier の原理を使用して行われますので。二量化反応が遅い、シクロペンタジエンは保たれた風邪が正常に合成フェロセン作りたてする必要があります。
- 25 mL の丸底フラスコに攪拌棒及びジシクロペンタジエン ダイマーの 10 mL を追加します。
注意: 両方の悪臭物質であるのでだけ発煙のフード ジシクロペンタジエン、シクロペンタジエンを使用するように気をつけてください。 - 丸底フラスコを分別蒸留装置 (有機化学の基本シリーズで「分別蒸留」モジュールを参照してください) に添付し油浴攪拌ホット プレート上に配置します。氷浴で収集のフラスコを持っていることを確認します。場所で装置を固定します。
- ホット プレートを 160 ° C に設定し、ソリューションを軽くかき混ぜます。
- 分別蒸留 〜 ダイマー (39-42 ° C) から Cp モノマーの 5 mL。

図 3。ジシクロペンタジエンの割れ。
2. 合成フェロセン (図 4)
- 100 mL Schlenk フラスコに追加攪拌棒と 15 g の KOH を細かく粉砕します。
注意: 島は非常に腐食性、吸湿性に優れて!KOH は換気フードの地し、調製後直ちに使用する必要があります。 - 攪拌しながらフラスコに 1, 2-dimethoxyethane 30 mL を追加します。
- 窒素にフラスコを接続し、フラスコの首にゴムキャップを配置します。
- 窒素下で攪拌しながら注射器を介してシクロペンタジエンの 2.75 mL を追加します。鉄添加する前に、少なくとも 10 分間攪拌しこれを許可します。
- 反応を攪拌、攪拌棒、地盤別 50 mL Schlenk フラスコにした FeCl2·4H2O および 12.5 mL の DMSO の 3.25 g を追加します。首に隔壁を置き、すべての鉄が溶けるまで窒素下で攪拌します。
- カニューレは、滴下し、30 分のコースを介して鉄液を窒素下でシクロペンタジエニル ソリューションに転送します。詳細な手順は、この無機化学シリーズの「合成の Ti(III) メタロセン Schlenk ライン法による"ビデオをご覧ください。
- 追加が完了すると、さらに 30 分間かき混ぜます。
- 一方、ビーカーには、砕いた氷 (50 g) を直接ソリューションに追加することによって 6 M 塩酸 45 mL を冷却します。
- 反応が完了したら、スラリーに混合物を注ぎ、数分間かき混ぜます。オレンジ色の結晶を形成する必要があります。
- Büchner の目標到達プロセス (ろ紙を装着)、結晶を収集し、水と沈殿物を洗います。
- 固形物を空気中で乾燥を許可します。
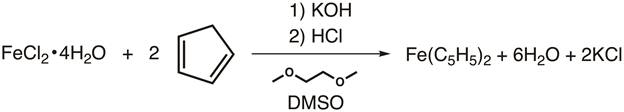
図 4。フェロセンの合成。
3. フェロセンの浄化。昇華によって、製品を浄化する (詳細な手順「昇華によってフェロセンの浄化」のビデオを参照してください)。
4. フェロセンのキャラクタリゼーション
- 準備し、フェロセンの1H-NMR スペクトルを収集します。
- フェロセンの IR スペクトルを収集します。
- フェロセンの繰返しのボルタモ グラムを収集 (分析化学の必需品シリーズの「サイクリックボルタンメトリー」ビデオを参照してください)。
結果
フェロセンの特性:
1H NMR (クロロホルムは δ をd、300 MHz、ppm): 4.15 (s)。
フェロセンの1H の NMR スペクトルは、構造 II を一貫性のある単一共振をはっきり示しています。
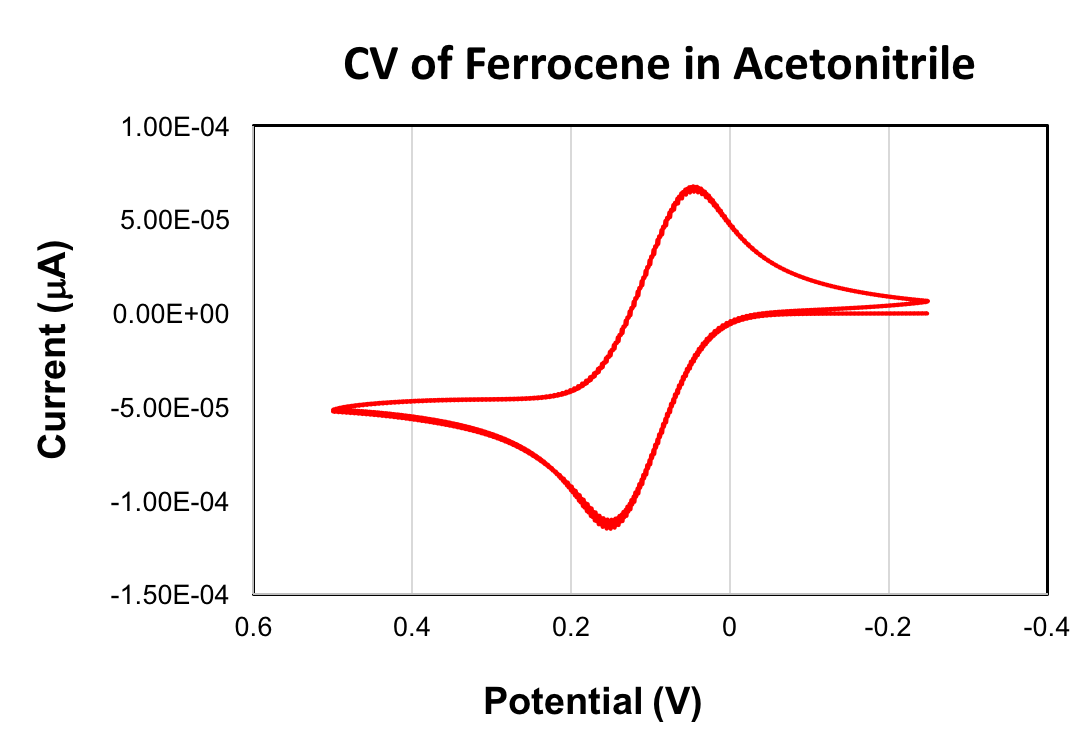
フェロセンの CV を記します。フェロセン酸化された +90 に得値E1/2 mV (アセトニ トリル、スキャン レート 100 mV/秒、0.1 M (Bu4N) PF6、グラシー カーボン作用電極)。フェロセン/ferrocenium レドックスのカップルは、サイクリックボルタンメトリーで参照として使用されます。参照として使用するフェロセンのEの1/2の値が 0 V に設定されます。
申請書と概要
このビデオでは、フェロセンとそれは有機金属化学の発展に果たした役割を説明します。フェロセンを合成し、 1H NMR や IR の分光学によって特徴付けられます。両方のスペクトルは 18 e−構造 II、どこ鉄は""の間に挟まれたすべての 10 の炭素原子 (図 1、構造 II) に等しいバインディングで、2 つのシクロペンタジエン リガンドと一致しています。Ferrocenium 陽イオンにフェロセンの酸化は、電気化学的に観察されました。
フェロセンの構造キャラクタリゼーションの後、1973 年にウィルキンソン ノーベル化学賞を受賞"[彼の] 先駆的な仕事、有機金属化学にサンドイッチ複合体と呼ばれる"2 つの化学者の一つであった。6彼の作品は、大きく影響を受けた、有機金属化学の新たなフィールドを拡大します。最初の有機金属化合物は、1849 年に準備された金属を炭素原子に結ぶことができる方法を理解する重要な進歩が行われた 1950 年代にだけだった。今日、有機金属化学のフィールドまたは金属-炭素結合を形成する化合物の化学は、多くのアプリケーションの中心です。これが含まれます: エネルギー、色素増感太陽電池、触媒、重合、創と合成、無機系、有機発光ダイオード (Oled)。7
フェロセン自体は、有機金属化学の分野で積極的な役割を果たしています。フェロセンは容易に参画求電子芳香族置換;実際には、10万回以上これらの反応でベンゼンよりも反応性です。フェロセンは有機金属触媒の二座配位子の構造のコンポーネントとして広範なアプリケーションを発見しました。たとえば、1, 1'-ビス (ジフェニルホスフィノ) フェロセン (dppf) は均一系触媒で使用されるキレート配位子です。リガンド dppf キレートの 1st2nd、3rd行遷移金属 Ni, Pd, Pt. など [1,1'-Bis(diphenylphosphino) ferrocene]palladium(II) 塩化パラジウム クロス カップリング触媒 C C の例とC-ヘテロ原子結合形成反応 (図 5)。8ビデオ「MO 理論の遷移金属錯体における"dppf を備えた 2 つの金属錯体が合成されます私たち。
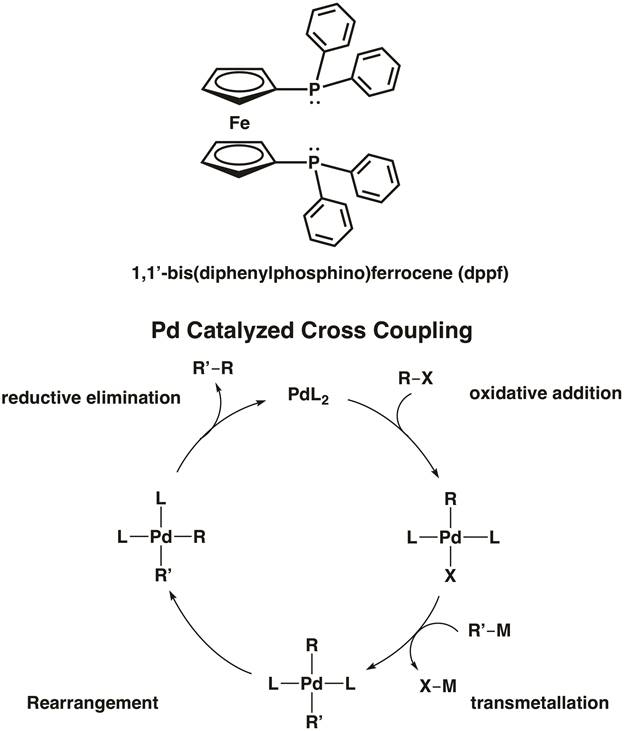
図 5 。[1,1'-Bis(diphenylphosphino) ferrocene]palladium(II) 二塩化 C C と C-X 結合形成のクロス カップリング触媒であります。
参考文献
1. Kealy, T. J., Pauson, P. L. A New Type of Organo-Iron Compound. Nature. 168 (4285), 1039-1040 (1951).
2. Pauson, P. L. Ferrocene—how it all began. J Organomet Chem. 637, 3-6 (2001).
3. Seeman, J. I., Cantrill, S. Wrong but seminal. Nat Chem. 8 (3), 193-200 (2016).
4. Wilkinson, G., Rosenblum, M., Whiting, M. C., Woodward, R. B. The Structure of Iron Bis-cyclopentadienyl. 74, 2125-2126 (1952).
5. Green, M. L. H., Parkin, G. Application of the Covalent Bond Classification Method for the Teaching of Inorganic Chemistry. J Chem Educ. 91 (6), 807-816 (2014).
6. Press Release. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1973/press.html.
7. Crabtree, R. H. The Organometallic Chemistry of the Transition Metals, 6th ed. John Wiley & Sons. Hoboken. 2014.
8. Gildner, P. G., Colacot, T. J. Reactions of the 21st Century: Two Decades of Innovative Catalyst Design for Palladium-Catalyzed Cross-Couplings. Organometallics. 34, 5497-5508 (2015).
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
フェロセンの構造
Inorganic Chemistry
79.1K 閲覧数

シュレンク管を用いた Ti(III) メタロセンの合成
Inorganic Chemistry
31.5K 閲覧数

グローブ ボックスと不純物センサー
Inorganic Chemistry
18.6K 閲覧数

昇華によってフェロセンの精製
Inorganic Chemistry
54.3K 閲覧数

エバンス メソッド
Inorganic Chemistry
68.0K 閲覧数

単結晶および粉末 x 線回折
Inorganic Chemistry
104.0K 閲覧数

電子常磁性共鳴 (EPR) 分光法
Inorganic Chemistry
25.4K 閲覧数

メスバウアー分光法
Inorganic Chemistry
21.9K 閲覧数

Ph3P BH3ルイス酸-塩基相互作用
Inorganic Chemistry
38.7K 閲覧数

群論の赤外分光法への応用
Inorganic Chemistry
45.0K 閲覧数

分子軌道 (MO) 理論
Inorganic Chemistry
35.1K 閲覧数

Quadruply 金属-金属接合外輪
Inorganic Chemistry
15.3K 閲覧数

色素増感太陽電池
Inorganic Chemistry
15.7K 閲覧数

酸素運ぶのコバルト (ii) 錯体の合成
Inorganic Chemistry
51.5K 閲覧数

根本的な重合反応の光化学開始
Inorganic Chemistry
16.7K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved