Structure du ferrocène
Vue d'ensemble
Source : Tamara M. Powers, département de chimie, Texas A & M University
En 1951, Kealy et Pauson ont signalé à la Nature , la synthèse d’un nouveau ferrocène composé organométallique. 1 dans leur rapport initial, Pauson a proposé une structure de ferrocène dans laquelle le fer est individuellement collé (liaisons sigma) à un atome de carbone de chaque ligand cyclopentadiène (Figure 1, la Structure I). 1 , 2 , 3 ce rapport initial conduit à intérêt largement répandu dans la structure du ferrocène, et beaucoup d’éminents scientifiques ont participé à l’élucidation de la structure de cette nouvelle molécule intéressante. Wilkinson et Woodward ont été prompts à suggérer une formalisation alternative où le fer est « en sandwich » entre deux ligands cyclopentadiène, avec liaison égale pour tous les atomes de carbone 10 (Figure 1, Structure II). 4 ici, nous allons synthétiser ferrocène et décider, basé sur des données expérimentales (IR et 1H RMN), qui, de ces structures sont observées. En outre, nous étudierons l’électrochimie du ferrocène en recueillant un voltamogramme cyclique. Au cours de cette expérience, nous introduire la règle des 18 électrons et discuter des électrons de valence, comptant pour les complexes de métaux de transition.
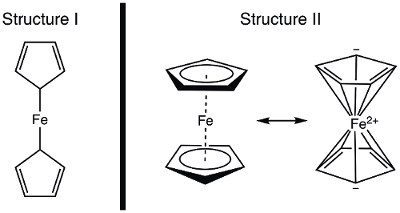
Figure 1. Deux structures proposées du ferrocène.
Principles
Règle des 18 électrons et comptage Total des électrons de Valence :
Lors de l’élaboration de structures de Lewis dot, il est important de se rappeler la règle de l’octet, qui stipule que les atomes des éléments du groupe principal ont 8 électrons dans leur couche de valence. Toutefois, la règle de l’octet ne tient-elle pas pour les métaux de transition, qui ont neuf orbitales de valence ( s, 3 pet cinq d orbitales) et peut donc accueillir jusqu'à 18 électrons. Par conséquent, une règle des 18 électrons s’applique pour des complexes de métaux de transition. Comme la règle de l’octet, il existe des exceptions à la règle des 18 électrons, mais en général, des complexes de métaux de transition avec 18 électrons de valence sont considérés comme des composés très stables.
Il existe deux méthodes qui peuvent servir à déterminer le nombre total des électrons de valence d’un métal de transition complex : le modèle ionique (payante) et le modèle covalent (neutre). 5 bonne application de chaque méthode devrait donner lieu au même nombre d’électrons total. Les deux modèles utilisent trois classifications de ligand appelées X-, L-et Z-types. Chaque type de ligand contribue un nombre différent d’électrons au nombre total d’électrons et dépend de la méthode utilisée. Ligands de type X comprennent des groupes anioniques comme les halogénures, hydroxyde et alcoolates. Ligands de type L sont doublet donateurs tels que les amines et les phosphines. Enfin, Z-type ligands sont des accepteurs de paires d’électrons ; par conséquent, Z-type ligands sont des acides de Lewis neutres, par exemple BR3. Nous considérons la molécule de Co (NH3)3Cl3 afin de démontrer les deux méthodes (Figure 2).

Figure 2. Électron exemple, Co (NH3)3Cl de comptage3.
Modèle ionique :
Tout d’abord, considérons le nombre d’électrons de l’atome central. Co est à 9 groupe du tableau périodique et a donc 9 électrons de valence. Dans le modèle ionique, l’état d’oxydation du métal doit être examinée. L’état d’oxydation du Co Co (NH3)3Cl3 étant + 3, le nombre total d’électrons de valence ont contribué par le métal dans le modèle ionique est 6 e− (tableau 1). Dans le modèle ionique, les deux ligands de type X et L donnent 2 e− le nombre total d’électrons alors que les ligands de type Z ne contribuent pas des électrons. Pour l’exemple Co (NH3)3Cl3, il y a deux types de ligand présents. CL est un ligand de type X et NH3 est un ligand de L-type. En utilisant le modèle ionique, le nombre d’électrons total est 18 e− (tableau 1).
Table 1. e− dépouillement du Co (NH3)3Cl3 en utilisant les modèles ioniques et covalentes
| Atome de ligand/centrale | Type de ligand | e − contribution
(modèle ionique) |
e − contribution
(modèle covalent) |
| Co | n/a | 6 e− | 9 e− |
| 3 NH3 | L | 3 x (2 e−) | 3 x (2 e−) |
| 3 Cl | X | 3 x (2 e−) | 3 x (1 e−) |
| Charge de l’ion | n/a * | − (0) | |
| Total e− comte | 18 e− | 18 e− | |
* La charge de l’ion métallique n’est pas incluse dans le nombre total d’électrons en utilisant le modèle ionique. L’accusation est comptabilisée dans l’état d’oxydation du métal (électrons de l’atome central).
Modèle covalent :
Pour le modèle covalent, la contribution de e− de l’atome central est égale au nombre total de valence e− pour l’atome neutre (dans ce cas 9 e−). Donnent de ligands de type X 1 e−, donnent 2 e−de ligands de type L, et de donnent de ligands de type Z 0 e−. Enfin, si la molécule est ionique, la charge de l’ion contenant le centre métallique doit être soustraite du métal plus les électrons de ligand. En utilisant le modèle covalent, le nombre total d’électrons pour Co (NH3)3Cl3 est également 18 e− (tableau 1).
Électron comptant pour ferrocène et ferrocénium Cation :
En utilisant le modèle covalent, Fe a 8 e−. Si nous considérons les liaisons dans le ferrocène comme qui Structure en I, les ligands cyclopentadiène (Cp) sont des donneurs de type X et donc chacun une contribution de 1 électron (tableau 2). Ainsi, nous aurions 10 électrons de valence. Toutefois, dans la Structure II, chaque anneau de Cp donne 5 électrons (ligand de la L2type-X), où nous avons deux doubles liaisons (chacun sont 2 électrons, donneurs de type L) et un donateur de la X-type (le radical). Cela donne un total de 18 électrons (tableau 2).
Le tableau 2.Électron comptant pour ferrocène (Fc) et de cations ferrocénium (Fc+) en utilisant le modèle covalent
| Ligand / Centre atom | Structure I | Structure II | ||||
| Type de ligand | FC | FC+ | Type de ligand | FC | FC+ | |
| Fe | -- | 8 e− | 8 e− | -- | 8 e− | 8 e− |
| CP | X | 2 x (1 e−) | 2 x (1 e−) | L2X | 2 x (5 e−) | 2 x (5 e−) |
| Charge de l’ion | − (0) | − (+ 1) | Charge de l’ion | − (0) | − (+ 1) | |
| Nombre total d’électrons | 10 e− | 9 e− | Nombre total d’électrons | 18 e− | 17 e− | |
Ferrocène subit facilement une 1 e− oxydation pour donner ferrocénium cation (équation 1).
 (1)
(1)
Considérons l’électron qui comptent pour le cation de ferrocénium des Structures I et II. À une oxydation e− 1, ferrocène devient ionique. La charge (+ 1), le cation de ferrocénium doit donc être soustrait les électrons de valence (tableau 2). En soustrayant les frais donnent comtes électronique totale de 9 e− et 17 e− pour Structure I et II de la Structure, respectivement.
Quelle Structure de ferrocène est Correct ? :
Si Structure j’ai c’est correct, avec seulement 10 électrons de valence, le ferrocène serait très réactif à la Fe. Oxydation pour donner le cation de ferrocénium serait assez difficile dans ce cas, puisque la Structure, j’ai du ferrocène est électron déficient. En revanche, Structure II du ferrocène obéit à la règle des 18 électrons et est donc conforme avec le ferrocène est un composé stable. Dans ce cas, oxydation du ferrocène ferrocénium cation produirait une espèce de 17 e− . Basé sur le comptage des électrons, on peut prédire que le ferrocène pièces Structure II ; Nous allons réfléchir à la manière de démontrer la structure correcte par spectroscopie.
Avant la publication de données structurales, la structure du ferrocène a été déduite à partir de ses propriétés magnétiques et spectroscopiques, ainsi que sa réactivité. Nous allons étudier les spectres IR qui nous serait de prévoir pour les deux structures. Structure j’ai affiche deux protons chimiquement non-équivalents et devrait donc donner lieu à plus d’un mode d’élongation C-H dans le spectre IR. En revanche, la Structure II affiche un seul type de liaison C-H et devrait donc afficher un seul tronçon de C-H. Spectroscopie RMN avait facilement disponible dans les années 1950, elle trop fournirait un indice : deux résonances dans le spectre 1H pour la Structure j’ai et une résonance pour Structure II pourrait être prédite. Dans cette expérience, nous synthétiser ferrocène et utiliser des données spectroscopiques pour fournir la preuve de sa structure.
Procédure
1. fissuration du dimère de cyclopentadiène (Figure 3)
Cyclopentadiène subit une réaction de Diels-Alder avec lui-même pour donner le dicyclopentadiène. Cette réaction est réversible, donc craquage est accompli en utilisant le principe de La Châtelier pour conduire la réaction inverse en distillant le monomère du cyclopentadiène (b.p. 42 ° C) loin de dimère dicyclopentadiène (b.p. 170 ° C). La réaction de dimérisation est lente lorsque le cyclopentadiène est conservé au froid, mais il doit être fraîchement préparée à synthétiser avec succès le ferrocène.
- Un ballon à fond rond 25 mL, ajouter une barre de remuer et 10 mL de dimère dicyclopentadiène.
ATTENTION : Veillez à utiliser uniquement dicyclopentadiène et cyclopentadiène sous une hotte parce qu’ils sont les deux produits chimiques puanteur. - Fixer le ballon sur un appareil de distillation fractionnée (voir module « Distillation fractionnaire » dans la série Essentials of Organic Chemistry ) et placer dans un bain d’huile sur une plaque de cuisson en remuant. Soyez sûr d’avoir les fioles de collecteurs dans un bain de glace. Fixez l’appareil en place.
- Mettre la plaque de cuisson à 160 ° C et remuer doucement la solution.
- Distillation fractionnée ~ 5 mL du monomère Cp de dimère (39-42 ° C).

La figure 3. Fissuration du dicyclopentadiène.
2. synthèse du ferrocène (Figure 4)
- Dans un ballon de Schlenk 100 mL, ajouter une barre de remuer et 15 g de finement moulu KOH.
ATTENTION : KOH est très corrosive et hygroscopique ! Le KOH doit être au sol sous une hotte ventilée et servir immédiatement après la préparation. - Ajouter 30 mL de 1, 2-diméthoxyéthane au ballon tout en remuant.
- Raccorder le ballon à l’azote et placez un septum en caoutchouc sur le col du matras.
- Tout en agitant sous atmosphère d’azote, ajouter 2,75 mL du cyclopentadiène par seringue. Permettre à ceci de remuer pendant au moins 10 min avant l’addition du fer.
- Alors que la réaction est en remuant, ajouter une barre de remuer, 3,25 g de sol FeCl2·4H2O et 12,5 mL DMSO dans un ballon de Schlenk 50 mL séparé. Placer une cloison sur le cou et remuer sous atmosphère d’azote, jusqu'à ce que tout le fer a dissout.
- Canule de transférer la solution de fer à la solution de cyclopentadiényle sous atmosphère d’azote goutte à goutte au cours de 30 min. Une procédure plus détaillée, veuillez consulter la vidéo de « Synthèse d’un TI métallocène utilisant Schlenk ligne Technique » dans cette série de Chimie inorganique .
- Une fois l’addition terminée, remuez pendant un 30 min supplémentaire.
- Pendant ce temps, dans un becher de refroidir 45 mL de HCl de 6 M en ajoutant de la glace pilée (50 g) directement à la solution.
- Une fois que la réaction est terminée, versez le mélange sur la pâte et remuez pendant quelques minutes. Cristaux orange devrait former.
- Recueillir les cristaux sur un entonnoir Büchner (équipé de papier filtre) et laver le précipité avec de l’eau.
- Laissez les solides à sécher à l’air.
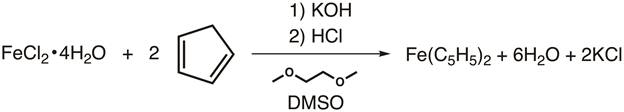
La figure 4. Synthèse du ferrocène.
3. purification du ferrocène. Purifier le produit par sublimation (pour une procédure plus détaillée, voir la vidéo de « Purification du ferrocène par Sublimation »).
4. caractérisation du ferrocène
- Préparer et recueillir un spectre de RMN H 1du ferrocène.
- Recueillir un spectre IR du ferrocène.
- Recueillir un voltamogramme cyclique du ferrocène (voir la vidéo « Voltampérométrie cyclique » dans la série Essentials of Analytical Chemistry ).
Résultats
Ferrocène caractérisation :
1 H RMN (chloroforme -d, 300 MHz, δ, ppm) : 4.15 (s).
Le spectre de RMN H 1du ferrocène montre clairement une résonance unique, cohérente avec la structure II.
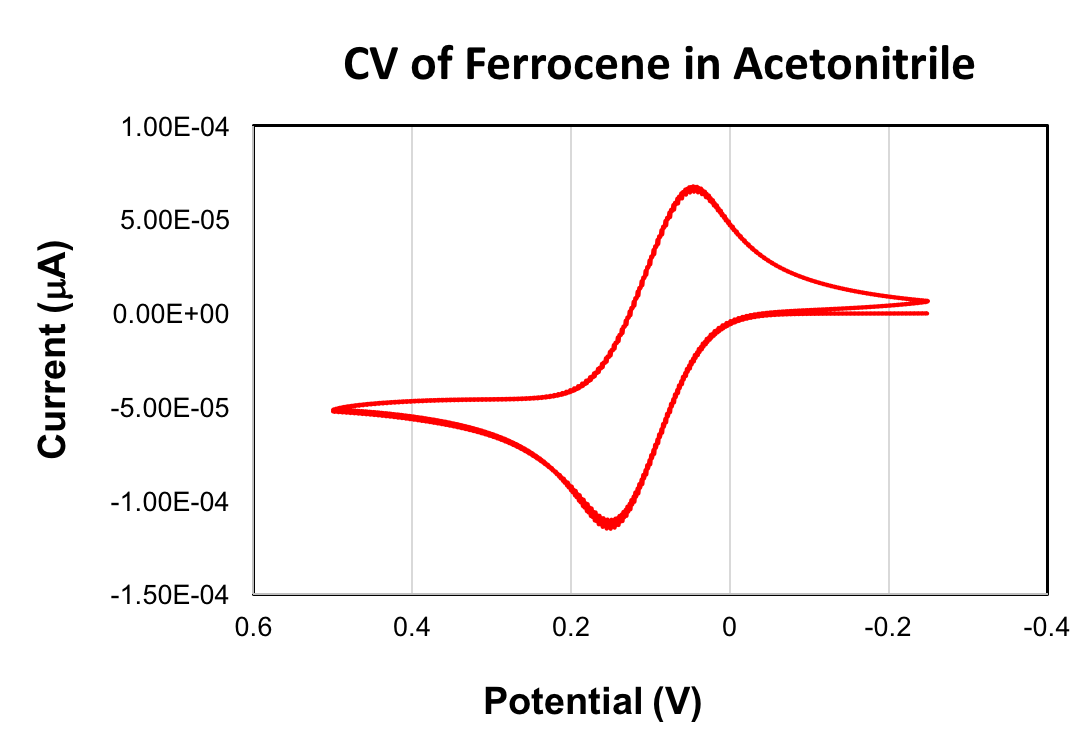
Un CV du ferrocène est donné ci-dessous. La valeur de1/2 Eobtenue pour l’oxydation du ferrocène est + 90 mV (acétonitrile, analyse taux 100 mV/s, 0,1 M (Bu4N) PF6, électrode de carbone vitreux travail). Le couple rédox ferrocène/ferrocénium est couramment utilisé comme référence en voltampérométrie cyclique. Lorsqu’il est utilisé comme référence, la valeur de1/2 Edu ferrocène est égale à 0 V.
Applications et Résumé
Dans cette vidéo, nous avons discuté de ferrocène et le rôle joué dans le développement de la chimie organométallique. Ferrocène a été synthétisé et caractérisé par la spectroscopie 1H RMN et IR. Les deux spectres sont compatibles avec la 18 e− Structure II, où le fer est « en sandwich » entre deux ligands cyclopentadiène, avec liaison égale pour tous les atomes de carbone 10 (Figure 1, Structure II). Oxydation du ferrocène ferrocénium cation a été observée par voie électrochimique.
En 1973, suite à la caractérisation du ferrocène, Wilkinson était l’un des deux chimistes décernés le prix Nobel de chimie « pour [son] travail de pionnier... sur la chimie de l’organométallique, ce qu’on appelé des complexes sandwich ». 6 son travail grandement influencé et élargi le domaine émergent de la chimie organométallique. Tandis que le premier composé organométallique a été préparé en 1849, il n’est qu’en 1950 que des progrès importants ont été faits pour comprendre comment les métaux peuvent lier aux atomes de carbone. Aujourd'hui, le domaine de la chimie organométallique ou la chimie des composés qui forment des liaisons métal-carbone, est essentielle pour de nombreuses applications. Cela inclut : énergie, colorant les cellules solaires, catalyse, polymérisation, la découverte de médicaments et synthèse, systèmes bioinorganique et diodes électroluminescentes organiques (OLED). 7
Ferrocène joue également un rôle actif dans le domaine de la chimie organométallique. Ferrocène participe volontiers de substitution aromatique électrophile ; en fait, c’est 100 000 fois plus réactif que le benzène dans ces réactions. Ferrocène a trouvé une application généralisée comme une composante structurelle des ligands bidentates dans la catalyse organométallique. Par exemple, 1, 1'-bis (diphénylphosphino) ferrocène (dppf) est un ligand chélatant utilisé dans la catalyse homogène. Le ligand dppf chélates 1st, 2èmeet 3rd row métaux de transition y compris Ni, Pd et PT. [dichlorure de ferrocene]palladium(II) 1,1'-Bis(diphenylphosphino) est un exemple d’un catalyseur au palladium couplage C-c et Formation d’une liaison C-hétéroatome (Figure 5). 8 dans la vidéo « MO théorie de métaux de Transition Complexes », nous résumera deux complexes métalliques, mettant en vedette dppf.
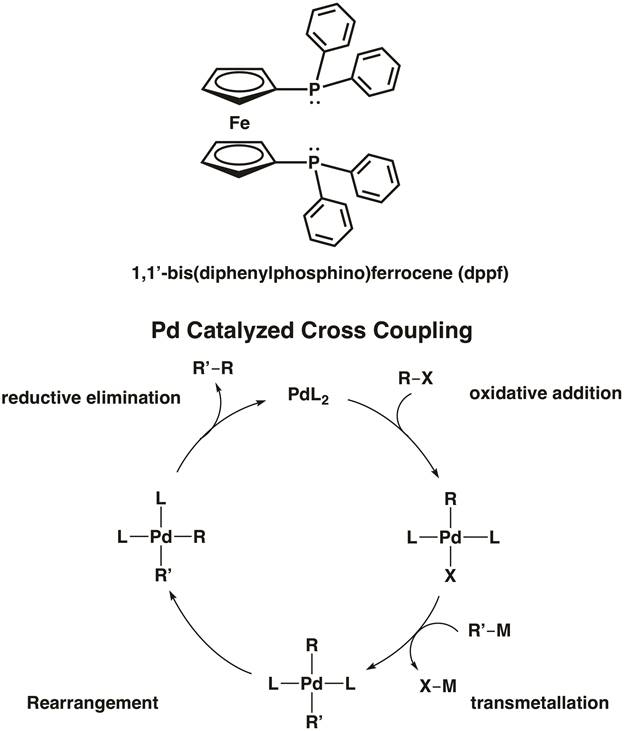
Figure 5. [Dichlorure de ferrocene]palladium(II) 1,1'-Bis(diphenylphosphino) est un catalyseur de couplage croisé de C-C et de la formation de la liaison C-X.
References
1. Kealy, T. J., Pauson, P. L. A New Type of Organo-Iron Compound. Nature. 168 (4285), 1039-1040 (1951).
2. Pauson, P. L. Ferrocene—how it all began. J Organomet Chem. 637, 3-6 (2001).
3. Seeman, J. I., Cantrill, S. Wrong but seminal. Nat Chem. 8 (3), 193-200 (2016).
4. Wilkinson, G., Rosenblum, M., Whiting, M. C., Woodward, R. B. The Structure of Iron Bis-cyclopentadienyl. 74, 2125-2126 (1952).
5. Green, M. L. H., Parkin, G. Application of the Covalent Bond Classification Method for the Teaching of Inorganic Chemistry. J Chem Educ. 91 (6), 807-816 (2014).
6. Press Release. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1973/press.html.
7. Crabtree, R. H. The Organometallic Chemistry of the Transition Metals, 6th ed. John Wiley & Sons. Hoboken. 2014.
8. Gildner, P. G., Colacot, T. J. Reactions of the 21st Century: Two Decades of Innovative Catalyst Design for Palladium-Catalyzed Cross-Couplings. Organometallics. 34, 5497-5508 (2015).
Passer à...
Vidéos de cette collection:

Now Playing
Structure du ferrocène
Inorganic Chemistry
79.1K Vues

Synthèse d'un métallocène de Ti(III) avec une ligne Schlenk
Inorganic Chemistry
31.5K Vues

Boîte à gants et capteurs d'impuretés
Inorganic Chemistry
18.6K Vues

Purification du Ferrocène par sublimation
Inorganic Chemistry
54.3K Vues

La méthode Evans
Inorganic Chemistry
68.0K Vues

Diffraction par rayons X : cristal vs poudre
Inorganic Chemistry
104.0K Vues

Spectroscopie par résonance paramagnétique électronique (RPE)
Inorganic Chemistry
25.4K Vues

Spectroscopie Mössbauer
Inorganic Chemistry
21.9K Vues

Interaction des acides et bases de Lewis au sein du complexe Ph3P-BH3
Inorganic Chemistry
38.7K Vues

Application de la théorie des groupes à la spectroscopie IR
Inorganic Chemistry
45.0K Vues

Théorie de l’orbital moléculaire (OM)
Inorganic Chemistry
35.1K Vues

Quadruples clusters métalliques
Inorganic Chemistry
15.3K Vues

Capteurs solaires teintés
Inorganic Chemistry
15.7K Vues

Synthèse d'un complexe de cobalt(II) porteur d'oxygène
Inorganic Chemistry
51.5K Vues

Initiation photochimique des réactions de polymérisation radicalaire
Inorganic Chemistry
16.7K Vues