水溶液の質量パーセントの組成を決定します。
概要
ソース: 博士ニール エイブラムスの研究室-環境科学および林業のニューヨーク州立大学
溶液の組成を決定する、重要な分析や科学捜査テクニックです。ソリューションは、水で作られています、水溶液、または含んでいる水であると呼ばれます。ソリューションの主なコンポーネントは、溶媒と呼ばれます、溶存微量成分溶質と呼びます。ソリューションを提案する溶剤で溶質を溶解します。水は、ほぼすべての生物学的システムと同様、日常生活の中で最も一般的な溶剤です。化学実験室に溶媒別液、アセトン、エーテル、アルコールなどがあります。溶質は液体または固体で、することができますが、この実験で固体のアドレス決定のみ。
原則
溶質は溶剤に溶解し、得られた溶液の質量は溶媒と溶質の質量の合計です。これは質量の保全法次します。
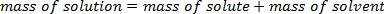
これは溶質の分子は溶媒の分子間のオープン スペースに収まるので、notadditive である、ボリュームの追加とは異なります、総量を予想以上に低い保ちます。質量 % を決定する、ソリューションの構成を分析するためのシンプルかつ重要な手法です。定義では、パーセント、全体と比較して 1 つのコンポーネントの小数、単位のない値です。この場合、質量パーセントとして数学的に表現できます。

質量 % は単位を付けませんが、その比較は質量 (重量) だけとない容積を伝えるためにこの値は時々 単位 (w/w) と表されます。% ボリュームでは、ボリューム (w/v) またはボリューム (v/v) ごとのボリュームあたりの重量として示されます。W/w の計算で分母が溶剤ではなく、ソリューション全体の質量であることに注意してくださいすることが重要です。質量パーセント濃度を決定する使用されますが、モル % は通常 anelement または分子グループのパーセントを計算するため使用されます。溶質と溶媒の全モル数が知られている必要があるために、ソリューションでモル % を計算することは困難です。これらの値が知られていた全体的な計算は無関係になります。
個別に溶媒や溶質の質量を得ることは、困難または不可能にすることができます。これらのケースで知られている組成ソリューションの検量線をプロデュース質量 % を決定する溶液の密度を使用できます。これはまず、知られるように次のよう必要があります: 溶液の濃度の溶質と合理的な範囲の id。ソリューションに 1 つ以上の溶質がある場合より複雑な解析のメソッドが必要です。たとえば、選択的析出またはイオン交換される可能性があります興味の溶質を分析します。シングル溶質ソリューション、十分な材料が一連の濃度既知のソリューションを作成する必要があります。ここで質量法による 2% を示します。
手順
1. 質量 - 直通 %
- クリーンとオーブン乾燥ビーカーまたは結晶皿にソリューションの少量を配置します。
- ソリューションの正確な総質量を正確に判断するには後、ビーカーまたはホット プレート、水をオフ駆動するオーブン皿を加熱します。ゆっくりと蒸発させる最良の方法は、ソリューションの飛散は、沸騰することができます。
- 溶媒が蒸発すると、一度 (溶質) の残りの固体を冷却し、質量を決定します。
- 質量百分率を計算します。

2. 質量の校正曲線を用いた %
- 溶媒に溶質の既知量を溶解することにより標準溶液のシリーズを作る。5 つの規格が推奨され、最大の期待されるパーセント組成範囲最小でなければなりません。
- おおよその値が既知の場合は、0% から水中の溶質の溶解度最大までソリューションのシリーズを生成します。参照テーブルは、さまざまな温度範囲で水で多くのソリッドの最大溶解度を示す。
- たとえば、35% (w/w) 塩化ナトリウム (NaCl) ソリューションを作成する、フラスコに 35 g を追加し、65 g を追加 (または 65 mL ボリュームとしても使えます 1.0 グラム/mL の周囲温度で知られている密度から純粋な水を測定するとき) 水・ ミックス ソリューション固体が溶解するまで。質量ですので添加物、これはなるトータル ソリューションは、100 グラムの質量を持つので、十分な水を追加すると同じ。
- 各標準溶液の正確な量の質量を測定した後として密度を計算します。
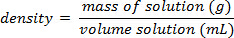
3. データ分析
- 標準溶液の質量割合に対して密度の値をプロットし、線の傾きを決定します。この坂は、線形方程式を当てはめて、溶液の質量 % 対密度に対応するy = mx+b と(図 1)。
- ソリューションの特定のボリュームの質量を取得することで未知試料溶液の密度を計算します。今ではラインの傾きは知られている測定密度と検量線からの斜面を利用した"x"に解決の溶質の質量割合を判断します。
結果
図 1に示す例を使用して、一連の塩化ナトリウム標準溶液中の溶質の 25.00%、20.00% 15.00% 10.00% 5.000% の質量パーセント組成と用意されていた。測定密度は 1.090 g/mL、1.070、1.060 1.042 1.025 であった。方程式を当てはめて、線形近似曲線が適用されるこれらのデータをプロットした後y = 3.446 x 10-3x + 1.0048, yは、密度、 xは質量パーセント組成。
次に、未知の割合の組成の溶液の 10.00 g 量は測定、9.497 mL であると判断します。ボリュームで質量を除した密度 1.053 g/mL として計算されます。線形方程式に密度値を挿入する、質量 %、 x:として決定されます。
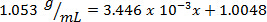

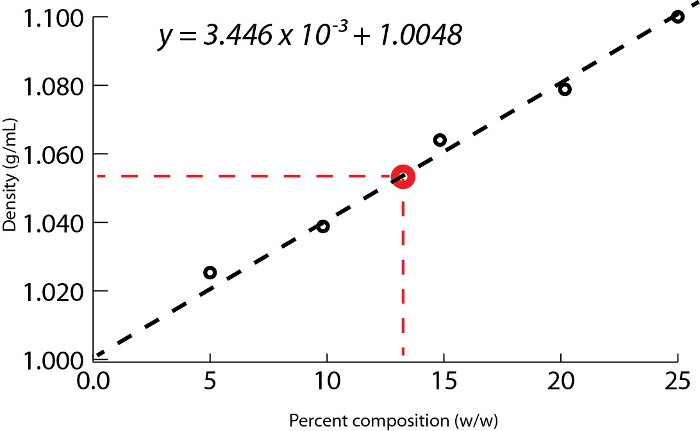
図 1。塩化ナトリウム水溶液の質量パーセント組成の関数としての密度。
申請書と概要
ソーダ、砂糖の割合は、determinedusing 質量パーセント組成の原理を簡単にできます。この実験を行うための手順は、質量と脱ソーダ (気泡なし) の量を測定してソリューションの密度を計算するでしょう。対でいくつかの標準的なショ糖 (砂糖) solutionswould 質量パーセント濃度の検量線を作成する必要があり、その校正はソーダでショ糖の割合を解決する使用できます。1 つの仮定は、ショ糖が true 非無糖ソーダ ソーダの密度の変化に大きく貢献。
海水は水に溶解したいくつかの異なる塩から成る例えば、塩化ナトリウム、MgCl2、および NaBr2。それは校正曲線を用いた質量 % を決定することは困難だろうが、蒸発は問題にシンプルなソリューションを提供します。海水の知られていた大容量を取得し、それを蒸発、溶質溶媒を蒸発後の量によって質量を決定できます。その後、溶質の質量は、海水中の塩 (溶存固形物) の質量パーセントを計算する元のソリューションの総質量で割った値必要があります。
水分子と水和物と呼びますイオン性化合物のさまざまながあります。化合物における水分子の数は、パーセント組成によって決定することができます。たとえば、塩化コバルト (II) は通常青、ピンクになり、それは水和時。5.0 グラム ピンク コバルト (II) 塩化物水和物を加熱ポイントに青に変わり、青色の固体の最終的な質量は 2.73 として記録されます。2.27 g の違いは、水和固体の 5 g は、水の質量に対応しています。元のサンプルは、質量で 45.4% 水だった。モル質量値に変換する、によって 0.02101 モル塩化コバルト (129.93 g/mol) と水 (18 g/mol) の 0.126 ほくろが存在するを計算できます。最小値を割った判定できます 6 モル水のすべての 1 モル塩化コバルトのため存在していること。
スキップ先...
このコレクションのビデオ:

Now Playing
水溶液の質量パーセントの組成を決定します。
General Chemistry
383.2K 閲覧数

共通の実験室ガラス製品と用途
General Chemistry
655.2K 閲覧数

・濃度
General Chemistry
273.6K 閲覧数

固体と液体の密度を決定します。
General Chemistry
555.5K 閲覧数

経験式を決定します。
General Chemistry
180.6K 閲覧数

イオン性化合物の溶解度ルールの決定
General Chemistry
141.3K 閲覧数

PH メーターを使用してください。
General Chemistry
344.9K 閲覧数

滴定の概要
General Chemistry
423.8K 閲覧数

理想気体法律
General Chemistry
78.3K 閲覧数

平衡定数の吸光光度定量
General Chemistry
158.3K 閲覧数

ル Châtelier の原理
General Chemistry
264.8K 閲覧数

未知の化合物を決定するための凝固点降下
General Chemistry
160.6K 閲覧数

率の法律および反作用の順序を決定します。
General Chemistry
195.8K 閲覧数

エンタルピーの示差走査熱量測定の変更を使用してください。
General Chemistry
44.4K 閲覧数

錯体化学
General Chemistry
91.3K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved