Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
Überblick
Quelle: Labor von Dr. Neal Abrams – SUNY College of Environmental Science and Forestry
Bestimmung der Zusammensetzung der Lösung ist eine wichtige analytische und forensische Technik. Wenn Lösungen mit Wasser vorgenommen werden, werden sie bezeichnet als wässrige oder mit Wasser. Die primäre Komponente einer Lösung nennt man als Lösungsmittel und gelöster Nebenkomponente nennt sich der gelöste Stoff. Der gelöste Stoff wird in das Lösungsmittel zu einer Lösung aufgelöst. Wasser ist das am häufigsten verwendete Lösungsmittel im Alltag, sowie fast allen biologischen Systemen. In Chemie-Labors möglicherweise das Lösungsmittel eine andere Flüssigkeit, wie Aceton, Äther oder Alkohol. Der gelöste Stoff kann eine Flüssigkeit oder ein Feststoff, aber dieses experiment nur Addressesthe Bestimmung der Feststoffe.
Grundsätze
Wenn ein gelöster Stoff in einem Lösungsmittel aufgelöst wird, ist die Masse der resultierenden Lösung eine Summe der Masse des gelösten Stoffes und das Lösungsmittel. Dies folgt dem Gesetz der Erhaltung der Masse:
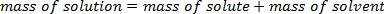
Dies unterscheidet sich von der Zugabe von Bänden, die Notadditive, da die Moleküle des gelösten Stoffes in Freiflächen zwischen den Molekülen des Lösungsmittels passen und hält das Gesamtvolumen niedriger als erwartet. Prozent von Masse zu bestimmen, ist eine einfache und wichtige Technik für die Analyse einer Lösung Make-up. Per Definition ist ein Prozent eine gebrochene, ohne Einheitenangabe Wert einer Komponente im Vergleich zu den gesamten. In diesem Fall kann die Prozent durch Masse als mathematisch dargestellt werden:

Obwohl Prozent durch Masse-Einheit-weniger ist, ist dieser Wert manchmal mit den Einheiten (w/w) vertreten, zu vermitteln, dass der Vergleich von Masse (Gewicht) nur und nicht nach Volumen ist. Prozent von Volumes werden als Gewicht pro Volumen (w/V) oder Volumen pro Volumen (V/V) angegeben. In w/w Berechnungen ist es wichtig zu beachten, dass der Nenner die Masse der gesamten Lösung, nicht das Lösungsmittel ist. Während Prozent durch Masse verwendet wird, um die Lösungskonzentration bestimmen, wird Prozent von Mole normalerweise verwendet, um den Prozentsatz der Anelement oder einer Gruppe in einem Molekül zu berechnen. Es ist schwierig, Prozent von Maulwurf in einer Lösung zu berechnen, da die gesamte Maulwürfe von gelösten und Lösungsmittel bekannt sein müssten. Wenn diese Werte bekannt waren, wäre der Gesamtberechnung irrelevant.
In einigen Fällen kann die Erlangung der Mass des Lösungsmittel oder gelösten individuell schwierig oder nicht praktikabel sein. In diesen Fällen kann die Dichte einer Lösung zur Masse Prozent herangezogen werden durch die erste Produktion einer Kalibrationskurve Lösungen mit bekannten Kompositionen. Dies erfordert zunächst Folgendes bekannt sein: die Identität des gelösten Anda angemessenen Bereich der Konzentration der Lösung. Komplexere Analyseverfahren sind erforderlich, wenn mehr als ein gelöster Stoff in Lösung vorhanden ist. Z. B. selektive Fällung oder Ionenaustausch ließe sich ein gelöster Stoff interessant zu analysieren. Für gelöste Einzellösungen muss genügend Material um eine Reihe von Lösungen bekannter Konzentration vorliegen. Zwei Prozent von Masse Methoden werden hier demonstriert.
Verfahren
(1) Prozent durch Masse - Direct
- Legen Sie ein kleines Volumen einer Lösung in eine saubere und Ofen getrocknet Becher oder Kristallisation Gericht.
- Erhitzen Sie nach der genauen Bestimmung der genauen Gesamtmasse der Lösung die Becher oder Schale auf einer Herdplatte oder in einem Ofen, aus dem Wasser zu fahren. Langsame Verdunstung ist die beste Methode, als Kochen spritzt der Lösung führen kann.
- Sobald das Lösungsmittel verdampft ist, die restlichen Solid (gelösten) kühl und bestimmen die Masse.
- Berechnen Sie die Masse Prozent als:

(2) Prozent durch Masse - mit Hilfe einer Eichkurve
- Machen Sie eine Reihe von standard-Lösungen von bekannten Größen des gelösten Stoffes in einem Lösungsmittel auflösen. Fünf-Standards werden empfohlen und sollte reichen vom Minimum bis die maximale erwartete prozentuale Zusammensetzungen.
- Wenn der ungefähre Wert unbekannt ist, produzieren Sie eine Reihe von Lösungen, die die maximale Löslichkeit des gelösten Stoffes im Wasser von 0 % hin. Referenztabellen stehen zur Verfügung um die maximale Löslichkeit für viele Feststoffe im Wasser über eine Vielzahl von Temperaturbereichen anzugeben.
- Um beispielsweise eine 35 % (w/w) Natriumchlorid (NaCl) Lösung, produzieren eine Flasche 35 g hinzufügen, dann fügen Sie 65 g (oder 65 mL als Volume kann auch verwendet werden, wenn reines Wasser zu messen, da die Dichte bekannt ist, 1,0 g/mL bei Umgebungstemperaturen) von Wasser und mischen die Lösung bis zur Auflösung der Feststoff. Denn Masse ist additiv, das wäre das gleiche wie das genug Wasser hinzufügen, so dass die Gesamtlösung eine Masse von 100 g hat.
- Nach der Messung der Mass eine präzise Volumen der einzelnen Standardlösungen, berechnen der Dichte:
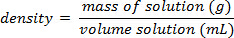
(3) Datenanalyse
- Die Dichtewerte gegen den Prozentsatz durch Masse der standard-Lösungen des Grundstückes und die Steigung der Linie zu bestimmen. Diese Neigung entspricht die Dichte gegen Masse Prozent die passende einer lineare Gleichung, Lösung y = Mx + b (Abbildung 1).
- Berechnen Sie die Dichte der Lösung der unbekannten Probe durch den Erhalt der Mass des spezifischen Volumens der Lösungen. Nun, da die Steigung der geraden bekannt ist, bestimmen Sie die Prozent durch Masse des gelösten Stoffes durch die Lösung für "X" über die gemessene Dichte und die Neigung von der Kalibrierkurve.
Ergebnisse
Mit dem Beispiel in Abbildung 1dargestellt, war eine Reihe von Natrium-Chlorid-Standards mit Masse Prozent Kompositionen von 5.000 % 10,00 %, 15.00 %, 20,00 % und 25,00 % des gelösten Stoffes in Lösung bereit. Die gemessenen dichten waren 1.025, 1.042 1.060, 1.070 und 1,090 g/mL, beziehungsweise. Nach diesen Daten Plotten, eine lineare Trendlinie angewendet wird, passt die Gleichung y = 3.446 x 10-3X + 1.0048, wo y ist die Dichte und x ist die Masse prozentuale Zusammensetzung.
Als nächstes ist das Volumen von 10,00 g Lösung mit unbekannter prozentuale Zusammensetzung gemessen und entschlossen, 9,497 mL betragen. Indem man die Masse durch das Volumen, wird die Dichte als 1,053 g/mL berechnet. Die lineare Gleichung den Dichtewert einfügen, wird die Masse Prozent als x: bestimmt.
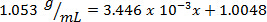

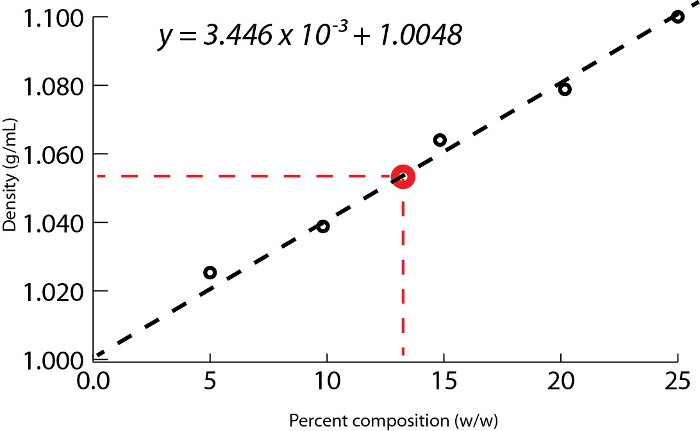
Abbildung 1. Wässrigen Natriumchlorid-Lösung Dichte als Funktion der prozentuale Zusammensetzung von Masse.
Anwendung und Zusammenfassung
Der Anteil des Zuckers im Soda, könnte leicht sein Determinedusing das Prinzip der Masse prozentuale Zusammensetzung. Die Vorgehensweise dieses Experiment wäre, Masse und Volumen entgast Soda (keine Bläschen) zu messen und um die Lösung Dichte zu berechnen. Eine Kalibrierkurve des Dichte vs. Prozent durch Masse für mehrere standard Saccharose (Zucker) Solutionswould geschaffen werden müssen, und dann könnte dieser Kalibrierung verwendet werden, um für den Prozentsatz der Saccharose in der Soda zu lösen. Eine Annahme ist, dass Saccharose den größten Anteil an eine Änderung der Dichte für Soda, das gilt für nicht-zuckerfreie Limonade.
Meerwasser besteht aus mehrere verschiedene Salze in Wasser aufgelöst; z. B. NaCl, MgCl2und NaBr2. Zwar wäre es schwierig zu bestimmen, Masse Prozent unter Verwendung einer Kalibrierkurve, bietet Verdunstung eine einfache Lösung für das Problem. Indem ein bekannter Masse von Meerwasser und es verdunstet, kann die Masse ermittelt werden, durch die Menge des gelösten Stoffes nach das Lösungsmittel verdunstet ist. Anschließend muss die Masse des gelösten Stoffes durch die Gesamtmasse der ursprünglichen Lösung zur Berechnung der Masse Prozent der Salze (gelöste Feststoffe) im Meerwasser geteilt werden.
Es gibt eine Vielzahl von ionische Verbindungen, die Wasser-Moleküle und werden als Hydrate bezeichnet. Die Anzahl der Wassermoleküle an einer Verbindung kann durch prozentuale Zusammensetzung bestimmt werden. Z. B. Kobalt (II)-Chlorid ist normalerweise blau, aber verfärbt sich rosa, wenn es hydratisiert ist. 5,0 Gramm rosa Kobalt (II)-Chlorid-Hydrat wird erhitzt, bis zu dem Punkt wird es blau, wenn die endgültige Masse der solid Blue wird als 2.73 aufgezeichnet. Der Unterschied, 2,27 g entspricht der Masse des Wassers, das auf dem 5 g hydratisiert fester wurde. Der Originalprobe war 45,4 % Wasser durch Masse. Durch die Umwandlung Massewerte, Maulwürfe, kann berechnet werden, dass 0,02101 Maulwürfe von Kobalt-Chlorid (129.93 g/Mol) und 0,126 Mol Wasser (18 g/Mol) vorhanden sind. Dividieren durch den kleinsten Wert, kann festgestellt werden, dass für jeden ein Maulwurf von Kobalt-Chlorid 6 Mol Wasser vorliegen.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
General Chemistry
383.3K Ansichten

Labor-Glaswaren und deren Verwendung
General Chemistry
655.3K Ansichten

Lösungen und Konzentrationen
General Chemistry
273.7K Ansichten

Bestimmung der Dichte von Fest- und Flüssigstoffen
General Chemistry
555.6K Ansichten

Ermittlung der Summenformel
General Chemistry
180.7K Ansichten

Bestimmung der Löslichkeit von ionischen Verbindungen
General Chemistry
141.3K Ansichten

Verwendung eines pH-Meters
General Chemistry
345.1K Ansichten

Einführung in die Titration
General Chemistry
423.9K Ansichten

Ideale Gasgleichung
General Chemistry
78.3K Ansichten

Spektrophotometrische Bestimmung der Gleichgewichtskonstante
General Chemistry
158.3K Ansichten

Das Prinzip von Le Chatelier
General Chemistry
264.9K Ansichten

Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
General Chemistry
160.6K Ansichten

Bestimmung der Ratengleichung und der Reaktionsreihenfolge
General Chemistry
195.9K Ansichten

Verwendung der dynamischen Differenzkalorimetrie zur Messung von Enthalpieänderungen
General Chemistry
44.4K Ansichten

Komplexchemie
General Chemistry
91.3K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten