Method Article
血行動態変化と高血圧に基づく頭蓋内動脈瘤の改変マウスモデル
* これらの著者は同等に貢献しました
要約
頭蓋内動脈瘤(IA)は、高血圧と血行動態の変化の危険因子を使用してマウスで構築されました。血行動態の変化は頸動脈の結紮枝によって誘発され、高血圧は腎動脈の後枝を結紮することによって達成されました。IA形成は、磁気共鳴血管造影法、立体顕微鏡法、および病理学的分析によって検出されました。
要約
頭蓋内動脈瘤 (IA) は、動脈瘤の破裂に関連する罹患率と死亡率により、重大な健康リスクをもたらします。しかし、IA発生の根底にある分子メカニズムは依然として不明であり、適切なマウスモデルが必要です。IAのマウスモデルは、翼状口蓋動脈(PPA)をライゲーションして相加的な血行動態変化を誘発し、高血圧誘導と組み合わせることで確立されました。C57BL/6雄マウスでは、右PPA、外頸動脈(ECA)、後頭動脈(OcA)、左対側総頸動脈(CCA)などの血管を結紮して血行動態変化を誘導した。1週間後、腎動脈の両側後枝(pRA)を結紮し、高血圧を誘発するために8%の塩食を導入しました。誘導後3か月のIAの形態学的および病理学的変化を評価するために、磁気共鳴血管造影法(MRA)、実体顕微鏡法、および免疫組織化学染色(IHC)が行われました。実験群では、最初の導入後に4匹のマウスが死亡しました。異なる場所でのIAは、残りの11匹のマウスのうち5匹で検出されました。顕微鏡検査とMRA検査の両方でIA形成が確認されました。病理学的およびIHC解析により、内部弾性ラミナの破壊、コラーゲン繊維の切断、およびCD86陽性M1マクロファージの浸潤が明らかになり、ヒトIAで観察されたものと一致する結果が得られました。このIAのマウスモデルは、ヒトサンプルで観察された病理学的変化を再現し、IAの形成と進行の分子メカニズムを調査するための貴重なツールとして役立つ可能性があります。
概要
頭蓋内動脈瘤(IA)の有病率は、一般人口の3.2%と推定されています1。IAは、関連する罹患率と死亡率が高いため、重大な健康リスクをもたらします。IAは、血行動態の変化、炎症、および血管リモデリングの影響を受ける複雑で多次元の病理学的状態です2,3。血行動態の変化と高血圧は、動脈瘤の形成と進行に関与しています4,5。IAは、血行動態のせん断応力が高い大脳分岐部で頻繁に発生し6、狭角の分岐部はヒトのIA発症の危険因子として特定されています7。血管内治療や外科的戦略の進歩にもかかわらず、IA破裂によるくも膜下出血は依然として壊滅的です。したがって、薬理学的治療を探求することは、動脈瘤破裂を予防するための有望なアプローチです8。しかし、IAの病態形成と進行の根底にあるメカニズムは不明のままです。ヒトのリスク因子に基づいて、IAの形成と進行に適したマウスモデルを開発することは、根本的なメカニズムを明らかにし、潜在的な治療標的を特定するために重要です。本研究は、ヒトのIA特性を模倣したマウスにおける破裂を伴わないIA形成のモデルを構築することを目指す。
ウィリス円(CW)は、右内頸動脈(ICA)、左ICA、および両側椎脳底動脈を接続および連絡します。CWは、ICAまたは椎骨動脈9の閉塞または狭窄の場合の代償メカニズムとして機能します。翼状口蓋動脈(PPA)は、脳10の外部部分に血液を供給するICAの枝である。CWの代償機能に基づいて、PPA閉塞はICAの血流を増加させます。左総頸動脈(CCA)、右外頸動脈(ECA)、および後頭動脈(OcA)の結紮を組み合わせると、特に狭角でCWの血流が増加し、血行動態の変化につながります。このモデルでは、脳への血液供給は椎骨脳底動脈と右ICAによって支えられています。PPA結紮は、マウスの死亡率に寄与しなかった11。
エラスターゼ注射に基づくIAモデルを誘導するために、アルゼットポンプまたは酢酸デオキシコルチコステロン(DOCA)-塩12,13を介したアンジオテンシン-II(Ang-II)放出により高血圧を誘発しました。AlzetとDOCAの高コストは、多数の動物を含む実験で考慮する必要があります。達成された高血圧のレベルは、両側腎動脈の後枝と下枝の結紮、または両側腎動脈の後枝のみの結紮の間で有意差はありませんでした。しかし、前者のアプローチはより大きな腎機能障害をもたらしました14。したがって、両側後腎動脈 (pRA) の結紮は、ほとんどの研究者にとって合理的な方法と考えられています。
エラスターゼは、単回定位注射12を介して右基底槽の脳脊髄液に注入された。エラスターゼ注射ベースのIAモデルは、注射15,16の3週間後に60%-80%のIA破裂を引き起こしましたが、これはIAの形成と発達を研究するには短すぎます。さらに、IA形成中のヒトのエラスターゼレベルの上昇を示唆する証拠はありません。さらに、右槽への定位固定装置の注射は、マウスの高い死亡率と障害と関連しており、初心者にとって大きな課題となっています。
本研究では、ヒトのリスク因子に基づいて、3ヶ月以内に破裂しないIAのマウスモデルを構築しました。このモデルにより、DOCAとAlzetに関連する高コストが排除されます。また、実体顕微鏡のみで行うことができ、初心者でも簡単に習得できます。
プロトコル
マウスのすべての操作手順は、倫理審査委員会の基準に準拠し、上海交通大学の動物施設管理および使用委員会によって承認されました。C57BL/6雄マウス(8週齢、20-25g)を22°Cの温度で飼育し、明暗サイクルを12時間/12時間で行いました。運用プロセスを 図 1A に示します。簡単に言えば、麻酔動物では、左総頸動脈(CCA)、右外頸動脈(ECA)、後頭動脈(OcA)、および翼状口蓋動脈(PPA)を結紮して血行動態の変化を誘導しました。その後、血行動態変化の開始から1週間後に両側腎動脈(bRA)を結紮することにより高血圧を誘発し、動物に8%の塩分を含む飼料を与えました。血行動態の変化とIA形成を 図1Bに示します。この研究で使用した試薬と機器の詳細は、 材料表に記載されています。
1. 血行動態変化と高血圧に基づくマウスUIAの確立
注:マウスは手術前に12時間絶食しました。手術器具は、70%アルコールに少なくとも30分間浸すことにより滅菌しました。
- 37°Cに維持された加熱パッド上で、O2 (1 L / min)の混合物で2%イソフルランを吸入した小動物麻酔器を使用して(施設で承認されたプロトコルに従って)麻酔を投与します。
- 左CCAをライゲートする
- 頸部の正中線に沿って1cmの直線的な切開を行います。皮下組織と板腫を解剖して気管を露出させます。
- 頸静脈を引き離し、気管に沿って頸動脈鞘を見つけます(図2A i、ii)。左のCCAを迷走神経から分離します。左のCCAを6-0シルク縫合糸で結紮します(図2A、iii、iv)。
- 適切なECAとOcAのライゲーション
- 右側のCCA、ICA、ECA、OcA、迷走神経、舌下神経の解剖学的構造を露出させます。6-0シルク縫合糸で右ECAを結紮します(図2Aiii、iv)。
- OcAを分離し、8-0でライゲートします。絹縫合糸(図2A v - viii)。2つのまっすぐなマイクロ鉗子を使用してOcAを切断します。
注:ECAから近位に発生するOcAは、舌下神経の下にあります(図2A v - viii)。OcAを解剖すると、PPAの解剖学的構造を効果的に公開するのに役立ちます。
- 適切なPPAをリケートする
- ICAから舌下神経を分離します。舌下神経とICAの間に手術用綿を置き、手術関連の損傷から神経を保護します。
- マイクロ鉗子を使用して、PPAの周りの血管周囲組織を解剖します。PPAをクランプし、一時的に軽く引き上げます。8-0 で配置するPPAを結紮するためのPPAとICAの間の絹縫合糸(図2A、ix、x)。
- PPAを結紮し、結紮部位とPPAの起点との間に十分な距離を維持して、ウィリスの円の血流を確保します(図2A×)。
注:このステップの主な課題は、末梢神経や血管構造を損なうことなく、非常に狭い手術空間内でPPAを結紮することです。PPA曝露中に気管を圧迫することは避けてください。
- 操作を完了する
- ポビドンヨードで手術野を滅菌し、傷口を縫合します。マウスが麻酔から回復するまでマウスを監視します。
- 高血圧を誘発する
- 背中の12番目の 椎骨レベルで2cmの長さの正中線を切開します。背側の筋肉を切って腎臓を露出させます。鉗子を使用して腎臓の周りの脂肪組織を固定し、腎臓を筋肉切開部に固定します(図2B i、ii)。
- 腎茎の周りの脂肪組織を分離します。腎静脈と密接に接触しているpRAを特定します(図2Biii、iv)。pRAをクランプし、まっすぐなマイクロ鉗子を使用して引き上げます。別のマイクロ鉗子を使用して、pRAと腎静脈の間の筋膜を解剖します(図2B、v、vi)。
注:壊滅的な出血につながる可能性のある腎静脈の損傷を防ぐために注意してください。 - pRAを6-0シルク縫合糸で結紮します(図2B vii、viii)。結紮の直後に、腎臓の上部に形成される虚血性病巣を観察します(図2B 、ix、x)。筋肉と皮膚の切開部を縫合します。
2. MRAと実体顕微鏡 による IA検査
- 動脈瘤導入の 3 か月後に Time-of-Flight (TOF) 7.0 T 磁気共鳴血管造影法 (MRA) を実行して、IA 形成を評価します。
- イソフルラン麻酔後の放血および子宮頸部脱臼 により マウスを安楽死させます(制度的に承認されたプロトコルに従います)。以前に報告されたように、実体顕微鏡でIAを検出します17。
- サンプルに冷却されたPBSを注入し、続いて4%パラホルムアルデヒドを注入し、次にMicrofilを注入して血管と動脈瘤を視覚化します。
- 動脈瘤を、親動脈の1.5倍の大きさの外側に膨らんでいると定義すると、2人の独立した脳神経外科医によって観察されます8,18。
3. 組織学的および免疫組織化学的な解析
- 顕微鏡でウィリスの円を分離します。試料を4%パラホルムアルデヒドで4°Cで24時間19分固定します。
- 標本をパラフィン切片および凍結切片に加工し、組織学的染色および免疫蛍光染色を行います。パラフィン切片をEVGおよびMasson染色で染色するには、製造元の指示に従ってください19。
- パラフィン切片をブロッキング溶液でインキュベートし、非特異的結合を最小限に抑えます。
- CD86に対する一次抗体と切片を4°Cで一晩インキュベートします。 二次抗体とのインキュベーション後、切片をDAB20と反応させることにより茶色を発色します。
- ヘマトキシリンで対比染色を行い、切片を水封入液20でマウントする。
結果
IA形成率
実験群(n = 15)では、最初の手順後の最初の1週間以内に2匹のマウスが不明な理由で死亡しました。1匹のマウスは2回目の手術後3日目に背中の傷の感染症で死亡し、もう1匹のマウスは動脈瘤が検出されず、不明な理由で38日目に死亡しました。対照群(n=5)では、5匹のマウス全員が犠牲になるまで生存した。実験群の生存マウス(n = 11)では、導入後3か月の収縮期血圧は導入前よりも有意に高かった(1.39mmHg ±90 vs 1.83 mm Hg±126.63; P < 0.0001)。対照群(n = 5)では、導入前および犠牲時に血圧は一定に保たれました(88 ± 2.34 mm Hg 対91.8 ± 1.2 mm Hg; P > 0.05)。
IAの評価と所見
実験群では、生存マウス11匹中5匹で、MRAと光学顕微鏡を用いて異なる部位の動脈瘤を検出しました。動脈瘤は前大脳動脈-嗅動脈分岐部に2つ、前連通動脈に2つ、後大脳動脈に1つありました(図3)。さらに、11匹のマウスのうち2匹は、前大脳動脈と中大脳動脈に曲がりくねった動きを示しました。動脈瘤はいずれも導入後3ヶ月以内に破裂しませんでした。実験群の11匹のマウスのうち4匹、または対照群の5匹のマウスのいずれにも動脈瘤の変化は観察されませんでした。.
組織学的および免疫蛍光検査
ヒトの脳動脈瘤では、血管壁は弾性薄板の破壊、培地の脱細胞化、コラーゲン線維の切断、およびM1マクロファージの浸潤によって特徴付けられます21。コントロール血管と比較して、EVG-Verhoeff染色はIA組織の内側弾性層に有意な破壊を明らかにしました(図4A)。マッソン染色では、IA壁のコラーゲン線維のかなりの切断が示されました(図4B)。免疫組織化学的分析により、動脈瘤壁にCD86陽性マクロファージが有意に浸潤していることが示されました(図4C、D)。
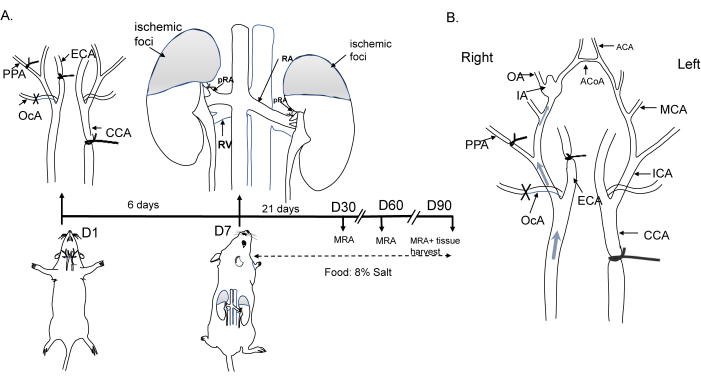
図1:マウス動脈瘤モデルの誘導の図。 (A)左総頸動脈、右外頸動脈、翼状口蓋動脈、および腎動脈の両側後枝の結紮と、8%NaCl食の概略図。(B)ウィリスの円の流れの変化と動脈瘤の形成につながる血行動態の変化。略語:ACA、前大脳動脈;ACoA、前部連絡動脈;CCA、総頸動脈;ECA、外部頸動脈;IA、頭蓋内動脈瘤;MCA、中大脳動脈;MRA、磁気共鳴血管造影;OA、嗅覚動脈;OcA、後頭動脈;PPA、翼状口蓋動脈。 この図の拡大版を表示するには、ここをクリックしてください。

図2:動脈結紮の解剖学的および概略図。 (A)頸部の動脈の露出と結紮。i-iv、左CCAの結紮;v-vi、右ECAの結紮;vii-viii、右OcAの結紮; ix-x、右PPAのライゲーション。(B)腎動脈の後枝(pRA)の曝露と結紮。i-iv、右pRAの曝露;v-vi、pRAの分離;vii-viii、pRAの結紮;ix-x、腎臓を元の位置に戻します。この図の拡大版を表示するには、ここをクリックしてください。

図3:頭蓋内動脈瘤の形態学的変化 (A)対照群における嗅動脈と前大脳動脈の正常な分岐部。(B)嗅動脈と前大脳動脈の分岐部における典型的な動脈瘤の変化をMRAおよび顕微鏡で観察(赤矢印)。倍率:6倍 この 図の拡大版を表示するには、ここをクリックしてください。

図4:頭蓋内動脈瘤の病理学的解析。 (A)EVG染色:正常群の弾性層は無傷で滑らかですが、動脈瘤群の弾性層は破壊されています。(B)マッソン染色:正常群ではコラーゲン線維は無傷ですが、動脈瘤群では多数のコラーゲン線維が途切れています。(C)CD86のIHC染色:CD86陽性細胞は正常群には存在しないが、動脈瘤壁には有意に存在している。スケールバー = 200 μm (拡大されていない画像の場合);50 μm (拡大画像の場合)、***P < 0.001。略語:IA、頭蓋内動脈瘤。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この研究は、PPAのライゲーションを通じてIAのマウスモデルを構築するための修正されたアプローチを提示し、高血圧と組み合わせて相加的な血行動態変化を誘発します。MRAイメージングと顕微鏡分析により、ウィリスの円に顕著な動脈瘤の変化が示されました。このモデルで観察された病理学的変化は、ヒトサンプルで見つかったものと一致しています。このマウスモデルは、IAの形成と発生の根底にある分子メカニズムを調査するための貴重なツールとして役立つ可能性があります。
IAは、左CCA、ECA、OcA、PPA、および両側後腎動脈(pRA)を高塩分食とともにライゲーションすることにより、マウスで誘導されました。Caiらは、正常な血圧でラット動脈瘤モデルを確立するために同様の手順を採用し、脳動脈瘤と前大脳動脈の拡張を特定した22。Miyamotoらは、左のCCAのみをライゲーションした場合と比較して、右のPPAと右のECAを追加でライゲーションすると、ラットのIA形成が有意に増加したことを報告しました。ECAおよびPPAの結紮は、血流量を増加させることにより血行動態の変化を増幅し得る18。ヒトでは、頸動脈閉塞は頭蓋内動脈瘤の形成と関連している23。したがって、このIAの改変マウスモデルは、IAの形成と発達を探索するために有益であることが証明される可能性があります。
調査研究における動物種の選択は重要であり、明確な研究目的を果たします。何十年にもわたって使用されてきたラットモデルは、内部弾性薄板の断片化や平滑筋細胞層の薄化など、特定の病理学的特徴を示します。ラットモデルは、主に動脈瘤の病因を調査するために使用されます24,25。一方、ウサギモデルは、血管内治療に関連する前臨床試験に特に適しています26,27,28。これらのモデルと比較して、マウスはライフサイクルが短く、トランスジェニック操作性があるため、遺伝子解析に適しています。さらに、マウスは、オルソログ遺伝子の発現および機能において、ヒトのものと有意な類似性を示す29。したがって、マウスモデルは実験室での研究に最適な選択肢となります。
以前の研究では、頭蓋内動脈瘤(IA)がエラスターゼを使用してマウスに誘発され、弾性薄層30を分解しました。エラスターゼに基づく動脈瘤は、ヒトで観察されるものと同様の形態学的および組織学的変化を示します31,32,33、それらは高い破裂率と関連しており、IA破裂の研究に有利です。しかし、エラスターゼによって誘発される血管の衰弱は、IA形成の自然なプロセスを正確に表しているわけではありません。ヒトIAの病理学的特徴を再現する現在のモデルは、IA形成の2つの独立した危険因子に基づいて開発され、3か月の観察期間中に破裂をもたらさなかった。
この研究にはいくつかの制限があります。マウスモデルは相加的な血行動態の変化と高血圧によって誘導されたが、小さなサンプルサイズでの脳動脈瘤の発生率は決定されず、総頸動脈の結紮または後腎動脈の両側結紮のみによって誘発された動脈瘤の発生率とも比較されなかった34。観察期間は3か月に制限されており、IA形成の自然なプロセスを部分的にシミュレートしていますが、破裂の可能性を排除するものではありません。人間の複雑でリアルな血行動態を再現することは、依然として課題です。さらに、PPAの追加結紮によって引き起こされる血行動態の変化は評価されておらず、血流の変化は正確に測定されていませんでした。それにもかかわらず、マウスのIAはMRAを使用して検出され、観察された病理学的変化はヒトのIAで観察されたものと一致していました。このIAのマウスモデルは、IA形成の過程を調べるための貴重なツールです。
開示事項
原稿は、指名されたすべての著者によって読まれ、承認されており、著者の基準を満たしているがリストされていない人は他にいません。著者らは、原稿に関連する利益相反はなく、この研究の結果に影響を与えた可能性のある多額の財政的支援はありませんでした。資金提供者は、データ収集、データ分析、または論文執筆に関与していませんでした。この原稿は、ジャーナル、ウェブサイト、ブログなど、これまでにオンラインまたは印刷物で公開されていません。
謝辞
本研究は、国立トランスレーショナル医療施設(Shanghai TMSK-2021-147)、上海仁済病院研究プロジェクト(RJTJ-QT-007)、中国ポスドク科学基金会(認証番号:2024M760658)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 7.0 T magnetic resonance angiography | Bruker | BioSpec 70/20 | |
| C57BL/6 mice | Charles River Laboratories | sex: male | |
| CD86 antibody | CST | 91882 | |
| Elastic Van Gieson (EVG)stain | Solarbio | G1597 | |
| Masson | Solarbio | G1340 | |
| Micro forcep | Shanghai Jinzhong Instrument Company | ||
| Microfil | Flow Tech Inc. | MV-120 | |
| Small animal anesthesia machine | RWD | R500 | |
| Stereo microscope | Shanghai Optical Instrument Company | XYH-6B | |
| Suture | Shanghai Jinhuan Medical Company | 6-0, 8-0 |
参考文献
- Vlak, M. H., Algra, A., Brandenburg, R., Rinkel, G. J. Prevalence of unruptured intracranial aneurysms, with emphasis on sex, age, comorbidity, country, and time period: A systematic review and meta-analysis. Lancet Neurol. 10 (7), 626-636 (2011).
- Turjman, A. S., Turjman, F., Edelman, E. R. Role of fluid dynamics and inflammation in intracranial aneurysm formation. Circulation. 129 (3), 373-382 (2014).
- Shikata, F., et al. Potential influences of gut microbiota on the formation of intracranial aneurysm. Hypertension. 73 (2), 491-496 (2019).
- Penn, D. L., Komotar, R. J., Sander Connolly, E. Hemodynamic mechanisms underlying cerebral aneurysm pathogenesis. J Clin Neurosci. 18 (11), 1435-1438 (2011).
- Vlak, M. H., Rinkel, G. J., Greebe, P., Algra, A. Independent risk factors for intracranial aneurysms and their joint effect: A case-control study. Stroke. 44 (4), 984-987 (2013).
- Alfano, J., et al. Intracranial aneurysms occur more frequently at bifurcation sites that typically experience higher hemodynamic stresses. Neurosurgery. 73 (3), 497-505 (2013).
- Idil Soylu, A., Ozturk, M., Akan, H. Can vessel diameters, diameter ratios, and vessel angles predict the development of anterior communicating artery aneurysms: A morphological analysis. J Clin Neurosci. 68, 250-255 (2019).
- Starke, R. M., et al. Critical role of TNF-alpha in cerebral aneurysm formation and progression to rupture. J Neuroinflammation. 11, 77 (2014).
- Vrselja, Z., Brkic, H., Mrdenovic, S., Radic, R., Curic, G. Function of circle of Willis. J Cereb Blood Flow Metab. 34 (4), 578-584 (2014).
- Azedi, F., et al. Intra-arterial drug delivery to the ischemic brain in rat middle cerebral artery occlusion model. Bio Protoc. 9 (23), e3438 (2019).
- Yoshimura, S., et al. Reliable infarction of the middle cerebral artery territory in C57BL/6 mice using pterygopalatine artery ligation and filament optimization - The PURE-MCAo model. J Cereb Blood Flow Metab. , (2024).
- Nuki, Y., et al. Elastase-induced intracranial aneurysms in hypertensive mice. Hypertension. 54 (6), 1337-1344 (2009).
- Tada, Y., et al. Roles of hypertension in the rupture of intracranial aneurysms. Stroke. 45 (2), 579-586 (2014).
- Eldawoody, H., et al. Simplified experimental cerebral aneurysm model in rats: Comprehensive evaluation of induced aneurysms and arterial changes in the circle of Willis. Brain Res. 1300, 159-168 (2009).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2014).
- Furukawa, H., et al. Mast cell promotes the development of intracranial aneurysm rupture. Stroke. 51 (11), 3332-3339 (2020).
- Dungan, C. M., et al. Deletion of SA beta-Gal+ cells using senolytics improves muscle regeneration in old mice. Aging Cell. 21 (1), e13528 (2022).
- Miyamoto, T., et al. Site-specific elevation of interleukin-1beta and matrix metalloproteinase-9 in the Willis circle by hemodynamic changes is associated with rupture in a novel rat cerebral aneurysm model. J Cereb Blood Flow Metab. 37 (8), 2795-2805 (2017).
- Xu, C., et al. CD147 monoclonal antibody attenuates abdominal aortic aneurysm formation in angiotensin II-Infused apoE(-/-) mice. Int Immunopharmacol. 122, 110526 (2023).
- Taube, J. M., et al. Multi-institutional TSA-amplified multiplexed immunofluorescence reproducibility evaluation (MITRE) study. J Immunother Cancer. 9 (7), e002197 (2021).
- Frosen, J., et al. Saccular intracranial aneurysm: Pathology and mechanisms. Acta Neuropathol. 123 (6), 773-786 (2012).
- Cai, J., He, C., Yuan, F., Chen, L., Ling, F. A novel haemodynamic cerebral aneurysm model of rats with normal blood pressure. J Clin Neurosci. 19 (1), 135-138 (2012).
- Arnaout, O. M., et al. De novo large fusiform posterior circulation intracranial aneurysm presenting with subarachnoid hemorrhage 7 years after therapeutic internal carotid artery occlusion: case report and review of the literature. Neurosurgery. 71 (3), E764-E771 (2012).
- Nagata, I., Handa, H., Hashimoto, N., Hazama, F. Experimentally induced cerebral aneurysms in rats: Part VI. Hypertension. Surg Neurol. 14 (6), 477-479 (1980).
- Aoki, T., Kataoka, H., Morimoto, M., Nozaki, K., Hashimoto, N. Macrophage-derived matrix metalloproteinase-2 and -9 promote the progression of cerebral aneurysms in rats. Stroke. 38 (1), 162-169 (2007).
- Grunwald, I. Q., et al. An experimental aneurysm model: a training model for neurointerventionalists. Interv Neuroradiol. 12 (1), 17-24 (2006).
- Brinjikji, W., Ding, Y. H., Kallmes, D. F., Kadirvel, R. From bench to bedside: Utility of the rabbit elastase aneurysm model in preclinical studies of intracranial aneurysm treatment. J Neurointerv Surg. 8 (5), 521-525 (2016).
- Adibi, A., Eesa, M., Wong, J. H., Sen, A., Mitha, A. P. Combined endovascular coiling and intra-aneurysmal allogeneic mesenchymal stromal cell therapy for intracranial aneurysms in a rabbit model: A proof-of-concept study. J Neurointerv Surg. 9 (7), 707-712 (2017).
- Liao, B. Y., Zhang, J. Evolutionary conservation of expression profiles between human and mouse orthologous genes. Mol Biol Evol. 23 (3), 530-540 (2006).
- Han, Y., et al. Axl promotes intracranial aneurysm rupture by regulating macrophage polarization toward M1 via STAT1/HIF-1alpha. Front Immunol. 14, 1158758 (2023).
- Wang, S., et al. Rabbit aneurysm models mimic histologic wall types identified in human intracranial aneurysms. J Neurointerv Surg. 10 (4), 411-415 (2018).
- Nowicki, K. W., Hosaka, K., Walch, F. J., Scott, E. W., Hoh, B. L. M1 macrophages are required for murine cerebral aneurysm formation. J Neurointerv Surg. 10 (1), 93-97 (2018).
- Shi, Y., et al. Nrf-2 signaling inhibits intracranial aneurysm formation and progression by modulating vascular smooth muscle cell phenotype and function. J Neuroinflammation. 16 (1), 185 (2019).
- Morimoto, M., et al. Mouse model of cerebral aneurysm: experimental induction by renal hypertension and local hemodynamic changes. Stroke. 33 (7), 1911-1915 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved