Method Article
نموذج فأر معدل لتمدد الأوعية الدموية داخل الجمجمة يعتمد على التغير الديناميكي الدموي وارتفاع ضغط الدم
* These authors contributed equally
In This Article
Summary
تم إنشاء تمدد الأوعية الدموية داخل الجمجمة (IA) في الفئران باستخدام عوامل خطر ارتفاع ضغط الدم والتغيرات الديناميكية الدموية. تم إحداث تغيرات ديناميكية الدم عن طريق ربط فروع الشريان السباتي ، بينما تم تحقيق ارتفاع ضغط الدم عن طريق ربط الفروع الخلفية للشريان الكلوي. تم الكشف عن تكوين IA من خلال تصوير الأوعية بالرنين المغناطيسي والفحص المجهري المجسم والتحليل المرضي.
Abstract
يشكل تمدد الأوعية الدموية داخل الجمجمة (IA) خطرا صحيا كبيرا بسبب المراضة والوفيات المرتبطة بتمزق تمدد الأوعية الدموية. ومع ذلك ، لا تزال الآليات الجزيئية الكامنة وراء تطور IA غير واضحة ، ويلزم وجود نموذج فأر مناسب. تم إنشاء نموذج فأر من IA عن طريق ربط الشريان الجفري (PPA) للحث على تغييرات ديناميكية دموية مضافة ، جنبا إلى جنب مع تحريض ارتفاع ضغط الدم. في ذكور الفئران C57BL / 6 ، تم ربط الأوعية ، بما في ذلك PPA الأيمن ، والشريان السباتي الخارجي (ECA) ، والشريان القذالي (OcA) ، والشريان السباتي المشترك الأيسر المقابل (CCA) ، لإحداث تغيرات ديناميكية للدم. بعد أسبوع واحد ، تم ربط الفروع الخلفية الثنائية للشريان الكلوي (pRA) ، وتم إدخال نظام غذائي ملحي بنسبة 8٪ للحث على ارتفاع ضغط الدم. تم إجراء تصوير الأوعية بالرنين المغناطيسي (MRA) ، والفحص المجهري المجسمة ، والتلوين الكيميائي المناعي (IHC) لتقييم التغيرات المورفولوجية والمرضية في IA بعد ثلاثة أشهر من التحريض. في المجموعة التجريبية ، ماتت أربعة فئران بعد الحث الأولي. تم الكشف عن IA في مواقع مختلفة في خمسة من الفئران الأحد عشر المتبقية. أكدت كل من الفحوصات المجهرية و MRA تكوين IA. كشفت التحليلات المرضية و IHC عن اضطراب الصفيحة المرنة الداخلية ، وانفصال ألياف الكولاجين ، وتسلل الضامة M1 الإيجابية CD86 ، وهي نتائج تتفق مع تلك التي لوحظت في IA البشري. يكرر نموذج الفأر هذا من IA التغيرات المرضية التي لوحظت في العينات البشرية وقد يكون بمثابة أداة قيمة للتحقيق في الآليات الجزيئية لتكوين IA وتقدمه.
Introduction
يقدر انتشار تمدد الأوعية الدموية داخل الجمجمة (IA) ب 3.2٪ من عامةالسكان 1. يشكل IA خطرا صحيا كبيرا بسبب ارتفاع معدلات المراضة والوفيات المرتبطة به. IA هي حالة مرضية معقدة ومتعددة الأبعاد تتأثر بالتغيرات الديناميكية الدموية والالتهابات وإعادة تشكيل الأوعيةالدموية 2،3. تشارك التغيرات الديناميكية الدموية وارتفاع ضغط الدم في تكوين وتطور تمدد الأوعية الدموية4،5. يحدث IA بشكل متكرر في التشعبات الدماغية مع إجهاد القص الديناميكي الدمويالمرتفع 6 ، ويتم تحديد التشعبات ذات الزوايا الضيقة كعوامل خطر لتطور IA لدى البشر7. على الرغم من التقدم في العلاجات داخل الأوعية الدموية والاستراتيجيات الجراحية ، إلا أن النزيف تحت العنكبوتية الناجم عن تمزق IA لا يزال كارثيا. لذلك ، يعد استكشاف العلاجات الدوائية نهجا واعدا لمنع تمزق تمدد الأوعيةالدموية 8. ومع ذلك ، فإن الآليات الكامنة وراء التكوين المرضي وتطور IA لا تزال غير واضحة. يعد تطوير نموذج فأر مناسب لتكوين IA وتطوره ، بناء على عوامل الخطر البشرية ، أمرا بالغ الأهمية للكشف عن الآليات الأساسية وتحديد الأهداف العلاجية المحتملة. تهدف هذه الدراسة إلى بناء نموذج لتكوين IA دون تمزق في الفئران التي تحاكي خصائص IA البشرية.
تربط دائرة ويليس (CW) وتتصل بالشريان السباتي الداخلي الأيمن (ICA) ، واليسار، والشرايين الفقرية القاعدية الثنائية. يعمل CW كآلية تعويضية في حالات انسداد أو تضيق ICA أو الشريان الفقري9. الشريان الجفري (PPA) هو فرع من ICA الذي يزود الدم إلى الجزء الخارجي منالدماغ 10. بناء على الوظيفة التعويضية ل CW ، يزيد انسداد PPA من تدفق الدم في ICA. يؤدي الجمع بين ربط الشريان السباتي المشترك الأيسر (CCA) والشريان السباتي الخارجي الأيمن (ECA) والشريان القذالي (OcA) إلى زيادة تدفق الدم في CW ، خاصة في الزوايا الضيقة ، مما يؤدي إلى تغيرات ديناميكية الدم. في هذا النموذج ، يتم دعم تدفق الدم إلى الدماغ بواسطة الشريان الفقري القاعدي و ICA الأيمن. لم يساهم ربط PPA في وفيات الفئران11.
للحث على نموذج IA على أساس حقن الإيلاستاز ، تم إحداث ارتفاع ضغط الدم عن طريق إطلاق الأنجيوتنسين-II (Ang-II) عبر مضخة Alzet أو أسيتات deoxycorticosterone (DOCA) - ملح12،13. يجب مراعاة التكلفة العالية ل Alzet و DOCA في التجارب التي تشمل عددا كبيرا من. لم تكن المستويات المحققة من ارتفاع ضغط الدم مختلفة بشكل كبير بين ربط الفروع الخلفية والسفلية للشرايين الكلوية الثنائية أو الفروع الخلفية للشرايين الكلوية الثنائية فقط. ومع ذلك ، أدى النهج السابق إلى زيادة الخلل الكلوي14. لذلك ، يعتبر ربط الشرايين الكلوية الخلفية الثنائية (pRA) طريقة عقلانية لمعظم الباحثين.
تم حقن الإيلاستاز في السائل النخاعي في الخزان القاعدي الأيمن عن طريق حقنة تجسيمية واحدة12. تسبب نموذج IA القائم على حقن الإيلاستاز في تمزق IA بنسبة 60٪ -80٪ بعد ثلاثة أسابيع من الحقن15،16 ، وهو أقصر من أن يدرس تكوين IA وتطوره. علاوة على ذلك ، لا يوجد دليل يشير إلى ارتفاع مستويات الإيلاستاز في البشر أثناء تكوين IA. بالإضافة إلى ذلك ، يرتبط الحقن التجسيمي في الخزان الأيمن بارتفاع معدل الوفيات والعجز لدى الفئران ، مما يشكل تحديات كبيرة للمبتدئين.
في هذه الدراسة ، تم إنشاء نموذج فأر ل IA بدون تمزق في غضون ثلاثة أشهر بناء على عوامل الخطر البشرية. يلغي هذا النموذج التكلفة العالية المرتبطة ب DOCA و Alzet. علاوة على ذلك ، يمكن إجراؤه باستخدام مجهر مجسمة فقط ويمكن للمبتدئين إتقانه بسهولة.
Protocol
التزمت جميع الإجراءات التشغيلية في الفئران بمعايير لجنة المراجعة الأخلاقية وتمت الموافقة عليها من قبل اللجنة المؤسسية لرعاية واستخدامها بجامعة شنغهاي جياوتونغ. تم إيواء C57BL / 6 ذكور الفئران (8 أسابيع ، 20-25 جم) عند درجة حرارة 22 درجة مئوية مع دورة ضوء / ظلام 12 ساعة / 12 ساعة. والعملية التشغيلية موضحة في الشكل 1 أ. باختصار ، في المخدرة ، تم ربط الشريان السباتي المشترك الأيسر (CCA) ، والشريان السباتي الخارجي الأيمن (ECA) ، والشريان القذالي (OcA) ، والشريان الجفري (PPA) لإحداث تغيرات ديناميكية دموية. تم إحداث ارتفاع ضغط الدم لاحقا عن طريق ربط الشرايين الكلوية الثنائية (bRA) بعد أسبوع واحد من بدء التغيرات الديناميكية الدموية ، وتم تغذية بنظام غذائي يحتوي على 8٪ ملح. تم تصوير التغيرات الديناميكية الدموية وتشكيل IA في الشكل 1 ب. وترد تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة في جدول المواد.
1. إنشاء UIA للفأر على أساس التغيرات الديناميكية الدموية وارتفاع ضغط الدم
ملاحظة: تم صيام الفئران لمدة 12 ساعة قبل العملية. تم تعقيم الأدوات الجراحية عن طريق نقعها في 70٪ كحول لمدة 30 دقيقة على الأقل.
- يتم تطبيق التخدير (باتباع البروتوكولات المعتمدة مؤسسيا) باستخدام جهاز تخدير حيواني صغير مع استنشاق إيزوفلوران بنسبة 2٪ في خليط من O2 (1 لتر/دقيقة) على وسادة ساخنة يتم الحفاظ عليها عند 37 درجة مئوية.
- ربط CCA الأيسر
- قم بعمل شق خطي بطول 1 سم على طول خط الوسط العنقي. تشريح الأنسجة تحت الجلد وبلاتيزما لكشف القصبة الهوائية.
- اسحب الوريد الوداجي بعيدا وحدد موقع غمد الشريان السباتي على طول القصبة الهوائية (الشكل 2 أ ، الأول ، الثاني). افصل CCA الأيسر عن العصب المبهم. اربط CCA الأيسر بخياطة حريرية 6-0 (الشكل 2 أ ، ثالثا ، رابع).
- ربط ECA و OcA المناسبين
- كشف التركيب التشريحي ل CCA و ICA و ECA و OcA والعصب المبهم والعصب تحت اللسان على الجانب الأيمن. اربط ECA الأيمن بخياطة حريرية 6-0 (الشكل 2 أ ، ثالثا ، رابع).
- اعزل OcA وربطه ب 8-0 خياطة الحرير (الشكل 2 أ الخامس - الثامن). افصل OcA باستخدام ملقطين دقيقين مستقيمين.
ملاحظة: يقع OcA ، الذي ينشأ بالقرب من ECA ، أسفل العصب تحت اللسان (الشكل 2A v - viii). يساعد تشريح OcA على فضح تشريح PPA بشكل فعال.
- ربط PPA الصحيح
- عزل العصب تحت اللسان عن ICA. ضع القطن الجراحي بين العصب تحت اللسان و ICA لحماية العصب من الإصابات المرتبطة بالإجراء.
- قم بتشريح الأنسجة المحيطة بالأوعية الدموية حول PPA باستخدام ملقط دقيق. قم بتثبيت PPA واسحبه مؤقتا برفق. ضع 8-0 خياطة الحرير بين PPA و ICA لربط PPA (الشكل 2 أ ix ، x).
- اربط PPA وحافظ على مسافة كافية بين موقع الربط وأصل PPA لضمان تدفق الدم في دائرة ويليس (الشكل 2 أ س).
ملاحظة: التحدي الأساسي في هذه الخطوة هو ربط PPA داخل مساحة تشغيل ضيقة للغاية دون إضعاف الأعصاب الطرفية وهياكل الأوعية الدموية. تجنب ضغط القصبة الهوائية أثناء التعرض ل PPA.
- إنهاء العملية
- تعقيم المجال التشغيلي ببوفيدون اليود وخياطة الجرح. راقب الفئران حتى تتعافى من التخدير.
- تحفيز ارتفاع ضغط الدم
- قم بعمل شق خط الوسط بطول 2 سم عندمستوى العمود الفقري 12 على الظهر. قطع العضلات الظهرية لفضح الكلى. قم بتثبيت الأنسجة الدهنية حول الكلى باستخدام الملقط وقم بتثبيت الكلية داخل شق العضلات (الشكل 2 ب ، الأول ، الثاني).
- عزل الأنسجة الدهنية حول عنيق الكلى. حدد pRA على اتصال وثيق بالوريد الكلوي (الشكل 2 ب ثالثا ، رابع). قم بتثبيت pRA واسحبه لأعلى باستخدام ملقط دقيق مستقيم. قم بتشريح اللفافة بين pRA والوريد الكلوي باستخدام ملقط دقيق آخر (الشكل 2 ب الخامس ، السادس).
ملاحظة: توخي الحذر لمنع تلف الوريد الكلوي ، مما قد يؤدي إلى نزيف كارثي. - اربط pRA بخياطة حريرية 6-0 (الشكل 2 ب السابع ، الثامن). مباشرة بعد الربط ، لاحظ البؤر الإقفارية التي تتشكل في الجزء العلوي من الكلى (الشكل 2 ب التاسع ، x). خياطة شقوق العضلات والجلد.
2. فحص IA عبر MRA والمجهر المجسم
- إجراء تصوير الأوعية بالرنين المغناطيسي (MRA) بعد ثلاثة أشهر من تحريض تمدد الأوعية الدموية لتقييم تكوين تمدد الأوعية الدموية.
- القتل الرحيم للفئران عن طريق الإخراج وخلع عنق الرحم بعد تخدير الأيزوفلوران (باتباع البروتوكولات المعتمدة مؤسسيا). كشف IA تحت مجهر مجسم كما تم الإبلاغ عنهسابقا 17.
- قم بغرس العينات ب PBS المبرد ، متبوعا بنسبة 4٪ بارافورمالدهيد ، ثم Microfil لتصور الأوعية الدموية وتمدد الأوعية الدموية.
- تعريف تمدد الأوعية الدموية على أنه انتفاخ خارجي أكبر بمقدار 1.5 مرة من الشريان الأم ، كما لاحظ جراحو أعصابمستقلان 8،18.
3. تحليلات الكيمياء النسيجية والمناعية
- اعزل دوائر ويليس تحت المجهر. ثبت العينات بنسبة 4٪ بارافورمالدهيد عند 4 درجات مئوية لمدة 24 ساعةو 19.
- قم بمعالجة العينات في أقسام البارافين والمجمدة لتلوين الأنسجة والتألق المناعي. تلطيخ أقسام البارافين ببقع EVG و Masson وفقا لتعليمات الشركات المصنعة19.
- احتضان أقسام البارافين بمحلول حجب لتقليل الارتباط غير المحدد.
- احتضان الأقسام بالأجسام المضادة الأولية ضد CD86 طوال الليل عند 4 درجات مئوية. بعد الحضانة بجسم مضاد ثانوي ، قم بتطوير لون بني من خلال تفاعل الأقسام مع DAB20.
- قم بإجراء تلطيخ مضاد باستخدام الهيماتوكسيلين وقم بتركيب الأقسام بمحلول تركيب مائي20.
النتائج
معدل تكوين IA
في المجموعة التجريبية (ن = 15) ، توفي فأران خلال الأسبوع الأول بعد الإجراء الأولي لأسباب غير معروفة. توفي فأر واحد بسبب عدوى في جرح الظهر في اليوم الثالث بعد الإجراء الثاني ، وتوفي فأر آخر في اليوم 38 لأسباب غير معروفة ، دون اكتشاف تمدد الأوعية الدموية. في المجموعة الضابطة (ن = 5) ، نجت جميع الفئران الخمسة حتى التضحية. بين الفئران الباقية على قيد الحياة في المجموعة التجريبية (ن = 11) ، كان ضغط الدم الانقباضي بعد ثلاثة أشهر من التحريض أعلى بكثير مما كان عليه قبل التحريض (90 ± 1.39 ملم زئبق مقابل 126.63 ± 1.83 ملم زئبق. ص < 0.0001). في المجموعة الضابطة (ن = 5) ، ظل ضغط الدم ثابتا قبل الحث وعند التضحية (88 ± 2.34 ملم زئبق مقابل 91.8 ± 1.2 ملم زئبق ؛ ص > 0.05).
تقييم التدقيق الداخلي ونتائجه
في المجموعة التجريبية ، تم اكتشاف تمدد الأوعية الدموية في مواقع مختلفة في 5 من 11 فأرا على قيد الحياة باستخدام MRA والفحص المجهري الضوئي. تم وضع تمدد الأوعية الدموية في تشعبات الشريان الدماغي الأمامي ، واثنان في الشريان المتصل الأمامي ، وواحد في الشريان الدماغي الخلفي (الشكل 3). بالإضافة إلى ذلك ، أظهر 2 من 11 فأرا التواء في الشريان الدماغي الأمامي والشريان الدماغي الأوسط. لم يتمزق أي من تمدد الأوعية الدموية في غضون ثلاثة أشهر من التحريض. لم يلاحظ أي تغيرات في تمدد الأوعية الدموية في 4 من 11 فأرا في المجموعة التجريبية أو في أي من الفئران الخمسة في المجموعة الضابطة.
الفحص النسيجي والتألق المناعي
في تمدد الأوعية الدموية الدماغية البشرية ، يتميز جدار الأوعية الدموية باضطراب الصفيحة المرنة ، وإزالة الخلايا من الوسائط ، وانفصال ألياف الكولاجين ، وتسلل البلاعم M121. بالمقارنة مع التحكم في الأوعية الدموية ، كشف تلطيخ EVG-Verhoeff عن اضطراب كبير في الطبقة المرنة الداخلية في أنسجة IA (الشكل 4 أ). أظهر تلطيخ ماسون انفصالا كبيرا لألياف الكولاجين في جدران IA (الشكل 4 ب). أشار التحليل الكيميائي المناعي إلى تسلل كبير للضامة الإيجابية CD86 في جدار تمدد الأوعية الدموية (الشكل 4C ، D).
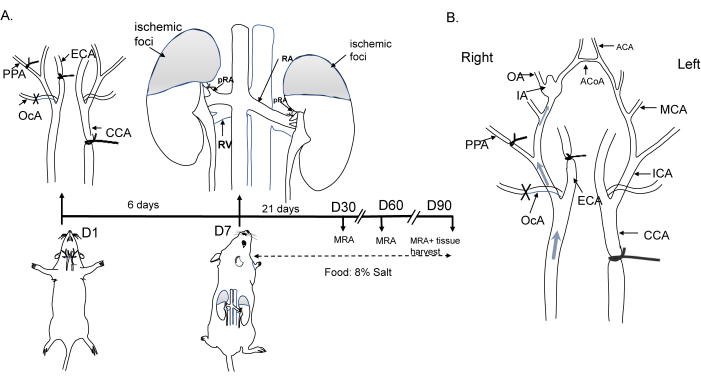
الشكل 1: رسم تخطيطي لتحريض نموذج تمدد الأوعية الدموية في الفأر. (أ) تمثيل تخطيطي لربط الشريان السباتي المشترك الأيسر ، والشريان السباتي الخارجي الأيمن ، والشريان الجفري ، والفروع الخلفية الثنائية للشريان الكلوي ، جنبا إلى جنب مع نظام غذائي كلوريد الصوديوم بنسبة 8٪. (ب) التغيرات الديناميكية الدموية التي تؤدي إلى تغيرات في التدفق في دائرة ويليس وتكوين تمدد الأوعية الدموية. الاختصارات: ACA ، الشريان الدماغي الأمامي. ACoA, الشريان الاتصال الأمامي; CCA, الشريان السباتي المشترك; ECA, الشريان السباتي الخارجي; IA ، تمدد الأوعية الدموية داخل الجمجمة. MCA, الشريان الدماغي الأوسط; MRA ، تصوير الأوعية بالرنين المغناطيسي. الزراعة العضوية ، الشريان الشمي. OcA, الشريان القذالي; PPA ، الشريان الظفرة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: المخططات التشريحية والتخطيطية لربط الشرايين. (أ) التعرض للشرايين في الرقبة وربطها. أنا-الرابع, ربط CCA الأيسر; V-VI ، ربط ECA الصحيح ؛ السابع - الثامن ، ربط الحق OcA ؛ ix-x ، ربط PPA الأيمن. (ب) التعرض وربطها للفروع الخلفية للشريان الكلوي (pRA). i-iv ، التعرض ل pRA الأيمن ؛ V-VI ، فصل pRA ؛ السابع - الثامن ، ربط pRA ؛ التاسع العاشر ، عودة الكلى إلى وضعها الأصلي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التغيرات المورفولوجية في تمدد الأوعية الدموية داخل الجمجمة. (أ) التشعب الطبيعي للشريان الشمي والشريان الدماغي الأمامي في المجموعة الضابطة. (ب) التغيرات النموذجية في تمدد الأوعية الدموية عند تشعب الشريان الشمي والشريان الدماغي الأمامي التي لوحظت في MRA وتحت المجهر (السهم الأحمر). التكبير: 6x. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التحليل المرضي لتمدد الأوعية الدموية داخل الجمجمة. (أ) تلطيخ EVG: الطبقة المرنة في المجموعة الطبيعية سليمة وناعمة ، بينما تتعطل الطبقة المرنة في مجموعة تمدد الأوعية الدموية. (ب) تلطيخ ماسون: ألياف الكولاجين سليمة في المجموعة الطبيعية ، بينما ينقطع عدد كبير من ألياف الكولاجين في مجموعة تمدد الأوعية الدموية. (ج) تلطيخ IHC ل CD86: الخلايا الإيجابية CD86 غائبة في المجموعة الطبيعية ولكنها موجودة بشكل كبير في جدار تمدد الأوعية الدموية. أشرطة المقياس = 200 ميكرومتر (للصور غير المكبرة) ؛ 50 ميكرومتر (للصور المكبرة) ، ***P < 0.001. اختصار: IA ، تمدد الأوعية الدموية داخل الجمجمة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تقدم هذه الدراسة نهجا معدلا لبناء نموذج فأر ل IA من خلال ربط PPA للحث على تغييرات ديناميكية الدم المضافة مع ارتفاع ضغط الدم. أظهر التصوير بالرنين المغناطيسي والتحليل المجهري تغيرات كبيرة في تمدد الأوعية الدموية في دائرة ويليس. تتوافق التغيرات المرضية التي لوحظت في هذا النموذج مع تلك الموجودة في العينات البشرية. قد يكون نموذج الفأر هذا بمثابة أداة قيمة للتحقيق في الآليات الجزيئية الكامنة وراء تكوين IA وتطوره.
تم تحفيز IA في الفئران عن طريق ربط الشرايين الكلوية الخلفية الليفية اليسرى ، و ECA ، و OcA ، و PPA ، والشرايين الكلوية الخلفية الثنائية (pRA) ، جنبا إلى جنب مع نظام غذائي غني بالملح. استخدم Cai et al. إجراء مشابها لإنشاء نموذج تمدد الأوعية الدموية في الفئران مع ضغط دم طبيعي وتحديد تمدد الأوعية الدموية الدماغية وتوسيع الشرايين الدماغيةالأمامية 22. أفاد مياموتو وآخرون أنه بالمقارنة مع ربط CCA الأيسر فقط ، فإن الربط الإضافي ل PPA الأيمن و ECA الأيمن زاد بشكل كبير من تكوين IA في الفئران. قد يؤدي ربط ECA و PPA إلى تضخيم التغيرات الديناميكية الدموية عن طريق زيادة حجم تدفق الدم18. في البشر ، تم ربط انسداد الشريان السباتي بتكوين تمدد الأوعية الدموية داخل الجمجمة23. لذلك ، قد يكون نموذج الفأر المعدل هذا من IA مفيدا لاستكشاف تكوين وتطوير IA.
يعد اختيار الأنواع الحيوانية في الدراسات البحثية أمرا بالغ الأهمية ويخدم أغراضا بحثية متميزة. تظهر نماذج الفئران ، التي تم استخدامها لعقود من الزمن ، سمات مرضية محددة مثل تجزئة الصفيحة المرنة الداخلية وترقق طبقة خلايا العضلات الملساء. تستخدم نماذج الفئران في الغالب للتحقيق في التسبب في تمدد الأوعية الدموية24،25. من ناحية أخرى ، تعتبر نماذج الأرانب مناسبة بشكل خاص للدراسات قبل السريرية المتعلقة بعلاج الأوعية الدموية26،27،28. بالمقارنة مع هذه النماذج ، يفضل استخدام الفئران للتحليلات الجينية نظرا لدورات حياتها الأقصر وقابليتها للتلاعب بالجينات المعدلة وراثيا. بالإضافة إلى ذلك ، تظهر الفئران تشابها كبيرا في التعبير عن الجينات المتعامدة ووظيفتها مع جينات البشر29. وبالتالي ، تمثل نماذج الفئران الخيار الأمثل للتحقيقات المختبرية.
في الدراسات السابقة ، تم إحداث تمدد الأوعية الدموية داخل الجمجمة (IAs) في الفئران باستخدام الإيلاستاز لتحلل الصفيحة المرنة30. على الرغم من أن تمدد الأوعية الدموية القائمة على الإيلاستاز تظهر تغيرات مورفولوجية ونسيجية مشابهة لتلك التي لوحظت في البشر31،32،33 ، إلا أنها مرتبطة بمعدل تمزق مرتفع ، مما يجعلها مفيدة لدراسة تمزق IA. ومع ذلك ، فإن ضعف الأوعية الناجمة عن الإيلاستاز لا يمثل بدقة العملية الطبيعية لتكوين IA. تم تطوير النموذج الحالي ، الذي يكرر الخصائص المرضية ل IA البشري ، بناء على عاملي خطر مستقلين لتكوين IA ولم ينتج عنه تمزق خلال فترة المراقبة التي استمرت ثلاثة أشهر.
هناك العديد من القيود على هذه الدراسة. في حين تم تحفيز نموذج الفأر من خلال التغيرات الديناميكية الدموية المضافة وارتفاع ضغط الدم ، لم يتم تحديد حدوث تمدد الأوعية الدموية الدماغية في حجم عينة صغير ، ولم تتم مقارنته بحدوث تمدد الأوعية الدموية الناجم فقط عن ربط الشريان السباتي المشترك أو الربط الثنائي للشرايين الكلوية الخلفية34. اقتصرت نافذة المراقبة على ثلاثة أشهر ، والتي تحاكي جزئيا العملية الطبيعية لتكوين IA ولكنها لا تلغي إمكانية التمزق. لا يزال تكرار ديناميكا الدم المعقدة والواقعية للبشر يمثل تحديا. بالإضافة إلى ذلك ، لم يتم تقييم التغيرات الديناميكية الدموية الناجمة عن الربط الإضافي ل PPA ، ولم يتم قياس تغيرات تدفق الدم بدقة. ومع ذلك ، تم اكتشاف IAs في الفئران باستخدام MRA ، وكانت التغيرات المرضية التي لوحظت متوافقة مع تلك الموجودة في IAs البشرية. يعد نموذج الماوس هذا من IA أداة قيمة للتحقيق في عملية تكوين IA.
Disclosures
تمت قراءة المخطوطة والموافقة عليها من قبل جميع المؤلفين المذكورين ، ولا يوجد أشخاص آخرون استوفوا معايير التأليف ولكنهم غير مدرجين في القائمة. ليس لدى المؤلفين أي تضارب في المصالح مرتبط بالمخطوطة ، ولم يكن هناك دعم مالي كبير لهذا العمل كان من الممكن أن يؤثر على نتائجه. لم يشارك الممولون في جمع البيانات أو تحليل البيانات أو كتابة الأوراق. لم يتم نشر المخطوطة من قبل على الإنترنت أو في شكل مطبوع ، بما في ذلك المجلات أو المواقع الإلكترونية أو المدونات.
Acknowledgements
تم دعم هذه الدراسة من قبل المرفق الوطني للطب الانتقالي (Shanghai TMSK-2021-147) ، ومشروع أبحاث مستشفى شنغهاي رينجي (RJTJ-QT-007) ، ومؤسسة علوم ما بعد الدكتوراه الصينية (رقم الشهادة: 2024M760658).
Materials
| Name | Company | Catalog Number | Comments |
| 7.0 T magnetic resonance angiography | Bruker | BioSpec 70/20 | |
| C57BL/6 mice | Charles River Laboratories | sex: male | |
| CD86 antibody | CST | 91882 | |
| Elastic Van Gieson (EVG)stain | Solarbio | G1597 | |
| Masson | Solarbio | G1340 | |
| Micro forcep | Shanghai Jinzhong Instrument Company | ||
| Microfil | Flow Tech Inc. | MV-120 | |
| Small animal anesthesia machine | RWD | R500 | |
| Stereo microscope | Shanghai Optical Instrument Company | XYH-6B | |
| Suture | Shanghai Jinhuan Medical Company | 6-0, 8-0 |
References
- Vlak, M. H., Algra, A., Brandenburg, R., Rinkel, G. J. Prevalence of unruptured intracranial aneurysms, with emphasis on sex, age, comorbidity, country, and time period: A systematic review and meta-analysis. Lancet Neurol. 10 (7), 626-636 (2011).
- Turjman, A. S., Turjman, F., Edelman, E. R. Role of fluid dynamics and inflammation in intracranial aneurysm formation. Circulation. 129 (3), 373-382 (2014).
- Shikata, F., et al. Potential influences of gut microbiota on the formation of intracranial aneurysm. Hypertension. 73 (2), 491-496 (2019).
- Penn, D. L., Komotar, R. J., Sander Connolly, E. Hemodynamic mechanisms underlying cerebral aneurysm pathogenesis. J Clin Neurosci. 18 (11), 1435-1438 (2011).
- Vlak, M. H., Rinkel, G. J., Greebe, P., Algra, A. Independent risk factors for intracranial aneurysms and their joint effect: A case-control study. Stroke. 44 (4), 984-987 (2013).
- Alfano, J., et al. Intracranial aneurysms occur more frequently at bifurcation sites that typically experience higher hemodynamic stresses. Neurosurgery. 73 (3), 497-505 (2013).
- Idil Soylu, A., Ozturk, M., Akan, H. Can vessel diameters, diameter ratios, and vessel angles predict the development of anterior communicating artery aneurysms: A morphological analysis. J Clin Neurosci. 68, 250-255 (2019).
- Starke, R. M., et al. Critical role of TNF-alpha in cerebral aneurysm formation and progression to rupture. J Neuroinflammation. 11, 77 (2014).
- Vrselja, Z., Brkic, H., Mrdenovic, S., Radic, R., Curic, G. Function of circle of Willis. J Cereb Blood Flow Metab. 34 (4), 578-584 (2014).
- Azedi, F., et al. Intra-arterial drug delivery to the ischemic brain in rat middle cerebral artery occlusion model. Bio Protoc. 9 (23), e3438 (2019).
- Yoshimura, S., et al. Reliable infarction of the middle cerebral artery territory in C57BL/6 mice using pterygopalatine artery ligation and filament optimization - The PURE-MCAo model. J Cereb Blood Flow Metab. , (2024).
- Nuki, Y., et al. Elastase-induced intracranial aneurysms in hypertensive mice. Hypertension. 54 (6), 1337-1344 (2009).
- Tada, Y., et al. Roles of hypertension in the rupture of intracranial aneurysms. Stroke. 45 (2), 579-586 (2014).
- Eldawoody, H., et al. Simplified experimental cerebral aneurysm model in rats: Comprehensive evaluation of induced aneurysms and arterial changes in the circle of Willis. Brain Res. 1300, 159-168 (2009).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2014).
- Furukawa, H., et al. Mast cell promotes the development of intracranial aneurysm rupture. Stroke. 51 (11), 3332-3339 (2020).
- Dungan, C. M., et al. Deletion of SA beta-Gal+ cells using senolytics improves muscle regeneration in old mice. Aging Cell. 21 (1), e13528 (2022).
- Miyamoto, T., et al. Site-specific elevation of interleukin-1beta and matrix metalloproteinase-9 in the Willis circle by hemodynamic changes is associated with rupture in a novel rat cerebral aneurysm model. J Cereb Blood Flow Metab. 37 (8), 2795-2805 (2017).
- Xu, C., et al. CD147 monoclonal antibody attenuates abdominal aortic aneurysm formation in angiotensin II-Infused apoE(-/-) mice. Int Immunopharmacol. 122, 110526 (2023).
- Taube, J. M., et al. Multi-institutional TSA-amplified multiplexed immunofluorescence reproducibility evaluation (MITRE) study. J Immunother Cancer. 9 (7), e002197 (2021).
- Frosen, J., et al. Saccular intracranial aneurysm: Pathology and mechanisms. Acta Neuropathol. 123 (6), 773-786 (2012).
- Cai, J., He, C., Yuan, F., Chen, L., Ling, F. A novel haemodynamic cerebral aneurysm model of rats with normal blood pressure. J Clin Neurosci. 19 (1), 135-138 (2012).
- Arnaout, O. M., et al. De novo large fusiform posterior circulation intracranial aneurysm presenting with subarachnoid hemorrhage 7 years after therapeutic internal carotid artery occlusion: case report and review of the literature. Neurosurgery. 71 (3), E764-E771 (2012).
- Nagata, I., Handa, H., Hashimoto, N., Hazama, F. Experimentally induced cerebral aneurysms in rats: Part VI. Hypertension. Surg Neurol. 14 (6), 477-479 (1980).
- Aoki, T., Kataoka, H., Morimoto, M., Nozaki, K., Hashimoto, N. Macrophage-derived matrix metalloproteinase-2 and -9 promote the progression of cerebral aneurysms in rats. Stroke. 38 (1), 162-169 (2007).
- Grunwald, I. Q., et al. An experimental aneurysm model: a training model for neurointerventionalists. Interv Neuroradiol. 12 (1), 17-24 (2006).
- Brinjikji, W., Ding, Y. H., Kallmes, D. F., Kadirvel, R. From bench to bedside: Utility of the rabbit elastase aneurysm model in preclinical studies of intracranial aneurysm treatment. J Neurointerv Surg. 8 (5), 521-525 (2016).
- Adibi, A., Eesa, M., Wong, J. H., Sen, A., Mitha, A. P. Combined endovascular coiling and intra-aneurysmal allogeneic mesenchymal stromal cell therapy for intracranial aneurysms in a rabbit model: A proof-of-concept study. J Neurointerv Surg. 9 (7), 707-712 (2017).
- Liao, B. Y., Zhang, J. Evolutionary conservation of expression profiles between human and mouse orthologous genes. Mol Biol Evol. 23 (3), 530-540 (2006).
- Han, Y., et al. Axl promotes intracranial aneurysm rupture by regulating macrophage polarization toward M1 via STAT1/HIF-1alpha. Front Immunol. 14, 1158758 (2023).
- Wang, S., et al. Rabbit aneurysm models mimic histologic wall types identified in human intracranial aneurysms. J Neurointerv Surg. 10 (4), 411-415 (2018).
- Nowicki, K. W., Hosaka, K., Walch, F. J., Scott, E. W., Hoh, B. L. M1 macrophages are required for murine cerebral aneurysm formation. J Neurointerv Surg. 10 (1), 93-97 (2018).
- Shi, Y., et al. Nrf-2 signaling inhibits intracranial aneurysm formation and progression by modulating vascular smooth muscle cell phenotype and function. J Neuroinflammation. 16 (1), 185 (2019).
- Morimoto, M., et al. Mouse model of cerebral aneurysm: experimental induction by renal hypertension and local hemodynamic changes. Stroke. 33 (7), 1911-1915 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved