Method Article
Un modelo murino modificado de aneurisma intracraneal basado en el cambio hemodinámico y la hipertensión
* Estos autores han contribuido por igual
En este artículo
Resumen
El aneurisma intracraneal (AI) se construyó en ratones utilizando los factores de riesgo de hipertensión y cambios hemodinámicos. Los cambios hemodinámicos fueron inducidos por la ligadura de las ramas de la arteria carótida, mientras que la hipertensión se logró mediante la ligadura de las ramas posteriores de la arteria renal. La formación de IA se detectó mediante angiografía por resonancia magnética, microscopía estereoscópica y análisis anatomopatológico.
Resumen
El aneurisma intracraneal (AI) representa un riesgo significativo para la salud debido a la morbilidad y mortalidad asociadas con la ruptura del aneurisma. Sin embargo, los mecanismos moleculares que subyacen al desarrollo de la IA siguen sin estar claros y se requiere un modelo de ratón adecuado. Se estableció un modelo murino de IA mediante la ligadura de la arteria pterigopalatina (PPA) para inducir cambios hemodinámicos aditivos, combinados con inducción de hipertensión. En ratones machos C57BL/6, se ligaron vasos, incluyendo la PPA derecha, la arteria carótida externa (ECA), la arteria occipital (OcA) y la arteria carótida común contralateral izquierda (CCA), para inducir cambios hemodinámicos. Una semana después, se ligaron las ramas posteriores bilaterales de la arteria renal (ARP) y se introdujo una dieta con sal al 8% para inducir hipertensión. Se realizó angiografía por resonancia magnética (ARM), estereomicroscopía y tinción inmunohistoquímica (IHQ) para evaluar los cambios morfológicos y patológicos en la AI tres meses después de la inducción. En el grupo experimental, cuatro ratones murieron después de la inducción inicial. Se detectó IA en diferentes localizaciones en cinco de los once ratones restantes. Tanto los exámenes microscópicos como los de ARM confirmaron la formación de IA. Los análisis anatomopatológicos y de IHQ revelaron disrupción de la lámina elástica interna, desconexión de las fibras de colágeno e infiltración de macrófagos M1 CD86 positivos, hallazgos consistentes con los observados en la AI humana. Este modelo de ratón de IA replica los cambios patológicos observados en muestras humanas y puede servir como una herramienta valiosa para investigar los mecanismos moleculares de la formación y progresión de IA.
Introducción
La prevalencia de aneurisma intracraneal (AI) se estima en 3,2% de la población general1. La AI representa un riesgo significativo para la salud debido a su alta morbilidad y mortalidad asociadas. La AI es una condición patológica compleja y multidimensional influenciada por cambios hemodinámicos, inflamación y remodelación vascular 2,3. Los cambios hemodinámicos y la hipertensión están implicados en la formación y progresión de los aneurismas 4,5. La IA ocurre frecuentemente en bifurcaciones cerebrales con esfuerzo de cizallamiento hemodinámico elevado6, y las bifurcaciones con ángulos estrechos se identifican como factores de riesgo para el desarrollo de IA en humanos7. A pesar de los avances en los tratamientos endovasculares y las estrategias quirúrgicas, la hemorragia subaracnoidea causada por la ruptura de la AI sigue siendo catastrófica. Por lo tanto, la exploración de tratamientos farmacológicos es un enfoque prometedor para la prevención de la rotura de un aneurisma8. Sin embargo, los mecanismos subyacentes a la formación patológica y la progresión de la AI siguen sin estar claros. El desarrollo de un modelo de ratón adecuado para la formación y progresión de la IA, basado en los factores de riesgo humanos, es crucial para descubrir los mecanismos subyacentes e identificar posibles dianas terapéuticas. Este estudio tiene como objetivo construir un modelo de formación de IA sin ruptura en ratones que imite las características de la IA humana.
El círculo de Willis (CW) conecta y comunica la arteria carótida interna derecha (ICA), la ICA izquierda y las arterias vertebrobasilares bilaterales. La CW sirve como mecanismo compensatorio en casos de oclusión o estenosis de la ACI o de la arteria vertebral9. La arteria pterigopalatina, es una rama de la ACI que suministra sangre a la parte externa del cerebro10. Sobre la base de la función compensatoria de la CW, la oclusión de PPA aumenta el flujo sanguíneo en la ACI. La combinación de la ligadura de la arteria carótida común izquierda (ACC), la arteria carótida externa derecha (ECA) y la arteria occipital (OcA) da como resultado un aumento del flujo sanguíneo en la CW, particularmente en ángulos estrechos, lo que conduce a cambios hemodinámicos. En este modelo, el suministro de sangre al cerebro está respaldado por la arteria vertebrobasilar y la ICA derecha. La ligadura de PPA no contribuyó a la mortalidad en los ratones11.
Para inducir un modelo de AI basado en la inyección de elastasa, la hipertensión fue inducida por liberación de angiotensina-II (Ang-II) a través de una bomba de Alzet o acetato de desoxicorticosterona (DOCA)-sal12,13. El alto costo de Alzet y DOCA debe tenerse en cuenta en experimentos con un gran número de animales. Los niveles de hipertensión alcanzados no fueron significativamente diferentes entre la ligadura de las ramas posterior e inferior de las arterias renales bilaterales o solo las ramas posteriores de las arterias renales bilaterales. Sin embargo, el primer abordaje resultó en una mayor disfunción renal14. Por lo tanto, la ligadura de las arterias renales posteriores bilaterales (ARPr) se considera un método racional para la mayoría de los investigadores.
La elastasa se inyectó en el líquido cefalorraquídeo en la cisterna basal derecha mediante una única inyección estereotáxica12. El modelo de IA basado en la inyección de elastasa causó una ruptura de IA del 60% al 80% tres semanas después de la inyección15,16, que es demasiado corto para estudiar la formación y el desarrollo de IA. Además, no hay evidencia que sugiera niveles elevados de elastasa en humanos durante la formación de IA. Además, la inyección estereotáxica en la cisterna derecha se asocia con una alta mortalidad y discapacidad en ratones, lo que plantea desafíos significativos para los novatos.
En este estudio, se construyó un modelo murino de IA sin ruptura en un plazo de tres meses basado en factores de riesgo humanos. Este modelo elimina el alto costo asociado con DOCA y Alzet. Además, se puede realizar usando solo un microscopio estereoscópico y puede ser fácilmente dominado por principiantes.
Protocolo
Todos los procedimientos operativos en ratones se adhirieron a los criterios del Comité de Revisión Ética y fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Jiaotong de Shanghai. Los ratones machos C57BL/6 (8 semanas de edad, 20-25 g) se alojaron a una temperatura de 22 °C con un ciclo de luz/oscuridad de 12 h/12 h. El proceso operativo se muestra en la Figura 1A. Brevemente, en animales anestesiados, la arteria carótida común izquierda (ACC), la arteria carótida externa derecha (ECA), la arteria occipital (OcA) y la arteria pterigopalatina (PPA) fueron ligadas para inducir cambios hemodinámicos. Posteriormente, la hipertensión se indujo mediante la ligadura de las arterias renales bilaterales (ARb) una semana después del inicio de los cambios hemodinámicos, y los animales fueron alimentados con una dieta que contenía un 8% de sal. Los cambios hemodinámicos y la formación de IA se representan en la Figura 1B. Los detalles de los reactivos y equipos utilizados en este estudio se proporcionan en la Tabla de Materiales.
1. Establecimiento de AIU en ratón basado en cambios hemodinámicos e hipertensión
NOTA: Los ratones se ayunaron durante 12 h antes de la operación. Los instrumentos quirúrgicos se esterilizaron sumergiéndolos en alcohol al 70% durante al menos 30 min.
- Administrar la anestesia (siguiendo los protocolos aprobados institucionalmente) utilizando una máquina de anestesia para animales pequeños con inhalación de isoflurano al 2% en una mezcla deO2 (1 L/min) sobre una almohadilla calefactada mantenida a 37 °C.
- Ligar el CCA izquierdo
- Realice una incisión lineal de 1 cm a lo largo de la línea media cervical. Diseccionar el tejido subcutáneo y el platisma para exponer la tráquea.
- Retire la vena yugular y ubique la vaina carotídea a lo largo de la tráquea (Figura 2A i,ii). Separe el CCA izquierdo del nervio vago. Ligue el CCA izquierdo con una sutura de seda 6-0 (Figura 2A iii, iv).
- Lijar el ECA y OcA correctos
- Exponga la estructura anatómica del CCA, ICA, ECA, OcA, el nervio vago y el nervio hipogloso en el lado derecho. Limine el ECA derecho con una sutura de seda 6-0 (Figura 2A iii, iv).
- Aislar el OcA y ligarlo con un 8-0 sutura de seda (Figura 2A v - viii). Desconecte el OcA con dos micropinzas rectas.
NOTA: El OcA, que surge proximalmente del ECA, se encuentra debajo del nervio hipogloso (Figura 2A v - viii). La disección del OcA ayuda a exponer la anatomía del PPA de manera efectiva.
- Ligar el PPA correcto
- Aislar el nervio hipogloso de la ICA. Coloque algodón quirúrgico entre el nervio hipogloso y la ICA para proteger el nervio de lesiones relacionadas con el procedimiento.
- Diseccionar el tejido perivascular alrededor de la PPA con micropinzas. Sujete el PPA y tire temporalmente hacia arriba ligeramente. Coloca un 8-0 sutura de seda entre el PPA y el ICA para ligar el PPA (Figura 2A, ix,x).
- Libar el PPA y mantener una distancia suficiente entre el sitio de ligadura y el origen del PPA para asegurar el flujo sanguíneo en el círculo de Willis (Figura 2A x).
NOTA: El desafío principal en este paso es ligar el PPA dentro de un espacio quirúrgico extremadamente estrecho sin dañar los nervios periféricos y las estructuras vasculares. Evite comprimir la tráquea durante la exposición al PPA.
- Finalizar la operación
- Esterilizar el campo operacional con povidona yodada y suturar la herida. Monitoree a los ratones hasta que se recuperen de la anestesia.
- Inducir hipertensión
- Realizar una incisión de 2 cm de largo en lalínea media a nivel 12 de la vértebra en la espalda. Corta los músculos dorsales para exponer el riñón. Pinzar el tejido adiposo alrededor del riñón con pinzas y fijar el riñón dentro de la incisión muscular (Figura 2B i,ii).
- Aísla el tejido adiposo alrededor del pedículo renal. Identificar el ARPp en estrecho contacto con la vena renal (Figura 2B iii,iv). Sujete el pRA y tire de él hacia arriba con micropinzas rectas. Diseccionar la fascia entre la ARP y la vena renal con otra micropinza (Figura 2B v,vi).
NOTA: Tenga cuidado para evitar daños en la vena renal, lo que podría provocar una hemorragia catastrófica. - Lime el pRA con una sutura de seda 6-0 (Figura 2B vii, viii). Inmediatamente después de la ligadura, observar la formación de focos isquémicos en la parte superior del riñón (Figura 2B ix,x). Suturar el músculo y las incisiones en la piel.
2. Examen de IA mediante ARM y microscopio estereoscópico
- Realizar una angiografía por resonancia magnética (ARM) de 7,0 T con tiempo de vuelo (TOF) tres meses después de la inducción del aneurisma para evaluar la formación de IA.
- Eutanasia de los ratones mediante exanguinación y luxación cervical después de la anestesia con isoflurano (siguiendo protocolos aprobados institucionalmente). Detectar IA bajo un microscopio estereoscópico como se informó anteriormente17.
- Infundir las muestras con PBS enfriado, seguido de paraformaldehído al 4%, y luego Microfil para visualizar vasos y aneurismas.
- Definir un aneurisma como una protuberancia hacia afuera 1,5 veces más grande que la arteria madre, según lo observado por dos neurocirujanos independientes 8,18.
3. Análisis histológicos e inmunohistoquímicos
- Aísla los círculos de Willis bajo un microscopio. Fijar las muestras con paraformaldehído al 4% a 4 °C durante 24 h19.
- Procese las muestras en secciones de parafina y congeladas para la tinción histológica y de inmunofluorescencia. Teñir las secciones de parafina con las tinciones EVG y Masson de acuerdo con las instrucciones del fabricante19.
- Incubar las secciones de parafina con una solución de bloqueo para minimizar la unión inespecífica.
- Incubar secciones con anticuerpos primarios contra CD86 durante la noche a 4 °C. Después de la incubación con un anticuerpo secundario, desarrolla un color marrón al reaccionar las secciones con DAB20.
- Realizar la contratinción con hematoxilina y montar las secciones con una solución de montaje acuosa20.
Resultados
Tasa de formación de IA
En el grupo experimental (n = 15), 2 ratones murieron dentro de la primera semana después del procedimiento inicial por razones desconocidas. Un ratón murió de una infección en la herida posterior al tercer día después del segundo procedimiento, y otro ratón murió el día 38 por razones desconocidas, sin que se detectaran aneurismas. En el grupo de control (n = 5), los 5 ratones sobrevivieron hasta el sacrificio. Entre los ratones supervivientes del grupo experimental (n = 11), la presión arterial sistólica a los tres meses después de la inducción fue significativamente más alta que antes de la inducción (90 ± 1,39 mm Hg frente a 126,63 ± 1,83 mm Hg; P < 0,0001). En el grupo control (n = 5), la presión arterial se mantuvo constante antes de la inducción y al sacrificio (88 ± 2,34 mm Hg vs. 91,8 ± 1,2 mm Hg; P > 0,05).
Evaluación y hallazgos de la AI
En el grupo experimental, se detectaron aneurismas en diferentes lugares en 5 de los 11 ratones supervivientes mediante ARM y microscopía óptica. Dos aneurismas se localizaron en la arteria cerebral anterior-bifurcaciones de la arteria olfativa, dos en la arteria comunicante anterior y uno en la arteria cerebral posterior (Figura 3). Además, 2 de los 11 ratones mostraron tortuosidad en la arteria cerebral anterior y la arteria cerebral media. Ninguno de los aneurismas se rompió dentro de los tres meses posteriores a la inducción. No se observaron cambios aneurismales en 4 de los 11 ratones del grupo experimental ni en ninguno de los 5 ratones del grupo control.
Examen histológico y de inmunofluorescencia
En los aneurismas cerebrales humanos, la pared vascular se caracteriza por la ruptura de la lámina elástica, la descelularización del medio, la desconexión de las fibras de colágeno y la infiltración de macrófagos M121. En comparación con los vasos sanguíneos control, la tinción con EVG-Verhoeff reveló una alteración significativa de la capa elástica interna en el tejido AI (Figura 4A). La tinción de Masson mostró una desconexión considerable de las fibras de colágeno en las paredes de IA (Figura 4B). El análisis inmunohistoquímico indicó una infiltración significativa de macrófagos CD86 positivos en la pared del aneurisma (Figura 4C,D).
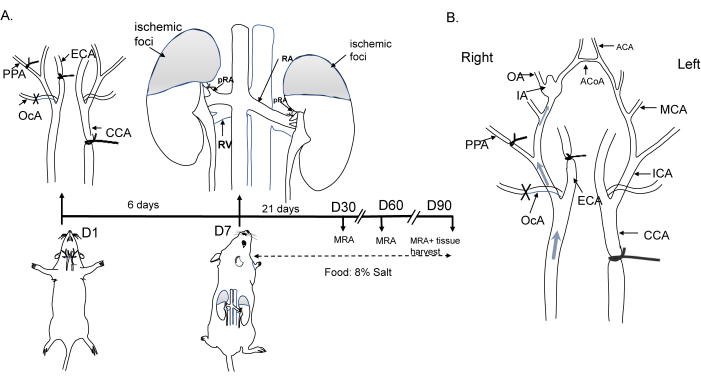
Figura 1: Diagrama de la inducción del modelo de aneurisma de ratón. (A) Representación esquemática de la ligadura de la arteria carótida común izquierda, la arteria carótida externa derecha, la arteria pterigopalatina y las ramas posteriores bilaterales de la arteria renal, junto con una dieta de NaCl al 8%. (B) Cambios hemodinámicos que conducen a alteraciones del flujo en el círculo de Willis y formación de aneurismas. Abreviaturas: ACA: arteria cerebral anterior; ACoA: arteria comunicante anterior; CCA: arteria carótida común; ECA: arteria carótida externa; IA: aneurisma intracraneal; ACM: arteria cerebral media; ARM: angiografía por resonancia magnética; OA: arteria olfativa; OcA: arteria occipital; PPA: arteria pterigopalatina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diagramas anatómicos y esquemáticos de la ligadura de arterias. (A) Exposición y ligadura de las arterias del cuello. i-iv, ligadura de CCA izquierda; v-vi, ligadura del ECA derecho; vii-viii, ligadura de la OcA derecha; ix-x, ligadura del PPA derecho. (B) Exposición y ligadura de las ramas posteriores de la arteria renal (pRA). i-iv, exposición de la pRA derecha; v-vi, separación de la pRA; vii-viii, ligadura de la pRA; IX-X, retorno de los riñones a su posición original. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Cambios morfológicos en aneurismas intracraneales. (A) La bifurcación normal de la arteria olfativa y la arteria cerebral anterior en el grupo control. (B) Cambios aneurismales típicos en la bifurcación de la arteria olfativa y la arteria cerebral anterior observados en la ARM y bajo un microscopio (flecha roja). Aumento: 6x. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Análisis anatomopatológico de los aneurismas intracraneales. (A) Tinción de EVG: La capa elástica en el grupo normal está intacta y lisa, mientras que la capa elástica en el grupo del aneurisma está alterada. (B) Tinción de Masson: Las fibras de colágeno están intactas en el grupo normal, mientras que un gran número de fibras de colágeno se interrumpen en el grupo de aneurismas. (C) Tinción de IHQ para CD86: las células CD86 positivas están ausentes en el grupo normal, pero están significativamente presentes en la pared del aneurisma. Barras de escala = 200 μm (para imágenes no ampliadas); 50 μm (para imágenes ampliadas), ***P < 0,001. Abreviatura: IA, aneurisma intracraneal. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este estudio presenta un enfoque modificado para la construcción de un modelo murino de IA a través de la ligadura de la PPA para inducir cambios hemodinámicos aditivos en combinación con la hipertensión. Las imágenes de resonancia magnética y el análisis microscópico demostraron cambios significativos en los aneurismas en el círculo de Willis. Las alteraciones patológicas observadas en este modelo son consistentes con las encontradas en muestras humanas. Este modelo de ratón puede servir como una herramienta valiosa para investigar los mecanismos moleculares que subyacen a la formación y el desarrollo de la IA.
La IA se indujo en ratones mediante la ligadura de las arterias renales posteriores (pRA) izquierdas CCA, ECA, OcA, PPA y bilaterales, junto con una dieta alta en sal. Cai et al. emplearon un procedimiento similar para establecer un modelo de aneurisma de rata con presión arterial normal e identificaron aneurismas cerebrales y la expansión de las arterias cerebrales anteriores22. Miyamoto et al. informaron que, en comparación con la ligadura solo del ACC izquierdo, la ligadura adicional del PPA derecho y el ECA derecho aumentó significativamente la formación de IA en ratas. La ligadura de ECA y PPA puede amplificar los cambios hemodinámicos al aumentar el volumen de flujo sanguíneo18. En humanos, la oclusión de la arteria carótida se ha relacionado con la formación de aneurismas intracraneales23. Por lo tanto, este modelo de ratón modificado de IA puede resultar beneficioso para explorar la formación y el desarrollo de la IA.
La elección de las especies animales en los estudios de investigación es crucial y sirve a distintos propósitos de investigación. Los modelos de ratas, que se han utilizado durante décadas, exhiben características patológicas específicas como la fragmentación de la lámina elástica interna y el adelgazamiento de la capa de células musculares lisas. Los modelos de rata se emplean principalmente para investigar la patogenia de los aneurismas24,25. Los modelos de conejo, por otro lado, son particularmente adecuados para estudios preclínicos relacionados con el tratamiento endovascular 26,27,28. En comparación con estos modelos, los ratones son los preferidos para los análisis genéticos debido a sus ciclos de vida más cortos y su manipulabilidad transgénica. Además, los ratones exhiben una similitud significativa en la expresión y función de los genes ortólogos con los de los humanos29. Por lo tanto, los modelos de ratón representan una opción óptima para las investigaciones de laboratorio.
En estudios previos, se indujeron aneurismas intracraneales (AI) en ratones utilizando elastasa para degradar la lámina elástica30. A pesar de que los aneurismas basados en elastaso presentan cambios morfológicos e histológicos similares a los observados en humanos 31,32,33, se asocian a una alta tasa de ruptura, lo que los hace ventajosos para el estudio de la ruptura de la AI. Sin embargo, la debilidad vascular inducida por elastasa no representa con precisión el proceso natural de formación de IA. El modelo actual, que replica las características patológicas de la AI humana, se desarrolló sobre la base de dos factores de riesgo independientes para la formación de IA y no resultó en ruptura durante el período de observación de tres meses.
Este estudio tiene varias limitaciones. Si bien el modelo de ratón fue inducido a través de cambios hemodinámicos aditivos e hipertensión, no se determinó la incidencia de aneurismas cerebrales en una muestra pequeña, ni se comparó con la incidencia de aneurismas inducidos únicamente por ligadura de la arteria carótida común o ligadura bilateral de las arterias renales posteriores34. La ventana de observación se limitó a tres meses, lo que simula parcialmente el proceso natural de formación de IA, pero no elimina la posibilidad de ruptura. Replicar la compleja y realista hemodinámica de los seres humanos sigue siendo un desafío. Además, no se evaluaron los cambios hemodinámicos causados por la ligadura adicional de la PPA y los cambios en el flujo sanguíneo no se midieron con precisión. No obstante, los AI en ratones se detectaron mediante ARM, y los cambios patológicos observados fueron consistentes con los encontrados en los AI humanos. Este modelo de ratón de IA es una herramienta valiosa para investigar el proceso de formación de IA.
Divulgaciones
El manuscrito ha sido leído y aprobado por todos los autores nombrados, y no hay otras personas que cumplan con los criterios de autoría pero que no estén en la lista. Los autores no tienen conflictos de intereses asociados con el manuscrito, y no ha habido apoyo financiero significativo para este trabajo que pudiera haber influido en su resultado. Los financiadores no participaron en la recopilación de datos, el análisis de datos ni la redacción de documentos. El manuscrito no ha sido publicado previamente en línea o en forma impresa, incluyendo revistas, sitios web o blogs.
Agradecimientos
Este estudio contó con el apoyo del Centro Nacional de Medicina Traslacional (Shanghai TMSK-2021-147), el Proyecto de Investigación del Hospital Renji de Shanghai (RJTJ-QT-007) y la Fundación de Ciencias Postdoctorales de China (Número de certificado: 2024M760658).
Materiales
| Name | Company | Catalog Number | Comments |
| 7.0 T magnetic resonance angiography | Bruker | BioSpec 70/20 | |
| C57BL/6 mice | Charles River Laboratories | sex: male | |
| CD86 antibody | CST | 91882 | |
| Elastic Van Gieson (EVG)stain | Solarbio | G1597 | |
| Masson | Solarbio | G1340 | |
| Micro forcep | Shanghai Jinzhong Instrument Company | ||
| Microfil | Flow Tech Inc. | MV-120 | |
| Small animal anesthesia machine | RWD | R500 | |
| Stereo microscope | Shanghai Optical Instrument Company | XYH-6B | |
| Suture | Shanghai Jinhuan Medical Company | 6-0, 8-0 |
Referencias
- Vlak, M. H., Algra, A., Brandenburg, R., Rinkel, G. J. Prevalence of unruptured intracranial aneurysms, with emphasis on sex, age, comorbidity, country, and time period: A systematic review and meta-analysis. Lancet Neurol. 10 (7), 626-636 (2011).
- Turjman, A. S., Turjman, F., Edelman, E. R. Role of fluid dynamics and inflammation in intracranial aneurysm formation. Circulation. 129 (3), 373-382 (2014).
- Shikata, F., et al. Potential influences of gut microbiota on the formation of intracranial aneurysm. Hypertension. 73 (2), 491-496 (2019).
- Penn, D. L., Komotar, R. J., Sander Connolly, E. Hemodynamic mechanisms underlying cerebral aneurysm pathogenesis. J Clin Neurosci. 18 (11), 1435-1438 (2011).
- Vlak, M. H., Rinkel, G. J., Greebe, P., Algra, A. Independent risk factors for intracranial aneurysms and their joint effect: A case-control study. Stroke. 44 (4), 984-987 (2013).
- Alfano, J., et al. Intracranial aneurysms occur more frequently at bifurcation sites that typically experience higher hemodynamic stresses. Neurosurgery. 73 (3), 497-505 (2013).
- Idil Soylu, A., Ozturk, M., Akan, H. Can vessel diameters, diameter ratios, and vessel angles predict the development of anterior communicating artery aneurysms: A morphological analysis. J Clin Neurosci. 68, 250-255 (2019).
- Starke, R. M., et al. Critical role of TNF-alpha in cerebral aneurysm formation and progression to rupture. J Neuroinflammation. 11, 77 (2014).
- Vrselja, Z., Brkic, H., Mrdenovic, S., Radic, R., Curic, G. Function of circle of Willis. J Cereb Blood Flow Metab. 34 (4), 578-584 (2014).
- Azedi, F., et al. Intra-arterial drug delivery to the ischemic brain in rat middle cerebral artery occlusion model. Bio Protoc. 9 (23), e3438 (2019).
- Yoshimura, S., et al. Reliable infarction of the middle cerebral artery territory in C57BL/6 mice using pterygopalatine artery ligation and filament optimization - The PURE-MCAo model. J Cereb Blood Flow Metab. , (2024).
- Nuki, Y., et al. Elastase-induced intracranial aneurysms in hypertensive mice. Hypertension. 54 (6), 1337-1344 (2009).
- Tada, Y., et al. Roles of hypertension in the rupture of intracranial aneurysms. Stroke. 45 (2), 579-586 (2014).
- Eldawoody, H., et al. Simplified experimental cerebral aneurysm model in rats: Comprehensive evaluation of induced aneurysms and arterial changes in the circle of Willis. Brain Res. 1300, 159-168 (2009).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2014).
- Furukawa, H., et al. Mast cell promotes the development of intracranial aneurysm rupture. Stroke. 51 (11), 3332-3339 (2020).
- Dungan, C. M., et al. Deletion of SA beta-Gal+ cells using senolytics improves muscle regeneration in old mice. Aging Cell. 21 (1), e13528 (2022).
- Miyamoto, T., et al. Site-specific elevation of interleukin-1beta and matrix metalloproteinase-9 in the Willis circle by hemodynamic changes is associated with rupture in a novel rat cerebral aneurysm model. J Cereb Blood Flow Metab. 37 (8), 2795-2805 (2017).
- Xu, C., et al. CD147 monoclonal antibody attenuates abdominal aortic aneurysm formation in angiotensin II-Infused apoE(-/-) mice. Int Immunopharmacol. 122, 110526 (2023).
- Taube, J. M., et al. Multi-institutional TSA-amplified multiplexed immunofluorescence reproducibility evaluation (MITRE) study. J Immunother Cancer. 9 (7), e002197 (2021).
- Frosen, J., et al. Saccular intracranial aneurysm: Pathology and mechanisms. Acta Neuropathol. 123 (6), 773-786 (2012).
- Cai, J., He, C., Yuan, F., Chen, L., Ling, F. A novel haemodynamic cerebral aneurysm model of rats with normal blood pressure. J Clin Neurosci. 19 (1), 135-138 (2012).
- Arnaout, O. M., et al. De novo large fusiform posterior circulation intracranial aneurysm presenting with subarachnoid hemorrhage 7 years after therapeutic internal carotid artery occlusion: case report and review of the literature. Neurosurgery. 71 (3), E764-E771 (2012).
- Nagata, I., Handa, H., Hashimoto, N., Hazama, F. Experimentally induced cerebral aneurysms in rats: Part VI. Hypertension. Surg Neurol. 14 (6), 477-479 (1980).
- Aoki, T., Kataoka, H., Morimoto, M., Nozaki, K., Hashimoto, N. Macrophage-derived matrix metalloproteinase-2 and -9 promote the progression of cerebral aneurysms in rats. Stroke. 38 (1), 162-169 (2007).
- Grunwald, I. Q., et al. An experimental aneurysm model: a training model for neurointerventionalists. Interv Neuroradiol. 12 (1), 17-24 (2006).
- Brinjikji, W., Ding, Y. H., Kallmes, D. F., Kadirvel, R. From bench to bedside: Utility of the rabbit elastase aneurysm model in preclinical studies of intracranial aneurysm treatment. J Neurointerv Surg. 8 (5), 521-525 (2016).
- Adibi, A., Eesa, M., Wong, J. H., Sen, A., Mitha, A. P. Combined endovascular coiling and intra-aneurysmal allogeneic mesenchymal stromal cell therapy for intracranial aneurysms in a rabbit model: A proof-of-concept study. J Neurointerv Surg. 9 (7), 707-712 (2017).
- Liao, B. Y., Zhang, J. Evolutionary conservation of expression profiles between human and mouse orthologous genes. Mol Biol Evol. 23 (3), 530-540 (2006).
- Han, Y., et al. Axl promotes intracranial aneurysm rupture by regulating macrophage polarization toward M1 via STAT1/HIF-1alpha. Front Immunol. 14, 1158758 (2023).
- Wang, S., et al. Rabbit aneurysm models mimic histologic wall types identified in human intracranial aneurysms. J Neurointerv Surg. 10 (4), 411-415 (2018).
- Nowicki, K. W., Hosaka, K., Walch, F. J., Scott, E. W., Hoh, B. L. M1 macrophages are required for murine cerebral aneurysm formation. J Neurointerv Surg. 10 (1), 93-97 (2018).
- Shi, Y., et al. Nrf-2 signaling inhibits intracranial aneurysm formation and progression by modulating vascular smooth muscle cell phenotype and function. J Neuroinflammation. 16 (1), 185 (2019).
- Morimoto, M., et al. Mouse model of cerebral aneurysm: experimental induction by renal hypertension and local hemodynamic changes. Stroke. 33 (7), 1911-1915 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ISSN 1940-087X
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.
