Method Article
Un modèle murin modifié d’anévrisme intracrânien basé sur le changement hémodynamique et l’hypertension
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’anévrisme intracrânien (AI) a été construit chez la souris en utilisant les facteurs de risque d’hypertension et de changements hémodynamiques. Les changements hémodynamiques ont été induits par la ligature des branches de l’artère carotide, tandis que l’hypertension a été obtenue par la ligature des branches postérieures de l’artère rénale. La formation d’IA a été détectée par angiographie par résonance magnétique, stéréomicroscopie et analyse pathologique.
Résumé
L’anévrisme intracrânien (AI) présente un risque important pour la santé en raison de la morbidité et de la mortalité associées à la rupture d’anévrisme. Cependant, les mécanismes moléculaires sous-jacents au développement de l’IA restent incertains, et un modèle murin approprié est nécessaire. Un modèle murin d’IA a été établi en ligaturant l’artère ptérygo-palatine (PPA) pour induire des changements hémodynamiques additifs, combinés à l’induction de l’hypertension. Chez les souris mâles C57BL/6, les vaisseaux, y compris l’APP droite, l’artère carotide externe (ECA), l’artère occipitale (OcA) et l’artère carotide commune controlatérale gauche (CCA), ont été ligaturés pour induire des changements hémodynamiques. Une semaine plus tard, les branches postérieures bilatérales de l’artère rénale (pRA) ont été ligaturées et un régime à 8 % de sel a été introduit pour induire l’hypertension. Une angiographie par résonance magnétique (ARM), une stéréomicroscopie et une coloration immunohistochimique (IHC) ont été réalisées pour évaluer les changements morphologiques et pathologiques de l’IA trois mois après l’induction. Dans le groupe expérimental, quatre souris sont mortes après l’induction initiale. L’IA à différents endroits a été détectée chez cinq des onze souris restantes. Les examens microscopiques et ARM ont confirmé la formation d’IA. Les analyses pathologiques et IHC ont révélé une perturbation de la lame élastique interne, une déconnexion des fibres de collagène et une infiltration de macrophages M1 CD86-positifs , des résultats cohérents avec ceux observés dans l’IA humaine. Ce modèle murin d’IA reproduit les changements pathologiques observés dans les échantillons humains et peut servir d’outil précieux pour étudier les mécanismes moléculaires de la formation et de la progression de l’IA.
Introduction
La prévalence de l’anévrisme intracrânien (AI) est estimée à 3,2 % de la population générale1. L’AI pose un risque important pour la santé en raison de la morbidité et de la mortalité élevées qui y sont associées. L’IA est une affection pathologique complexe et multidimensionnelle influencée par des changements hémodynamiques, une inflammation et unremodelage vasculaire2,3. Les modifications hémodynamiques et l’hypertension sont impliquées dans la formation et la progression des anévrismes 4,5. L’IA se produit fréquemment au niveau des bifurcations cérébrales avec une contrainte de cisaillement hémodynamique élevée6, et les bifurcations avec des angles étroits sont identifiées comme des facteurs de risque pour le développement de l’IA chez l’homme7. Malgré les progrès réalisés dans les traitements endovasculaires et les stratégies chirurgicales, l’hémorragie sous-arachnoïdienne causée par la rupture de l’IA reste catastrophique. Par conséquent, l’exploration de traitements pharmacologiques est une approche prometteuse pour prévenir la rupture d’anévrisme8. Cependant, les mécanismes sous-jacents à la formation pathologique et à la progression de l’IA restent incertains. Le développement d’un modèle murin approprié pour la formation et la progression de l’AI, basé sur les facteurs de risque humains, est crucial pour découvrir les mécanismes sous-jacents et identifier des cibles thérapeutiques potentielles. Cette étude vise à construire un modèle de formation d’IA sans rupture chez la souris qui imite les caractéristiques humaines de l’IA.
Le cercle de Willis (CW) relie et communique l’artère carotide interne droite (ICA), l’ICA gauche et les artères vertébrobasilaires bilatérales. La CW sert de mécanisme compensatoire en cas d’occlusion ou de sténose de l’ICA ou de l’artère vertébrale9. L’artère ptérygo-palatine (PPA) est une branche de l’ICA qui fournit du sang à la partie externe du cerveau10. Sur la base de la fonction compensatoire de la CW, l’occlusion de la PPA augmente le flux sanguin dans l’ICA. La combinaison de la ligature de l’artère carotide commune gauche (ACC), de l’artère carotide externe droite (ECA) et de l’artère occipitale (OcA) entraîne une augmentation du flux sanguin dans la CW, en particulier aux angles rétrécis, entraînant des changements hémodynamiques. Dans ce modèle, l’apport sanguin au cerveau est soutenu par l’artère vertébrobasilaire et l’ICA droite. La ligature de l’APP n’a pas contribué à la mortalité chez les souris11.
Pour induire un modèle IA basé sur l’injection d’élastase, l’hypertension a été induite par la libération d’angiotensine-II (Ang-II) via une pompe Alzet ou un sel d’acétate de désoxycorticostérone (DOCA)12,13. Le coût élevé d’Alzet et de DOCA doit être pris en compte dans les expériences impliquant un grand nombre d’animaux. Les niveaux d’hypertension atteints n’étaient pas significativement différents entre la ligature des branches postérieure et inférieure des artères rénales bilatérales ou seulement les branches postérieures des artères rénales bilatérales. Cependant, la première approche a entraîné une augmentation de la dysfonction rénale14. Par conséquent, la ligature des artères rénales postérieures bilatérales (pRA) est considérée comme une méthode rationnelle pour la plupart des investigateurs.
L’élastase a été injecté dans le liquide céphalo-rachidien au niveau de la citerne basale droite par une seule injection stéréotaxique12. Le modèle IA basé sur l’injection d’élastase a provoqué une rupture de 60 à 80 % de l’IA trois semaines après l’injection15,16, ce qui est trop court pour étudier la formation et le développement de l’IA. De plus, il n’y a aucune preuve suggérant des niveaux élevés d’élastase chez l’homme pendant la formation de l’AI. De plus, l’injection stéréotaxique dans la citerne droite est associée à une mortalité et à une invalidité élevées chez les souris, ce qui pose des défis importants aux novices.
Dans cette étude, un modèle murin d’AI sans rupture dans les trois mois a été construit sur la base de facteurs de risque humains. Ce modèle élimine le coût élevé associé à DOCA et Alzet. De plus, il peut être réalisé à l’aide d’un stéréomicroscope uniquement et peut être facilement maîtrisé par les novices.
Protocole
Toutes les procédures opérationnelles chez la souris ont adhéré aux critères du comité d’examen éthique et ont été approuvées par le comité institutionnel de soin et d’utilisation des animaux de l’Université Jiaotong de Shanghai. Des souris mâles C57BL/6 (âgées de 8 semaines, 20-25 g) ont été logées à une température de 22 °C avec un cycle lumière/obscurité de 12 h/12 h. Le processus opérationnel est illustré à la figure 1A. En bref, chez les animaux anesthésiés, l’artère carotide commune gauche (ACC), l’artère carotide externe droite (ECA), l’artère occipitale (OcA) et l’artère ptérygo-palatine (PPA) ont été ligaturées pour induire des changements hémodynamiques. L’hypertension a ensuite été induite par la ligature des artères rénales bilatérales (artères rénales bilatérales) une semaine après le début des changements hémodynamiques, et les animaux ont été nourris avec un régime contenant 8 % de sel. Les changements hémodynamiques et la formation d’IA sont représentés à la figure 1B. Des détails sur les réactifs et l’équipement utilisés dans cette étude sont fournis dans la table des matériaux.
1. Etablissement de l’AIU de souris basé sur les modifications hémodynamiques et l’hypertension
REMARQUE : Les souris ont été jeûnées pendant 12 h avant l’opération. Les instruments chirurgicaux ont été stérilisés en les trempant dans de l’alcool à 70 % pendant au moins 30 min.
- Administrer l’anesthésie (conformément aux protocoles approuvés par l’établissement) à l’aide d’un appareil d’anesthésie pour petits animaux avec inhalation d’isoflurane à 2 % dans un mélanged’O2 (1 L/min) sur un coussin chauffant maintenu à 37 °C.
- Plaider le CCA gauche
- Faites une incision linéaire de 1 cm le long de la ligne médiane cervicale. Disséquer le tissu sous-cutané et le platysma pour exposer la trachée.
- Retirez la veine jugulaire et localisez la gaine carotidienne le long de la trachée (Figure 2A i,ii). Séparez l’ACC gauche du nerf vague. Lister l’ACC gauche avec une suture en soie 6-0 (Figure 2A iii,iv).
- Plaidez pour l’ECA et l’OcA appropriés
- Exposez la structure anatomique de l’ACC, de l’ICA, de l’ECA, de l’OcA, du nerf vague et du nerf hypoglosse du côté droit. Lister l’ECA droit avec une suture en soie 6-0 (Figure 2A iii,iv).
- Isolez l’OcA et ligaturez-le avec un 8-0 suture en soie (figure 2A v - viii). Débranchez l’OcA à l’aide de deux micro-pinces droites.
REMARQUE : L’OcA, qui naît proximale de l’ECA, se trouve sous le nerf hypoglosse (Figure 2A v - viii). La dissection de l’OcA permet d’exposer efficacement l’anatomie de l’APP.
- Plaidez le bon PPA
- Isolez le nerf hypoglosse de l’ICA. Placez du coton chirurgical entre le nerf hypoglosse et l’ICA pour protéger le nerf des blessures liées à l’intervention.
- Disséquez le tissu périvasculaire autour de l’APP à l’aide d’une micropince. Serrez le PPA et tirez-le temporairement vers le haut légèrement. Placez un 8-0 suture en soie entre le PPA et l’ICA pour ligaturer le PPA (Figure 2A ix,x).
- Lister l’APP et maintenir une distance suffisante entre le site de ligature et l’origine de l’APP pour assurer la circulation sanguine dans le cercle de Willis (Figure 2A x).
REMARQUE : Le principal défi de cette étape est de ligaturer le PPA dans un espace opératoire extrêmement restreint sans altérer les nerfs périphériques et les structures vasculaires. Évitez de comprimer la trachée pendant l’exposition au PPA.
- Finaliser l’opération
- Stérilisez le champ opératoire avec de la povidone iodée et suturez la plaie. Surveillez les souris jusqu’à ce qu’elles se remettent de l’anesthésie.
- Induire l’hypertension
- Faites une incision médiane de 2 cm de long au niveau vertébral du 12e sur le dos. Coupez les muscles dorsaux pour exposer le rein. Clampez le tissu adipeux autour du rein à l’aide d’une pince et fixez le rein à l’intérieur de l’incision musculaire (Figure 2B i,ii).
- Isolez le tissu adipeux autour du pédicule rénal. Identifier l’ARP en contact étroit avec la veine rénale (Figure 2B iii,iv). Serrez le pRA et tirez-le vers le haut à l’aide d’une micro-pince droite. Disséquez le fascia entre l’AP et la veine rénale à l’aide d’une autre micro-pince (Figure 2B v,vi).
REMARQUE : Faites preuve de prudence pour éviter d’endommager la veine rénale, ce qui pourrait entraîner des saignements catastrophiques. - Lister le pRA avec une suture en soie 6-0 (Figure 2B vii,viii). Immédiatement après la ligature, observez la formation de foyers ischémiques dans la partie supérieure du rein (Figure 2B ix,x). Suturez les incisions musculaires et cutanées.
2. Examen IA par ARM et stéréomicroscope
- Effectuer une angiographie par résonance magnétique (ARM) à temps de vol (TOF) de 7,0 T trois mois après l’induction de l’anévrisme pour évaluer la formation de l’IA.
- Euthanasier les souris par exsanguination et luxation cervicale après une anesthésie à l’isoflurane (selon les protocoles approuvés par l’établissement). Détection de l’IA au stéréomicroscope, comme indiqué précédemment17.
- Infusez les échantillons avec du PBS refroidi, suivi de 4 % de paraformaldéhyde, puis de Microfil pour visualiser les vaisseaux et les anévrismes.
- Définir un anévrisme comme un renflement vers l’extérieur 1,5 fois plus grand que l’artère mère, comme observé par deux neurochirurgiens indépendants 8,18.
3. Analyses histologiques et immunohistochimiques
- Isolez les cercles de Willis au microscope. Fixer les échantillons avec 4 % de paraformaldéhyde à 4 °C pendant 24 h19.
- Transformez les échantillons en paraffine et en coupes congelées pour la coloration histologique et par immunofluorescence. Teindre les sections de paraffine avec des colorants EVG et Masson selon les instructions du fabricant19.
- Incuber les sections de paraffine avec une solution de blocage pour minimiser la liaison non spécifique.
- Incuber des sections avec des anticorps primaires contre CD86 pendant la nuit à 4 °C. Après incubation avec un anticorps secondaire, développer une couleur brune en faisant réagir les sections avec du DAB20.
- Effectuez une contre-coloration à l’hématoxyline et montez les sections avec une solution de montage aqueuse20.
Résultats
Taux de formation d’IA
Dans le groupe expérimental (n = 15), 2 souris sont mortes dans la première semaine après la procédure initiale pour des raisons inconnues. Une souris est morte d’une infection dans la plaie dorsale le troisième jour après la deuxième procédure, et une autre souris est morte le 38e jour pour des raisons inconnues, sans qu’aucun anévrisme n’ait été détecté. Dans le groupe témoin (n = 5), les 5 souris ont survécu jusqu’au sacrifice. Parmi les souris survivantes du groupe expérimental (n = 11), la pression artérielle systolique trois mois après l’induction était significativement plus élevée qu’avant l’induction (90 ± 1,39 mm Hg contre 126,63 ± 1,83 mm Hg ; P < 0,0001). Dans le groupe témoin (n = 5), la pression artérielle est demeurée constante avant l’induction et au moment du sacrifice (88 ± 2,34 mm Hg vs 91,8 ± 1,2 mm Hg ; P > 0,05).
Évaluation et constatations de l’AI
Dans le groupe expérimental, des anévrismes à différents endroits ont été détectés chez 5 des 11 souris survivantes à l’aide de l’ARM et de la microscopie optique. Deux anévrismes étaient situés au niveau des bifurcations de l’artère cérébrale antérieure et de l’artère olfactive, deux au niveau de l’artère communicante antérieure et un au niveau de l’artère cérébrale postérieure (Figure 3). De plus, 2 des 11 souris présentaient une tortuosité dans l’artère cérébrale antérieure et l’artère cérébrale moyenne. Aucun des anévrismes ne s’est rompu dans les trois mois suivant l’induction. Aucun changement anévrysmal n’a été observé chez 4 des 11 souris du groupe expérimental ou chez l’une des 5 souris du groupe témoin.
Examen histologique et d’immunofluorescence
Dans les anévrismes cérébraux humains, la paroi vasculaire est caractérisée par une perturbation de la lame élastique, une décellularisation du média, une déconnexion des fibres de collagène et une infiltration de macrophages M121. Par rapport aux vaisseaux sanguins témoins, la coloration EVG-Verhoeff a révélé une perturbation significative de la couche élastique interne dans le tissu IA (Figure 4A). La coloration de Masson a montré une déconnexion considérable des fibres de collagène dans les parois de l’IA (Figure 4B). L’analyse immunohistochimique a indiqué une infiltration significative de macrophages CD86-positifs dans la paroi de l’anévrisme (Figure 4C,D).
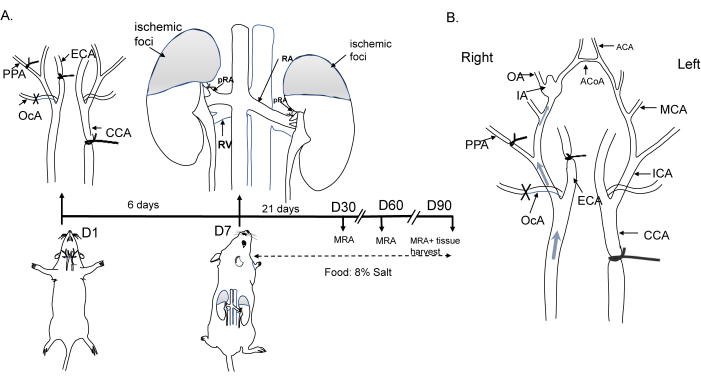
Figure 1 : Schéma de l’induction du modèle d’anévrisme de la souris. (A) Représentation schématique de la ligature de l’artère carotide commune gauche, de l’artère carotide externe droite, de l’artère ptérygo-palatine et des branches postérieures bilatérales de l’artère rénale, avec un régime alimentaire à 8 % de NaCl. (B) Changements hémodynamiques conduisant à des altérations du flux dans le cercle de Willis et à la formation d’anévrismes. Abréviations : ACA, artère cérébrale antérieure ; ACoA, artère communicante antérieure ; ACC, artère carotide commune ; ECA, artère carotide externe ; AI, anévrisme intracrânien ; MCA, artère cérébrale moyenne ; ARM, angiographie par résonance magnétique ; OA, artère olfactive ; OcA, artère occipitale ; PPA, artère ptérygo-palatine. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Diagrammes anatomiques et schématiques de la ligature artérielle. (A) Exposition et ligature des artères du cou. i-iv, ligature de l’ACC gauche ; v-vi, ligature de l’ECA droit ; vii-viii, ligature de l’OcA droit ; ix-x, ligature du PPA droit. (B) Exposition et ligature des branches postérieures de l’artère rénale (pRA). i-iv, exposition de l’ARP droit ; v-vi, séparation de l’ARP ; vii-viii, ligature de l’ARP ; IX-X, retour des reins à leur position initiale. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Changements morphologiques dans les anévrismes intracrâniens. (A) La bifurcation normale de l’artère olfactive et de l’artère cérébrale antérieure dans le groupe témoin. (B) Modifications anévrismales typiques à la bifurcation de l’artère olfactive et de l’artère cérébrale antérieure observées sur l’ARM et au microscope (flèche rouge). Grossissement : 6x. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Analyse pathologique des anévrismes intracrâniens. (A) Coloration EVG : La couche élastique du groupe normal est intacte et lisse, tandis que la couche élastique du groupe anévrisme est perturbée. (B) Coloration de Masson : Les fibres de collagène sont intactes dans le groupe normal, tandis qu’un grand nombre de fibres de collagène sont interrompues dans le groupe des anévrismes. (C) Coloration IHC pour CD86 : Les cellules CD86-positives sont absentes dans le groupe normal mais sont significativement présentes dans la paroi de l’anévrisme. Barres d’échelle = 200 μm (pour les images non agrandies) ; 50 μm (pour les images agrandies), ***P < 0,001. Abréviation : IA, anévrisme intracrânien. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette étude présente une approche modifiée de la construction d’un modèle murin d’IA par ligature du PPA pour induire des changements hémodynamiques additifs en combinaison avec l’hypertension. L’imagerie par IRM et l’analyse microscopique ont révélé des changements anévrismaux significatifs dans le cercle de Willis. Les altérations pathologiques observées dans ce modèle sont cohérentes avec celles trouvées dans les échantillons humains. Ce modèle murin peut servir d’outil précieux pour étudier les mécanismes moléculaires sous-jacents à la formation et au développement de l’IA.
L’IA a été induite chez la souris en ligaturant l’ACC gauche, l’ECA, l’OcA, le PPA et les artères rénales postérieures bilatérales (ARP), ainsi qu’un régime riche en sel. Cai et al. ont utilisé une procédure similaire pour établir un modèle d’anévrisme chez le rat avec une pression artérielle normale et ont identifié des anévrismes cérébraux et l’expansion des artères cérébrales antérieures22. Miyamoto et al. ont rapporté que, par rapport à la ligature uniquement de l’ACC gauche, la ligature supplémentaire de l’ACP droit et de l’ECA droit augmentait significativement la formation d’IA chez les rats. La ligature de l’ECA et de l’APP peut amplifier les changements hémodynamiques en augmentant le volume du flux sanguin18. Chez l’homme, l’occlusion de l’artère carotide a été liée à la formation d’anévrismes intracrâniens23. Par conséquent, ce modèle murin modifié de l’IA peut s’avérer bénéfique pour l’exploration de la formation et du développement de l’AI.
Le choix des espèces animales dans les études de recherche est crucial et sert des objectifs de recherche distincts. Les modèles de rats, qui sont utilisés depuis des décennies, présentent des caractéristiques pathologiques spécifiques telles que la fragmentation de la lame élastique interne et l’amincissement de la couche de cellules musculaires lisses. Les modèles de rats sont principalement utilisés pour étudier la pathogenèse des anévrismes24,25. Les modèles de lapin, en revanche, sont particulièrement adaptés aux études précliniques liées au traitement endovasculaire 26,27,28. Par rapport à ces modèles, les souris sont préférées pour les analyses génétiques en raison de leurs cycles de vie plus courts et de leur manipulabilité transgénique. De plus, les souris présentent une similitude significative dans l’expression et la fonction des gènes orthologues avec celles des humains29. Ainsi, les modèles murins représentent un choix optimal pour les investigations en laboratoire.
Dans des études antérieures, des anévrismes intracrâniens (IA) ont été induits chez des souris en utilisant l’élastase pour dégrader la lame élastique30. Bien que les anévrismes à base d’élastase présentent des changements morphologiques et histologiques similaires à ceux observés chez l’homme 31,32,33, ils sont associés à un taux de rupture élevé, ce qui les rend avantageux pour l’étude de la rupture IA. Cependant, la faiblesse des vaisseaux induite par l’élastase ne représente pas avec précision le processus naturel de formation de l’IA. Le modèle actuel, qui reproduit les caractéristiques pathologiques de l’AI humain, a été élaboré sur la base de deux facteurs de risque indépendants de formation d’AI et n’a pas entraîné de rupture au cours de la période d’observation de trois mois.
Cette étude comporte plusieurs limites. Alors que le modèle murin a été induit par des changements hémodynamiques additifs et l’hypertension, l’incidence des anévrismes cérébraux dans un échantillon de petite taille n’a pas été déterminée, ni comparée à l’incidence des anévrismes induits uniquement par la ligature de l’artère carotide commune ou la ligature bilatérale des artères rénales postérieures34. La fenêtre d’observation a été limitée à trois mois, ce qui simule partiellement le processus naturel de formation de l’IA mais n’élimine pas la possibilité de rupture. Reproduire l’hémodynamique complexe et réaliste de l’homme reste un défi. De plus, les changements hémodynamiques causés par la ligature supplémentaire du PPA n’ont pas été évalués, et les changements du débit sanguin n’ont pas été mesurés avec précision. Néanmoins, des IA chez la souris ont été détectées à l’aide de l’ARM, et les changements pathologiques observés correspondaient à ceux observés dans les IA humaines. Ce modèle murin d’IA est un outil précieux pour étudier le processus de formation de l’IA.
Déclarations de divulgation
Le manuscrit a été lu et approuvé par tous les auteurs nommés, et il n’y a pas d’autres personnes qui ont satisfait aux critères de paternité mais qui ne sont pas répertoriées. Les auteurs n’ont aucun conflit d’intérêts associé au manuscrit, et il n’y a pas eu de soutien financier significatif pour ce travail qui aurait pu influencer son résultat. Les bailleurs de fonds n’ont pas participé à la collecte ou à l’analyse des données, ni à la rédaction des articles. Le manuscrit n’a pas encore été publié en ligne ou imprimé, y compris dans des revues, des sites Web ou des blogs.
Remerciements
Cette étude a été soutenue par le National Facility for Translational Medicine (Shanghai TMSK-2021-147), le projet de recherche de l’hôpital Renji de Shanghai (RJTJ-QT-007) et la China Postdoctoral Science Foundation (numéro de certificat : 2024M760658).
matériels
| Name | Company | Catalog Number | Comments |
| 7.0 T magnetic resonance angiography | Bruker | BioSpec 70/20 | |
| C57BL/6 mice | Charles River Laboratories | sex: male | |
| CD86 antibody | CST | 91882 | |
| Elastic Van Gieson (EVG)stain | Solarbio | G1597 | |
| Masson | Solarbio | G1340 | |
| Micro forcep | Shanghai Jinzhong Instrument Company | ||
| Microfil | Flow Tech Inc. | MV-120 | |
| Small animal anesthesia machine | RWD | R500 | |
| Stereo microscope | Shanghai Optical Instrument Company | XYH-6B | |
| Suture | Shanghai Jinhuan Medical Company | 6-0, 8-0 |
Références
- Vlak, M. H., Algra, A., Brandenburg, R., Rinkel, G. J. Prevalence of unruptured intracranial aneurysms, with emphasis on sex, age, comorbidity, country, and time period: A systematic review and meta-analysis. Lancet Neurol. 10 (7), 626-636 (2011).
- Turjman, A. S., Turjman, F., Edelman, E. R. Role of fluid dynamics and inflammation in intracranial aneurysm formation. Circulation. 129 (3), 373-382 (2014).
- Shikata, F., et al. Potential influences of gut microbiota on the formation of intracranial aneurysm. Hypertension. 73 (2), 491-496 (2019).
- Penn, D. L., Komotar, R. J., Sander Connolly, E. Hemodynamic mechanisms underlying cerebral aneurysm pathogenesis. J Clin Neurosci. 18 (11), 1435-1438 (2011).
- Vlak, M. H., Rinkel, G. J., Greebe, P., Algra, A. Independent risk factors for intracranial aneurysms and their joint effect: A case-control study. Stroke. 44 (4), 984-987 (2013).
- Alfano, J., et al. Intracranial aneurysms occur more frequently at bifurcation sites that typically experience higher hemodynamic stresses. Neurosurgery. 73 (3), 497-505 (2013).
- Idil Soylu, A., Ozturk, M., Akan, H. Can vessel diameters, diameter ratios, and vessel angles predict the development of anterior communicating artery aneurysms: A morphological analysis. J Clin Neurosci. 68, 250-255 (2019).
- Starke, R. M., et al. Critical role of TNF-alpha in cerebral aneurysm formation and progression to rupture. J Neuroinflammation. 11, 77 (2014).
- Vrselja, Z., Brkic, H., Mrdenovic, S., Radic, R., Curic, G. Function of circle of Willis. J Cereb Blood Flow Metab. 34 (4), 578-584 (2014).
- Azedi, F., et al. Intra-arterial drug delivery to the ischemic brain in rat middle cerebral artery occlusion model. Bio Protoc. 9 (23), e3438 (2019).
- Yoshimura, S., et al. Reliable infarction of the middle cerebral artery territory in C57BL/6 mice using pterygopalatine artery ligation and filament optimization - The PURE-MCAo model. J Cereb Blood Flow Metab. , (2024).
- Nuki, Y., et al. Elastase-induced intracranial aneurysms in hypertensive mice. Hypertension. 54 (6), 1337-1344 (2009).
- Tada, Y., et al. Roles of hypertension in the rupture of intracranial aneurysms. Stroke. 45 (2), 579-586 (2014).
- Eldawoody, H., et al. Simplified experimental cerebral aneurysm model in rats: Comprehensive evaluation of induced aneurysms and arterial changes in the circle of Willis. Brain Res. 1300, 159-168 (2009).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2014).
- Furukawa, H., et al. Mast cell promotes the development of intracranial aneurysm rupture. Stroke. 51 (11), 3332-3339 (2020).
- Dungan, C. M., et al. Deletion of SA beta-Gal+ cells using senolytics improves muscle regeneration in old mice. Aging Cell. 21 (1), e13528 (2022).
- Miyamoto, T., et al. Site-specific elevation of interleukin-1beta and matrix metalloproteinase-9 in the Willis circle by hemodynamic changes is associated with rupture in a novel rat cerebral aneurysm model. J Cereb Blood Flow Metab. 37 (8), 2795-2805 (2017).
- Xu, C., et al. CD147 monoclonal antibody attenuates abdominal aortic aneurysm formation in angiotensin II-Infused apoE(-/-) mice. Int Immunopharmacol. 122, 110526 (2023).
- Taube, J. M., et al. Multi-institutional TSA-amplified multiplexed immunofluorescence reproducibility evaluation (MITRE) study. J Immunother Cancer. 9 (7), e002197 (2021).
- Frosen, J., et al. Saccular intracranial aneurysm: Pathology and mechanisms. Acta Neuropathol. 123 (6), 773-786 (2012).
- Cai, J., He, C., Yuan, F., Chen, L., Ling, F. A novel haemodynamic cerebral aneurysm model of rats with normal blood pressure. J Clin Neurosci. 19 (1), 135-138 (2012).
- Arnaout, O. M., et al. De novo large fusiform posterior circulation intracranial aneurysm presenting with subarachnoid hemorrhage 7 years after therapeutic internal carotid artery occlusion: case report and review of the literature. Neurosurgery. 71 (3), E764-E771 (2012).
- Nagata, I., Handa, H., Hashimoto, N., Hazama, F. Experimentally induced cerebral aneurysms in rats: Part VI. Hypertension. Surg Neurol. 14 (6), 477-479 (1980).
- Aoki, T., Kataoka, H., Morimoto, M., Nozaki, K., Hashimoto, N. Macrophage-derived matrix metalloproteinase-2 and -9 promote the progression of cerebral aneurysms in rats. Stroke. 38 (1), 162-169 (2007).
- Grunwald, I. Q., et al. An experimental aneurysm model: a training model for neurointerventionalists. Interv Neuroradiol. 12 (1), 17-24 (2006).
- Brinjikji, W., Ding, Y. H., Kallmes, D. F., Kadirvel, R. From bench to bedside: Utility of the rabbit elastase aneurysm model in preclinical studies of intracranial aneurysm treatment. J Neurointerv Surg. 8 (5), 521-525 (2016).
- Adibi, A., Eesa, M., Wong, J. H., Sen, A., Mitha, A. P. Combined endovascular coiling and intra-aneurysmal allogeneic mesenchymal stromal cell therapy for intracranial aneurysms in a rabbit model: A proof-of-concept study. J Neurointerv Surg. 9 (7), 707-712 (2017).
- Liao, B. Y., Zhang, J. Evolutionary conservation of expression profiles between human and mouse orthologous genes. Mol Biol Evol. 23 (3), 530-540 (2006).
- Han, Y., et al. Axl promotes intracranial aneurysm rupture by regulating macrophage polarization toward M1 via STAT1/HIF-1alpha. Front Immunol. 14, 1158758 (2023).
- Wang, S., et al. Rabbit aneurysm models mimic histologic wall types identified in human intracranial aneurysms. J Neurointerv Surg. 10 (4), 411-415 (2018).
- Nowicki, K. W., Hosaka, K., Walch, F. J., Scott, E. W., Hoh, B. L. M1 macrophages are required for murine cerebral aneurysm formation. J Neurointerv Surg. 10 (1), 93-97 (2018).
- Shi, Y., et al. Nrf-2 signaling inhibits intracranial aneurysm formation and progression by modulating vascular smooth muscle cell phenotype and function. J Neuroinflammation. 16 (1), 185 (2019).
- Morimoto, M., et al. Mouse model of cerebral aneurysm: experimental induction by renal hypertension and local hemodynamic changes. Stroke. 33 (7), 1911-1915 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon