Method Article
トリパノソーマ・エバンシ感染マウスにおけるアロディニアと疼痛を評価するためのマウスしかめっ面尺度に関連する電子フォン・フレイ
要約
ここでは、 トリパノソーマ エバンシに感染したマウスの侵害受容を評価するためのプロトコルを紹介します。電子フォン フレイ装置をツールとして使用し、後肢と内臓の機械的閾値を測定します。
要約
感染症の病因は、まだ研究すべき複雑な分野です。アロディニアや痛みなどのいくつかの臨床徴候の経過は、家畜で観察される場合があります。.しかし、その経路と正しい治療に関する知識には、制御された実験が必要であり、その多くは実験動物を使用しています。後足と内臓の機械的閾値の変化を測定することは、げっ歯類の痛み知覚の変化を観察するための有用な手法です。離脱反応は、ベースラインテストで最初に測定できるため、実験グループの制御が向上します。その後の試験は、感染を誘発し、プロトコルに薬物を追加した後に実施することができます。顔面スケールを使用して痛みのような変化を観察することに関連する電子フォンフレイ装置を使用すると、マウスの異痛症と痛みを評価するためのシンプルで正確かつ一貫した評価が可能になります。したがって、本方法論を用いた トリパノソーマ・エバンシ 感染症の実験は、実験室感染動物のアロディニアおよび疼痛を評価するための有用な方法であり、これは従来の家畜動物の治療に適用できる。
概要
Trypanosoma evansiは、南アメリカで「surra」または「mal-das-cadeiras」と呼ばれる疾患の病原体です1,2。それは一般的に馬や牛に影響を及ぼしますが、野生の動物にも影響を及ぼし、血球食性のコウモリ、タバニド、およびストモックスハエの咬傷1,3によって伝染します。スーラは家畜の主要な病気であり、適切な治療法がないと致命的となる可能性があり、貧血、食欲不振や体重減少、筋力低下、流産などの非特異的な臨床徴候を示し、宿主や地理的地域によって異なる場合があります2,4,5,6。
病気の経過中に感染した動物における異痛症と痛みの発現は、まだ新しいトピックです2,7。これらの徴候の背後にある病因を理解したいという衝動は、古典的なトリパノサイドプロトコル5,6に効果的な鎮痛薬を追加することにより、現在使用されている治療法を改善し、洗練するための重要なステップです。このシナリオでは、マウスモデルを用いて病気を再現できる可能性が利点となり、マウスを実験室の制御された環境下で容易に飼育できるため、家畜を用いた野外実験よりも一貫性のある結果が得られることになります。
機械的な閾値は、一般に、膨大な数の実験2,8,9における異痛症の評価のために、電子フォンフレイ(EvF)装置を用いて得られる。この装置は、機械的刺激に対する組織の感受性を評価するために使用されます:装置が動物の足に触れると、装置に取り付けられた20-200μLの先端を介して、動物が足を引き抜く力が記録されます。
これらの実験では、通常、げっ歯類が標準的な動物として使用され、研究された病気のほとんどは、対照研究を行うことが困難な他の種から来ているため、ほとんどの結果は他の種に外挿されます。さらに、異痛症と痛みは密接に関連しています。感染したマウスの痛みを評価するための特定の顔面スケールの使用は、T. evansi感染の経過中の痛みの存在を確認するための確認アジュバントとして重要な役割を果たします2,10。
このプロトコルでは、 実験的に T. evansi に感染したマウスの異痛症と痛みを評価するための新しいモデルを示し、変数間の高い相関を示し、強力なモデルであることが証明されました。さらに、全体の手順を実行するのに必要な研究者は少ないため、実験中に人間の干渉を受ける可能性が低くなります。また、研究者は急性期に標的疾患を再現し、実験デザインにいくつかの異なる治療薬を追加することで、短期間で一貫した結果を得ることができます。
プロトコル
すべての実験は、10週齢の成体雌スイスマウス(35-55g)を用いて行った。動物は、温度制御された部屋(21±1°C)、12時間の明るいサイクル/ 12時間の暗いサイクル、および標準的な実験室のチャウと水 を自由に使用した部屋で、ポリスルホンケージ(ケージあたり3〜5匹の動物)に収容されました。各試験で10匹の動物を各グループに割り当て、薬物治療の一貫した効果を実証しました。実験デザインは、サンタカタリーナ州立大学(CEUA)の倫理委員会(プロトコル番号:6019201123)によって提出され、承認されました。すべての動物実験は、ARRIVEガイドライン(Animal Research: Reporting of in vivo Experiments)に準拠し、National Research Council Guide for the Care and Use of Laboratory Animals(全米研究評議会実験動物のケアと使用に関するガイド)に従って実施されました。
1. トリパノソーマ・エバンシの調製と接種
注意: 感染した血液サンプル、試薬、およびその他の化合物を取り扱うときは、使い捨ての白衣、手袋、マスク、および目の保護具を着用してください。
- ウォーターバス装置の電源を入れ、37°Cの一定温度で調整します。
- 保存した血液サンプルが入った微量遠心チューブをウルトラフリーザー(-80°C)から取り出します。血液が溶けるまで水浴に入れます。
注:同じ分離株を使用して、異なる実験のすべてのグループのすべてのマウスに感染させ、血液通過の数を一定に維持する必要があります。 - 60% D-(+)-グルコース(pH 7.4)を含むリン酸緩衝生理食塩水(PBS、0.1 M)を使用して、0.1 mLあたり1 ×10 4 トリパノソーマが得られるまで段階希釈(10:1 v v)を行います。寄生虫細胞の数は、100倍対物レンズ2を搭載した顕微鏡上のノイバウアーチャンバーを用いた手動細胞計数により決定します。
- 希釈した血液溶液 0.1 mL (感染群) または同量の 0.9% 生理食塩水ビヒクル (対照群) を、インスリン注射器に結合した 26 G 1/2" 針を使用して腹腔内に接種します。
2. 電子フォン・フレイ装置のセットアップと操作
注意:取得したデータの記録方法に注意してください。一部のEvF機器には、取得したデータを装置からコンピューター、タブレット、スマートフォンなどの他の電子機器に転送するための特定のプログラムがあります。
- EvF装置の電源を入れます。実験を開始する前に、装置が十分に充電されていることを確認し、装置の画面に表示されるバッテリーレベルを観察し、必要に応じて充電してください。
- EvF装置を選択した電子機器にWi-Fi経由で接続し、取得したデータを転送および保存します。
- 10 μL のポリプロピレンチップを EvF 装置コーンに挿入し、足記号の付いたボタンを押して読み出しをゼロ (0.00 g) に設定します。
- 評価された組織がプローブされたら、それを観察します。最大印加圧力は、EvF装置のディスプレイに表示されます。その後、アンテナ記号の付いたボタンを押して、選択した電子機器に転送し、安全に録音します。
- 読み出しをゼロにリセットし、足の記号が付いたボタンをもう一度押すだけで、新しい測定を行う準備をします。
3. 機械的閾値評価に関する一般的な考慮事項
- すべての実験は、21°Cに制御された温度と12時間の明かり/12時間の暗サイクルで静かな部屋で行い、すべての評価を1日目の2日目に同時に実行することにより、マウスの概日周期を尊重するようにしてください。
- 同じ人にベースラインと実験の両方の機械的閾値評価を行ってもらい、バイアスを減らし、測定の一貫性を確保します。実験が盲検化されていることを確認してください。
- ポリメチルメタクリレート(PMMA)で作られた個々のチャンバー内に各マウスを静かに置き、穴あきトップを5mm²のメッシュフロアスタンド2,8に置きます。
- マウスをPMMAチャンバーで30分間順応させてから、ベースラインと実験の両方の機械的閾値を評価します2.
- メッシュのフロアスタンドを快適な高さ(安定した表面)に配置して、動物がすべての側面からアクセスできるようにします。マウスの腹部と4本の足すべてがメッシュの床の開口部から簡単にアクセスできることを確認してください。
- チャンバーを割り当てるために使用される安定した表面を吸収材で覆い、排尿と排便を吸収または収集します。EvF装置の操作中は、研究者の腕がチャンバーの下を自由に移動できることを確認してください。
4. ベースラインの機械的閾値評価とマウスの刺激に対する反応
- 腹部の測定では、腹部を3つの仮想部分(頭蓋、中、尾部)に分割します。内臓異痛症の機械的閾値評価のための標準的な標的組織として、頭蓋領域 (解剖学的に肝臓を含む) を選択します。足の測定には、標準化のために右の後足を選択します。
- 感染の48時間前に各マウスからベースライン測定を行います。これを行うには、マウスを収容チャンバーに入れ、EvF装置を準備し、両手でプローブをゆっくりと持ち上げて標的組織を刺激します。
- マウスが侵害受容行動を示すまで、組織への圧力を徐々に増やします。右後足の評価には、足の引き込み、足を舐める、または4本足のジャンプを探します2,8,9。内臓評価のためには、腹部の急激な収縮、プローブされた部位の即時の舐めまたは引っ掻き傷、または4本足のジャンプ2,11を探します。
- 特定のEvFプログラムを含む選択した電子機器にデータを転送するか、成績表に書き込んで、取得した値を保存します。ディスプレイをゼロにリセットし、プロセスを4回繰り返して5つの測定値を取得します8。
注:平均値2を推定するには、3つの類似した測定値のみを考慮してください - 各マウスが5回プローブされ、各動物の平均値が得られるまで、隣接するチャンバーに存在するマウスの機械的閾値を測定します。
- 24時間後にベースライン測定を繰り返し、平均値が3.00 g未満、または基礎測定値の差が2.00 gを超えるマウスを除外します2,8。
注:各実験では、マウスごとに1つの標的組織のみを選択する必要があります。これにより、動物がプローブされることに慣れることはありません。これは、短期間で評価の数がかなり多くなるためです。
5.実験的に右後肢と内臓異痛症の機械的閾値評価
- 感染の 0 日目の評価のために、感染の 1 時間後に右後肢または内臓異痛症の機械的閾値を評価します。
- 感染後5日間にわたって24時間ごとにこの手順を繰り返します。.
注: 投与する治療がある場合は、実験デザイン内で適切な時点を選択してください。 - 動物同士が争うのを防ぐために、マウスを元のケージに戻し、測定 が完了した後は 標準的な実験室のチャウと水を自由に利用できます。
- 正規性検定を実行してデータの正規分布を確認し、収集したデータのさらに適切な統計分析を行います。
6.マウスのしかめっ面スケール評価
- 収容チャンバー内で各マウスが容易に見えることを確認し、実験前に各マウスを検査して、手足、腹部、または顔に病変がなく、被毛が変化していないことを確認します。
- マウスの眼窩領域を観察します。目が開いていることを痛みがないと分類し (スコア 0)、マウスが目を閉じたときに明らかな痛みを表すことができます (スコア 2)。
- マウスの鼻を観察します。正常な鼻は痛みがないこと、鼻梁に膨らみがあることは明らかな痛みを表すと分類します。
- ネズミの頬を観察します。正常な頬は痛みがないこと、両頬に膨らみがあることは明らかな痛みを表すと分類します。
- マウスの耳の位置を観察します。丸みを帯びた耳は痛みがないと分類し、耳が顔から離れて外側または後方に回転し、尖った形では明らかな痛みを表します。耳の間のスペースは、痛みのスコアとともに増加します。
- マウスのひげを観察します。ひげは自然な下向きの曲線で痛みがないと分類し、ひげが頬に引っ張られているか前に引っ張られている場合は明らかな痛みを表します。
- セルフグルーミングなどの生来の行動は顔の表情を妨げる可能性があるため、これらを痛みに関連する行動とは見なさないでください8。マウスがこの動作を停止するのを待ってから、すべてのアクション ユニットを評価します。
- 正規性検定を実行してデータの正規分布を確認し、収集したデータのさらに適切な統計分析を行います。
注:すべての実験の終わりに、マウスはケタミン(90 mg / kg)とキシラジン(7.5 mg / kg)を使用して人道的に安楽死させられました。確認された深部麻酔計画に達した後、彼らは頸椎脱臼に提出されました。
結果
T. evansi感染による機械的閾値の低下は、右後肢と内臓組織の両方に対する電子フォンフレイ装置によって評価されました
この実験は、利用可能な T. evansi サンプル2に関連する以前のデータによると、5日間にわたって実施されました。感染したマウスは、感染後3日目に右後足の機械的閾値に有意差を示し始め、感染後2日間は非感染マウスと比較して対照群よりも有意に低いままでした(図1A)。腹部触覚過敏症の同様の結果は、感染後3日目から感染マウスの内臓異痛症を示し、感染後2日間は対照群よりも有意に低いままでした(図1B)。
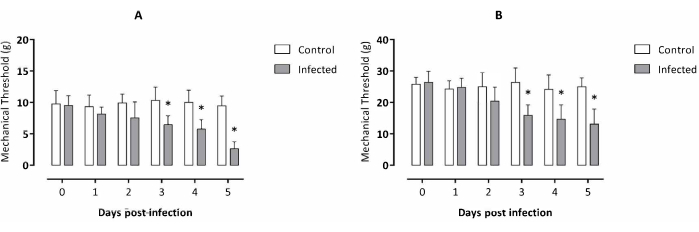
図1:Trypanosoma evansiに実験的に感染したマウスの異痛症評価(A)右後足異痛症および(B)内臓異痛症。データは、各実験群の10匹の動物の平均±SDで表されます。統計分析:スチューデントのt検定、時点ごとに1つの対応のない分析。アスタリスクは、同じ分析時点(p < 0.05)を考慮した場合、実験グループ間で有意差を示しています。この図の拡大版を表示するには、ここをクリックしてください。
T. evansi感染によるマウス疼痛関連顔面特徴の誘導とMouse Grimace Scale疼痛評価による数値解釈
感染したマウスは、感染後3日目に疼痛関連の顔面特徴の顕著な徴候を示し始め、紹介された時点での平均スコアは0.4 [0-1]であった。実験中も同様の傾向が見られ、感染群は対照群と比較して有意差を示し、感染後4日目と5日目の平均スコアはそれぞれ0.6 [0-1]と1.3 [0-2]を示しました。対照群は、予想通り、マウスしかめっ面スケールで得点しませんでした。統計分析は、スチューデントの t 検定 (1 時点につき 1 つの対応のない分析) を使用して実行され、p < 0.05 の値を有意と見なしました。さらに、ピアソン相関係数(r)は、マウスしかめっ面スケールの痛み評価と右後足異痛症との間の相互作用パターン、または同じスケールと内臓異痛症との間の相互作用パターンを特定し、その値はそれぞれ-96.35%と-84.08%でした。また、マウスしかめっ面スケール疼痛評価と右後肢異痛症または内臓異痛症の決定係数(R2)は、それぞれ0.9283と0.7070であった。
本研究は、T. evansi感染の経過を通じて炎症と痛みの存在を確認した以前のデータと一致しています2,3,7,12。さらに、記載された方法は、マウスの異痛症および疼痛を同定および測定するための正確な方法論を提供する。さらに、感染マウスにおけるマウスしかめっ面スケールの疼痛評価の使用は、右後足異痛症評価によって表される結果と比較すると非常に高い陰性r(90〜100%)を示し、各動物の内臓異痛症評価では高い陰性r(70〜89%)を示した13。同様に、感染マウスにおけるマウスしかめっ面スケールの疼痛評価の使用は、右後足異痛症評価によって表される結果と比較すると、非常に強いR2(0.90〜1.00)を示し、同じ動物の内臓異痛症評価では強いR2(0.70〜0.89)を示した14。
ディスカッション
感染した動物を対象とした実験における重要なステップは、寄生虫血症のレベルを制御することです。T. evansiの異なる系統は、マウスでは異なる方法で振る舞う可能性があり、急性感染症から慢性感染症に至ります2,4,5,6。さらに、感染用量の変化は、マウスの生存期間を短縮または延長する可能性があります。したがって、実験に先立って生存曲線を得ることは、実験の正しい期間を決定し、予期せぬマウスの死事象15,16によるフラストレーションを防ぐために推奨される。さらに、このデータは、該当する場合、実験の人道的なエンドポイントを決定する場合があります。
さらに、プロトコルのセクションで説明されているように、実験のすべてのマウスに感染させるために、同じ分離株を使用して、同じ数の血液通過を尊重する必要があります。同様に、凍結保存された血液または新たに感染した血液を使用してマウスに感染させることができ、一部の凍結保存されたサンプルは、水浴で解凍した後に不活性化される可能性があります。しかし、新たに感染した血液は、より速い寄生虫症を引き起こす可能性があり、したがって、早期の死亡イベントを引き起こす可能性がある17,18。
トリパノサイド薬や鎮痛薬の追加など、実験の変更は実行可能です。新しいグループはより多くの動物を意味し、選択した薬物の対照グループでさえベースライン測定に提出する必要があることを覚えておくことが重要です。我々の経験では、マウスの約20〜25%が2回目のベースライン測定後に実験から除外され、これは以前のデータ8と一致している。これは、初期動物数が実験動物数よりも多くなければならないことを意味し、より多くのグループが評価され、その結果、より多くのマウスが推定される場合に問題になる可能性があります。
このモデルでは、薬物動態と薬力学を考慮に入れる必要があります。.一部の薬物は、その薬理学的作用を発揮するために長期間を要するため、マウスが通常平均4〜5日で死亡するモデルの実験デザインに影響を与える可能性があります2,6。さらに、動物が選択した治療のために絶食している場合、プロトコルのセクションで報告されているように、順応期間は薬物動態と実験スケジュールと手順の両方に影響を与えるため、考慮すべき重要な要素になる可能性があります。
現在の方法の大きな改善点は、十分に訓練された 1 人の研究者が、感染や治療を知らせずに、EvF 読み取り手順全体 (ベースライン測定と実験的測定の両方) を実行できることです。実験の開始時に別の研究者が感染を行う必要があります。EvF装置には、1人だけが機器を完全に操作できる特定のvon Frey Wi-Fi測定プログラムがあるため、感染手順後には必要ありません。さらに、この方法は通常のフィラメントフォンフレイ装置よりも高速で、8,19の実行が容易です。
しかし、同じ研究者がすべての動物の読み取りを行う必要があり、しばらくすると反復運動により疲労を発症する可能性があるため、疲労は合併症になる可能性があります8。 T. evansiに感染したマウスの生存期待を考慮すると、実験計画に多数のグループを含めることは推奨されません。私たちの経験では、一度に平均10匹のマウス(実験デザインによって異なります)を30分未満で測定できます。さらに、プロトコルのセクションで説明されているように、動物がプローブされることに慣れないように、すべての実験でマウスごとに1つの標的組織のみを選択する必要があります。
さらに、EvF(右後肢と内臓の測定)とマウスしかめっ面スケールの評価には、十分な訓練を受けた研究者が必要です。実験を行う前に、研究者は長期間の練習をしなければなりません。マウスの表情の変化を正しく評価するためには、研究者は、予想される変化だけでなく、通常のマウスの正常な表情とその正常性と行動のバリエーションも知らなければならない10,20。さらに、EvF装置を使用してマウスの機械的閾値を正しく評価するためには、研究者は、プローブ刺激に対するマウスの応答が容易に認識され、一貫性が達成されるまで、いくつかのベースライン測定を繰り返す必要があります2,8。
このプロトコルの将来の適用には、 T. evansiに感染したマウスに対する異痛症と疼痛の評価、およびその治療が含まれます。現在のモデルにより、科学研究者は、実験室の制御された環境下で、家畜によく見られる病気の痛みに関連する病因をマウスで評価できます。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
著者らは、財政的支援を提供してくれたサンタカタリーナ州立大学、動物と宇宙に関する薬理学研究所、そしてこれらの実験で使用された T. evansi に感染した凍結保存された血液サンプルを提供してくれた血液寄生虫およびベクター生化学研究所に特に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 26 G 1/2" needle coupled to insulin syringe | TKL | 80288090100 | Used to infund solutions on laboratory animals |
| Accessories for von Frey analgesimeter | INSIGHT | EFF 303 | Containment box with support for digital analgesimeter assessment |
| D-(+)-Glucose | SIGMA-ALDRICH | G7021 | A monosaccharide which is the main source of energy in the form of ATP for living organisms |
| Digital analgesimeter | INSIGHT | von Frey Wi-Fi | The von Frey Wi-Fi is a portable device used to assess tissue sensitivity to mechanical stimuli |
| Gilson type 10 µL polypropylene tip | CRALPLAST | 18261 | Polypropylene to be used on eletronic von Frey apparatus, recommended for hind paw allodynia assessment |
| Laboratory water bath | BEING INSTRUMENT | BW-22P | Used to heat liquid and semi-solid substances contained in appropriate recipients to specific temperature |
| Phosphate buffered saline | SIGMA-ALDRICH | 806552 | A balanced salt solution buffer used for a variety of cell culture applications |
| Swiss mice (Mus musculus) from both gender | UFSC | Swiss Webster | Laboratory animals used for controlled experiments |
| Trypanosoma evansi cryiopreserved sample | UDESC | - | Sample used to infect all mice, ceded by the Hemoparasites and Vectors Biochemistry Laboratory |
| Universal type 10 µL polypropylene tip | CRALPLAST | 18171 | Polypropylene to be used on eletronic von Frey apparatus, recommended for visceral allodynia assessment |
参考文献
- Desquesnes, M., et al. Trypanosoma evansi and surra: a review and perspectives on origin, history, distribution, taxonomy, morphology, hosts, and pathogenic effects. BioMed Research International. 2013, 194176 (2013).
- Cipriani, D. S., et al. Experimental Trypanosoma evansi infection induces pain along with oxidative stress, prevented by COX-2 inhibition. Experimental Parasitology. 247, 108477 (2023).
- Paim, F. C., et al. Cytokines in rats experimentally infected with Trypanosoma evansi. Experimental Parasitology. 128 (4), 365-370 (2011).
- Gillingwater, K., et al. In vivo investigations of selected diamidine compounds against Trypanosoma evansi using a mouse model. Antimicrobial Agents and Chemotherapy. 53 (12), 5074-5079 (2009).
- Dkhil, M. A., et al. Treatment of Trypanosoma evansi-infected mice with Eucalyptus camaldulensis led to a change in brain response and spleen immunomodulation. Frontiers in Microbiology. 13, 833520 (2022).
- Dkhil, M. A., et al. Murine liver response to Allium sativum treatment during infection induced-trypanosomiasis. Saudi Journal of Biological Sciences. 28 (6), 3270-3274 (2021).
- Martins de Moraes, C., et al. Infection by Trypanosoma evansi in horses from Brazil. Revista Portuguesa de Ciências Veterinárias. 102 (561-562), 159-163 (2007).
- Martinov, T., et al. Measuring changes in tactile sensitivity in the hind paw of mice using an electronic von Frey apparatus. Journal of Visualized Experiments. 82, e51212 (2013).
- Rodríguez-Angulo, H., et al. Role of TNF in sickness behavior and allodynia during the acute phase of Chagas' disease. Experimental Parasitology. 134 (4), 422-429 (2013).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7, 447-449 (2010).
- Eijkelkamp, N., et al. Increased visceral sensitivity to capsaicin after DSS-induced colitis in mice: spinal cord c-Fos expression and behavior. American Journal of Physiology-Gastrointestinal and Liver Physiology. 293 (4), 749-757 (2007).
- Mekata, H., et al. Expression of regulatory dendritic cell-related cytokines in cattle experimentally infected with Trypanosoma evansi. Journal of Veterinary Medical Science. 77 (8), 1017-1019 (2015).
- Mukaka, M. M. Statistics corner: a guide to appropriate use of correlation coefficient in medical research. Malawi Medical Journal. 24 (3), 69-71 (2012).
- Schober, P., et al. Correlation coefficients: appropriate use and interpretation. Anesthesia and Analgesia. 126 (5), 1763-1768 (2018).
- Kamidi, C. M., et al. Differential virulence of camel Trypanosoma evansi isolates in mice. Parasitology. 145 (9), 1235-1242 (2018).
- Mekata, H., et al. Isolation, cloning, and pathologic analysis of Trypanosoma evansi field isolates. Parasitology Research. 112, 1513-1521 (2013).
- Silva, A. S., et al. Trypanosoma evansi pathogenicity strain in rats inoculated with parasite in fresh and cryopreserved blood. Ciência Rural. 39 (6), 1842-1846 (2009).
- Silva, A. S., et al. Acetylcholinesterase activity and lipid peroxidation in the brain and spinal cord of rats infected with Trypanosoma evansi. Veterinary Parasitology. 175, 237-244 (2011).
- Diógenes, A. K. L., et al. Concurrent validity of electronic von Frey as an assessment tool for burn associated pain. Burns. 46 (6), 1328-1336 (2020).
- Kalueff, A. V., et al. Neurobiology of rodent self-grooming and its value for translational neuroscience. Nature Reviews Neuroscience. 17, 45-59 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved