Method Article
L’électronique de von Frey associée à l’échelle de grimace de la souris pour évaluer l’allodynie et la douleur chez les souris infectées par Trypanosoma evansi
Dans cet article
Résumé
Ici, nous présentons un protocole pour évaluer la nociception chez les souris infectées par Trypanosoma evansi, en utilisant l’appareil électronique de von Frey comme outil, mesurant les seuils mécaniques de la patte arrière et des viscères.
Résumé
La pathogenèse des maladies infectieuses reste un domaine complexe à étudier. L’évolution de plusieurs signes cliniques, tels que l’allodynie et la douleur, peut être observée chez les animaux domestiques. Cependant, la connaissance de leurs voies et le traitement correct nécessitent des expériences contrôlées, dont beaucoup utilisent des animaux de laboratoire. La mesure des changements dans les seuils mécaniques de la patte arrière et des viscères est une technique utile pour observer les changements dans la perception de la douleur chez les rongeurs. La réponse de sevrage peut être mesurée en premier dans les tests de base, ce qui crée un meilleur contrôle des groupes expérimentaux. Des tests ultérieurs peuvent être effectués après avoir induit l’infection et ajouté des médicaments au protocole. L’utilisation d’un appareil électronique de von Frey associé à l’utilisation d’une échelle faciale pour observer les changements semblables à la douleur permet une évaluation simple, précise et cohérente de l’allodynie et de la douleur chez la souris. Ainsi, les expériences utilisant la méthodologie actuelle pour l’infection à Trypanosoma evansi représentent une méthode utile pour évaluer l’allodynie et la douleur chez les animaux infectés en laboratoire, qui peut être appliquée au traitement conventionnel des animaux d’élevage.
Introduction
Trypanosoma evansi est l’agent étiologique de la maladie appelée « surra » ou « mal-das-cadeiras » en Amérique du Sud 1,2. Il affecte généralement les équidés et les bovins, mais aussi la faune sauvage, étant transmis par les chauves-souris hématophages, les tabanidés et les morsures de mouchesstomoxes 1,3. Surra est une maladie majeure chez les animaux domestiques, qui peut être mortelle en l’absence d’un traitement approprié, présentant des signes cliniques non spécifiques tels que l’anémie, la perte d’appétit et de poids, la faiblesse musculaire et l’avortement, qui peuvent varier selon l’hôte et la région géographique 2,4,5,6.
L’expression de l’allodynie et de la douleur chez les animaux infectés au cours de la maladie est encore un sujet nouveau 2,7. L’envie de comprendre la pathogenèse derrière ces signes est une étape importante pour améliorer et affiner le traitement actuellement utilisé en ajoutant des analgésiques efficaces au protocole trypanocide classique 5,6. Dans ce scénario, la possibilité de reproduire la maladie à l’aide d’un modèle murin représente un avantage, car les souris peuvent être facilement maintenues dans des environnements contrôlés en laboratoire et donnent donc des résultats plus cohérents que les expériences sur le terrain avec du bétail.
Un seuil mécanique est couramment obtenu à l’aide d’un appareil électronique de von Frey (EvF) pour l’évaluation de l’allodynie dans un grand nombre d’expériences 2,8,9. Cet appareil est utilisé pour évaluer la sensibilité des tissus à la stimulation mécanique : une fois que l’appareil touche la patte de l’animal, à travers une pointe de 20 à 200 μL fixée à l’appareil, la force avec laquelle l’animal retire la patte est enregistrée.
Les rongeurs sont généralement utilisés comme animaux standard dans ces expériences, et la plupart des résultats sont extrapolés à d’autres espèces, car la plupart des maladies étudiées proviennent d’autres espèces sur lesquelles il serait difficile de mener une étude contrôlée. De plus, l’allodynie et la douleur sont intimement liées. L’utilisation d’une échelle faciale spécifique pour évaluer la douleur chez les souris infectées joue un rôle important en tant qu’adjuvant de confirmation pour affirmer la présence de la douleur au cours de l’infection à T. evansi 2,10.
Dans ce protocole, nous démontrons un nouveau modèle pour évaluer l’allodynie et la douleur chez des souris infectées expérimentalement par T. evansi, montrant une forte corrélation entre les variables, s’avérant ainsi être un modèle solide. De plus, il faut un petit nombre de chercheurs pour effectuer l’ensemble de la procédure, ce qui réduit le risque d’interférence humaine pendant l’expérience. Il permet également à l’investigateur de reproduire la maladie cible au cours d’une phase aiguë et d’ajouter plusieurs médicaments de traitement différents dans la conception expérimentale, obtenant ainsi des résultats cohérents dans un court laps de temps.
Protocole
Toutes les expériences ont été réalisées sur des souris suisses femelles adultes de 10 semaines (35-55 g). Les animaux ont été logés dans des cages en polysulfone (3 à 5 animaux par cage) dans une pièce à température contrôlée (21 ± 1 °C), avec un cycle de 12 h de lumière et 12 h d’obscurité, ainsi qu’une nourriture de laboratoire standard et de l’eau à volonté. Dix animaux ont été assignés à chaque groupe dans chaque test pour démontrer les effets cohérents des traitements médicamenteux. Le plan expérimental a été soumis et approuvé par le Comité d’éthique de l’Université d’État de Santa Catarina (CEUA) (numéro de protocole : 6019201123). Toutes les expériences sur les animaux ont été conformes aux directives ARRIVE (Animal Research : Reporting of in vivo Experiments) et ont été réalisées conformément au Guide du Conseil national de recherches sur le soin et l’utilisation des animaux de laboratoire.
1. Préparation et inoculation de Trypanosoma evansi
ATTENTION : Portez une blouse de laboratoire jetable, des gants, un masque et des lunettes de protection lorsque vous manipulez des échantillons de sang infectés, des réactifs et d’autres composés chimiques.
- Allumez le bain-marie et réglez-le à une température constante de 37 °C.
- Sortez de l’ultracongélateur (-80 °C) un tube de microcentrifugation contenant l’échantillon de sang conservé. Placez-le dans le bain-marie jusqu’à ce que le sang dégèle.
REMARQUE : Le même isolat doit être utilisé pour infecter toutes les souris de chaque groupe d’expériences différentes afin de maintenir un nombre égal de voies sanguines. - Utiliser une solution saline tamponnée au phosphate (PBS, 0,1 M) contenant 60 % de D-(+)-glucose (pH 7,4) pour effectuer une dilution en série (10:1 v v) jusqu’à l’obtention de 1 × 104 trypanosomes par 0,1 mL. Déterminer le nombre de cellules parasitaires par comptage manuel des cellules à l’aide d’une chambre de Neubauer sur un microscope avec une lentille d’objectif 100x2.
- Inocuculer 0,1 mL de la solution sanguine diluée (groupe infecté), ou le même volume dans un véhicule salin à 0,9 % (groupe témoin), par voie intrapéritonéale, à l’aide d’une aiguille de 26 G 1/2" couplée à une seringue à insuline.
2. Configuration et fonctionnement de l’appareil électronique de von Frey
REMARQUE : Faites attention à la façon dont les données obtenues sont enregistrées. Certains équipements EvF disposent de programmes spécifiques pour transférer les données obtenues de l’appareil vers d’autres appareils électroniques, tels que des ordinateurs, des tablettes ou des smartphones.
- Allumez l’appareil EvF. Assurez-vous que l’équipement est bien chargé avant de commencer l’expérience, en observant le niveau de la batterie affiché sur l’écran de l’équipement et en le chargeant si nécessaire.
- Connectez l’appareil EvF à l’appareil électronique choisi via Wi-Fi pour transférer et enregistrer les données obtenues.
- Insérez une pointe en polypropylène de 10 μL dans le cône de l’appareil EvF et réglez la lecture à zéro (0,00 g) en appuyant sur le bouton avec le symbole de la patte.
- Observez qu’une fois que le tissu évalué est sondé ; la pression maximale appliquée est indiquée sur l’écran de l’appareil EvF. Après cela, transférez-le sur l’appareil électronique choisi en appuyant sur le bouton avec un symbole d’antenne pour un enregistrement en toute sécurité.
- Réinitialisez l’affichage à zéro et préparez-vous à prendre une nouvelle mesure en appuyant simplement à nouveau sur le bouton avec le symbole de la patte.
3. Considérations générales pour l’évaluation des seuils mécaniques
- Effectuez toutes les expériences dans une pièce calme avec une température contrôlée à 21 °C et un cycle 12 h lumière/12 h obscurité, et assurez-vous de respecter le cycle circadien de la souris en effectuant toutes les évaluations en même temps du jour2.
- Demander à la même personne d’effectuer à la fois des évaluations de seuil mécanique de base et expérimentales afin de réduire les biais et d’assurer l’uniformité des mesures ; Assurez-vous que les expériences sont à l’aveugle.
- Placez délicatement chaque souris à l’intérieur d’une chambre individuelle en polyméthacrylate de méthyle (PMMA) avec un dessus perforé placé sur un support de sol en maillede 5 mm² 2,8.
- Laissez les souris s’acclimater pendant 30 minutes dans les chambres PMMA avant d’évaluer les seuils mécaniques de base et expérimentaux2.
- Placez le support de sol en maille à une hauteur confortable (sur une surface stable) afin que les animaux soient accessibles de tous les côtés. Assurez-vous que l’abdomen et les quatre pattes des souris sont facilement accessibles par les ouvertures du sol en maille.
- Couvrez la surface stable utilisée pour allouer les chambres avec un matériau absorbant pour absorber ou recueillir la miction et la défécation. Assurez-vous que les bras de l’enquêteur peuvent se déplacer librement sous les chambres lors de l’utilisation de l’appareil EvF.
4. Évaluation du seuil mécanique de base et réponse de la souris aux stimuli
- Pour les mesures de l’abdomen, divisez l’abdomen en trois parties virtuelles (zones crânienne, moyenne et caudale). Choisissez la zone crânienne (contenant anatomiquement le foie) comme tissu cible standard pour l’évaluation du seuil mécanique de l’allodynie viscérale. Pour les mesures de la patte, choisissez la bonne patte arrière pour la standardisation.
- Prenez une mesure de base de chaque souris 48 h avant l’infection. Pour ce faire, placez les souris dans les chambres de confinement, préparez l’appareil EvF et utilisez les deux mains pour soulever lentement la sonde afin de stimuler le tissu ciblé.
- Augmentez progressivement la pression sur les tissus jusqu’à ce que la souris exprime un comportement nociceptif. Pour l’évaluation de la patte arrière droite, recherchez la rétraction de la patte, le léchage de la patte ou le saut à quatre pattes2, 8, 9. Pour une évaluation viscérale, recherchez une rétraction brusque de l’abdomen, un léchage ou un grattage immédiat du site sondé ou un saut à quatre pattes 2,11.
- Enregistrez la valeur obtenue en transférant les données sur l’appareil électronique choisi contenant le programme EvF spécifique ou en l’écrivant dans un carnet de notes. Remettez l’affichage à zéro et répétez le processus quatre fois pour obtenir cinq mesures8.
REMARQUE : Ne considérez que trois mesures similaires pour estimer la valeur moyenne2 - Mesurer le seuil mécanique de la souris présente dans la chambre adjacente jusqu’à ce que chaque souris soit sondée cinq fois et qu’une valeur moyenne soit obtenue pour chaque animal.
- Répéter les mesures de référence 24 h plus tard et exclure les souris dont les valeurs moyennes sont inférieures à 3,00 g ou dont les différences entre les mesures basales sont supérieures à 2,00 g 2,8.
REMARQUE : Un seul tissu cible doit être choisi pour chaque souris dans chaque expérience afin que les animaux ne s’habituent pas à être sondés, car le nombre d’évaluations serait considérablement plus élevé dans un court laps de temps.
5. Évaluation expérimentale du seuil mécanique de la patte postérieure droite et de l’allodynie viscérale
- Évaluer la patte arrière droite ou le seuil mécanique de l’allodynie viscérale 1 h après l’infection pour l’évaluation du jour 0.
- Répétez la procédure toutes les 24 heures pendant 5 jours après l’infection.
REMARQUE : s’il y a un traitement à administrer, choisissez un moment approprié dans le plan d’expérience. - Remettez les souris dans leurs cages d’origine pour éviter que les animaux ne se battent les uns contre les autres, avec un accès à de la nourriture de laboratoire standard et de l’eau à volonté une fois les mesures terminées.
- Effectuez un test de normalité pour vérifier la distribution normale des données et une analyse statistique appropriée des données collectées.
6. Évaluation de l’échelle de grimace de la souris
- Assurez-vous que chaque souris est facilement visible à l’intérieur de la chambre de confinement et examinez chaque souris avant l’expérience pour vous assurer qu’il n’y a pas de lésions sur les membres, l’abdomen ou le visage et qu’il n’y a pas de changements de pelage.
- Observez la zone orbitale de la souris. Classer les yeux ouverts comme une absence de douleur (score 0) tandis qu’une douleur évidente peut être représentée lorsque la souris ferme les yeux (score 2).
- Observez le nez de la souris. Classez un nez normal comme l’absence de douleur tandis que la présence d’un renflement sur l’arête du nez représente une douleur évidente.
- Observez les joues de la souris. Classez des joues normales comme l’absence de douleur tandis que la présence d’un renflement sur les deux joues représente une douleur évidente.
- Observez la position des oreilles de la souris. Classez les oreilles arrondies comme l’absence de douleur tandis que les oreilles tournant vers l’extérieur ou vers l’arrière, loin du visage, dans une forme pointue, représentent une douleur évidente. L’espace entre les oreilles augmente avec le score de douleur.
- Observez les moustaches de la souris. Classez les moustaches avec leur courbe descendante naturelle comme l’absence de douleur, tandis que les moustaches qui sont soit tirées vers l’arrière contre la joue, soit tirées vers l’avant représentent une douleur évidente.
- Comme les comportements innés, tels que l’auto-toilettage, peuvent interférer avec l’expression faciale, ne considérez pas qu’il s’agit de comportements liés à la douleur8. Attendez que la souris arrête ce comportement avant chaque évaluation d’unité d’action.
- Effectuez un test de normalité pour vérifier la distribution normale des données et une analyse statistique appropriée des données collectées.
REMARQUE : À la fin de toutes les expériences, les souris ont été euthanasiées sans cruauté à l’aide de kétamine (90 mg/kg) et de xylazine (7,5 mg/kg), injectées par voie intrapéritonéale. Après avoir atteint un plan d’anesthésie profonde confirmé, ils ont été soumis à une luxation cervicale.
Résultats
Diminution du seuil mécanique due à l’infection à T. evansi évaluée par l’appareil électronique de von Frey sur la patte arrière droite et les tissus viscéraux
L’expérience a été menée sur 5 jours, selon les données précédentes relatives à l’échantillondisponible de T. evansi 2. Les souris infectées ont commencé à montrer une différence significative de seuil mécanique sur la patte arrière droite au jour 3 après l’infection et sont restées significativement plus faibles que le groupe témoin au cours des 2 jours suivant l’infection (figure 1A) par rapport aux souris non infectées. Des résultats similaires pour la sensibilité tactile abdominale ont montré une allodynie viscérale chez les souris infectées à partir du 3e jour après l’infection et restant significativement plus faible que dans le groupe témoin au cours des 2 jours suivant l’infection (Figure 1B).
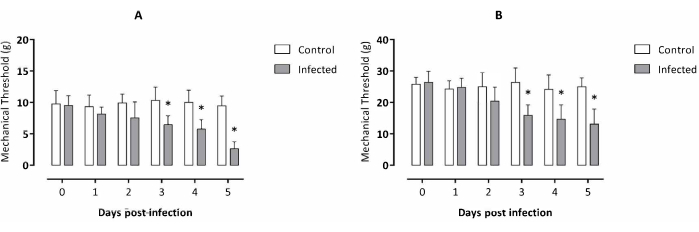
Figure 1 : Évaluation de l’allodynie chez des souris infectées expérimentalement par Trypanosoma evansi. (A) allodynie de la patte arrière droite et (B) allodynie viscérale. Données exprimées en moyenne ± ET de dix animaux pour chaque groupe expérimental. Analyse statistique : test t de l’élève, une analyse non appariée par point temporel. Les astérisques montrent des différences significatives entre les groupes expérimentaux considérant le même point temporel analysé (p < 0,05). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Induction des traits faciaux liés à la douleur chez la souris par l’infection à T. evansi et interprétation numérique par l’évaluation de la douleur sur l’échelle de grimace de la souris
Les souris infectées ont commencé à manifester des signes significatifs de traits faciaux liés à la douleur le 3e jour après l’infection, montrant un score moyen de 0,4 [0-1] au point temporel référé. La même tendance a été observée au cours de l’expérience, dans laquelle le groupe infecté a montré des différences significatives par rapport au groupe témoin, présentant des scores moyens de 0,6 [0-1] et 1,3 [0-2] pour les jours 4 et 5 après l’infection, respectivement. Le groupe témoin n’a pas obtenu de score sur l’échelle de grimace de souris, comme prévu. L’analyse statistique a été réalisée à l’aide du test t de Student, une analyse non appariée par point temporel, en considérant comme significative une valeur de p < 0,05. De plus, le coefficient de corrélation de Pearson (r) a permis d’identifier des modèles d’interaction entre l’évaluation de la douleur sur l’échelle de grimace de la souris et l’allodynie de la patte arrière droite ou entre la même échelle et l’allodynie viscérale, dont les valeurs étaient respectivement de -96,35 % et -84,08 %. De plus, les coefficients de détermination (R2) pour l’évaluation de la douleur sur l’échelle de grimace de la souris et l’allodynie de la patte arrière droite ou l’allodynie viscérale étaient respectivement de 0,9283 et 0,7070.
La présente étude est en accord avec les données précédentes, qui ont confirmé la présence d’inflammation et de douleur au cours de l’infection à T. evansi 2,3,7,12. De plus, la méthode décrite fournit une méthodologie précise pour identifier et mesurer l’allodynie et la douleur chez la souris. De plus, l’utilisation de l’évaluation de la douleur sur l’échelle de grimace de souris chez les souris infectées a indiqué un r négatif très élevé (90 à 100%) par rapport aux résultats exprimés par l’évaluation de l’allodynie de la patte arrière droite et un r négatif élevé (70 à 89%) pour l’évaluation de l’allodynie viscérale des animaux respectifs13. De même, l’utilisation de l’évaluation de la douleur sur l’échelle de grimace de souris chez les souris infectées a indiqué un R2 très fort (0,90 à 1,00) par rapport aux résultats exprimés par l’évaluation de l’allodynie de la patte arrière droite et un R2 fort (0,70 à 0,89) pour l’évaluation de l’allodynie viscérale des mêmes animaux14.
Discussion
Une étape critique dans les expériences impliquant des animaux infectés est le contrôle des niveaux de parasitémie. Différentes souches de T. evansi peuvent se comporter de manière divergente chez la souris, conduisant à des infections aiguës à des infections chroniques 2,4,5,6. De plus, les changements dans la dose d’infection peuvent diminuer ou prolonger la durée de survie des souris. Par conséquent, il est recommandé d’obtenir une courbe de survie avant les expériences pour déterminer la période correcte de l’expérience et éviter la frustration liée à des événements inattendus de mort de souris15,16. De plus, ces données peuvent déterminer les critères d’évaluation sans cruauté de l’expérience, le cas échéant.
De plus, le même isolat doit être utilisé pour infecter toutes les souris de l’expérience afin de respecter un nombre égal de passages sanguins, comme expliqué dans la section protocole. De la même manière, du sang cryoconservé ou du sang infecté frais peut être utilisé pour infecter les souris, car certains échantillons cryoconservés peuvent être inactivés après décongélation au bain-marie. Cependant, le sang infecté frais peut produire une parasitémie plus rapide et, par conséquent, des événements de décès plus précoces17,18.
Les modifications apportées à l’expérience, telles que l’ajout de médicaments trypanocides ou analgésiques, sont viables. De nouveaux groupes signifient plus d’animaux et il est important de se rappeler que même les groupes témoins pour les médicaments choisis doivent être soumis à des mesures de base. D’après notre expérience, environ 20 à 25 % des souris sont exclues de l’expérience après la deuxième mesure de base, ce qui est cohérent avec les données précédentes8. Cela signifie que le nombre initial d’animaux doit être supérieur au nombre d’animaux expérimentaux, ce qui peut être un problème lorsque davantage de groupes sont évalués et qu’un nombre plus élevé de souris est estimé.
La pharmacocinétique et la pharmacodynamie doivent être prises en compte pour ce modèle. Certains médicaments mettent de longues périodes à exercer leur action pharmacologique, ce qui peut avoir un impact sur la conception expérimentale d’un modèle où les souris meurent généralement en moyenne en 4 à 5 jours 2,6. De plus, si les animaux sont à jeun pour le traitement choisi, la période d’acclimatation peut être un facteur important à prendre en compte, car elle affectera à la fois la dynamique du médicament et le calendrier et la procédure expérimentaux, comme indiqué dans la section sur le protocole.
Une grande amélioration de la méthode actuelle est qu’un seul chercheur bien formé peut effectuer l’ensemble de la procédure de lecture de l’EvF (mesures de base et expérimentales) tout en restant aveugle à l’infection ou aux traitements. Un autre investigateur doit effectuer l’infection au début de l’expérience. Ce n’est pas nécessaire après la procédure d’infection, car l’appareil EvF dispose d’un programme de mesure Wi-Fi von Frey spécifique qui permet à une seule personne d’utiliser pleinement l’équipement. De plus, cette méthode est plus rapide que l’équipement Filament von Frey ordinaire et plus facile à réaliser 8,19.
Cependant, la fatigue peut être une complication, car le même chercheur doit effectuer toutes les lectures d’animaux et peut développer un épuisement dû au mouvement répétitif après un certain temps8. Compte tenu de l’espérance de survie des souris infectées par T. evansi, un nombre élevé de groupes dans le plan expérimental n’est pas encouragé. D’après notre expérience, une moyenne de 10 souris à la fois (selon le plan d’expérience) peut être mesurée en moins de 30 min. De plus, un seul tissu cible doit être choisi pour chaque souris dans chaque expérience afin que les animaux ne s’habituent pas à être sondés, comme expliqué dans la section du protocole, ce qui diminue également le risque de développement de fatigue par l’enquêteur.
De plus, les évaluations de l’EvF (mesures de la patte arrière droite et des viscérales) et de l’échelle de grimace de la souris nécessitent des chercheurs bien formés. Avant de réaliser les expériences, l’investigateur doit passer de longues périodes à s’exercer. Pour évaluer correctement les changements d’expression faciale chez la souris, le chercheur doit connaître non seulement les altérations attendues, mais aussi l’expression faciale normale d’une souris ordinaire et ses variations de normalité et de comportements10,20. De plus, pour évaluer correctement le seuil mécanique des souris à l’aide de l’appareil EvF, le chercheur doit répéter plusieurs mesures de base jusqu’à ce que la réponse de la souris aux stimuli de la sonde soit facilement reconnue et que la cohérence soit obtenue 2,8.
Les applications futures du protocole impliquent l’évaluation de l’allodynie et de la douleur, ainsi que son traitement, sur des souris infectées par T. evansi. Le modèle actuel permet aux chercheurs scientifiques d’évaluer la pathogenèse liée à la douleur d’une maladie que l’on trouve couramment chez le bétail, chez la souris, dans un environnement contrôlé en laboratoire.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Les auteurs remercient tout particulièrement l’Université d’État de Santa Catarina pour son soutien financier, le Laboratoire de pharmacologie pour les animaux et l’espace, et le Laboratoire de biochimie des hémoparasites et des vecteurs pour l’échantillon de sang cryoconservé infecté par T. evansi utilisé dans ces expériences.
matériels
| Name | Company | Catalog Number | Comments |
| 26 G 1/2" needle coupled to insulin syringe | TKL | 80288090100 | Used to infund solutions on laboratory animals |
| Accessories for von Frey analgesimeter | INSIGHT | EFF 303 | Containment box with support for digital analgesimeter assessment |
| D-(+)-Glucose | SIGMA-ALDRICH | G7021 | A monosaccharide which is the main source of energy in the form of ATP for living organisms |
| Digital analgesimeter | INSIGHT | von Frey Wi-Fi | The von Frey Wi-Fi is a portable device used to assess tissue sensitivity to mechanical stimuli |
| Gilson type 10 µL polypropylene tip | CRALPLAST | 18261 | Polypropylene to be used on eletronic von Frey apparatus, recommended for hind paw allodynia assessment |
| Laboratory water bath | BEING INSTRUMENT | BW-22P | Used to heat liquid and semi-solid substances contained in appropriate recipients to specific temperature |
| Phosphate buffered saline | SIGMA-ALDRICH | 806552 | A balanced salt solution buffer used for a variety of cell culture applications |
| Swiss mice (Mus musculus) from both gender | UFSC | Swiss Webster | Laboratory animals used for controlled experiments |
| Trypanosoma evansi cryiopreserved sample | UDESC | - | Sample used to infect all mice, ceded by the Hemoparasites and Vectors Biochemistry Laboratory |
| Universal type 10 µL polypropylene tip | CRALPLAST | 18171 | Polypropylene to be used on eletronic von Frey apparatus, recommended for visceral allodynia assessment |
Références
- Desquesnes, M., et al. Trypanosoma evansi and surra: a review and perspectives on origin, history, distribution, taxonomy, morphology, hosts, and pathogenic effects. BioMed Research International. 2013, 194176 (2013).
- Cipriani, D. S., et al. Experimental Trypanosoma evansi infection induces pain along with oxidative stress, prevented by COX-2 inhibition. Experimental Parasitology. 247, 108477 (2023).
- Paim, F. C., et al. Cytokines in rats experimentally infected with Trypanosoma evansi. Experimental Parasitology. 128 (4), 365-370 (2011).
- Gillingwater, K., et al. In vivo investigations of selected diamidine compounds against Trypanosoma evansi using a mouse model. Antimicrobial Agents and Chemotherapy. 53 (12), 5074-5079 (2009).
- Dkhil, M. A., et al. Treatment of Trypanosoma evansi-infected mice with Eucalyptus camaldulensis led to a change in brain response and spleen immunomodulation. Frontiers in Microbiology. 13, 833520 (2022).
- Dkhil, M. A., et al. Murine liver response to Allium sativum treatment during infection induced-trypanosomiasis. Saudi Journal of Biological Sciences. 28 (6), 3270-3274 (2021).
- Martins de Moraes, C., et al. Infection by Trypanosoma evansi in horses from Brazil. Revista Portuguesa de Ciências Veterinárias. 102 (561-562), 159-163 (2007).
- Martinov, T., et al. Measuring changes in tactile sensitivity in the hind paw of mice using an electronic von Frey apparatus. Journal of Visualized Experiments. 82, e51212 (2013).
- Rodríguez-Angulo, H., et al. Role of TNF in sickness behavior and allodynia during the acute phase of Chagas' disease. Experimental Parasitology. 134 (4), 422-429 (2013).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7, 447-449 (2010).
- Eijkelkamp, N., et al. Increased visceral sensitivity to capsaicin after DSS-induced colitis in mice: spinal cord c-Fos expression and behavior. American Journal of Physiology-Gastrointestinal and Liver Physiology. 293 (4), 749-757 (2007).
- Mekata, H., et al. Expression of regulatory dendritic cell-related cytokines in cattle experimentally infected with Trypanosoma evansi. Journal of Veterinary Medical Science. 77 (8), 1017-1019 (2015).
- Mukaka, M. M. Statistics corner: a guide to appropriate use of correlation coefficient in medical research. Malawi Medical Journal. 24 (3), 69-71 (2012).
- Schober, P., et al. Correlation coefficients: appropriate use and interpretation. Anesthesia and Analgesia. 126 (5), 1763-1768 (2018).
- Kamidi, C. M., et al. Differential virulence of camel Trypanosoma evansi isolates in mice. Parasitology. 145 (9), 1235-1242 (2018).
- Mekata, H., et al. Isolation, cloning, and pathologic analysis of Trypanosoma evansi field isolates. Parasitology Research. 112, 1513-1521 (2013).
- Silva, A. S., et al. Trypanosoma evansi pathogenicity strain in rats inoculated with parasite in fresh and cryopreserved blood. Ciência Rural. 39 (6), 1842-1846 (2009).
- Silva, A. S., et al. Acetylcholinesterase activity and lipid peroxidation in the brain and spinal cord of rats infected with Trypanosoma evansi. Veterinary Parasitology. 175, 237-244 (2011).
- Diógenes, A. K. L., et al. Concurrent validity of electronic von Frey as an assessment tool for burn associated pain. Burns. 46 (6), 1328-1336 (2020).
- Kalueff, A. V., et al. Neurobiology of rodent self-grooming and its value for translational neuroscience. Nature Reviews Neuroscience. 17, 45-59 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon