Method Article
فون فراي الإلكترونية المرتبطة بمقياس تجهم الفأر لتقييم الألم والألم في الفئران المصابة بالمثقبيات إيفانسي
In This Article
Summary
هنا ، نقدم بروتوكولا لتقييم nociception في الفئران المصابة بالمثقبية إيفانسي ، باستخدام جهاز فون فراي الإلكتروني كأداة ، وقياس العتبات الميكانيكية للمخلب الخلفي والأحشاء.
Abstract
لا يزال التسبب في الأمراض المعدية مجالا معقدا للدراسة. يمكن ملاحظة مسار العديد من العلامات السريرية ، مثل الألم الخيفي والألم ، في الأليفة. ومع ذلك ، فإن معرفة مساراتهم والعلاج الصحيح يحتاجون إلى تجارب خاضعة للرقابة ، وكثير منهم يستخدمون المختبر. يعد قياس التغيرات في العتبات الميكانيكية للمخلب الخلفي والأحشاء تقنية مفيدة لمراقبة التغيرات في إدراك الألم في القوارض. يمكن قياس استجابة الانسحاب أولا في اختبارات خط الأساس ، مما يخلق تحكما أفضل في المجموعات التجريبية. يمكن إجراء الاختبارات اللاحقة بعد إحداث العدوى وإضافة الأدوية إلى البروتوكول. يسمح استخدام جهاز فون فراي الإلكتروني المرتبط باستخدام مقياس الوجه لمراقبة التغيرات الشبيهة بالألم بإجراء تقييم بسيط ودقيق ومتسق لتقييم الألم الخيفي والألم في الفئران. وبالتالي ، فإن التجارب التي تستخدم المنهجية الحالية لعدوى المثقبية إيفانسي تمثل طريقة مفيدة لتقييم الألم الخيفي والألم في المصابة بالمختبر ، والتي يمكن تطبيقها على العلاج التقليدي لحيوانات الماشية.
Introduction
المثقبية إيفانسي هي العامل المسبب للمرض المسمى "سورا" أو "mal-das-cadeiras" في أمريكا الجنوبية 1,2. يصيب عادة الخيول والماشية ، ولكن أيضا البرية ، التي تنتقل عن طريق الخفافيش الدموية ، والتابانيدات ، ولدغات الذباب 1,3. السرة مرض رئيسي في الأليفة ، والذي يمكن أن يكون قاتلا في غياب العلاج الصحيح ، ويظهر علامات سريرية غير محددة مثل فقر الدم وفقدان الشهية والوزن وضعف العضلات والإجهاض ، والتي قد تختلف وفقا للمضيف والمنطقة الجغرافية2،4،5،6.
لا يزال التعبير عن الألم الخيفي والألم في المصابة أثناء المرض موضوعا جديدا 2,7. تعد الرغبة في فهم التسبب وراء هذه العلامات خطوة مهمة لتحسين وصقل العلاج المستخدم حاليا عن طريق إضافة أدوية مسكنة فعالة إلى بروتوكول المثقبيات الكلاسيكي 5,6. في هذا السيناريو ، تمثل إمكانية تكرار المرض باستخدام نموذج الفئران ميزة ، حيث يمكن الاحتفاظ بالفئران بسهولة في بيئات خاضعة للرقابة في المختبر ، وبالتالي ، تسفر عن نتائج أكثر اتساقا من التجارب الميدانية باستخدام الماشية.
عادة ما يتم الحصول على عتبة ميكانيكية باستخدام جهاز فون فراي الإلكتروني (EvF) لتقييم الألم الخيفي في عدد كبير من التجارب2،8،9. يستخدم هذا الجهاز لتقييم حساسية الأنسجة للتحفيز الميكانيكي: بمجرد أن يلمس الجهاز مخلب ، من خلال طرف 20-200 ميكرولتر متصل بالجهاز ، يتم تسجيل القوة التي يسحب بها المخلب.
عادة ما تستخدم القوارض كحيوانات قياسية في هذه التجارب ، ويتم استقراء معظم النتائج لأنواع أخرى ، حيث أن معظم الأمراض التي تم بحثها تأتي من أنواع أخرى يصعب فيها إجراء دراسة خاضعة للرقابة. علاوة على ذلك ، ترتبط آلام الظهر والألم ارتباطا وثيقا. يلعب استخدام مقياس وجه محدد لتقييم الألم في الفئران المصابة دورا مهما كمساعد مؤكد لتأكيد وجود الألم أثناء عدوى T. evansi 2,10.
في هذا البروتوكول ، نعرض نموذجا جديدا لتقييم الألم الخيفي والألم في الفئران المصابة تجريبيا ب T. evansi ، مما يدل على وجود علاقة عالية بين المتغيرات ، وبالتالي إثبات أنه نموذج قوي. علاوة على ذلك ، يتطلب الأمر عددا صغيرا من الباحثين لتنفيذ الإجراء بأكمله ، مما يقلل من فرصة التدخل البشري أثناء التجربة. كما أنه يمكن الباحث من تكرار المرض المستهدف خلال دورة حادة وإضافة العديد من الأدوية العلاجية المختلفة في التصميم التجريبي ، وبالتالي الحصول على نتائج متسقة في فترة قصيرة.
Protocol
أجريت جميع التجارب باستخدام إناث الفئران السويسرية البالغة من العمر 10 أسابيع (35-55 جم). تم إيواء في أقفاص بولي سلفون (3-5 لكل قفص) في غرفة ذات درجة حرارة مضبوطة (21 ± 1 درجة مئوية) ، ودورة مظلمة لمدة 12 ساعة / 12 ساعة مظلمة ، ومختبر قياسي وماء مخصص. تم تعيين عشرة لكل مجموعة في كل اختبار لإثبات الآثار المتسقة للعلاجات الدوائية. تم تقديم التصميم التجريبي والموافقة عليه من قبل لجنة الأخلاقيات بجامعة ولاية سانتا كاتارينا (CEUA) (رقم البروتوكول: 6019201123). امتثلت جميع التجارب على لإرشادات REACH (البحوث الحيوانية: الإبلاغ عن التجارب في الجسم الحي ) وتم إجراؤها وفقا لدليل المجلس القومي للبحوث لرعاية واستخدام المختبر.
1. تحضير المثقبيات إيفانسي وتلقيحها
تنبيه: ارتد معطف مختبر يمكن التخلص منه وقفازات وقناع وحماية للعين عند التعامل مع عينات الدم المصابة والكواشف والمركبات الكيميائية الأخرى.
- قم بتشغيل معدات الحمام المائي واضبطها عند درجة حرارة ثابتة تبلغ 37 درجة مئوية.
- خذ أنبوب طرد مركزي دقيق يحتوي على عينة الدم المحفوظة من الفريزر الفائق (-80 درجة مئوية). ضعه في حمام مائي حتى يذوب الدم.
ملاحظة: يجب استخدام نفس العزلة لإصابة جميع الفئران في كل مجموعة من التجارب المختلفة للحفاظ على عدد متساو من ممرات الدم. - استخدم محلول ملحي مخزن بالفوسفات (PBS ، 0.1 M) يحتوي على 60٪ D- (+) - جلوكوز (درجة الحموضة 7.4) لإجراء التخفيف التسلسلي (10: 1 v v) حتى يتم تحقيق 1 × 104 تريبانوزومات لكل 0.1 مل. حدد عدد الخلايا الطفيلية عن طريق عد الخلايا يدويا باستخدام غرفة نيوباور على مجهر بعدسة موضوعية 100x2.
- تلقيح 0.1 مل من محلول الدم المخفف (المجموعة المصابة) ، أو نفس الحجم في مركبة ملحية 0.9٪ (مجموعة التحكم) ، داخل الصفاق ، باستخدام إبرة 26 جم 1/2 بوصة مقترنة بحقنة الأنسولين.
2. إعداد وتشغيل جهاز فون فراي الإلكتروني
ملاحظة: كن حذرا حول كيفية تسجيل البيانات التي تم الحصول عليها. تحتوي بعض معدات EvF على برامج محددة لنقل البيانات التي تم الحصول عليها من الجهاز إلى أجهزة إلكترونية أخرى ، مثل أجهزة الكمبيوتر أو الأجهزة اللوحية أو الهواتف الذكية.
- قم بتشغيل جهاز EvF. تأكد من أن الجهاز مشحون جيدا قبل بدء التجربة ، ومراقبة مستوى البطارية المعروض على شاشة الجهاز وشحنه إذا لزم الأمر.
- قم بتوصيل جهاز EvF بالجهاز الإلكتروني المختار عبر Wi-Fi لنقل وحفظ البيانات التي تم الحصول عليها.
- أدخل طرف بولي بروبيلين سعة 10 ميكرولتر في مخروط جهاز EvF واضبط القراءة على صفر (0.00 جم) بالضغط على الزر الذي يحمل رمز مخلب.
- لاحظ أنه بمجرد فحص الأنسجة التي تم تقييمها ؛ يظهر الحد الأقصى للضغط المطبق على شاشة جهاز EvF. بعد ذلك ، قم بنقله إلى الجهاز الإلكتروني المختار عن طريق الضغط على الزر برمز هوائي للتسجيل الآمن.
- أعد تعيين القراءة إلى الصفر واستعد لإجراء قياس جديد بمجرد الضغط على الزر برمز المخلب مرة أخرى.
3. اعتبارات عامة لتقييم العتبة الميكانيكية
- قم بإجراء جميع التجارب في غرفة هادئة مع درجة حرارة مضبوطة عند 21 درجة مئوية ودورة ضوء 12 ساعة / 12 ساعة مظلمة ، وتأكد من احترام دورة الساعة البيولوجية للفأر من خلال إجراء جميع التقييمات في نفس الوقت من اليوم2.
- اطلب من نفس الشخص إجراء تقييمات العتبة الميكانيكية الأساسية والتجريبية لتقليل التحيز وضمان اتساق القياس ؛ تأكد من أن التجارب عمياء.
- ضع كل ماوس برفق داخل حجرة فردية مصنوعة من بولي ميثيل ميثاكريلات (PMMA) مع قمة مثقبة موضوعة على حامل أرضي شبكي 5 مم² 2,8.
- اسمح للفئران بالتأقلم لمدة 30 دقيقة في غرف PMMA قبل تقييم كل من العتبات الميكانيكية الأساسيةوالتجريبية 2.
- ضع حامل الأرضية الشبكي على ارتفاع مريح (على سطح ثابت) بحيث يمكن الوصول إلى من جميع الجوانب. تأكد من سهولة الوصول إلى البطن وجميع الكفوف الأربعة للفئران من خلال فتحات الأرضية الشبكية.
- قم بتغطية السطح الثابت المستخدم لتخصيص الغرف بمواد ماصة لامتصاص أو جمع التبول والتغوط. تأكد من أن أذرع المحقق يمكن أن تتحرك بحرية أسفل الغرف أثناء تشغيل جهاز EvF.
4. تقييم العتبة الميكانيكية الأساسية واستجابة الماوس للمنبهات
- لقياسات البطن ، قسم البطن إلى ثلاثة أجزاء افتراضية (مناطق الجمجمة والمتوسطة والذيلية). اختر منطقة الجمجمة (التي تحتوي على الكبد تشريحيا) كنسيج مستهدف قياسي لتقييم العتبة الميكانيكية للألم الخيفي الحشوي. لقياسات مخلب ، اختر مخلب الخلف المناسب للتوحيد.
- خذ قياسا أساسيا من كل فأر قبل 48 ساعة من الإصابة. للقيام بذلك ، ضع الفئران في الغرف المحتوية ، وقم بإعداد جهاز EvF ، واستخدم كلتا يديك لرفع المسبار ببطء لتحفيز الأنسجة المستهدفة.
- قم بزيادة الضغط تدريجيا على الأنسجة حتى يعبر الماوس عن سلوك مسبب للألم. لتقييم المخلب الخلفي الأيمن ، ابحث عن تراجع المخلب أو لعق المخلب أو القفز بأربعة مخالب2،8،9. للتقييم الحشوي ، ابحث عن تراجع حاد في البطن ، أو لعق أو خدش فوري للموقع الذي تم فحصه ، أو القفز بأربعة مخالب 2,11.
- حفظ القيمة التي تم الحصول عليها عن طريق نقل البيانات إلى الجهاز الإلكتروني المختار الذي يحتوي على برنامج EvF المحدد أو كتابتها في دفتر الدرجات. أعد ضبط الشاشة على الصفر وكرر العملية أربع مرات للحصول على خمسة قياسات8.
ملاحظة: ضع في اعتبارك ثلاثة قياسات متشابهة فقط لتقدير القيمة المتوسطة2 - قم بقياس العتبة الميكانيكية للفأر الموجود في الغرفة المجاورة حتى يتم فحص كل فأر خمس مرات ويتم الحصول على قيمة متوسطة لكل.
- كرر قياسات خط الأساس بعد 24 ساعة واستبعد الفئران ذات القيم المتوسطة أقل من 3.00 جم أو مع وجود اختلافات بين القياسات القاعدية أعلى من 2.00 جم 2,8.
ملاحظة: يجب اختيار نسيج مستهدف واحد فقط لكل فأر في كل تجربة حتى لا تعتاد على الفحص ، حيث سيكون عدد التقييمات أعلى بكثير في فترة قصيرة.
5. مخلب خلفي أيمن تجريبي وتقييم العتبة الميكانيكية للألم الحشوي
- قم بتقييم المخلب الخلفي الأيمن أو العتبة الميكانيكية الحشوية بعد 1 ساعة من الإصابة لتقييم اليوم 0.
- كرر الإجراء كل 24 ساعة على مدار 5 أيام بعد الإصابة.
ملاحظة: إذا كان هناك علاج يجب إعطاؤه ، فاختر نقطة زمنية مناسبة ضمن التصميم التجريبي. - أعد الفئران إلى أقفاصها الأصلية لمنع من قتال بعضها البعض ، مع إمكانية الوصول إلى المختبر القياسي والماء بعد الانتهاء من القياسات.
- قم بإجراء اختبار الحالة الطبيعية للتحقق من التوزيع الطبيعي للبيانات والمزيد من التحليل الإحصائي المناسب للبيانات التي تم جمعها.
6. تقييم مقياس كشر الماوس
- تأكد من رؤية كل فأر بسهولة أثناء وجوده داخل الغرفة المحتوية وفحص كل فأر قبل التجربة للتأكد من عدم وجود آفات على الأطراف أو البطن أو الوجه وعدم تغيير المعطف.
- مراقبة المنطقة المدارية للفأر. صنف العيون المفتوحة على أنها غياب الألم (الدرجة 0) بينما يمكن تمثيل الألم الواضح عندما يغلق الفأر عينيه (النتيجة 2).
- مراقبة أنف الفأر. صنف الأنف الطبيعي على أنه غياب الألم بينما يمثل وجود انتفاخ على جسر الأنف ألما واضحا.
- مراقبة الخدين الماوس. صنف الخدين الطبيعيين على أنه غياب الألم بينما يمثل وجود انتفاخ على كلا الخدين ألما واضحا.
- مراقبة موقف آذان الماوس. صنف الآذان المستديرة على أنها غياب الألم بينما تمثل الأذنان التي تدور للخارج أو للخلف ، بعيدا عن الوجه ، في شكل مدبب ، ألما واضحا. تزداد المسافة بين الأذنين مع درجة الألم.
- مراقبة شعيرات الماوس. صنف الشعيرات مع منحنى هبوطي طبيعي على أنها غياب الألم بينما الشعيرات التي يتم سحبها للخلف على الخد أو سحبها للأمام تمثل ألما واضحا.
- نظرا لأن السلوكيات الفطرية ، مثل الاستمالة الذاتية ، قد تتداخل مع تعبيرات الوجه ، فلا تعتبر هذه سلوكيات مرتبطة بالألم8. انتظر حتى يتوقف الماوس عن هذا السلوك قبل كل تقييم لوحدة الإجراءات.
- قم بإجراء اختبار الحالة الطبيعية للتحقق من التوزيع الطبيعي للبيانات والمزيد من التحليل الإحصائي المناسب للبيانات التي تم جمعها.
ملاحظة: في نهاية جميع التجارب ، تم القتل الرحيم للفئران بشكل إنساني باستخدام الكيتامين (90 مجم / كجم) والزيلازين (7.5 مجم / كجم) ، وتم حقنهم داخل الصفاق. بعد التوصل إلى خطة تخدير عميق مؤكدة ، تم تقديمهم لخلع عنق الرحم.
النتائج
انخفاض في العتبة الميكانيكية بسبب عدوى T. evansi كما تم تقييمها بواسطة جهاز فون فراي الإلكتروني على كل من المخلب الخلفي الأيمن والأنسجة الحشوية
أجريت التجربة على مدار 5 أيام ، وفقا للبيانات السابقة المتعلقةبعينة T. evansi 2 المتاحة. بدأت الفئران المصابة في إظهار اختلاف كبير في العتبة الميكانيكية على المخلب الخلفي الأيمن في اليوم 3 بعد الإصابة وظلت أقل بكثير من المجموعة الضابطة خلال اليومين التاليين بعد الإصابة (الشكل 1 أ) مقارنة بالفئران غير المصابة. أظهرت نتائج مماثلة لحساسية البطن عن طريق اللمس ألم خيفي حشوي في الفئران المصابة بدءا من اليوم 3 بعد الإصابة وتبقى أقل بكثير من المجموعة الضابطة خلال اليومين التاليين بعد الإصابة (الشكل 1 ب).
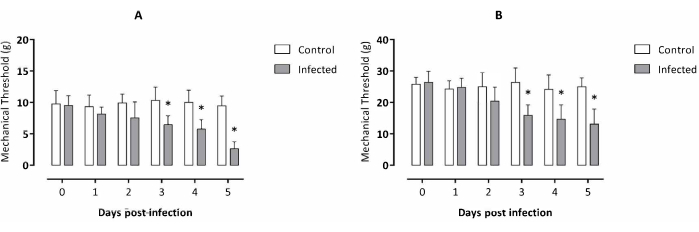
الشكل 1: تقييم الألودينيا للفئران المصابة تجريبيا بالمثقبية إيفانسي. (أ) آلام المخلب الخلفية اليمنى، (ب) الألم الخيفي الحشوي. البيانات معبرا عنها كمتوسط ± SD لعشرة لكل مجموعة تجريبية. التحليل الإحصائي: اختبار t للطالب ، تحليل واحد غير مزاوج لكل نقطة زمنية. تظهر العلامات النجمية اختلافات كبيرة بين المجموعات التجريبية مع الأخذ في الاعتبار نفس النقطة الزمنية التي تم تحليلها (p < 0.05). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تحريض ملامح الوجه المرتبطة بألم الفأر بواسطة عدوى T. evansi والتفسير العددي بواسطة تقييم الألم على مقياس تجهم الفأر
بدأت الفئران المصابة في إظهار علامات كبيرة على ملامح الوجه المرتبطة بالألم في اليوم الثالث بعد الإصابة ، حيث أظهرت متوسط درجة 0.4 [0-1] في النقطة الزمنية المشار إليها. لوحظ نفس الاتجاه خلال التجربة ، حيث أظهرت المجموعة المصابة اختلافات كبيرة عند مقارنتها بالمجموعة الضابطة ، حيث قدمت متوسط درجات 0.6 [0-1] و 1.3 [0-2] لليومين 4 و 5 بعد الإصابة ، على التوالي. لم تسجل المجموعة الضابطة على مقياس Mouse Grimace ، كما هو متوقع. تم إجراء التحليل الإحصائي باستخدام اختبار t للطالب ، وهو تحليل واحد غير مزاوج لكل نقطة زمنية ، مع الأخذ في الاعتبار قيمة p < 0.05. علاوة على ذلك ، حدد معامل ارتباط بيرسون (r) أنماط التفاعل بين تقييم الألم في مقياس تجهم الفأر وألم المخلب الخلفي الأيمن أو بين نفس المقياس والألم الخيفي الحشوي ، والتي كانت القيم -96.35٪ و -84.08٪ على التوالي. بالإضافة إلى ذلك ، كانت معاملات التحديد (R2) لتقييم ألم مقياس Mouse Grimace و allodynia الخلفي الأيمن أو allodynia الحشوية 0.9283 و 0.7070 ، على التوالي.
تتفق الدراسة الحالية مع البيانات السابقة ، التي أكدت وجود التهاب وألم خلال مسار عدوى T. evansi 2،3،7،12. علاوة على ذلك ، توفر الطريقة الموصوفة منهجية دقيقة لتحديد وقياس الألم والألم في الفئران. علاوة على ذلك ، أشار استخدام تقييم الألم بمقياس Mouse Grimace في الفئران المصابة إلى r سلبي مرتفع جدا (90 إلى 100٪) عند مقارنته بالنتائج التي عبر عنها تقييم آلام المخلب الخلفي الأيمن و r سلبي مرتفع (70 إلى 89٪) لتقييم الألم الحشوي للحيوانات المعنية13. وبالمثل ، أشار استخدام تقييم الألم بمقياس Mouse Grimace في الفئران المصابة إلى R2 قوي جدا (0.90 إلى 1.00) عند مقارنته بالنتائج التي عبر عنها تقييم ألم المخلب الخلفي الأيمن و R2 القوي (0.70 إلى 0.89) لتقييم الألم الحشوي لنفس14.
Discussion
خطوة حاسمة في التجارب التي تشمل المصابة هي السيطرة على مستويات الطفيليات. قد تتصرف سلالات مختلفة من T. evansi بطرق متباينة في الفئران ، مما يؤدي من الالتهابات الحادة إلى المزمنة2،4،5،6. علاوة على ذلك ، قد تؤدي التغييرات في جرعة العدوى إلى تقليل أو إطالة وقت بقاء الفئران. لذلك ، يوصى بالحصول على منحنى البقاء على قيد الحياة قبل التجارب لتحديد الفترة الصحيحة للتجربة ومنع الإحباط من أحداث موت الفأر غير المتوقعة15,16. بالإضافة إلى ذلك ، قد تحدد هذه البيانات نقاط نهاية إنسانية للتجربة ، إن أمكن.
بالإضافة إلى ذلك ، يجب استخدام نفس العزلة لإصابة جميع الفئران في التجربة لاحترام عدد متساو من ممرات الدم ، كما هو موضح في قسم البروتوكول. وبنفس الطريقة، يمكن استخدام الدم المصاب بالتبريد أو الدم الطازج المصاب لإصابة الفئران، حيث قد يتم تعطيل بعض العينات المحفوظة بالتبريد بعد إذابة الجليد في حمام مائي. ومع ذلك ، قد ينتج الدم المصاب الطازج طفيليات أسرع ، وبالتالي ، أحداث الوفاة المبكرة 17,18.
التعديلات في التجربة ، مثل إضافة أدوية المثقبيات أو المسكنات ، قابلة للتطبيق. المجموعات الجديدة تعني المزيد من ومن المهم أن نتذكر أنه حتى المجموعات الضابطة للأدوية المختارة يجب أن تخضع لقياسات خط الأساس. في تجربتنا ، يتم استبعاد ما يقرب من 20-25 ٪ من الفئران من التجربة بعد قياس خط الأساس الثاني ، وهو ما يتوافق مع البيانات السابقة8. وهذا يعني أن العدد الأولي للحيوانات يجب أن يكون أعلى من العدد التجريبي للحيوانات ، والذي يمكن أن يكون مشكلة عندما يتم تقييم المزيد من المجموعات وبالتالي تقدير عدد أكبر من الفئران.
يجب أن تؤخذ الحرائك الدوائية والديناميكا الدوائية في الاعتبار لهذا النموذج. تستغرق بعض الأدوية فترات طويلة لممارسة عملها الدوائي ، مما قد يؤثر على التصميم التجريبي لنموذج تموت فيه الفئران عادة في متوسط 4 إلى 5 أيام 2,6. بالإضافة إلى ذلك ، إذا كانت صائمة للعلاج المختار ، فقد تكون فترة التأقلم عاملا مهما يجب مراعاته ، لأنها ستؤثر على كل من ديناميكيات الدواء والجدول الزمني التجريبي والإجراءات ، كما ورد في قسم البروتوكول.
التحسن الكبير في الطريقة الحالية هو أن باحثا واحدا مدربا جيدا قد يقوم بإجراء قراءة EvF بالكامل (كل من القياسات الأساسية والتجريبية) بينما يظل أعمى عن العدوى أو العلاجات. يجب على محقق آخر إجراء العدوى في بداية التجربة. هذا ليس ضروريا بعد إجراء العدوى ، حيث يحتوي جهاز EvF على برنامج قياس von Frey Wi-Fi محدد يسمح لشخص واحد فقط بتشغيل الجهاز بالكامل. علاوة على ذلك ، هذه الطريقة أسرع من معدات Filament von Frey العادية وأسهل في الأداء 8,19.
ومع ذلك ، قد يكون التعب من المضاعفات ، حيث يجب على الباحث نفسه إجراء جميع قراءات وقد يصاب بالإرهاق بسبب الحركة المتكررة بعد مرور بعض الوقت8. مع الأخذ في الاعتبار توقعات البقاء على قيد الحياة للفئران المصابة ب T. evansi ، لا يتم تشجيع عدد كبير من المجموعات في التصميم التجريبي. في تجربتنا ، يمكن قياس ما معدله 10 فئران في المرة الواحدة (اعتمادا على التصميم التجريبي) في أقل من 30 دقيقة. علاوة على ذلك ، يجب اختيار نسيج مستهدف واحد فقط لكل فأر في كل تجربة حتى لا تعتاد على الفحص ، كما هو موضح في قسم البروتوكول ، مما يقلل أيضا من فرصة تطور التعب من قبل المحقق.
بالإضافة إلى ذلك ، تحتاج كل من تقييمات EvF (قياسات المخلب الخلفي الأيمن والحشوية) ومقياس تجهم الماوس إلى باحثين مدربين تدريبا جيدا. قبل إجراء التجارب ، يجب على المحقق قضاء فترات طويلة في الممارسة. لتقييم تغيرات تعبيرات الوجه في الفئران بشكل صحيح ، يجب على الباحث معرفة ليس فقط التعديلات المتوقعة ولكن أيضا تعبيرات الوجه الطبيعية للفأر العادي وتنوعاته في الحياة الطبيعية والسلوكيات10,20. علاوة على ذلك ، لتقييم العتبة الميكانيكية للفئران بشكل صحيح باستخدام جهاز EvF ، يجب على الباحث تكرار العديد من قياسات خط الأساس حتى يتم التعرف بسهولة على استجابة الماوس لمحفزات المسبار وتحقيقالاتساق 2,8.
تتضمن التطبيقات المستقبلية للبروتوكول تقييم الألم الخيفي والألم ، وكذلك علاجه ، على الفئران المصابة ب T. evansi. يمكن النموذج الحالي الباحثين العلميين من تقييم التسبب في الألم لمرض شائع في الماشية ، في الفئران في بيئة خاضعة للرقابة في المختبر.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
يقدم المؤلفون شكر خاص لجامعة ولاية سانتا كاتارينا على الدعم المالي ، وإلى مختبر علم الأدوية للحيوانات والفضاء ، وإلى مختبر الكيمياء الحيوية للطفيليات الدموية والنواقل على عينة الدم المحفوظة بالتبريد المصابة ب T. evansi المستخدمة في هذه التجارب.
Materials
| Name | Company | Catalog Number | Comments |
| 26 G 1/2" needle coupled to insulin syringe | TKL | 80288090100 | Used to infund solutions on laboratory animals |
| Accessories for von Frey analgesimeter | INSIGHT | EFF 303 | Containment box with support for digital analgesimeter assessment |
| D-(+)-Glucose | SIGMA-ALDRICH | G7021 | A monosaccharide which is the main source of energy in the form of ATP for living organisms |
| Digital analgesimeter | INSIGHT | von Frey Wi-Fi | The von Frey Wi-Fi is a portable device used to assess tissue sensitivity to mechanical stimuli |
| Gilson type 10 µL polypropylene tip | CRALPLAST | 18261 | Polypropylene to be used on eletronic von Frey apparatus, recommended for hind paw allodynia assessment |
| Laboratory water bath | BEING INSTRUMENT | BW-22P | Used to heat liquid and semi-solid substances contained in appropriate recipients to specific temperature |
| Phosphate buffered saline | SIGMA-ALDRICH | 806552 | A balanced salt solution buffer used for a variety of cell culture applications |
| Swiss mice (Mus musculus) from both gender | UFSC | Swiss Webster | Laboratory animals used for controlled experiments |
| Trypanosoma evansi cryiopreserved sample | UDESC | - | Sample used to infect all mice, ceded by the Hemoparasites and Vectors Biochemistry Laboratory |
| Universal type 10 µL polypropylene tip | CRALPLAST | 18171 | Polypropylene to be used on eletronic von Frey apparatus, recommended for visceral allodynia assessment |
References
- Desquesnes, M., et al. Trypanosoma evansi and surra: a review and perspectives on origin, history, distribution, taxonomy, morphology, hosts, and pathogenic effects. BioMed Research International. 2013, 194176 (2013).
- Cipriani, D. S., et al. Experimental Trypanosoma evansi infection induces pain along with oxidative stress, prevented by COX-2 inhibition. Experimental Parasitology. 247, 108477 (2023).
- Paim, F. C., et al. Cytokines in rats experimentally infected with Trypanosoma evansi. Experimental Parasitology. 128 (4), 365-370 (2011).
- Gillingwater, K., et al. In vivo investigations of selected diamidine compounds against Trypanosoma evansi using a mouse model. Antimicrobial Agents and Chemotherapy. 53 (12), 5074-5079 (2009).
- Dkhil, M. A., et al. Treatment of Trypanosoma evansi-infected mice with Eucalyptus camaldulensis led to a change in brain response and spleen immunomodulation. Frontiers in Microbiology. 13, 833520 (2022).
- Dkhil, M. A., et al. Murine liver response to Allium sativum treatment during infection induced-trypanosomiasis. Saudi Journal of Biological Sciences. 28 (6), 3270-3274 (2021).
- Martins de Moraes, C., et al. Infection by Trypanosoma evansi in horses from Brazil. Revista Portuguesa de Ciências Veterinárias. 102 (561-562), 159-163 (2007).
- Martinov, T., et al. Measuring changes in tactile sensitivity in the hind paw of mice using an electronic von Frey apparatus. Journal of Visualized Experiments. 82, e51212 (2013).
- Rodríguez-Angulo, H., et al. Role of TNF in sickness behavior and allodynia during the acute phase of Chagas' disease. Experimental Parasitology. 134 (4), 422-429 (2013).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7, 447-449 (2010).
- Eijkelkamp, N., et al. Increased visceral sensitivity to capsaicin after DSS-induced colitis in mice: spinal cord c-Fos expression and behavior. American Journal of Physiology-Gastrointestinal and Liver Physiology. 293 (4), 749-757 (2007).
- Mekata, H., et al. Expression of regulatory dendritic cell-related cytokines in cattle experimentally infected with Trypanosoma evansi. Journal of Veterinary Medical Science. 77 (8), 1017-1019 (2015).
- Mukaka, M. M. Statistics corner: a guide to appropriate use of correlation coefficient in medical research. Malawi Medical Journal. 24 (3), 69-71 (2012).
- Schober, P., et al. Correlation coefficients: appropriate use and interpretation. Anesthesia and Analgesia. 126 (5), 1763-1768 (2018).
- Kamidi, C. M., et al. Differential virulence of camel Trypanosoma evansi isolates in mice. Parasitology. 145 (9), 1235-1242 (2018).
- Mekata, H., et al. Isolation, cloning, and pathologic analysis of Trypanosoma evansi field isolates. Parasitology Research. 112, 1513-1521 (2013).
- Silva, A. S., et al. Trypanosoma evansi pathogenicity strain in rats inoculated with parasite in fresh and cryopreserved blood. Ciência Rural. 39 (6), 1842-1846 (2009).
- Silva, A. S., et al. Acetylcholinesterase activity and lipid peroxidation in the brain and spinal cord of rats infected with Trypanosoma evansi. Veterinary Parasitology. 175, 237-244 (2011).
- Diógenes, A. K. L., et al. Concurrent validity of electronic von Frey as an assessment tool for burn associated pain. Burns. 46 (6), 1328-1336 (2020).
- Kalueff, A. V., et al. Neurobiology of rodent self-grooming and its value for translational neuroscience. Nature Reviews Neuroscience. 17, 45-59 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved