Method Article
Von Frey electrónico asociado con la escala de muecas de ratón para evaluar la alodinia y el dolor en ratones infectados con Trypanosoma evansi
En este artículo
Resumen
En este trabajo se presenta un protocolo para evaluar la nocicepción en ratones infectados con Trypanosoma evansi, utilizando como herramienta el aparato electrónico de von Frey, midiendo umbrales mecánicos de la pata trasera y vísceras.
Resumen
La patogénesis de las enfermedades infecciosas sigue siendo un campo complejo de estudiar. En los animales domésticos puede observarse el curso de varios signos clínicos, como alodinia y dolor. Sin embargo, el conocimiento de sus vías y el tratamiento correcto requieren experimentos controlados, muchos de ellos con animales de laboratorio. La medición de los cambios en los umbrales mecánicos de la pata trasera y las vísceras es una técnica útil para observar los cambios en la percepción del dolor en roedores. La respuesta de retirada se puede medir primero en las pruebas de referencia, lo que crea un mejor control de los grupos experimentales. Las pruebas posteriores se pueden realizar después de inducir la infección y agregar medicamentos al protocolo. El uso de un aparato electrónico de von Frey asociado con el uso de una escala facial para observar cambios similares al dolor permite una evaluación simple, precisa y consistente para evaluar la alodinia y el dolor en ratones. Por lo tanto, los experimentos que utilizan la metodología actual para la infección por Trypanosoma evansi representan un método útil para evaluar la alodinia y el dolor en animales infectados de laboratorio, que se puede aplicar al tratamiento convencional para animales de ganado.
Introducción
El Trypanosoma evansi es el agente etiológico de la enfermedad denominada "surra" o "mal-das-cadeiras" en América del Sur 1,2. Afecta comúnmente a equinos y ganado, pero también a la fauna silvestre, siendo transmitida por picaduras de moscas de murciélagos hematófagos, tabánidos y estomoscas 1,3. La surra es una enfermedad importante en los animales domésticos, que puede ser mortal en ausencia del tratamiento correcto, presentando signos clínicos inespecíficos como anemia, pérdida de apetito y peso, debilidad muscular y aborto, que pueden variar según el huésped y la región geográfica 2,4,5,6.
La expresión de alodinia y dolor en animales infectados durante el curso de la enfermedad es todavía un tema nuevo 2,7. La necesidad de comprender la patogenia detrás de estos signos es un paso importante para mejorar y perfeccionar el tratamiento actualmente utilizado, mediante la adición de fármacos analgésicos eficaces al protocolo clásico de tripanocidas 5,6. En este escenario, la posibilidad de replicar la enfermedad utilizando un modelo murino representa una ventaja, ya que los ratones se pueden mantener fácilmente en ambientes controlados en el laboratorio y, por lo tanto, arrojar resultados más consistentes que los experimentos de campo con ganado.
Un umbral mecánico se obtiene comúnmente utilizando un aparato electrónico de von Frey (EvF) para la evaluación de la alodinia en un gran número de experimentos 2,8,9. Este dispositivo se utiliza para evaluar la sensibilidad de los tejidos a la estimulación mecánica: una vez que el aparato toca la pata del animal, a través de una punta de 20-200 μL unida al dispositivo, se registra la fuerza con la que el animal retira la pata.
Los roedores se utilizan generalmente como animales estándar en estos experimentos, y la mayoría de los resultados se extrapolan a otras especies, ya que la mayoría de las enfermedades investigadas provienen de otras especies en las que sería difícil realizar un estudio controlado. Además, la alodinia y el dolor están íntimamente relacionados. El uso de una escala facial específica para evaluar el dolor en ratones infectados juega un papel importante como coadyuvante confirmador para afirmar la presencia de dolor durante el curso de la infección por T. evansi 2,10.
En este protocolo, demostramos un modelo novedoso para evaluar la alodinia y el dolor en ratones infectados experimentalmente con T. evansi, mostrando una alta correlación entre variables, demostrando así ser un modelo fuerte. Además, requiere un pequeño número de investigadores para llevar a cabo todo el procedimiento, lo que disminuye la posibilidad de interferencia humana durante el experimento. También permite al investigador replicar la enfermedad objetivo durante un curso agudo y añadir varios fármacos de tratamiento diferentes en el diseño experimental, obteniendo así resultados consistentes en un corto período de tiempo.
Protocolo
Todos los experimentos se realizaron con ratones suizos hembras adultas de 10 semanas de edad (35-55 g). Los animales se alojaron en jaulas de polisulfona (3-5 animales por jaula) en una sala con temperatura controlada (21 ± 1 °C), ciclo de 12 h de luz/12 h de oscuridad, y comida de laboratorio estándar y agua ad libitum. Se asignaron diez animales a cada grupo en cada prueba para demostrar los efectos consistentes de los tratamientos farmacológicos. El diseño experimental fue presentado y aprobado por el Comité de Ética de la Universidad Estadual de Santa Catarina (CEUA) (número de protocolo: 6019201123). Todos los experimentos con animales cumplieron con las directrices ARRIVE (Animal Research: Reporting of in vivo Experiments) y se llevaron a cabo de acuerdo con la Guía del Consejo Nacional de Investigación para el Cuidado y Uso de Animales de Laboratorio.
1. Preparación e inoculación de Trypanosoma evansi
PRECAUCIÓN: Use una bata de laboratorio desechable, guantes, mascarilla y protección para los ojos cuando manipule muestras de sangre infectadas, reactivos y otros compuestos químicos.
- Encienda el equipo de baño de agua y ajústelo a una temperatura constante de 37 °C.
- Retire del ultracongelador (-80 °C) un tubo de microcentrífuga que contiene la muestra de sangre conservada. Colócalo en el baño maría hasta que la sangre se descongele.
NOTA: Se debe usar el mismo aislado para infectar a todos los ratones en cada grupo de experimentos diferentes para mantener un número igual de conductos sanguíneos. - Utilice solución salina tamponada con fosfato (PBS, 0,1 M) que contenga un 60% de D-(+)-glucosa (pH 7,4) para realizar una dilución en serie (10:1 v v) hasta conseguir 1 × 104 tripanosomas por 0,1 mL. Determine el número de células del parásito mediante el recuento manual de células utilizando una cámara de Neubauer en un microscopio con una lente de objetivo de 100x2.
- Inocular 0,1 mL de la solución sanguínea diluida (grupo infectado), o el mismo volumen en un vehículo de solución salina al 0,9% (grupo control), por vía intraperitoneal, utilizando una aguja de 26 G 1/2" acoplada a una jeringa de insulina.
2. Configuración y operación del aparato electrónico von Frey
NOTA: Tenga cuidado con la forma en que se registran los datos obtenidos. Algunos equipos EvF tienen programas específicos para transferir los datos obtenidos del aparato a otros dispositivos electrónicos, como computadoras, tabletas o teléfonos inteligentes.
- Encienda el aparato EvF. Asegúrese de que el equipo esté bien cargado antes de comenzar el experimento, observando el nivel de batería que se muestra en la pantalla del equipo y cargándolo si es necesario.
- Conecte el aparato EvF al dispositivo electrónico elegido a través de Wi-Fi para transferir y guardar los datos obtenidos.
- Inserte una punta de polipropileno de 10 μL en el cono del aparato EvF y ajuste la lectura a cero (0,00 g) presionando el botón con el símbolo de la pata.
- Obsérvese que una vez que se sondea el tejido evaluado; la presión máxima aplicada se muestra en la pantalla del aparato EvF. Después de eso, transfiéralo al dispositivo electrónico elegido presionando el botón con un símbolo de antena para una grabación segura.
- Restablezca la lectura a cero y prepárese para tomar una nueva medición simplemente presionando el botón con el símbolo de la pata nuevamente.
3. Consideraciones generales para las evaluaciones de umbrales mecánicos
- Realice todos los experimentos en una habitación tranquila con temperatura controlada a 21 °C y un ciclo de 12 h de luz/12 h de oscuridad, y asegúrese de respetar el ciclo circadiano del ratón realizando todas las evaluaciones a la misma hora del día2.
- Hacer que la misma persona realice evaluaciones de umbral mecánico de referencia y experimentales para reducir el sesgo y garantizar la consistencia de la medición; Asegúrate de que los experimentos estén ciegos.
- Coloque cada ratón suavemente dentro de una cámara individual hecha de polimetacrilato de metilo (PMMA) con una parte superior perforada colocada sobre un soporte de suelo de malla de 5 mm² 2,8.
- Permita que los ratones se aclimaten durante 30 minutos en las cámaras de PMMA antes deevaluar los umbrales mecánicos basales y experimentales.
- Coloque el soporte de piso de malla a una altura cómoda (sobre una superficie firme) para que los animales sean accesibles desde todos los lados. Asegúrese de que el abdomen y las cuatro patas de los ratones sean fácilmente accesibles a través de las aberturas del piso de malla.
- Cubra la superficie firme utilizada para asignar las cámaras con material absorbente para absorber o recoger la micción y la defecación. Asegúrese de que los brazos del investigador puedan moverse libremente por debajo de las cámaras mientras opera el aparato EvF.
4. Evaluación del umbral mecánico basal y respuesta del ratón a los estímulos
- Para las mediciones del abdomen, divida el abdomen en tres partes virtuales (áreas craneal, media y caudal). Elija el área craneal (que contiene anatómicamente el hígado) como tejido objetivo estándar para la evaluación del umbral mecánico de la alodinia visceral. Para las medidas de las patas, elija la pata trasera correcta para la estandarización.
- Tome una medición de referencia de cada ratón 48 horas antes de la infección. Para hacerlo, coloque los ratones en las cámaras de contención, prepare el aparato EvF y use ambas manos para levantar la sonda lentamente para estimular el tejido objetivo.
- Aumente gradualmente la presión sobre el tejido hasta que el ratón exprese un comportamiento nociceptivo. Para la evaluación de la pata trasera derecha, busque la retracción de la pata, el lamido de la pata o el salto de cuatro patas 2,8,9. Para la evaluación visceral, busque una retracción brusca del abdomen, lamido o rascado inmediato del sitio sondeado, o salto de cuatro patas 2,11.
- Guarde el valor obtenido transfiriendo los datos al dispositivo electrónico elegido que contenga el programa EvF específico o escribiéndolo en un libro de calificaciones. Restablezca la pantalla a cero y repita el proceso cuatro veces para obtener cinco mediciones8.
NOTA: Considere solo tres mediciones similares para estimar el valor medio2 - Mida el umbral mecánico del ratón presente en la cámara adyacente hasta que cada ratón sea sondeado cinco veces y se obtenga un valor medio para cada animal.
- Repetir las mediciones basales 24 h más tarde y excluir ratones con valores medios inferiores a 3,00 g o con diferencias entre las mediciones basales superiores a 2,00 g 2,8.
NOTA: Solo se debe elegir un tejido objetivo para cada ratón en cada experimento para que los animales no se acostumbren a ser sondeados, ya que el número de evaluaciones sería considerablemente mayor en un corto período de tiempo.
5. Evaluación experimental del umbral mecánico de la pata trasera derecha y la alodinia visceral
- Evaluar la pata trasera derecha o el umbral mecánico de alodinia visceral 1 h después de la infección para la evaluación del día 0.
- Repita el procedimiento cada 24 horas durante 5 días después de la infección.
NOTA: si hay un tratamiento a administrar, elija un punto de tiempo apropiado dentro del diseño experimental. - Regrese los ratones a sus jaulas originales para evitar que los animales peleen entre sí, con acceso a comida de laboratorio estándar y agua ad libitum después de que se completen las mediciones.
- Realizar una prueba de normalidad para comprobar la distribución normal de los datos y un análisis estadístico adecuado de los datos recogidos.
6. Evaluación de la escala de mueca del ratón
- Asegúrese de que cada ratón se vea fácilmente mientras está dentro de la cámara de contención y examine cada ratón antes del experimento para asegurarse de que no haya lesiones en las extremidades, el abdomen o la cara y que no haya cambios de pelaje.
- Observe el área orbital del ratón. Clasificar los ojos abiertos como ausencia de dolor (puntuación 0), mientras que un dolor evidente puede representarse cuando el ratón cierra los ojos (puntuación 2).
- Observa la nariz del ratón. Clasifique una nariz normal como la ausencia de dolor, mientras que la presencia de una protuberancia en el puente de la nariz representa un dolor evidente.
- Observa las mejillas del ratón. Clasifique las mejillas normales como la ausencia de dolor, mientras que la presencia de un bulto en ambas mejillas representa un dolor evidente.
- Observa la posición de las orejas del ratón. Clasifique las orejas redondeadas como la ausencia de dolor, mientras que las orejas que giran hacia afuera o hacia atrás, lejos de la cara, en forma puntiaguda, representan un dolor evidente. El espacio entre las orejas aumenta con la puntuación de dolor.
- Observa los bigotes del ratón. Clasifique los bigotes con su curva natural hacia abajo como la ausencia de dolor, mientras que los bigotes que se tiran hacia atrás contra la mejilla o hacia adelante representan un dolor obvio.
- Dado que las conductas innatas, como el autoaseo, pueden interferir con la expresión facial, no considere que estas son conductas relacionadas con el dolor8. Espere a que el mouse detenga este comportamiento antes de cada evaluación de la unidad de acción.
- Realizar una prueba de normalidad para comprobar la distribución normal de los datos y un análisis estadístico adecuado de los datos recogidos.
NOTA: Al final de todos los experimentos, los ratones fueron sacrificados humanamente usando ketamina (90 mg/kg) y xilacina (7,5 mg/kg), inyectados por vía intraperitoneal. Después de llegar a un plan de anestesia profunda confirmado, fueron sometidos a luxación cervical.
Resultados
Disminución del umbral mecánico debido a la infección por T. evansi evaluada por el aparato electrónico de von Frey tanto en la pata trasera derecha como en los tejidos viscerales
El experimento se llevó a cabo durante 5 días, de acuerdo con los datos previos relacionados con la muestra disponible de T. evansi 2. Los ratones infectados comenzaron a mostrar una diferencia significativa en el umbral mecánico en la pata trasera derecha el día 3 después de la infección y permanecieron significativamente más bajos que el grupo de control durante los siguientes 2 días después de la infección (Figura 1A) en comparación con los ratones no infectados. Resultados similares para la sensibilidad táctil abdominal mostraron alodinia visceral en ratones infectados a partir del día 3 después de la infección y permaneciendo significativamente más baja que el grupo de control durante los siguientes 2 días después de la infección (Figura 1B).
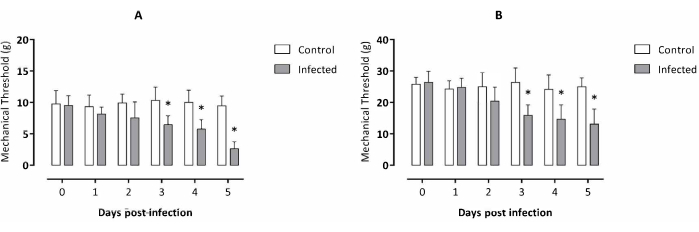
Figura 1: Evaluación de la alodinia de ratones infectados experimentalmente por Trypanosoma evansi. (A) Alodinia de la pata trasera derecha y (B) alodinia visceral. Los datos se expresan como la media ± DE de diez animales para cada grupo experimental. Análisis estadístico: prueba t de Student, un análisis no pareado por punto de tiempo. Los asteriscos muestran diferencias significativas entre los grupos experimentales considerando el mismo punto de tiempo analizado (p < 0,05). Haga clic aquí para ver una versión más grande de esta figura.
Inducción de rasgos faciales relacionados con el dolor en ratones por infección por T. evansi e interpretación numérica mediante la evaluación del dolor en la escala de muecas de ratón
Los ratones infectados comenzaron a manifestar signos significativos de rasgos faciales relacionados con el dolor el día 3 después de la infección, mostrando una puntuación media de 0,4 [0-1] en el punto de tiempo referido. La misma tendencia se observó durante el experimento, en el que el grupo infectado mostró diferencias significativas en comparación con el grupo control, presentando puntuaciones medias de 0,6 [0-1] y 1,3 [0-2] para los días 4 y 5 post infección, respectivamente. El grupo de control no puntuó en la Escala de Muecas del Ratón, como se esperaba. El análisis estadístico se realizó mediante la prueba t de Student, un análisis no pareado por punto de tiempo, considerando como significativo un valor de p < 0,05. Además, el coeficiente de correlación de Pearson (r) identificó patrones de interacción entre la evaluación del dolor de la Escala de Muecas de Ratón y la alodinia de la pata trasera derecha o entre la misma escala y la alodinia visceral, cuyos valores fueron de -96,35% y -84,08%, respectivamente. Además, los coeficientes de determinación (R2) para la evaluación del dolor en la Escala de Muecas de Ratón y la alodinia de la pata trasera derecha o la alodinia visceral fueron de 0,9283 y 0,7070, respectivamente.
El presente estudio concuerda con datos anteriores, que confirmaron la presencia de inflamación y dolor a lo largo del curso de la infección por T. evansi 2,3,7,12. Además, el método descrito proporciona una metodología precisa para identificar y medir la alodinia y el dolor en ratones. Además, el uso de la evaluación del dolor de la Escala de Muecas de Ratón en ratones infectados indicó un r negativo muy alto (90 a 100%) en comparación con los resultados expresados por la evaluación de la alodinia de la pata trasera derecha y un r negativo alto (70 a 89%) para la evaluación de la alodinia visceral de los respectivos animales13. De manera similar, el uso de la evaluación del dolor de la Escala de Muecas de Ratón en ratones infectados indicó un R2 muy fuerte (0,90 a 1,00) en comparación con los resultados expresados por la evaluación de alodinia de la pata trasera derecha y un R2 fuerte (0,70 a 0,89) para la evaluación de la alodinia visceral de los mismos animales14.
Discusión
Un paso crítico en los experimentos con animales infectados es el control de los niveles de parasitemia. Diferentes cepas de T. evansi pueden comportarse de manera divergente en ratones, lo que lleva a infecciones agudas a crónicas 2,4,5,6. Además, los cambios en la dosis de infección pueden disminuir o prolongar el tiempo de supervivencia de los ratones. Por lo tanto, se recomienda obtener una curva de supervivencia antes de los experimentos para determinar el período correcto del experimento y prevenir la frustración con eventos inesperados de muerte de ratones15,16. Además, estos datos pueden determinar criterios de valoración humanitarios para el experimento, si corresponde.
Además, se debe utilizar el mismo aislado para infectar a todos los ratones del experimento para respetar un número igual de fosas hematológicas, tal y como se explica en el apartado de protocolo. De la misma manera, se puede utilizar sangre criopreservada o fresca infectada para infectar a los ratones, ya que algunas muestras criopreservadas pueden inactivarse después de descongelarlas en un baño de agua. Sin embargo, la sangre fresca infectada puede producir parasitemia más rápida y, por lo tanto, eventos de muerte más tempranos17,18.
Las modificaciones en el experimento, como la adición de fármacos tripanocidas o analgésicos, son viables. Nuevos grupos significan más animales y es importante recordar que incluso los grupos de control para los medicamentos elegidos deben someterse a mediciones de referencia. En nuestra experiencia, aproximadamente el 20-25% de los ratones son excluidos del experimento después de la segunda medición de referencia, lo que es consistente con los datos anteriores8. Esto significa que el número inicial de animales debe ser mayor que el número experimental de animales, lo que puede ser un problema cuando se evalúan más grupos y, en consecuencia, se estima un número mayor de ratones.
La farmacocinética y la farmacodinamia deben tenerse en cuenta para este modelo. Algunos fármacos tardan mucho tiempo en ejercer su acción farmacológica, lo que puede afectar el diseño experimental de un modelo en el que los ratones suelen morir en una media de 4 a 5 días 2,6. Además, si los animales están en ayunas para el tratamiento elegido, el período de aclimatación puede ser un factor importante a considerar, ya que afectará tanto a la dinámica del fármaco como al programa y procedimiento experimental, como se informó en la sección de protocolo.
Una gran mejora en el método actual es que un solo investigador bien entrenado puede realizar todo el procedimiento de lectura de la EvF (tanto las mediciones basales como las experimentales) mientras permanece ciego a la infección o a los tratamientos. Otro investigador debe realizar la infección al comienzo del experimento. Esto no es necesario después del procedimiento de infección, ya que el aparato EvF tiene un programa específico de medición de Wi-Fi de von Frey que permite que solo una persona opere completamente el equipo. Además, este método es más rápido que el equipo ordinario de filamento von Frey y más fácil de realizar 8,19.
Sin embargo, la fatiga puede ser una complicación, ya que el mismo investigador debe realizar todas las lecturas de los animales y puede desarrollar agotamiento debido al movimiento repetitivo después de algún tiempo8. Teniendo en cuenta las expectativas de supervivencia de los ratones infectados por T. evansi, no se recomienda un alto número de grupos en el diseño experimental. En nuestra experiencia, se puede medir un promedio de 10 ratones a la vez (dependiendo del diseño experimental) en menos de 30 minutos. Además, solo se debe elegir un tejido objetivo para cada ratón en cada experimento para que los animales no se acostumbren a ser sondeados, como se explica en la sección de protocolo, lo que también disminuye la posibilidad de desarrollo de fatiga por parte del investigador.
Además, tanto las evaluaciones de la EvF (pata trasera derecha y mediciones viscerales) como las de la escala de muecas de ratón necesitan investigadores bien capacitados. Antes de realizar los experimentos, el investigador debe pasar largos períodos practicando. Para evaluar correctamente los cambios en la expresión facial en ratones, el investigador debe conocer no solo las alteraciones esperadas, sino también la expresión facial normal de un ratón ordinario y sus variaciones de normalidad y comportamientos 10,20. Además, para evaluar correctamente el umbral mecánico de los ratones utilizando el aparato EvF, el investigador debe repetir varias mediciones de referencia hasta que la respuesta del ratón a los estímulos de la sonda sea fácilmente reconocida y se logre la consistencia 2,8.
Las aplicaciones futuras del protocolo implican la evaluación de la alodinia y el dolor, así como su tratamiento, en ratones infectados por T. evansi. El presente modelo permite a los investigadores científicos evaluar la patogénesis relacionada con el dolor de una enfermedad que se encuentra comúnmente en el ganado, en ratones, en un ambiente controlado en el laboratorio.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Los autores agradecen especialmente a la Universidad Estadual de Santa Catarina por el apoyo financiero, al Laboratorio de Farmacología por los animales y el espacio, y al Laboratorio de Bioquímica de Hemoparásitos y Vectores por la muestra de sangre criopreservada infectada con T. evansi utilizada en estos experimentos.
Materiales
| Name | Company | Catalog Number | Comments |
| 26 G 1/2" needle coupled to insulin syringe | TKL | 80288090100 | Used to infund solutions on laboratory animals |
| Accessories for von Frey analgesimeter | INSIGHT | EFF 303 | Containment box with support for digital analgesimeter assessment |
| D-(+)-Glucose | SIGMA-ALDRICH | G7021 | A monosaccharide which is the main source of energy in the form of ATP for living organisms |
| Digital analgesimeter | INSIGHT | von Frey Wi-Fi | The von Frey Wi-Fi is a portable device used to assess tissue sensitivity to mechanical stimuli |
| Gilson type 10 µL polypropylene tip | CRALPLAST | 18261 | Polypropylene to be used on eletronic von Frey apparatus, recommended for hind paw allodynia assessment |
| Laboratory water bath | BEING INSTRUMENT | BW-22P | Used to heat liquid and semi-solid substances contained in appropriate recipients to specific temperature |
| Phosphate buffered saline | SIGMA-ALDRICH | 806552 | A balanced salt solution buffer used for a variety of cell culture applications |
| Swiss mice (Mus musculus) from both gender | UFSC | Swiss Webster | Laboratory animals used for controlled experiments |
| Trypanosoma evansi cryiopreserved sample | UDESC | - | Sample used to infect all mice, ceded by the Hemoparasites and Vectors Biochemistry Laboratory |
| Universal type 10 µL polypropylene tip | CRALPLAST | 18171 | Polypropylene to be used on eletronic von Frey apparatus, recommended for visceral allodynia assessment |
Referencias
- Desquesnes, M., et al. Trypanosoma evansi and surra: a review and perspectives on origin, history, distribution, taxonomy, morphology, hosts, and pathogenic effects. BioMed Research International. 2013, 194176 (2013).
- Cipriani, D. S., et al. Experimental Trypanosoma evansi infection induces pain along with oxidative stress, prevented by COX-2 inhibition. Experimental Parasitology. 247, 108477 (2023).
- Paim, F. C., et al. Cytokines in rats experimentally infected with Trypanosoma evansi. Experimental Parasitology. 128 (4), 365-370 (2011).
- Gillingwater, K., et al. In vivo investigations of selected diamidine compounds against Trypanosoma evansi using a mouse model. Antimicrobial Agents and Chemotherapy. 53 (12), 5074-5079 (2009).
- Dkhil, M. A., et al. Treatment of Trypanosoma evansi-infected mice with Eucalyptus camaldulensis led to a change in brain response and spleen immunomodulation. Frontiers in Microbiology. 13, 833520 (2022).
- Dkhil, M. A., et al. Murine liver response to Allium sativum treatment during infection induced-trypanosomiasis. Saudi Journal of Biological Sciences. 28 (6), 3270-3274 (2021).
- Martins de Moraes, C., et al. Infection by Trypanosoma evansi in horses from Brazil. Revista Portuguesa de Ciências Veterinárias. 102 (561-562), 159-163 (2007).
- Martinov, T., et al. Measuring changes in tactile sensitivity in the hind paw of mice using an electronic von Frey apparatus. Journal of Visualized Experiments. 82, e51212 (2013).
- Rodríguez-Angulo, H., et al. Role of TNF in sickness behavior and allodynia during the acute phase of Chagas' disease. Experimental Parasitology. 134 (4), 422-429 (2013).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7, 447-449 (2010).
- Eijkelkamp, N., et al. Increased visceral sensitivity to capsaicin after DSS-induced colitis in mice: spinal cord c-Fos expression and behavior. American Journal of Physiology-Gastrointestinal and Liver Physiology. 293 (4), 749-757 (2007).
- Mekata, H., et al. Expression of regulatory dendritic cell-related cytokines in cattle experimentally infected with Trypanosoma evansi. Journal of Veterinary Medical Science. 77 (8), 1017-1019 (2015).
- Mukaka, M. M. Statistics corner: a guide to appropriate use of correlation coefficient in medical research. Malawi Medical Journal. 24 (3), 69-71 (2012).
- Schober, P., et al. Correlation coefficients: appropriate use and interpretation. Anesthesia and Analgesia. 126 (5), 1763-1768 (2018).
- Kamidi, C. M., et al. Differential virulence of camel Trypanosoma evansi isolates in mice. Parasitology. 145 (9), 1235-1242 (2018).
- Mekata, H., et al. Isolation, cloning, and pathologic analysis of Trypanosoma evansi field isolates. Parasitology Research. 112, 1513-1521 (2013).
- Silva, A. S., et al. Trypanosoma evansi pathogenicity strain in rats inoculated with parasite in fresh and cryopreserved blood. Ciência Rural. 39 (6), 1842-1846 (2009).
- Silva, A. S., et al. Acetylcholinesterase activity and lipid peroxidation in the brain and spinal cord of rats infected with Trypanosoma evansi. Veterinary Parasitology. 175, 237-244 (2011).
- Diógenes, A. K. L., et al. Concurrent validity of electronic von Frey as an assessment tool for burn associated pain. Burns. 46 (6), 1328-1336 (2020).
- Kalueff, A. V., et al. Neurobiology of rodent self-grooming and its value for translational neuroscience. Nature Reviews Neuroscience. 17, 45-59 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados