Method Article
Elettronico von Frey associato alla scala della smorfia del topo per valutare l'allodinia e il dolore nei topi infetti da Trypanosoma evansi
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per valutare la nocicezione in topi infettati da Trypanosoma evansi, utilizzando l'apparato elettronico di von Frey come strumento, misurando le soglie meccaniche della zampa posteriore e dei visceri.
Abstract
La patogenesi delle malattie infettive è ancora un campo complesso da studiare. Il decorso di diversi segni clinici, come l'allodinia e il dolore, può essere osservato negli animali domestici. Tuttavia, la conoscenza dei loro percorsi e il corretto trattamento richiedono esperimenti controllati, molti dei quali utilizzando animali da laboratorio. Misurare i cambiamenti nelle soglie meccaniche della zampa posteriore e dei visceri è una tecnica utile per osservare i cambiamenti nella percezione del dolore nei roditori. La risposta di astinenza può essere misurata prima nei test di base, il che crea un migliore controllo dei gruppi sperimentali. I test successivi possono essere eseguiti dopo aver indotto l'infezione e aver aggiunto farmaci al protocollo. L'uso di un apparato elettronico di von Frey associato all'uso di una scala facciale per osservare i cambiamenti simili al dolore consente una valutazione semplice, precisa e coerente per valutare l'allodinia e il dolore nei topi. Pertanto, gli esperimenti che utilizzano la presente metodologia per l'infezione da Trypanosoma evansi rappresentano un metodo utile per valutare l'allodinia e il dolore negli animali infetti da laboratorio, che può essere applicato al trattamento convenzionale per gli animali da reddito.
Introduzione
Il Trypanosoma evansi è l'agente eziologico della malattia chiamata "surra" o "mal-das-cadeiras" in Sud America 1,2. Colpisce comunemente equini e bovini, ma anche la fauna selvatica, essendo trasmessa da pipistrelli ematofagi, tabanidi e stomi morsi di mosca 1,3. La Surra è una malattia importante negli animali domestici, che può essere fatale in assenza di un trattamento corretto, presentando segni clinici aspecifici come anemia, perdita di appetito e peso, debolezza muscolare e aborto, che possono variare a seconda dell'ospite e della regione geografica 2,4,5,6.
L'espressione dell'allodinia e del dolore negli animali infetti durante il decorso della malattia è ancora un argomento nuovo 2,7. L'urgenza di comprendere la patogenesi dietro questi segni è un passo importante per migliorare e affinare il trattamento attualmente in uso aggiungendo farmaci analgesici efficaci al classico protocollo tripanocida 5,6. In questo scenario, la possibilità di replicare la malattia utilizzando un modello murino rappresenta un vantaggio, in quanto i topi possono essere facilmente tenuti in ambienti controllati in laboratorio e quindi produrre risultati più coerenti rispetto agli esperimenti sul campo con il bestiame.
Una soglia meccanica è comunemente ottenuta utilizzando un apparato elettronico di von Frey (EvF) per la valutazione dell'allodinia in un vasto numero di esperimenti 2,8,9. Questo dispositivo viene utilizzato per valutare la sensibilità dei tessuti alla stimolazione meccanica: una volta che l'apparato tocca la zampa dell'animale, attraverso una punta da 20-200 μL attaccata al dispositivo, viene registrata la forza con cui l'animale ritira la zampa.
I roditori sono solitamente usati come animali standard in questi esperimenti e la maggior parte dei risultati sono estrapolati ad altre specie, poiché la maggior parte delle malattie studiate proviene da altre specie in cui sarebbe difficile condurre uno studio controllato. Inoltre, l'allodinia e il dolore sono intimamente correlati. L'uso di una specifica scala facciale per valutare il dolore nei topi infetti svolge un ruolo importante come adiuvante di conferma per affermare la presenza di dolore durante il corso dell'infezione da T. evansi 2,10.
In questo protocollo, dimostriamo un nuovo modello per valutare l'allodinia e il dolore in topi infettati sperimentalmente da T. evansi, mostrando un'elevata correlazione tra le variabili, dimostrando così di essere un modello forte. Inoltre, richiede un numero ridotto di ricercatori per eseguire l'intera procedura, diminuendo la possibilità di interferenza umana durante l'esperimento. Consente inoltre allo sperimentatore di replicare la malattia bersaglio durante un decorso acuto e di aggiungere diversi farmaci di trattamento nel disegno sperimentale, ottenendo così risultati coerenti in un breve periodo.
Protocollo
Tutti gli esperimenti sono stati eseguiti utilizzando topi svizzeri femmine adulte di 10 settimane (35-55 g). Gli animali sono stati alloggiati in gabbie di polisulfone (3-5 animali per gabbia) in una stanza a temperatura controllata (21 ± 1 °C), ciclo luce 12 ore / buio 12 ore e cibo da laboratorio standard e acqua ad libitum. Dieci animali sono stati assegnati a ciascun gruppo in ogni test per dimostrare gli effetti coerenti dei trattamenti farmacologici. Il disegno sperimentale è stato presentato e approvato dal Comitato Etico dell'Università Statale di Santa Catarina (CEUA) (numero di protocollo: 6019201123). Tutti gli esperimenti sugli animali sono stati conformi alle linee guida ARRIVE (Animal Research: Reporting of in vivo Experiments) e sono stati condotti in conformità con la Guida del Consiglio Nazionale delle Ricerche per la cura e l'uso degli animali da laboratorio.
1. Preparazione e inoculazione del Trypanosoma evansi
ATTENZIONE: Indossare un camice da laboratorio monouso, guanti, maschera e protezione per gli occhi quando si maneggiano campioni di sangue infetti, reagenti e altri composti chimici.
- Accendere l'attrezzatura a bagnomaria e regolarla a una temperatura costante di 37 °C.
- Estrarre dall'ultracongelatore una provetta da microcentrifuga contenente il campione di sangue conservato (-80 °C). Mettilo a bagnomaria fino a quando il sangue non si scioglie.
NOTA: Lo stesso isolato dovrebbe essere utilizzato per infettare tutti i topi in ogni gruppo di esperimenti diversi per mantenere un numero uguale di passaggi di sangue. - Utilizzare soluzione fisiologica tamponata con fosfato (PBS, 0,1 M) contenente il 60% di D-(+)-glucosio (pH 7,4) per eseguire la diluizione seriale (10:1 v v) fino a raggiungere 1 × 104 tripanosomi per 0,1 mL. Determinare il numero di cellule parassite mediante conteggio manuale delle cellule utilizzando una camera Neubauer su un microscopio con obiettivo 100x2.
- Inoculare 0,1 mL della soluzione di sangue diluito (gruppo infetto), o lo stesso volume in un veicolo salino allo 0,9% (gruppo di controllo), per via intraperitoneale, utilizzando un ago da 26 G 1/2" accoppiato a una siringa da insulina.
2. Configurazione e funzionamento dell'apparato elettronico von Frey
NOTA: Prestare attenzione a come vengono registrati i dati ottenuti. Alcune apparecchiature EvF dispongono di programmi specifici per trasferire i dati ottenuti dall'apparecchio ad altri dispositivi elettronici, come computer, tablet o smartphone.
- Accendere l'apparecchio EvF. Assicurarsi che l'apparecchiatura sia ben carica prima di iniziare l'esperimento, osservando il livello della batteria visualizzato sullo schermo dell'apparecchiatura e caricandola se necessario.
- Collegare l'apparecchio EvF al dispositivo elettronico scelto tramite Wi-Fi per trasferire e salvare i dati ottenuti.
- Inserire una punta in polipropilene da 10 μl nel cono dell'apparecchio EvF e impostare la lettura su zero (0,00 g) premendo il pulsante con il simbolo di una zampa.
- Osservare che una volta sondato il tessuto valutato; la pressione massima applicata viene visualizzata sul display dell'apparecchio EvF. Successivamente, trasferiscilo sul dispositivo elettronico scelto premendo il pulsante con il simbolo di un'antenna per una registrazione sicura.
- Azzera la lettura e preparati a effettuare una nuova misurazione semplicemente premendo nuovamente il pulsante con il simbolo della zampa.
3. Considerazioni generali per le valutazioni meccaniche delle soglie
- Eseguire tutti gli esperimenti in una stanza silenziosa con temperatura controllata a 21 °C e un ciclo di 12 ore luce/12 ore di buio, e assicurarsi di rispettare il ciclo circadiano del topo eseguendo tutte le valutazioni alla stessa ora del giorno2.
- Chiedere alla stessa persona di eseguire valutazioni della soglia meccanica sia di base che sperimentale per ridurre le distorsioni e garantire la coerenza delle misurazioni; Assicurati che gli esperimenti siano accecati.
- Posizionare delicatamente ogni topo all'interno di una camera individuale in polimetilmetacrilato (PMMA) con una parte superiore perforata posizionata su un supporto da pavimento in rete da 5 mm² 2,8.
- Lasciare che i topi si acclimatino per 30 minuti nelle camere in PMMA prima di valutare sia la soglia meccanica basale che quella sperimentale2.
- Posiziona il supporto da pavimento in rete a un'altezza comoda (su una superficie stabile) in modo che gli animali siano accessibili da tutti i lati. Assicurarsi che l'addome e tutte e quattro le zampe dei topi siano facilmente accessibili attraverso le aperture del pavimento in rete.
- Coprire la superficie stabile utilizzata per allocare le camere con materiale assorbente per assorbire o raccogliere la minzione e la defecazione. Assicurarsi che i bracci dell'investigatore possano muoversi liberamente sotto le camere durante il funzionamento dell'apparecchio EvF.
4. Valutazione della soglia meccanica basale e risposta del topo agli stimoli
- Per le misurazioni dell'addome, dividere l'addome in tre parti virtuali (area cranica, media e caudale). Scegliere l'area cranica (che contiene anatomicamente il fegato) come tessuto bersaglio standard per la valutazione della soglia meccanica dell'allodinia viscerale. Per le misure delle zampe, scegli la zampa posteriore giusta per la standardizzazione.
- Effettuare una misurazione basale da ciascun topo 48 ore prima dell'infezione. Per fare ciò, posizionare i topi nelle camere di contenimento, preparare l'apparecchio EvF e utilizzare entrambe le mani per sollevare lentamente la sonda per stimolare il tessuto bersaglio.
- Aumentare gradualmente la pressione sul tessuto fino a quando il topo esprime un comportamento nocicettivo. Per la valutazione della zampa posteriore destra, cerca la retrazione della zampa, il leccamento delle zampe o il salto a quattro zampe 2,8,9. Per la valutazione viscerale, cercare una forte retrazione dell'addome, leccare o graffiare immediatamente il sito sondato o saltare a quattro zampe 2,11.
- Salvare il valore ottenuto trasferendo i dati sul dispositivo elettronico scelto contenente lo specifico programma EvF o scrivendolo in un registro dei voti. Azzerare il display e ripetere il processo quattro volte per ottenere cinque misurazioni8.
NOTA: Considerare solo tre misurazioni simili per stimare il valore medio2 - Misurare la soglia meccanica del topo presente nella camera adiacente fino a quando ogni topo viene sondato cinque volte e si ottiene un valore medio per ogni animale.
- Ripetere le misurazioni di base 24 ore dopo ed escludere i topi con valori medi inferiori a 3,00 g o con differenze tra le misure basali superiori a 2,00 g 2,8.
NOTA: In ogni esperimento, per ogni topo deve essere scelto un solo tessuto bersaglio, in modo che gli animali non si abituino ad essere sondati, poiché il numero di valutazioni sarebbe notevolmente più alto in un breve periodo.
5. Valutazione sperimentale della soglia meccanica della zampa posteriore destra e dell'allodinia viscerale
- Valutare la soglia meccanica dell'allodinia viscerale o della zampa posteriore destra 1 ora dopo l'infezione per la valutazione del giorno 0.
- Ripetere la procedura ogni 24 ore per 5 giorni dopo l'infezione.
NOTA: se c'è un trattamento da somministrare, scegliere un punto temporale appropriato all'interno del disegno sperimentale. - Riporta i topi nelle loro gabbie originali per evitare che gli animali combattano tra loro, con accesso al cibo da laboratorio standard e all'acqua ad libitum dopo che le misurazioni sono state completate.
- Eseguire un test di normalità per verificare la normale distribuzione dei dati e un'ulteriore analisi statistica appropriata dei dati raccolti.
6. Valutazione della scala delle smorfie del mouse
- Assicurati che ogni topo sia visibile facilmente mentre si trova all'interno della camera di contenimento ed esamina ogni topo prima dell'esperimento per assicurarti che non ci siano lesioni sugli arti, sull'addome o sul viso e che non vi siano cambiamenti nel mantello.
- Osservare l'area orbitale del mouse. Classifica gli occhi aperti come assenza di dolore (punteggio 0) mentre un dolore evidente può essere rappresentato quando il topo chiude gli occhi (punteggio 2).
- Osserva il naso del topo. Classificare un naso normale come l'assenza di dolore mentre la presenza di un rigonfiamento sul ponte del naso rappresenta un dolore evidente.
- Osserva le guance del topo. Classificare le guance normali come l'assenza di dolore mentre la presenza di un rigonfiamento su entrambe le guance rappresenta un dolore evidente.
- Osserva la posizione delle orecchie del mouse. Classificare le orecchie arrotondate come l'assenza di dolore mentre le orecchie che ruotano verso l'esterno o all'indietro, lontano dal viso, in una forma appuntita, rappresentano un dolore evidente. Lo spazio tra le orecchie aumenta con il punteggio del dolore.
- Osserva i baffi del topo. Classifica i baffi con la loro naturale curva verso il basso come l'assenza di dolore, mentre i baffi che sono tirati indietro contro la guancia o tirati in avanti rappresentano un dolore evidente.
- Poiché i comportamenti innati, come l'auto-cura, possono interferire con l'espressione facciale, non considerare questi comportamenti correlati al dolore8. Attendi che il mouse interrompa questo comportamento prima di ogni valutazione dell'unità di azione.
- Eseguire un test di normalità per verificare la normale distribuzione dei dati e un'ulteriore analisi statistica appropriata dei dati raccolti.
NOTA: Alla fine di tutti gli esperimenti, i topi sono stati sottoposti a eutanasia umana utilizzando ketamina (90 mg/kg) e xilazina (7,5 mg/kg), iniettati per via intraperitoneale. Dopo aver raggiunto un piano di anestesia profonda confermato, sono stati sottoposti a lussazione cervicale.
Risultati
Diminuzione della soglia meccanica dovuta all'infezione da T. evansi valutata mediante apparecchio elettronico di von Frey sia sulla zampa posteriore destra che sui tessuti viscerali
L'esperimento è stato condotto nell'arco di 5 giorni, secondo i dati precedenti relativi al campione2 disponibile di T. evansi. I topi infetti hanno iniziato a mostrare una differenza significativa nella soglia meccanica sulla zampa posteriore destra al giorno 3 dopo l'infezione e sono rimasti significativamente più bassi rispetto al gruppo di controllo durante i successivi 2 giorni dopo l'infezione (Figura 1A) rispetto ai topi non infetti. Risultati simili per la sensibilità tattile addominale hanno mostrato un'allodinia viscerale nei topi infetti a partire dal giorno 3 dopo l'infezione e rimanendo significativamente più bassa rispetto al gruppo di controllo durante i successivi 2 giorni dopo l'infezione (Figura 1B).
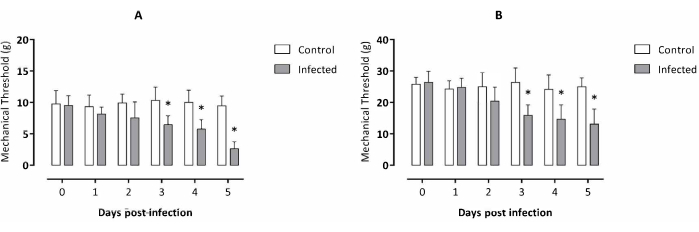
Figura 1: Valutazione dell'allodinia di topi infettati sperimentalmente da Trypanosoma evansi. (A) Allodinia della zampa posteriore destra e (B) allodinia viscerale. Dati espressi come media ± SD di dieci animali per ciascun gruppo sperimentale. Analisi statistica: t-test di Student, un'analisi non appaiata per punto temporale. Gli asterischi mostrano differenze significative tra i gruppi sperimentali considerando lo stesso punto temporale analizzato (p < 0,05). Clicca qui per visualizzare una versione più grande di questa figura.
Induzione delle caratteristiche facciali correlate al dolore nel topo mediante infezione da T. evansi e interpretazione numerica mediante valutazione del dolore della scala della smorfia del topo
I topi infetti hanno iniziato a manifestare segni significativi di caratteristiche facciali correlate al dolore il giorno 3 dopo l'infezione, mostrando un punteggio medio di 0,4 [0-1] al punto temporale di riferimento. La stessa tendenza è stata osservata durante l'esperimento, in cui il gruppo infetto ha mostrato differenze significative rispetto al gruppo di controllo, presentando punteggi medi di 0,6 [0-1] e 1,3 [0-2] per i giorni 4 e 5 dopo l'infezione, rispettivamente. Il gruppo di controllo non ha ottenuto un punteggio sulla scala della smorfia del topo, come previsto. L'analisi statistica è stata eseguita utilizzando il t-test di Student, un'analisi non appaiata per punto temporale, considerando significativo un valore di p < 0,05. Inoltre, il coefficiente di correlazione di Pearson (r) ha identificato modelli di interazione tra la valutazione del dolore della scala della smorfia del topo e l'allodinia della zampa posteriore destra o tra la stessa scala e l'allodinia viscerale, i cui valori erano rispettivamente -96,35% e -84,08%. Inoltre, i coefficienti di determinazione (R2) per la valutazione del dolore della scala della smorfia del topo e l'allodinia della zampa posteriore destra o l'allodinia viscerale erano rispettivamente 0,9283 e 0,7070.
Il presente studio concorda con i dati precedenti, che hanno confermato la presenza di infiammazione e dolore nel corso dell'infezione da T. evansi 2,3,7,12. Inoltre, il metodo descritto fornisce una metodologia accurata per identificare e misurare l'allodinia e il dolore nei topi. Inoltre, l'uso della valutazione del dolore della Scala della Smorfia di Topo nei topi infetti ha indicato un r negativo molto alto (dal 90 al 100%) rispetto ai risultati espressi dalla valutazione dell'allodinia della zampa posteriore destra e un r negativo elevato (dal 70 all'89%) per la valutazione dell'allodinia viscerale dei rispettivi animali13. Allo stesso modo, l'uso della valutazione del dolore della scala della smorfia di topo nei topi infetti ha indicato un R2 molto forte (da 0,90 a 1,00) rispetto ai risultati espressi dalla valutazione dell'allodinia della zampa posteriore destra e un forte R2 (da 0,70 a 0,89) per la valutazione dell'allodinia viscerale degli stessi animali14.
Discussione
Un passaggio critico negli esperimenti che coinvolgono animali infetti è il controllo dei livelli di parassitemia. Diversi ceppi di T. evansi possono comportarsi in modi divergenti nei topi, portando da infezioni acute a croniche 2,4,5,6. Inoltre, le variazioni della dose di infezione possono ridurre o prolungare il tempo di sopravvivenza dei topi. Pertanto, si raccomanda di ottenere una curva di sopravvivenza prima degli esperimenti per determinare il periodo corretto dell'esperimento e prevenire la frustrazione con eventi di morte imprevisti del topo15,16. Inoltre, questi dati possono determinare gli endpoint umani per l'esperimento, se applicabile.
Inoltre, lo stesso isolato deve essere utilizzato per infettare tutti i topi nell'esperimento per rispettare un numero uguale di passaggi di sangue, come spiegato nella sezione del protocollo. Allo stesso modo, il sangue crioconservato o fresco infetto può essere utilizzato per infettare i topi, poiché alcuni campioni crioconservati possono essere inattivati dopo lo scongelamento a bagnomaria. Tuttavia, il sangue infetto fresco può produrre una parassitemia più rapida e, quindi, eventi di morte precoci17,18.
Le modifiche nell'esperimento, come l'aggiunta di farmaci tripanocidi o analgesici, sono praticabili. Nuovi gruppi significano più animali ed è importante ricordare che anche i gruppi di controllo per i farmaci scelti devono essere sottoposti a misurazioni di base. Nella nostra esperienza, circa il 20-25% dei topi viene escluso dall'esperimento dopo la seconda misurazione di base, il che è coerente con i dati precedenti8. Ciò significa che il numero iniziale di animali deve essere superiore al numero sperimentale di animali, il che può essere un problema quando vengono valutati più gruppi e di conseguenza viene stimato un numero più elevato di topi.
Per questo modello devono essere prese in considerazione la farmacocinetica e la farmacodinamica. Alcuni farmaci impiegano periodi prolungati per esercitare la loro azione farmacologica, il che può influire sul disegno sperimentale di un modello in cui i topi di solito muoiono in una media di 4-5 giorni 2,6. Inoltre, se gli animali sono a digiuno per il trattamento scelto, il periodo di acclimatazione può essere un fattore importante da considerare, in quanto influenzerà sia la dinamica del farmaco che il programma e la procedura sperimentale, come riportato nella sezione del protocollo.
Un grande miglioramento nel metodo attuale è che un singolo ricercatore ben addestrato può eseguire l'intera procedura di lettura dell'EvF (sia le misurazioni di base che quelle sperimentali) rimanendo all'oscuro dell'infezione o dei trattamenti. Un altro ricercatore deve eseguire l'infezione all'inizio dell'esperimento. Ciò non è necessario dopo la procedura di infezione, poiché l'apparecchio EvF dispone di uno specifico programma di misurazione Wi-Fi von Frey che consente a una sola persona di utilizzare completamente l'apparecchiatura. Inoltre, questo metodo è più veloce della normale apparecchiatura Filament von Frey e più facile da eseguire 8,19.
Tuttavia, l'affaticamento può essere una complicazione, poiché lo stesso ricercatore deve eseguire tutte le letture degli animali e può sviluppare esaurimento a causa del movimento ripetitivo dopo un po' di tempo8. Prendendo in considerazione l'aspettativa di sopravvivenza per i topi infettati da T. evansi, un numero elevato di gruppi nel disegno sperimentale non è incoraggiato. Nella nostra esperienza, una media di 10 topi alla volta (a seconda del disegno sperimentale) può essere misurata in meno di 30 minuti. Inoltre, in ogni esperimento deve essere scelto un solo tessuto bersaglio per ogni topo in modo che gli animali non si abituino a essere sondati, come spiegato nella sezione del protocollo, il che diminuisce anche la possibilità di sviluppo di affaticamento da parte dello sperimentatore.
Inoltre, sia le valutazioni EvF (misure della zampa posteriore destra e viscerale) che la scala della smorfia del topo richiedono ricercatori ben addestrati. Prima di eseguire gli esperimenti, lo sperimentatore deve trascorrere lunghi periodi di pratica. Per valutare correttamente i cambiamenti dell'espressione facciale nei topi, il ricercatore deve conoscere non solo le alterazioni attese, ma anche la normale espressione facciale di un topo normale e le sue variazioni di normalità e comportamenti10,20. Inoltre, per valutare correttamente la soglia meccanica dei topi utilizzando l'apparato EvF, il ricercatore deve ripetere diverse misurazioni di base fino a quando la risposta del topo agli stimoli della sonda non è facilmente riconoscibile e la coerenzaè raggiunta 2,8.
Le future applicazioni del protocollo prevedono la valutazione dell'allodinia e del dolore, nonché il suo trattamento, su topi infettati da T. evansi. Il presente modello consente ai ricercatori scientifici di valutare la patogenesi correlata al dolore di una malattia comunemente riscontrata nel bestiame, nei topi in un ambiente controllato in laboratorio.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Gli autori ringraziano in particolare l'Università Statale di Santa Catarina per il sostegno finanziario, il Laboratorio di Farmacologia per gli animali e lo spazio e il Laboratorio di Biochimica degli Emoparassiti e dei Vettori per il campione di sangue crioconservato infettato da T. evansi utilizzato in questi esperimenti.
Materiali
| Name | Company | Catalog Number | Comments |
| 26 G 1/2" needle coupled to insulin syringe | TKL | 80288090100 | Used to infund solutions on laboratory animals |
| Accessories for von Frey analgesimeter | INSIGHT | EFF 303 | Containment box with support for digital analgesimeter assessment |
| D-(+)-Glucose | SIGMA-ALDRICH | G7021 | A monosaccharide which is the main source of energy in the form of ATP for living organisms |
| Digital analgesimeter | INSIGHT | von Frey Wi-Fi | The von Frey Wi-Fi is a portable device used to assess tissue sensitivity to mechanical stimuli |
| Gilson type 10 µL polypropylene tip | CRALPLAST | 18261 | Polypropylene to be used on eletronic von Frey apparatus, recommended for hind paw allodynia assessment |
| Laboratory water bath | BEING INSTRUMENT | BW-22P | Used to heat liquid and semi-solid substances contained in appropriate recipients to specific temperature |
| Phosphate buffered saline | SIGMA-ALDRICH | 806552 | A balanced salt solution buffer used for a variety of cell culture applications |
| Swiss mice (Mus musculus) from both gender | UFSC | Swiss Webster | Laboratory animals used for controlled experiments |
| Trypanosoma evansi cryiopreserved sample | UDESC | - | Sample used to infect all mice, ceded by the Hemoparasites and Vectors Biochemistry Laboratory |
| Universal type 10 µL polypropylene tip | CRALPLAST | 18171 | Polypropylene to be used on eletronic von Frey apparatus, recommended for visceral allodynia assessment |
Riferimenti
- Desquesnes, M., et al. Trypanosoma evansi and surra: a review and perspectives on origin, history, distribution, taxonomy, morphology, hosts, and pathogenic effects. BioMed Research International. 2013, 194176 (2013).
- Cipriani, D. S., et al. Experimental Trypanosoma evansi infection induces pain along with oxidative stress, prevented by COX-2 inhibition. Experimental Parasitology. 247, 108477 (2023).
- Paim, F. C., et al. Cytokines in rats experimentally infected with Trypanosoma evansi. Experimental Parasitology. 128 (4), 365-370 (2011).
- Gillingwater, K., et al. In vivo investigations of selected diamidine compounds against Trypanosoma evansi using a mouse model. Antimicrobial Agents and Chemotherapy. 53 (12), 5074-5079 (2009).
- Dkhil, M. A., et al. Treatment of Trypanosoma evansi-infected mice with Eucalyptus camaldulensis led to a change in brain response and spleen immunomodulation. Frontiers in Microbiology. 13, 833520 (2022).
- Dkhil, M. A., et al. Murine liver response to Allium sativum treatment during infection induced-trypanosomiasis. Saudi Journal of Biological Sciences. 28 (6), 3270-3274 (2021).
- Martins de Moraes, C., et al. Infection by Trypanosoma evansi in horses from Brazil. Revista Portuguesa de Ciências Veterinárias. 102 (561-562), 159-163 (2007).
- Martinov, T., et al. Measuring changes in tactile sensitivity in the hind paw of mice using an electronic von Frey apparatus. Journal of Visualized Experiments. 82, e51212 (2013).
- Rodríguez-Angulo, H., et al. Role of TNF in sickness behavior and allodynia during the acute phase of Chagas' disease. Experimental Parasitology. 134 (4), 422-429 (2013).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7, 447-449 (2010).
- Eijkelkamp, N., et al. Increased visceral sensitivity to capsaicin after DSS-induced colitis in mice: spinal cord c-Fos expression and behavior. American Journal of Physiology-Gastrointestinal and Liver Physiology. 293 (4), 749-757 (2007).
- Mekata, H., et al. Expression of regulatory dendritic cell-related cytokines in cattle experimentally infected with Trypanosoma evansi. Journal of Veterinary Medical Science. 77 (8), 1017-1019 (2015).
- Mukaka, M. M. Statistics corner: a guide to appropriate use of correlation coefficient in medical research. Malawi Medical Journal. 24 (3), 69-71 (2012).
- Schober, P., et al. Correlation coefficients: appropriate use and interpretation. Anesthesia and Analgesia. 126 (5), 1763-1768 (2018).
- Kamidi, C. M., et al. Differential virulence of camel Trypanosoma evansi isolates in mice. Parasitology. 145 (9), 1235-1242 (2018).
- Mekata, H., et al. Isolation, cloning, and pathologic analysis of Trypanosoma evansi field isolates. Parasitology Research. 112, 1513-1521 (2013).
- Silva, A. S., et al. Trypanosoma evansi pathogenicity strain in rats inoculated with parasite in fresh and cryopreserved blood. Ciência Rural. 39 (6), 1842-1846 (2009).
- Silva, A. S., et al. Acetylcholinesterase activity and lipid peroxidation in the brain and spinal cord of rats infected with Trypanosoma evansi. Veterinary Parasitology. 175, 237-244 (2011).
- Diógenes, A. K. L., et al. Concurrent validity of electronic von Frey as an assessment tool for burn associated pain. Burns. 46 (6), 1328-1336 (2020).
- Kalueff, A. V., et al. Neurobiology of rodent self-grooming and its value for translational neuroscience. Nature Reviews Neuroscience. 17, 45-59 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon