Method Article
マウス心不全モデルにおける心拍数依存性拡張期機能の評価のためのペーシング制御手順
要約
本プロトコルは、心不全のマウスモデルにおける拡張期機能の評価における貴重なツールとして役立つ経食道ペーシングによる圧力と体積の関係の取得について記述している。
要約
駆出率が保たれた心不全(HFpEF)は、拡張期機能障害と運動不耐症を特徴とする状態です。ヒトの拡張期機能障害の検出やHFpEFの診断には、運動ストレスによる血行動態検査やMRIが用いられますが、マウスモデルを用いた基礎研究では限界があります。この目的のために、マウスではトレッドミル運動テストが一般的に使用されていますが、その結果は体重、骨格筋力、および精神状態によって影響を受ける可能性があります。ここでは、心拍数(HR)依存的な拡張期パフォーマンスの変化を検出するための心房ペーシングプロトコルについて説明し、HFpEFのマウスモデルでその有用性を検証します。この方法では、麻酔、挿管、および心房ペーシングに付随する圧力-容積(PV)ループ分析を実行します。この研究では、コンダクタンスカテーテルを左心室頂端アプローチ で 挿入し、心房ペーシングカテーテルを食道に配置しました。ベースラインのPVループは、HRがイバブラジンで遅くなる前に収集されました。PVループは、心房ペーシング を介して 400bpmから700bpmの範囲のHR増分で収集および分析されました。このプロトコルを用いて、代謝誘発性HFpEFモデルにおけるHR依存性拡張期障害を明確に示しました。弛緩時定数(Tau)と拡張末期圧力-容積関係(EDPVR)は、対照マウスと比較してHRが増加するにつれて悪化しました。結論として、この心房ペーシング制御プロトコルは、HR依存性心機能障害の検出に役立ちます。この研究は、HFpEFマウスモデルにおける拡張期機能障害の根本的なメカニズムを研究する新しい方法を提供し、拡張期障害に対する新しい治療法の開発に役立つ可能性がある。
概要
心不全は世界中の入院と死亡の主な原因であり、駆出率が保たれた心不全(HFpEF)は心不全診断全体の約50%を占めています。HFpEFは拡張期機能障害と運動耐性障害を特徴とし、拡張期機能障害などの関連する血行動態異常は、運動ストレス血行動態検査またはMRIスキャンによって明確に検出できます1,2。
しかし、実験モデルでは、HFpEFに関連する生理学的異常を評価するために利用可能なモダリティは限られています3,4。トレッドミル運動テスト(TMT)は、運動ストレス心臓の血行動態を反映する可能性のあるランニング時間と距離を決定するために使用されます。ただし、この方法は、体重、骨格筋力、精神状態などの外部変数からの干渉を受けやすいです。
これらの制限を回避するために、心拍数(HR)に基づいて拡張期パフォーマンスの微妙だが重要な変化を検出する心房ペーシングプロトコルを考案し、HFpEF5のマウスモデルでその有用性を検証しました。交感神経やカテコールアミン反応、末梢血管拡張、内皮反応、心拍数など、いくつかの生理学的要因が運動関連の心機能に寄与しています6。しかし、これらのうち、心拍圧関係(ボウディッチ効果とも呼ばれる)は、心臓の生理学的特徴の重要な決定要因として知られています7,8,9。
このプロトコルでは、ベースラインで従来の圧力-容積分析を実行して、収縮期および拡張期機能を評価することが含まれます 圧力発生速度(dp / dt)、収縮末期圧力-容積関係(ESPVR)、および拡張末期圧力-容積関係(EDPVR)などのパラメーター。ただし、これらのパラメータはHRの影響を受け、固有の心拍数の違いにより動物間で異なる可能性があることに注意してください。さらに、HRに対する麻酔の影響も考慮する必要があります。これに対処するために、心房ペーシングをイバブラジンと同時に投与することでHRを標準化し、心拍数の増加で心臓パラメータ測定を実施しました。注目すべきは、HR依存性心筋反応がHFpEFマウスと対照群マウスを区別したのに対し、ベースラインのPVループ測定(内因性心拍数を使用)では有意差は認められなかったことです5。
このペーシングプロトコルは比較的複雑に見えるかもしれませんが、よく理解すれば成功率は90%を超えます。このプロトコルは、HFpEFマウスモデルにおける拡張期機能障害の根本的なメカニズムを研究し、この状態の新しい治療法の開発に役立つ有用な方法を提供します。
プロトコル
この動物実験計画書は、動物実験委員会で承認され、東京大学の動物実験等に関する規定に従ったものです。本研究では、8-12週齢の雄のC57/Bl6Jマウスを用いた。動物は市販の供給源から入手しました( 資料表を参照)。HFpEFのモデルは、前述のように、NG-ニトロ-L-アルギニンメチルエステルと組み合わせて高脂肪食を15週間投与することによって確立されました10。
1. カテーテルの準備と圧力/容量の校正
- コンダクタンスカテーテルを生理食塩水に挿入し、PowerLab 8/35と圧力-体積ユニット(MPVSモジュール、 材料表を参照)で構成されるモジュールに取り付けます。
- MPVSモジュール3,11に所定の圧力(0mmHgおよび100mmHg)および体積パラメータ(これらはMPVSモジュールによって異なる)を記録して、圧力と体積を電子的に較正する(製造元の指示も参照)。
2. カテーテル挿入のための動物の準備
- 麻酔と換気
- 挿管の5〜10分前に、5 mg / kgのエトミデートと500 mg / kgのウレタンの腹腔内注射を投与します( 材料表を参照)。
注:ウレタンは、動物実験では麻酔薬として有効ですが、ヒトに対して発がん性があると疑われています。したがって、ウレタンが実験目的の達成に必要であり、代替剤が十分でない場合は、取り扱いに注意する必要があります。準備中は、手袋やマスクの着用、ドラフトの使用など、適切な保護対策が義務付けられています。可能な代替として、ケタミン(80 mg / kg、ip)が採用される可能性があります。 - 2%イソフルランで飽和させた麻酔チャンバーにマウスを置き、麻酔導入時に38°C〜40°Cに維持された予め温めた加熱パッドに動物を移します。
- 手術部位を剃ります。次に、ベタジンとアルコールを交互に3回投与して手術部位を消毒します。
- 首を水平に切開(1〜2cm)し、気管の筋肉を切除し、気管を露出させます。外科用2-0シルク縫合糸を気管の下に通し、気管を持ち上げ、小さな切開(1〜2 mm)して開きます。
- 気管内に気管内チューブを挿入し、100%酸素と2%イソフルランの混合物を送達する人工呼吸器に接続します(後で0.5%から1%に減らします)。
- 挿管の5〜10分前に、5 mg / kgのエトミデートと500 mg / kgのウレタンの腹腔内注射を投与します( 材料表を参照)。
- 中心静脈(CV)カテーテルの挿入と輸液注入
- 胸鎖乳突筋の下にある内頸静脈を見つけます3。
- 30 Gの針に取り付けられたPE-10シラスティックチューブ( 材料表を参照)で構成される中心静脈カテーテルを頸静脈に挿入します。
- 体重10%アルブミン/ NaClの5〜6μL / gのボーラス注入を3分間投与し、その後5〜10μL / minの一定の注入速度で投与します。.
注:このステップは、麻酔によって引き起こされる末梢血管拡張に起因する低血圧を防ぐために重要です。内頸静脈は胸鎖乳突筋と頸動脈の間に位置し、動脈よりも色が濃く見えます。
3.左心室カテーテル法(開胸法)の外科的処置
- 麻酔をかけたマウスの手術部位を剃ります。次に、ベタジンとアルコールを交互に3回投与して手術部位を消毒します。
- つま先をつまんで麻酔の深さを確認します。次に、剣状突起の下に水平切開(2〜3 cm)を行い、鈍いハサミを使用して皮膚を胸壁から分離します。
- 電気焼灼を使用して胸壁の両側を横方向に切断します( 材料表を参照)。
- 横隔膜を切開して心臓を露出させ、鉗子を使用して心膜を心臓からそっと取り除きます。
- 左心室(LV)の頂点に27Gの針を挿入し、穿刺穴 から コンダクタンスカテーテルをLVに逆行性に挿入します。
- 正方形の圧力-体積ループが得られるようにカテーテルの位置を調整します。
- 下大静脈(IVC)閉塞時のPVループの形状を確認することで、負荷条件の変化が生じた際にカテーテルが乳頭筋に接触しないことを確認します。
注意: 適切な心臓への曝露は、手順を容易にし、クリアな視界を得るのに役立ちます。
4.PVループデータを記録し、収縮末期圧力-容積関係(ESPVR)および拡張末期圧力-容積関係(EDPVR)を決定する
注:IVCオクルージョンによってプリロードを減らすことで、ESPVRとEDPVRの決定が可能になります。
- 信号安定化後(カヌレーション後5〜10分)に、LabChartソフトウェア( 材料表を参照)、PowerLab、およびMPVSモジュールを使用して、ベースラインの圧力-体積(PV)ループを記録および分析します。
- 鉗子でIVCを圧縮してIVC閉塞を実行し、IVC閉塞中に少なくとも20心臓サイクルのPVループを記録します。PVループの収縮期末点を通る線形回帰直線をフィッティングしてESPVRを決定し、LabChartソフトウェアを使用してPVループの拡張期末点を通る曲線線フィッティングしてEDPVRを決定します。
注意: 肺の動きのアーチファクトを防ぐために、IVC閉塞中は人工呼吸器を停止してください。パンクロニウム(0.5-1 mg / kg)などの麻痺薬は、肺の動きが過剰である場合に役立つ可能性があり、安定した麻酔面が確認された後にのみ使用する必要があります。.
5.経食道ペーシング
- 2-Fr四極電極カテーテルを食道に挿入し、カテーテルをパルス刺激装置に接続し( 材料表を参照)、心房捕捉閾値を決定します(通常、刺激振幅は3mA、パルス幅は1msです)。
- 腹腔内に投与された20 mg / kgのイバブラジン( 材料表を参照)を使用して、HRを400ビート/分未満に減速します。.
- 安定化後、400 拍/分から 700 拍/分までのさまざまなペーシング速度で、100 拍/分ずつ増分して、PV ループの 20 回の連続心臓サイクルを取得します。各ペーシングレートで5分以上のサイクルを取得します。
6.生理食塩水校正と大動脈流量校正
- 人工呼吸器を不活性化し、CVカテーテルを介して5〜10μLの高張生理食塩水を静脈内投与します。.
- 生理食塩水注入中の圧力と容量の変動を記録し、PowerLab 3,11 を使用して Vp 値を計算します。
- 生理食塩水の校正を繰り返して、精度と再現性を高めます。
- 音量信号を乱さないように、マウスを左側に回します。
- 脊椎に向かってTh3からTh5の間で外側開胸術を行い、鉗子で下行大動脈のごく一部を静かに解剖します。
- 血管流量プローブ( 材料表を参照)を大動脈の上に置き、心拍出量を測定します。
注:絶対体積を正確に計算するには、生理食塩水校正と大動脈流量校正の2種類の校正を使用する必要があります。過剰な塩負荷は収縮性の低下をもたらす可能性があるため、動物被験者への高張生理食塩水注入に関連する潜在的なリスクを認識することが重要です。.
7.安楽死
- 研究後、子宮頸部脱臼 による 麻酔薬の過剰摂取下でマウスを安楽死させます。
注:生命機能の完全な停止を確実にするために、麻酔下での放血とその後の心臓組織採取など、安楽死の二次的な方法が採用されています。
結果
ベースラインのPVループデータを図1と表1に示します。ベースライン時(ペーシングなし)では、対照マウスとHFpEFマウスの間で、緩和時定数(Tau)、最小圧力変化率(dP/dt min)、EDPVRなどの拡張期パラメータに有意差はありませんでした。しかし、HFpEFマウスは、図1に示すように、より高い血圧と動脈弾性(Ea)を示し、心室収縮期に典型的な山型のPVループを示しました。これは、心室筋が圧力トランスデューサに直接接触することによって引き起こされるスパイクとは区別する必要があります(図2)。重要なことは、心房ペーシングを用いることで、対照マウスとHFpEFマウス5の間で拡張期機能を明確に区別できたことです(図3および図4)。対照群では、ペーシング率が増加するにつれてタウとEDPVRの両方が改善しましたが、HFpEF群では、心房ペーシングでHRが増加するにつれてタウとEDPVRの両方が悪化しました。
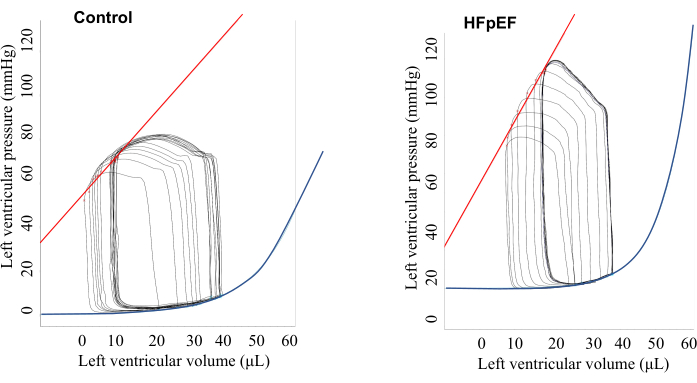
図1:ペーシングがない場合のベースラインでの代表的な圧力と体積の関係(スクリーンショットに示されている)。 その結果、HFpEFマウスは対照マウスと比較して高い動脈弾性および心室圧を示すことが示された。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:スパイク状のPVループの代表画像。 このタイプのPVループ形状は、心室筋による圧力トランスデューサの直接圧縮(オレンジ色の矢印で示されている)の結果であり、結果の精度を維持するために分析から除外する必要があります。 この図の拡大版をご覧になるには、ここをクリックしてください。

図3:駆出率が保たれた心不全(HFpEF)モデルマウスと対照マウスの心房ペーシングに応じた血行動態パラメータの違いを示す代表的なチャート。 このグラフでは、2つのグループを明確に区別しており、心拍数は毎分400拍から毎分700拍の範囲です。略語:LVP =左心室圧;dP/dt = LVPの1次導関数。EDPVR = 拡張末期の圧力と体積の関係;LVV = 左心室容積;タウ = 緩和時定数。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:心拍数(HR)で示した圧力-容積ループ分析からの拡張期パラメータの血行動態反応。HFpEFモデルマウスでは、心房ペーシング中に心拍数が増加するにつれて拡張期機能(タウおよびEDPVR)が低下しました。二元配置分散分析では、HFpEF(F = 28.95、p < 0.001)およびHR(F = 3.035、p = 0.08644) がEDPVRに有意な主効果を示し、グループと心拍数の間の有意な交互作用効果(F = 3.938、p = 0.02454)が示されました。 タウでは、群(F = 25.56、p < 0.001)とHR(F = 0.1088、p = 0.7425 )の有意な効果、および群と心拍数の間に有意な交互作用効果(F = 3.461、p = 0.03759)が認められた。データは平均±標準誤差として表示されます。n = 6匹のマウス/グループ。この図の拡大版をご覧になるには、ここをクリックしてください。

図5:生理食塩水校正手順の代表的な図。高張生理食塩水の注入は、血液の電気伝導率を変化させ、したがって、周囲の心臓組織に起因する信号成分の計算を可能にします。注射中、血圧は安定しており、体積はわずかに増加します(オレンジ色の矢印で表示)。略語:LVP =左心室圧;LVV = 左心室容積 この図の拡大版を表示するには、ここをクリックしてください。

図6:経食道ペーシングカテーテルの適切な配置の代表的な図。 経食道ペーシングカテーテルの適切な配置により、狭いQRSリズムが可能になります。青い矢印は正常な洞調律を表し、赤い矢印は心房ペーシングのリズムを示しています。この図の拡大版をご覧になるには、ここをクリックしてください。
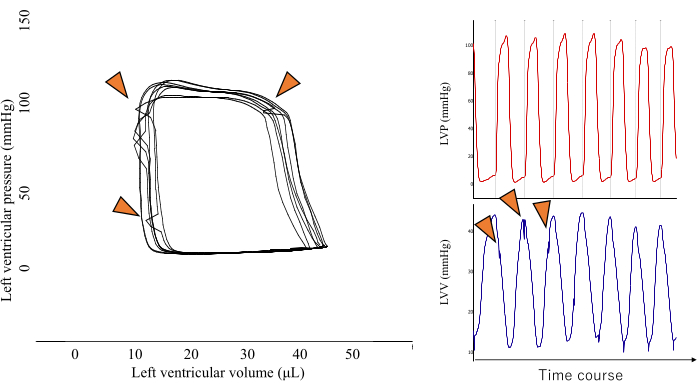
図7:心房ペーシングにおける刺激振幅の調整が誤って行われ、圧力と体積のループが歪んでいる代表的な画像。 刺激強度は、コンダクタンス信号に望ましくないモーションアーチファクトを誘発し、揺れ線(矢印で示す)を持つPVループとして描かれています。 この図の拡大版をご覧になるには、ここをクリックしてください。
| コントロール (n = 10) | HFpEF (n = 10) | p値 | |
| CO (μL/min) | 12436.8 ± 938.4 | 10923.5 ± 1032.7 | 0.2897 |
| SV (μL) | 23.6 ± 1.85 | 20.5 ± 1.88 | 0.2515 |
| Ved (μl) | 37.6±3.45 | 34.0±1.32 | 0.4242 |
| ペレス(mmHg) | 95.2 ± 3.56 | 109.3 ± 1.74 | 0.00032* |
| ペッド(mmHg) | 6.16 ± 1.53 | 6.95 ± 1.22 | 0.6889 |
| 心拍数(ビート/分) | 532.4 ± 20.8 | 534.0 ± 13.9 | 0.9505 |
| EF (%) | 66.5±2.95 | 63.68 ± 2.37 | 0.4718 |
| Ea(mmHg/μL) | 4.02 ± 0.30 | 5.90 ± 0.72 | 0.03224* |
| 最大dP/dt(mmHg/s) | 10812.1 ± 1042.9 | 9481.1 ± 262.02 | 0.2444 |
| 最小dP/dt(mmHg/s) | △9540.7 ± 748.9 | △9003.9 ± 320.0 | 0.5177 |
| タウ(ミリ秒) | 7.30 ± 0.50 | 8.02 ± 0.39 | 0.268 |
| ESPVR (mmHg/μL) | 3.41 ± 0.51 | 4.69 ± 0.41 | 0.09147 |
| EDPVR (mmHg/μL) | 0.096 ± 0.0061 | 0.103 ± 0.013 | 0.6103 |
表1:対照マウスとHFpEFマウスのベースライン心臓パラメータ。 データは標準誤差の平均±表示されます。*p < 0.05 と t 検定による対照。
ディスカッション
経食道ペーシングの適用による圧力と体積の関係を評価する方法論を提示します。運動不耐症はHFpEFの重要な特徴の1つですが、運動中のマウスの心機能を評価するための技術はありません。私たちのペーシングプロトコルは、安静状態では明らかではない拡張期機能障害を検出するための貴重なツールを提供します。
正確で一貫した品質のPVループを実現するには、次の手順を細心の注意を払って実行する必要があります3,4,5,7,8,11,12,13,14:(1)動物は慎重に麻酔されなければならず、加熱パッドを使用して37〜37.5°Cの一貫した体温を維持する必要があります。(2)動物は適切に挿管されなければならず、換気は効果的に制御されなければなりません。(3)静脈内アクセスの適切な配置を確保する必要があります。(4)コンダクタンスカテーテルはLV内に適切に配置する必要があります。(5)経食道カテーテルは慎重に留置し、適切なペーシングを確保する必要があります。6)データ収集システムは注意して接続する必要があり、ゲイン値とオフセット値を適切に調整する必要があります。(7)コンダクタンス信号は、高張生理食塩水を使用して校正する必要があります。(8)フロープローブによる大動脈流量の適切な測定を検証する必要があります。(9)動物の健康状態は、ストレスや運動によって引き起こされるアーティファクトを最小限に抑えるために、手順全体を通して継続的に監視する必要があります。
麻酔の投与量を最適化することは、マウスで再現性のある高品質のPVループを得るために重要です。通常、800 mg / kgのウレタンと5〜10 mg / kgのエトミデートの用量が投与されます。.ただし、病的心不全の場合は、低用量の麻酔薬を投与することをお勧めします。処置中は、麻酔をかけた動物を温熱パッドの上にそっと置いて、37〜38°Cの温かい体温を維持することが不可欠です。体温の低下はHRの大幅な低下を引き起こす可能性があるため、これはマウスにとって特に重要です。さらに、心臓の適切な露出は、明確な視界を得て手順を容易にするために重要です。場合によっては、12本目から11本目の肋骨を切ると、心臓が露出することがあります。
挿管プロセスは、気管近くの頸動脈と迷走神経の損傷を避けるために慎重に行う必要があります。人工呼吸器の設定は、動物の体重に基づいて、以下の式を使用して調整する必要があります3。
一回換気量(Vt、mL)= 6.2 × W1.01 (W =体重、kg)
呼吸数(RR、min-1)= 53.5 × W-0.26
例えば、25 gマウスではVt = 149.4 μL、RR = 140/minです。
カ挿入の前に、静脈カテーテル(30 G針付き)を10%アルブミンで完全にプライミングし、脆弱な静脈壁の裂け目を防ぐために浅い角度で静脈に挿入する必要があります。正確な結果を得るためには、左心室(LV)内のコンダクタンスカテーテルの適切な配置が最も重要です。カテーテルはLVの縦軸に合わせ、すべての電極をLV流出路と心頂部の心内膜境界の間に配置する必要があります。ノッチのない安定したPVループは、静脈内閉塞、高張生理食塩水のキャリブレーション、経食道ペーシングなど、手順全体を通して取得する必要があります。生理食塩水のキャリブレーションでは、高張生理食塩水注入中にLV圧力が安定している必要があり、音量上昇信号の初期ウォッシュインフェーズ中のビートが使用されます(図5)。高張生理食塩水は、容量過多によって心臓機能を簡単に低下させる可能性があるため、20μLを超える高張生理食塩水を注入しないように注意する必要があります。食道から導入したペーシングカテーテルは、心房捕捉によって適切な位置にあることを確認し(図6)、刺激振幅を適切に調整する必要があります(通常3mA、パルス幅1ms)。より強い刺激を受けると、コンダクタンスカテーテルに影響し、揺れ状のPVループが発生します(図7)。
絶対体積を正確に計算するには、生理食塩水校正と大動脈流量校正の2種類の校正を利用する必要があります。コンダクタンスカテーテル技術では、心室腔内の血液プールからだけでなく、周囲の構造からも測定されたコンダクタンスを説明するために、平行コンダクタンス(Vp)オフセットの評価が必要です。この評価は、高張生理食塩水ボーラス注入の投与によって達成できます。.大動脈流量キャリブレーションは、大動脈流量の直接測定を可能にし、その結果、絶対ストローク量の決定を可能にします。ただし、この較正は絶対ストローク容積のみを提供し、絶対心室容積は提供しないことに留意すべきである。心室の絶対容積を得るには、生理食塩水校正と大動脈校正の両方を実行する必要があります。
この方法にはいくつかの制限があります。まず、コンダクタンスカテーテルを導入する際に経心尖的アプローチを採用しました。LV頂点にアクセスするには、心膜を切除する必要があります。これは、拡張期パラメータ、特に小児に影響を与える可能性があります。.第二に、長い処置時間の間にいくらかの血液が失われる可能性があり、それはまた心臓機能パラメータに影響を与える可能性がありますが、これらの問題は、処置に習熟することで回避できます。このプロトコルで利用されるHFpEFモデルは、肥満、糖尿病、高血圧、心房細動、多臓器不全など、関連する併存疾患に応じていくつかの表現型を持つ症候群であるヒトHFpEFを完全に再現していないことは注目に値します。これらすべての併存疾患を模倣する利用可能なマウスモデルはありません。しかし、ダブルヒットHFpEFマウスモデルは、代謝性併存疾患を有するヒトHFpEFに最も関連している10。マウスの遺伝的背景は拡張期機能に影響を与える可能性があります。C57BL/6Jマウスは、C57BL/6Nマウスと比較して、心血管ストレスに対する異なる反応と潜在的に軽度の疾患表現型を示すことが報告されていますが、このプロトコルでは、C57BL/6Jバックグラウンド5でも2ヒットモデルで拡張期障害が検出されており、これはマウスで通常採用されている他のモダリティでは難しい可能性があります。
この原稿は、HR関連の心機能を評価し、心不全の研究を進めるのに役立つ、ペーシング関連のPVループ手順を効果的に実行するためのガイダンスを提供することを目的としています。
開示事項
競合する金銭的利害関係はありません。
謝辞
本研究は、福田医療技術財団(E.T.、G.N.)および日本学術振興会科学研究費助成事業(E.T.)の研究助成を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture, sterlie | Alfresa Pharma Corporation, Osaka, Japan | 62-9965-57 | Surgical Supplies |
| 2-Fr tetrapolar electrode catheter | Fukuda Denshi, Japan and UNIQUE MEDICAL, Japan | custom-made | Surgical Supplies |
| Albumin Bovine Serum | Nacalai Tesque, Inc., Kyoto, Japan | 01859-47 | Miscellaneous |
| C57/BI6J mouse | Jackson Laboratory | animals | |
| Conductance catheter | Millar Instruments, Houston, TX | PVR 1035 | |
| Electrical cautery, Electrocautery Knife Kit | ellman-Japan,Osaka, Japan | 1-1861-21 | Surgical Supplies |
| Etomidate | Tokyo Chemical Industory Co., Ltd., Tokyo Japan | E0897 | Anesthetic |
| Grass Instrument S44G Square Pulse Stimulator | Astro-Med, West Warwick, RI | Pacing equipment | |
| Isoflurane | Viatris Inc., Tokyo, Japan | 8803998 | Anesthetic |
| Ivabradine | Tokyo Chemical Industory Co., Ltd., Tokyo Japan | I0847 | Miscellaneous |
| LabChart software | ADInstruments, Sydney, Australia | LabChart 7 | Hemodynamic equipment |
| MPVS Ultra | Millar Instruments, Houston, TX | PL3516B49 | Hemodynamic equipment |
| Pancronium bromide | Sigma Aldrich Co., St. Louis, MO | 15500-66-0 | Anesthetic |
| PE10 polyethylene tube | Bio Research Center Co. Ltd., Tokyo, Japan | 62101010 | Surgical Supplies |
| PowerLab 8/35 | ADInstruments, Sydney, Australia | PL3508/P | Hemodynamic equipment |
| PVR 1035 | Millar Instruments, Houston, TX | 842-0002 | Hemodynamic equipment |
| Urethane (Ethyl Carbamate) | Wako Pure Chemical Industries, Ltd., Osaka, Japan | 050-05821 | Anesthetic |
| Vascular Flow Probe | Transonic, Ithaca, NY | MA1PRB | Surgical Supplies |
参考文献
- Backhaus, S. J. Exercise stress real-time cardiac magnetic resonance imaging for noninvasive characterization of heart failure with preserved ejection fraction. Circulation. 143 (15), 1484-1498 (2021).
- Borlaug, B. A., Nishimura, R. A., Sorajja, P., Lam, C. S. P., Redfield, M. M. Exercise hemodynamics enhance diagnosis of early heart failure with preserved ejection fraction. Circulation. Heart Failure. 3 (5), 588-595 (2010).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Bátkai, S., David, A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nature Protocols. 3 (9), 1422-1434 (2008).
- Cingolani, O. H., Kass, D. A. Pressure-volume relation analysis of mouse ventricular function. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2198-2206 (2011).
- Numata, G., et al. A pacing-controlled protocol for frequency-diastolic relations distinguishes diastolic dysfunction specific to a mouse HFpEF model. American Journal of Physiology - Heart and Circulatory Physiology. 323 (3), H523-H527 (2022).
- Piña, I. L., et al. Exercise and heart failure. Circulation. 107 (8), 1210-1225 (2003).
- Georgakopoulos, D., Kass, D. A. Minimal force-frequency modulation of inotropy and relaxation of in situ murine heart. Journal of Physiology. 534 (2), 535-545 (2001).
- Takimoto, E., et al. Frequency- and afterload-dependent cardiac modulation in vivo by troponin I with constitutively active protein kinase A phosphorylation sites. Circulation Research. 94 (4), 496-504 (2004).
- Meyer, M., Lewinter, M. M. Heart rate and heart failure with preserved ejection fraction: Time to slow β-blocker use? Circulation. Heart Failure. 12 (8), 006213 (2019).
- Schiattarella, G. G., et al. Nitrosative stress drives heart failure with preserved ejection fraction. Nature. 568 (7752), 351-356 (2019).
- Abraham, D., Mao, L. Cardiac pressure-volume loop analysis using conductance catheters in mice. Journal of Visualized Experiments. (103), e52942 (2015).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch effect. Journal of Visualized Experiments. (100), e52618 (2015).
- Townsend, D. W. Measuring pressure volume loops in the mouse. Journal of Visualized Experiments. (111), e53810 (2016).
- Georgakopoulos, D., Kass, D. A. Estimation of parallel conductance by dual-frequency conductance catheter in mice. American Journal of Physiology - Heart and Circulatory Physiology. 279 (1), H47 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved