Method Article
用于评估小鼠心力衰竭模型心率依赖性舒张功能的起搏控制程序
摘要
本方案描述了通过经食管起搏获得压力-容积关系,这是评估心力衰竭小鼠模型舒张功能的宝贵工具。
摘要
射血分数保留型心力衰竭 (HFpEF) 是一种以舒张功能障碍和运动不耐受为特征的疾病。虽然运动应激血流动力学测试或 MRI 可用于检测舒张功能障碍和诊断人类的 HFpEF,但这种方式在使用小鼠模型的基础研究中受到限制。跑步机运动试验通常用于小鼠的此目的,但其结果会受到体重、骨骼肌力量和精神状态的影响。在这里,我们描述了一种心房起搏方案,用于检测舒张性能的心率(HR)依赖性变化,并验证其在HFpEF小鼠模型中的有用性。该方法包括麻醉、插管和进行压力-容积 (PV) 环分析,同时进行心房起搏。在这项工作中, 通过 左心室心尖入路插入电导导管,并在食管中放置心房起搏导管。在用伊伐布雷定减慢心率之前收集基线 PV 环。 通过 心房起搏以 400 bpm 至 700 bpm 的 HR 增量收集和分析 PV 环路。使用该协议,我们在代谢诱导的HFpEF模型中清楚地证明了HR依赖性舒张功能障碍。与对照组小鼠相比,弛豫时间常数(Tau)和舒张末期压力-容积关系(EDPVR)均随着HR的增加而恶化。总之,这种心房起搏控制方案可用于检测 HR 依赖性心功能障碍。它为研究HFpEF小鼠模型中舒张功能障碍的潜在机制提供了一种新方法,并可能有助于开发针对这种情况的新疗法。
引言
心力衰竭是全球住院和死亡的主要原因,射血分数保留型心力衰竭 (HFpEF) 约占所有心力衰竭诊断的 50%。HFpEF 的特征是舒张功能障碍和运动耐量受损,相关的血流动力学异常,如舒张功能障碍,可以通过运动应激血流动力学测试或 MRI 扫描 1,2 清楚地检测到。
然而,在实验模型中,用于评估与 HFpEF 相关的生理异常的可用模式是有限的 3,4。跑步机运动试验 (TMT) 用于确定跑步时间和距离,这可能反映运动应激心脏血流动力学;然而,这种方法容易受到体重、骨骼肌力量和精神状态等外来变量的干扰。
为了规避这些限制,我们设计了一种心房起搏方案,该方案根据心率 (HR) 检测舒张性能的细微但关键的变化,并验证了其在 HFpEF5 小鼠模型中的有用性。有几个生理因素会影响与运动相关的心脏功能,包括交感神经和儿茶酚胺反应、外周血管舒张、内皮反应和心率6.然而,其中,心率-压力关系(也称为鲍迪奇效应)被称为心脏生理特征的关键决定因素 7,8,9。
该方案涉及在基线时进行常规压力-容积分析,以评估收缩压和舒张功能,包括压力发展速率 (dp/dt)、收缩末期压力-容积关系 (ESPVR) 和舒张末期压力-容积关系 (EDPVR) 等参数。然而,应该注意的是,这些参数受心率的影响,由于动物的内在心率不同,心率可能因动物而异。此外,还应考虑麻醉对心率的影响。为了解决这个问题,通过与伊伐布雷定同时进行心房起搏来标准化心率,并以增量心率进行心脏参数测量。值得注意的是,HR依赖性心脏反应将HFpEF小鼠与对照组小鼠区分开来,而在基线PV环测量(使用固有心率)中未观察到显着差异5。
虽然这种起搏协议可能看起来相对复杂,但当它被充分理解时,它的成功率超过 90%。该协议将为研究HFpEF小鼠模型中舒张功能障碍的潜在机制提供有用的方法,并有助于开发针对这种情况的新疗法。
研究方案
该动物方案已获得机构动物护理和使用委员会的批准,并遵循东京大学动物实验和相关活动的规定。本研究以8-12周龄雄性C57/Bl6J小鼠为研究对象。这些动物是从商业来源获得的(见 材料表)。如前所述,通过与NG-硝基-L-精氨酸甲酯一起给予高脂肪饮食15周来建立HFpEF模型10。
1. 导管准备和压力/体积校准
- 将电导导管放入生理盐水中,并将其连接到由 PowerLab 8/35 和压力容积单元(MPVS 模块,参见 材料表)组成的模块上。
- 通过在 MPVS 模块 3,11 上记录预定压力(0 mmHg 和 100 mmHg)和体积参数(这些因 MPVS 模块而异)以电子方式校准压力和体积(另请参阅制造商的说明)。
2. 准备动物进行导尿
- 麻醉和通气
- 插管前 5-10 分钟腹膜内注射 5 mg/kg 依托咪酯和 500 mg/kg 氨基甲酸乙酯(见 材料表)。
注:聚氨酯虽然在动物研究中作为麻醉剂有效,但被怀疑对人类致癌。因此,当氨基甲酸乙酯是实现实验目标所必需的,并且没有替代剂足以满足时,必须谨慎处理。必须采取适当的保护措施,例如戴手套和口罩以及在准备过程中使用通风柜。作为一种可能的替代方法,可以使用氯胺酮(80 mg/kg,ip)。 - 将小鼠置于先前用2%异氟烷饱和的麻醉室中,并在麻醉诱导时将动物转移到保持在38°C至40°C之间的预热加热垫中。
- 剃除手术区域。然后,用三轮交替的甜菜碱和酒精对手术部位进行消毒。
- 在颈部做一个水平切口(1-2厘米),切除气管肌,露出气管。将手术 2-0 丝线缝合在气管下方,将其抬高,并做一个小切口(1-2 毫米)将其打开。
- 将气管插管插入气管,并将其连接到呼吸机,呼吸机提供 100% 氧气和 2% 异氟烷的混合物(后来减少到 0.5% 至 1%)。
- 插管前 5-10 分钟腹膜内注射 5 mg/kg 依托咪酯和 500 mg/kg 氨基甲酸乙酯(见 材料表)。
- 中心静脉 (CV) 导管插入和液体注入
- 找到胸锁乳突肌下方的颈内静脉3.
- 将中心静脉导管插入颈静脉,该导管由连接到30G针头的PE-10硅橡胶管(参见 材料表)组成。
- 在 3 分钟内推注 5-6 μL/g 体重的 10% 白蛋白/NaCl,然后以 5-10 μL/min 的恒定输注速率。
注意:此步骤对于预防麻醉引起的外周血管舒张引起的低血压至关重要。颈内静脉位于胸锁乳突肌和颈动脉之间,颜色比动脉深。
3. 左心室导管插入术(开胸入路)的外科手术
- 剃除麻醉小鼠的手术区域。然后,用三轮交替的甜菜碱和酒精对手术部位进行消毒。
- 通过捏脚趾来确认麻醉深度。然后,在剑突下方做一个水平切口(2-3厘米),并用钝剪刀将皮肤与胸壁分开。
- 使用电烧术在两侧横向切开胸壁(参见 材料表)。
- 通过切开横膈膜暴露心脏,然后用镊子轻轻地从心脏中取出心包。
- 将一根 27 G 针插入左心室 (LV) 的顶点,然后 通过 穿刺孔逆行将电导导管插入左心室。
- 调整导管位置,以获得方形压力-容积环。
- 通过检查下腔静脉 (IVC) 闭塞期间 PV 环的形状,验证当负荷条件发生变化时导管不会接触肌。
注意:充分的心脏暴露有助于手术并有助于获得清晰的视野。
4. 记录PV回路数据,确定收缩末期压力-容积关系(ESPVR)和舒张末期压力-容积关系(EDPVR)
注意:通过 IVC 闭塞减少预紧力可以确定 ESPVR 和 EDPVR。
- 在信号稳定后(插管后5-10分钟),使用LabChart软件(参见 材料表),PowerLab和MPVS模块记录和分析基线压力 - 体积(PV)回路。
- 通过用镊子按压IVC进行IVC闭塞,并在IVC闭塞期间记录至少20个心动周期的PV环。通过使用 LabChart 软件将曲线线拟合到 PV 环的收缩末点和 EDPVR 中,通过拟合一条曲线穿过 PV 环的舒张末期点来确定 ESPVR。
注意: 在 IVC 闭塞期间停止呼吸机以防止肺运动伪影。当肺运动过度时,泮库溴铵 (0.5-1 mg/kg) 等麻痹剂可能有帮助,只有在确认麻醉平面稳定后才应使用。
5.经食管起搏
- 将 2-Fr 四极电极导管插入食管,将导管连接到脉冲刺激器(参见 材料表),并确定心房捕获阈值(通常,刺激幅度为 3 mA,脉冲宽度为 1 ms)。
- 使用腹膜内给药的20mg / kg伊伐布雷定(参见 材料表)将HR减慢至400次/ min以下。
- 稳定后,以 400 次/分钟至 700 次/分钟的不同起搏率获取 20 个连续心动周期的 PV 循环,增量为 100 次/分钟;以每个起搏率获得超过 5 分钟的周期。
6. 生理盐水校准和主动脉血流校准
- 使呼吸机失活,并通过 CV 导管静脉注射 5-10 μL 高渗盐水溶液。
- 记录盐水注射过程中压力和体积的波动,并使用 PowerLab 3,11 计算 Vp 值。
- 重复盐水校准以提高准确性和可重复性。
- 将鼠标转到左侧,以免干扰音量信号。
- 在Th3至Th5之间朝向脊柱进行侧向开胸术,并用镊子轻轻解剖降主动脉的一小部分。
- 在主动脉上放置一个血管流量探头(参见 材料表)以测量心输出量。
注意:绝对容积的准确计算需要使用两种类型的校准:盐水校准和主动脉血流校准。重要的是要认识到与动物受试者高渗盐水输注相关的潜在风险,因为过量的盐负荷会导致收缩力下降。
7. 安乐死
- 研究结束后, 通过 颈椎脱位在麻醉剂过量下对小鼠实施安乐死。
注意:为确保生命功能完全停止,采用安乐死的辅助方法,例如在麻醉下放血,随后摘取心脏组织。
结果
基线PV环路数据如图1和表1所示。在基线(没有起搏的情况下),对照组和HFpEF小鼠之间的舒张期参数(如弛豫时间常数(Tau)、最小压力变化率(dP / dt min)和EDPVR没有显着差异。然而,HFpEF小鼠表现出更高的血压和动脉弹性(Ea),如图1所示,并在心室收缩期间表现出典型的山形PV环。这应与心室肌肉直接接触压力传感器引起的尖峰区分开来(图2)。重要的是,使用心房起搏,可以清楚地区分对照小鼠和HFpEF小鼠之间的舒张功能5(图3和图4)。在对照组中,Tau 和 EDPVR 均随着起搏率的增加而改善,而在 HFpEF 组中,Tau 和 EDPVR 均随着心房起搏的 HR 增加而恶化。
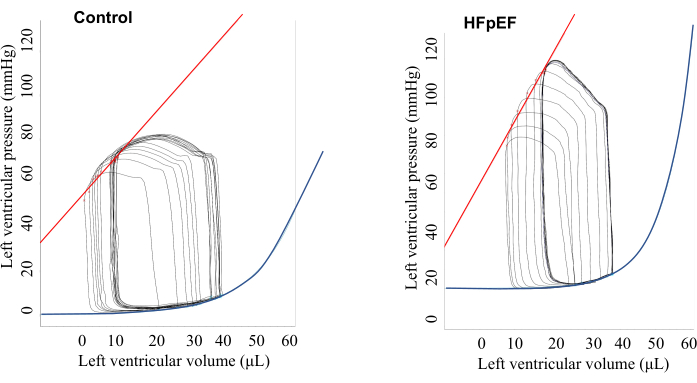
图 1:在没有起搏的情况下,基线时的代表性压力-体积关系,如屏幕截图所示。 结果显示,与对照组小鼠相比,HFpEF小鼠表现出更高的动脉弹性和心室压。 请点击这里查看此图的较大版本.

图 2:尖峰形 PV 回路的代表性图像。 这种类型的PV环形状是心室肌肉直接压缩压力传感器的结果(由橙色箭头显示),应从分析中排除,以保持结果的准确性。 请点击这里查看此图的较大版本.

图 3:代表性图表说明了射血分数保留的心力衰竭 (HFpEF) 模型小鼠和对照小鼠之间响应心房起搏的血流动力学参数差异。 该图表清楚地区分了两组,心率范围从每分钟 400 次到每分钟 700 次。缩写:LVP=左心室压;dP/dt = LVP 的一阶导数;EDPVR = 舒张末期压力-容积关系;LVV = 左心室容积;Tau = 弛豫时间常数。 请点击这里查看此图的较大版本.

图 4:压力-容积环分析中舒张压参数的血流动力学响应,以心率 (HR) 表示。在HFpEF模型小鼠中,舒张功能(Tau和EDPVR)随着心房起搏期间心率的增加而恶化。双因素方差分析显示,HFpEF(F = 28.95,p < 0.001)和HR(F = 3.035,p = 0.08644) 对EDPVR有显著的主效应,组与心率的交互作用显著(F = 3.938,p = 0.02454 )。 对于Tau,组(F = 25.56,p < 0.001)和HR(F = 0.1088,p = 0.7425 )有显著影响,组与心率之间有显著的交互作用(F = 3.461,p = 0.03759)。 数据显示为平均值±标准误差。n = 6 只小鼠/组。请点击这里查看此图的较大版本.

图 5:盐水校准程序的代表性图示。输注高渗盐水会改变血液的电导率,从而能够计算归因于周围心脏组织的信号分量。注射过程中血压应保持稳定,体积略有增加(如橙色箭头所示)。缩写:LVP=左心室压;LVV = 左心室容积 请点击这里查看此图的较大版本.

图 6:经食管起搏导管正确放置的代表性图示。 经食管起搏导管的正确放置可使 QRS 心律变窄。蓝色箭头表示正常的窦性心律,红色箭头表示心房起搏节律。请点击这里查看此图的较大版本.
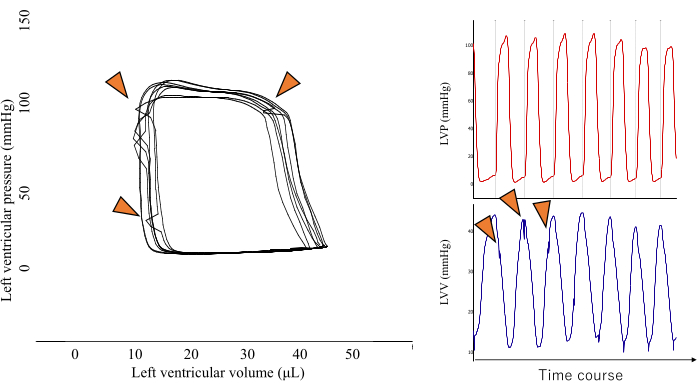
图 7:心房起搏中错误调整的刺激幅度的代表性图像,导致压力-容积环失真。 刺激强度在电导信号中引起不需要的运动伪影,描述为带有晃动线的 PV 回路(由箭头表示)。 请点击这里查看此图的较大版本.
| 对照 (n = 10) | HFpEF (n = 10) | p 值 | |
| 一氧化碳 (μL/min) | 12436.8 ± 938.4 | 10923.5 ± 1032.7 | 0.2897 |
| SV (微升) | 23.6 ± 1.85 | 20.5 ± 1.88 | 0.2515 |
| Ved (μl) | 37.6 ± 3.45 | 34.0 ± 1.32 | 0.4242 |
| PES (毫米汞柱) | 95.2 ± 3.56 | 109.3 ± 1.74 | 0.00032* |
| 钽 (mmHg) | 6.16 ± 1.53 | 6.95 ± 1.22 | 0.6889 |
| 心率(节拍/分钟) | 532.4 ± 20.8 | 534.0 ± 13.9 | 0.9505 |
| EF (%) | 66.5 ± 2.95 | 63.68 ± 2.37 | 0.4718 |
| 驿 (mmHg/μL) | 4.02 ± 0.30 | 5.90 ± 0.72 | 0.03224* |
| dP/dt 最大值 (mmHg/s) | 10812.1 ± 1042.9 | 9481.1 ± 262.02 | 0.2444 |
| dP/dt 最小值 (mmHg/s) | -9540.7 ± 748.9 | -9003.9 ± 320.0 | 0.5177 |
| Tau (毫秒) | 7.30 ± 0.50 | 8.02 ± 0.39 | 0.268 |
| ESPVR (毫米汞柱/μL) | 3.41 ± 0.51 | 4.69 ± 0.41 | 0.09147 |
| EDPVR (毫米汞柱/μL) | 0.096 ± 0.0061 | 0.103 ± 0.013 | 0.6103 |
表 1:对照组和 HFpEF 小鼠的基线心脏参数。 数据显示为平均值±标准误差;*P < 0.05 与 t 检验对照组相比。
讨论
我们提出了一种方法来评估压力-容积与经食管起搏应用的关系。运动不耐受是HFpEF的关键特征之一,但尚无技术可用于评估运动期间小鼠的心脏功能。我们的起搏方案为检测舒张功能障碍提供了有价值的工具,这在静息条件下可能并不明显。
为了获得准确和一致的质量的PV回路,必须仔细执行以下步骤3,4,5,7,8,11,12,13,14:(1)必须小心地麻醉动物,并且必须使用加热垫保持37-37.5°C的一致体温;(2)必须适当插管动物,有效控制通气;(3)必须确保静脉通路的正确放置;(4)电导导管必须正确定位在左心室内;(5)经食管导管放置应合理,起搏适当;6)数据采集系统必须小心连接,增益和偏移值必须适当调整;(7)电导信号应使用高渗盐水校准;(8)应验证用流量探头正确测量主动脉血流;(9) 在整个过程中应持续监测动物的健康状况,以尽量减少任何压力或运动引起的伪影。
优化麻醉剂量对于在小鼠中获得可重复和高质量的 PV 环至关重要。通常,施用剂量为 800 mg/kg 的氨基甲酸乙酯和 5-10 mg/kg 的依托咪酯。然而,在病理性心力衰竭的情况下,建议给予较低剂量的麻醉剂。在手术过程中,必须通过将麻醉的动物轻轻地放在加热垫上来保持37-38°C的温暖体温。这对小鼠尤其重要,因为体温下降会导致心率显着下降。此外,充分暴露心脏对于获得清晰的视野和促进手术至关重要。在某些情况下,切掉第 12 至第 11 根肋骨有助于暴露心脏。
插管过程应谨慎进行,以免损伤气管附近的颈动脉和迷走神经。呼吸机设置必须根据动物的体重使用提供的公式进行调整3:
潮气量 (Vt, mL) = 6.2 × W1.01 (W = 体重, kg)
呼吸频率 (RR, min−1) = 53.5 × W−0.26
例如,在 25 g 小鼠中,Vt = 149.4 μL,RR = 140/min。
插管前,静脉导管(用 30 G 针头)必须用 10% 白蛋白完全灌注,并以浅角度插入静脉,以防止脆弱的静脉壁撕裂。电导导管在左心室 (LV) 内的正确定位对于获得准确的结果至关重要。导管应与左心室纵轴对齐,所有电极均位于左心室流出道和心尖心内膜边界之间。在整个手术过程中,包括静脉闭塞、高渗盐水校准和经食管起搏期间,应获得无切迹的稳定 PV 环。在生理盐水校准中,在高渗盐水注射期间左心室压力应保持稳定,并使用容量上升信号的初始冲洗阶段的搏动(图5)。需要注意不要注射高于 20 μL 的高渗盐水,因为高渗盐水很容易因容量超负荷而抑制心脏功能。必须通过心房捕获确认通过食管引入的起搏导管处于正确位置(图 6),并适当调整刺激幅度(通常为 3 mA,脉冲宽度为 1 ms)。更强的刺激会影响电导导管并导致晃动形状的PV回路(图7)。
绝对容积的精确计算需要使用两种类型的校准:盐水校准和主动脉血流校准。电导导管技术需要评估平行电导 (Vp) 偏移量,以考虑不仅从心室内的血池测量的电导,而且从周围结构测量的电导。该评估可以通过高渗盐水推注来完成。主动脉血流校准可以直接测量主动脉血流,从而可以确定绝对每搏输出量。然而,应该注意的是,这种校准仅提供绝对每搏输出量,而不是绝对心室容量。为了获得绝对心室容积,必须同时进行生理盐水校准和主动脉校准。
此方法存在一些限制。首先,在引入电导导管时采用经心尖方法。为了进入左心室心尖,需要切除心包。这可能会影响舒张压参数,尤其是儿科。其次,在漫长的手术时间内可能会流失一些血液,这也可能会影响心脏功能参数,但这些问题可以通过更加熟练地进行手术来避免。值得注意的是,该协议中使用的HFpEF模型并不能完全复制人类HFpEF,HFpEF是一种具有多种表型的综合征,具体取决于相关的合并症,例如肥胖,糖尿病,高血压,心房颤动或多器官衰竭。没有可用的小鼠模型可以模拟所有这些合并症。然而,双命中 HFpEF 小鼠模型与具有代谢合并症的人 HFpEF 最相关10。小鼠的遗传背景可能影响舒张功能。虽然据报道,与C57BL / 6N小鼠相比,C57BL / 6J小鼠对心血管应激表现出不同的反应和潜在的较轻的疾病表型,但即使在C57BL / 6J背景5上,该协议也检测到了两次命中模型中的舒张功能障碍,这可能难以用于通常用于小鼠的其他模式。
本文旨在为有效实施起搏相关 PV 环程序提供指导,有助于评估 HR 相关心脏功能并推进心力衰竭的研究。
披露声明
没有相互竞争的经济利益。
致谢
这项工作得到了福田医疗技术基金会(ET和GN)和JSPS KAKENHI科学研究资助21K08047(ET)的研究资助。
材料
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture, sterlie | Alfresa Pharma Corporation, Osaka, Japan | 62-9965-57 | Surgical Supplies |
| 2-Fr tetrapolar electrode catheter | Fukuda Denshi, Japan and UNIQUE MEDICAL, Japan | custom-made | Surgical Supplies |
| Albumin Bovine Serum | Nacalai Tesque, Inc., Kyoto, Japan | 01859-47 | Miscellaneous |
| C57/BI6J mouse | Jackson Laboratory | animals | |
| Conductance catheter | Millar Instruments, Houston, TX | PVR 1035 | |
| Electrical cautery, Electrocautery Knife Kit | ellman-Japan,Osaka, Japan | 1-1861-21 | Surgical Supplies |
| Etomidate | Tokyo Chemical Industory Co., Ltd., Tokyo Japan | E0897 | Anesthetic |
| Grass Instrument S44G Square Pulse Stimulator | Astro-Med, West Warwick, RI | Pacing equipment | |
| Isoflurane | Viatris Inc., Tokyo, Japan | 8803998 | Anesthetic |
| Ivabradine | Tokyo Chemical Industory Co., Ltd., Tokyo Japan | I0847 | Miscellaneous |
| LabChart software | ADInstruments, Sydney, Australia | LabChart 7 | Hemodynamic equipment |
| MPVS Ultra | Millar Instruments, Houston, TX | PL3516B49 | Hemodynamic equipment |
| Pancronium bromide | Sigma Aldrich Co., St. Louis, MO | 15500-66-0 | Anesthetic |
| PE10 polyethylene tube | Bio Research Center Co. Ltd., Tokyo, Japan | 62101010 | Surgical Supplies |
| PowerLab 8/35 | ADInstruments, Sydney, Australia | PL3508/P | Hemodynamic equipment |
| PVR 1035 | Millar Instruments, Houston, TX | 842-0002 | Hemodynamic equipment |
| Urethane (Ethyl Carbamate) | Wako Pure Chemical Industries, Ltd., Osaka, Japan | 050-05821 | Anesthetic |
| Vascular Flow Probe | Transonic, Ithaca, NY | MA1PRB | Surgical Supplies |
参考文献
- Backhaus, S. J. Exercise stress real-time cardiac magnetic resonance imaging for noninvasive characterization of heart failure with preserved ejection fraction. Circulation. 143 (15), 1484-1498 (2021).
- Borlaug, B. A., Nishimura, R. A., Sorajja, P., Lam, C. S. P., Redfield, M. M. Exercise hemodynamics enhance diagnosis of early heart failure with preserved ejection fraction. Circulation. Heart Failure. 3 (5), 588-595 (2010).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Bátkai, S., David, A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nature Protocols. 3 (9), 1422-1434 (2008).
- Cingolani, O. H., Kass, D. A. Pressure-volume relation analysis of mouse ventricular function. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2198-2206 (2011).
- Numata, G., et al. A pacing-controlled protocol for frequency-diastolic relations distinguishes diastolic dysfunction specific to a mouse HFpEF model. American Journal of Physiology - Heart and Circulatory Physiology. 323 (3), H523-H527 (2022).
- Piña, I. L., et al. Exercise and heart failure. Circulation. 107 (8), 1210-1225 (2003).
- Georgakopoulos, D., Kass, D. A. Minimal force-frequency modulation of inotropy and relaxation of in situ murine heart. Journal of Physiology. 534 (2), 535-545 (2001).
- Takimoto, E., et al. Frequency- and afterload-dependent cardiac modulation in vivo by troponin I with constitutively active protein kinase A phosphorylation sites. Circulation Research. 94 (4), 496-504 (2004).
- Meyer, M., Lewinter, M. M. Heart rate and heart failure with preserved ejection fraction: Time to slow β-blocker use? Circulation. Heart Failure. 12 (8), 006213 (2019).
- Schiattarella, G. G., et al. Nitrosative stress drives heart failure with preserved ejection fraction. Nature. 568 (7752), 351-356 (2019).
- Abraham, D., Mao, L. Cardiac pressure-volume loop analysis using conductance catheters in mice. Journal of Visualized Experiments. (103), e52942 (2015).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch effect. Journal of Visualized Experiments. (100), e52618 (2015).
- Townsend, D. W. Measuring pressure volume loops in the mouse. Journal of Visualized Experiments. (111), e53810 (2016).
- Georgakopoulos, D., Kass, D. A. Estimation of parallel conductance by dual-frequency conductance catheter in mice. American Journal of Physiology - Heart and Circulatory Physiology. 279 (1), H47 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。