Method Article
Una procedura controllata dalla stimolazione per la valutazione delle funzioni diastoliche dipendenti dalla frequenza cardiaca in modelli murini di insufficienza cardiaca
In questo articolo
Riepilogo
Il presente protocollo descrive l'ottenimento della relazione pressione-volume attraverso la stimolazione transesofagea, che funge da strumento prezioso nella valutazione della funzione diastolica in modelli murini di insufficienza cardiaca.
Abstract
L'insufficienza cardiaca con frazione di eiezione conservata (HFpEF) è una condizione caratterizzata da disfunzione diastolica e intolleranza all'esercizio fisico. Mentre i test emodinamici da sforzo o la risonanza magnetica possono essere utilizzati per rilevare la disfunzione diastolica e diagnosticare l'HFpEF nell'uomo, tali modalità sono limitate nella ricerca di base che utilizza modelli murini. Un test da sforzo su tapis roulant è comunemente usato per questo scopo nei topi, ma i suoi risultati possono essere influenzati dal peso corporeo, dalla forza muscolare scheletrica e dallo stato mentale. Qui, descriviamo un protocollo di stimolazione atriale per rilevare i cambiamenti dipendenti dalla frequenza cardiaca (HR) nelle prestazioni diastoliche e convalidare la sua utilità in un modello murino di HFpEF. Il metodo prevede l'anestesia, l'intubazione e l'esecuzione dell'analisi del circuito pressione-volume (PV) in concomitanza con la stimolazione atriale. In questo lavoro, è stato inserito un catetere di conduttanza tramite un approccio apicale ventricolare sinistro e un catetere di stimolazione atriale è stato posizionato nell'esofago. I loop fotovoltaici al basale sono stati raccolti prima che l'HR fosse rallentato con ivabradina. I loop fotovoltaici sono stati raccolti e analizzati con incrementi di FC compresi tra 400 bpm e 700 bpm tramite stimolazione atriale. Utilizzando questo protocollo, abbiamo chiaramente dimostrato la compromissione diastolica HR-dipendente in un modello di HFpEF indotto metabolicamente. Sia la costante di tempo di rilassamento (Tau) che la relazione pressione-volume telediastolica (EDPVR) sono peggiorate con l'aumentare della frequenza cardiaca rispetto ai topi di controllo. In conclusione, questo protocollo controllato dalla stimolazione atriale è utile per rilevare le disfunzioni cardiache HR-dipendenti. Fornisce un nuovo modo per studiare i meccanismi alla base della disfunzione diastolica nei modelli murini di HFpEF e può aiutare a sviluppare nuovi trattamenti per questa condizione.
Introduzione
L'insufficienza cardiaca rappresenta una delle principali cause di ospedalizzazione e morte in tutto il mondo e l'insufficienza cardiaca con frazione di eiezione conservata (HFpEF) rappresenta circa il 50% di tutte le diagnosi di insufficienza cardiaca. L'HFpEF è caratterizzata da disfunzione diastolica e ridotta tolleranza all'esercizio fisico e le anomalie emodinamiche associate, come la disfunzione diastolica, possono essere chiaramente rilevate attraverso test emodinamici da sforzo o scansioni MRI 1,2.
Nei modelli sperimentali, tuttavia, le modalità disponibili per valutare le anomalie fisiologiche correlate all'HFpEF sono limitate 3,4. Il test da sforzo su tapis roulant (TMT) viene utilizzato per determinare il tempo di corsa e la distanza, che potrebbero riflettere l'emodinamica cardiaca da sforzo da sforzo; Tuttavia, questo metodo è suscettibile di interferenze da parte di variabili estranee come il peso corporeo, la forza muscolare scheletrica e lo stato mentale.
Per aggirare queste limitazioni, abbiamo ideato un protocollo di stimolazione atriale che rileva cambiamenti sottili ma cruciali nelle prestazioni diastoliche in base alla frequenza cardiaca (FC) e ne abbiamo convalidato l'utilità in un modello murino di HFpEF5. Diversi fattori fisiologici contribuiscono alla funzione cardiaca correlata all'esercizio, tra cui la risposta del nervo simpatico e delle catecolamine, la vasodilatazione periferica, la risposta endoteliale e la frequenza cardiaca6. Tra questi, tuttavia, la relazione HR-pressione (chiamata anche effetto Bowditch) è nota come determinante critico delle caratteristiche fisiologiche cardiache 7,8,9.
Il protocollo prevede l'esecuzione di un'analisi pressione-volume convenzionale al basale per valutare la funzione sistolica e diastolica, compresi parametri come la velocità di sviluppo della pressione (dp/dt), la relazione pressione-volume telesistolica (ESPVR) e la relazione pressione-volume telediastolica (EDPVR). Tuttavia, va notato che questi parametri sono influenzati dalla frequenza cardiaca, che può variare tra gli animali a causa delle differenze nella loro frequenza cardiaca intrinseca. Inoltre, dovrebbero essere considerati anche gli effetti dell'anestesia sulla frequenza cardiaca. Per affrontare questo problema, la frequenza cardiaca è stata standardizzata somministrando la stimolazione atriale in concomitanza con ivabradina e le misurazioni dei parametri cardiaci sono state eseguite a frequenze cardiache incrementali. In particolare, la risposta cardiaca dipendente dall'HR ha distinto i topi HFpEF dai topi del gruppo di controllo, mentre non sono state osservate differenze significative nelle misurazioni del loop PV al basale (utilizzando la frequenza cardiaca intrinseca)5.
Sebbene questo protocollo di stimolazione possa sembrare relativamente complicato, il suo tasso di successo supera il 90% quando è ben compreso. Questo protocollo fornirebbe un modo utile per studiare i meccanismi alla base della disfunzione diastolica nei modelli murini di HFpEF e aiuterebbe nello sviluppo di nuovi trattamenti per questa condizione.
Protocollo
Questo protocollo sugli animali è stato approvato dal Comitato Istituzionale per la Cura e l'Uso degli Animali e ha seguito i regolamenti per gli esperimenti sugli animali e le attività correlate presso l'Università di Tokyo. Per il presente studio sono stati utilizzati topi maschi C57/Bl6J di età compresa tra 8 e 12 settimane. Gli animali sono stati ottenuti da una fonte commerciale (vedi la tabella dei materiali). Un modello di HFpEF è stato stabilito somministrando una dieta ricca di grassi per 15 settimane in combinazione con l'estere metilico NG-nitro-L-arginina, come descritto in precedenza10.
1. Preparazione del catetere e calibrazione pressione/volume
- Posizionare un catetere di conduttanza in soluzione fisiologica normale e collegarlo a un modulo composto da PowerLab 8/35 e da un'unità di pressione-volume (modulo MPVS, vedere la tabella dei materiali).
- Calibrare elettronicamente la pressione e il volume attraverso la registrazione dei parametri di pressione (0 mmHg e 100 mmHg) e volume predeterminati (che variano tra i moduli MPVS) sul modulo MPVS 3,11 (vedere anche le istruzioni del produttore).
2. Preparazione di un animale per il cateterismo
- Anestesia e ventilazione
- Somministrare un'iniezione intraperitoneale di 5 mg/kg di etomidato e 500 mg/kg di uretano (vedere la tabella dei materiali) 5-10 minuti prima dell'intubazione.
NOTA: L'uretano, sebbene efficace come agente anestetico negli studi sugli animali, è sospettato di essere cancerogeno per l'uomo. Pertanto, quando l'uretano è necessario per il raggiungimento degli obiettivi sperimentali e non sono sufficienti agenti alternativi, deve essere maneggiato con cautela. Sono obbligatorie misure di protezione adeguate, come l'uso di guanti e maschere e l'utilizzo di una cappa aspirante durante la preparazione. Come possibile alternativa, potrebbe essere impiegata la ketamina (80 mg/kg, ip). - Posizionare il topo in una camera di anestesia precedentemente saturata con isoflurano al 2% e trasferire l'animale in un termoforo preriscaldato mantenuto tra 38 °C e 40 °C dopo l'induzione dell'anestesia.
- Radere l'area chirurgica. Quindi, disinfettare il sito chirurgico con tre cicli alternati di betadine e alcol.
- Praticare un'incisione orizzontale (1-2 cm) nel collo, asportare il muscolo tracheale ed esporre la trachea. Passare una sutura chirurgica di seta 2-0 sotto la trachea, sollevarla e praticare una piccola incisione (1-2 mm) per aprirla.
- Inserire un tubo endotracheale nella trachea e collegarlo a un ventilatore che eroga una miscela di ossigeno al 100% e isoflurano al 2% (ridotta allo 0,5% all'1% in seguito).
- Somministrare un'iniezione intraperitoneale di 5 mg/kg di etomidato e 500 mg/kg di uretano (vedere la tabella dei materiali) 5-10 minuti prima dell'intubazione.
- Inserimento del catetere venoso centrale (CV) e iniezione di fluido
- Localizzare la vena giugulare interna sotto il muscolo sternocleidomastoideo3.
- Inserire il catetere venoso centrale, costituito da un tubo silastico in PE-10 (vedere la tabella dei materiali) collegato a un ago da 30 G, nella vena giugulare.
- Somministrare un'infusione in bolo di 5-6 μL/g di peso corporeo al 10% di albumina/NaCl nell'arco di 3 minuti, seguita da una velocità di infusione costante di 5-10 μL/min.
NOTA: Questo passaggio è fondamentale per prevenire l'ipotensione derivante dalla vasodilatazione periferica causata dall'anestesia. La vena giugulare interna si trova tra il muscolo sternocleidomastoideo e l'arteria carotide e appare di colore più scuro rispetto all'arteria.
3. Procedura chirurgica per cateterismo ventricolare sinistro (approccio a torace aperto)
- Rasare l'area chirurgica del topo anestetizzato. Quindi, disinfettare il sito chirurgico con tre cicli alternati di betadine e alcol.
- Confermare la profondità dell'anestesia eseguendo un pizzicamento delle dita dei piedi. Quindi, fai un'incisione orizzontale (2-3 cm) sotto il processo xifoideo e separa la pelle dalla parete toracica usando forbici smussate.
- Tagliare lateralmente la parete toracica su entrambi i lati utilizzando cauterizzazione elettrica (vedere la tabella dei materiali).
- Esporre il cuore tagliando il diaframma e rimuovere delicatamente il pericardio dal cuore usando una pinza.
- Inserire un ago da 27 G nell'apice del ventricolo sinistro (LV) e inserire retrogradamente un catetere di conduttanza nel LV attraverso il foro di puntura.
- Regolare la posizione del catetere in modo da ottenere un circuito pressione-volume di forma quadrata.
- Verificare che il catetere non entri in contatto con il muscolo papillare quando si verificano cambiamenti nelle condizioni di carico controllando la forma dell'ansa PV durante l'occlusione della vena cava inferiore (IVC).
NOTA: Un'adeguata esposizione del cuore facilita la procedura e aiuta a ottenere una visione chiara.
4. Registrazione dei dati del circuito fotovoltaico e determinazione della relazione pressione-volume telesistolico (ESPVR) e della relazione pressione-volume telediastolica (EDPVR)
NOTA: La riduzione del precarico mediante occlusione IVC consente la determinazione dell'ESPVR e dell'EDPVR.
- Registra e analizza il loop pressione-volume (PV) di base con il software LabChart (vedi la Tabella dei Materiali), PowerLab e il modulo MPVS dopo la stabilizzazione del segnale (5-10 minuti dopo la canulazione).
- Eseguire l'occlusione IVC comprimendo l'IVC con una pinza e registrare l'ansa PV per almeno 20 cicli cardiaci durante l'occlusione IVC. Determinare l'ESPVR inserendo una linea di regressione lineare attraverso i punti terminali sistolici dell'ansa FV e l'EDPVR inserendo una linea curvilinea attraverso i punti diastolici terminali dell'ansa FV utilizzando il software LabChart.
NOTA: Arrestare il ventilatore durante l'occlusione dell'IVC per prevenire artefatti da movimento polmonare. Un agente paralitico come il pancuronio (0,5-1 mg/kg) può essere utile quando il movimento polmonare è eccessivo e deve essere utilizzato solo dopo aver confermato un piano anestetico stabile.
5. Stimolazione transesofagea
- Inserire un catetere con elettrodo tetrapolare 2-Fr nell'esofago, collegare il catetere a uno stimolatore di impulsi (vedere la tabella dei materiali) e determinare la soglia di cattura atriale (normalmente, l'ampiezza dello stimolo è di 3 mA e l'ampiezza dell'impulso è di 1 ms).
- Rallentare la frequenza cardiaca al di sotto di 400 battiti/min utilizzando 20 mg/kg di ivabradina (vedere la tabella dei materiali) somministrata per via intraperitoneale.
- Dopo la stabilizzazione, acquisire 20 cicli cardiaci continui di loop PV a diverse frequenze di stimolazione da 400 battiti/min a 700 battiti/min, con un incremento di 100 battiti/min; Acquisisci i cicli nell'arco di 5 minuti ad ogni velocità di stimolazione.
6. Calibrazione salina e calibrazione del flusso aortico
- Inattivare il ventilatore e somministrare 5-10 μL di soluzione salina ipertonica per via endovenosa attraverso il catetere cardiovascolare.
- Documentare le fluttuazioni di pressione e volume durante l'iniezione salina e calcolare il valore Vp utilizzando PowerLab 3,11.
- Ripetere la calibrazione della soluzione salina per migliorare l'accuratezza e la riproducibilità.
- Ruotare il mouse sul lato sinistro per non disturbare il segnale del volume.
- Eseguire una toracotomia laterale tra Th3 e Th5 verso la colonna vertebrale e sezionare delicatamente una piccola parte dell'aorta discendente con una pinza.
- Posizionare una sonda di flusso vascolare (vedere la tabella dei materiali) sopra l'aorta per misurare la gittata cardiaca.
NOTA: Il calcolo accurato del volume assoluto richiede l'utilizzo di due tipi di calibrazione: calibrazione salina e calibrazione del flusso aortico. È importante riconoscere i potenziali rischi associati a un'infusione salina ipertonica nei soggetti animali, poiché un eccessivo carico di sale può comportare un calo della contrattilità.
7. Eutanasia
- Dopo lo studio, sopprimere i topi sotto un sovradosaggio di anestetico tramite lussazione cervicale.
NOTA: Per garantire la completa cessazione della funzione vitale, viene impiegato un metodo secondario di eutanasia, come il dissanguamento in anestesia con successivo prelievo di tessuto cardiaco.
Risultati
I dati del circuito fotovoltaico di base sono visualizzati nella Figura 1 e nella Tabella 1. Al basale (in assenza di stimolazione), non ci sono state differenze significative nei parametri diastolici come la costante di tempo di rilassamento (Tau), la velocità minima di variazione della pressione (dP/dt min) e l'EDPVR tra i topi di controllo e HFpEF. Tuttavia, i topi HFpEF hanno mostrato una pressione sanguigna e un'elastanza arteriosa (Ea) più elevate, come mostrato nella Figura 1, e hanno dimostrato un tipico loop PV a forma di montagna durante la sistole ventricolare. Questo dovrebbe essere distinto da un picco causato dal contatto diretto del muscolo ventricolare sul trasduttore di pressione (Figura 2). È importante sottolineare che, utilizzando la stimolazione atriale, la funzione diastolica potrebbe essere chiaramente distinta tra i topi di controllo e i topi HFpEF5 (Figura 3 e Figura 4). Nel gruppo di controllo, sia la Tau che l'EDPVR sono migliorate con l'aumentare della velocità di stimolazione, mentre, nel gruppo HFpEF, sia la Tau che l'EDPVR sono peggiorate con l'aumento della frequenza cardiaca con la stimolazione atriale.
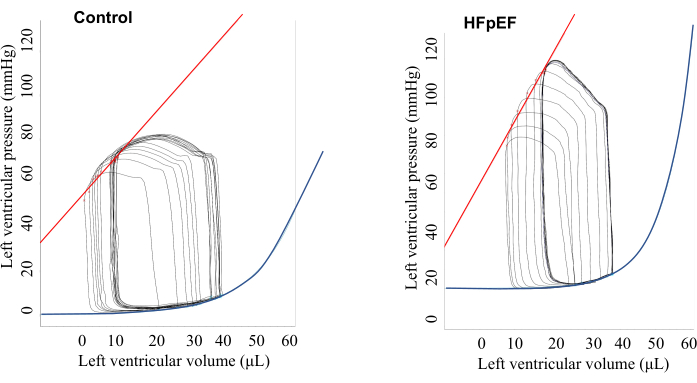
Figura 1: Relazione rappresentativa pressione-volume al basale in assenza di stimolazione, illustrata in uno screenshot. I risultati hanno mostrato che i topi HFpEF mostravano una maggiore elastenza arteriosa e pressione ventricolare rispetto ai topi di controllo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Un'immagine rappresentativa di un circuito fotovoltaico a forma di punta. Questo tipo di forma ad anello PV è il risultato della compressione diretta del trasduttore di pressione da parte del muscolo ventricolare (mostrato dalla punta della freccia arancione) e deve essere escluso dall'analisi per mantenere l'accuratezza dei risultati. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Grafico rappresentativo che illustra le differenze nei parametri emodinamici in risposta alla stimolazione atriale tra i topi modello di insufficienza cardiaca con frazione di eiezione preservata (HFpEF) e i topi di controllo. Il grafico distingue chiaramente tra i due gruppi, con la frequenza cardiaca che varia da 400 battiti al minuto a 700 battiti al minuto. Abbreviazioni: LVP = pressione ventricolare sinistra; dP/dt = derivata prima di LVP; EDPVR = rapporto pressione-volume end-diastolica; LVV = volume ventricolare sinistro; Tau = costante del tempo di rilassamento. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: La risposta emodinamica dei parametri diastolici dall'analisi del loop pressione-volume rappresentata in termini di frequenza cardiaca (FC). Nei topi modello HFpEF, la funzione diastolica (Tau e EDPVR) si è deteriorata con l'aumento della frequenza cardiaca durante la stimolazione atriale. L'analisi ANOVA bidirezionale ha mostrato un effetto principale significativo di HFpEF (F = 28,95, p < 0,001) e HR (F = 3,035, p = 0,08644) sull'EDPVR, nonché un significativo effetto di interazione tra gruppo e frequenza cardiaca (F = 3,938, p = 0,02454). Per Tau, c'è stato un effetto significativo del gruppo (F = 25,56, p < 0,001) e HR (F = 0,1088, p = 0,7425), nonché un significativo effetto di interazione tra gruppo e frequenza cardiaca (F = 3,461, p = 0,03759). I dati vengono visualizzati come media ± errore standard. n = 6 topi/gruppo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Illustrazione rappresentativa della procedura di calibrazione della soluzione fisiologica. L'infusione di soluzione fisiologica ipertonica altera la conducibilità elettrica del sangue, consentendo così il calcolo della componente di segnale attribuita al tessuto cardiaco circostante. La pressione arteriosa deve rimanere stabile durante l'iniezione, con un leggero aumento di volume (mostrato nella freccia arancione). Abbreviazioni: LVP = pressione ventricolare sinistra; LVV = volume ventricolare sinistro Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Illustrazione rappresentativa del corretto posizionamento del catetere per stimolazione transesofagea. Il corretto posizionamento del catetere per stimolazione transesofagea consente un ritmo QRS stretto. Le frecce blu rappresentano un ritmo sinusale normale e le frecce rosse mostrano il ritmo del ritmo atriale. Fare clic qui per visualizzare una versione più grande di questa figura.
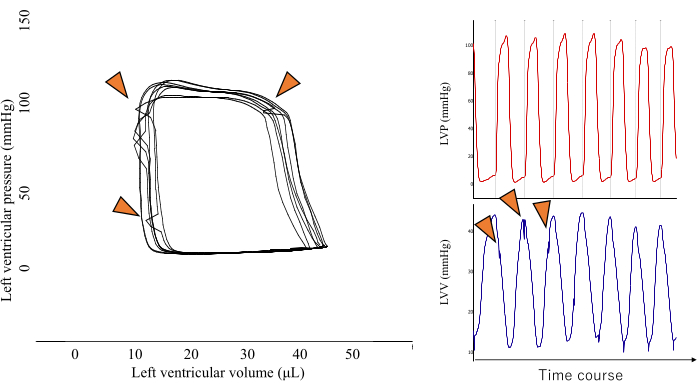
Figura 7: Immagine rappresentativa di un'ampiezza dello stimolo regolata in modo errato nella stimolazione atriale, con conseguente distorsione del ciclo pressione-volume. L'intensità della stimolazione ha indotto artefatti di movimento indesiderati nel segnale di conduttanza, raffigurato come il circuito fotovoltaico con una linea di scuotimento (indicata dalle frecce). Fare clic qui per visualizzare una versione più grande di questa figura.
| Controllo (n = 10) | HFpEF (n = 10) | valore p | |
| CO (μL/min) | 12436.8 ± 938.4 | 10923.5 ± 1032.7 | 0.2897 |
| SV (μL) | 23,6 ± 1,85 | 20,5 ± 1,88 | 0.2515 |
| Ved (μl) | 37,6 ± 3,45 | 34,0 ± 1,32 | 0.4242 |
| Pes (mmHg) | 95,2 ± 3,56 | 109,3 ± 1,74 | 0.00032* |
| Ped (mmHg) | 6.16 ± 1.53 | 6.95 ± 1.22 | 0.6889 |
| FC (battito/min) | 532,4 ± 20,8 | 534.0 ± 13.9 | 0.9505 |
| EF (%) | 66,5 ± 2,95 | 63,68 ± 2,37 | 0.4718 |
| Ea (mmHg/μL) | 4.02 ± 0.30 | 5.90 ± 0.72 | 0.03224* |
| dP/dt max (mmHg/s) | 10812.1 ± 1042.9 | 9481.1 ± 262.02 | 0.2444 |
| dP/dt min (mmHg/s) | -9540,7 ± 748,9 | -9003,9 ± 320,0 | 0.5177 |
| Tau (ms) | 7.30 ± 0.50 | 8.02 ± 0.39 | 0.268 |
| ESPVR (mmHg/μL) | 3,41 ± 0,51 | 4.69 ± 0.41 | 0.09147 |
| EDPVR (mmHg/μL) | 0,096 ± 0,0061 | 0,103 ± 0,013 | 0.6103 |
Tabella 1: Parametri cardiaci basali nei topi di controllo e HFpEF. I dati vengono visualizzati come media ± errore standard; *P < 0,05 rispetto al controllo del test T.
Discussione
Presentiamo una metodologia per valutare le relazioni pressione-volume con l'applicazione della stimolazione transesofagea. L'intolleranza all'esercizio fisico è una delle caratteristiche chiave dell'HFpEF, ma non sono disponibili tecniche per la valutazione della funzione cardiaca nei topi durante l'esercizio. Il nostro protocollo di stimolazione offre uno strumento prezioso per rilevare la disfunzione diastolica, che potrebbe non essere evidente in condizioni di riposo.
Per ottenere un circuito fotovoltaico di qualità accurata e costante, è necessario eseguire meticolosamente i seguenti passaggi 3,4,5,7,8,11,12,13,14: (1) gli animali devono essere anestetizzati con cura e deve essere mantenuta una temperatura corporea costante di 37-37,5 °C utilizzando un termoforo; (2) gli animali devono essere intubati in modo appropriato e la ventilazione deve essere controllata in modo efficace; (3) deve essere garantito il corretto posizionamento dell'accesso endovenoso; (4) il catetere di conduttanza deve essere posizionato correttamente all'interno del ventricolo sinistro; (5) il catetere transesofageo deve essere posizionato con giudizio e deve essere assicurata una stimolazione adeguata; 6) il sistema di acquisizione dati deve essere collegato con cura e i valori di guadagno e offset devono essere regolati in modo appropriato; (7) i segnali di conduttanza devono essere calibrati utilizzando soluzione salina ipertonica; (8) deve essere verificata la corretta misurazione del flusso aortico con una sonda di flusso; (9) Il benessere degli animali deve essere continuamente monitorato durante tutta la procedura per ridurre al minimo eventuali artefatti indotti da stress o movimento.
L'ottimizzazione della dose di anestesia è fondamentale per ottenere un ciclo fotovoltaico riproducibile e di alta qualità nei topi. In genere, viene somministrata una dose di 800 mg/kg di uretano e 5-10 mg/kg di etomidato. Tuttavia, in caso di scompenso cardiaco patologico, è consigliabile somministrare una dose inferiore di anestetico. Durante la procedura, è essenziale mantenere una temperatura corporea calda di 37-38 °C posizionando delicatamente l'animale anestetizzato su un termoforo. Questo è particolarmente importante per i topi perché un calo della temperatura corporea può causare una significativa diminuzione della frequenza cardiaca. Inoltre, un'adeguata esposizione del cuore è fondamentale per ottenere una visione chiara e facilitare la procedura. In alcuni casi, tagliare le costole dal 12° all'11° può essere utile per esporre il cuore.
Il processo di intubazione deve essere eseguito con cautela per evitare danni alle arterie carotidi e ai nervi vaghi vicino alla trachea. L'impostazione del ventilatore deve essere regolata in base al peso corporeo dell'animale utilizzando le formule fornite3:
Volume corrente (Vt, mL) = 6,2 × W1,01 (W = peso corporeo, kg)
Frequenza respiratoria (RR, min−1) = 53,5 × W−0,26
Ad esempio, Vt = 149,4 μL, RR = 140/min in un topo da 25 g.
Prima della canulazione, il catetere venoso (con un ago da 30 G) deve essere completamente innescato con albumina al 10% e inserito nella vena con un angolo poco profondo per evitare la lacerazione delle fragili pareti venose. Il corretto posizionamento del catetere di conduttanza all'interno del ventricolo sinistro (LV) è fondamentale per ottenere risultati accurati. Il catetere deve essere allineato con l'asse longitudinale del ventricolo sinistro, con tutti gli elettrodi posizionati tra il tratto di efflusso del ventricolo sinistro e il bordo endocardico apicale. Un loop FV stabile senza tacche deve essere ottenuto durante l'intera procedura, anche durante l'occlusione endovenosa, la calibrazione della soluzione salina ipertonica e la stimolazione transesofagea. Nella calibrazione salina, le pressioni del ventricolo sinistro devono essere stabili durante l'iniezione salina ipertonica e vengono utilizzati i battiti durante la fase iniziale di lavaggio dei segnali di volume crescente (Figura 5). Bisogna fare attenzione a non iniettare volumi di soluzione fisiologica ipertonica superiori a 20 μL perché la soluzione salina ipertonica potrebbe facilmente deprimere la funzione cardiaca a causa del sovraccarico di volume. Il catetere di stimolazione introdotto attraverso l'esofago deve essere confermato nella posizione corretta attraverso la cattura atriale (Figura 6) e l'ampiezza dello stimolo deve essere regolata in modo appropriato (di solito 3 mA, con un'ampiezza dell'impulso di 1 ms). Una stimolazione più forte influenzerebbe il catetere di conduttanza e causerebbe un loop fotovoltaico a forma di scuotimento (Figura 7).
Il calcolo accurato del volume assoluto richiede l'utilizzo di due tipi di calibrazione: la calibrazione salina e la calibrazione del flusso aortico. La tecnica del catetere a conduttanza richiede una valutazione dell'offset della conduttanza parallela (Vp) per tenere conto della conduttanza misurata non solo dal pool sanguigno all'interno della cavità ventricolare, ma anche dalle strutture circostanti. Questa valutazione può essere effettuata attraverso la somministrazione di un'infusione di bolo salino ipertonico. La calibrazione del flusso aortico consente la misurazione diretta del flusso aortico, che, a sua volta, consente la determinazione del volume sistolico assoluto. Tuttavia, va notato che questa calibrazione fornisce solo il volume sistolico assoluto e non il volume ventricolare assoluto. Per ottenere il volume ventricolare assoluto, è necessario eseguire sia la calibrazione salina che la calibrazione aortica.
Esistono alcune limitazioni a questo metodo. In primo luogo, è stato utilizzato un approccio transapicale durante l'introduzione del catetere di conduttanza. Per accedere all'apice del ventricolo sinistro, il pericardio deve essere rimosso. Questo potrebbe influenzare i parametri diastolici, soprattutto quelli pediatrici. In secondo luogo, un po' di sangue potrebbe essere perso durante il lungo periodo di procedura, il che potrebbe anche influenzare i parametri funzionali cardiaci, ma questi problemi possono essere evitati diventando più abili nelle procedure. Vale la pena notare che il modello HFpEF utilizzato in questo protocollo non replica completamente l'HFpEF umano, che è una sindrome con diversi fenotipi a seconda delle comorbidità associate, come obesità, diabete mellito, ipertensione, fibrillazione atriale o insufficienza multiorgano. Non esiste un modello murino disponibile che riproduca tutte queste comorbidità. Il modello murino HFpEF double-hit, tuttavia, è più rilevante per l'HFpEF umano con comorbidità metaboliche10. Il background genetico dei topi potrebbe influenzare la funzione diastolica. Mentre è stato riportato che i topi C57BL/6J mostrano risposte differenziali allo stress cardiovascolare e un fenotipo di malattia potenzialmente più lieve rispetto ai topi C57BL/6N, questo protocollo ha rilevato una compromissione diastolica nel modello a due colpi anche sul background C57BL/6J5, che potrebbe essere difficile con altre modalità solitamente impiegate nei topi.
Questo manoscritto ha lo scopo di fornire una guida per l'esecuzione efficace delle procedure di loop PV associate alla stimolazione, che possono essere utili per valutare la funzione cardiaca associata all'HR e far progredire la ricerca sull'insufficienza cardiaca.
Divulgazioni
Non ci sono interessi finanziari in competizione.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni di ricerca della Fukuda Foundation for Medical Technology (a E.T. e G. N.) e dal JSPS KAKENHI Scientific Research Grant-in-Aid 21K08047 (a E.T.).
Materiali
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture, sterlie | Alfresa Pharma Corporation, Osaka, Japan | 62-9965-57 | Surgical Supplies |
| 2-Fr tetrapolar electrode catheter | Fukuda Denshi, Japan and UNIQUE MEDICAL, Japan | custom-made | Surgical Supplies |
| Albumin Bovine Serum | Nacalai Tesque, Inc., Kyoto, Japan | 01859-47 | Miscellaneous |
| C57/BI6J mouse | Jackson Laboratory | animals | |
| Conductance catheter | Millar Instruments, Houston, TX | PVR 1035 | |
| Electrical cautery, Electrocautery Knife Kit | ellman-Japan,Osaka, Japan | 1-1861-21 | Surgical Supplies |
| Etomidate | Tokyo Chemical Industory Co., Ltd., Tokyo Japan | E0897 | Anesthetic |
| Grass Instrument S44G Square Pulse Stimulator | Astro-Med, West Warwick, RI | Pacing equipment | |
| Isoflurane | Viatris Inc., Tokyo, Japan | 8803998 | Anesthetic |
| Ivabradine | Tokyo Chemical Industory Co., Ltd., Tokyo Japan | I0847 | Miscellaneous |
| LabChart software | ADInstruments, Sydney, Australia | LabChart 7 | Hemodynamic equipment |
| MPVS Ultra | Millar Instruments, Houston, TX | PL3516B49 | Hemodynamic equipment |
| Pancronium bromide | Sigma Aldrich Co., St. Louis, MO | 15500-66-0 | Anesthetic |
| PE10 polyethylene tube | Bio Research Center Co. Ltd., Tokyo, Japan | 62101010 | Surgical Supplies |
| PowerLab 8/35 | ADInstruments, Sydney, Australia | PL3508/P | Hemodynamic equipment |
| PVR 1035 | Millar Instruments, Houston, TX | 842-0002 | Hemodynamic equipment |
| Urethane (Ethyl Carbamate) | Wako Pure Chemical Industries, Ltd., Osaka, Japan | 050-05821 | Anesthetic |
| Vascular Flow Probe | Transonic, Ithaca, NY | MA1PRB | Surgical Supplies |
Riferimenti
- Backhaus, S. J. Exercise stress real-time cardiac magnetic resonance imaging for noninvasive characterization of heart failure with preserved ejection fraction. Circulation. 143 (15), 1484-1498 (2021).
- Borlaug, B. A., Nishimura, R. A., Sorajja, P., Lam, C. S. P., Redfield, M. M. Exercise hemodynamics enhance diagnosis of early heart failure with preserved ejection fraction. Circulation. Heart Failure. 3 (5), 588-595 (2010).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Bátkai, S., David, A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nature Protocols. 3 (9), 1422-1434 (2008).
- Cingolani, O. H., Kass, D. A. Pressure-volume relation analysis of mouse ventricular function. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2198-2206 (2011).
- Numata, G., et al. A pacing-controlled protocol for frequency-diastolic relations distinguishes diastolic dysfunction specific to a mouse HFpEF model. American Journal of Physiology - Heart and Circulatory Physiology. 323 (3), H523-H527 (2022).
- Piña, I. L., et al. Exercise and heart failure. Circulation. 107 (8), 1210-1225 (2003).
- Georgakopoulos, D., Kass, D. A. Minimal force-frequency modulation of inotropy and relaxation of in situ murine heart. Journal of Physiology. 534 (2), 535-545 (2001).
- Takimoto, E., et al. Frequency- and afterload-dependent cardiac modulation in vivo by troponin I with constitutively active protein kinase A phosphorylation sites. Circulation Research. 94 (4), 496-504 (2004).
- Meyer, M., Lewinter, M. M. Heart rate and heart failure with preserved ejection fraction: Time to slow β-blocker use? Circulation. Heart Failure. 12 (8), 006213 (2019).
- Schiattarella, G. G., et al. Nitrosative stress drives heart failure with preserved ejection fraction. Nature. 568 (7752), 351-356 (2019).
- Abraham, D., Mao, L. Cardiac pressure-volume loop analysis using conductance catheters in mice. Journal of Visualized Experiments. (103), e52942 (2015).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch effect. Journal of Visualized Experiments. (100), e52618 (2015).
- Townsend, D. W. Measuring pressure volume loops in the mouse. Journal of Visualized Experiments. (111), e53810 (2016).
- Georgakopoulos, D., Kass, D. A. Estimation of parallel conductance by dual-frequency conductance catheter in mice. American Journal of Physiology - Heart and Circulatory Physiology. 279 (1), H47 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon