Method Article
Ein schrittmachergesteuertes Verfahren zur Beurteilung herzfrequenzabhängiger diastolischer Funktionen in murinen Herzinsuffizienzmodellen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die Bestimmung der Druck-Volumen-Beziehung durch transösophageale Stimulation, die als wertvolles Werkzeug zur Beurteilung der diastolischen Funktion in Mausmodellen der Herzinsuffizienz dient.
Zusammenfassung
Die Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) ist eine Erkrankung, die durch diastolische Dysfunktion und Belastungsintoleranz gekennzeichnet ist. Während belastungsbelastete hämodynamische Tests oder MRT verwendet werden können, um diastolische Funktionsstörungen zu erkennen und HFpEF beim Menschen zu diagnostizieren, sind solche Modalitäten in der Grundlagenforschung mit Mausmodellen begrenzt. Ein Laufband-Belastungstest wird häufig zu diesem Zweck bei Mäusen verwendet, aber seine Ergebnisse können durch das Körpergewicht, die Skelettmuskelkraft und den mentalen Zustand beeinflusst werden. In dieser Arbeit beschreiben wir ein Vorhofstimulationsprotokoll zur Erkennung von herzfrequenzabhängigen Veränderungen der diastolischen Leistung und zur Validierung seiner Nützlichkeit in einem Mausmodell der HFpEF. Die Methode umfasst die Anästhesie, Intubation und die Durchführung einer Druck-Volumen-Schleifenanalyse (PV) in Verbindung mit einer Vorhofstimulation. In dieser Arbeit wurde ein Leitleitungskatheter über einen linksventrikulären apikalen Zugang eingeführt und ein Vorhofschrittkatheter in die Speiseröhre gelegt. Ausgangs-PV-Schleifen wurden gesammelt, bevor die Herzfrequenz mit Ivabradin verlangsamt wurde. PV-Schleifen wurden gesammelt und in HF-Schritten von 400 bpm bis 700 bpm mittels Vorhofstimulation analysiert. Mit Hilfe dieses Protokolls konnten wir eine HR-abhängige diastolische Beeinträchtigung in einem metabolisch induzierten HFpEF-Modell eindeutig nachweisen. Sowohl die Relaxationszeitkonstante (Tau) als auch die enddiastolische Druck-Volumen-Beziehung (EDPVR) verschlechterten sich mit steigender Herzfrequenz im Vergleich zu Kontrollmäusen. Zusammenfassend lässt sich sagen, dass dieses Vorhofstimulations-gesteuerte Protokoll für die Erkennung von HR-abhängigen Herzfunktionsstörungen nützlich ist. Es bietet eine neue Möglichkeit, die zugrunde liegenden Mechanismen der diastolischen Dysfunktion in HFpEF-Mausmodellen zu untersuchen und könnte dazu beitragen, neue Behandlungen für diese Erkrankung zu entwickeln.
Einleitung
Herzinsuffizienz ist weltweit eine der Hauptursachen für Krankenhausaufenthalte und Todesfälle, und Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) macht etwa 50 % aller Herzinsuffizienzdiagnosen aus. Die HFpEF ist durch eine diastolische Dysfunktion und eine beeinträchtigte Belastungstoleranz gekennzeichnet, und die damit verbundenen hämodynamischen Anomalien, wie z. B. die diastolische Dysfunktion, können durch belastungsbelastete hämodynamische Tests oder MRT-Scans eindeutig nachgewiesen werden 1,2.
In experimentellen Modellen sind die verfügbaren Modalitäten zur Beurteilung der physiologischen Anomalien im Zusammenhang mit HFpEF jedoch begrenzt 3,4. Laufband-Belastungstests (TMT) werden verwendet, um die Laufzeit und Distanz zu bestimmen, die die Herzhämodynamik bei Belastung widerspiegeln können. Diese Methode ist jedoch anfällig für Störungen durch externe Variablen wie das Körpergewicht, die Skelettmuskelkraft und den mentalen Status.
Um diese Einschränkungen zu umgehen, haben wir ein Vorhofstimulationsprotokoll entwickelt, das subtile, aber entscheidende Veränderungen der diastolischen Leistung auf der Grundlage der Herzfrequenz (HF) erkennt und seine Nützlichkeit in einem Mausmodell von HFpEF5 validiert. Mehrere physiologische Faktoren tragen zur belastungsbedingten Herzfunktion bei, darunter die sympathische Nerven- und Katecholaminantwort, die periphere Vasodilatation, die Endothelantwort und die Herzfrequenz6. Unter diesen ist jedoch die HR-Druck-Beziehung (auch Bowditch-Effekt genannt) als kritische Determinante kardialer physiologischer Merkmale bekannt 7,8,9.
Das Protokoll beinhaltet die Durchführung einer konventionellen Druck-Volumen-Analyse zu Studienbeginn, um die systolische und diastolische Funktion zu beurteilen, einschließlich Parametern wie der Druckentwicklungsrate (dp/dt), der endsystolischen Druck-Volumen-Beziehung (ESPVR) und der enddiastolischen Druck-Volumen-Beziehung (EDPVR). Es ist jedoch zu beachten, dass diese Parameter von der Herzfrequenz beeinflusst werden, die aufgrund von Unterschieden in ihrer intrinsischen Herzfrequenz zwischen den Tieren variieren kann. Darüber hinaus sollten auch die Auswirkungen der Anästhesie auf die Herzfrequenz berücksichtigt werden. Um diesem Problem entgegenzuwirken, wurde die Herzfrequenz standardisiert, indem gleichzeitig mit Ivabradin eine atriale Stimulation verabreicht wurde, und kardiale Parametermessungen wurden mit inkrementellen Herzfrequenzen durchgeführt. Bemerkenswert ist, dass die HFpEF-Mäuse durch die HR-abhängige kardiale Reaktion von den Mäusen der Kontrollgruppe unterschieden, während bei den PV-Loop-Messungen zu Studienbeginn (unter Verwendung der intrinsischen Herzfrequenz) keine signifikanten Unterschiede beobachtet wurden5.
Obwohl dieses Pacing-Protokoll relativ kompliziert erscheinen mag, liegt seine Erfolgsquote bei über 90 %, wenn es gut verstanden wird. Dieses Protokoll würde eine nützliche Möglichkeit bieten, die zugrunde liegenden Mechanismen der diastolischen Dysfunktion in HFpEF-Mausmodellen zu untersuchen und bei der Entwicklung neuer Behandlungen für diese Erkrankung zu helfen.
Protokoll
Dieses Tierprotokoll wurde vom Institutional Animal Care and Use Committee genehmigt und entsprach den Vorschriften für Tierversuche und verwandte Aktivitäten an der Universität Tokio. Für die vorliegende Studie wurden 8-12 Wochen alte männliche C57/Bl6J-Mäuse verwendet. Die Tiere stammten aus einer kommerziellen Quelle (siehe Materialtabelle). Ein Modell der HFpEF wurde durch die Verabreichung einer fettreichen Diät für 15 Wochen in Verbindung mit NG-Nitro-L-Argininmethylester etabliert, wie zuvor beschrieben10.
1. Katheterpräparationen und Druck-/Volumenkalibrierung
- Legen Sie einen Leitfähigkeitskatheter in normale Kochsalzlösung und befestigen Sie ihn an einem Modul, bestehend aus dem PowerLab 8/35 und einer Druck-Volumen-Einheit (MPVS-Modul, siehe Materialtabelle).
- Elektronische Kalibrierung von Druck und Volumen durch die Aufzeichnung von vorgegebenen Druck- (0 mmHg und 100 mmHg) und Volumenparametern (diese variieren zwischen MPVS-Modulen) auf dem MPVS-Modul 3,11 (siehe auch Herstellerangaben).
2. Vorbereitung eines Tieres für die Katheterisierung
- Anästhesie und Beatmung
- Verabreichen Sie 5-10 Minuten vor der Intubation eine intraperitoneale Injektion von 5 mg/kg Etomidat und 500 mg/kg Urethan (siehe Materialtabelle).
HINWEIS: Obwohl Urethan in Tierversuchen als Anästhetikum wirksam ist, steht es im Verdacht, für den Menschen krebserregend zu sein. Wenn Urethan zur Erreichung der Versuchsziele erforderlich ist und keine Alternativmittel ausreichen, muss daher mit Vorsicht umgegangen werden. Geeignete Schutzmaßnahmen, wie das Tragen von Handschuhen und Masken sowie die Verwendung eines Abzugs während der Zubereitung, sind vorgeschrieben. Als mögliche Alternative könnte Ketamin (80 mg/kg, ip) eingesetzt werden. - Legen Sie die Maus in eine Anästhesiekammer, die zuvor mit 2 % Isofluran gesättigt war, und legen Sie das Tier auf ein vorgewärmtes Heizkissen, das nach der Einleitung der Anästhesie zwischen 38 °C und 40 °C gehalten wird.
- Rasieren Sie den Operationsbereich. Desinfizieren Sie dann die Operationsstelle mit drei abwechselnden Runden Betadin und Alkohol.
- Machen Sie einen horizontalen Schnitt (1-2 cm) im Hals, entfernen Sie den Trachealmuskel und legen Sie die Luftröhre frei. Führen Sie eine chirurgische 2-0-Seidennaht unter die Luftröhre, heben Sie sie an und machen Sie einen kleinen Schnitt (1-2 mm), um sie zu öffnen.
- Führen Sie einen Endotrachealtubus in die Luftröhre ein und schließen Sie ihn an ein Beatmungsgerät an, das eine Mischung aus 100 % Sauerstoff und 2 % Isofluran abgibt (später auf 0,5 % bis 1 % reduziert).
- Verabreichen Sie 5-10 Minuten vor der Intubation eine intraperitoneale Injektion von 5 mg/kg Etomidat und 500 mg/kg Urethan (siehe Materialtabelle).
- Einführen eines zentralvenösen Katheters (CV) und Flüssigkeitsinjektion
- Lokalisieren Sie die Vena jugularis interna unterhalb des Musculus sternocleidomastoideus3.
- Der zentrale Venenkatheter, bestehend aus einem PE-10-Silastikschlauch (siehe Materialtabelle), der an einer 30-G-Nadel befestigt ist, wird in die Jugularvene eingeführt.
- Verabreichen Sie eine Bolusinfusion von 5-6 μl/g Körpergewicht von 10 % Albumin/NaCl über 3 Minuten, gefolgt von einer konstanten Infusionsrate von 5-10 μl/min.
HINWEIS: Dieser Schritt ist entscheidend, um eine Hypotonie zu verhindern, die sich aus der durch die Anästhesie verursachten peripheren Vasodilatation ergibt. Die Vena jugularis interna befindet sich zwischen dem Musculus sternocleidomastoideus und der Halsschlagader und erscheint dunkler als die Arterie.
3. Chirurgischer Eingriff bei linksventrikulärer Katheterisierung (offener Thoraxzugang)
- Rasieren Sie den Operationsbereich der betäubten Maus. Desinfizieren Sie dann die Operationsstelle mit drei abwechselnden Runden Betadin und Alkohol.
- Bestätigen Sie die Tiefe der Anästhesie, indem Sie eine Zehenkneifung durchführen. Machen Sie dann einen horizontalen Schnitt (2-3 cm) unterhalb des Processus xiphoideus und trennen Sie die Haut mit einer stumpfen Schere von der Brustwand.
- Schneiden Sie die Brustwand seitlich auf beiden Seiten mit Elektrokauter durch (siehe Materialtabelle).
- Legen Sie das Herz frei, indem Sie das Zwerchfell durchschneiden, und entfernen Sie den Herzbeutel vorsichtig mit einer Pinzette aus dem Herzen.
- Führen Sie eine 27-G-Nadel in die Spitze des linken Ventrikels (LV) ein und führen Sie retrograd einen Leitfähigkeitskatheter über das Punktionsloch in den LV ein.
- Stellen Sie die Katheterposition so ein, dass eine quadratische Druck-Volumen-Schleife entsteht.
- Stellen Sie sicher, dass der Katheter den Papillarmuskel nicht berührt, wenn sich die Belastungsbedingungen ändern, indem Sie die Form der PV-Schleife während des Verschlusses der unteren Hohlvene (IVC) überprüfen.
HINWEIS: Eine ausreichende Exposition des Herzens erleichtert den Eingriff und hilft, eine klare Sicht zu erhalten.
4. Aufzeichnen von PV-Schleifendaten und Bestimmung der endsystolischen Druck-Volumen-Beziehung (ESPVR) und der enddiastolischen Druck-Volumen-Beziehung (EDPVR)
HINWEIS: Die Reduzierung der Vorlast durch IVC-Okklusion ermöglicht die Bestimmung der ESPVR und EDPVR.
- Aufzeichnen und analysieren Sie die Basis-Druck-Volumen-Schleife (PV) mit der LabChart-Software (siehe Materialtabelle), PowerLab und dem MPVS-Modul nach der Signalstabilisierung (5-10 Minuten nach der Kanüle).
- Führen Sie eine IVC-Okklusion durch, indem Sie die IVC mit einer Pinzette komprimieren, und zeichnen Sie die PV-Schleife während der IVC-Okklusion für mindestens 20 Herzzyklen auf. Bestimmen Sie die ESPVR, indem Sie eine lineare Regressionslinie durch die systolischen Endpunkte der PV-Schleife anpassen, und die EDPVR, indem Sie eine gekrümmte Linie durch die enddiastolischen Punkte der PV-Schleife mit der LabChart-Software anpassen.
HINWEIS: Stoppen Sie das Beatmungsgerät während des IVC-Verschlusses, um Lungenbewegungsartefakte zu vermeiden. Ein paralytisches Mittel wie Pancuronium (0,5-1 mg/kg) kann bei übermäßiger Lungenbewegung hilfreich sein und sollte erst angewendet werden, wenn eine stabile Anästhesieebene bestätigt wurde.
5. Transösophageale Stimulation
- Führen Sie einen 2-Fr-Katheter mit tetrapolaren Elektroden in die Speiseröhre ein, schließen Sie den Katheter an einen Pulsstimulator an (siehe Materialtabelle) und bestimmen Sie die Schwelle für den atrialen Einfang (normalerweise beträgt die Stimulusamplitude 3 mA und die Pulsbreite 1 ms).
- Verlangsamen Sie die Herzfrequenz unter 400 Schläge/min mit 20 mg/kg Ivabradin (siehe Materialtabelle), das intraperitoneal verabreicht wird.
- Nach der Stabilisierung werden 20 kontinuierliche Herzzyklen von PV-Schleifen mit unterschiedlichen Schrittraten von 400 Schlägen/min bis 700 Schlägen/min mit einem Inkrement von 100 Schlägen/min erfasst. Erfassen Sie die Zyklen über 5 Minuten bei jeder Schrittfrequenz.
6. Kalibrierung von Kochsalzlösung und Aortenfluss
- Deaktivieren Sie das Beatmungsgerät und verabreichen Sie 5-10 μl hypertone Kochsalzlösung intravenös über den CV-Katheter.
- Dokumentieren Sie die Druck- und Volumenschwankungen während der Kochsalzinjektion und berechnen Sie den Pp-Wert mit PowerLab 3,11.
- Wiederholen Sie die Kochsalzkalibrierung, um die Genauigkeit und Reproduzierbarkeit zu verbessern.
- Drehen Sie die Maus auf die linke Seite, um das Lautstärkesignal nicht zu stören.
- Machen Sie eine laterale Thorakotomie zwischen Th3 und Th5 in Richtung Wirbelsäule und präparieren Sie vorsichtig einen kleinen Teil der absteigenden Aorta mit einer Pinzette.
- Platzieren Sie eine Gefäßflusssonde (siehe Materialtabelle) über der Aorta, um das Herzzeitvolumen zu messen.
HINWEIS: Die genaue Berechnung des absoluten Volumens erfordert die Verwendung von zwei Arten der Kalibrierung: die Kalibrierung von Kochsalzlösung und die Kalibrierung des Aortenflusses. Es ist wichtig, die potenziellen Risiken zu erkennen, die mit einer hypertonen Kochsalzinfusion bei tierischen Probanden verbunden sind, da eine übermäßige Salzbelastung zu einer Abnahme der Kontraktilität führen kann.
7. Euthanasie
- Nach der Studie werden die Mäuse unter einer Überdosis Anästhesie durch Zervixluxation eingeschläfert.
HINWEIS: Um die vollständige Beendigung der Vitalfunktion zu gewährleisten, wird eine sekundäre Methode der Euthanasie angewendet, wie z. B. die Blutung unter Narkose mit anschließender Entnahme von Herzgewebe.
Ergebnisse
Die Basisdaten des PV-Loops sind in Abbildung 1 und Tabelle 1 dargestellt. Zu Studienbeginn (ohne Stimulation) gab es keine signifikanten Unterschiede in den diastolischen Parametern wie der Relaxationszeitkonstante (Tau), der minimalen Druckänderungsrate (dP/dt min) und der EDPVR zwischen den Kontroll- und HFpEF-Mäusen. Die HFpEF-Mäuse wiesen jedoch einen höheren Blutdruck und eine höhere arterielle Elastanz (Ea) auf, wie in Abbildung 1 gezeigt, und zeigten eine typische bergförmige PV-Schleife während der ventrikulären Systole. Dies sollte von einem Spike unterschieden werden, der durch direkten Kontakt des Ventrikelmuskels mit dem Druckwandler verursacht wird (Abbildung 2). Wichtig ist, dass mit Hilfe der Vorhofstimulation die diastolische Funktion zwischen den Kontrollmäusen und den HFpEF-Mäusen klar unterschieden werdenkonnte 5 (Abbildung 3 und Abbildung 4). In der Kontrollgruppe verbesserten sich sowohl die Tau- als auch die EDPVR-Rate mit zunehmender Stimulationsrate, während sich in der HFpEF-Gruppe sowohl die Tau- als auch die EDPVR-Rate verschlechterten, wenn die HR mit der atrialen Stimulation zunahm.
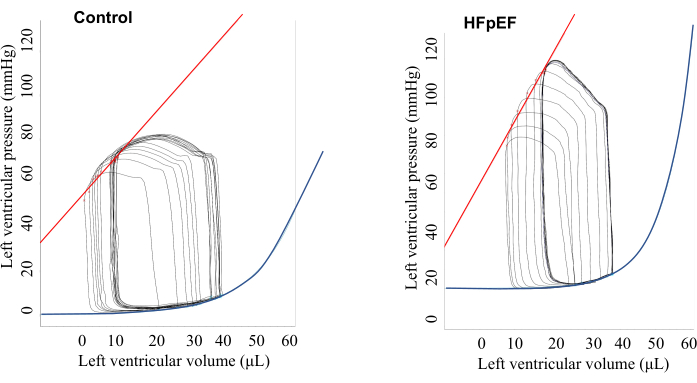
Abbildung 1: Repräsentative Druck-Volumen-Beziehung zu Studienbeginn ohne Stimulation, dargestellt in einem Screenshot. Die Ergebnisse zeigten, dass HFpEF-Mäuse im Vergleich zu den Kontrollmäusen eine höhere arterielle Elastanz und einen höheren ventrikulären Druck aufwiesen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Ein repräsentatives Bild einer stachelförmigen PV-Schleife. Diese Art von PV-Schleifenform ist das Ergebnis einer direkten Kompression des Druckaufnehmers durch den Ventrikelmuskel (dargestellt durch die orangefarbene Pfeilspitze) und sollte aus der Analyse ausgeschlossen werden, um die Genauigkeit der Ergebnisse zu erhalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Repräsentatives Diagramm zur Veranschaulichung der Unterschiede in den hämodynamischen Parametern als Reaktion auf die Vorhofstimulation zwischen den Modellmäusen der Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) und den Kontrollmäusen. Das Diagramm unterscheidet klar zwischen den beiden Gruppen, wobei die Herzfrequenz zwischen 400 Schlägen pro Minute und 700 Schlägen pro Minute liegt. Abkürzungen: LVP = linksventrikulärer Druck; dP/dt = erste Ableitung von LVP; EDPVR = enddiastolische Druck-Volumen-Beziehung; LVV = linksventrikuläres Volumen; Tau = Relaxationszeitkonstante. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Die hämodynamische Reaktion der diastolischen Parameter aus der Druck-Volumen-Schleifenanalyse dargestellt in Bezug auf die Herzfrequenz (HF). Bei den HFpEF-Modellmäusen verschlechterte sich die diastolische Funktion (Tau und EDPVR) mit zunehmender Herzfrequenz während der Vorhofstimulation. Die bidirektionale ANOVA-Analyse zeigte einen signifikanten Haupteffekt von HFpEF (F = 28,95, p < 0,001) und HR (F = 3,035, p = 0,08644) auf den EDPVR, sowie einen signifikanten Interaktionseffekt zwischen Gruppe und Herzfrequenz (F = 3,938, p = 0,02454). Für Tau gab es einen signifikanten Effekt von Gruppe (F = 25,56, p < 0,001) und Herzfrequenz (F = 0,1088, p = 0,7425) sowie einen signifikanten Interaktionseffekt zwischen Gruppe und Herzfrequenz (F = 3,461, p = 0,03759). Die Daten werden als Mittelwert ± Standardfehlers angezeigt. n = 6 Mäuse/Gruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Repräsentative Darstellung des Kochsalzkalibrierungsverfahrens. Die Infusion von hypertoner Kochsalzlösung verändert die elektrische Leitfähigkeit des Blutes und ermöglicht so die Berechnung der Signalkomponente des umgebenden Herzgewebes. Der Blutdruck sollte während der Injektion stabil bleiben, mit einer leichten Volumenzunahme (dargestellt im orangefarbenen Pfeil). Abkürzungen: LVP = linksventrikulärer Druck; LVV = linksventrikuläres Volumen Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Repräsentative Darstellung der korrekten Platzierung des transösophagealen Stimulationskatheters. Die richtige Platzierung des transösophagealen Schrittmacherkatheters ermöglicht einen engen QRS-Rhythmus. Die blauen Pfeile stellen einen normalen Sinusrhythmus dar, und die roten Pfeile zeigen den Vorhofrhythmus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
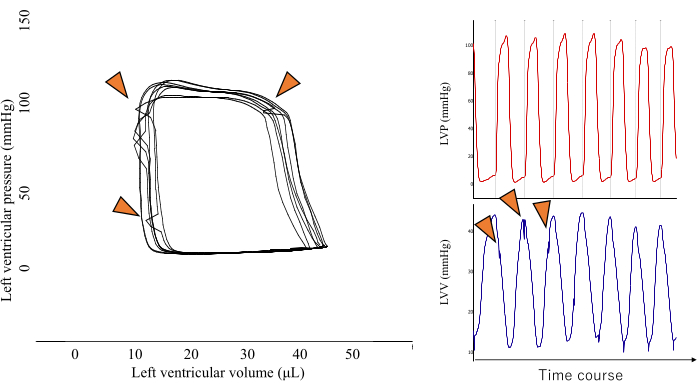
Abbildung 7: Repräsentatives Bild einer falsch eingestellten Reizamplitude bei der atrialen Stimulation, die zu einer verzerrten Druck-Volumen-Schleife führt. Die Stimulationsintensität induzierte unerwünschte Bewegungsartefakte im Leitwertsignal, dargestellt als PV-Schleife mit einer Schüttellinie (gekennzeichnet durch die Pfeile). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Kontrolle (n = 10) | HFpEF (n = 10) | p-Wert | |
| CO (μl/min) | 12436,8 ± 938,4 | 10923,5 ± 1032,7 | 0.2897 |
| SV (μl) | 23,6 ± 1,85 | 20,5 ± 1,88 | 0.2515 |
| Ved (μl) | 37,6 ± 3,45 | 34,0 ± 1,32 | 0.4242 |
| Pes (mmHg) | 95,2 ± 3,56 | 109,3 ± 1,74 | 0.00032* |
| Ped (mmHg) | 6,16 ± 1,53 | 6,95 ± 1,22 | 0.6889 |
| HF (Takt/Min.) | 532,4 ± 20,8 | 534,0 ± 13,9 | 0.9505 |
| EF (%) | 66,5 ± 2,95 | 63,68 ± 2,37 | 0.4718 |
| Ea (mmHg/μL) | 4,02 ± 0,30 | 5,90 ± 0,72 | 0.03224* |
| dP/dt max (mmHg/s) | 10812,1 ± 1042,9 | 9481,1 ± 262,02 | 0.2444 |
| dP/dt min (mmHg/s) | -9540,7 ± 748,9 | -9003,9 ± 320,0 | 0.5177 |
| Tau (ms) | 7,30 ± 0,50 | 8,02 ± 0,39 | 0.268 |
| ESPVR (mmHg/μL) | 3,41 ± 0,51 | 4,69 ± 0,41 | 0.09147 |
| EDPVR (mmHg/μL) | 0,096 ± 0,0061 | 0,103 ± 0,013 | 0.6103 |
Tabelle 1: Ausgangswerte der kardialen Parameter bei den Kontroll- und HFpEF-Mäusen. Die Daten werden als Mittelwert ± Standardfehlers angezeigt. *p < 0,05 im Vergleich zur Kontrolle durch t-Test.
Diskussion
Wir stellen eine Methodik zur Beurteilung von Druck-Volumen-Beziehungen bei der Anwendung der transösophagealen Stimulation vor. Belastungsintoleranz ist eines der Hauptmerkmale der HFpEF, jedoch gibt es keine Techniken zur Beurteilung der Herzfunktion bei Mäusen während des Trainings. Unser Stimulationsprotokoll bietet ein wertvolles Werkzeug zur Erkennung diastolischer Dysfunktionen, die unter Ruhebedingungen möglicherweise nicht offensichtlich sind.
Um einen PV-Kreislauf von genauer und gleichbleibender Qualität zu erreichen, müssen die folgenden Schritte sorgfältig ausgeführt werden 3,4,5,7,8,11,12,13,14: (1) Die Tiere müssen sorgfältig betäubt werden, und eine konstante Körpertemperatur von 37-37,5 °C muss mit einem Heizkissen aufrechterhalten werden; (2) Die Tiere müssen in geeigneter Weise intubiert werden, und die Belüftung muss wirksam kontrolliert werden. (3) Die ordnungsgemäße Platzierung des intravenösen Zugangs muss sichergestellt sein; (4) Der Leitfähigkeitskatheter muss ordnungsgemäß innerhalb des LV positioniert werden. (5) Der transösophageale Katheter sollte mit Bedacht platziert werden, und es sollte auf eine angemessene Stimulation geachtet werden. 6) Das Datenerfassungssystem muss sorgfältig angeschlossen werden, und die Verstärkungs- und Offset-Werte müssen entsprechend eingestellt werden. (7) Die Leitwertsignale sollten mit hypertoner Kochsalzlösung kalibriert werden. (8) Die ordnungsgemäße Messung des Aortenflusses mit einer Durchflusssonde sollte überprüft werden. (9) Das Wohlbefinden der Tiere sollte während des gesamten Verfahrens kontinuierlich überwacht werden, um stress- oder bewegungsbedingte Artefakte zu minimieren.
Die Optimierung der Anästhesiedosis ist entscheidend, um eine reproduzierbare und qualitativ hochwertige PV-Schleife bei Mäusen zu erhalten. Typischerweise wird eine Dosis von 800 mg/kg Urethan und 5-10 mg/kg Etomidat verabreicht. Bei krankhafter Herzinsuffizienz ist es jedoch ratsam, eine niedrigere Dosis des Anästhetikums zu verabreichen. Während des Eingriffs ist es wichtig, eine warme Körpertemperatur von 37-38 °C aufrechtzuerhalten, indem das betäubte Tier vorsichtig auf ein Heizkissen gelegt wird. Dies ist besonders wichtig für Mäuse, da ein Abfall der Körpertemperatur zu einer deutlichen Abnahme der Herzfrequenz führen kann. Darüber hinaus ist eine ausreichende Freilegung des Herzens entscheidend, um eine klare Sicht zu erhalten und den Eingriff zu erleichtern. In einigen Fällen kann das Durchtrennen der 12. bis 11. Rippe hilfreich sein, um das Herz freizulegen.
Der Intubationsprozess sollte vorsichtig durchgeführt werden, um eine Schädigung der Halsschlagadern und des Vagusnervs in der Nähe der Luftröhre zu vermeiden. Die Einstellung des Beatmungsgeräts muss auf der Grundlage des Körpergewichts des Tieres anhand der folgenden Formeln3 angepasst werden:
Tidalvolumen (Vt, mL) = 6,2 × W1,01 (W = Körpergewicht, kg)
Atemfrequenz (RR, min−1) = 53,5 × W−0,26
Zum Beispiel: Vt = 149,4 μl, RR = 140/min in einer 25 g schweren Maus.
Vor der Kanulierung muss der Venenkatheter (mit einer 30-G-Nadel) vollständig mit 10% Albumin grundiert und in einem flachen Winkel in die Vene eingeführt werden, um ein Einreißen der empfindlichen Venenwände zu verhindern. Die richtige Positionierung des Leitfähigkeitskatheters innerhalb der linken Herzkammer (LV) ist von größter Bedeutung, um genaue Ergebnisse zu erhalten. Der Katheter sollte auf die LV-Längsachse ausgerichtet werden, wobei alle Elektroden zwischen dem LV-Abflusstrakt und dem apikalen endokardialen Rand positioniert werden sollten. Während des gesamten Eingriffs sollte eine stabile PV-Schleife ohne Kerben erreicht werden, auch während des intravenösen Verschlusses, der hypertonen Kochsalzkalibrierung und der transösophagealen Stimulation. Bei der Kochsalzkalibrierung sollten die LV-Drücke während der hypertonen Kochsalzinjektion stabil sein, und die Schwebungen während der anfänglichen Einwaschphase von Signalen mit steigendem Volumen werden verwendet (Abbildung 5). Man muss darauf achten, dass man keine Mengen hypertoner Kochsalzlösung von mehr als 20 μl injiziert, da hypertone Kochsalzlösung die Herzfunktion durch Volumenüberlastung leicht beeinträchtigen kann. Der durch die Speiseröhre eingeführte Schrittmacherkatheter muss durch Vorhoferfassung in der richtigen Position bestätigt werden (Abbildung 6), und die Stimulusamplitude sollte entsprechend eingestellt werden (in der Regel 3 mA, mit einer Pulsbreite von 1 ms). Eine stärkere Stimulation würde sich auf den Leitfähigkeitskatheter auswirken und eine schüttelförmige PV-Schleife verursachen (Abbildung 7).
Die genaue Berechnung des absoluten Volumens erfordert die Verwendung von zwei Arten der Kalibrierung: die Kalibrierung von Kochsalzlösung und die Kalibrierung des Aortenflusses. Die Leitfähigkeitskathetertechnik erfordert eine Bewertung des Parallelleitfähigkeitsversatzes (Vp), um den Leitwert zu berücksichtigen, der nicht nur aus dem Blutpool in der Herzkammer, sondern auch aus den umgebenden Strukturen gemessen wird. Diese Beurteilung kann durch die Verabreichung einer hypertonen Kochsalz-Bolus-Infusion erreicht werden. Die Aortenflusskalibrierung ermöglicht die direkte Messung des Aortenflusses, was wiederum die Bestimmung des absoluten Schlagvolumens ermöglicht. Es ist jedoch zu beachten, dass diese Kalibrierung nur das absolute Schlagvolumen und nicht das absolute ventrikuläre Volumen liefert. Um das absolute Ventrikelvolumen zu erhalten, muss sowohl eine Kochsalzkalibrierung als auch eine Aortenkalibrierung durchgeführt werden.
Es gibt einige Einschränkungen bei dieser Methode. Zunächst wurde bei der Einführung des Leitfähigkeitskatheters ein transapikaler Ansatz gewählt. Um an die LV-Spitze zu gelangen, muss der Perikard entfernt werden. Dies könnte sich auf die diastolischen Parameter auswirken, insbesondere auf die pädiatrischen Parameter. Zweitens kann während der langen Eingriffszeit etwas Blut verloren gehen, was sich auch auf die kardialen Funktionsparameter auswirken könnte, aber diese Probleme können vermieden werden, indem man die Verfahren besser beherrscht. Es ist erwähnenswert, dass das in diesem Protokoll verwendete HFpEF-Modell die humane HFpEF nicht vollständig repliziert, da es sich um ein Syndrom mit mehreren Phänotypen handelt, die von den damit verbundenen Komorbiditäten wie Fettleibigkeit, Diabetes mellitus, Bluthochdruck, Vorhofflimmern oder multiplem Organversagen abhängen. Es gibt kein verfügbares Mausmodell, das all diese Komorbiditäten nachahmt. Das Double-Hit-HFpEF-Mausmodell ist jedoch am relevantesten für humane HFpEF mit metabolischen Komorbiditäten10. Der genetische Hintergrund der Mäuse könnte die diastolische Funktion beeinflussen. Während berichtet wurde, dass C57BL/6J-Mäuse im Vergleich zu C57BL/6N-Mäusen unterschiedliche Reaktionen auf kardiovaskulären Stress und einen potenziell milderen Krankheitsphänotyp zeigten, hat dieses Protokoll eine diastolische Beeinträchtigung im Zwei-Treffer-Modell auch auf dem C57BL/6J-Hintergrund5 nachgewiesen, was bei anderen Modalitäten, die normalerweise bei Mäusen eingesetzt werden, schwierig sein könnte.
Dieses Manuskript soll eine Anleitung für die effektive Durchführung der Pacing-assoziierten PV-Loop-Verfahren geben, die bei der Beurteilung der HR-assoziierten Herzfunktion und der Förderung der Forschung zur Herzinsuffizienz hilfreich sein können.
Offenlegungen
Es gibt keine konkurrierenden finanziellen Interessen.
Danksagungen
Diese Arbeit wurde durch Forschungsstipendien der Fukuda Foundation for Medical Technology (an E.T. und G. N.) und des JSPS KAKENHI Scientific Research Grant-in-Aid 21K08047 (an E.T.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture, sterlie | Alfresa Pharma Corporation, Osaka, Japan | 62-9965-57 | Surgical Supplies |
| 2-Fr tetrapolar electrode catheter | Fukuda Denshi, Japan and UNIQUE MEDICAL, Japan | custom-made | Surgical Supplies |
| Albumin Bovine Serum | Nacalai Tesque, Inc., Kyoto, Japan | 01859-47 | Miscellaneous |
| C57/BI6J mouse | Jackson Laboratory | animals | |
| Conductance catheter | Millar Instruments, Houston, TX | PVR 1035 | |
| Electrical cautery, Electrocautery Knife Kit | ellman-Japan,Osaka, Japan | 1-1861-21 | Surgical Supplies |
| Etomidate | Tokyo Chemical Industory Co., Ltd., Tokyo Japan | E0897 | Anesthetic |
| Grass Instrument S44G Square Pulse Stimulator | Astro-Med, West Warwick, RI | Pacing equipment | |
| Isoflurane | Viatris Inc., Tokyo, Japan | 8803998 | Anesthetic |
| Ivabradine | Tokyo Chemical Industory Co., Ltd., Tokyo Japan | I0847 | Miscellaneous |
| LabChart software | ADInstruments, Sydney, Australia | LabChart 7 | Hemodynamic equipment |
| MPVS Ultra | Millar Instruments, Houston, TX | PL3516B49 | Hemodynamic equipment |
| Pancronium bromide | Sigma Aldrich Co., St. Louis, MO | 15500-66-0 | Anesthetic |
| PE10 polyethylene tube | Bio Research Center Co. Ltd., Tokyo, Japan | 62101010 | Surgical Supplies |
| PowerLab 8/35 | ADInstruments, Sydney, Australia | PL3508/P | Hemodynamic equipment |
| PVR 1035 | Millar Instruments, Houston, TX | 842-0002 | Hemodynamic equipment |
| Urethane (Ethyl Carbamate) | Wako Pure Chemical Industries, Ltd., Osaka, Japan | 050-05821 | Anesthetic |
| Vascular Flow Probe | Transonic, Ithaca, NY | MA1PRB | Surgical Supplies |
Referenzen
- Backhaus, S. J. Exercise stress real-time cardiac magnetic resonance imaging for noninvasive characterization of heart failure with preserved ejection fraction. Circulation. 143 (15), 1484-1498 (2021).
- Borlaug, B. A., Nishimura, R. A., Sorajja, P., Lam, C. S. P., Redfield, M. M. Exercise hemodynamics enhance diagnosis of early heart failure with preserved ejection fraction. Circulation. Heart Failure. 3 (5), 588-595 (2010).
- Pacher, P., Nagayama, T., Mukhopadhyay, P., Bátkai, S., David, A. Measurement of cardiac function using pressure-volume conductance catheter technique in mice and rats. Nature Protocols. 3 (9), 1422-1434 (2008).
- Cingolani, O. H., Kass, D. A. Pressure-volume relation analysis of mouse ventricular function. American Journal of Physiology - Heart and Circulatory Physiology. 301 (6), 2198-2206 (2011).
- Numata, G., et al. A pacing-controlled protocol for frequency-diastolic relations distinguishes diastolic dysfunction specific to a mouse HFpEF model. American Journal of Physiology - Heart and Circulatory Physiology. 323 (3), H523-H527 (2022).
- Piña, I. L., et al. Exercise and heart failure. Circulation. 107 (8), 1210-1225 (2003).
- Georgakopoulos, D., Kass, D. A. Minimal force-frequency modulation of inotropy and relaxation of in situ murine heart. Journal of Physiology. 534 (2), 535-545 (2001).
- Takimoto, E., et al. Frequency- and afterload-dependent cardiac modulation in vivo by troponin I with constitutively active protein kinase A phosphorylation sites. Circulation Research. 94 (4), 496-504 (2004).
- Meyer, M., Lewinter, M. M. Heart rate and heart failure with preserved ejection fraction: Time to slow β-blocker use? Circulation. Heart Failure. 12 (8), 006213(2019).
- Schiattarella, G. G., et al. Nitrosative stress drives heart failure with preserved ejection fraction. Nature. 568 (7752), 351-356 (2019).
- Abraham, D., Mao, L. Cardiac pressure-volume loop analysis using conductance catheters in mice. Journal of Visualized Experiments. (103), e52942(2015).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch effect. Journal of Visualized Experiments. (100), e52618(2015).
- Townsend, D. W. Measuring pressure volume loops in the mouse. Journal of Visualized Experiments. (111), e53810(2016).
- Georgakopoulos, D., Kass, D. A. Estimation of parallel conductance by dual-frequency conductance catheter in mice. American Journal of Physiology - Heart and Circulatory Physiology. 279 (1), H47(2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten