Method Article
ラットモデルにおける虚血性プレコンディショニング効果を研究するための表在性下上腹部動脈軸フラップ
* これらの著者は同等に貢献しました
要約
このプロトコルでは、ラットの皮膚筋膜の採取、縫合、およびモニタリングについて説明しており、大腿血管をクランプして結紮することにより、表在性下上腹部血管を通る血流の良好な視覚化と操作を可能にします。これは、虚血性プレコンディショニングを含む研究にとって重要です。
要約
皮膚筋膜弁(FCF)は、形成外科および再建手術における複雑な欠陥再建のゴールドスタンダードとなっています。この筋肉温存技術は、血管新生組織を移して大きな欠陥をカバーすることを可能にする。FCFは、ペディクルフラップまたはフリーフラップとして使用できます。ただし、文献では、ペディクルドFCFおよびフリーFCFの故障率は5%を超えており、これらの技術の改善とこの分野でのさらなる知識の拡大の余地があります。虚血性プレコンディショニング(I.P.)は広く研究されていますが、I.P.レジメンのメカニズムと最適化はまだ決定されていません。この現象は、形成外科や再建手術では確かに十分に調査されていません。ここでは、ラット軸筋膜皮膚皮弁モデルにおけるI.P.レジメンを研究するための手術モデルを提示し、フラップの生存に対するI.P.の影響を安全かつ確実に評価する方法を説明しています。この記事では、このモデルの信頼性を向上させるための提案を含む、完全な外科的処置について説明します。目的は、さまざまな虚血性プレコンディショニングレジメンをテストし、フラップの生存率に対するそれらの効果を評価するための再現性のある信頼性の高いモデルを研究者に提供することです。
概要
形成外科および再建手術は常に進化しています。筋肉、皮膚筋膜、および穿孔フラップの開発により、罹患率を減らしながら、より高品質の再建を提供することが可能になりました。この改善された解剖学的知識と強化された技術的スキルを組み合わせることで、再建外科医は、欠陥が局所的な解決策に近くない場合に無料のフラップ移植を行うことができます。しかし、穿孔フラップ手術は現在、再建手術において最も先進的な技術ですが、文献では、遊離フラップ移植で5%の失敗率1,2,3、有茎フラップ再建術で最大20%の失敗率が報告されています4,5,6。部分的または全体的なフラップの故障は、フラップの椎弓根が損なわれたときに発生するため、現在の技術の改善を継続的に模索することが不可欠です。皮弁生存率を改善する方法の1つは、創傷床上でのその新生血管形成を促進し、したがって、茎以外の供給源による灌流を可能にすることである。虚血性プレコンディショニング(I.P.)は、心臓モデル7で最初に説明されており、制御された虚血にさらされた臓器は、虚血誘発性新生血管化を受けることによって一次血液供給を失った後、より高い程度まで生存することを示しています。何人かの著者は、前臨床モデルおよび臨床モデルにおけるフラップ生存を最適化するために、この基礎原理を研究しています8、9、10。
フラップの生存率を改善するための他の方法に対するこの技術の利点は、血液源のクランプ/デクランプテストで構成される実装の容易さです。ラットモデルでは、以前の著者は表在性下上腹部動脈(SIEA)フラップを使用して、主椎弓根11、12、13をクランプすることによってI.P.を研究しました。それにもかかわらず、このモデルではいくつかの技術的な問題が発生する可能性があり、文献には十分に記述されたプロトコルが欠けています。
したがって、この研究は、大腿血管の拡張解剖を伴うラットSIEAフラップ調達技術の詳細な説明を研究者に提供することを目的としており、軸方向筋膜皮膚皮弁モデルのI.P.研究を可能にします。このモデルは、上腹部血管の完全性を保持し、代わりに、より弾力性のある大腿血管を操作します。この現象の研究を改善し、この手順の再現性を高めるために、経験とツールを共有します。
プロトコル
マサチューセッツ総合病院施設動物管理使用委員会は、実験プロトコル(IACUC-プロトコル #2022N000099)を承認しました。著者らは、この研究のARRIVE(動物研究: インビボ 実験の報告)ガイドラインチェックリストに従った。すべての動物は、実験動物の世話と使用のための国立衛生研究所のガイドに従って人道的な世話を受けました。合計12匹の雄性ルイスラット(250〜350g、8〜10週齢)をすべての実験に使用した。
1.動物の準備
注:ラットは代謝率が高く、脂肪の蓄積が限られています。したがって、手術前に断食したり、手術前に水を制限したりしないでください。
- すべての手順について、イソフルラン精密気化器のチャンバー内で3%〜5%のイソフルランを使用して動物を鎮静させる( 材料表を参照)。動物がよく鎮静されたら、鼻錐を通してイソフルランの投与量を1%〜3%に下げます。
注:2人目の研究者は、呼吸数を継続的に監視し、イソフルランの投与量を調整する必要があります。 - 最初の手術の2日前に、プラスチック製のeカラー(ラット用のサイズ、 材料表を参照)を動物に置き、3-0ナイロン縫合糸を使用して動物の首の背側と腹側にeカラーを固定します。このeカラーへの順応には2日かかります。ぴったりとフィットする必要がありますが、動物の気道を妨げないようにする必要があります。
2.術前ケア
- 最初の手術の日に、腹部の下部前側を剃り、動物の外側部分から正中線をわずかに超えるまで領域をクリアします。
- 次に、脱毛製品(脱毛クリーム; 材料表を参照)を使用して、この領域(前の手順で説明した腹部の下部前方)に残っているすべての髪を取り除きます。
- 外科用スクラブとベタジン溶液(10%ポビドンヨード)でその領域を完全に洗浄して乾燥させます。
- 0.05 mg / kgのブプレノルフィンを皮下投与します。.
3.術中モニタリング
- 手術中、動物が精密気化器とノーズコーン を介して 1%〜3%のイソフルランにとどまるようにします。動物の呼吸数、呼吸、酸素飽和度を目視観察とラット用に作られたげっ歯類パルスオキシメータで監視します。
注:典型的な呼吸数は毎分80-90サイクルです14,15。手術中に観察された意識を示す反応は、イソフルラン率を増加させる必要がある。 - げっ歯類の体温は麻酔下で急速に冷えるので、手術全体を通して動物を加温パッドの上に置きます。
4.上腹部皮弁収穫
- 動物を仰臥位に置きます。腹部を鼠径部のしわの下から剣状突起のレベルより上まで剃ります。
- 滅菌スキンペンと定規を使用して、最初に動物の腹部の正中線をマークし、次に鼠径部のしわをマークします。鼠径部のしわ線に沿った切開は、大腿血管から分岐する下上腹部血管を露出させます。
- 切開の前に、将来のフラップを楕円形または長方形として、垂直方向に最大6 cm、水平方向に3 cmまで描き、鼠径部のしわから頭蓋方向に伸びます。
- フラップ制限に垂直な5つまたは6つの等距離のマークを描画します。これらは、フラップを持ち上げて元の位置に戻した後、皮膚をより適切に再調整するためのガイドとして機能します(図1)。
- ラグネルはさみ( 材料表を参照)を使用して、鼠径部のしわに3〜4 cmの縦方向の切開を行います。
注意: 研究者は注意を払い、血管の損傷を避けるために皮膚を上に引き上げる必要があります。 - #4ジュエラー顕微手術鉗子( 材料表を参照)を使用して大腿血管と上腹部血管を露出させ、鉗子を開閉して筋膜を分離し、鼠径脂肪パッドの下にある血管にアクセスします。
- 鼠径部切開を使用して、ラグネルハサミを使用してフラップ切開を開始します。腹部の筋肉の上の皮膚と結合組織の全厚さを損なうように注意してください。
- 皮弁の収穫を容易にするために、はさみが筋肉に向かって押し、はさみの刃を広げることによって、正しい解剖面に従うようにします。このフラップ弱体化は、フラップ描画の周りを調整された方向に移動して実行します。
注意: 適切な平面を決定するには、解剖面の下に微小血管が存在したままであってはなりません。
- 皮弁の収穫を容易にするために、はさみが筋肉に向かって押し、はさみの刃を広げることによって、正しい解剖面に従うようにします。このフラップ弱体化は、フラップ描画の周りを調整された方向に移動して実行します。
- フラップの最初の先端が周囲の皮膚から解放されたら、ラグネルはさみの先端を使用してフラップを筋肉から分離し、フラップの周りの穿孔血管と真皮神経叢血管を焼灼しながら、遠位部から近位部まで弱体化してフラップの調達を続けます。これにより、すべての血液が上腹部血管 を介して フラップに流れるようになります。
注意: フラップを収穫するときに、強く引っ張ったり、皮膚をねじったりして、フラップ血管系を損傷しないように注意する必要があります。フラップの近位部分で作業している間、フラップの解放された部分を外科医の手の親指の上に注意深く配置することをお勧めします。 - 皮弁が完全に収穫されると、表在性下心窩部血管の枝が皮膚の深い側面に見えます。フラップをゆっくりと上に持ち上げて血管を視覚化することにより、SIEAの両方の枝全体をフラップでカプセル化することを目指します。
- フラップが収穫されたら、フラップの内側と外側の両方で下側の脂肪パッドを分離します。双極焼灼(材料の表を参照)を使用して、 表在性下心窩部茎を傷つけないように注意しながら、切開部の境界近くの脂肪パッドを焼灼します(図2)。
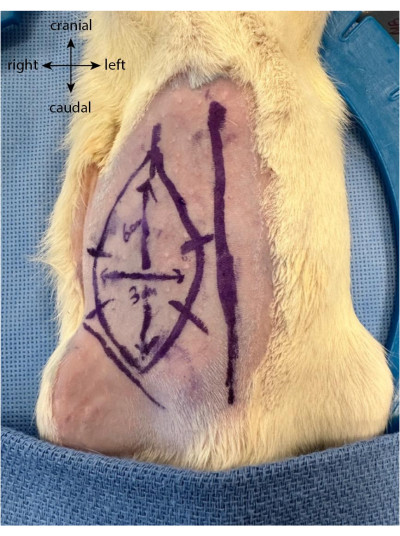
図1:動物の腹部に描かれたフラップ。 正中線は、上腹部皮弁の位置を特定するためのマーカーとして使用されます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:フラップが完全に上昇した状態。 脂肪パッドは、表在性下心窩部茎から来る血管新生を維持するために、皮弁の近位部分に保存される。 この図の拡大版を表示するには、ここをクリックしてください。
5.血管の準備と虚血誘発
注:フラップはこの段階で完全に収穫されますが、血管はまだ虚血性プレコンディショニングの準備ができていません。
- 大腿血管の準備の前に、陰茎静脈 を介して 17.5IUのヘパリンナトリウムの単回投与を注射します。
注:この注射は、亀頭を露出させ、非外傷性アドソン鉗子を使用して陰茎を外部に保持し、陰茎静脈を識別し、27Gシリンジを使用して陰茎静脈に沿って表面的に注射することによって行われます。 - より良い露出を作成するには、動物をローンスター自己保持リトラクター内に置きます( 材料表を参照)。
注意: Lone Star弾性ステーは、皮膚を手術部位から引き離し、血管のより良い視界を可能にします。研究者は手術用顕微鏡(40倍の倍率)の下で作業する必要があります。 - 血管を露出させるには、2つの#4顕微手術鉗子を使用して、表在性上腹部血管の出現に対して大腿血管を近位および遠位の両方に解剖します。血管を直接保持するのではなく、鉗子を使用して、鉗子を血管に対して垂直に開閉することにより、結合組織を層ごとに穏やかに分離します。
- 遠位大腿血管で、筋膜をきれいにし、動脈と静脈から神経をやさしく解放します。8-0ナイロン縫合糸( 材料表を参照)、動脈と静脈の下の顕微手術針ホルダーを迂回し、縫合糸を握り締め、これらの血管を縛ることによって、遠位大腿骨血管を結紮します(図3)。術後の罹患率を最小限に抑えるために、神経を傷つけたり結ばったりしてはなりません。
注:外科医は、鉗子の1つを使用して、片手で筋膜を神経の外側にそっと引っ張り、別のペアを使用して神経を血管から完全に分離できます。 - 8-0縫合糸、上腹部血管の出現直後に遠位血管を結紮し、椎弓根の起点から1mmの距離を残す。これにより、虚血期に深い枝からSIEAを通過する逆流がなくなります。
注 :図3 は、SIEA椎弓根の出現後の結紮された遠位大腿骨血管を示しています。 - 近位大腿血管で、結合組織をきれいにする同じプロセスを繰り返します。ただし、動脈と静脈を互いに分離して、効率的なクランプを可能にします。これは、閉じた鉗子を動脈と静脈の間に静かに置き、血管の走行方向に鉗子をゆっくりと開くことによって達成できます。
- 間欠性虚血を誘発するには、各近位大腿動脈と静脈に個別に顕微手術クランプを配置します(図4)。
- 虚血性損傷が完了したら、フラップを元の位置に縫合し、術前に描かれたマークを並べます(ステップ4.2.2)。3-0ナイロンを使用したランニング縫合糸を使用してフラップを縫合します( 材料表を参照)、鼠径部の折り目の内側から始まり、フラップの周り、鼠径部の折り目で横方向に終わります。
注意: 鼠径部のしわに沿って、同じ縫合糸を使用して中断されたステッチを配置することができます。これにより、研究者はフラップの閉鎖に影響を与えることなくこの領域を開くことができます。 - フラップへの血液供給を確認するには、ヘパリン生理食塩水注射で説明したのと同じ技術とツールを使用して、0.25 mLの滅菌フルオレセインナトリウム(10%、 材料の表を参照)を陰茎静脈に注入します(ステップ5.1)。3分後、長波UV-366 nmランプ(フルオレセイン励起光)を照らし、灌流領域に対応する蛍光領域を明らかにした。
- 閉鎖と検証の後、自動切断を防ぐために縫合糸に沿って粉砕されたメトロニダゾール( 材料表を参照)を広げ、同じ領域に液体包帯をスプレーします。
- 動物が麻酔から回復する前に、カルプロフェン(2-5 mg / kg)を皮下投与します。.
- 研究者は、フラップへの唯一の栄養源である大腿血管にアクセスして、実験的な虚血性プレコンディショニングレジメンを数日間続けてテストできるようになりました。手術の毎日、2〜5 mg / kgのカルプロフェンを皮下投与します。.
- 虚血性プレコンディショニング期間の終わりに、上腹部血液供給からフラップを除去するために、フラップの下境界に沿って脂肪パッドより下を焼灼する。
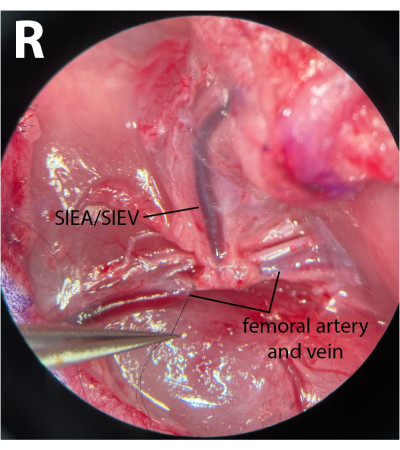
図3:大腿骨血管の顕微鏡図。 遠位大腿骨血管は結ばれています。神経は保存されています。解剖側は右鼠径部折り目(R)である。倍率:40倍。 この図の拡大版を表示するには、ここをクリックしてください。

図4:2つの別々の顕微手術クランプを使用した近位大腿血管のクランプ。 これにより、より良いクランプ制御が可能になり、動脈および逆行性の静脈流がなくなります。(A)は、左(L)挟持された両大腿血管を示す。表在性下心窩部血管が見える(SIEA/SIEV)。(B)は、クランプ前の大腿動脈と大腿静脈を示す、動物(R)の右鼠径瀂に。倍率:40倍。 この図の拡大版を表示するには、ここをクリックしてください。
6.術後ケア
- カルプロフェン(2-5 mg / kg)を術後4日間1日1回皮下投与し、補助鎮静後に1回投与します。.
- 最初の24時間は、動物を2回観察します。次に、研究が終了するまで、少なくとも1日1回、動物とフラップを評価します。
注意: 動物は明るく、警戒心が強く、反応的でなければなりません。全身性日和見感染の兆候がある場合(すなわち、嗜眠または体重減少)、動物は施設で承認されたプロトコルに従って安楽死させる必要があります。. - 早期壊死(術後5日目の結紮前[POD5])、手術部位の裂開、感染、血腫、虚血、および/または皮弁のオートファジーについてフラップを監視します。
- 手術部位の裂開がある場合は、瘢痕縁をデブライドし、滅菌水または滅菌生理食塩水で十分にすすぐ前に10%ポビドンヨードで部位を洗浄し、中断された3-0ナイロン縫合糸を使用して創傷を閉じます。
- 研究の最後に、0.1〜0.2 mLの31%ナトリウムフェノバルビタール溶液のIV注射または地元のIACUCが推奨するプロトコルで動物を安楽死させます。心拍と呼吸運動がないことで死亡を確認します。
結果
すべてのフラップはPOD5で実行可能であり、SIEAのみによる良好な血管新生を示しました。 図5 は、フルオレセイン注射のIV前後のフラップを示す、完全な血管新生を示す。

図5:フルオレセイン血管造影(POD0)の即時静脈内投与。 この評価は、SIEAのみによるフラップの血管新生を示しています。緑色の蛍光は、フラップパドル全体を含むよく灌流された組織を示しています。倍率:40倍。 この図の拡大版を表示するには、ここをクリックしてください。
ピクセル分析ソフトウェア( 材料表を参照)を使用して、フラップの生存率を客観的に評価しました。フルオレセイン蛍光は緑色の波長に位置しています(115〜255nmの窓を使用しました)。フラップ円周を選択することにより、ソフトウェアは特定の波長に含まれるピクセルの割合を提供します。これにより、壊死領域に含まれるピクセルが蛍光波長ウィンドウ内にないため、フラップの生存率を正確に測定できます。
2つの対照モデルの結果が提示される:I.P.のないこの軸性筋膜皮膚皮弁モデルの生存率を確認するための陰性対照群、および事前のI.P.なしでPOD 5で結紮した場合の生存不能を検証するための陽性対照群現在の文献16。 図6 は、これらの制御モデルの両方の実験計画を示しています。

図6:対照群モデルのタイムライン。 すべてのグループはPOD0でフラップ上昇を受けました。陰性対照群は、フラップの血管に外科的介入を伴わないフラップ観察で構成されていました。陽性対照群は、虚血性プレコンディショニングなしのPOD5上の結紮で構成されていました。 この図の拡大版を表示するには、ここをクリックしてください。
図7に見られるように、陰性対照群はフラップパドルの全生存率を示した。このグループでは、POD10で99.50%±0.76%の生存が経験され、給餌容器に結紮は行われませんでした。この観察期間中、すべての動物は健康を維持しました。
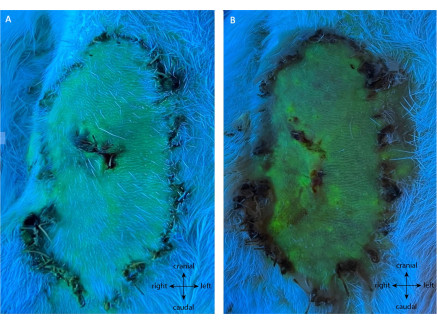
図7:(A)POD5および(B)POD10での陰性対照の血管造影。 この評価は、その茎への介入なしに皮弁の完全な生存を示しています。緑色の蛍光は、フラップパドル全体を含む、十分に灌流された組織を示しています。注:この複製で対照生検が行われました。倍率:40倍。 この図の拡大版を表示するには、ここをクリックしてください。
陽性対照群は、同じ最初の皮弁収穫手術を受けた。その後、POD5では、血管を焼灼し、フラップへの血流を直接遮断した。結紮前にI.P.は行われなかった。POD5-10を通して、フラップの色が暗くなり硬化するにつれて、進行性のフラップ壊死が見られました。 図8Aに見られるように、結紮後のフラップは、IVフルオレセイン注射後、周囲の皮膚が灌流されている間、先端を除いて蛍光を示さなかった。POD10では、フラップはすべての反復で表面の11.25%±1.58%以上生存可能であり(図8B)、POD5の主茎からの自律神経症が不十分であることが示されました。興味深いことに、遠位先端は自律的でPOD10で生き残った唯一の部分でした。
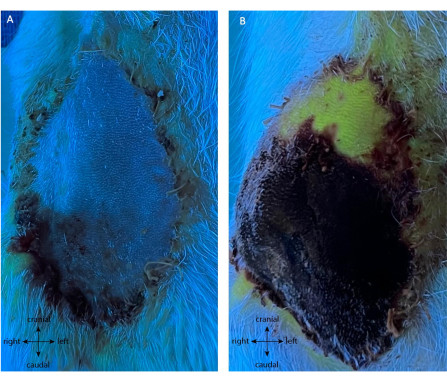
図8:結紮後の(A)POD5および(B)POD10におけるポジティブコントロールの血管造影。 結紮直後の緑色蛍光の不在(A)は、皮弁の灌流を示さず、新生血管形成の欠如を証明した。これはPOD10(B)で確認され、皮膚パドル(黒/紫)の85%が壊死します。興味深いことに、遠位先端は生存可能であり、新生血管化されています(フラップの緑色蛍光部分)。倍率:40倍。 この図の拡大版を表示するには、ここをクリックしてください。
このモデルの価値を実証するために、I.P.の短いサイクルを使用するグループ(n = 3)もテストされました。動物は、15分間の虚血の3サイクルを受け、続いて、POD516の結紮前に、POD0、1、2、および3の鼠径部の折り目を介してアクセスされる近位大腿血管の動脈および静脈をクランプおよびアンクランプすることにより、15分間の再灌流を受けた。
目視では、虚血期間中の皮弁の淡い/青色の変色と上腹部血管の血液の黒ずみを観察することにより、クランプ期間の機能を確認しました。さらに、研究者らは結紮後にPOD5にフルオレセインを注射し、陽性対照群と同等のフラップ生存率(フラップ生存率の5.03%±13.67%)を観察し、このI.P.プロトコルがこのモデルでは非効率的であることを示しています(図9)。

図9:POD10のフラップ表面生存率の統計分析。 マン-ホイットニーU検定を実施して群を比較した。両側 のp値がUジグザグ線上に表示されます。陰性対照群(n=4)は99.5%の生存率を示した。陽性対照群(n = 5)は11.25%の生存率を示した。一例として、実験群は13.67%の生存率を示し、陽性対照と比較して有意でない改善を示した(p = 0.86)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この記事では、ラットで採取した再現性のある皮膚筋膜モデルについて説明し、I.P.評価を可能にします。この段階的な手術プロトコルは、研究グループにさまざまなIPレジメンをテストするための信頼できるモデルを提供します。椎弓根以外の血管新生を防ぐことにより、このモデルは、創傷床と縁からのフラップの新生血管形成を研究することを可能にします。以前の研究では、POD5-711、13、16のラットでこのフラップの自律化が観察されているため、この研究ではPOD5で結紮を行いました。このモデルは、完全な自律化に必要な間隔を最適化および短縮する虚血再灌流障害(IRI)研究を支援することを目的としています。したがって、虚血性プレコンディショニングで最も重要な結果を確認するために、私たちの目標は、自律化後、フラップの完全な新生血管形成の前に摂食血管を結紮することでした(POD716で起こると説明されています)。
このモデルの成功は、皮膚フラップの調達中に大腿骨血管またはSIE血管に損傷が発生しないようにすることにあり、外科医はフラップ手順全体を通して血管の視覚化を維持する必要があります。さらに、遠位大腿血管は、他の血管からの逆流が来ないように、近位血管を通して虚血を正確に誘発するために適切に結紮されなければならない。これらのステップは、実験結果を観察するために重要です。
このモデルの利点は、近位大腿血管がSIEA茎への唯一の血液源であることを確認する慎重な血管準備の後、代わりに大腿骨血管を操作することによって上腹部血管の完全性を維持することです。利点は、固定された大腿血管のサイズがその内腔の良好な回復を可能にすることである。対照的に、静脈顕微手術クランプは上腹部血管に永久的な損傷を与える可能性があり、実験の終了が必要になります。さらに、鼠径部のしわの大腿血管郭清は、術後の線維症のために、最初の手術後の上腹部脂肪パッドよりもアクセスしやすいです。このモデルは、血管クランプを含む反復手術のためのより安全なアクセスを可能にします。Hsuら17 は、IRI研究のための同様のモデルを説明したが、手順は記述しなかった。
このモデルのもう一つの革新は、フラップ血管新生と生存率を確認するためのIVフルオレセイン注射です。他の著者らは、ラット皮弁モデルにおけるインドシアニングリーン(ICG)IV注射18,19を記載し、診療所での使用と同様である20,21。しかしながら、ICGおよび特定の必要なハードウェアのコストは制限であり、効率的な技術ではないようである22。私たちは、シンプルな木製ランプを使用してあらゆる実験室で使用できる簡単な技術について説明し、フラップの生存率と血管新生を適切に視覚化できるようにしました。
このモデルの1つの制限は、同じ動物の2つのフラップを適切に評価できないことです。対側フラップの椎弓根23のクランプによって引き起こされるリモートI.P.の潜在的な影響のために、治療されたフラップと生物学的対照の両方を同時に評価することは不可能です。
I.P.の臨床応用は、形成外科医によるテーブル上のクランプ/アンクランプシーケンスの信頼性の高いプロトコルを提供することにより、筋膜皮膚皮弁の生存率を向上させることができます。一部の著者は、額のフラップと鼠径部のフラップの早期の椎弓根分割を可能にするためのIPの使用を説明しています24,25。ただし、IPプロトコルは、外科医がより一般的に使用できるように信頼できるツールを提供するように最適化する必要があります。私たちが説明するモデルで可能になったローカルとリモートI.P.の両方が、筋膜皮膚皮弁の生存率を改善する上で有望な結果を示しています26。最後に、このモデルは、虚血再灌流損傷および研究対象分野であるそのようなタイプのストレスに対する全身反応の研究に適している23。
結論として、信頼性が高く再現性のあるモデルのこの正確な説明は、ラット筋膜皮膚皮弁モデルにおけるI.P.および虚血再灌流損傷研究のための貴重なツールを提供し、研究者に以前のモデルと比較して操作とアクセスのためのより大きな血管を提供します。
開示事項
すべての著者は、宣言する金銭的利益を持っていません。
謝辞
この作業は、マサチューセッツ総合病院(W.G.A)とシュラインズチルドレンズボストン(B.U、K.U、C.L.C)によって資金提供されました。Y.BとI.F.v.Rは、シュラインズ・ホスピタルズ・フォー・チルドレン(それぞれ提案ID:#970280と#857829)によって資金提供されています。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe Luer-Lok Tip | BD | 309628 | |
| 3-0 Ethilon 18” Black Monofilament Nylon suture | Ethicon | ETH-663H | |
| 8-0 Ethilon 12” Black Monofilament Nylon suture | Ethicon | 1716G | |
| Adson Atraumatic Forceps | Aesculap Surgical Instruments | BD51R | |
| Akorn Fluorescein Injection USP 10% Single Dose Vial 5 mL | Akorn | 17478025310 | |
| Betadine Solution 5% Povidone-Iodine Antiseptic Microbicide | PBS Animal Health | 11205 | |
| Bipolar Cords | ASSI | ASSI.ATK26426 | |
| Buprenorphine Hydrochloride Injection | PAR Pharmaceutical | 3003406C | This concentration needs to be diluted for rodents. |
| Depilatory product – Nair Hair remover lotion | Nair | NC0132811 | |
| Ear tag applier | World Precision Instruments | NC0038715 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | |
| Jewelers Bipolar Forceps Non-Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star elastic stays | Cooper Surgical | 3311-1G | |
| Lone star Self-retaining retractor | Cooper Surgical | 3304G | |
| Metronidazole tablets USP | Teva | 500111-333-06 | |
| Micro spring handle scissors | AROSurgical | 11.603.14 | |
| Microscope (surgical) | Leica | M525 F40 | |
| Microsurgical clamp applying forceps | Ambler Surgical | 31-906 | |
| Microsurgical clamps (x2) | Millennium Surgical | 18-B1V | |
| Microsurgical Dumont #4 forceps | Dumont Swiss made | 1708-4TM-PO | |
| Microsurgical needle holder | ASSI | B-14-8 | |
| Needle holder | World Precision Instruments | 501246 | |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | |
| Pixel analysis software | GNU Image Manipulation Program v2.10 | GIMP | GNU Open licence |
| PrecisionGlide Needle 27 G | BD | 305109 | |
| Ragnell Scissors | Roboz Surgical | RS-6015 | |
| Rimadyl (carprofen) | Zoetis | 10000319 | This concentration needs to be diluted for rodents |
| Scientific Elizabethan collar (e-collar) for Rats | Braintree Scientific | NC9263311 | |
| Small animal ear tag | National Band & Tag Company | Style 1005-1 | |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Sterile towel drape | Dynarex Corporation | 4410 | |
| Sterile water for injection and irrigation | Hospira | 0409488724-1 | |
| Surgical scrub – BD ChloraPrep Hi-Lite Orange 3 mL applicator with Sterile Solution | BD | 930415 | |
| UV lamp | UVP | UVL-56 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
参考文献
- Copelli, C., et al. Management of free flap failure in head and neck surgery. ACTA Otorhinolaryngologica Italica. 37 (5), 387-392 (2017).
- Lese, I., Biedermann, R., Constantinescu, M., Grobbelaar, A. O., Olariu, R. Predicting risk factors that lead to free flap failure and vascular compromise: A single unit experience with 565 free tissue transfers. Journal of Plastic, Reconstructive & Aesthetic Surgery. 74 (3), 512-522 (2021).
- Wang, W., et al. Flap failure and salvage in head and neck reconstruction. Seminars in Plastic Surgery. 34 (4), 314-320 (2020).
- Gabrysz-Forget, F., et al. Free versus pedicled flaps for reconstruction of head and neck cancer defects: a systematic review. Journal of Otolaryngology - Head & Neck Surgery. 48 (1), 13 (2019).
- Sievert, M., et al. Failure of pedicled flap reconstruction in the head and neck area: A case report of a bilateral subclavian artery stenosis. International Journal of Surgery Case Reports. 76, 381-385 (2020).
- Vaienti, L., et al. Failure by congestion of pedicled and free flaps for reconstruction of lower limbs after trauma: the role of negative-pressure wound therapy. Journal of Orthopaedics and Traumatology. 14 (3), 213-217 (2013).
- Murry, C. E., Jennings, R. B., Reimer, K. A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 74 (5), 1124-1136 (1986).
- Akcal, A., et al. Combination of ischemic preconditioning and postconditioning can minimise skin flap loss: experimental study. Journal of Plastic Surgery and Hand Surgery. 50 (4), 233-238 (2016).
- Ulker, P., et al. Does ischemic preconditioning increase flap survival by ADORA2B receptor activation. Clinical Hemorheology and Microcirculation. 75 (2), 151-162 (2020).
- Min, S. -. H., Choe, S. H., Kim, W. S., Ahn, S. -. H., Cho, Y. J. Effects of ischemic conditioning on head and neck free flap oxygenation: a randomized controlled trial. Scientific Reports. 12 (1), 8130 (2022).
- Dacho, A., Lyutenski, S., Aust, G., Dietz, A. Ischemic preconditioning in a rat adipocutaneous flap model. HNO. 57 (8), 829-834 (2009).
- Yildiz, K., et al. Comparison of the flap survival with ischemic preconditioning on different pedicles under varied ischemic intervals in a rat bilateral pedicled flap model. Microsurgery. 34 (2), 129-135 (2014).
- Ottomann, C., Küntscher, M., Hartmann, B., Antonic, V. Ischaemic preconditioning suppresses necrosis of adipocutaneous flaps in a diabetic rat model regardless of the manner of preischaemia induction. Dermatology Research and Practice. 2017, 4137597 (2017).
- Grimaud, J., Murthy, V. N. How to monitor breathing in laboratory rodents: a review of the current methods. Journal of Neurophysiology. 120 (2), 624-632 (2018).
- Strohl, K. P., et al. Ventilation and metabolism among rat strains. Journal of Applied Physiology. 82 (1), 317-323 (1997).
- Mucke, T., et al. Autonomization of epigastric flaps in rats. Microsurgery. 31 (6), 472-478 (2011).
- Hsu, C. -. E., et al. The rat groin flap model redesigned for evaluating treatment effects on ischemia-reperfusion injury. Journal of Surgical Research. 222, 160-166 (2018).
- Mücke, T., et al. Indocyanine green videoangiography-assisted prediction of flap necrosis in the rat epigastric flap using the flow® 800 tool. Microsurgery. 37 (3), 235-242 (2017).
- Wang, D., Chen, W. Indocyanine green angiography for continuously monitoring blood flow changes and predicting perfusion of deep inferior epigastric perforator flap in rats. Journal of Investigative Surgery. 34 (4), 393-400 (2021).
- Berkane, Y., et al. How to secure pedicled flaps using perioperative indocyanine green angiography: a prospective study about 10 cases. World Journal of Surgery and Surgical Research. 4 (1), 1319 (2021).
- Alstrup, T., Christensen, B. O., Damsgaard, T. E. ICG angiography in immediate and delayed autologous breast reconstructions: peroperative evaluation and postoperative outcomes. Journal of Plastic Surgery and Hand Surgery. 52 (5), 307-311 (2018).
- Küntscher, M. V., et al. Ischemic preconditioning by brief extremity ischemia before flap ischemia in a rat model. Plastic and Reconstructive Surgery. 109 (7), 2398-2404 (2002).
- Liu, R. Q., et al. Cost analysis of indocyanine green fluorescence angiography for prevention of anastomotic leakage in colorectal surgery. Surgical Endoscopy. 36 (12), 9281-9287 (2022).
- Cheng, M. H., et al. Devices for ischemic preconditioning of the pedicled groin flap. The Journal of Trauma. 48 (3), 552-557 (2000).
- Xiao, W., et al. An innovative and economical device for ischemic preconditioning of the forehead flap prior to pedicle division: a comparative study. Journal of Reconstructive Microsurgery. 38 (9), 703-710 (2022).
- Küntscher, M. V., Hartmann, B., Germann, G. Remote ischemic preconditioning of flaps: a review. Microsurgery. 25 (4), 346-352 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved