Method Article
Il lembo assiale dell'arteria epigastrica inferiore superficiale per studiare gli effetti del precondizionamento ischemico in un modello di ratto
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive la raccolta, la sutura e il monitoraggio dei lembi fasciocutanei nei ratti che consentono una buona visualizzazione e manipolazione del flusso sanguigno attraverso i vasi epigastrici inferiori superficiali mediante il serraggio e la legatura dei vasi femorali. Questo è fondamentale per gli studi che coinvolgono il precondizionamento ischemico.
Abstract
I lembi fasciocutanei (FCF) sono diventati il gold standard per la ricostruzione di difetti complessi in chirurgia plastica e ricostruttiva. Questa tecnica di risparmio muscolare consente di trasferire tessuti vascolarizzati per coprire qualsiasi difetto di grandi dimensioni. FCF può essere utilizzato come alette peduncolari o come alette libere; tuttavia, in letteratura, i tassi di fallimento per FCF peduncolata e FCF libera sono superiori al 5%, lasciando spazio per il miglioramento di queste tecniche e un'ulteriore espansione delle conoscenze in questo settore. Il precondizionamento ischemico (I.P.) è stato ampiamente studiato, ma i meccanismi e l'ottimizzazione del regime I.P. devono ancora essere determinati. Questo fenomeno è infatti poco esplorato nella chirurgia plastica e ricostruttiva. Qui, viene presentato un modello chirurgico per studiare il regime I.P. in un modello di lembo fasciocutaneo assiale di ratto, che descrive come valutare in modo sicuro e affidabile gli effetti dell'I.P. sulla sopravvivenza del lembo. Questo articolo descrive la procedura chirurgica completa, inclusi suggerimenti per migliorare l'affidabilità di questo modello. L'obiettivo è fornire ai ricercatori un modello riproducibile e affidabile per testare vari regimi di precondizionamento ischemico e valutare i loro effetti sulla sopravvivenza del lembo.
Introduzione
La chirurgia plastica e ricostruttiva è in continua evoluzione. Lo sviluppo dei lembi muscolari, fasciocutanei e perforatori ha permesso di offrire ricostruzioni di migliore qualità riducendo la morbilità. Combinando questa migliore conoscenza anatomica con competenze tecniche avanzate, i chirurghi ricostruttivi possono eseguire trasferimenti di lembo liberi quando i difetti non sono vicini a nessuna soluzione locale. Tuttavia, mentre la chirurgia del lembo perforatore è attualmente la tecnica più avanzata in chirurgia ricostruttiva, la letteratura riporta un tasso di fallimento del 5% nei trasferimenti di lembo libero 1,2,3 e fino al 20% per la ricostruzione del lembo peduncolare 4,5,6. Il fallimento parziale o totale del lembo si verifica quando il peduncolo del lembo è compromesso, quindi è essenziale cercare continuamente miglioramenti alle tecniche attuali. Uno dei metodi per migliorare la sopravvivenza del lembo è quello di promuovere la sua neovascolarizzazione sul letto della ferita, consentendo così la perfusione da parte di una fonte diversa dal peduncolo. Il precondizionamento ischemico (I.P.) è stato inizialmente descritto in un modello cardiaco7, dimostrando che un organo esposto a ischemia controllata sopravvive in misura maggiore dopo aver perso il suo apporto di sangue primario subendo neovascolarizzazione indotta da ischemia. Diversi autori hanno studiato questo principio fondamentale per ottimizzare la sopravvivenza del lembo in modelli preclinici e clinici 8,9,10.
Il vantaggio di questa tecnica rispetto ad altri metodi per migliorare la sopravvivenza del lembo è la sua facilità di implementazione, consistente in test di morsetto/declamp della fonte di sangue. Nel modello di ratto, gli autori precedenti hanno utilizzato il lembo superficiale dell'arteria epigastrica inferiore (SIEA) per studiare l'I.P. bloccando il peduncolo principale11,12,13. Tuttavia, diversi problemi tecnici possono essere incontrati con questo modello e la letteratura manca di protocolli ben descritti.
Pertanto, questo lavoro mira a fornire ai ricercatori una descrizione dettagliata di una tecnica di approvvigionamento del lembo SIEA di ratto con una dissezione estesa dei vasi femorali per consentire studi I.P. su un modello di lembo fasciocutaneo assiale. Questo modello mantiene l'integrità dei vasi epigastrici e manipola invece i vasi femorali, che sono più resistenti. Condividiamo la nostra esperienza e gli strumenti per migliorare lo studio di questo fenomeno e aumentare la replicabilità di questa procedura.
Protocollo
Il Massachusetts General Hospital Institutional Animal Care and Use Committee ha approvato il protocollo sperimentale (protocollo IACUC #2022N000099). Gli autori hanno seguito la lista di controllo delle linee guida ARRIVE (Animal Research: Reporting In Vivo Experiments) per questo lavoro. Tutti gli animali hanno ricevuto cure umane seguendo la Guida del National Institute of Health per la cura e l'uso degli animali da laboratorio. Un totale di 12 ratti maschi di Lewis (250-350 g, 8-10 settimane) sono stati utilizzati per tutti gli esperimenti.
1. Preparazione degli animali
NOTA: I ratti hanno un alto tasso metabolico e riserve di grasso limitate; Pertanto, non averli veloci prima dell'intervento chirurgico e non limitare mai l'acqua prima dell'intervento chirurgico.
- Per tutte le procedure, sedare l'animale usando isoflurano al 3%-5% nella camera del vaporizzatore di precisione isoflurano (vedi Tabella dei materiali). Quando l'animale è ben sedato, abbassare la dose di isoflurano all'1% -3% attraverso un cono nasale.
NOTA: Un secondo ricercatore deve monitorare continuamente la frequenza respiratoria e adattare la dose di isoflurano. - A 2 giorni prima dell'intervento chirurgico iniziale, posizionare un collare elettronico di plastica (delle dimensioni di un ratto; vedi Tabella dei materiali) sull'animale e utilizzare una sutura di nylon 3-0 per fissare il collare elettronico sui lati dorsale e ventrale del collo dell'animale. Consentire 2 giorni per l'acclimatazione a questo collare elettronico; Dovrebbe adattarsi perfettamente ma non ostruire le vie aeree dell'animale.
2. Cure preoperatorie
- Il giorno dell'intervento iniziale, radere l'aspetto anteriore inferiore dell'addome, liberando l'area dalla parte laterale dell'animale fino a superare leggermente la linea mediana.
- Quindi, utilizzare un prodotto depilatorio (crema depilatoria; vedere Tabella dei materiali) per rimuovere tutti i peli rimanenti in quest'area (l'aspetto anteriore inferiore dell'addome come descritto nel passaggio precedente).
- Lavare e asciugare accuratamente l'area con scrub chirurgico e soluzione di betadine (10% povidone-iodio).
- Somministrare 0,05 mg/kg di buprenorfina per via sottocutanea.
3. Monitoraggio intraoperatorio
- Assicurarsi che l'animale rimanga sull'isoflurano all'1% -3% tramite un vaporizzatore di precisione e un cono nasale durante l'intervento. Monitorare la frequenza respiratoria, la respirazione e il livello di saturazione di ossigeno dell'animale mediante l'osservazione visiva e un pulsossimetro per roditori fatto per un ratto.
NOTA: La frequenza respiratoria tipica è di 80-90 cicli al minuto14,15. Qualsiasi reazione che indichi la coscienza osservata durante l'intervento chirurgico richiede l'aumento della velocità di isoflurano. - Posizionare l'animale su una piastra riscaldante per l'intero intervento chirurgico, poiché la temperatura corporea dei roditori si raffredda rapidamente sotto anestesia.
4. Raccolta del lembo epigastrico
- Metti l'animale in posizione supina. Rasare l'addome da sotto la piega inguinale al di sopra del livello del processo xifoideo.
- Usando una penna e un righello sterili, segnare prima la linea mediana dell'addome dell'animale e poi la piega inguinale. Un'incisione lungo la linea di piega inguinale espone i vasi epigastrici inferiori che si diramano dai vasi femorali.
- Prima dell'incisione, disegnare il lembo futuro come un ovale o un rettangolo fino a 6 cm verticalmente e 3 cm orizzontalmente, estendendosi cranialmente dalla piega inguinale.
- Disegna cinque o sei segni equidistanti perpendicolarmente ai limiti dei lembi. Questi servono come guide per riallineare meglio la pelle dopo che il lembo è stato sollevato e viene suturato di nuovo in posizione (Figura 1).
- Usando le forbici Ragnell (vedi Tabella dei materiali), fai un'incisione longitudinale di 3-4 cm sulla piega inguinale.
NOTA: I ricercatori dovrebbero usare cautela e tirare la pelle verso l'alto per evitare di danneggiare i vasi. - Esporre e identificare i vasi femorali ed epigastrici utilizzando la pinza microchirurgica #4 jewelers (vedi Tabella dei materiali), aprendo e chiudendo la pinza per separare la fascia e accedere ai vasi che si trovano sotto il cuscinetto di grasso inguinale.
- Utilizzare l'incisione inguinale per iniziare l'incisione del lembo usando le forbici Ragnell. Prestare attenzione a minare l'intero spessore della pelle e il tessuto connettivo sopra il muscolo addominale.
- Per facilitare la raccolta dei lembi, assicurarsi che le forbici seguano il giusto piano di dissezione spingendo verso il muscolo e allargando le lame delle forbici. Eseguire questo indebolimento del lembo spostandosi in una direzione coordinata attorno al disegno del lembo.
NOTA: Per determinare il piano corretto, nessun microvaso deve rimanere presente al di sotto del piano di dissezione.
- Per facilitare la raccolta dei lembi, assicurarsi che le forbici seguano il giusto piano di dissezione spingendo verso il muscolo e allargando le lame delle forbici. Eseguire questo indebolimento del lembo spostandosi in una direzione coordinata attorno al disegno del lembo.
- Quando la punta iniziale del lembo viene liberata dalla pelle circostante, continuare l'approvvigionamento del lembo minando dalla parte distale a quella prossimale, usando le punte a forbice Ragnell per separare il lembo dal muscolo mentre cauterizziamo eventuali vasi perforatori e vasi del plesso dermico attorno al lembo. Ciò garantisce che tutto il sangue fluisca al lembo attraverso i vasi epigastrici.
NOTA: Prestare attenzione a non danneggiare la vascolarizzazione del lembo tirando con troppa forza o torcendo la pelle mentre il lembo viene raccolto. Si consiglia di posizionare con attenzione la parte liberata del lembo sopra il pollice della mano del chirurgo mentre si lavora sulla parte prossimale del lembo. - Una volta che il lembo è completamente raccolto, i rami dei vasi epigastrici inferiori superficiali sono visibili sull'aspetto profondo della pelle. Cercare di incapsulare la totalità di entrambi i rami del SIEA con il lembo sollevando delicatamente il lembo verso l'alto per visualizzare i vasi.
- Una volta raccolto il lembo, separare i cuscinetti di grasso sull'aspetto inferiore su entrambi i lati mediale e laterale del lembo. Utilizzare il cauterizzazione bipolare (vedi Tabella dei materiali) per cauterizzare i cuscinetti adiposi vicino al bordo dell'incisione, prestando attenzione a non danneggiare il peduncolo epigastrico inferiore superficiale (Figura 2).
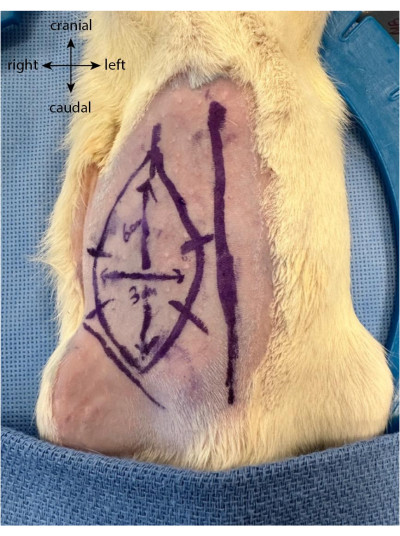
Figura 1: Disegno del lembo sull'addome dell'animale. La linea mediana viene utilizzata come marcatore per individuare la posizione del lembo epigastrico. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Flap completamente elevato. Il cuscinetto adiposo viene conservato nella parte prossimale del lembo per preservare la vascolarizzazione proveniente dal peduncolo epigastrico inferiore superficiale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Preparazione dei vasi e induzione dell'ischemia
NOTA: Il lembo è interamente raccolto in questa fase, ma i vasi non sono ancora preparati per il precondizionamento ischemico.
- Prima della preparazione dei vasi femorali, iniettare una singola dose di 17,5 UI di eparina di sodio attraverso la vena del pene.
NOTA: Questa iniezione viene eseguita esponendo il glande, tenendo il pene esternamente utilizzando una pinza Adson atraumatica, identificando la vena del pene e iniettando superficialmente e lungo la vena del pene utilizzando una siringa da 27 G. - Per creare una migliore esposizione, posizionare l'animale all'interno di un divaricatore autobloccante Lone Star (vedi Tabella dei materiali).
NOTA: I foderi elastici Lone Star allontanano la pelle dal sito chirurgico, consentendo una migliore visione dei vasi. Il ricercatore deve ora lavorare al microscopio chirurgico (ingrandimento 40x). - Per esporre i vasi, utilizzare due pinze microchirurgiche #4 per sezionare i vasi femorali sia prossimalmente che distalmente all'emergere dei vasi epigastrici superficiali. Non tenere direttamente i vasi, ma utilizzare invece la pinza per separare delicatamente il tessuto connettivo strato per strato aprendo e chiudendo la pinza verticalmente ai vasi.
- Sui vasi femorali distali, pulire la fascia e liberare delicatamente il nervo dall'arteria e dalla vena. Usando un 8-0 sutura di nylon (vedi Tabella dei materiali), ligare i vasi femorali distali aggirando il portaago microchirurgico sotto l'arteria e la vena, stringendo la sutura e legando questi vasi (Figura 3). Il nervo non deve essere danneggiato né legato per ridurre al minimo la morbilità postoperatoria.
NOTA: I chirurghi possono utilizzare una delle pinze per tirare delicatamente la fascia laterale al nervo con una mano e utilizzare un'altra coppia per separare completamente il nervo dai vasi. - Usando un 8-0 sutura, ligare i vasi distali subito dopo l'emergere dei vasi epigastrici, lasciando una distanza di 1 mm dopo l'origine del peduncolo. Ciò garantisce che nessun flusso inverso attraversi il SIEA dai rami profondi durante le fasi ischemiche.
NOTA: La figura 3 mostra i vasi femorali distali legati dopo l'emergere del peduncolo SIEA. - Sui vasi femorali prossimali, ripetere lo stesso processo di pulizia del tessuto connettivo. Tuttavia, separare l'arteria e la vena l'una dall'altra per consentire un serraggio efficiente. Ciò può essere ottenuto posizionando delicatamente una pinza chiusa tra l'arteria e la vena e aprendo lentamente le pinze nella direzione di corsa dei vasi.
- Per indurre ischemia intermittente, posizionare morsetti microchirurgici separatamente su ciascuna arteria e vena femorale prossimale (Figura 4).
- Quando le lesioni ischemiche sono completate, suturare il lembo nella sua posizione originale, allineando i segni come disegnati preoperatoriamente (fase 4.2.2). Suturare il lembo usando una sutura corrente con nylon 3-0 (vedi Tabella dei materiali), iniziando dalla piega inguinale medialmente, attorno al lembo, e terminando alla piega inguinale lateralmente.
NOTA: Lungo la piega inguinale, la stessa sutura può essere utilizzata per posizionare punti interrotti. Ciò consente ai ricercatori di aprire quest'area senza influire sulla chiusura del lembo. - Per verificare l'afflusso di sangue al lembo, iniettare 0,25 ml di fluoresceina sodica sterile (10%, vedere Tabella dei materiali) nella vena del pene utilizzando la stessa tecnica e gli stessi strumenti descritti per l'iniezione salina di eparina (fase 5.1). Dopo 3 minuti, far brillare una lampada UV-366 nm a onda lunga (luce di eccitazione della fluoresceina) per rivelare le aree fluorescenti corrispondenti alle aree perfuse.
- Dopo la chiusura e la verifica, distribuire metronidazolo frantumato (vedi Tabella dei materiali) lungo le suture per prevenire l'automutilazione e spruzzare benda liquida nella stessa area.
- Prima del recupero dell'animale dall'anestesia, somministrare Carprofen (2-5 mg/kg) per via sottocutanea.
- I ricercatori possono ora accedere ai vasi femorali, l'unica fonte di alimentazione per il lembo, per testare regimi sperimentali di precondizionamento ischemico per diversi giorni consecutivi. Ogni giorno dell'intervento, fornire una dose di 2-5 mg / kg di Carprofen per via sottocutanea.
- Alla fine del periodo di precondizionamento ischemico, per rimuovere il lembo dall'afflusso di sangue epigastrico, cauterizzare inferiore al cuscinetto adiposo lungo il bordo inferiore del lembo.
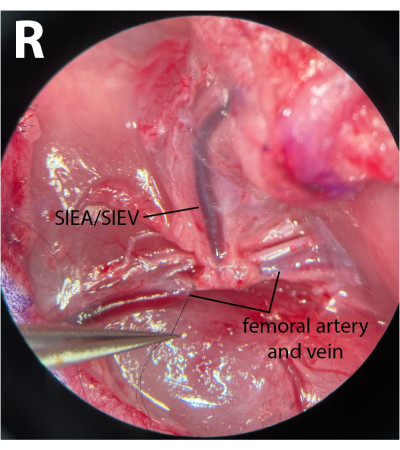
Figura 3: Vista microscopica dei vasi femorali. I vasi femorali distali sono legati. Il nervo è stato preservato. Il lato della dissezione è la piega inguinale destra (R). Ingrandimento: 40x. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Bloccaggio dei vasi femorali prossimali mediante due morsetti microchirurgici separati. Ciò consente un migliore controllo del serraggio, garantendo l'assenza di flusso venoso arterioso e retrogrado. (A) mostra entrambi i vasi femorali sinistro (L) bloccati. Sono visibili i vasi epigastrici inferiori superficiali (SIEA/SIEV). (B) mostra un'arteria femorale bloccata e una vena femorale prima del serraggio, sulla piega inguinale destra dell'animale (R). Ingrandimento: 40x. Fare clic qui per visualizzare una versione ingrandita di questa figura.
6. Cure postoperatorie
- Somministrare Carprofen (2-5 mg/kg) per via sottocutanea una volta al giorno per 4 giorni dopo l'intervento e una volta dopo eventuali sedazioni supplementari.
- Per le prime 24 ore, osserva l'animale due volte. Quindi, valutare l'animale e il lembo almeno una volta al giorno fino alla fine dello studio.
NOTA: L'animale deve essere brillante, vigile e reattivo. Se ci sono segni di infezioni opportunistiche sistemiche (cioè letargia o perdita di peso), l'animale deve essere eutanasia seguendo protocolli approvati dall'istituzione. - Monitorare il lembo per necrosi precoce (prima della legatura il giorno 5 postoperatorio [POD5]), deiscenza del sito chirurgico, infezione, ematoma, ischemia e/o autofagia del lembo.
- Se c'è deiscenza del sito chirurgico, sbrigliare i margini della cicatrice, pulire il sito con il 10% di iodio povidone prima di risciacquare abbondantemente con acqua sterile o soluzione salina sterile e chiudere la ferita usando suture di nylon 3-0 interrotte.
- Al termine dello studio, eutanasia dell'animale con un'iniezione endovenosa di 0,1-0,2 ml di soluzione di fenobarbital di sodio al 31% o con il protocollo raccomandato dalla IACUC locale. Confermare la morte per l'assenza di battito cardiaco e movimenti respiratori.
Risultati
Tutti i lembi erano vitali su POD5, mostrando una buona vascolarizzazione da parte della sola SIEA. La figura 5 mostra il lembo prima e dopo l'iniezione endovenosa di fluoresceina, mostrando una vascolarizzazione completa.

Figura 5: Angiografia con fluoresceina per via endovenosa immediata (POD0). Questa valutazione mostra la vascolarizzazione del lembo da parte della sola SIEA. La fluorescenza verde mostra tessuto ben perfuso compresa l'intera paletta del lembo. Ingrandimento: 40x. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Un software di analisi dei pixel (vedi Tabella dei materiali) è stato utilizzato per fornire una valutazione oggettiva della sopravvivenza del lembo. La fluorescenza della fluoresceina si trova nella lunghezza d'onda verde (è stata utilizzata una finestra da 115 a 255 nm). Selezionando la circonferenza del lembo, il software fornisce una percentuale di pixel inclusi nella lunghezza d'onda specifica. Ciò consente la misurazione precisa della sopravvivenza dei lembi, poiché i pixel inclusi nelle aree necrotiche non si trovano all'interno della finestra di lunghezza d'onda della fluorescenza.
Vengono presentati i risultati di due modelli di controllo: un gruppo di controllo negativo per confermare la fattibilità di questo modello assiale fasciocutaneo senza I.P., e un gruppo di controllo positivo per verificare la sua non sopravvivenza in caso di legatura su POD 5 senza precedente I.P. con la letteratura corrente16. La Figura 6 mostra il disegno sperimentale per entrambi questi modelli di controllo.

Figura 6: Sequenza temporale dei modelli del gruppo di controllo. Tutti i gruppi sono stati sottoposti ad elevazione del flap su POD0. Il gruppo di controllo negativo consisteva nell'osservazione del lembo senza intervento chirurgico sui vasi del lembo. Il gruppo di controllo positivo consisteva nella legatura su POD5 senza precondizionamento ischemico. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Come si vede nella Figura 7, il gruppo di controllo negativo ha presentato l'intera vitalità della paletta del lembo. In questo gruppo, il 99,50% ± lo 0,76% di sopravvivenza è stata sperimentata al POD10, dove non è stata eseguita alcuna legatura sui vasi di alimentazione. Tutti gli animali sono rimasti sani durante questo periodo di osservazione.
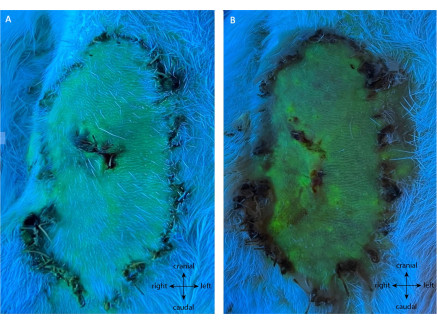
Figura 7: Angiografia del controllo negativo a (A) POD5 e (B) POD10. Questa valutazione mostra la piena sopravvivenza del lembo senza intervento sul suo peduncolo. La fluorescenza verde mostra tessuto ben perfuso, compresa l'intera paletta del lembo. Nota: sono state eseguite biopsie di controllo su questa replica. Ingrandimento: 40x. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Il gruppo di controllo positivo è stato sottoposto allo stesso intervento chirurgico iniziale di raccolta del lembo. Successivamente, su POD5, i vasi sono stati cauterizzati, interrompendo direttamente il flusso sanguigno al lembo. Nessuna I.P. è stata eseguita prima della legatura. Durante il POD5-10, è stata notata necrosi progressiva del lembo quando il lembo è diventato di colore scuro e si è indurito. Come si vede nella Figura 8A, la legatura post lembo non ha mostrato alcuna fluorescenza dopo l'iniezione endovenosa di fluoresceina a parte la punta, mentre la pelle circostante è stata perfusa. Per POD10, il lembo era vitale oltre l'11,25% ± l'1,58% della sua superficie per tutte le repliche (Figura 8B), mostrando una scarsa autonomizzazione dal suo peduncolo principale su POD5. È interessante notare che la punta distale era l'unica parte che era autonomizzata e sopravvisse a POD10.
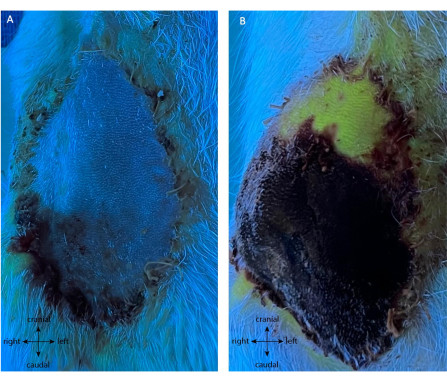
Figura 8: Angiografia del controllo positivo a (A) POD5 e (B) POD10 post legatura. L'assenza della fluorescenza verde immediatamente dopo la legatura (A) non mostra alcuna perfusione del lembo, dimostrando l'assenza di neovascolarizzazione. Ciò è confermato a POD10 (B), con necrosi dell'85% della paletta cutanea (nero/viola). È interessante notare che la punta distale è vitale e neovascolarizzata (parte fluorescente verde del lembo). Ingrandimento: 40x. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Un gruppo (n = 3) utilizzando cicli brevi di I.P. è stato anche testato per dimostrare il valore di questo modello. Gli animali sono stati sottoposti a tre cicli di 15 minuti di ischemia, seguiti da 15 minuti di riperfusione mediante serraggio e sbloccaggio dell'arteria e della vena dei vasi femorali prossimali, accessibili attraverso la piega inguinale su POD0, 1, 2 e 3, prima della legatura su POD516.
Visivamente, i ricercatori hanno confermato la funzionalità del periodo di serraggio osservando una colorazione pallida / blu del lembo e l'oscuramento del sangue nei vasi epigastrici durante i periodi di ischemia. Inoltre, i ricercatori hanno iniettato fluoresceina su POD5 dopo la legatura e hanno osservato una sopravvivenza del lembo comparabile con il gruppo di controllo positivo (13,67% ± 5,03% di sopravvivenza del lembo), dimostrando che questo protocollo IP è inefficiente in questo modello (Figura 9).

Figura 9: Analisi statistica della vitalità della superficie del lembo su POD10. I test U di Mann-Whitney sono stati eseguiti per confrontare i gruppi. I valori p a due code sono mostrati sulle linee a zigzag U. Il gruppo di controllo negativo (n = 4) ha mostrato una sopravvivenza del 99,5%. Il gruppo di controllo positivo (n = 5) ha mostrato una sopravvivenza dell'11,25%. Il gruppo sperimentale, ad esempio, ha mostrato una sopravvivenza del 13,67%, mostrando un miglioramento non significativo rispetto al controllo positivo (p = 0,86). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Questo articolo descrive un modello di lembo fasciocutaneo riproducibile raccolto nei ratti, consentendo la valutazione I.P. Questo protocollo chirurgico passo-passo fornisce ai gruppi di ricerca un modello affidabile per testare diversi regimi IP. Impedendo qualsiasi vascolarizzazione diversa dal peduncolo, questo modello consente di studiare la neovascolarizzazione del lembo dal letto e dal margine della ferita. Questo studio ha eseguito la legatura su POD5, poiché studi precedenti hanno osservato l'autonomizzazione di questo lembo nei ratti su POD5-711,13,16. Questo modello mira ad aiutare negli studi sul danno da ischemia-riperfusione (IRI) che ottimizzano e accorciano l'intervallo necessario per la piena autonomizzazione. Quindi, per vedere i risultati più significativi con il precondizionamento ischemico, il nostro obiettivo era quello di ligare i vasi di alimentazione dopo l'autonomizzazione ma prima della completa neovascolarizzazione del lembo (descritta per accadere su POD716).
Il successo del modello sta nel garantire che non si verifichino danni ai vasi femorali o SIE durante l'approvvigionamento del lembo cutaneo, il che richiederebbe al chirurgo di mantenere la visualizzazione dei vasi durante l'intera procedura del lembo. Inoltre, i vasi femorali distali devono essere opportunamente legati per indurre l'ischemia con precisione attraverso i vasi prossimali senza riflusso proveniente da altri vasi. Questi passaggi sono fondamentali per osservare i risultati sperimentali.
Il vantaggio di questo modello è che preserva l'integrità dei vasi epigastrici manipolando invece i vasi femorali, dopo un'attenta preparazione dei vasi che assicura che i vasi femorali prossimali siano l'unica fonte di sangue per il peduncolo SIEA. Il vantaggio è che la dimensione dei vasi femorali bloccati consente un buon recupero del suo lume. Al contrario, un morsetto microchirurgico venoso può danneggiare in modo permanente i vasi epigastrici, richiedendo la cessazione dell'esperimento. Inoltre, la dissezione dei vasi femorali nella piega inguinale è più accessibile rispetto al cuscinetto adiposo epigastrico dopo l'intervento chirurgico iniziale a causa della fibrosi postoperatoria. Questo modello consente un accesso più sicuro per interventi chirurgici ripetitivi che comportano il bloccaggio dei vasi; Hsu et al.17 hanno descritto un modello simile per uno studio IRI, ma non hanno descritto la procedura.
Un'altra innovazione di questo modello sono le iniezioni di fluoresceina IV per confermare la vascolarizzazione e la vitalità del lembo. Altri autori hanno descritto iniezioni di verde indocianina IV (ICG) in un modello di lembo di ratto18,19, simile al suo uso nelle cliniche20,21. Tuttavia, il costo dell'ICG e dell'hardware specifico necessario è un limite e non sembra essere una tecnica efficiente22. Abbiamo descritto una tecnica semplice che può essere utilizzata in qualsiasi laboratorio con una semplice lampada a legno, consentendo una buona visualizzazione della vitalità e della vascolarizzazione del lembo.
Una limitazione di questo modello è l'impossibilità di valutare correttamente due lembi nello stesso animale. Non è possibile valutare contemporaneamente sia un lembo trattato che un controllo biologico, a causa dei potenziali effetti di I.P. remota provocati dal bloccaggio del peduncolo del lembo controlaterale23.
Le applicazioni cliniche della terapia endovenosa possono migliorare la sopravvivenza del lembo fasciocutaneo fornendo protocolli affidabili di sequenze di clamp/unclamp on-table da parte dei chirurghi plastici. Alcuni autori hanno descritto l'uso dell'IP per consentire una divisione peduncolare precoce nei lembi della fronte e nei lembi inguinali24,25. Tuttavia, i protocolli I.P. devono essere ottimizzati per fornire ai chirurghi uno strumento affidabile per consentirne l'uso più comunemente. Sia il locale reso possibile con il modello che descriviamo che l'I.P. remota mostrano risultati promettenti nel migliorare la sopravvivenza del lembo fasciocutaneo26. Infine, questo modello è adatto per studiare le lesioni da ischemia-riperfusione e la risposta sistemica a tali tipi di stress, che è un'area di interesse di ricerca23.
In conclusione, questa descrizione accurata di un modello affidabile e riproducibile offre uno strumento prezioso per gli studi di I.P. e lesioni da ischemia-riperfusione in un modello di lembo fasciocutaneo di ratto, fornendo ai ricercatori vasi più grandi da manipolare e accedere rispetto ai modelli precedenti.
Divulgazioni
Tutti gli autori non hanno alcun interesse finanziario da dichiarare.
Riconoscimenti
Questo lavoro è stato finanziato dal Massachusetts General Hospital (W.G.A) e dallo Shriners Children's Boston (B.U, K.U, C.L.C). Y.B e I.F.v.R sono finanziati da Shriners Hospitals for Children (ID proposta: # 970280 e # 857829 rispettivamente).
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe Luer-Lok Tip | BD | 309628 | |
| 3-0 Ethilon 18” Black Monofilament Nylon suture | Ethicon | ETH-663H | |
| 8-0 Ethilon 12” Black Monofilament Nylon suture | Ethicon | 1716G | |
| Adson Atraumatic Forceps | Aesculap Surgical Instruments | BD51R | |
| Akorn Fluorescein Injection USP 10% Single Dose Vial 5 mL | Akorn | 17478025310 | |
| Betadine Solution 5% Povidone-Iodine Antiseptic Microbicide | PBS Animal Health | 11205 | |
| Bipolar Cords | ASSI | ASSI.ATK26426 | |
| Buprenorphine Hydrochloride Injection | PAR Pharmaceutical | 3003406C | This concentration needs to be diluted for rodents. |
| Depilatory product – Nair Hair remover lotion | Nair | NC0132811 | |
| Ear tag applier | World Precision Instruments | NC0038715 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | |
| Jewelers Bipolar Forceps Non-Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star elastic stays | Cooper Surgical | 3311-1G | |
| Lone star Self-retaining retractor | Cooper Surgical | 3304G | |
| Metronidazole tablets USP | Teva | 500111-333-06 | |
| Micro spring handle scissors | AROSurgical | 11.603.14 | |
| Microscope (surgical) | Leica | M525 F40 | |
| Microsurgical clamp applying forceps | Ambler Surgical | 31-906 | |
| Microsurgical clamps (x2) | Millennium Surgical | 18-B1V | |
| Microsurgical Dumont #4 forceps | Dumont Swiss made | 1708-4TM-PO | |
| Microsurgical needle holder | ASSI | B-14-8 | |
| Needle holder | World Precision Instruments | 501246 | |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | |
| Pixel analysis software | GNU Image Manipulation Program v2.10 | GIMP | GNU Open licence |
| PrecisionGlide Needle 27 G | BD | 305109 | |
| Ragnell Scissors | Roboz Surgical | RS-6015 | |
| Rimadyl (carprofen) | Zoetis | 10000319 | This concentration needs to be diluted for rodents |
| Scientific Elizabethan collar (e-collar) for Rats | Braintree Scientific | NC9263311 | |
| Small animal ear tag | National Band & Tag Company | Style 1005-1 | |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Sterile towel drape | Dynarex Corporation | 4410 | |
| Sterile water for injection and irrigation | Hospira | 0409488724-1 | |
| Surgical scrub – BD ChloraPrep Hi-Lite Orange 3 mL applicator with Sterile Solution | BD | 930415 | |
| UV lamp | UVP | UVL-56 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Riferimenti
- Copelli, C., et al. Management of free flap failure in head and neck surgery. ACTA Otorhinolaryngologica Italica. 37 (5), 387-392 (2017).
- Lese, I., Biedermann, R., Constantinescu, M., Grobbelaar, A. O., Olariu, R. Predicting risk factors that lead to free flap failure and vascular compromise: A single unit experience with 565 free tissue transfers. Journal of Plastic, Reconstructive & Aesthetic Surgery. 74 (3), 512-522 (2021).
- Wang, W., et al. Flap failure and salvage in head and neck reconstruction. Seminars in Plastic Surgery. 34 (4), 314-320 (2020).
- Gabrysz-Forget, F., et al. Free versus pedicled flaps for reconstruction of head and neck cancer defects: a systematic review. Journal of Otolaryngology - Head & Neck Surgery. 48 (1), 13 (2019).
- Sievert, M., et al. Failure of pedicled flap reconstruction in the head and neck area: A case report of a bilateral subclavian artery stenosis. International Journal of Surgery Case Reports. 76, 381-385 (2020).
- Vaienti, L., et al. Failure by congestion of pedicled and free flaps for reconstruction of lower limbs after trauma: the role of negative-pressure wound therapy. Journal of Orthopaedics and Traumatology. 14 (3), 213-217 (2013).
- Murry, C. E., Jennings, R. B., Reimer, K. A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 74 (5), 1124-1136 (1986).
- Akcal, A., et al. Combination of ischemic preconditioning and postconditioning can minimise skin flap loss: experimental study. Journal of Plastic Surgery and Hand Surgery. 50 (4), 233-238 (2016).
- Ulker, P., et al. Does ischemic preconditioning increase flap survival by ADORA2B receptor activation. Clinical Hemorheology and Microcirculation. 75 (2), 151-162 (2020).
- Min, S. -. H., Choe, S. H., Kim, W. S., Ahn, S. -. H., Cho, Y. J. Effects of ischemic conditioning on head and neck free flap oxygenation: a randomized controlled trial. Scientific Reports. 12 (1), 8130 (2022).
- Dacho, A., Lyutenski, S., Aust, G., Dietz, A. Ischemic preconditioning in a rat adipocutaneous flap model. HNO. 57 (8), 829-834 (2009).
- Yildiz, K., et al. Comparison of the flap survival with ischemic preconditioning on different pedicles under varied ischemic intervals in a rat bilateral pedicled flap model. Microsurgery. 34 (2), 129-135 (2014).
- Ottomann, C., Küntscher, M., Hartmann, B., Antonic, V. Ischaemic preconditioning suppresses necrosis of adipocutaneous flaps in a diabetic rat model regardless of the manner of preischaemia induction. Dermatology Research and Practice. 2017, 4137597 (2017).
- Grimaud, J., Murthy, V. N. How to monitor breathing in laboratory rodents: a review of the current methods. Journal of Neurophysiology. 120 (2), 624-632 (2018).
- Strohl, K. P., et al. Ventilation and metabolism among rat strains. Journal of Applied Physiology. 82 (1), 317-323 (1997).
- Mucke, T., et al. Autonomization of epigastric flaps in rats. Microsurgery. 31 (6), 472-478 (2011).
- Hsu, C. -. E., et al. The rat groin flap model redesigned for evaluating treatment effects on ischemia-reperfusion injury. Journal of Surgical Research. 222, 160-166 (2018).
- Mücke, T., et al. Indocyanine green videoangiography-assisted prediction of flap necrosis in the rat epigastric flap using the flow® 800 tool. Microsurgery. 37 (3), 235-242 (2017).
- Wang, D., Chen, W. Indocyanine green angiography for continuously monitoring blood flow changes and predicting perfusion of deep inferior epigastric perforator flap in rats. Journal of Investigative Surgery. 34 (4), 393-400 (2021).
- Berkane, Y., et al. How to secure pedicled flaps using perioperative indocyanine green angiography: a prospective study about 10 cases. World Journal of Surgery and Surgical Research. 4 (1), 1319 (2021).
- Alstrup, T., Christensen, B. O., Damsgaard, T. E. ICG angiography in immediate and delayed autologous breast reconstructions: peroperative evaluation and postoperative outcomes. Journal of Plastic Surgery and Hand Surgery. 52 (5), 307-311 (2018).
- Küntscher, M. V., et al. Ischemic preconditioning by brief extremity ischemia before flap ischemia in a rat model. Plastic and Reconstructive Surgery. 109 (7), 2398-2404 (2002).
- Liu, R. Q., et al. Cost analysis of indocyanine green fluorescence angiography for prevention of anastomotic leakage in colorectal surgery. Surgical Endoscopy. 36 (12), 9281-9287 (2022).
- Cheng, M. H., et al. Devices for ischemic preconditioning of the pedicled groin flap. The Journal of Trauma. 48 (3), 552-557 (2000).
- Xiao, W., et al. An innovative and economical device for ischemic preconditioning of the forehead flap prior to pedicle division: a comparative study. Journal of Reconstructive Microsurgery. 38 (9), 703-710 (2022).
- Küntscher, M. V., Hartmann, B., Germann, G. Remote ischemic preconditioning of flaps: a review. Microsurgery. 25 (4), 346-352 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon