Method Article
浅表下上腹部动脉轴向皮瓣研究大鼠模型中缺血预处理效应
* 这些作者具有相同的贡献
摘要
该协议描述了收获,缝合和监测大鼠的筋膜皮肤皮瓣,通过钳夹和结扎股血管,可以很好地观察和操纵通过浅表下上腹部血管的血流。这对于涉及缺血性预处理的研究至关重要。
摘要
筋膜皮肤皮瓣(FCF)已成为整形和重建手术中复杂缺损重建的金标准。这种肌肉保留技术允许转移血管化组织以覆盖任何大的缺陷。FCF可用作带蒂皮瓣或自由皮瓣;然而,在文献中,有蒂FCF和游离FCF的失败率高于5%,为这些技术和该领域的进一步知识扩展留下了改进的空间。缺血性预处理(I.P.)已被广泛研究,但IP方案的机制和优化尚未确定。这种现象在整形和重建手术中确实没有得到很好的探索。本文介绍了一个手术模型,用于研究大鼠轴向筋膜皮瓣模型中的腹腔方案,描述了如何安全可靠地评估腹膜对皮瓣存活的影响。本文介绍了完整的外科手术,包括提高该模型可靠性的建议。目的是为研究人员提供一个可重复和可靠的模型来测试各种缺血性预处理方案,并评估它们对皮瓣生存能力的影响。
引言
整形和重建手术在不断发展。肌肉、筋膜皮肤和穿支皮瓣的发展使得在降低发病率的同时提供更高质量的重建成为可能。将这种改进的解剖学知识与增强的技术技能相结合,重建外科医生可以在缺陷不接近任何局部解决方案时进行自由皮瓣移植。然而,虽然穿支皮瓣手术是目前重建手术中最先进的技术,但文献报道游离皮瓣转移的失败率为5%1,2,3,而椎弓根皮瓣重建的失败率高达20%4,5,6。当皮瓣的椎弓根受损时,会发生部分或全部皮瓣故障,因此必须不断寻求对当前技术的改进。提高皮瓣存活率的方法之一是促进其在伤口床上的新生血管形成,从而允许通过椎弓根以外的来源灌注。缺血性预处理(I.P.)最初已在心脏模型7中描述,表明暴露于受控缺血的器官在通过经历缺血诱导的新生血管而失去其主要血液供应后存活到更高程度。几位作者研究了这一基石原理,以优化临床前和临床模型中的皮瓣存活率8,9,10。
与其他提高皮瓣存活率的方法相比,该技术的优势在于其易于实施,包括血源的钳夹/脱夹测试。在大鼠模型中,以前的作者使用浅表下上腹部动脉(SIEA)皮瓣通过夹住主椎弓根11,12,13来研究腹腔膜外膜。尽管如此,该模型可能会遇到一些技术问题,并且文献缺乏描述良好的协议。
因此,这项工作旨在为研究人员提供大鼠SIEA皮瓣采购技术的详细描述,该技术对股血管进行了扩展解剖,以允许对轴向筋膜皮瓣模型进行腹腔研究。该模型保留了上腹部血管的完整性,而是操纵了更具弹性的股血管。我们分享我们的经验和工具,以改进对这种现象的研究,并提高该程序的可复制性。
研究方案
马萨诸塞州总医院机构动物护理和使用委员会批准了实验方案(IACUC-协议 #2022N000099)。作者遵循ARRIVE(动物研究: 报告体内 实验)指南清单进行这项工作。所有动物都按照国家卫生研究所实验动物护理和使用指南进行了人道护理。所有实验共使用12只雄性刘易斯大鼠(250-350g,8-10周龄)。
1. 动物制备
注意:大鼠代谢率高,脂肪储备有限;因此,手术前不要禁食,手术前也不要限制饮水。
- 对于所有程序,在异氟烷精密蒸发器的腔室中使用3%-5%异氟醚镇静动物(见 材料表)。当动物镇静良好时,通过鼻锥将异氟醚剂量降低至1%-3%。
注意:第二名研究人员必须持续监测呼吸频率并调整异氟醚剂量。 - 在初次手术前2天,将塑料电子项圈(适合大鼠的大小;见 材料表)放在动物身上,并使用3-0尼龙缝合线将电子项圈固定在动物颈部的背侧和腹侧。允许 2 天适应此电子领;它应该贴合但不阻塞动物的气道。
2. 术前护理
- 在初次手术当天,剃掉腹部的下前侧,清除从动物外侧到略微超过中线的区域。
- 然后,使用脱毛产品(脱毛膏;见 材料表)去除该区域(上一步所述的腹部下前侧)的所有剩余毛发。
- 用手术磨砂膏和倍他定溶液(10%聚维酮碘)彻底清洗并擦干该区域。
- 皮下注射0.05毫克/千克丁丙诺啡。
3.术中监测
- 确保动物在整个手术过程中通过精密蒸发器和鼻锥 保持 1%-3%异氟醚。通过目视观察和为大鼠制造的啮齿动物脉搏血氧仪监测动物的呼吸频率、呼吸和氧饱和度水平。
注意:典型的呼吸频率为每分钟 80-90 个周期14,15。在手术过程中观察到的任何表明意识的反应都需要增加异氟烷率。 - 在整个手术过程中,将动物放在加热垫上,因为啮齿动物的体温在麻醉下迅速冷却。
4. 上腹部皮瓣采集
- 将动物置于仰卧位。将腹部从腹股沟折痕下方剃到剑突水平以上。
- 使用无菌皮笔和尺子,首先标记动物腹部的中线,然后标记腹股沟折痕。沿腹股沟折痕线的切口暴露了股骨血管外的下上腹部血管分支。
- 在切口之前,将未来的皮瓣绘制为椭圆形或矩形,垂直可达6厘米,水平可达3厘米,从腹股沟折痕向颅延伸。
- 绘制垂直于襟翼极限的五到六个等距标记。这些可作为指南,在皮瓣被抬起并缝合回原位后更好地重新对齐皮肤(图1)。
- 使用拉格内尔剪刀(见 材料表),在腹股沟折痕上做一个3-4厘米的纵向切口。
注意:研究人员应谨慎行事,将皮肤向上拉,以免损坏血管。 - 使用 #4 珠宝商显微外科钳(见 材料表)暴露和识别股骨和上腹部血管,方法是打开和关闭镊子以分离筋膜并进入腹股沟脂肪垫下方的血管。
- 使用腹股沟切口使用拉格内尔剪刀开始皮瓣切口。注意破坏腹部肌肉上的皮肤和结缔组织的全厚度。
- 为了便于皮瓣收获,请确保剪刀沿着正确的解剖平面,向肌肉推动并展开剪刀的刀片。通过围绕襟翼图纸沿协调方向移动来执行此翻板破坏。
注意:要确定正确的平面,解剖平面下方不应存在任何微血管。
- 为了便于皮瓣收获,请确保剪刀沿着正确的解剖平面,向肌肉推动并展开剪刀的刀片。通过围绕襟翼图纸沿协调方向移动来执行此翻板破坏。
- 当皮瓣的初始尖端从周围皮肤中释放出来时,通过使用 Ragnell 剪刀尖端将皮瓣与肌肉分离,同时烧灼皮瓣周围的任何穿支血管和真皮丛血管,继续从远端到近端进行皮瓣获取。这可确保所有血液 通过 上腹部血管流向皮瓣。
注意:必须注意不要在收获皮瓣时用力过猛或扭曲皮肤来损坏皮瓣脉管系统。建议在皮瓣的近端工作时,将皮瓣的释放部分小心地放在外科医生手的拇指上。 - 一旦皮瓣完全收获,浅表下上腹部血管的分支在皮肤的深层可见。旨在通过轻轻向上抬起皮瓣以可视化血管,用瓣封装SIEA的两个分支的整个分支。
- 收获皮瓣后,将皮瓣内侧和外侧下侧的脂肪垫分开。使用双极烧灼(见材料表)烧灼靠近切口边界的脂肪垫,同时注意不要伤害浅 表下上腹部椎弓根(图2)。
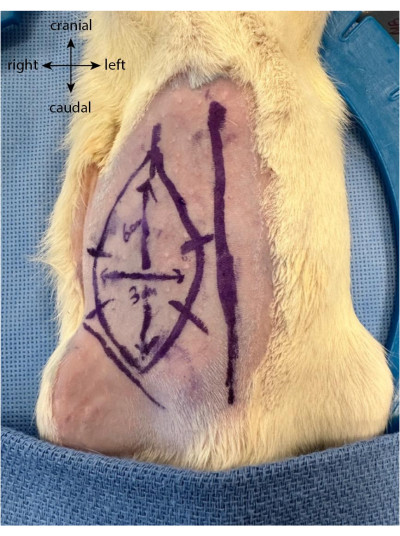
图 1:动物腹部的襟翼图画。 中线用作定位上腹部皮瓣位置的标记。 请点击此处查看此图的大图。

图 2:襟翼完全升高。 脂肪垫保留在皮瓣的近端,以保留来自浅下上腹部蒂的血管形成。 请点击此处查看此图的大图。
5. 血管准备和缺血诱导
注意:皮瓣在此阶段完全收获,但血管尚未准备好进行缺血预处理。
- 在股血管制备之前,通过静脉 注射 单剂量的17.5IU肝素钠。
注意:这种注射是通过暴露龟头,使用无创伤的Adson钳在外部握住阴茎,识别阴茎静脉,并使用27 G注射器在阴茎静脉表面和沿阴茎静脉注射来完成的。 - 为了创造更好的曝光,将动物放在Lone Star自保持牵开器中(见 材料表)。
注意:Lone Star弹性保持将皮肤从手术部位拉开,从而可以更好地观察血管。研究人员现在必须在手术显微镜(40倍放大倍率)下工作。 - 要暴露血管,请使用两个#4显微手术钳在浅表上腹部血管出现的近端和远端解剖股血管。不要直接握住血管,而是用镊子将镊子垂直打开和关闭到血管上,逐层轻轻地分离结缔组织。
- 在股骨远端血管上,清洁筋膜并轻轻地将神经从动脉和静脉中解放出来。使用 8-0尼龙缝合线(见 材料表),通过绕过动脉和静脉下方的显微外科针架,扣住缝合线并绑住这些血管来结扎股骨远端血管(图3)。不得伤害或束缚神经,以尽量减少术后发病率。
注意:外科医生可以使用其中一只镊子用一只手轻轻地将筋膜拉到神经外侧,然后用另一对镊子将神经与血管完全分离。 - 使用 8-0缝合,在上腹部血管出现后立即结扎远端血管,在椎弓根起源后留出 1 毫米的距离。这确保了在缺血期没有逆流从深分支通过SIEA。
注意: 图3 显示了SIEA椎弓根出现后结扎的远端股骨血管。 - 在股骨近端血管上,重复清洁结缔组织的相同过程。但是,将动脉和静脉彼此分开,以便有效地钳夹。这可以通过在动脉和静脉之间轻轻放置闭合的镊子并在血管的运行方向上缓慢打开镊子来实现。
- 为了诱导间歇性缺血,将显微手术夹分别放在每个股动脉近端和静脉上(图4)。
- 缺血性损伤完成后,将皮瓣缝合到其原始位置,将标记排列在术前绘制的位置(步骤4.2.2)。使用3-0尼龙的跑步缝合线缝合皮瓣(见 材料表),从腹股沟折痕内侧开始,围绕皮瓣,到腹股沟折痕横向结束。
注意:沿着腹股沟折痕,相同的缝合线可用于放置中断缝合。这使得研究人员可以在不影响皮瓣闭合的情况下打开该区域。 - 为了验证皮瓣的血液供应,使用与肝素盐水注射相同的技术和工具(步骤5.1)将0.25mL无菌荧光素钠(10%,参见 材料表)注射到静脉中。3分钟后,照射长波UV-366nm灯(荧光素激发光),以显示对应于灌注区域的荧光区域。
- 闭合和验证后,沿缝合线铺开粉碎的甲硝唑(见 材料表)以防止自动残缺,并在同一区域喷洒液体绷带。
- 在动物从麻醉中恢复之前,皮下注射卡洛芬(2-5 mg / kg)。
- 研究人员现在可以进入股血管,这是皮瓣的唯一喂养来源,以连续几天测试实验性缺血预处理方案。在手术的每一天,皮下提供2-5毫克/公斤剂量的卡洛芬。
- 在缺血性预处理期结束时,为了从上腹部血液供应中去除皮瓣,沿皮瓣的下缘烧灼到脂肪垫下。
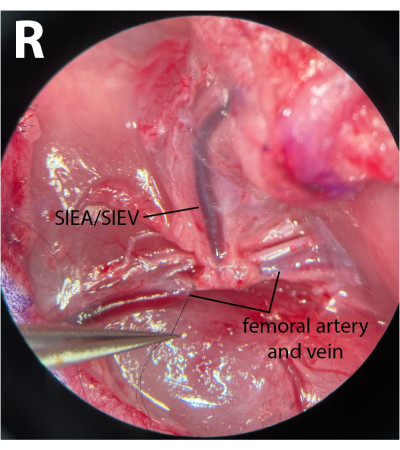
图3:股血管的显微镜视图。 股骨管远端系扎。神经被保留了下来。夹层侧是右腹股沟折痕(R)。放大倍率:40倍。 请点击此处查看此图的大图。

图 4:使用两个单独的显微外科钳夹钳夹住股骨近端血管。 这样可以更好地钳夹控制,确保没有动脉和逆行静脉血流。(A)显示左(L)股骨血管被夹紧。浅表下上腹部血管可见(SIEA/SIEV)。(B)在动物的右腹股沟折痕(R)上显示钳夹前的股动脉和股静脉。放大倍率:40倍。 请点击此处查看此图的大图。
6. 术后护理
- 皮下注射卡洛芬(2-5mg / kg),每天一次,术后4天,任何补充镇静剂后一次。
- 在前24小时内,观察动物两次。然后,每天至少评估一次动物和皮瓣,直到研究结束。
注意:动物必须明亮、警觉且反应灵敏。如果有全身性机会性感染的迹象(即嗜睡或体重减轻),应按照机构批准的方案对动物实施安乐死。 - 监测皮瓣有无早期坏死(术后第 5 天结扎前 [POD5])、手术部位裂开、感染、血肿、缺血和/或皮瓣自噬。
- 如果有手术部位裂开,清创疤痕边缘,用10%聚维酮碘清洁部位,然后用无菌水或无菌盐水彻底冲洗,并使用中断的3-0尼龙缝合线缝合伤口。
- 在研究结束时,用静脉注射0.1-0.2mL的31%苯巴比妥钠溶液或当地IACUC推荐的方案对动物实施安乐死。通过无心跳和呼吸运动来确认死亡。
结果
所有皮瓣在POD5上都是可行的,仅通过SIEA显示良好的血管形成。 图5 显示了静脉注射荧光素前后的皮瓣,显示出完全的血管化。

图 5:立即静脉注射荧光素血管造影 (POD0)。 该评估显示皮瓣仅由SIEA形成血管化。绿色荧光显示灌注良好的组织,包括整个皮瓣桨。放大倍率:40倍。 请点击此处查看此图的大图。
使用像素分析软件(见 材料表)对襟翼的生存能力进行客观评估。荧光素荧光位于绿色波长(使用115至255nm的窗口)。通过选择襟翼圆周,软件提供特定波长中包含的像素百分比。这允许精确测量皮瓣的生存能力,因为坏死区域中包含的像素不在荧光波长窗口内。
提出了两个对照模型的结果:阴性对照组确认该轴向筋膜皮瓣模型在没有腹腔膜的情况下的可行性,以及一个阳性对照组,以验证其在没有先前腹腔膜的情况下在POD 5上结扎时的不可存活性与当前文献16。 图6 显示了这两种控制模型的实验设计。

图 6:对照组模型的时间线。 所有组均在POD0上进行了皮瓣抬高。阴性对照组包括皮瓣观察,无需对皮瓣血管进行手术干预。阳性对照组由POD5上的连接组成,无缺血预处理。 请点击此处查看此图的大图。
如图 7所示,阴性对照组展示了襟翼桨的全部活力。在该组中,在POD10时经历了99.50%±0.76%的生存率,其中没有对喂养容器进行连接。在此期间,所有动物都保持健康。
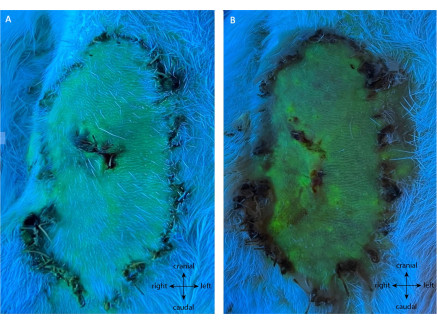
图7:(A)POD5和(B)POD10处阴性对照的血管造影。 该评估显示皮瓣完全存活,无需对其蒂进行干预。绿色荧光显示灌注良好的组织,包括整个皮瓣桨。注意:对照活检是在这个重复上进行的。放大倍率:40倍。 请点击此处查看此图的大图。
阳性对照组接受了相同的初始皮瓣采集手术。随后,在POD5上,血管被烧灼,直接切断流向皮瓣的血流。结扎前未进行腹腔内膜检查。在整个POD5-10中,随着皮瓣变深并变硬,注意到进行性皮瓣坏死。如图 8A所示,静脉注射荧光素后,除尖端外,皮瓣结扎后未显示任何荧光,而周围皮肤则被灌注。到POD10时,皮瓣在所有重复中存活率超过其表面的11.25%±1.58%(图8B),显示出POD5上主蒂的自主性差。有趣的是,远端尖端是唯一自主并在POD10存活的部分。
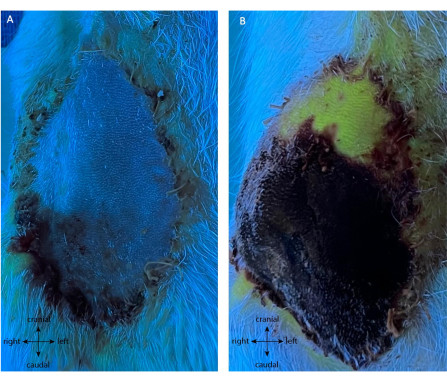
图8:连接后(A)POD5和(B)POD10阳性对照的血管造影。 结扎后立即没有绿色荧光(A)表明皮瓣没有灌注,证明没有新生血管形成。这在 POD10 (B) 时得到证实,85% 的皮肤桨坏死(黑色/紫色)。有趣的是,远端尖端是活的和新生血管的(皮瓣的绿色荧光部分)。放大倍率:40倍。 请点击此处查看此图的大图。
还测试了使用短周期I.P.的一组(n = 3),以证明该模型的价值。动物经历了三个周期,每次15分钟缺血,然后通过钳夹和解开股骨近端血管的动脉和静脉进行再灌注15分钟,通过POD0,1,2和3上的腹股沟折痕进入,然后在POD516上结扎。
在视觉上,研究人员通过观察缺血期间皮瓣的苍白/蓝色变色和上腹部血管血液变黑来确认夹紧期的功能。此外,研究人员在连接后在POD5上注射荧光素,并观察到与阳性对照组相当的皮瓣存活率(13.67%±5.03%的皮瓣存活率),表明该IP方案在该模型中效率低下(图9)。

图 9:POD10 上襟翼表面活力的统计分析。 进行曼-惠特尼U检验以比较组。双尾 p 值显示在 U 锯齿线上。阴性对照组(n = 4)显示出99.5%的生存率。阳性对照组(n = 5)显示出11.25%的生存率。例如,实验组显示出13.67%的生存能力,与阳性对照相比没有显着改善(p = 0.86)。 请点击此处查看此图的大图。
讨论
本文描述了在大鼠中收获的可重复的筋膜皮肤皮瓣模型,允许腹腔内评估。这种循序渐进的手术方案为研究小组提供了一个可靠的模型来测试不同的腹腔内膜方案。通过防止椎弓根以外的任何血管形成,该模型允许从伤口床和边缘研究皮瓣的新生血管形成。这项研究对POD5进行了连接,因为以前的研究已经观察到POD5-711,13,16上大鼠的这种皮瓣的自主化。该模型旨在帮助缺血再灌注损伤(IRI)研究,以优化和缩短完全自主化所需的间隔。因此,为了看到缺血性预处理的最显着结果,我们的目标是在自主化后但在皮瓣完全新生血管化之前结扎喂养血管(描述发生在POD716上)。
该模型的成功在于确保在获取皮瓣期间不会对股骨或SIE血管造成损伤,这需要外科医生在整个皮瓣手术过程中保持血管的可视化。此外,必须正确结扎股骨远端血管,以通过近端血管准确诱导缺血,而没有来自其他血管的回流。这些步骤对于观察实验结果至关重要。
该模型的好处是,在仔细准备血管后,它通过操纵股血管来保持上腹部血管的完整性,确保股骨管近端是SIEA椎弓根的唯一血液来源。优点是夹紧的股血管的大小允许其管腔的良好恢复。相比之下,静脉显微手术钳夹会永久伤害上腹部血管,需要终止实验。此外,由于术后纤维化,由于术后纤维化,初始手术后腹股沟折痕中的股血管夹层比上腹部脂肪垫更容易接近。该模型允许更安全地进行涉及血管夹紧的重复性手术;Hsu等人17 描述了IRI研究的类似模型,但没有描述该过程。
该模型的另一项创新是静脉注射荧光素,以确认皮瓣血管形成和活力。其他作者描述了大鼠瓣模型18,19中的静脉吲哚菁绿(ICG)注射液,类似于其在临床中的使用20,21。然而,ICG的成本和特定的必要硬件是一个限制,似乎不是一种有效的技术22。我们描述了一种简单的技术,可以在任何实验室中使用简单的木灯,可以很好地可视化襟翼的活力和血管化。
该模型的一个局限性是无法正确评估同一动物的两个皮瓣。由于夹紧对侧皮瓣23引起的远程腹膜压的潜在影响,不可能同时评估治疗过的皮瓣和生物对照。
腹腔内膜的临床应用可以通过提供整形外科医生在手术台上夹紧/松开序列的可靠方案来提高筋膜皮肤瓣的存活率。一些作者描述了使用IP来允许前额皮瓣和腹股沟皮瓣的早期椎弓根分裂24,25。然而,必须优化腹腔内膜方案,为外科医生提供可靠的工具,使其更普遍地使用。使用我们描述的模型实现的局部和远程 I.P. 在提高筋膜皮肤皮瓣生存能力方面都显示出有希望的结果26.最后,该模型适用于研究缺血再灌注损伤和对此类应激的全身反应,这是一个研究兴趣领域23。
总之,这种对可靠且可重复模型的准确描述为大鼠筋膜皮瓣模型中的腹腔和缺血再灌注损伤研究提供了有价值的工具,与以前的模型相比,为研究人员提供了更大的血管来操纵和访问。
披露声明
所有作者都没有经济利益要声明。
致谢
这项工作由马萨诸塞州总医院(WGA)和Shriners Children's Boston(B.U,K.U,C.L.C)资助。Y.B和I.F.v.R由Shriners儿童医院资助(提案ID:#970280和#857829分别为)。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe Luer-Lok Tip | BD | 309628 | |
| 3-0 Ethilon 18” Black Monofilament Nylon suture | Ethicon | ETH-663H | |
| 8-0 Ethilon 12” Black Monofilament Nylon suture | Ethicon | 1716G | |
| Adson Atraumatic Forceps | Aesculap Surgical Instruments | BD51R | |
| Akorn Fluorescein Injection USP 10% Single Dose Vial 5 mL | Akorn | 17478025310 | |
| Betadine Solution 5% Povidone-Iodine Antiseptic Microbicide | PBS Animal Health | 11205 | |
| Bipolar Cords | ASSI | ASSI.ATK26426 | |
| Buprenorphine Hydrochloride Injection | PAR Pharmaceutical | 3003406C | This concentration needs to be diluted for rodents. |
| Depilatory product – Nair Hair remover lotion | Nair | NC0132811 | |
| Ear tag applier | World Precision Instruments | NC0038715 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | |
| Jewelers Bipolar Forceps Non-Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star elastic stays | Cooper Surgical | 3311-1G | |
| Lone star Self-retaining retractor | Cooper Surgical | 3304G | |
| Metronidazole tablets USP | Teva | 500111-333-06 | |
| Micro spring handle scissors | AROSurgical | 11.603.14 | |
| Microscope (surgical) | Leica | M525 F40 | |
| Microsurgical clamp applying forceps | Ambler Surgical | 31-906 | |
| Microsurgical clamps (x2) | Millennium Surgical | 18-B1V | |
| Microsurgical Dumont #4 forceps | Dumont Swiss made | 1708-4TM-PO | |
| Microsurgical needle holder | ASSI | B-14-8 | |
| Needle holder | World Precision Instruments | 501246 | |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | |
| Pixel analysis software | GNU Image Manipulation Program v2.10 | GIMP | GNU Open licence |
| PrecisionGlide Needle 27 G | BD | 305109 | |
| Ragnell Scissors | Roboz Surgical | RS-6015 | |
| Rimadyl (carprofen) | Zoetis | 10000319 | This concentration needs to be diluted for rodents |
| Scientific Elizabethan collar (e-collar) for Rats | Braintree Scientific | NC9263311 | |
| Small animal ear tag | National Band & Tag Company | Style 1005-1 | |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Sterile towel drape | Dynarex Corporation | 4410 | |
| Sterile water for injection and irrigation | Hospira | 0409488724-1 | |
| Surgical scrub – BD ChloraPrep Hi-Lite Orange 3 mL applicator with Sterile Solution | BD | 930415 | |
| UV lamp | UVP | UVL-56 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
参考文献
- Copelli, C., et al. Management of free flap failure in head and neck surgery. ACTA Otorhinolaryngologica Italica. 37 (5), 387-392 (2017).
- Lese, I., Biedermann, R., Constantinescu, M., Grobbelaar, A. O., Olariu, R. Predicting risk factors that lead to free flap failure and vascular compromise: A single unit experience with 565 free tissue transfers. Journal of Plastic, Reconstructive & Aesthetic Surgery. 74 (3), 512-522 (2021).
- Wang, W., et al. Flap failure and salvage in head and neck reconstruction. Seminars in Plastic Surgery. 34 (4), 314-320 (2020).
- Gabrysz-Forget, F., et al. Free versus pedicled flaps for reconstruction of head and neck cancer defects: a systematic review. Journal of Otolaryngology - Head & Neck Surgery. 48 (1), 13 (2019).
- Sievert, M., et al. Failure of pedicled flap reconstruction in the head and neck area: A case report of a bilateral subclavian artery stenosis. International Journal of Surgery Case Reports. 76, 381-385 (2020).
- Vaienti, L., et al. Failure by congestion of pedicled and free flaps for reconstruction of lower limbs after trauma: the role of negative-pressure wound therapy. Journal of Orthopaedics and Traumatology. 14 (3), 213-217 (2013).
- Murry, C. E., Jennings, R. B., Reimer, K. A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 74 (5), 1124-1136 (1986).
- Akcal, A., et al. Combination of ischemic preconditioning and postconditioning can minimise skin flap loss: experimental study. Journal of Plastic Surgery and Hand Surgery. 50 (4), 233-238 (2016).
- Ulker, P., et al. Does ischemic preconditioning increase flap survival by ADORA2B receptor activation. Clinical Hemorheology and Microcirculation. 75 (2), 151-162 (2020).
- Min, S. -. H., Choe, S. H., Kim, W. S., Ahn, S. -. H., Cho, Y. J. Effects of ischemic conditioning on head and neck free flap oxygenation: a randomized controlled trial. Scientific Reports. 12 (1), 8130 (2022).
- Dacho, A., Lyutenski, S., Aust, G., Dietz, A. Ischemic preconditioning in a rat adipocutaneous flap model. HNO. 57 (8), 829-834 (2009).
- Yildiz, K., et al. Comparison of the flap survival with ischemic preconditioning on different pedicles under varied ischemic intervals in a rat bilateral pedicled flap model. Microsurgery. 34 (2), 129-135 (2014).
- Ottomann, C., Küntscher, M., Hartmann, B., Antonic, V. Ischaemic preconditioning suppresses necrosis of adipocutaneous flaps in a diabetic rat model regardless of the manner of preischaemia induction. Dermatology Research and Practice. 2017, 4137597 (2017).
- Grimaud, J., Murthy, V. N. How to monitor breathing in laboratory rodents: a review of the current methods. Journal of Neurophysiology. 120 (2), 624-632 (2018).
- Strohl, K. P., et al. Ventilation and metabolism among rat strains. Journal of Applied Physiology. 82 (1), 317-323 (1997).
- Mucke, T., et al. Autonomization of epigastric flaps in rats. Microsurgery. 31 (6), 472-478 (2011).
- Hsu, C. -. E., et al. The rat groin flap model redesigned for evaluating treatment effects on ischemia-reperfusion injury. Journal of Surgical Research. 222, 160-166 (2018).
- Mücke, T., et al. Indocyanine green videoangiography-assisted prediction of flap necrosis in the rat epigastric flap using the flow® 800 tool. Microsurgery. 37 (3), 235-242 (2017).
- Wang, D., Chen, W. Indocyanine green angiography for continuously monitoring blood flow changes and predicting perfusion of deep inferior epigastric perforator flap in rats. Journal of Investigative Surgery. 34 (4), 393-400 (2021).
- Berkane, Y., et al. How to secure pedicled flaps using perioperative indocyanine green angiography: a prospective study about 10 cases. World Journal of Surgery and Surgical Research. 4 (1), 1319 (2021).
- Alstrup, T., Christensen, B. O., Damsgaard, T. E. ICG angiography in immediate and delayed autologous breast reconstructions: peroperative evaluation and postoperative outcomes. Journal of Plastic Surgery and Hand Surgery. 52 (5), 307-311 (2018).
- Küntscher, M. V., et al. Ischemic preconditioning by brief extremity ischemia before flap ischemia in a rat model. Plastic and Reconstructive Surgery. 109 (7), 2398-2404 (2002).
- Liu, R. Q., et al. Cost analysis of indocyanine green fluorescence angiography for prevention of anastomotic leakage in colorectal surgery. Surgical Endoscopy. 36 (12), 9281-9287 (2022).
- Cheng, M. H., et al. Devices for ischemic preconditioning of the pedicled groin flap. The Journal of Trauma. 48 (3), 552-557 (2000).
- Xiao, W., et al. An innovative and economical device for ischemic preconditioning of the forehead flap prior to pedicle division: a comparative study. Journal of Reconstructive Microsurgery. 38 (9), 703-710 (2022).
- Küntscher, M. V., Hartmann, B., Germann, G. Remote ischemic preconditioning of flaps: a review. Microsurgery. 25 (4), 346-352 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。